叶绿素是绿色果蔬中主要的呈色物质,也是自然界含量较为丰富的植物代谢物,叶绿素具有多种生物活性如抗氧化[1]、抗炎[2]、抗肿瘤[3]等。肠道菌群是机体重要的微生态系统,健康机体内肠道菌群形成的天然屏障可以抵御病菌侵入机体,并通过肠-肝轴调节肝脏代谢[4]。长期高脂膳食会造成肠道菌群结构失调,破坏肠道菌群形成的天然屏障,有害物质穿过屏障进入身体各个部位,刺激机体进行免疫应答释放炎性细胞因子,损伤肝脏代谢功能并导致机体肥胖[5]。哺乳动物不能直接消化吸收蔬菜中的叶绿素,在经过胃肠后,约有95%会进入结肠与肠道菌群产生相互作用,作用后的小分子代谢物能够对机体代谢产生影响。郑红莉等[6]基于流式细胞技术研究后发现叶绿素(叶绿素a和叶绿素b含量占比分别为70.99%和21.12%)可显著调节益生菌假长双岐杆菌(Bifidobacterium pseudolongum)与鼠乳杆菌(Lactobacillus murinus)的丰度。不仅如此,LI等[7-8]使用富含叶绿素的菠菜提取物(主要是叶绿素a和叶绿素b),对高脂膳食喂养的C57BL/6 J小鼠进行干预后,发现其可改善高脂小鼠肠道微生物菌群失调并抑制炎症因子的升高,进而缓解高脂膳食诱导的低度炎症和血糖值。但是,此前的研究采用的多是叶绿素粗提取物(含有叶黄素、类胡萝卜素、多糖等),实验结果可能存在干扰因素。在课题组的前期研究中发现[9],结肠中的叶绿素大多是以脱镁叶绿素及其衍生物的形式存在。随着更进一步研究,发现在高脂膳食诱导小鼠结肠中,是脱镁叶绿酸a(pheophorbide a,Pheo a)在与微生物产生主要相互作用,并对机体健康产生潜在有益影响,但其作用机制和潜在健康效应还需深入研究[10]。因此,阐明脱镁叶绿酸a介导肠道菌群改善高脂饮食诱导肥胖的机制及量效关系,还需进行深入的研究。
鉴于此,本实验让高脂膳食小鼠额外摄入脱镁叶绿酸a,利用组织病理、血液生化及高通量测序技术(微生物多样性和肝、菌群代谢组学),研究在不同质量浓度(0.16、0.12、0.08、0.04 mg/mL)脱镁叶绿酸a干预下,对高脂膳食诱导的肝肠损伤的缓解作用及机制,对于高脂膳食人群的膳食指导有重要意义。
1 材料与方法
1.1 材料与试剂
紫菜(干坛紫菜,产地福建霞浦),重庆市北碚区永辉超市;盐酸、丙酮、石油醚(60~90 ℃)、乙醚、乙醇、乙腈、甲醇、多聚甲醛、氯化钠、碳酸氢钠、氯化钙、氢氧化钠、羧甲基纤维素钠(sodium carboxymethylcellulose,CMC-Na),川东化工公司(中国重庆);乙酸铵、丙酮、甲醇、乙腈均为色谱纯,Sigma-Aldrich贸易有限公司(中国上海);PBS,Bio-sharp公司(中国北京);水为超纯水。
1.2 仪器与设备
BSM-120.4型电子天平,上海卓精电子科技有限公司;Agilent 1290超高效液相色谱仪,美国Agilent公司;Impact Ⅱ四极杆飞行时间质谱仪(具有Bruker Compass DataAnalysis 5.1数据处理软件),德国Bruker公司;Vortex-2涡旋混匀仪,上海沪析实业有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;罗氏血糖仪,Roche Accu-Chek(德国,慕尼黑);DW-HL398超低温冷冻贮存箱,中科美菱低温科技股份有限公司;UV-5200紫外可见光分光光度计,上海元析仪器有限公司;KQ5200DE型数控超声波清洗器,昆山市超声仪器有限公司;Mini Spin高速微型离心机,德国Eppendorf公司。
1.3 实验方法
1.3.1 提取和测定脱镁叶绿酸a
参照实验室已有的方法制备脱镁叶绿酸a[11],称取初始紫菜原料50 g,撕成碎片放入破壁机中打散至粉末状态,加入100 mL纯水搅拌均匀,随后加入4倍体积的丙酮浸泡12 h,采用高速滤纸进行过滤。加入1 mL 3.88 mol/L左右的HCl溶液摇晃至溶液轻微变成黄色,再加入50 mL乙醚、过量NaCl固体和少量的NaHCO3粉末中和盐酸。随后进行分层萃取,将上层清液在55~60 ℃条件下减压旋转蒸干。
采用实验室已有的层析方法分离原液中的脱镁叶绿酸a[11],将原液均匀点样在1 mm厚的滤纸板上,进行石油醚洗脱的薄层层析[(V(石油醚)∶V(乙醇)∶V(甲醇)=60∶20∶1)]。将层析得到的脱镁叶绿酸a条带裁下用丙酮溶解后,得到相应的脱镁叶绿酸a-丙酮溶液,放置于-20 ℃冰箱中保存至使用。
利用超高效液相-二极管阵列检测器(ultra high performance liquid phase diode array detector,UPLC-DAD)对脱镁叶绿酸a进行定量,测定其浓度。检测条件参考实验室原有的方法进行设定[12]。DAD检测器记录在300~750 nm下的色谱图,利用实验室所建立的基于叶绿素标准品所作标准曲线进行定量测定。
1.3.2 动物实验
如图1所示,48只雄性C57/BL6 J小鼠(6周龄),分为6组,每组8只,组数编号为:HFD-Pheo a 0.16、HFD-Pheo a 0.12、HFD-Pheo a 0.08、HFD-Pheo a 0.04、HFD、NC(动物实验伦理编号:IACUC-20230228-15)。NC组采用正常饲料喂养,其余采取高脂饲料喂养;高脂饲料配方:31.6%(质量分数,下同)猪油+25.8%酪蛋白+16.1%麦芽糊精+9.5%蔗糖+6.5%纤维素+6.5%混合矿物质+3.2%大豆油+0.4%L-胱氨酸+0.3%酒石酸氢胆碱+0.1%混合维生素;正常饲料即基础饲料。其中4组(HFD-Pheo a 0.16至HFD-Pheo a 0.04)用脱镁叶绿酸a-CMC-Na乳液代替饮水,剩余2组用5%(质量分数)CMC-Na乳液代替饮水;脱镁叶绿酸a摄入剂量参考已有研究并设置梯度[13]:0.16、0.12、0.08、0.04 mg/mL(脱镁叶绿酸a-CMC-Na乳液制备方法:将各实验组对应量的脱镁叶绿酸a剂量分别溶解于200 mL的5% CMC-Na溶液中,并超声处理10 min)。喂养条件为:相对湿度55%~65%;室温(25±1) ℃,在12 h黑暗/12 h光照循环条件下喂养,采用标准的实验室饮食。6组连续喂养12周,期间小鼠可以正常饮食。
图1 小鼠实验分组情况
Fig.1 Experimental grouping of mices
注:实验分为6组,实验组小鼠摄入不同剂量的脱镁叶绿酸a-CMC-Na乳液,对照组小鼠摄入5%的CMC-Na乳液。HFD-Pheo a 0.16组:0.16 mg/mL;HFD-Pheo a 0.12组:0.12 mg/mL;HFD-Pheo a 0.08组:0.08 mg/mL;HFD-Pheo a 0.04组:0.04 mg/mL;HFD:高脂膳食;NC:正常膳食。
1.3.3 口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)
当动物实验进行到11周时,利用血糖仪检测小鼠尾静脉血液标本血糖值,进行葡萄糖耐量实验。小鼠禁食12 h[14]后,每组小鼠取4只与该组平均体重接近的进行测量,按2 g/kg剂量灌胃5%(质量分数)葡萄糖溶液[15]。使用血糖仪检测小鼠尾静脉末梢血糖水平,记录注射前(0 min)及注射后30、60、90、120 min的血糖值。最后利用SPSS Statistics 27对数据进行显著性差异分析。
1.3.4 血清生化指标检测
采用已有的方法收集小鼠眼球血[16]。将装有眼球血的抗凝1.5 mL EP管放入4 ℃微型离心机中进行2 000 r/min离心15 min,取上层血清于新的抗凝1.5 mL EP管中,放于4 ℃冰箱待测。
取收集到的血清采用二喹啉甲酸(bicinchoninic acid,BCA)法测蛋白浓度,根据试剂盒测定小鼠血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、总胆固醇(total cholesterol,TC)水平;采用全自动生化测定分析仪检测血清中胰岛素(insulin,INS)、脂多糖(lipopolysaccharide,LPS)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达水平,具体操作方法参照试剂盒说明书进行。
与动物机体抗氧化性能相关的指标,采用比色法测定血清总抗氧化能力(total-antioxidant capacity,T-AOC),黄嘌呤氧化酶法测定血清总超氧化物歧化酶(total-superoxide dismutase,T-SOD)以及硫代巴比妥酸(thiobarbituric acid,TBA)法测定血清丙二醛(malondialdehyde,MDA),操作方法参照相应检测试剂盒说明书进行。
1.3.5 组织病理学观察
将收集到的肝脏组织固定在多聚甲醛溶液(体积分数为4%)中48 h,经过石蜡包埋、切片、苏木精-伊红(hematoxylin eosin,HE)染色和油红O染色等步骤处理后进行组织病理学观察。取收集到的结肠样本,用多聚甲醛溶液(4%)固定48 h,再经过石蜡包埋、切片以及阿利新蓝-过碘酸-雪夫(alcian blue-periodic acid schiff,AB-PAS)染色和HE染色后进行病理学观察并分析。
1.3.6 高脂膳食诱导的肠道菌群测定
新鲜粪便采集自喂养完成后的C57BL/6 J小鼠,每只小鼠粪便取3~5颗放入无菌冻存管中至于-80 ℃冰箱贮存。各组随机取3只小鼠粪便进行肠道菌群检测。按照试剂盒说明书从样品中提取出肠道菌群的总DNA,使用PCR扩增细菌16S rRNA基因的V3和V4区。回收PCR产物后使用2%琼脂糖凝胶电泳检测,最终扩增产物在Illumina公司(加州,美国)的PE250平台进行测序,使用QIIME2软件进行分析。
1.3.7 肝脏代谢组和粪便代谢组检测
肝脏代谢组预处理:每只小鼠剪取一片肝脏组织(100~120 mg)于贴好标签的1.5 mL离心管中称重并记录,置于液氮速冻,随后放入-80 ℃冰箱保存。将冻存的肝脏组织转移至5 mL离心管按照1∶9的料液比(即1 g肝脏组织加入9 mL的提取液)加入甲醇-乙腈-水(体积比2∶2∶1)后,使用均质机匀浆涡旋1 min,并超声处理10 min,于12 000 r/min离心10 min[17]。上清液用0.22 μm微孔滤膜过滤,分装在液相小瓶中保存于-80 ℃待测。
粪便代谢组预处理:取出冻存的粪便样品100 mg于1.5 mL离心管中,吸取0.6 mL生理盐水到已灭菌的微型离心管中并使用均质机匀浆涡旋1 min,超声5 min后立即冷冻离心(10 000 r/min,4 ℃,5 min)。吸取上清液0.2 mL加入0.8 mL乙腈-甲醇(体积比1∶1)于新离心管内,进行冷冻离心(10 000 r/min,4 ℃,5 min),取上清液200 μL进行样品制备。
非靶向代谢组方法参考实验室已有方法,采用超高效液相色谱-质谱联用技术(ultra-high performance liquid chromatography-mass spectroscope,UPLC-MS)进行检测,进样程序参考已有研究[18]。检测条件:色谱柱采用Poroshell 120 C18(2.1 mm×100 mm,1.9 μm),柱温30 ℃,进样量5 μL,时间30 min,ESI正、负离子模式进行质谱采集。ESI正离子模式下流动相A[0.1%(体积分数)甲酸-水],流动相B(乙腈);ESI负离子模式下流动相A(0.1% 甲酸-水-5 mmol/L乙酸铵),流动相B(乙腈)。
1.4 数据分析
所有实验组均为6个平行,肠道微生物多样性检测设置3个平行,实验数据使用SPSS Statistics 27进行显著性分析。组间比较采用最小显著性差异法分析,P<0.05为存在显著差异,用Origin 2021进行作图。微生物组学部分的原始数据进行分类操作单元的划分(ASV水平),肠道菌群丰度及微生物种类差异分析通过美吉生物云平台(https://www.majorbio.com/)分析。超高效液相色谱-质谱联用技术非靶向检测肝脏和粪菌提取液,原始数据放入Bruker Data Analysis 5.1软件进行校正后,profile.文件转为MzXML格式放入Wizard MZmine 3进行降噪、基线校正、归一化、去同位素等处理。KEGG(https://www.genome.jp/kegg/)在线注释后的数据导出为Excel文件,表格数据根据样本组别进行分列整理。非靶向代谢组学相关分析使用基迪奥在线生信云处理平台(https://www.omicshare.com/tools/)。富集分析结果分析采用Metaboanalysis 5.0。
2 结果与分析
2.1 脱镁叶绿酸a定量分析
利用UPLC-DAD技术对脱镁叶绿酸a进行定量分析。结果显示采用层析方法分离的脱镁叶绿酸a纯度达到95%,与同课题组以往的研究结果一致[10]。
2.2 小鼠喂养过程体重变化
取各组小鼠1周体重的平均值进行绘图,结果如图2所示,前6周小鼠体重差异无统计学意义(P>0.05)。随着实验进行到第8周之后,实验组小鼠的体重均低于HFD组小鼠。各组小鼠体重都有明显增加,而NC组小鼠的体重增加比较缓慢,此时HFD组小鼠体重同实验组和NC组小鼠体重出现显著性差异(P<0.05),但是仍与HFD-Pheo a 0.04组小鼠体重无显著性差异(P>0.05);高脂膳食导致的小鼠体重变化与先前研究一致[19]。
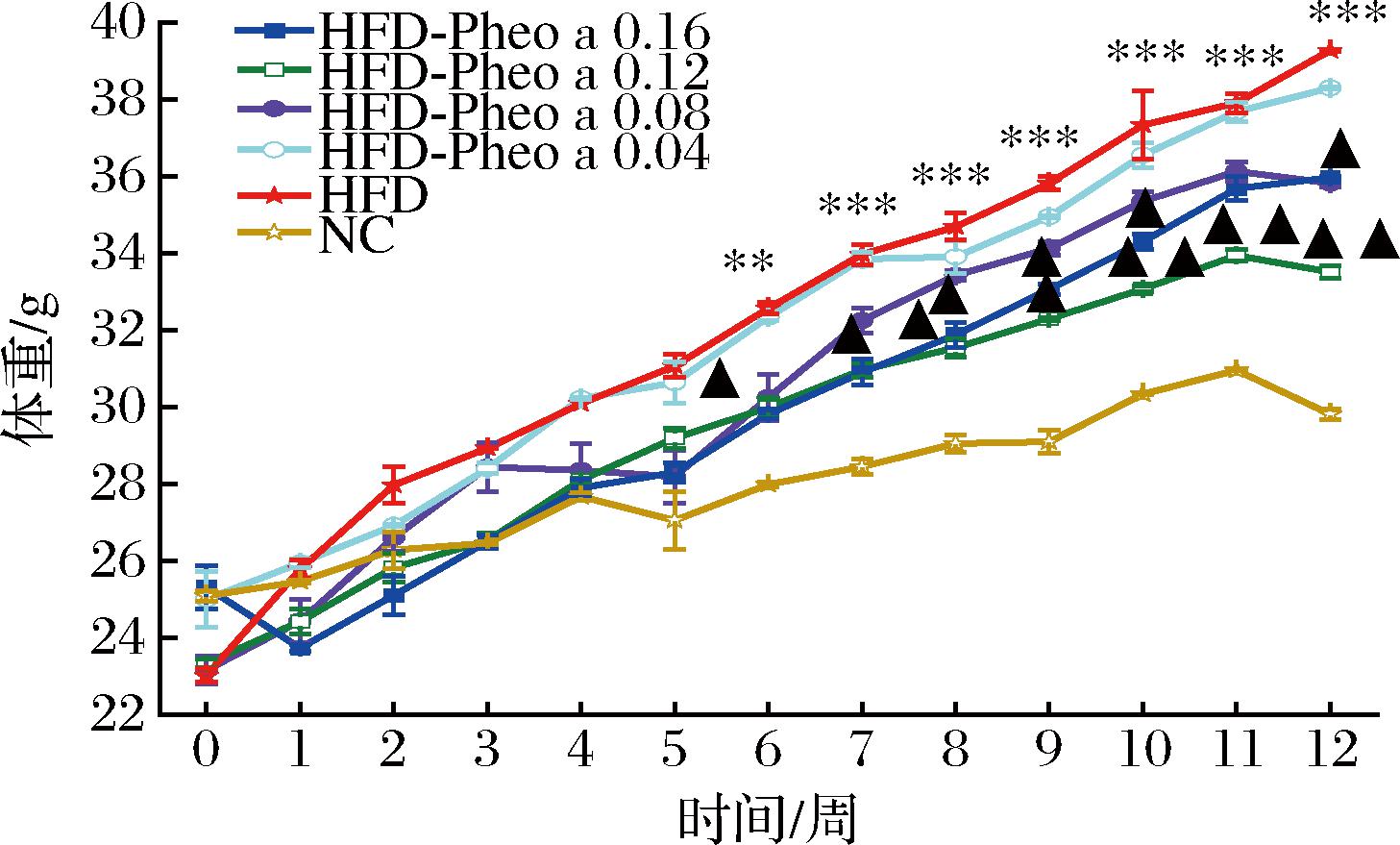
图2 各组小鼠体重的变化
Fig.2 Changes in body weight of mices
注:HFD组与NC组同期相比,**P<0.01,***P<0.001;实验组与HFD组同期相比,▲P<0.05,▲▲P<0.01,▲▲▲P<0.01(下同)。
如图2所示,高浓度组(HFD-Pheo a 0.16、0.12)对于高脂膳食小鼠体重抑制有明显的帮助,而低浓度组(HFD-Pheo a 0.08、0.04)机制效果减弱,但实验组之间不具有统计学意义。
2.3 脱镁叶绿酸a对高脂膳食小鼠血糖值的影响
判断小鼠是否患有糖尿病的诊断标准为:血糖正常:空腹血糖值(fasting plasma glucose,FPG)<6.1 mmol/L,同时OGTT 2 h血糖值<7.8 mmol/L。糖尿病前期:6.1 mmol/L≤FPG<7.0 mmol/L或7.8 mmol/L≤OGTT 2 h血糖<11.1 mmol/L。糖尿病:FPG≥7.0 mmol/L和(或)OGTT 2 h血糖≥11.1 mmol/L[20]。
如图3所示,HFD-Pheo a 0.16、0.12组和NC组的小鼠血糖值都属于正常值的范围,而HFD-Pheo a 0.08、0.04组和HFD组的小鼠血糖值不管是初始时还是2 h后都超出了正常范围,属于糖尿病血糖值范围。说明高脂膳食会促进小鼠的血糖值增长,这与KREBS等[21]的研究结果一致。
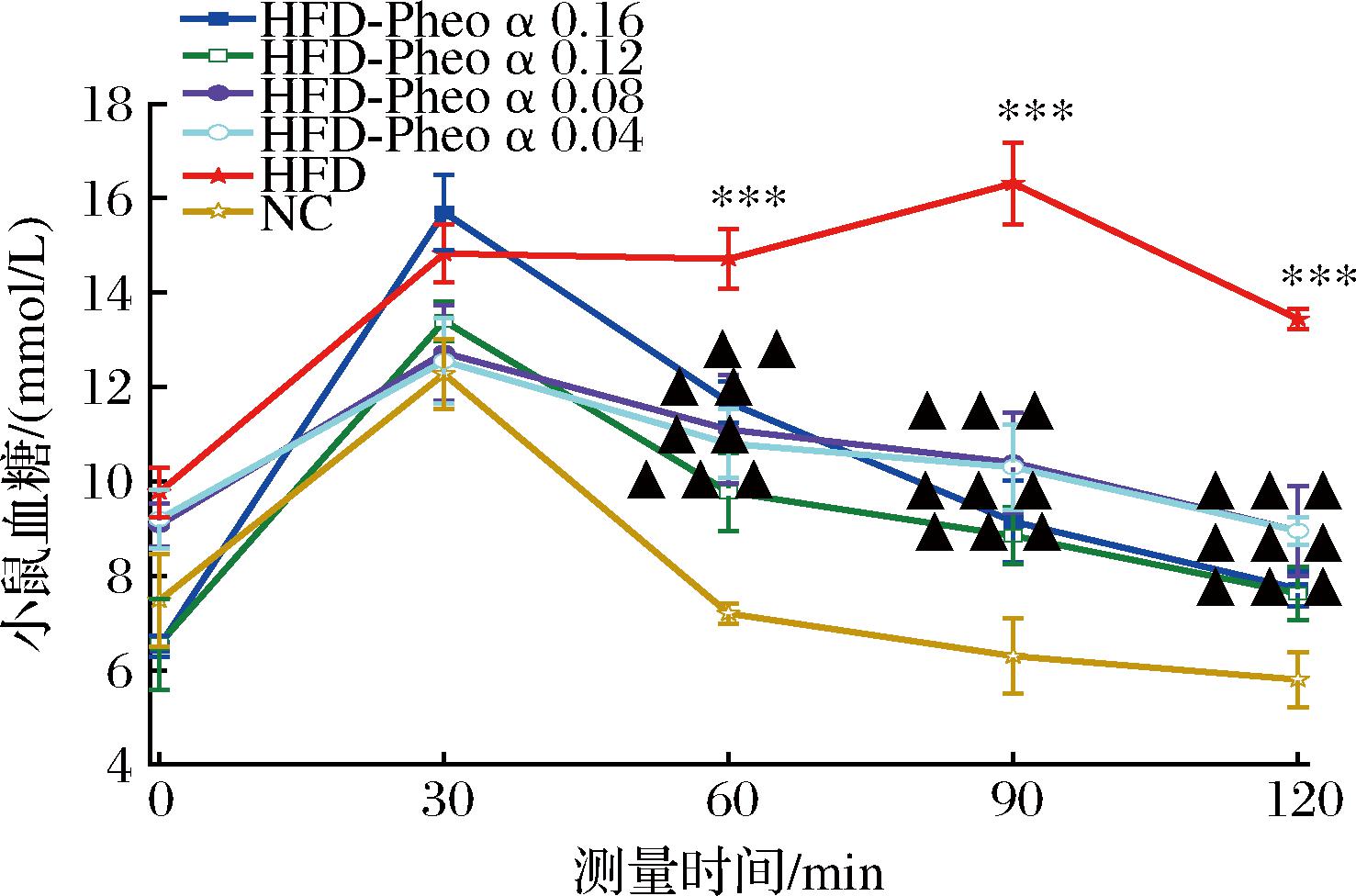
图3 各组小鼠血糖值的变化
Fig.3 Changes in blood glucose values of mices
由图3可知,HFD组小鼠血糖值与另外5组具有显著性差异(P<0.05),可判定为造模成功。同时说明脱镁叶绿酸a会对小鼠血糖指数有明显抑制作用,并且高浓度组(HFD-Pheo a 0.16、0.12)与HFD组相比小鼠血糖值的差异性更加显著,说明摄入不同剂量的脱镁叶绿酸a对小鼠血糖指数抑制效果不同,呈剂量依赖关系,高剂量(HFD-Pheo a 0.16、0.12)有明显的改善作用。
2.4 小鼠血清生化指标测试结果
2.4.1 生理生化指标差异
生理生化指标测定结果如表1所示。ALT和AST是被广泛应用于评价肝脏功能的指标[22],HFD组的均高于NC组,实验组的ALT、AST水平虽然均低于HFD组,但结果并不显著(P>0.05),说明高脂膳食会影响小鼠ALT、AST水平升高。TG、TC、LDL-C和HDL-C是临床血脂分析的重要指标[23],正常小鼠血清中TG、TC活力较低,当肝脏发生损伤、坏死或受到破坏时,就会引起二者在血清中活性增加。HFD组TG、TC水平的均显著高于NC组(P<0.05),而实验组的均低于HFD组,尤其是高浓度组(HFD-Pheo a 0.16,0.12)与HFD组相比具有显著性差异(P<0.05),数据结果表明高脂膳食会诱导小鼠TG、TC水平升高,脱镁叶绿酸a对此具有抑制作用且抑制效果与脱镁叶绿酸a的摄入量相关,可判断其趋势是摄入量越高抑制效果越显著。当肝细胞受损时LDL-C含量将会升高,而HDL-C含量将会减少。HFD-Pheo a 0.12组的LDL-C水平较HFD组相比显著降低(P<0.05);HDL-C水平显著性提高(P<0.05),其余实验组较HFD组相比也有所降低但结果并不显著(P>0.05);则脱镁叶绿酸a会降低小鼠体内LDL-C水平,升高HDL-C水平,但数据结果表明其作用效果与摄入量无明显依赖性。
表1 小鼠血清生化检测分析
Table 1 Analysis of serum biochemical assays in mice
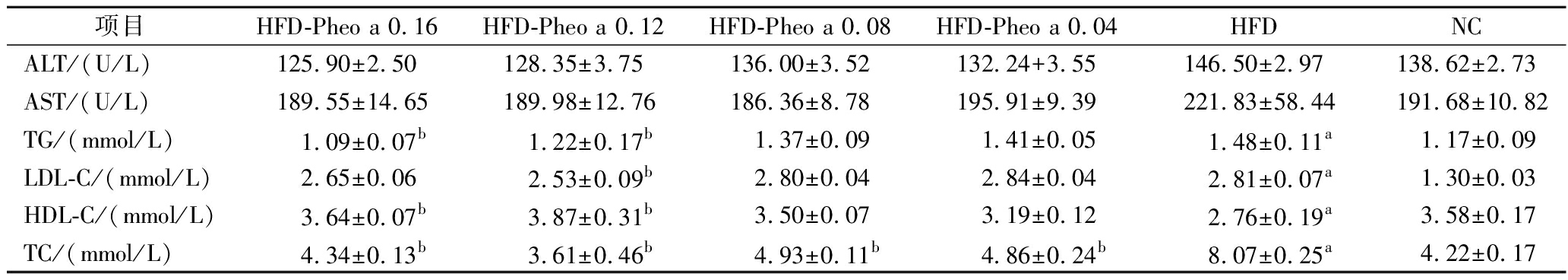
项目HFD-Pheo a 0.16HFD-Pheo a 0.12HFD-Pheo a 0.08HFD-Pheo a 0.04HFDNCALT/(U/L)125.90±2.50128.35±3.75136.00±3.52132.24+3.55146.50±2.97138.62±2.73AST/(U/L)189.55±14.65189.98±12.76186.36±8.78195.91±9.39221.83±58.44191.68±10.82TG/(mmol/L)1.09±0.07b1.22±0.17b1.37±0.091.41±0.051.48±0.11a1.17±0.09LDL-C/(mmol/L)2.65±0.062.53±0.09b2.80±0.042.84±0.042.81±0.07a1.30±0.03HDL-C/(mmol/L)3.64±0.07b3.87±0.31b3.50±0.073.19±0.122.76±0.19a3.58±0.17TC/(mmol/L)4.34±0.13b3.61±0.46b4.93±0.11b4.86±0.24b8.07±0.25a4.22±0.17
注:与NC组比较,aP<0.05;与HFD组比较,bP<0.05(下同)。
2.4.2 炎症因子含量差异
炎症因子含量测定结果如表2所示。高浓度组(HFD-Pheo a 0.16、0.12)的INS水平较HFD组显著降低(P<0.05),而HFD组小鼠的INS水平与NC组相比较高。根据胰岛素抵抗指数(HOMA-IR=空腹胰岛素×空腹血糖/22.5)数值大小将各组小鼠分为胰岛素抵抗(IR)和非胰岛素抵抗(N-IR),结果发现实验组和HFD组小鼠均属于IR范围[24]。这说明高脂膳食摄入过多会导致内脏脂肪堆积,从而造成小鼠体内INS水平偏高,出现INS抵抗的现象。从数据结果来看,脱镁叶绿酸a可改善INS抵抗现象,其改善效果与摄入量存在依赖关系,摄入量越高改善效果更好,但其作用机理仍需进一步研究。
表2 小鼠血清炎症因子含量分析
Table 2 Analysis of serum inflammatory factor levels in mice
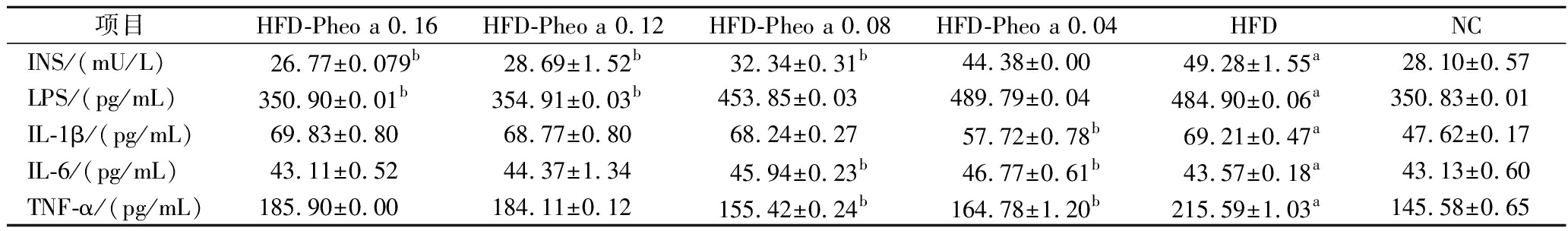
项目HFD-Pheo a 0.16HFD-Pheo a 0.12HFD-Pheo a 0.08HFD-Pheo a 0.04HFDNCINS/(mU/L)26.77±0.079b28.69±1.52b32.34±0.31b44.38±0.0049.28±1.55a28.10±0.57LPS/(pg/mL)350.90±0.01b354.91±0.03b453.85±0.03489.79±0.04484.90±0.06a350.83±0.01IL-1β/(pg/mL)69.83±0.8068.77±0.8068.24±0.2757.72±0.78b69.21±0.47a47.62±0.17IL-6/(pg/mL)43.11±0.5244.37±1.3445.94±0.23b46.77±0.61b43.57±0.18a43.13±0.60TNF-α/(pg/mL)185.90±0.00184.11±0.12155.42±0.24b164.78±1.20b215.59±1.03a145.58±0.65
LPS常被认为是炎症、肥胖和代谢紊乱之间的关键联系,它可以通过与白细胞结合引导其产生转录因子,再通过转录因子刺激TNF-α、IL-1β、IL-6等炎性胞质分裂因子的产生,最终引发炎症[25]。该实验结果表明高脂膳食会增加小鼠体内LPS的活性,脱镁叶绿酸a对此具有改善作用且高浓度组(HFD-Pheo a 0.16,0.12)改善效果更加显著(P<0.05)。
IL-1β、IL-6、TNF-α作为炎症反应的重要调节因子,在机体健康中起着关键作用[26]。与NC组比较,HFD组IL-1β、IL-6、TNF-α水平明显升高(P<0.05);与HFD组比较,HFD-Pheo a 0.04组IL-1β水平明显降低(P<0.05),HFD-Pheo a 0.16、0.12组IL-6水平和HFD-Pheo a 0.12组TNF-α水平有所降低但无显著性(P>0.05)。结果表明,高脂膳食会导致脂肪组织过度积累,进而刺激炎症因子的表达水平提高,最终加剧炎症反应;而脱镁叶绿酸a对于肥胖引起的炎症具有积极调节作用,但其调节效果与摄入量并未表现出强烈的相关性。
2.4.3 抗氧化酶活性及氧化产物含量差异
T-SOD、T-AOC、MDA是机体重要的生化指标,它们与氧化应激、脂质过氧化等过程密切相关[27]。T-SOD是一种重要的抗氧化酶,能够清除机体内的超氧阴离子自由基,从而减轻氧化应激反应。T-AOC反映了机体对自由基的清除能力,是评价抗氧化能力的重要指标。MDA是脂质过氧化物的产物,其含量可以反映脂质过氧化的程度。如表3所示,HFD组与NC组比较,T-SOD、T-AOC含量明显降低,MDA含量明显升高(P<0.05);高浓度组(HFD-Pheo a 0.16,0.12)与HFD组相比,T-SOD、T-AOC含量明显升高,MDA含量明显降低(P<0.05)。结果表明高脂膳食会导致小鼠体内T-SOD、T-AOC活性下降,MDA含量增加,进而加重氧化应激反应,增加患慢性疾病的风险,这与先前研究结果一致[28]。而脱镁叶绿酸a具有强的抗氧化作用[26],可以提高T-SOD、T-AOC的表达量和活性,提高二者清除自由基的能力,进一步增加其含量同时减少MDA的产生。
表3 小鼠体内抗氧化酶活性及氧化产物含量分析
Table 3 Analysis of antioxidant enzyme activities and oxidation product contents in mice

项目HFD-Pheo a 0.16HFD-Pheo a 0.12HFD-Pheo a 0.08HFD-Pheo a 0.04HFDNCT-SOD/(U/mL)96.45±3.09b98.05±1.60b82.18±1.6781.42±0.3275.01±2.49a92.86±0.49T-AOC/(U/mL)24.28±0.4223.86±0.7817.88±1.26b15.60±0.5112.43±0.29a23.45±0.39MDA/(nmol/mL)27.46±1.11b26.19±1.46b33.65±0.1629.60±0.57b47.94±0.57a27.14±0.27
2.5 脱镁叶绿酸a对高脂膳食小鼠组织病理的影响
观察各组小鼠肝脏结构的情况,HE染色结果如图4所示。NC组小鼠肝脏组织结构清晰,肝小叶界限分明,小叶内的肝细胞排列有序,形成明显索状结构,未出现明显病理学现象。HFD组小鼠肝脏组织有较多的空泡状脂滴形成;肝小叶内炎性细胞浸润增加,还伴随着其结构改变以及肝细胞增生。与HFD组相比,HFD-Pheo a 0.16组的肝脏组织脂肪变性以及炎症反应等症状明显减轻,空泡状脂滴数量明显减少,肝细胞增生得到缓解。其余实验组较HFD组相比,结果虽有所改善,但不够明显。
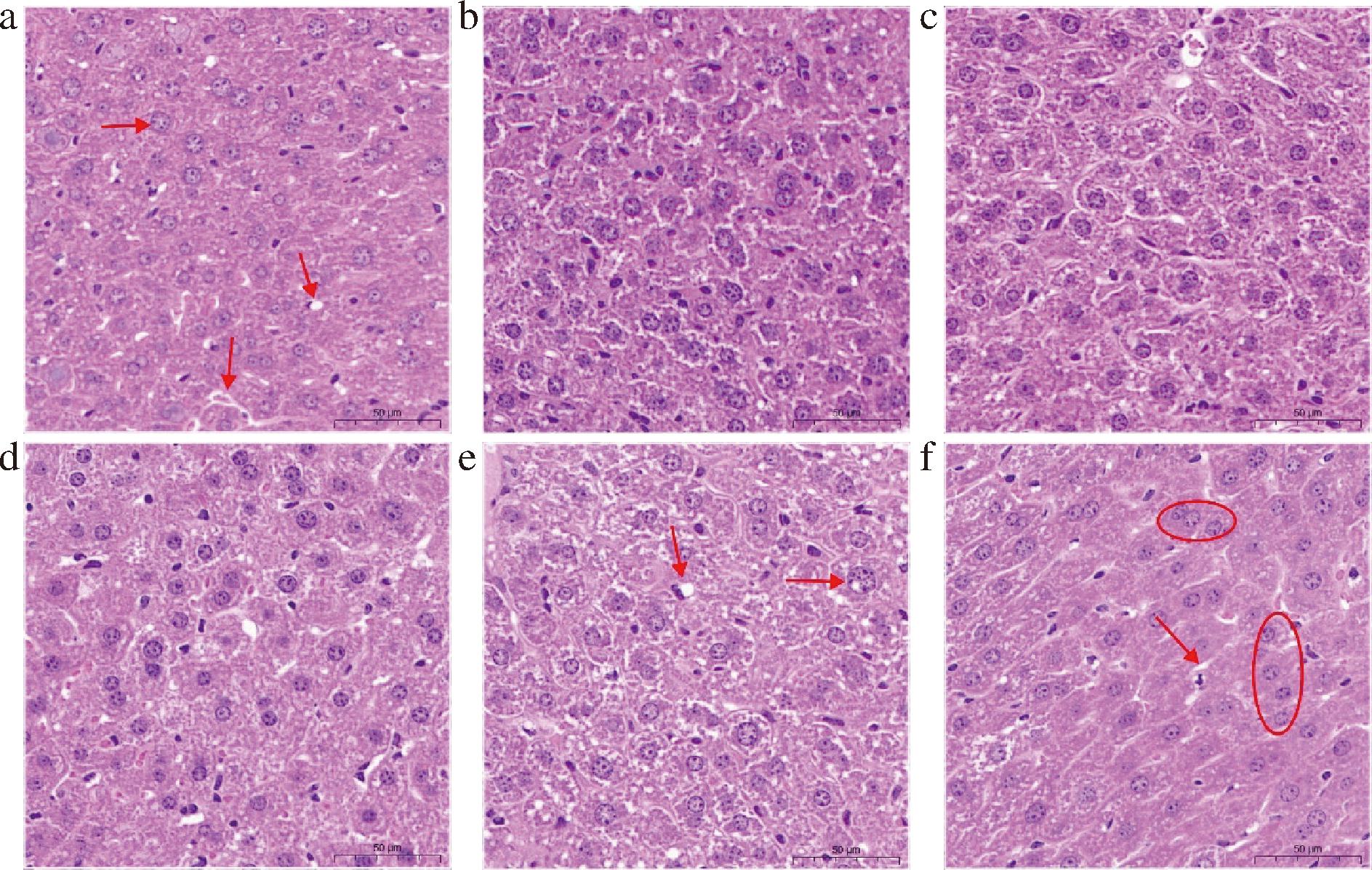
a-HFD-Pheo a 0.16组;b-HFD-Pheo a 0.12组;c-HFD-Pheo a 0.08组;d-HFD-Pheo a 0.04组;e-HFD组;f-NC组
图4 各组小鼠肝脏组织HE染色图
Fig.4 HE staining of liver tissue of mices
注:“→”代表空泡状脂滴出现,肝细胞肿大;“○”代表肝细胞排列情况。
各组小鼠肝脏组织油红O染色结果如图5所示。NC组小鼠肝脏组织未观察到显著的脂滴积聚现象,而HFD组小鼠脂滴数量明显增多,表现为不均一的红色脂滴聚集在肝细胞周围。与HFD组相比,实验组脂肪变性程度明显减轻,脂滴数量大幅减少且以较为分散的形式存在。初步判断脱镁叶绿酸a对改善高脂小鼠慢性肝炎等疾病有所作用,作用效果与小鼠摄入量有关,摄入量越高,对肝脏疾病的改善效果就越好。
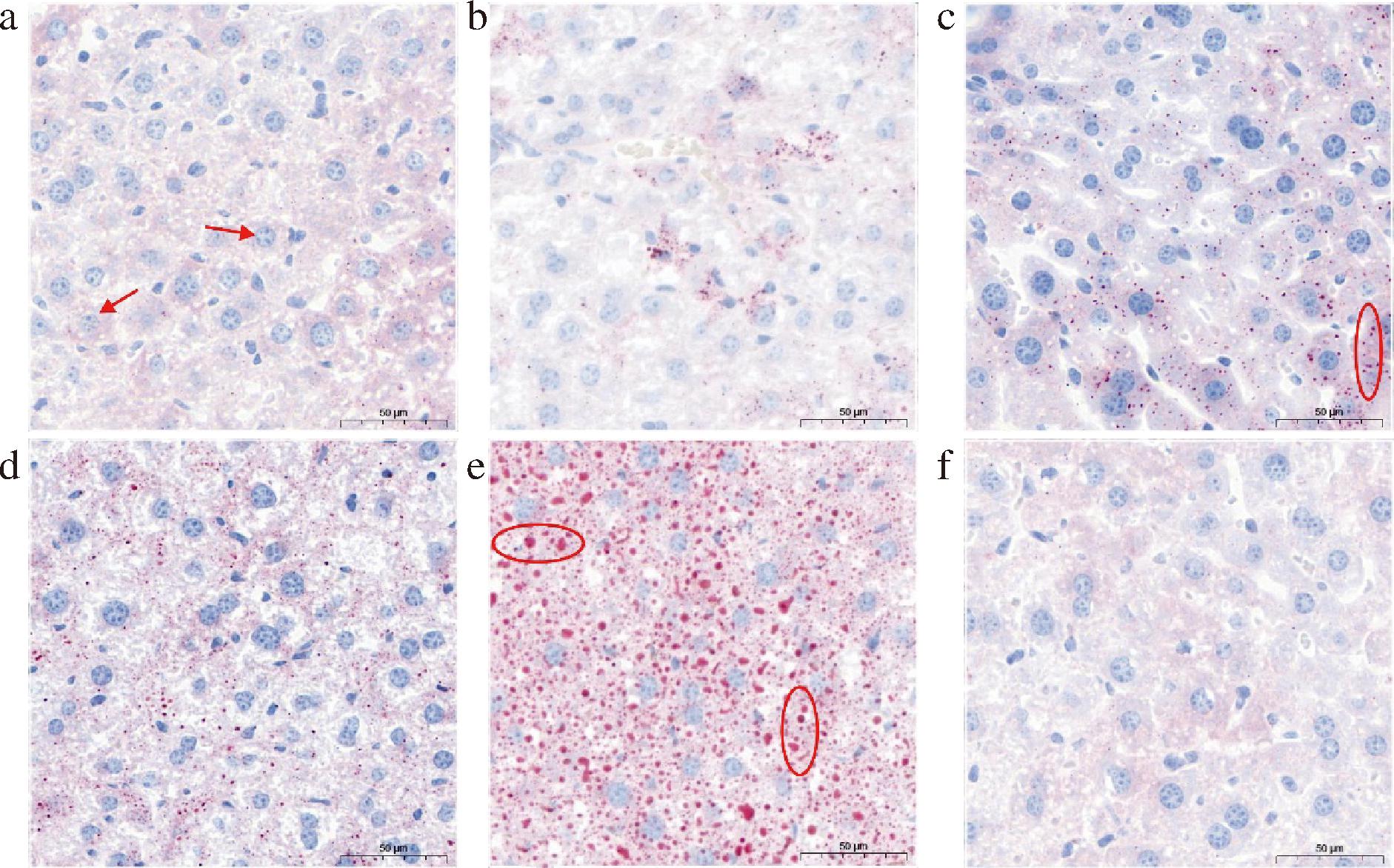
a-HFD-Pheo a 0.16组;b-HFD-Pheo a 0.12组;c-HFD-Pheo a 0.08组;d-HFD-Pheo a 0.04组;e-HFD组;f-NC组
图5 各组小鼠肝脏组织油红O染色图
Fig.5 Oil-red O staining of liver tissue of mices
注:“→”代表肝细胞生长情况;“○”代表脂质沉积情况。
各组小鼠结肠组织AB-PAS染色结果如图6所示。NC组小鼠结肠的黏液层经染色后分布均匀、厚度适中;纤维绒毛呈现出细丝状形态,覆盖在黏膜表面;杯状细胞数量适中,无明显炎症现象。HFD组小鼠出现明显炎症细胞浸润现象;其染色阳性区域较NC组更密集,则结肠黏液层出现增加、增厚现象;杯状细胞形状变圆还伴随着绒毛形状不规则等现象。与HFD组比较,高浓度组(HFD-Pheo a 0.16、0.12)小鼠肠道黏膜损伤有所改变,炎症细胞浸润现象减少,杯状细胞数量增加、体积增大。
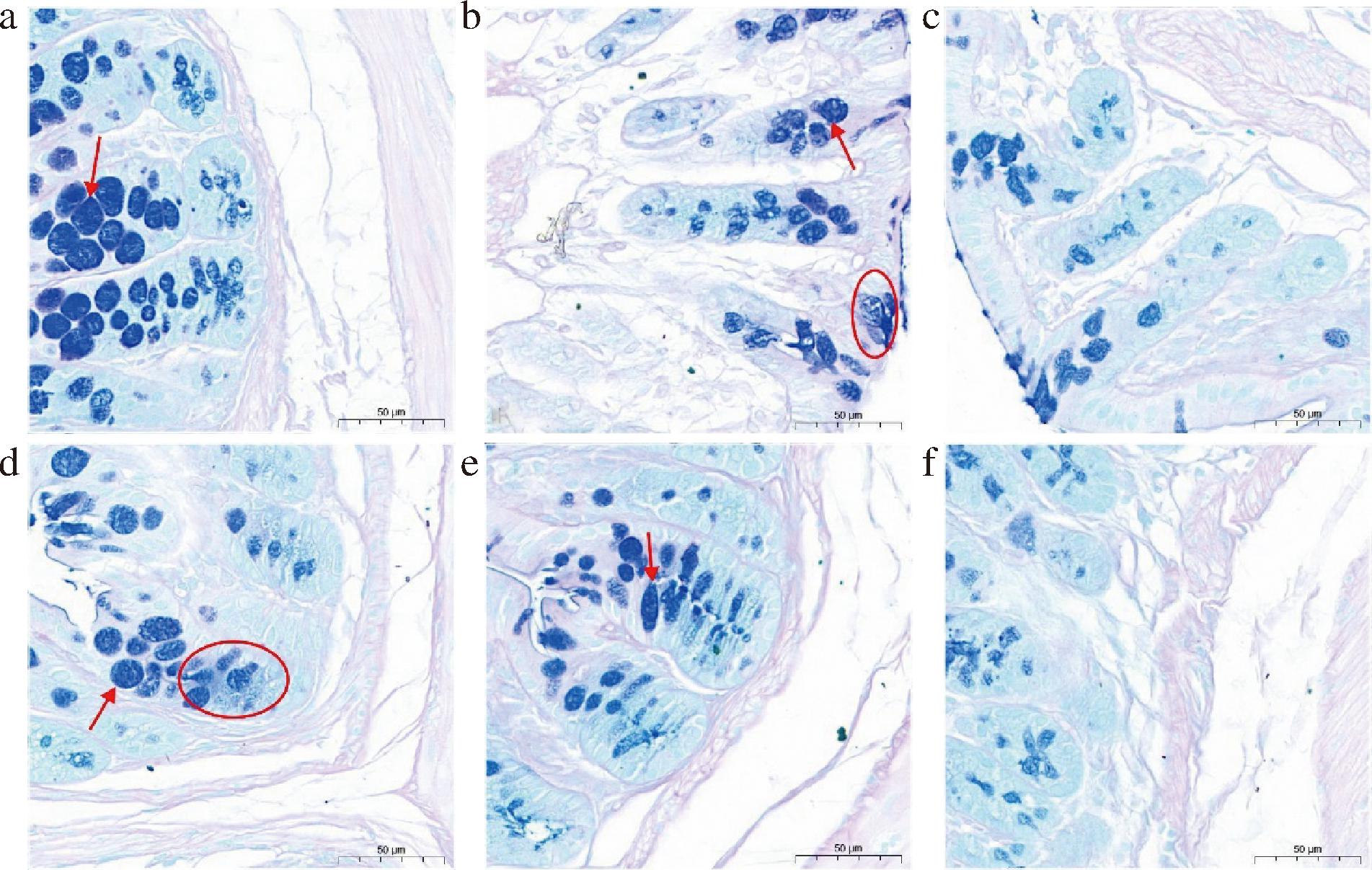
a-HFD-Pheo a 0.16组;b-HFD-Pheo a 0.12组;c-HFD-Pheo a 0.08组;d-HFD-Pheo a 0.04组;e-HFD组;f-NC组
图6 各组小鼠结肠组织AB-PAS染色图
Fig.6 AB-PAS staining of mouse colon tissue in each group
注:“→”代表杯状细胞生长情况;“○”代表炎症细胞浸润现象。
各组小鼠结肠组织HE染色结果如图7所示。NC组小鼠未观察到明显的空泡状脂滴和炎性细胞浸润现象;HFD组小鼠空泡状脂滴数量增加且有明显的炎症细胞浸润现象。高浓度组(HFD-Pheo a 0.16、0.12)小鼠与HFD组相比炎症反应现象得到缓解,空泡状脂滴数量明显减少。结果表示高脂膳食可通过破坏肠道黏膜,分泌促炎细胞因子,引起炎症细胞浸润,最终触发慢性低水平炎症反应,小鼠摄入脱镁叶绿酸a后,炎症反应又会得到缓解。说明其具有改善高脂膳食导致的肠道炎症的作用并且高浓度组(HFD-Pheo a 0.16、0.12)的改善效果更加明显。
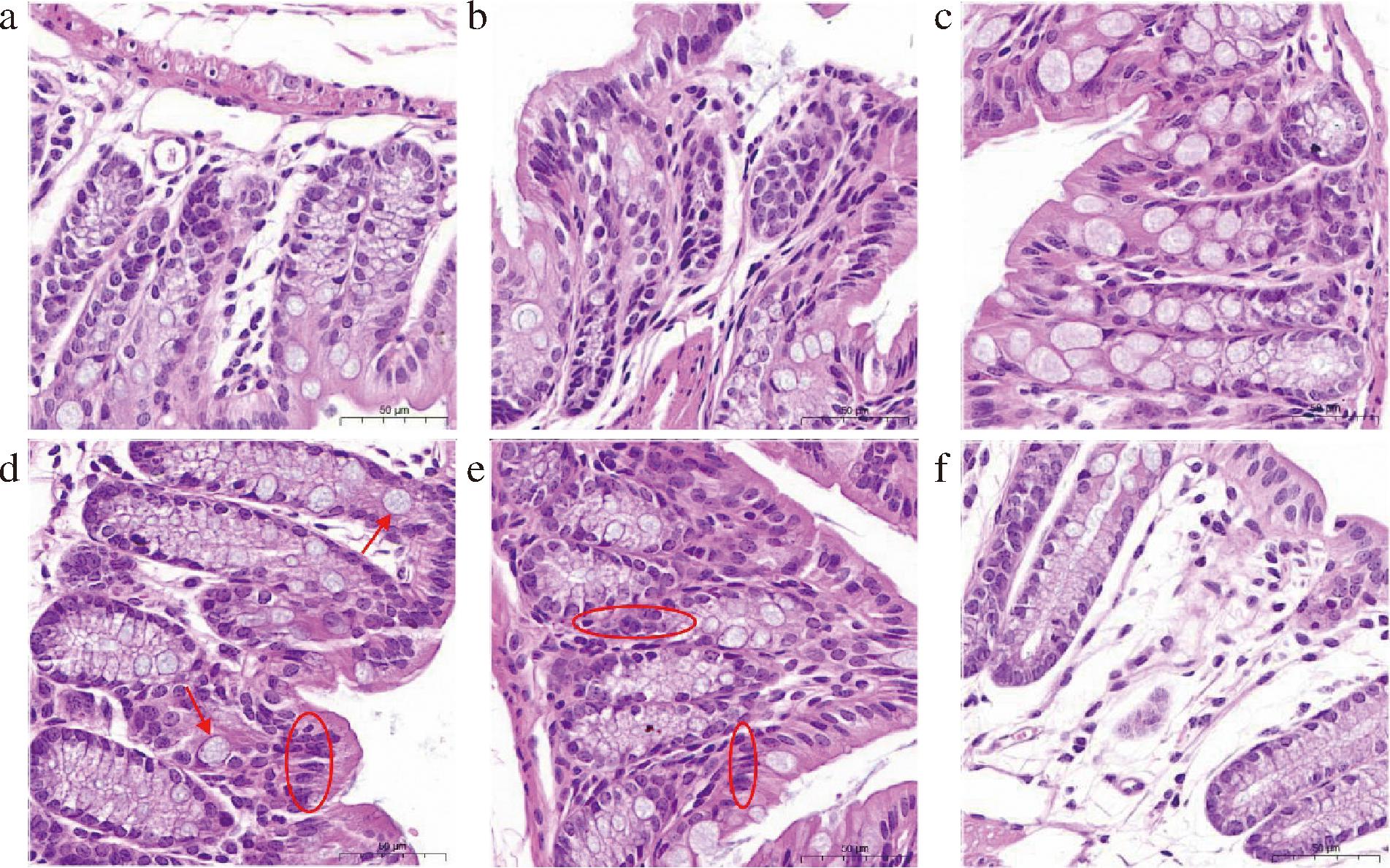
a-HFD-Pheo a 0.16组;b-HFD-Pheo a 0.12组;c-HFD-Pheo a 0.08组;d-HFD-Pheo a 0.04组;e-HFD组;f-NC组
图7 各组小鼠结肠组织HE染色图
Fig.7 HE staining of mouse colon tissue
注:“→”代表空泡状脂滴生长情况;“○”代表炎症细胞浸润现象。
2.6 脱镁叶绿酸a对高脂膳食小鼠肝脏代谢物的影响
运用UPLC-MS非靶向代谢组学分析小鼠肝脏代谢物变化,HFD-Pheo a 0.04组和HFD组的肝脏代谢物有显著性差异,说明实验组的代谢模式发生显著变化。如图8-a所示,实验组小鼠肝脏代谢物水平与对照组相比出现显著差异,得到烟酰甘氨酸、琥珀酸、缬氨酸、丙氨酸以及谷氨酸等差异代谢物。对差异代谢物使用KEGG富集分析,以P<0.05为条件进行筛选,结果如图8-b所示。该实验发现,脱镁叶绿酸a缓解高脂膳食诱导的肝脏代谢紊乱主要作用途径为:丙酮酸代谢、缬氨酸、亮氨酸和异亮氨酸生物合成、三羧酸循环。
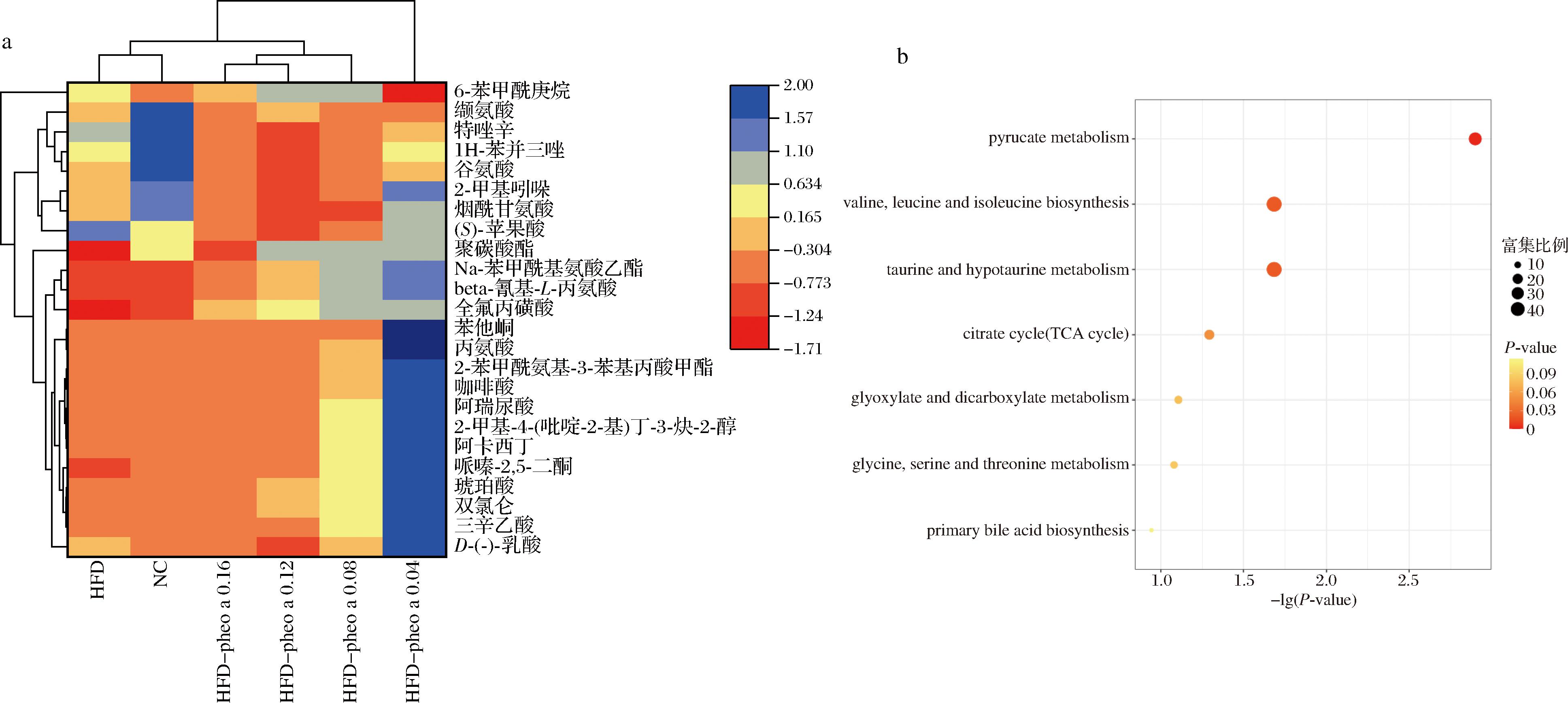
a-肝脏代谢物结果分析;b-肝脏代谢物KEGG富集分析
图8 各组小鼠肝脏代谢物分析
Fig.8 Analysis of liver metabolites of mices
注:pyruvate metabolism-丙酮酸盐代谢;valine,leucine and isoleucine biosynthesis-缬氨酸,亮氨酸和异亮氨酸生物合成;taurine and hypotaurine metabolism-牛磺酸和次牛磺酸代谢;citrate cycle-柠檬酸循环;glyoxylate and dicarboxylate metabolism-乙醛酸和二羧酸代谢;glycine,serine and threonine metabolism-甘氨酸,丝氨酸和苏氨酸代谢;primary bile acid biosynthesis-初级胆汁酸生物合成。
肝脏糖脂代谢紊乱表现为脂质和氨基酸不能正常代谢,会造成体内毒性物质的过度积累,导致肝脏功能受损,使其在清除外源性LPS方面能力下降,最终造成循环中LPS的水平升高。谷氨酸等的代谢紊乱造成的高水平LPS可通过影响肝脏中脂肪酸合成、分解和氧化来改变脂质代谢,导致脂肪在肝细胞中过度积累,进而促进脂肪肝的发展。例如LPS通过诱导巨噬细胞导致三羧酸循环中间产物琥珀酸的积累,琥珀酸可作为肝脏炎症和氧化应激的信号分子,当琥珀酸在小鼠体内积累时,会触发炎症因子IL-1β、IL-6、TNF-α的释放,从而引发肝脏炎症反应。烟酰甘氨酸可在水解酶的作用下分解成烟酰基团和甘氨酸,烟酰基团在酰胺合成酶催化下发生酰胺化反应,生成烟酰胺。烟酰胺具有抗炎、抗氧化等作用,适量的烟酰胺对高脂膳食诱导的脂质代谢紊乱有一定调节作用,通过减少脂肪的堆积来预防和减轻脂肪肝的发展;它还能够提高T-SOD和T-AOC表达量和活性,并降低氧化产物MDA的生成,最终减轻氧化应激对肝脏的损伤。这与前文小鼠血清生化指标测试结果相符合,该实验研究结果表明,脱镁叶绿酸a可能通过调节肝脏内脂质代谢途径,来抑制炎症反应,最终发挥对肝脏的保护作用。
2.7 脱镁叶绿酸a对高脂膳食小鼠肠道菌群的影响
2.7.1 Alpha多样性和Beta多样性评价
Alpha多样性指数常被用来评估样本中微生物群落丰富度和均匀度,本实验采用Chao指数和Shannon指数在ASV水平上进行分析,结果如图9所示。经过Kruskal-Wallis秩和检验后,Chao模型P=0.734 2,Shannon模型P=0.463 2,说明脱镁叶绿酸a对高脂膳食小鼠肠道菌群的丰富度和均匀度影响并不显著。
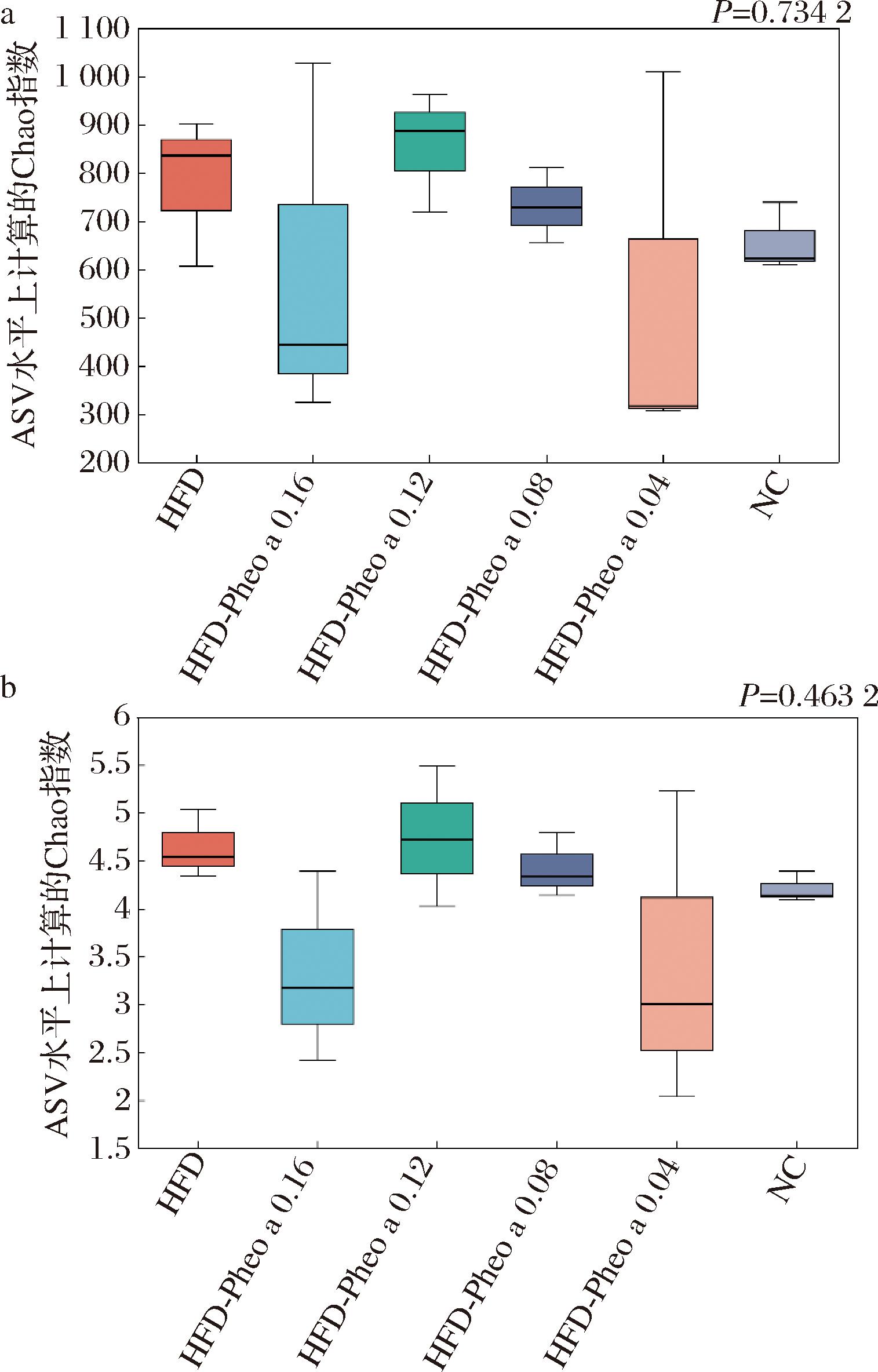
a-Chao指数;b-Shannon指数
图9 Alpha多样性分析
Fig.9 Alpha diversity analysis
再使用Beta多样性在ASV水平上进行分析,结果如图10所示。采用主坐标分析(principal co-ordinates analysis,PCoA)对高脂膳食小鼠进行脱镁叶绿酸a灌胃后的肠道微生物群落组成,结果表明各组样本之间存在统计学差异,同组样本间有明显的聚类;实验组与HFD组间有明显的分开。使用NMDS(non-metric multidimensional scaling sorting)来评估各组之间的相似性,HFD组与NC组间隔较远且HFD-Pheo a 0.16组与HFD组间隔较远,HFD-Pheo a 0.12、0.08组介于二者中间。经过ANOSIM检验后,PCoA模型和NMDS模型R=0.655 1,P=0.001,参数表明,2种模型分析的组内差异具有统计学意义。
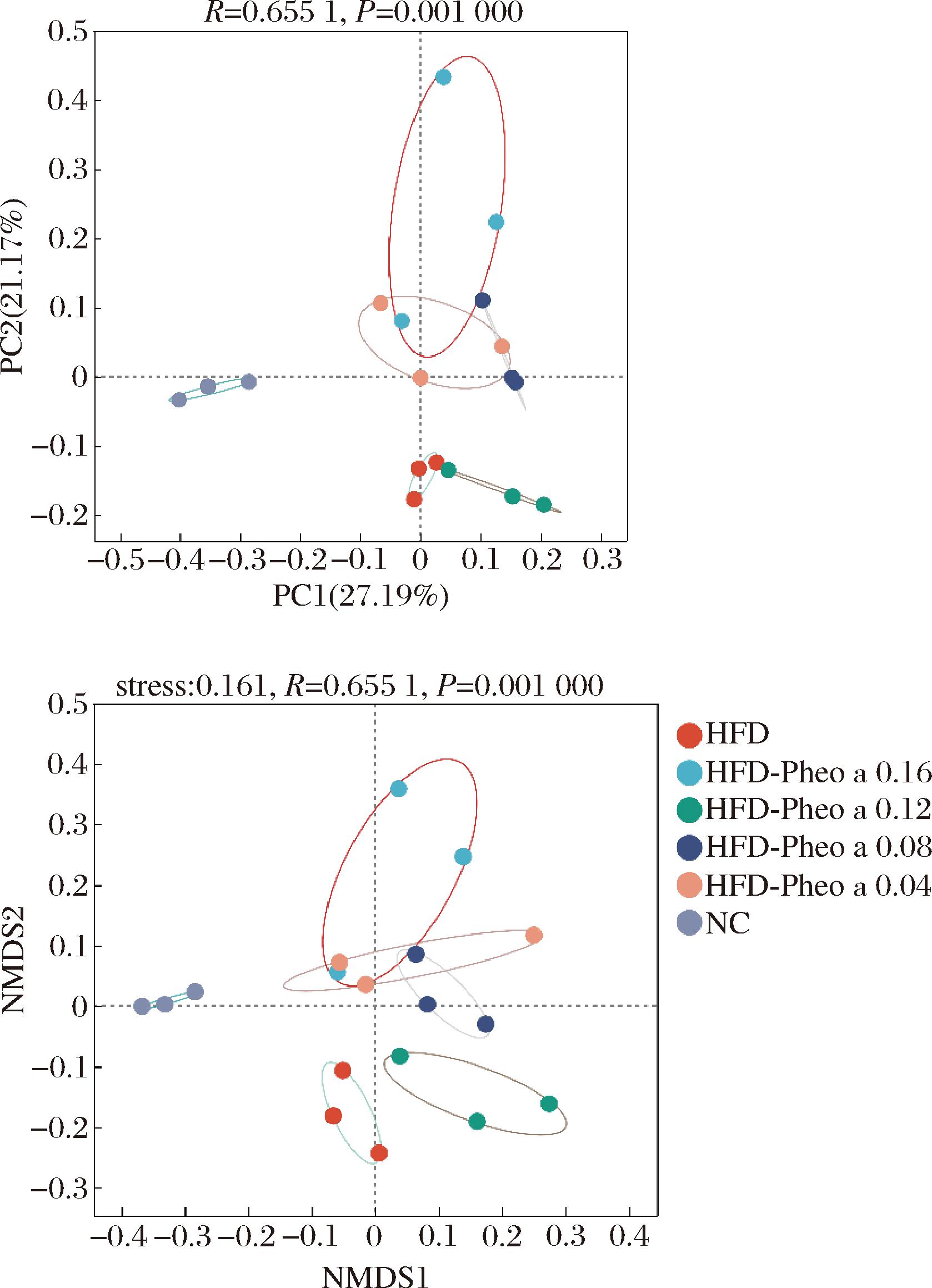
a-PCoA分析结果;b-NMDS分析结果
图10 Beta多样性分析
Fig.10 Beta diversity analysis
注:NMDS1-非度量多维尺度1;NMDS2-非度量多维尺度2。
2.7.2 脱镁叶绿酸a对高脂膳食小鼠肠道菌群物种组成的影响
在门水平和属水平上评估脱镁叶绿酸a对小鼠肠道菌群的影响。如图11-a所示,与NC组小鼠肠道菌群的丰度相比,HFD组门水平的菌群丰度出现明显变化。小鼠摄入脱镁叶绿酸a后,在门水平上占据90%丰度的菌群是厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)。与HFD组相比,脱镁叶绿酸a提高了拟杆菌门(Bacteroidota),降低了厚壁菌门(Firmicutes)的丰度,这与先前研究结果一致[8]。
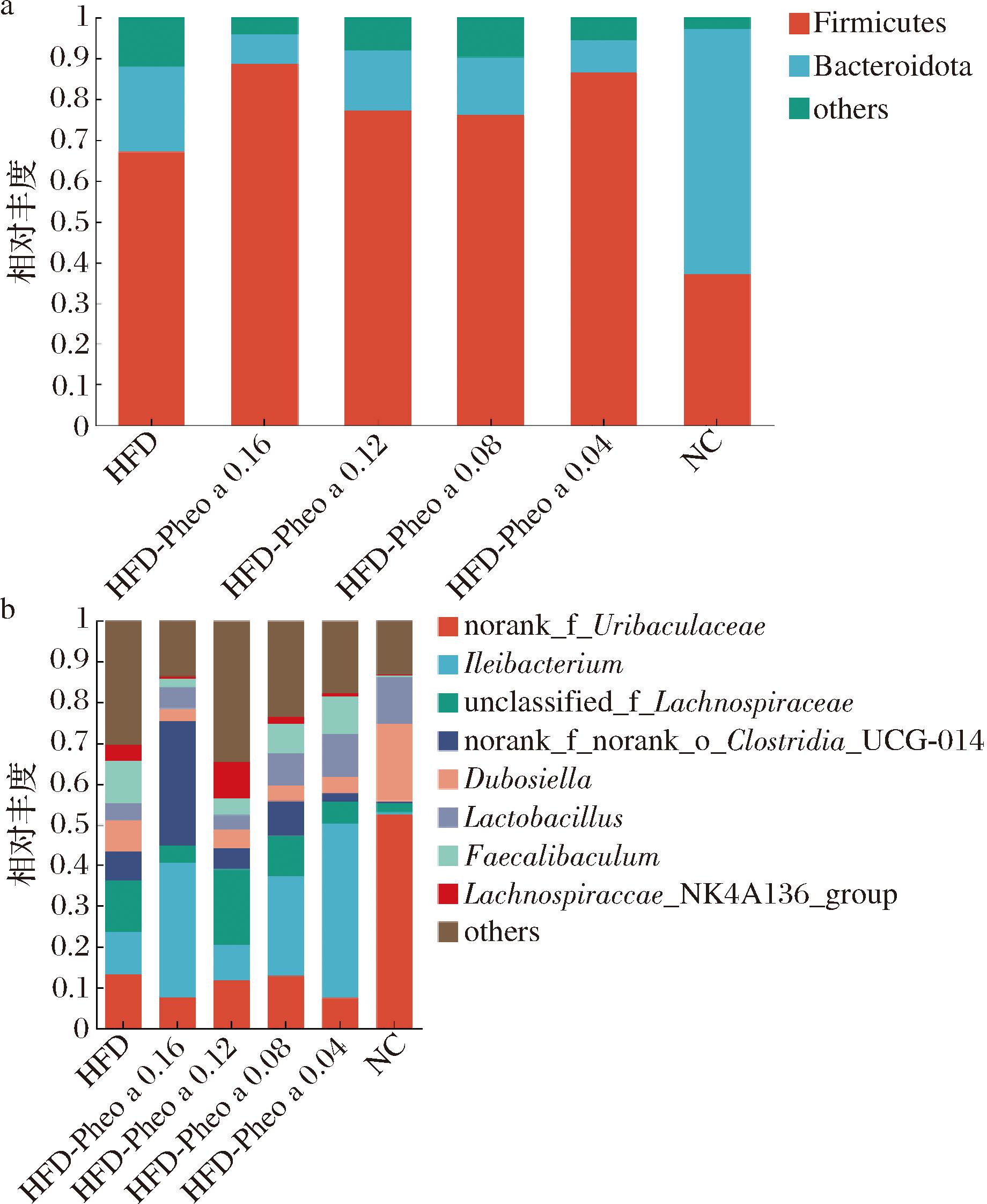
a-门水平丰度;b-属水平丰度
图11 各组小鼠肠道微生物菌群组成
Fig.11 Composition of intestinal microflora of mices
属水平丰度如图11-b所示,当小鼠摄入脱镁叶绿酸a一段时间后,属水平上主要是拟杆菌属(Muribaculaceae)、乳杆菌属(Lactobacillus)、回肠杆菌(Ileibacterium)和毛螺菌属(Lachnospira)。在属水平上实验组与对照组相比,毛螺菌属(Lachnospira)的丰度有所抑制但无显著性(P>0.05),梭菌属(Clostridium)丰度被显著抑制(P<0.05),推测高脂膳食诱导的肠道菌群和脱镁叶绿酸a的互作产物对其有一定的抑制作用。拟杆菌属(Muribaculaceae)和乳杆菌属(Lactobacillus)丰度显著升高(P<0.05),其作为肠道微生物的重要组成部分参与食物消化和吸收过程,帮助宿主分解复杂的食物成分,在维护肠道健康方面发挥着重要作用。但各实验组肠道菌群丰度变化情况与脱镁叶绿酸a摄入量无明显相关性;这也许是受到肠道微生物自身抵抗力或小鼠个体差异的影响。
肠道菌群失调与肥胖及糖脂代谢紊乱密切相关。研究发现,高脂膳食会导致小鼠脂肪组织堆积、糖耐量受损以及TC、TG等指标含量上升,而脱镁叶绿酸a通过显著提高高脂膳食小鼠体内乳杆菌属(Lactobacillus)等益生菌的丰度,益生菌又通过调节肠道菌群,改善肠道屏障作用,使能量代谢能力提高,抵抗了高脂膳食这一导致肥胖的因素,减少了高脂膳食小鼠体内脂肪堆积,从而延缓肝脏脂肪变性及其炎症反应[29]。
2.7.3 脱镁叶绿酸a对高脂膳食小鼠粪便代谢物的影响
对小鼠粪便代谢物进行非靶向代谢组学分析,结果如图12所示。HFD组小鼠粪便代谢物同NC组存在显著差异(P<0.05),实验组尤其是高浓度组(HFD-Pheo a 0.16、0.12)和HFD组小鼠相比也存在显著差异(P<0.05)。该实验发现高脂膳食诱导的HFD组小鼠与NC组相比出现了草乙酸、甲基-2-羟基异丁酸、α-酮戊二酸等差异代谢物。其中,草乙酸在肠道内可被进一步代谢成其他短链脂肪酸,具有抗炎、抗氧化,调节肝脏能量代谢,维持肠道屏障完整的作用;有助于减少氧化应激对肝脏的损伤,预防慢性炎症和相关的肝脏疾病。α-酮戊二酸作为三羧酸循环的中间产物,帮助提供肝脏代谢所需的能量,参与氨基酸的转运和代谢,具有改善胰岛素抵抗,调节氧化应激等作用。所以当高脂小鼠肠道代谢紊乱时,其体内的INS、TG、TC以及MDA含量会有所升高,这与前文所测的小鼠血清生化指标结果相符合。
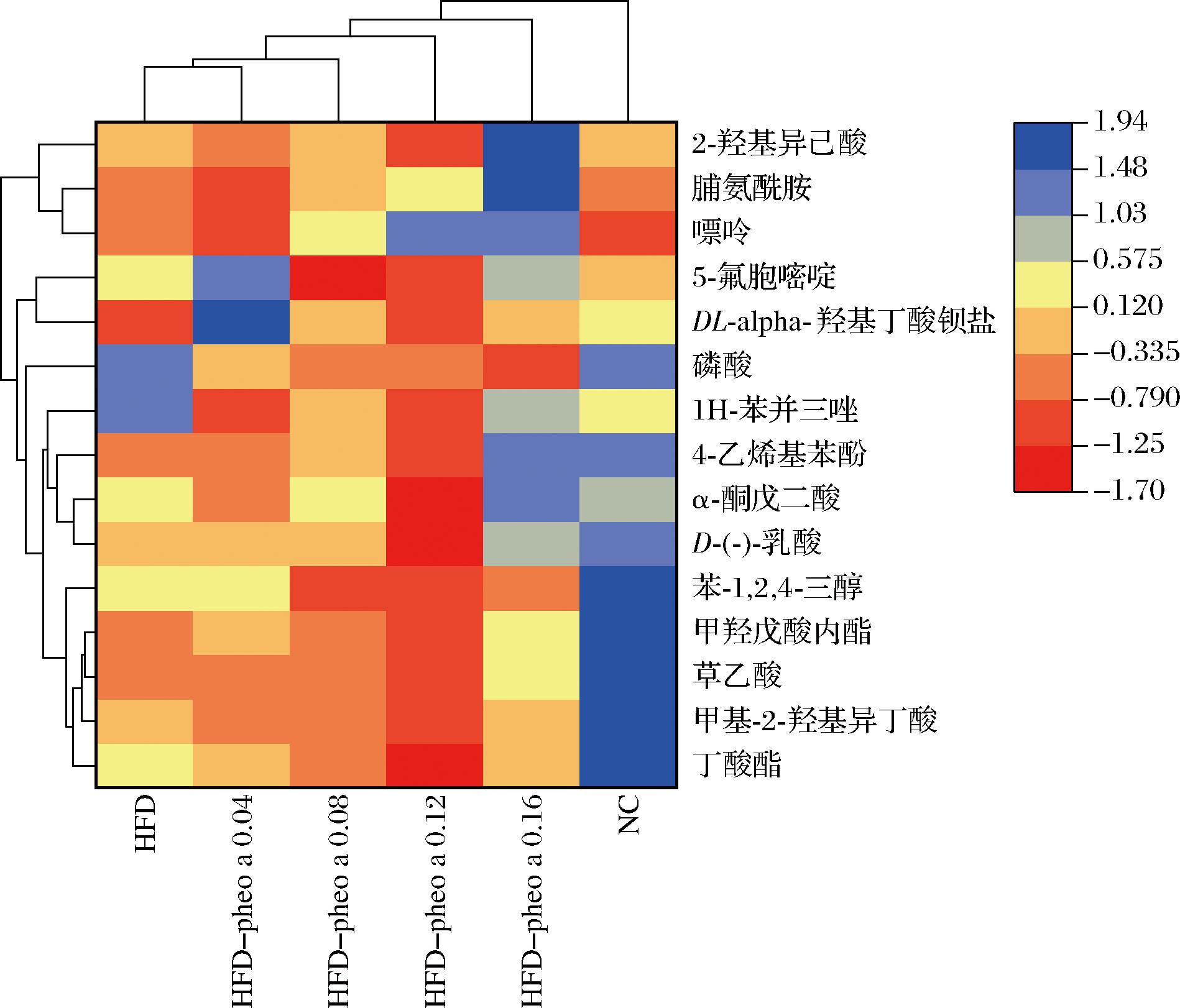
图12 各组小鼠粪便代谢物分析
Fig.12 Analysis of fecal metabolites of mices
当高脂膳食小鼠摄入脱镁叶绿酸a后,小鼠体内影响短链脂肪酸生成的相关代谢物(草乙酸、α-酮戊二酸等)出现明显变化,HFD-pheo a 0.16组效果尤为显著。这也可能与脱镁叶绿酸a造成小鼠肠道中拟杆菌属(Muribaculaceae)和乳杆菌属(Lactobacillus)丰度上升有关,二者是产生短链脂肪酸的优势菌,主要产生乙酸与丙酸[10]。说明脱镁叶绿酸a对改善小鼠体内短链脂肪酸生成和肝脏脂质堆积有重要意义,且摄入量越高对其帮助越明显。
3 结论
本实验通过高脂膳食小鼠摄入脱镁叶绿酸a乳液,研究脱镁叶绿酸a对高脂膳食诱导的肝肠损伤缓解效果和作用机制。基于血液生化实验对小鼠血清各项指标的测试,结果表明脱镁叶绿酸a对高脂膳食小鼠体内激素、炎症因子及氧化产物,如TG、INS、IL-6、IL-1β和MDA有明显抑制效果,可有效减轻其患慢性炎症类疾病的风险。基于微生物多样性结果表明,脱镁叶绿酸a在属水平上显著升高拟杆菌属(Muribaculaceae)和乳杆菌属(Lactobacillus)的丰度,降低梭菌属(Clostridium)的丰度。基于UPLC-MS技术对小鼠肝脏和粪便的代谢产物进行分析,结果表明食用脱镁叶绿酸a的高脂膳食小鼠产生的差异代谢物主要富集在丙酮酸代谢、缬氨酸、亮氨酸和异亮氨酸生物合成、三羧酸循环等通路,以此来调节高脂膳食小鼠肠道菌群和缓解机体炎症的发生。现有研究结果表明,脱镁叶绿酸a对高脂膳食诱导的肠道菌群及其代谢存在调节作用,具有高脂饮食习惯的代谢综合征人群可多食用富含脱镁叶绿酸a的食物,如紫菜等海藻食品。
[1] ZHONG S Q, BIRD A, KOPEC R E.The metabolism and potential bioactivity of chlorophyll and metallo-chlorophyll derivatives in the gastrointestinal tract[J].Molecular Nutrition &Food Research, 2021, 65(7):2000761.
[2] LEE D, NISHIZAWA M, SHIMIZU Y, et al.Anti-inflammatory effects of dulse (Palmaria palmata) resulting from the simultaneous water-extraction of phycobiliproteins and chlorophyll a[J].Food Research International, 2017, 100:514-521.
[3] ZHANG X H, ZHANG L J, SUN J J, et al.Photodynamic efficiency of a chlorophyll-a derivative in vitro and in vivo[J].Biomedicine &Pharmacotherapy, 2016, 81:265-272.
[4] BELKAID Y, HAND T W.Role of the microbiota in immunity and inflammation[J].Cell, 2014, 157(1):121-141.
[5] SCHIRMER M, SMEEKENS S P, VLAMAKIS H, et al.Linking the human gut microbiome to inflammatory cytokine production capacity[J].Cell, 2016, 167(4):1125-1136.
[6] 郑红莉, 王潇, 杜梦璇, 等.基于流式细胞术研究叶绿素对肠道细菌增殖的影响[J].食品工业科技, 2022, 43(22):296-302.ZHENG H L, WANG X, DU M X, et al.Effect of chlorophyll on the proliferation of intestinal bacteria based on flow cytometry method[J].Science and Technology of Food Industry, 2022, 43(22):296-302.
[7] LI Y Y, CUI Y, HU X S, et al.Chlorophyll supplementation in early life prevents diet-induced obesity and modulates gut microbiota in mice[J].Molecular Nutrition &Food Research, 2019, 63(21):1801219.
[8] LI Y Y, CUI Y, LU F, et al.Beneficial effects of a chlorophyll-rich spinach extract supplementation on prevention of obesity and modulation of gut microbiota in high-fat diet-fed mice[J].Journal of Functional Foods, 2019, 60:103436.
[9] CHEN K W, ROCA M.In vitro digestion of chlorophyll pigments from edible seaweeds[J].Journal of Functional Foods, 2018, 40:400-407.
[10] 曾全恒, 王元楷, 周纯洁, 等.基于体外发酵研究脱镁叶绿素对高脂饮食诱导小鼠肠道菌群的调节作用[J].食品与发酵工业, 2025,51(5):126-133.ZENG Q H, WANG Y K, ZHOU C J, et al.The regulating effect of pheophytins on mice gut microflora induced with high-fat diet based on in vitro fermentation[J].Food and Fermentation Industries, 2025,51(5):126-133.
[11] LI Y C, AGARRY I E, DING D S, et al.Screening of dephytinization reaction of chlorophyll pigments with citrus acetone powder by UPLC-DAD-MS[J].Journal of Food Science, 2023, 88(1):147-160.
[12] AGARRY I E, DING D S, LI Y C, et al.In vitro bioaccessibility evaluation of chlorophyll pigments in single and binary carriers[J].Food Chemistry, 2023, 415:135757.
[13] 葛挺, 张曼丽, 张于念, 等.米非司酮混悬液灌胃制备小鼠不完全型胚胎着床障碍模型的适宜剂量选择[J].山东医药, 2024, 64(12):32-36.GE T, ZHANG M L, ZHANG Y N, et al.Selection of appropriate dosage of mifepristone suspension for preparation of incomplete EID models in mice[J].Shandong Medical Journal, 2024, 64(12):32-36.
[14] 韩福禄, 姚兴伟, 栗晓彬, 等.口服葡萄糖耐量试验1 h血糖对糖尿病前期的诊断和鉴别价值[J].郑州大学学报(医学版), 2024, 59(2):201-205.HAN F L, YAO X W, LI X B, et al.Diagnosis and differentiation value of 1 hour blood glucose during oral glucose tolerance test for prediabetes[J].Journal of Zhengzhou University (Medical Sciences), 2024, 59(2):201-205.
[15] 卢婉贤, 马琦, 王黎, 等.肝特异性Rbp4基因敲除小鼠的建立及糖代谢特征分析[J].中国实验动物学报, 2024, 32(4):493-502.LU W X, MA Q, WANG L, et al.Establishment of liver-specific Rbp4 knockout mice and analysis of glucose metabolism characteristics[J].Acta Laboratorium Animalis Scientia Sinica, 2024, 32(4):493-502.
[16] 汪霞. LOX-1敲减对2型糖尿病小鼠视网膜病变及TPL2的影响研究[D].兰州:甘肃中医药大学, 2023.WANG X.Effect of LOX-1 knockdown on retinopathy and TPL2 in type 2 diabetic mice[D].Lanzhou:Gansu University of Chinese Medicine, 2023.
[17] 丁宝锋, 王小爽, 王芳, 等.肥胖模型小鼠肝脏的病理变化及代谢组分析[J].基础医学与临床, 2024, 44(5):699-704.DING B F, WANG X S, WANG F, et al.Pathological changes and metabolome analysis of liver in obese mouse models[J].Basic &Clinical Medicine, 2024, 44(5):699-704.
[18] CHAN Y T, HUANG J T, WONG H C, et al.Metabolic fate of black raspberry polyphenols in association with gut microbiota of different origins in vitro[J].Food Chemistry, 2023, 404:134644.
[19] 田真, 王紫玉, 渠鹏霞, 等.连翘叶改善肥胖大鼠炎症因子水平及肠道菌群结构的作用[J].海南医学院学报, 2024, 30(13):970-981.TIAN Z, WANG Z Y, QU P X, et al.Effects of Forsythia leaves on the levels of inflammatory factors and the structure of intestinal flora in obese rats[J].Journal of Hainan Medical University, 2024, 30(13):970-981.
[20] KALAYJIAN T, WESTMAN E C. Re: Effect of a ketogenic diet versus Mediterranean diet on glycated hemoglobin in individuals with prediabetes and type 2 diabetes mellitus:The interventional keto-med randomized crossover trial[J].The American Journal of Clinical Nutrition, 2022, 116(4):1184.
[21] KREBS N F, HIMES J H, JACOBSON D, et al.Assessment of child and adolescent overweight and obesity[J].Pediatrics, 2007, 120(Suppl 4):S193-S228.
[22] 岑梦佳. 高糖对BRL-3A肝细胞损害指标和乳酸产生的影响及其机制研究[D].兰州:兰州大学, 2021.CEN M J.Effects of high glucose concentration on damage index and lactic acid production ofBRL-3A rat hepatocytes and its potential mechanism[D].Lanzhou:Lanzhou University, 2021.
[23] 王会宾, 梁东名.甘精胰岛素联合利拉鲁肽对2型糖尿病并肥胖症患者血糖与血脂的调控作用分析[J].临床医学工程, 2024, 31(5):543-544.WANG H B, LIANG D M.Analysis on regulation effect of insulin glargine combined with liraglutide on blood glucose and blood lipid in patients with type 2 diabetes mellitus complicated with obesity[J].Clinical Medicine &Engineering, 2024, 31(5):543-544.
[24] 聂钦, 秦亚兰, 李平, 等.血浆致动脉粥样硬化指数与2型糖尿病患者胰岛素抵抗的相关性分析[J/OL].武汉大学学报(医学版), 2024.DOI:10.14188/j.1671-8852.2024.0029.NIE Q, QIN Y L, LI P, et al.Correlation analysis between atherogenic index of plasma and insulin resistance in patients with type 2 diabetes[J/OL].Medical Journal of Wuhan University, 2024.DOI:10.14188/j.1671-8852.2024.0029.
[25] ZHOU S J, CHEN G, QI M, et al.Gram negative bacterial inflammation ameliorated by the plasma protein beta 2-glycoprotein I[J].Scientific Reports, 2016, 6:33656.
[26] SUBRAMONIAM A, ASHA V V, NAIR S A, et al.Chlorophyll Revisited:Anti-inflammatory activities of chlorophyll a and inhibition of expression of TNF-α gene by the same[J].Inflammation, 2012, 35(3):959-966.
[27] KOWLURU R A, MISHRA M, KOWLURU A, et al.Hyperlipidemia and the development of diabetic retinopathy:Comparison between type 1 and type 2 animal models[J].Metabolism, 2016, 65(10):1570-1581.
[28] MI S Q, GU J X, CAO X L, et al.Regulatory mechanism of fermented wheat germ on lipid metabolism in hyperlipidemia rats via activation of AMPK pathway[J].Food Science and Technology, 2022, 42: e57222.
[29] NOBILI V, PUTIGNANI L, MOSCA A, et al.Bifidobacteria and lactobacilli in the gut microbiome of children with non-alcoholic fatty liver disease:Which strains act as health players?[J].Archives of Medical Science, 2018, 14(1):81-87.