大肠埃希菌(Escherichia coli)是常见的食源性病原体之一[1]。动物产品在屠宰过程中由于与胃肠道或粪便的接触而容易受到污染,而新鲜农产品也常因使用粪便作为肥料而受到影响。一旦E.coli侵入食品,便引发腐败变质,严重时还会导致严重的胃肠道疾病。据世界卫生组织报告,全球每年约有17亿次腹泻病例,其中有大约76万名5岁以下的儿童因腹泻病而死亡[2]。为了抑制食品中病原微生物的生长,人们常用苯甲酸钠、山梨酸钾、对羟基苯甲酸酯等化学防腐剂,然而这些化学物质的使用也带来了潜在的健康风险。为此,食品加工业正逐渐转向天然抗菌剂的研究和开发,以寻求更安全、健康的食品保存方法。
鱼腥草(Houttuynia cordata Thunb.),别名折耳根,是三白草科(Saururacere)植物蕺菜的带根全草,自1998年起被我国卫生部纳入药食两用植物目录。鱼腥草挥发油(Houttuynia essential oil,HEO)成分丰富,含有单萜、氧化二萜、倍半萜等多种化合物[3]。研究发现,不同种类及不同部位的鱼腥草挥发油在成分上存在一定差异[4],HEO具有广泛药理作用[5]。XU等[6]研究发现,HEO联合牛至挥发油对沙门氏菌(Salmonella)具有显著的协同抗菌作用,其抗菌机制可能与破坏细菌细胞膜、干扰生物膜的形成有关,这为其在食品防腐、延长保质期等方面的应用提供了可能。本研究旨在探究HEO对E.coli的体外抗菌特性,并整合扫描电镜、荧光光谱分析、网络分析、贪心算法等技术,系统挖掘HEO的抗菌活性成分及其作用机制,为鱼腥草资源的开发利用以及天然抑菌剂的研究提供科学依据和参考数据。
1 材料与方法
1.1 实验试剂及菌种
鱼腥草(市售);二甲基亚砜,国药集团化学试剂有限公司;吐温-80,阿拉丁试剂有限公司;磷酸盐缓冲液(PBS,0.1 mol/L,pH=7.2)、4-羟乙基哌嗪乙磺酸(2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES)缓冲液(pH=7.2)、碘化丙啶(propidium iodine,PI)、2′,7′ -二氯二氢荧光素二乙酸酯(DiSC3-(5))和3,3′-二丙基硫杂二羰花青碘化物(benzothiazolium,3-propyl-2-[5-(3-propyl-2(3H)-benzothiazolylidene)-1,3-pentadien-1-yl]-,iodide(1∶1),DCFH-DA),上海泰坦科技股份有限公司;琼脂,北京索莱宝科技有限公司;营养肉汤培养基和LB肉汤培养基,杭州百思生物技术有限公司。
E.coli(ATCC 8739),中国工业微生物菌种保藏管理中心。
1.2 仪器与设备
DSX-18L手提式高压蒸汽灭菌锅,上海申安医疗器械厂;GNP-9050恒温培养箱,上海精宏实验设备有限公司;SPH-200B恒温培养摇床,上海世平实验设备有限公司;VD-850型超净台,苏州净化设备有限公司;LW1008光学显微镜,上海测唯光电技术有限公司;FS-5荧光光谱仪,江苏艾塔科学仪器有限公司;Nikon ECLIPSE Ti-U荧光倒置显微镜,日本尼康公司;SU8010扫描电子显微镜,日本Hitachi;Microfuge 20R离心机,贝克曼库尔特;GCMS-QP2020 NX气相色谱质谱联用仪,日本岛津 Shimadzu;Evolutio 201和220紫外-可见分光光度计,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 HEO的提取
采用水蒸气蒸馏法提取HEO。将鱼腥草置于挥发油提取器的圆底烧瓶中,按1∶8的料液比(g∶mL)浸泡1 h,加热5 h,收集油层,无水硫酸钠干燥,置于棕色瓶中,4 ℃密封保存。
1.3.2 HEO的化学成分分析
采用GC-MS进行HEO成分分析。
色谱条件:色谱柱为DB-5 ms(30 m×0.25 mm×0.25 μm),载气为氦气,压力47.7 kPa,总流量101.5 mL/min,柱流量0.98 mL/min,线速度35.6 cm/s,吹扫流量3 mL/min,分流比100∶1,使用全自动进样器,进样量0.5 μL,进样温度280 ℃。柱温40 ℃保持3 min,以10 ℃/min升至280 ℃,保持5 min。
质谱条件:EI离子源,电子能量70 eV,离子源温度200 ℃,接口温度280 ℃,溶剂延迟时间1 min,扫描方式为全扫描,间隔0.3 s,质谱扫描范围为25~450 m/z,扫描速度1 666个光谱/min。采用NIST 22数据库进行相似度对比,确定挥发油成分,并按照峰面积归一化法,计算各成分相对含量。
1.3.3 HEO的抗菌活性
1.3.3.1 抑菌圈的测定
采用药敏纸片法测定抑菌圈的大小,用游标卡尺测量抑菌圈直径。每组设置3个重复。
1.3.3.2 最小抑菌浓度(minimum inhibitory concentration, MIC)和最小杀菌浓度(minimum bactericidal concentration, MBC)的测定
采用常量肉汤稀释法测定MIC和MBC。HEO、二甲基亚砜和吐温-80按8∶1∶1的体积比配制成溶液,调整菌悬液浓度为1×106CFU/mL。用二倍稀释法将挥发油溶液加入菌悬液中,37 ℃,120 r/min培养过夜。肉眼观察无菌生长的最低浓度为最低抑菌浓度,取50 μL菌液涂布在固体培养基上,无菌落生长的最低浓度为最低杀菌浓度。每组设置3个重复。
1.3.3.3 生长曲线分析
在1×106CFU/mL菌悬液中加入不同浓度的HEO,使其终浓度分别为0.1×、0.2×、0.3×、0.5×MIC,每间隔一定时间取样测OD600nm值,以无菌水做对照,绘制生长曲线。每组设置3个重复。
1.3.4 扫描电镜(scanning electron microscope,SEM)分析
在培养至对数生长期的菌液中加入不同浓度HEO,使其终浓度分别为0.2×、0.5×、1×MIC,以无菌水为对照。37 ℃,120 r/min培养2 h,离心(3 000 r/min,5 min),菌体用磷酸盐缓冲液洗涤2次,加入适量2.5%(体积分数)戊二醛,4 ℃冰箱中固定过夜。用磷酸盐缓冲液洗涤2次除去戊二醛,用乙醇(30%、50%、70%、90%和100%,体积分数)梯度脱水后,喷金,进行SEM观察。每组设置3个重复。
1.3.5 对细胞膜通透性的影响
收集对数生长期的菌体,用HEPES缓冲溶液(pH=7.2)洗涤3次并重悬,调整菌悬液OD600nm值为1.0。加入DiSC3-(5)荧光试剂(终浓度为0.4 μmol/L),避光培养2 h,离心(3 000 r/min,5 min)收集菌体,用HEPES缓冲液洗涤并重悬。加入终浓度为0.2×、0.5×、1×MIC的HEO,对照组加入无菌水,继续避光孵育1 h,用HEPES缓冲液稀释10倍,在激发波长622 nm和发射波长670 nm下测定荧光强度。每组设置3个重复。
1.3.6 对细胞膜完整性的影响
收集对数生长期的菌体,用等体积PBS缓冲液洗涤3次,重悬,调整菌液OD600nm值为1.0。加入不同浓度HEO使其终浓度为0.2×、0.5×、1×MIC,以无菌水为对照,培养1.5 h,加入PI试剂(终浓度为9 μmol/L),避光染色30 min,离心(3 000 r/min,5 min)收集菌体,加入PBS重悬。取10 μL菌液滴加在干净的载玻片上,于荧光倒置显微镜下观察,为定性分析结果。取2~3 mL菌液用荧光光谱仪在激发波长535 nm和发射波长615 nm条件下测定荧光强度,为定量分析结果。每组设置3个重复。
1.3.7 细胞内核酸和蛋白质的泄露分析
参考VARTIKA等[7]相关研究,并稍作修改。收集对数生长期的菌液,用PBS洗涤并重悬,调整菌悬液OD600nm值为1.0。加入不同浓度HEO使其终浓度为0.1×、0.3×、0.5×、1×MIC,对照组不作处理。避光培养4 h,离心(4 ℃,9 300 r/min,15 min),收集上清液。测定260 nm和280 nm下的吸收值。每组设置3个重复。
1.3.8 活性氧(reactive oxygen species,ROS)含量分析
收集对数生长期的菌体,用PBS洗涤并重悬,加入不同浓度的HEO使其终浓度为0.1×、0.3×、0.5×、1×MIC,37 ℃培养1 h,加入0.02 mmol/L DCFH-DA避光孵育0.5 h,用荧光光谱仪在激发波长485 nm和发射波长528 nm条件下测定荧光强度[8]。每组设置3个重复。
1.4 数据处理
1.4.1 网络分析
HEO成分靶标通过TTD(https://db.idrblab.net/ttd/)、DrugBank(https://go.drugbank.com/)、TCMSP(https://tcmsp-e.com/tcmsp.php)、SwissTargetPrediction(http://swisstargetprediction.ch/)和GeneCards(https://www.genecards.org/)数据库查询,抗菌靶标通过TTD(https://db.idrblab.net/ttd/)、DrugBank(https://go.drugbank.com/)、OMIM(https://www.omim.org)、DisGeNET(https://www.disgenet.org)、NCBI(https://www.ncbi.nlm.nih.gov/)、PharmGKB(https://www.pharmgkb.org/)和GeneCards(http://www.genecards.org)数据库查询,并结合文献进行补充[9]。使用UniProt数据库将查询到的靶点信息进行归一化处理和统一命名,然后将二者取交集。将交集靶点上传到STRING数据库,设定最低互相作用评分条件为0.400,建立PPI网络图,使用Cytoscape 3.9.1软件进行可视化处理。将上述交集靶点导入DAVID数据库,进行包括生物过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)在内的Gene Ontology(GO)富集分析和Kyoto Encyclopedia of Genes and Genomes(KEGG)通路分析[P<0.05,错误发现率(false discovery rate,FDR)<0.05],以count值进行筛选排序。最后将有效成分,主要靶点和通路构建“HEO成分-靶点-信号通路”网络图[10]。
1.4.2 贪心算法
贪心算法又叫贪婪算法,是能够得到某种度量意义下的最优解的分级处理方法。利用贪心算法的原理可以计算能完全覆盖HEO和E.coli相关靶标的生物活性成分的最小集合,该算法用R语言(4.3.3)执行,输入成分和靶点对应表可获得最小成分覆盖集合[11-12]。
2 结果与分析
2.1 HEO的化学成分
将HEO进行GC-MS分析,根据NIST数据库和Kovats保留指数,共鉴定出41种化合物,占总离子峰的88.33%。其主要成分有蒎烯(α-pinene,18.26%)、芳樟醇(linalool,12.13%)、α-花柏烯(α-chamigrene,7.05%)、茴香脑(cis-anethol,6.85%)、黄樟素(safrole,4.33%)、樟脑((+)-camphor,3.44%)、桉叶油醇(cineole,2.51%)、α-芹子烯(α-selinine,3.59%)等,如图1、表1所示。
表1 鱼腥草挥发油的化学成分
Table 1 Chemical composition of HEO
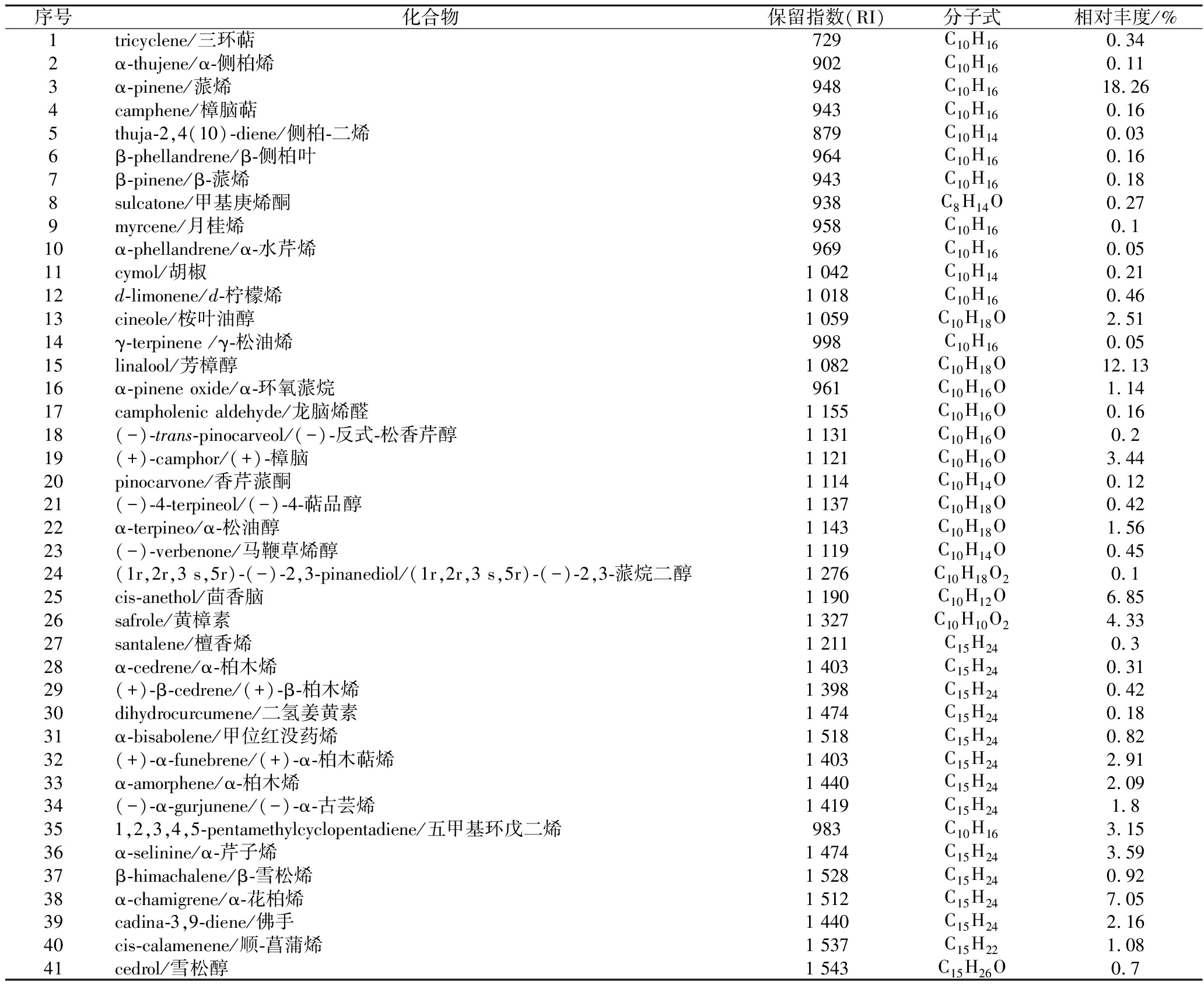
序号化合物保留指数(RI)分子式相对丰度/%1tricyclene/三环萜729C10H160.342α-thujene/α-侧柏烯902C10H160.113α-pinene/蒎烯948C10H1618.264camphene/樟脑萜943C10H160.165thuja-2,4(10)-diene/侧柏-二烯879C10H140.036β-phellandrene/β-侧柏叶964C10H160.167β-pinene/β-蒎烯943C10H160.188sulcatone/甲基庚烯酮938C8H14O0.279myrcene/月桂烯958C10H160.110α-phellandrene/α-水芹烯969C10H160.0511cymol/胡椒1 042C10H140.2112d-limonene/d-柠檬烯1 018C10H160.4613cineole/桉叶油醇1 059C10H18O2.5114γ-terpinene /γ-松油烯998C10H160.0515linalool/芳樟醇1 082C10H18O12.1316α-pinene oxide/α-环氧蒎烷961C10H16O1.1417campholenic aldehyde/龙脑烯醛1 155C10H16O0.1618(-)-trans-pinocarveol/(-)-反式-松香芹醇1 131C10H16O0.219(+)-camphor/(+)-樟脑1 121C10H16O3.4420pinocarvone/香芹蒎酮1 114C10H14O0.1221(-)-4-terpineol/(-)-4-萜品醇1 137C10H18O0.4222α-terpineo/α-松油醇1 143C10H18O1.5623(-)-verbenone/马鞭草烯醇1 119C10H14O0.4524(1r,2r,3 s,5r)-(-)-2,3-pinanediol/(1r,2r,3 s,5r)-(-)-2,3-蒎烷二醇1 276C10H18O20.125cis-anethol/茴香脑1 190C10H12O6.8526safrole/黄樟素1 327C10H10O24.3327santalene/檀香烯1 211C15H240.328α-cedrene/α-柏木烯1 403C15H240.3129(+)-β-cedrene/(+)-β-柏木烯1 398C15H240.4230dihydrocurcumene/二氢姜黄素1 474C15H240.1831α-bisabolene/甲位红没药烯1 518C15H240.8232(+)-α-funebrene/(+)-α-柏木萜烯1 403C15H242.9133α-amorphene/α-柏木烯1 440C15H242.0934(-)-α-gurjunene/(-)-α-古芸烯1 419C15H241.8351,2,3,4,5-pentamethylcyclopentadiene/五甲基环戊二烯983C10H163.1536α-selinine/α-芹子烯1 474C15H243.5937β-himachalene/β-雪松烯1 528C15H240.9238α-chamigrene/α-花柏烯1 512C15H247.0539cadina-3,9-diene/佛手1 440C15H242.1640cis-calamenene/顺-菖蒲烯1 537C15H221.0841cedrol/雪松醇1 543C15H26O0.7
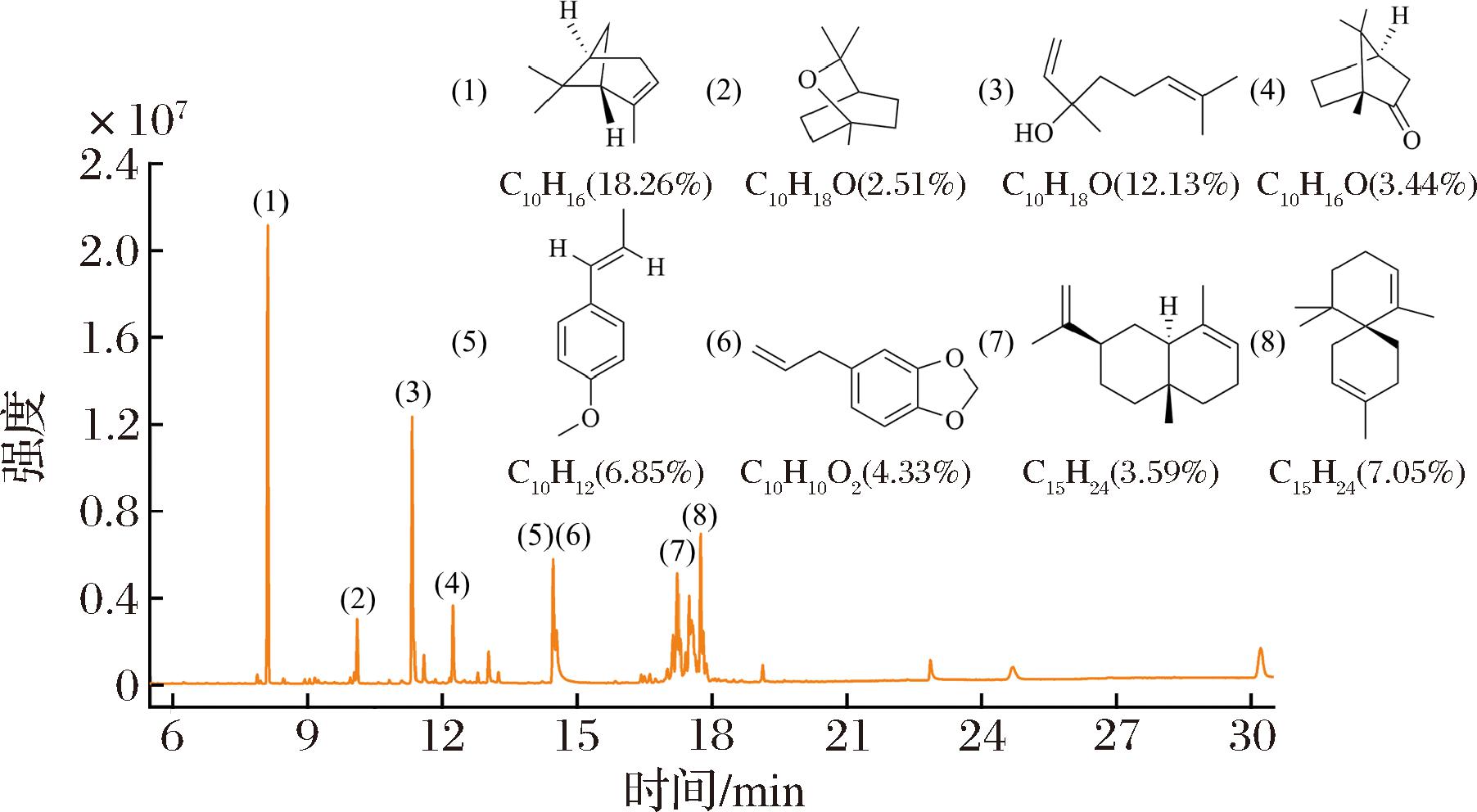
图1 鱼腥草挥发油的GC-MS总离子流色谱图
Fig.1 Total ion flow chromatogram of HEO by GC-MS
2.2 HEO对E.coli的抑菌活性
HEO抗E.coli的抑菌圈直径为(12.93±0.61) mm,根据K-B法的标准进行判断,E.coli对HEO表现为中度敏感,MIC和MBC分别为5.3 mg/mL和7.1 mg/mL。HEO对E.coli生长曲线的影响如图2所示,随着HEO浓度的增加,菌体的生长受到不同程度的影响。与对照组比,当HEO浓度达到0.2 MIC时,E.coli的延滞期明显增长,对数期受到明显限制,表明HEO对E.coli有较好的抑制作用。
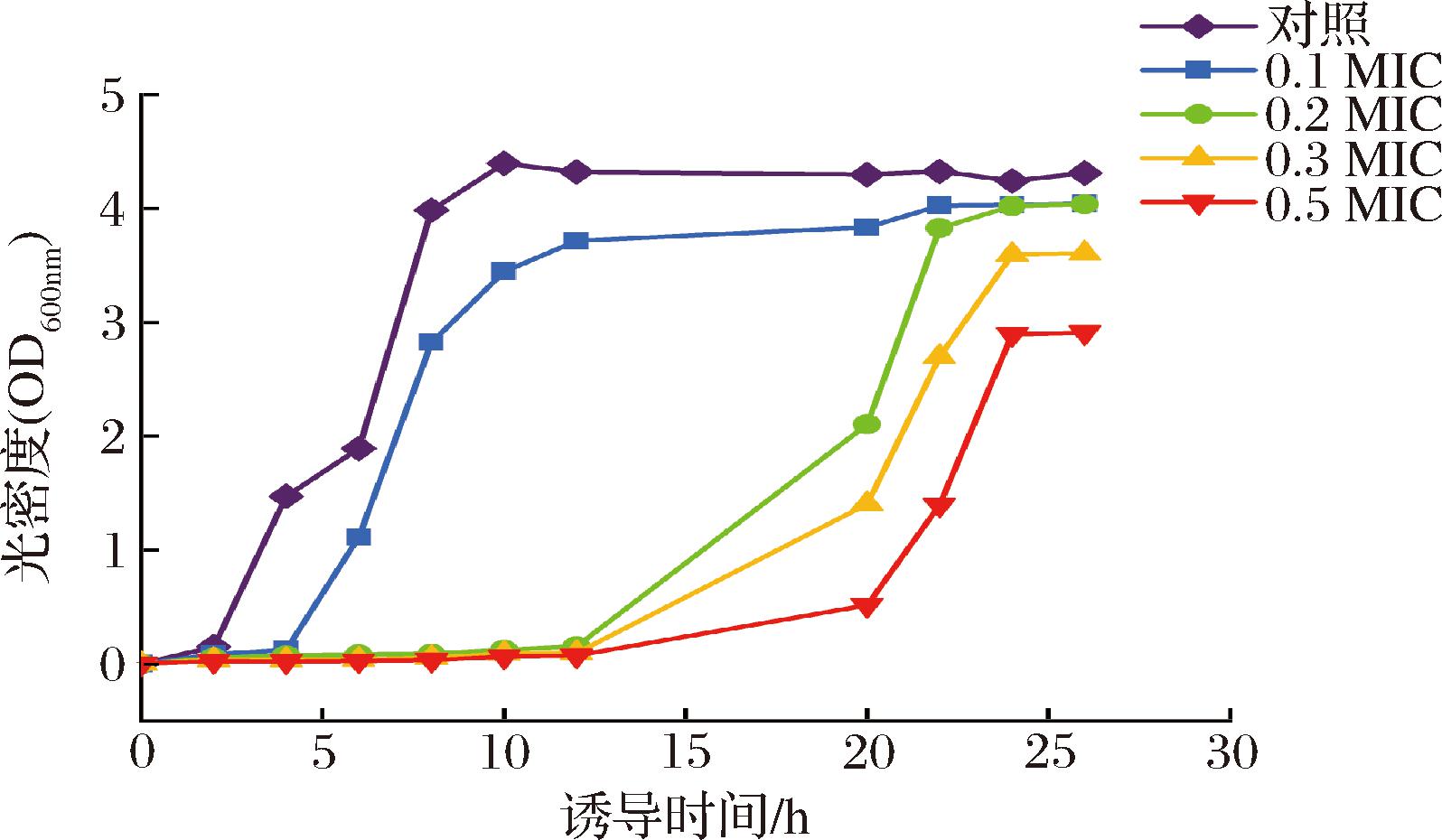
图2 不同浓度HEO对E.coli生长的影响
Fig.2 Effects of different concentrations of HEO on the growth of E.coli
2.3 HEO对E.coli细胞形态的影响
如图3所示,未经HEO处理的对照组菌体表面光滑,拥有完整的结构和饱满的形态。当加入0.2 MIC HEO处理时,可以观察到部分E.coli菌体开始呈现轻微的凹陷和褶皱,说明HEO开始对菌体产生影响。当HEO浓度进一步提高至0.5 MIC和1 MIC时,可以观察到E.coli菌体开始明显的萎缩和褶皱,菌体出现破裂,凹陷,并有内容物流出。E.coli属于革兰氏阴性细菌,具有双层细胞包膜和一系列外排泵,是抗菌剂渗透的强大屏障[13],本研究发现,随着HEO浓度增大,E.coli菌体表面形态被破坏程度越严重,说明保护屏障被破坏。
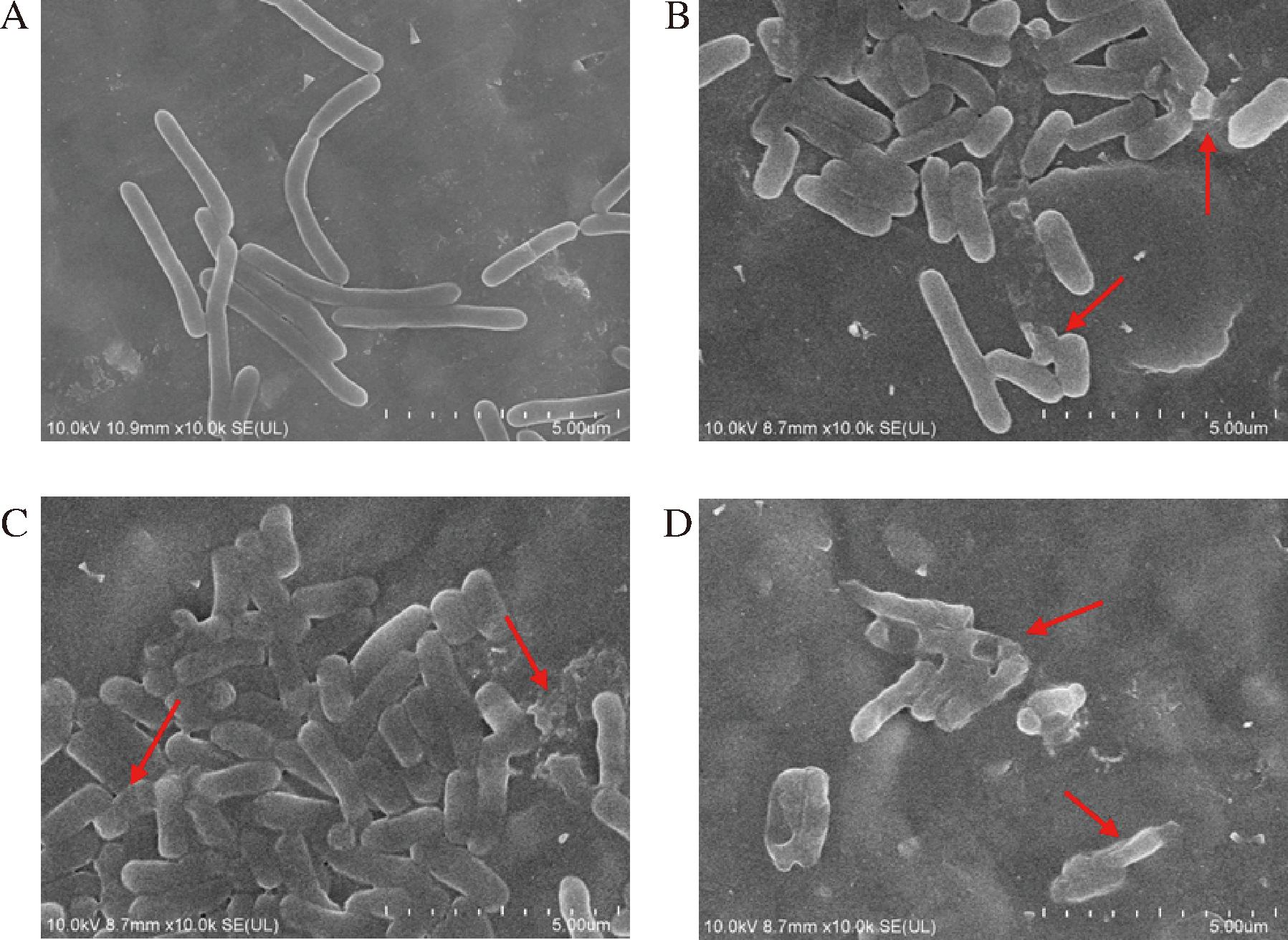
A-对照;B-0.2 MIC;C-0.5 MIC;D-1 MIC
图3 不同浓度HEO对E.coli细胞形态的影响
Fig.3 Effects of different concentrations of HEO on the cellular morphology of E.coli
2.4 HEO对E.coli细胞膜通透性的影响
荧光试剂DiSC3-(5) 具有较长的亲脂烃链,可以稳定地与细胞膜上的脂质分子结合,由于聚集发生荧光淬灭,荧光强度很低,当细胞膜通透性增加时,荧光试剂可被释放到细胞外,导致荧光强度增加[14]。不同浓度HEO处理E.coli后荧光变化如图4所示。与对照组相比,随着HEO浓度增大,荧光强度逐步增强,表明HEO对E.coli的细胞膜造成了破坏,引起荧光试剂释放。以往研究表明,细胞膜是天然抗菌剂的作用靶点,五味子通过破坏细胞膜,导致酶和蛋白质泄露,从而影响能力代谢而发挥抗菌作用[15]。
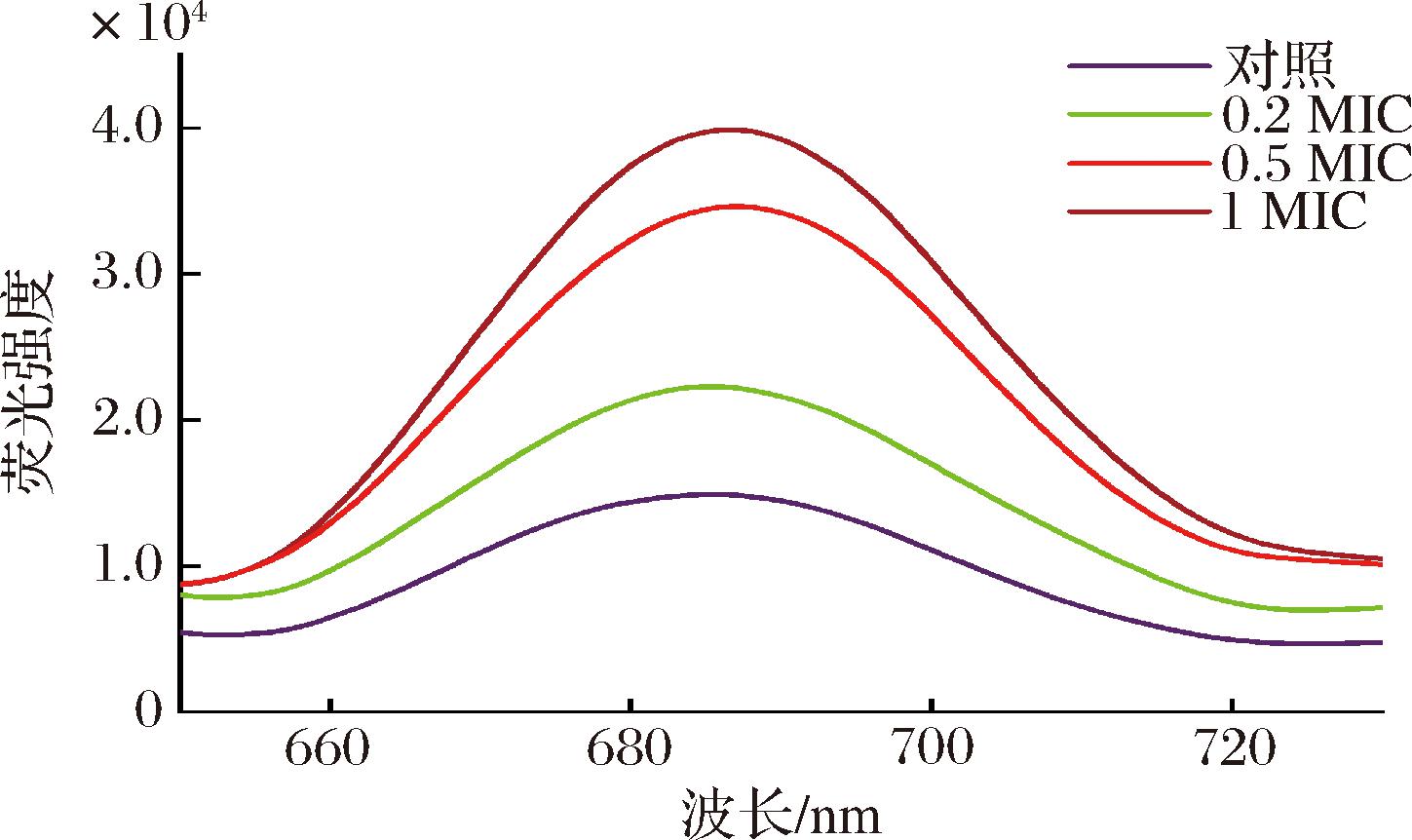
图4 不同浓度HEO对E.coli细胞膜通透性的影响
Fig.4 Effects of different concentrations of HEO on membrane permeability of E.coli
2.5 HEO对E.coli细胞膜完整性的影响
PI是一种常见的荧光染料,它不能穿过正常细胞膜,但可以穿过受损的细胞膜与细胞内核酸结合[16],常用来检测天然抗菌剂对细菌细胞膜破坏情况[17]。由图5-A~图5-D可知,未经HEO处理的对照组,没有检测到荧光,当加入不同浓度HEO处理后,开始检测到红色荧光,且随着HEO浓度的增大,红色荧光逐渐变强。从定量分析结果(图5-E)同样可以看出,随着HEO浓度的增大,荧光强度也在增加。说明HEO干预后,菌体细胞膜完整性受到破坏。
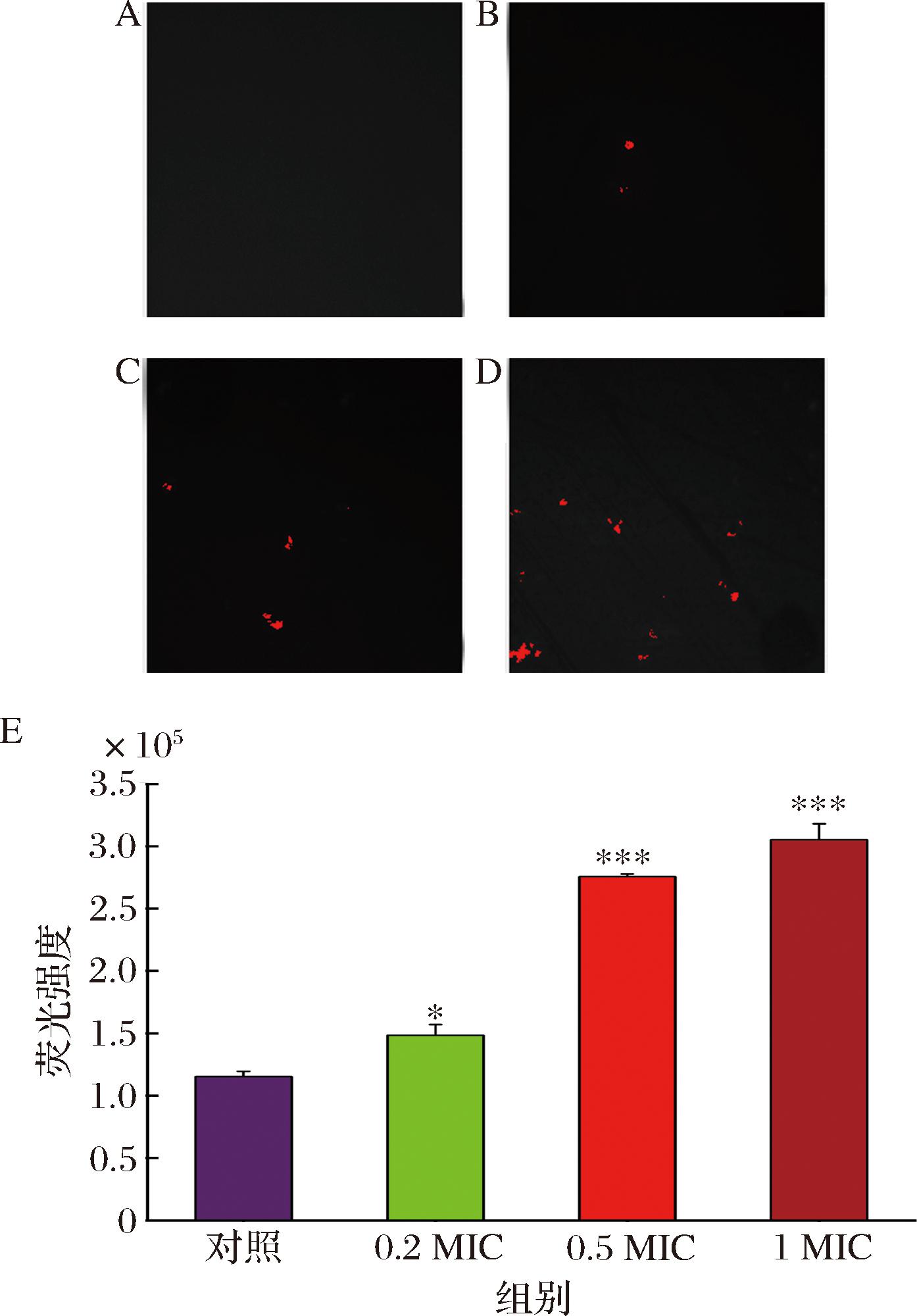
A~D-不同浓度HEO对E.coli细胞膜完整性的定性分析(A:对照;B:0.2 MIC;C:0.5 MIC;D:1 MIC);E-定量分析
图5 不同浓度HEO对E.coli细胞膜完整性的定性和定量分析
Fig.5 Qualitative analysis and quantitative analysis of membrane integrity of E.coli with different concentrations of HEO
注:数据以3次重复(n=3)的“平均值±标准差”表示,与对照组相比*P<0.05,***P<0.001(下同)。
2.6 HEO E.coli细胞内核酸和蛋白质泄漏的变化
细菌细胞膜由磷脂双分子层和嵌入的蛋白质组成,它将细胞内部与外部环境分开,维持一个相对稳定的内环境。当细胞膜受损时,胞内物质会向外泄漏[18]。260 nm和280 nm处的紫外吸收强度与核酸和蛋白质的浓度呈正比,因此可通过测定其吸光度来分析菌体细胞膜完整性的变化[19]。HEO引起E.coli细胞内核酸和蛋白质泄漏的变化如图6所示,与对照组相比,低浓度HEO处理组泄漏不太明显,说明细胞膜完整性未受到明显损害,当浓度达到1 MIC时,泄漏量急剧增加,说明细胞膜完整性被严重破坏,导致细胞内容物流出,从而引起菌体凋亡。
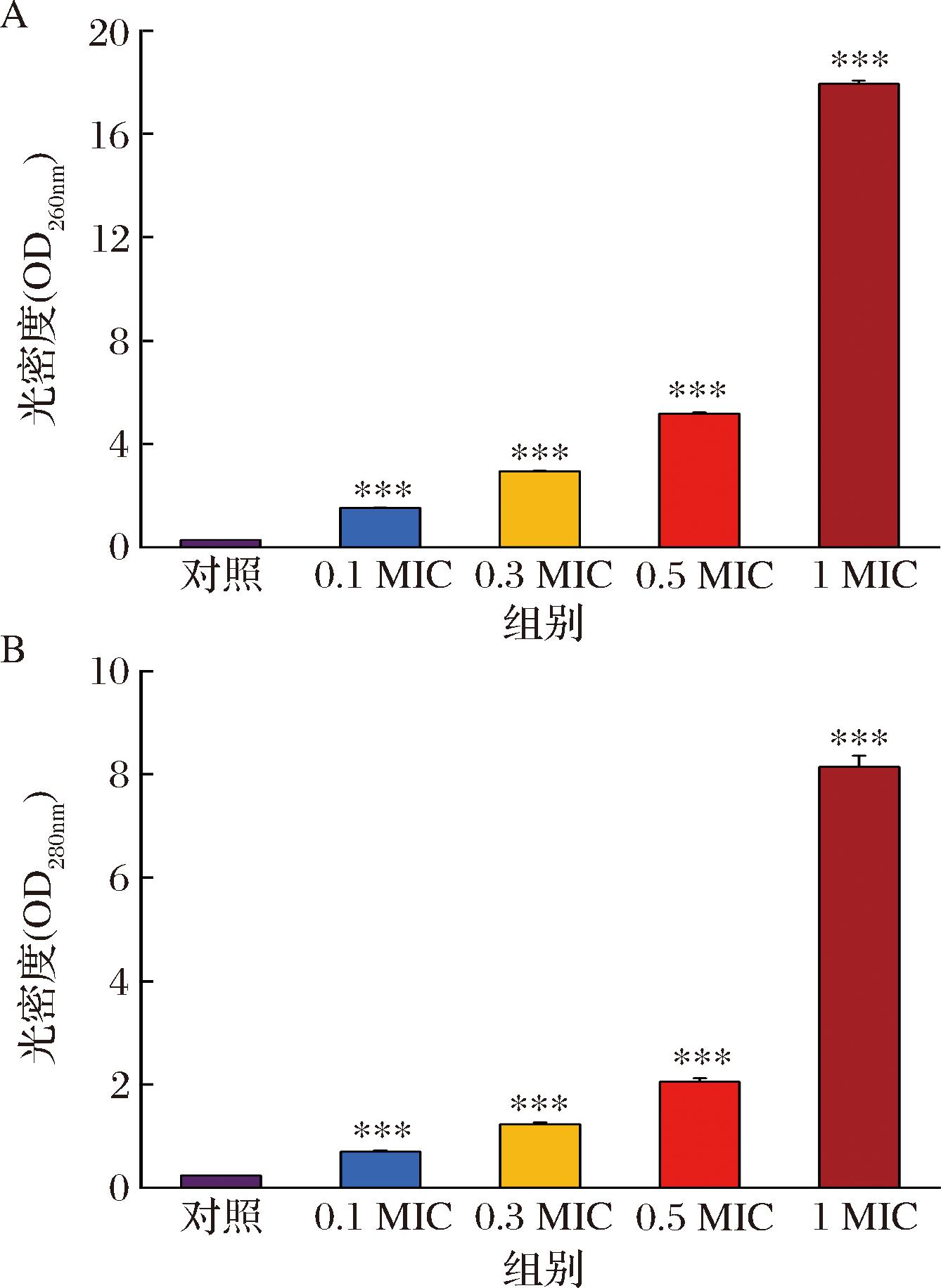
A-260 nm;B-280 nm
图6 不同浓度HEO对E.coli胞内核酸和蛋白质泄漏的影响
Fig.6 Effects of different concentrations of HEO on the release of intracellular nucleic acids and proteins in E.coli
2.7 HEO对E.coli细胞内ROS的影响
DCFH-DA是一种非荧光的、可穿透细胞的染料,在细胞酯酶的作用下在细胞内水解成2’,7’-二氯二氢荧光素,2’,7’-二氯二氢荧光素在细胞内被ROS氧化形成具有荧光强度的2’,7’-二氯荧光素[20]。由图7可知,与对照组相比,随着HEO浓度增加,菌体内ROS含量逐渐降低。
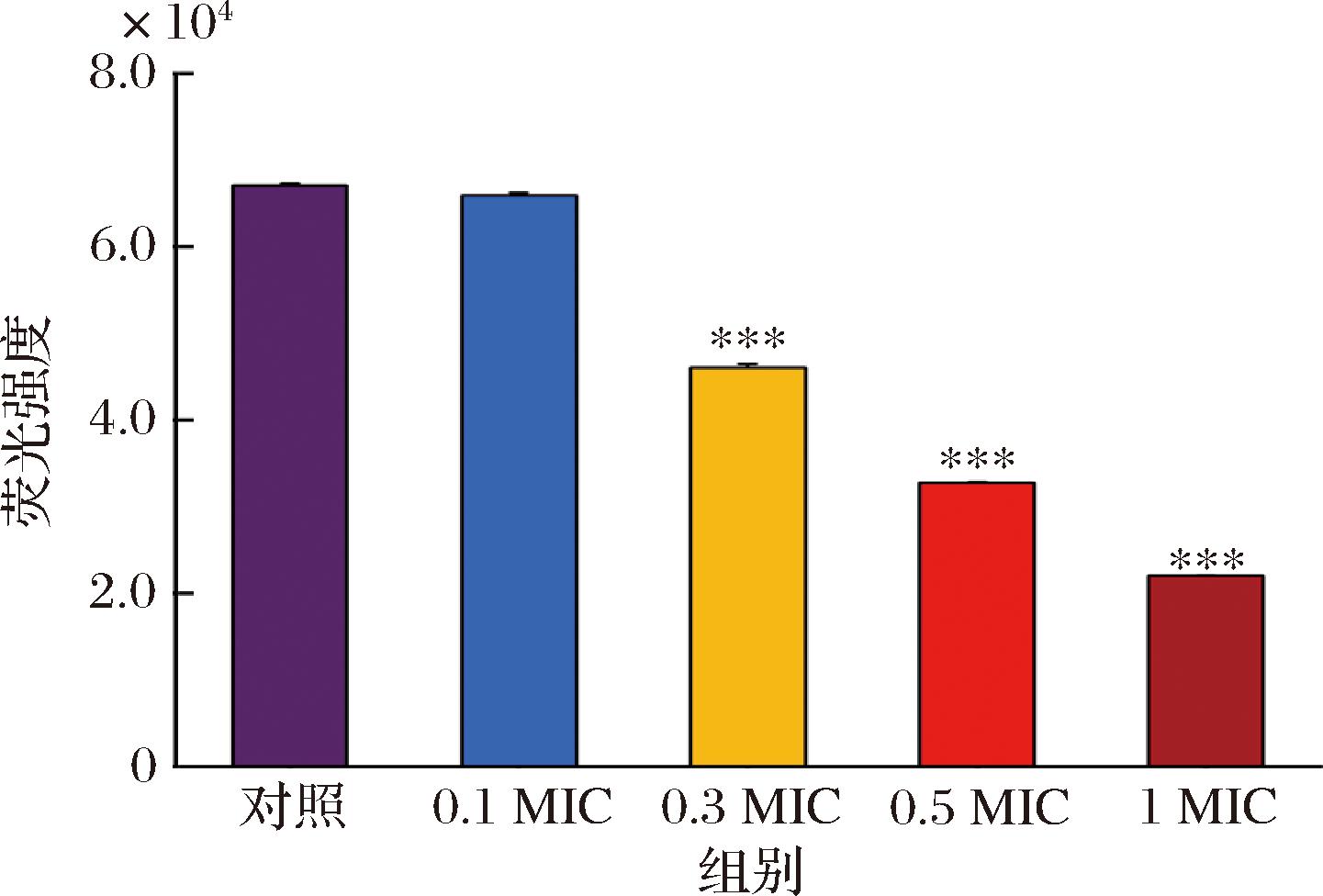
图7 不同浓度HEO对E.coli细胞内ROS的影响
Fig.7 Effects of different concentrations of HEO on intracellular ROS in E.coli
2.8 网络分析
从公共数据库分别获取了HEO化学成分和E.coli对应的靶点563和188个。将两者共有的86个靶点(图8-A)导入STRING数据库,构建HEO抗E.coli潜在作用靶标互作网络图。该网络含有84个节点、646条边,平均degree值为15.4。其中,degree值TOP10的核心靶点有TNF、PTGS2、CYP1A2、TLR4、IL1B、MAOB、PARP1、TNFRSF1A、PTGES和SOD1(图8-B)。CYP1A2是与细胞膜相关的蛋白[21],PARP1在细胞膜的修复中起着重要的作用[22],抑制PARP1会加速膜损伤,表明细胞膜是其潜在抗菌靶点。
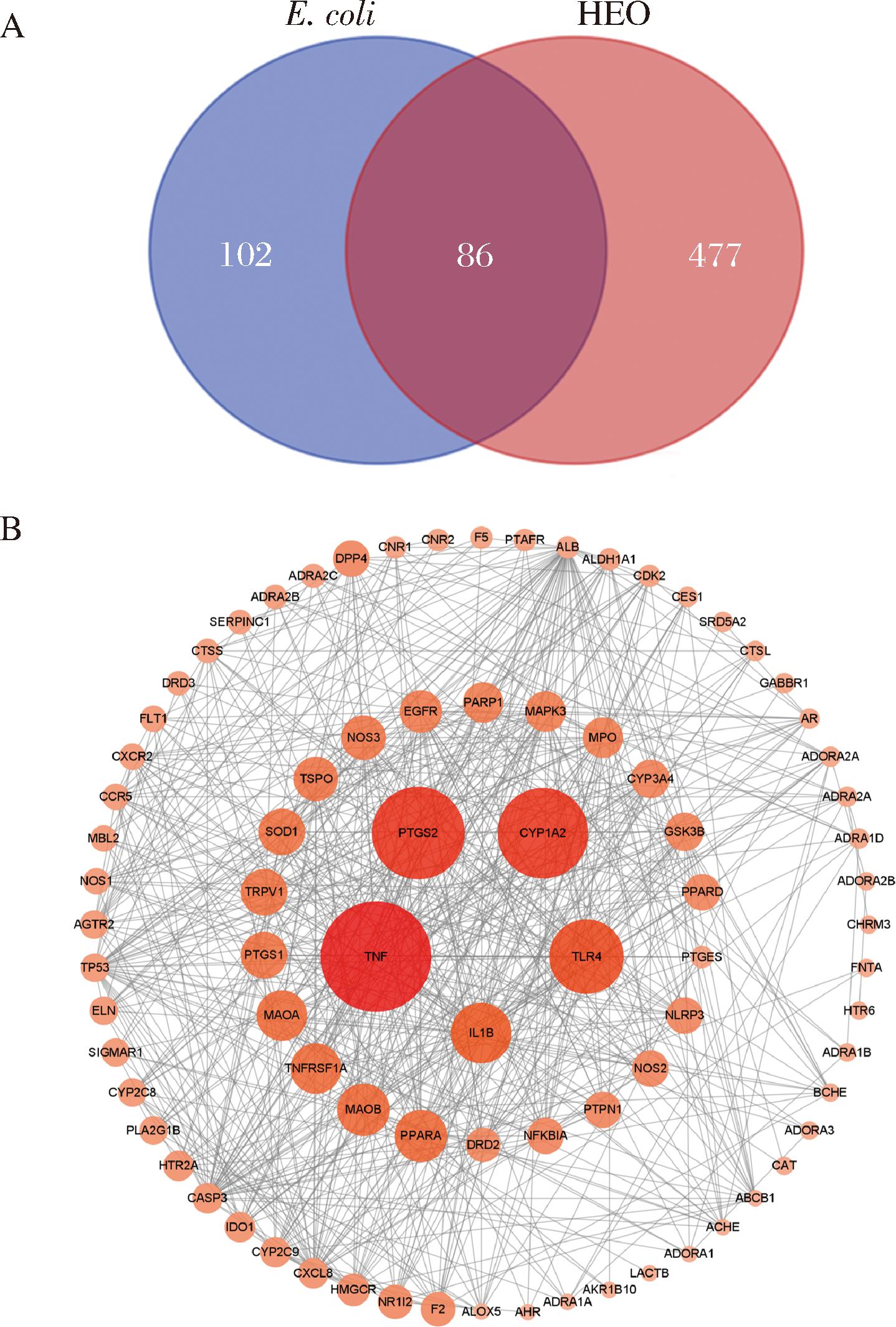

A-HEO化学成分与E.coli靶点的映射分析;B-关键靶标的互作网络;C-基因本体(GO)功能和KEGG通路富集分析;D-成分-靶标-通路互作网络
图8 网络分析结果
Fig.8 Network analysis results
对这些关键靶标进行GO功能富集分析和KEGG通路富集分析,获得生物过程主要包括炎症反应、细胞增殖、氧化应激、脂质分解代谢等。细胞成分主要涉及质膜、细胞外区、细胞表面等。分子功能方面主要涉及蛋白质结合,G蛋白偶联受体和酶等的结合。KEGG通路富集分析主要包括花生四烯酸代谢、MAPK信号通路、鞘磷脂信号通路、细胞凋亡、IL-17信号通路、TNF信号通路等(P<0.05,FDR<0.05)(图8-C)。进一步构建HEO成分-靶点-通路相互作用网络,该网络含有162个节点、651条边。其中红色圆形代表HEO的成分,绿色菱形代表对应的靶点,蓝色正方形代表对应的信号通路(图8-D)。
2.9 抗菌活性成分
通过贪心算法,得到HEO抑菌的关键成分包括芳樟醇、茴香脑、黄樟素、樟脑和桉叶油醇,这些成分与关键靶点PTGS2、CYP1A2、MAOB、PARP1、ACHE、AR、DRD2、IDO1、MAOA、TRPV1的对应关系如图9所示。芳樟醇具有广泛的抗菌性能,是潜在的食品防腐剂,它可以破坏细胞正常形态、降低膜电位,引起碱性磷酸酶、核酸和蛋白质的释放,表明它是通过破坏细胞膜发挥抗菌作用[23-24]。茴香脑可提高莫匹罗星对耐药金黄色葡萄球菌的抗菌活性,将其应用到有机蔬菜的包装材料中,可改善蔬菜新鲜度[25-26]。樟脑能明显抑制白色念珠菌菌丝生长,减少生物膜的形成。黄樟素和桉叶油醇也是潜在的抗菌活性物质[27-28]。
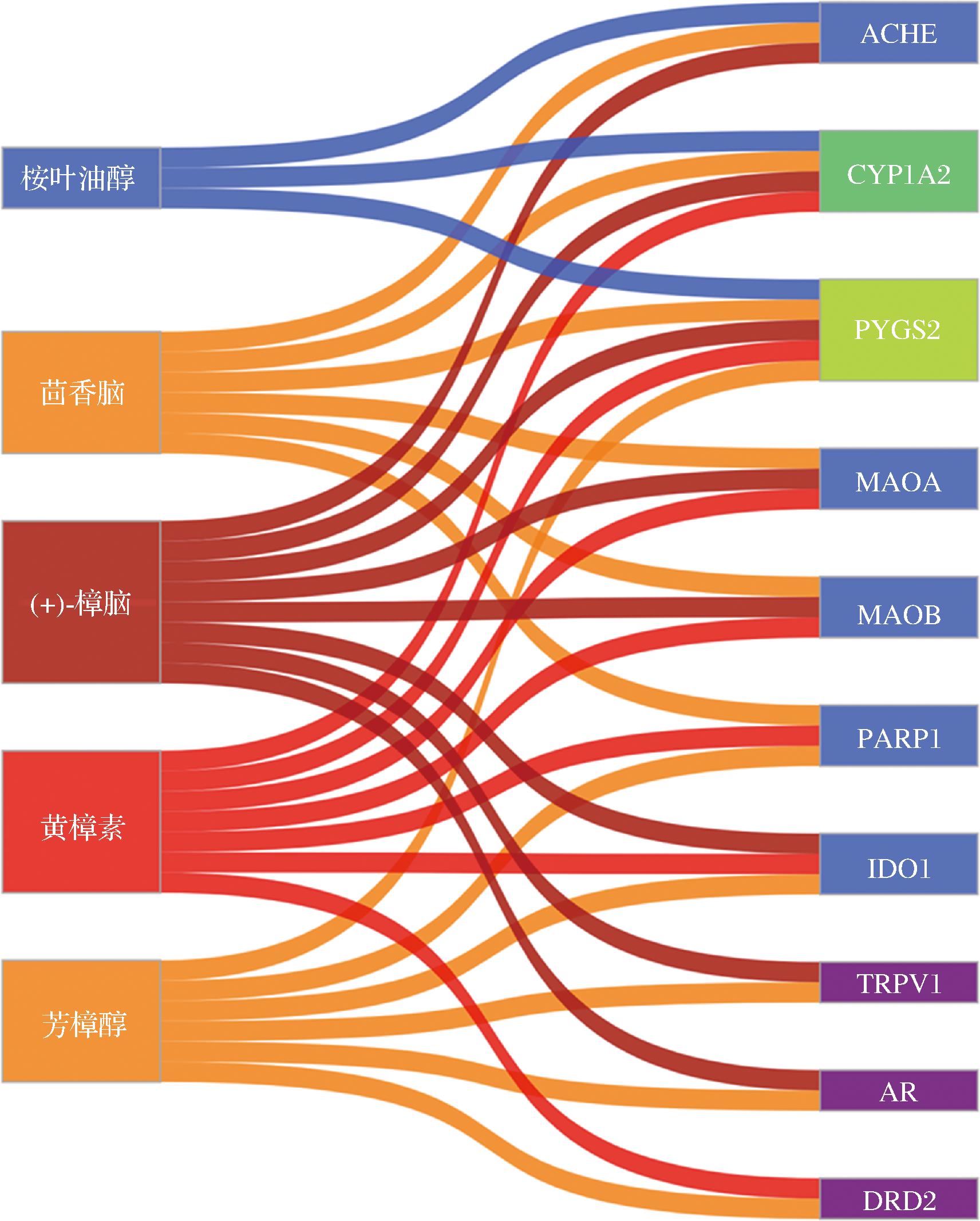
图9 HEO抗E.coli的潜在活性成分及靶标
Fig.9 Possible active ingredients and targets of HEO against E.coli
3 结论与讨论
本文对HEO体外抗E.coli的活性成分和抗菌机理进行了研究。结果表明HEO对E.coli生长有显著抑制作用,可破坏E.coli正常形态、细胞膜完整性和通透性,导致胞内蛋白质和核酸泄露增加,ROS含量下降。整合网络分析和贪心算法,发现HEO抗E.coli的关键成分是芳樟醇、茴香脑、黄樟素、樟脑和桉叶油醇,涉及的关键靶点是PTGS2、CYP1A2、MAOB、PARP1、ACHE、AR、DRD2、IDO1、MAOA、TRPV1。研究结果为HEO在天然保鲜剂领域的应用提供了理论依据。
[1] LI H R, ZHU J J.Targeted metabolic profiling rapidly differentiates Escherichia coli and Staphylococcus aureus at species and strain level [J].Rapid Communications in Mass Spectrometry, 2017, 31(19):1669-1676.
[2] YANG S C, LIN C H, ALJUFFALI I A, et al.Current pathogenic Escherichia coli foodborne outbreak cases and therapy development [J].Archives of Microbiology, 2017, 199(6):811-825.
[3] ![]() K, BAJER T, SILHA D, et al.Chemical composition and determination of the antibacterial activity of essential oils in liquid and vapor phases extracted from two different Southeast Asian herbs:Houttuynia cordata (Saururaceae) and Persicaria odorata (Polygonaceae) [J].Molecules, 2020, 25(10):2432.
K, BAJER T, SILHA D, et al.Chemical composition and determination of the antibacterial activity of essential oils in liquid and vapor phases extracted from two different Southeast Asian herbs:Houttuynia cordata (Saururaceae) and Persicaria odorata (Polygonaceae) [J].Molecules, 2020, 25(10):2432.
[4] LU H M, WU X J, LIANG Y Z, et al.Variation in chemical composition and antibacterial activities of essential oils from two species of Houttuynia THUNB [J].Chemical and Pharmaceutical Bulletin, 2006, 54(7):936-940.
[5] RAFIQ S, HAO H H, IJAZ M, et al.Pharmacological effects of Houttuynia cordata Thunb (H.cordata):A comprehensive review [J].Pharmaceuticals, 2022, 15(9):1079.
[6] XU Z H, WU J Y, DAI S, et al.Antimicrobial activity of combined essential oils of Origanum vulgare L.and Houttuynia cordata T.against Salmonella enteritidis and Salmonella Paratyphi β [J].Journal of Food Processing and Preservation, 2022, 46(4):e16472.
[7] VARTIKA, CHAUDHARY M, BHAGYAWANT S S, et al.Effects of prednisolone derivative and panaxydol:Biosurfactants on cell wall integrity of acne-causing resistant bacteria [J].Cell Biochemistry and Biophysics, 2022, 80(1):229-243.
[8] TANG C L, CHEN J L, ZHOU Y, et al.Exploring antimicrobial mechanism of essential oil of Amomum villosum Lour through metabolomics based on gas chromatography-mass spectrometry in methicillin-resistant Staphylococcus aureus [J].Microbiological Research, 2021, 242:126608.
[9] XU N, DU L H, CHEN Y C, et al.Lonicera japonica Thunb.as a promising antibacterial agent for Bacillus cereus ATCC14579 based on network pharmacology, metabolomics, and in vitro experiments [J].RSC Advances, 2023, 13(23):15379-15390.
[10] DUAN Z L, WANG Y J, LU Z H, et al.Wumei Wan attenuates angiogenesis and inflammation by modulating RAGE signaling pathway in IBD:Network pharmacology analysis and experimental evidence [J].Phytomedicine, 2023, 111:154658.
[11] HUANG J S, ZHAO L J, SUN J J, et al.Clinical evidence and potential mechanisms of complementary treatment of Ling Gui Zhu Gan formula for the management of serum lipids and obesity [J].Evidence-Based Complementary and Alternative Medicine, 2022, 2022(1):7714034.
[12] GU K R, FENG S Y, ZHANG X Y, et al.Deciphering the antifungal mechanism and functional components of Cinnamomum cassia essential oil against Candida albicans through integration of network-based metabolomics and pharmacology, the greedy algorithm, and molecular docking [J].Journal of Ethnopharmacology, 2024, 319:117156.
[13] PANDEYA A, OJO I, ALEGUN O, et al.Periplasmic targets for the development of effective antimicrobials against gram-negative bacteria [J].ACS Infectious Diseases, 2020, 6(9):2337-2354.
[14] HE F, WANG W, WU M C, et al.Antioxidant and antibacterial activities of essential oil from Atractylodes lancea rhizomes [J].Industrial Crops and Products, 2020, 153:112552.
[15] CUI S M, LI T, WANG Q, et al.Antibacterial effects of Schisandra chinensis extract on Escherichia coli and its applications in cosmetic [J].Current Microbiology, 2020, 77(5):865-874.
[16] ZHANG N, FAN Y X, LI C, et al.Cell permeability and nuclear DNA staining by propidium iodide in basidiomycetous yeasts [J].Applied Microbiology and Biotechnology, 2018, 102(9):4183-4191.
[17] 李敏宇, 李恋, 李汇, 等.源自副干酪乳杆菌ALAC-4的抗真菌肽APT对粘红酵母细胞抑制作用的初步研究[J].食品与发酵工业, 2025,51(7):25-31.LI M Y, LI L, LI H, et al.Preliminary study on inhibitory effect of antifungal peptide APT derived from Lactobacillus paracasei ALAC-4 on Rhodotorula glutinis[J].Food and Fermentation Industries, 2025,51(7):25-31.
[18] YUE Y X, ZHONG K, WU Y P, et al.Insight into the antibacterial activity and membrane-damage mechanism of pyrrole-2-carboxylic acid against Listeria monocytogenes [J].LWT, 2023, 184:114999.
[19] SHAN M Y, MENG F Q, ZHOU L B, et al.Surfactin inhibits the growth of Propionibacterium acnes by destroying the cell wall and membrane [J].Letters in Applied Microbiology, 2021, 73(6):684-693.
[20] 李连彬. 菌丝霉素源抗菌肽对金黄色葡萄球菌乳腺炎的防治及其耐药产生机制的研究 [D].杨凌:西北农林科技大学.2018.LI L B. Study on the prevention and treatment of Staphylococcus aureus mastitis by antibacterial peptides derived from hyphomycins and the mechanism of drug resistance[D]. Yangling: Northwest A &F University, 2018.
[21] PARK J W, REED J R, BACKES W L.The localization of cytochrome P450 s CYP1A1 and CYP1A2 into different lipid microdomains is governed by their N-terminal and internal protein regions [J].Journal of Biological Chemistry, 2015, 290(49):29449-29460.
[22] MASHIMO M, KITA M, NOBEYAMA A, et al.PARP1 is activated by membrane damage and is involved in membrane repair through poly(ADP-ribosyl)ation [J].Genes to Cells, 2022, 27(4):305-312.
[23] GUO F Y, LIANG Q, ZHANG M, et al.Antibacterial activity and mechanism of linalool against Shewanella putrefaciens [J].Molecules, 2021, 26(1):245.
[24] LIU X, CAI J X, CHEN H M, et al.Antibacterial activity and mechanism of linalool against Pseudomonas aeruginosa [J].Microbial Pathogenesis, 2020, 141:103980.
[25] ![]() J, CAVOSKI I.Antimicrobial, antioxidant and sensory features of eugenol, carvacrol and trans-anethole in active packaging for organic ready-to-eat iceberg lettuce [J].Food Chemistry, 2018, 259:251-260.
J, CAVOSKI I.Antimicrobial, antioxidant and sensory features of eugenol, carvacrol and trans-anethole in active packaging for organic ready-to-eat iceberg lettuce [J].Food Chemistry, 2018, 259:251-260.
[26] KWIATKOWSKI P, GRYGORCEWICZ B, PRUSS A, et al.The effect of subinhibitory concentrations of trans-anethole on antibacterial and antibiofilm activity of mupirocin against mupirocin-resistant Staphylococcus aureus strains [J].Microbial Drug Resistance, 2019, 25(10):1424-1429.
[27] EID A M, HAWASH M.Biological evaluation of safrole oil and safrole oil nanoemulgel as antioxidant, antidiabetic, antibacterial, antifungal and anticancer [J].BMC Complementary Medicine and Therapies, 2021, 21(1):159.
[28] TINE Y, DIALLO A, DIOP A, et al. The essential oil of Eucalyptus alba L. growing on the salt zone of fatick (Senegal) as a source of 1,8-Cineole and their antibacterial activity [J].Journal of Drug Delivery and Therapeutics, 2020, 10(1-s):140-143.