黄酒作为中国传统的酒类之一,历史悠久,文化底蕴深厚。其独特的酿造工艺和风味特征,使其在国内外享有较高的声誉[1]。黄酒是以米、麦等为原料,在开放式的环境下通过酵母、乳酸菌和霉菌等菌种混合酿造而成,其风味不仅受酿造原料、发酵工艺等因素的影响,还与微生物群落的变化密切相关[2-5]。近年来,随着对微生物群体作用机制的深入研究,利用特定微生物菌种调控黄酒发酵过程中的风味组分成为提升黄酒品质和特色的重要途径。
大量研究表明,乳酸菌是黄酒酿造过程中的优势菌属,对黄酒感官品质及风味物质合成具有重要作用[6-9]。融合魏斯氏菌(Weissella confusa)是一类广泛存在于发酵食品中的乳酸菌,具有很强的耐酸性和发酵能力,也是黄酒酿造过程中的优势乳酸菌[10-11]。融合魏斯氏菌作为一种具有重要功能的发酵微生物,已经在多种发酵食品中展现出了显著的作用,包括酸奶、泡菜、酱油以及酒类等[12-15]。融合魏斯氏菌不仅能在发酵过程中产生乳酸,还能够促进其他发酵产物的生成,如醇、酯、酸等风味物质,这些产物对黄酒的风味特征有着重要的影响。此外,魏斯氏菌可能通过产有机酸、抗菌物质等,抑制发酵环境中不良微生物的生长,从而促进有益菌群的优势地位。例如,魏斯氏菌在发酵初期可能通过快速发酵糖类提高环境的酸度,抑制杂菌的生长;在后期则通过调节酸度和产生一些风味物质,促进发酵的顺利进行。可见,将融合魏斯氏菌应用于黄酒酿造不仅有望提高产品风味品质,还可提升发酵稳定性和效率。
在黄酒的发酵过程中,融合魏斯氏菌的丰度随理化环境因子改变而发生动态变化[11]。在投料初期,黄酒酿造环境中营养丰富,且乳酸菌受到的环境胁迫较小,有利于乳酸菌占据主导地位;在酒精发酵阶段,酵母发酵糖分产生大量乙醇,易对乳酸菌生长产生一定的胁迫作用;而在后酵阶段,环境中糖原几乎被消耗殆尽,其中更高含量乙醇的压力会对乳酸菌造成更强的生长胁迫[16-18]。因此,合理的接种时序才能确保融合魏斯氏菌在适宜的发酵阶段发挥最大效能,增强其对风味物质合成代谢的调控作用。通过研究融合魏斯氏菌接种时序对黄酒酿造特性及关键特征风味组分的影响,能够为以乳酸菌作为附属发酵剂的新型黄酒生产工艺提供科学依据,有助于提升黄酒的质量和市场竞争力,并为黄酒风味的多样化和个性化发展提供理论依据和技术支持。
1 材料与方法
1.1 菌种与试剂
酿酒酵母F23(CGMCC 12787)、融合魏斯氏菌AR1038(CGMCC 25624),上海理工大学食品生物技术研究所;麦曲,上海石库门酿酒有限公司;MRS培养基、MEB培养基及YPD培养基,北京路桥技术股份有限公司。
1.2 仪器与设备
e2695高效液相色谱仪,Waters公司;Kjeltec 8400全自动凯氏定氮仪,Foss公司;SpectraMax i3x酶标仪,Molecular Devices公司;ET18电位滴定仪,梅特勒公司;trace1310-ISQ气相色谱-质谱联用仪,赛默飞公司;DB-WAX气相色谱柱,安捷伦公司;Carbomix H-NP 10:8%液相色谱柱,Sepax公司。
1.3 实验方法
1.3.1 黄酒酿造工艺流程
黄酒酿造工艺:将粳米浸泡、蒸煮后进行冷却投料。实验采用5 L黄酒罐进行酿造,各物料的用量及AR1038的接种时序设置如表1所示。发酵过程前酵阶段控制温度在28 ℃条件下发酵5 d,后酵温度20 ℃,发酵10 d。
表1 黄酒投料量及AR1038接种时序表
Table 1 Raw material parameters of Huangjiu and inoculation time of AR1038.

组别粳米/g水/mL生麦曲/g熟麦曲/gF23酒母/mLAR1038添加量/mLAR1038接种时间ST1 5001 200757513812投料D21 5001 200757513812发酵24 hD51 5001 200757513812发酵120 hD91 5001 200757513812发酵216 h
1.3.2 发酵过程理化指标测定
按照GB/T 13662—2018《黄酒》对酒样中的总酸含量及氨基酸态氮含量进行检测。
酒精含量测定:将发酵液样品经过0.22 μm水相滤膜过滤后加入进样小瓶中,后采用液相色谱仪进行检测,具体色谱条件如下:色谱柱(Carbomix H-MP 10:8%)、流动相(2.5 mmol/L硫酸水溶液)、柱温(55 ℃)、流速(0.6 mL/min)、检测器(RI检测器,50 ℃)。通过乙醇标准品确定保留时间并建立标准曲线。
还原糖采用3, 5-二硝基水杨酸比色法进行测定。具体为:配制1 g/L葡萄糖标准液,分别在具塞试管中加入0、0.2、0.4、0.6、0.8、1.0、1.2 mL上述葡萄标准液,并加入不同体积的去离子水补齐至2 mL。继续添加2 mL 3,5-二硝基水杨酸试剂,混匀后于沸水浴中加热5 min,取出后用流动水冷却至室温,稀释定容到10 mL并混匀。测定其在550 nm处的吸光值(OD550)并建立吸光值-葡萄糖浓度标准曲线。检测样品时取1 mL样品于含有1 mL去离子水与2 mL DNS试剂的具塞试管中,经上述具体步骤后通过测定的OD550计算得到还原糖含量。
1.3.3 挥发性风味化合物测定
样品准备:分别将2 g氯化钠、5 mL发酵液与10 μL浓度为200 μg/mL的2-辛醇(溶于乙醇)内标加入20 mL顶空进样瓶中并压盖密封。
固相微萃取条件:将老化后的SPME萃取头刺入瓶内,并将萃取头暴露在外,于50 ℃萃取30 min后取出,迅速插入GC进样口进行进样分析。
GC条件:色谱柱为DB-WAX;柱温(42 ℃保持3分钟,随后以6 ℃/min的速率升高至120 ℃,最后以8 ℃/min升高至230 ℃并保持10 min);进样口温度为250 ℃;采用不分流模式,隔垫吹扫速率为5 mL/min;载气为氦气,流速为1.0 mL/min。
质谱(MS)条件:以EI 作为离子源,电离电压为70 eV,离子源温度为260 ℃,传输线温度为250 ℃,采集质量数范围为30~400 amu。
1.3.4 香气活力值(odor activity value,OAV)分析
OAV是香气化合物的浓度与该化合物的阈值之比,OAV>1,表示该化合物对整体风味贡献突出;OAV<1,则表示该化合物对黄酒整体风味无显著性贡献。
1.4 数据统计分析
所有实验均为3平行,HPLC所得数据经Empower 3软件处理方法自动积分后计算含量。所得数据通过SPSS Statistics 19.0软件进行显著性差异分析,采用Duncan检验,并通过GraphPad Prism 8进行绘图分析。与ST组相比,“*”表示在P<0.05水平下,分析组与其有显著性差异。挥发性风味物质经Xcalibur软件,通过对比NIST、Wiley等质谱库完成定性,并根据内标含量完成定量计算。挥发性风味物质的主成分分析使用Origin 2018进行计算分析并绘图。
2 结果与分析
2.1 融合魏斯氏菌AR1038接种时序对黄酒酿造过程中理化指标的影响
由图1-a可知,在发酵前期,ST组还原糖含量显著低于其余组,且在第3天几乎将糖消耗完毕(2.66 g/L)。而在发酵启动后,接种AR1038显著抑制了还原糖的消耗速率,且前期的还原糖含量显著高于ST组。随着后发酵的进行,除ST组外,其他组的还原糖含量进一步下降,并在发酵结束时与ST组无显著差异。延迟接种策略在一定程度上抑制了融合魏斯氏菌的快速增殖,进而抑制了糖分的快速消耗。在黄酒酿造过程中,酵母利用还原糖发酵产生乙醇,ST组中的乙醇含量在发酵前期略微高于延迟接种组,这与ST组中较高的糖分消耗一致。延迟接种虽能抑制糖分的过分消耗,但对乙醇的最终产量却无显著影响(图1-b)。
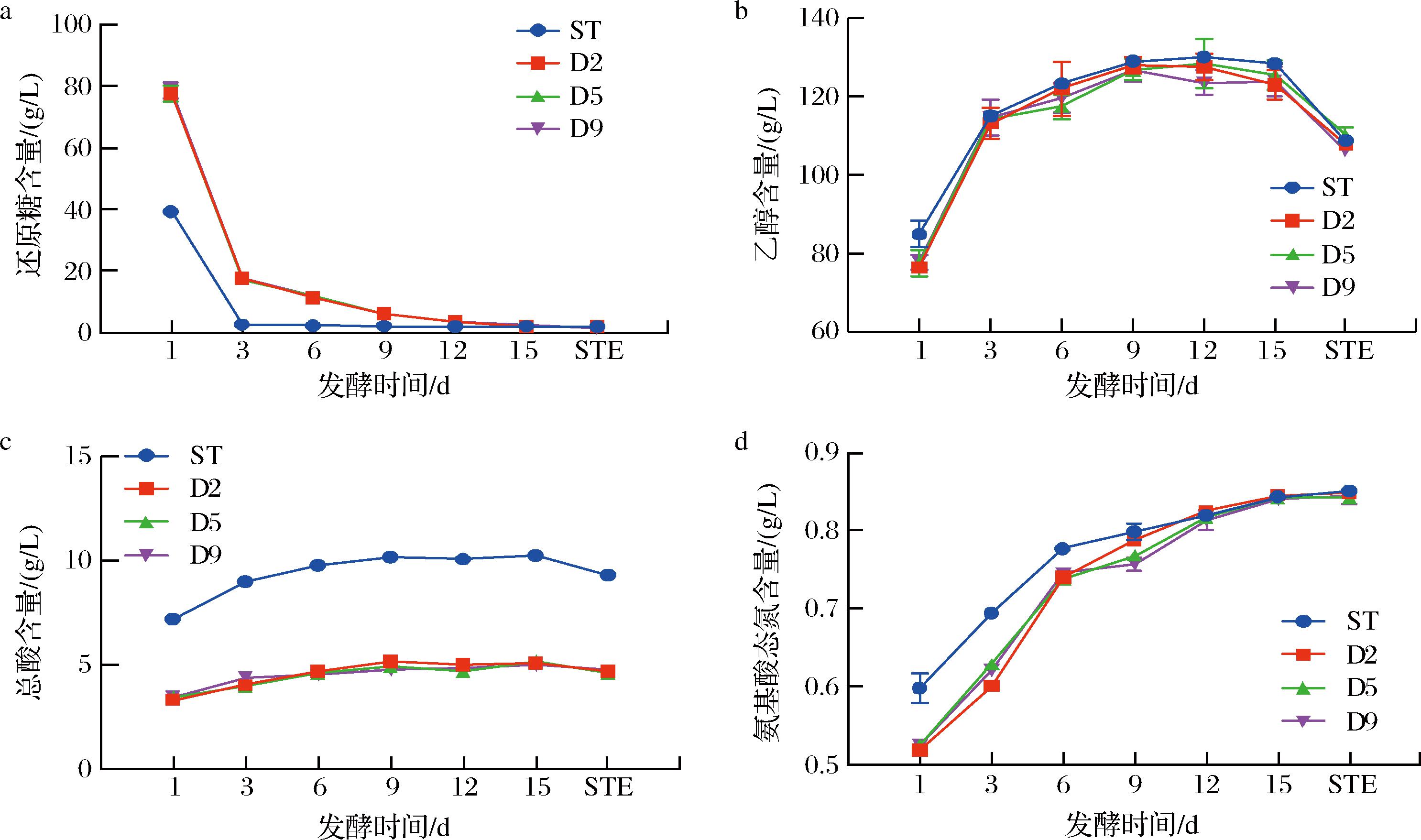
a-不同黄酒发酵过程的还原糖含量;b-不同黄酒发酵过程的乙醇含量;c-不同黄酒发酵过程的总酸;d-不同黄酒发酵过程的氨基酸态氮含量
图1 不同AR1038接种时序对黄酒理化指标的影响
Fig.1 Effects of different AR1038 inoculation times on the physiochemical indexes in Huangjiu
注:ST代表在投料时接种AR1038;D2、D5、D9分别代表在发酵1、5、9 d后接种菌株(下同)。
延迟接种AR1038对黄酒发酵液的总酸产生了重要影响(图1-c)。与ST组相比,延迟接种显著降低了发酵液中的总酸含量,尤其是在D2、D5与D9组中,总酸含量保持在5 g/L以内,显著低于ST组。图1-d显示,发酵液中氨基酸态氮含量随发酵时间逐步上升,且在投料时接种AR1038的黄酒发酵液中含量最高(3.40 g/L)。然而,在发酵结束时ST组的氨基酸态氮含量其他组之间并无显著性差异,表明接种时序对黄酒中的氨基酸态氮的含量没有显著影响。这表明,延迟接种策略可能通过抑制其他细菌的过度生长,减少了酸性物质的积累,进而控制了黄酒的酸度。综上所述,相比于在投料时接种AR1038,延迟接种策略对总酸和还原糖消耗产生了显著影响,但不同延迟接种时间(即接种时序)对这些黄酒酿造理化指标并无显著性影响。
2.2 接种时序对黄酒挥发性风味成分的影响
根据GC-MS分析,在不同黄酒发酵液中共鉴定出47种挥发性风味化合物,其中醇类物质11种、酯类物质31种、酸类物质2种、醛类物质2种、酮类物质1种。在相对浓度上,醇类物质含量占风味物质总量67.05%~76.44%,酯类物质占21.22%~32.37%,酸类物质占0.30%~2.48%,其余物质的平均占比不足1%(图2)。可知,酯类化合物种类最多,但醇类物质的相对含量最高,醛类和酮类物质种类与含量都较少。
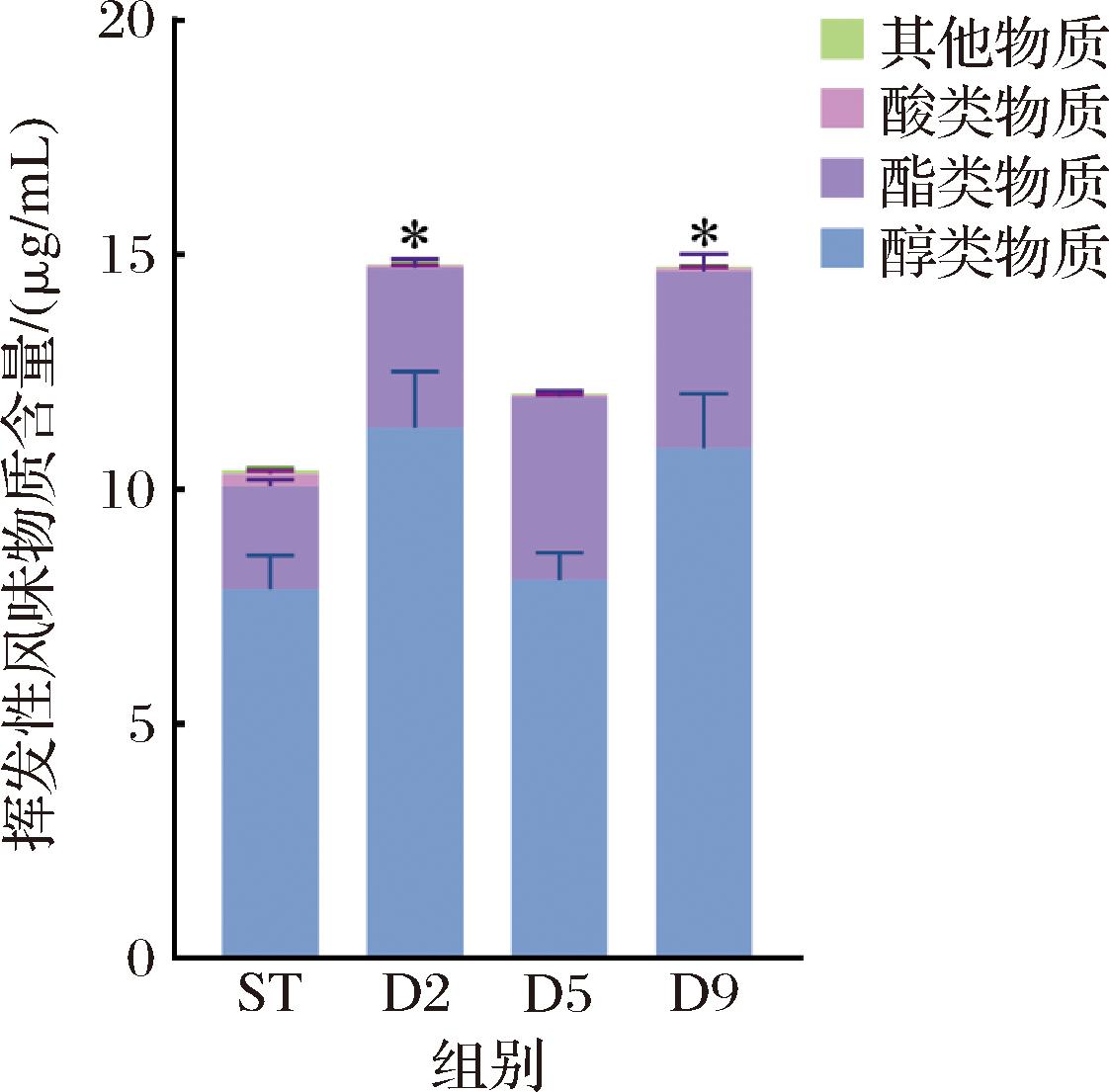
图2 不同AR1038接种时间对黄酒挥发性风味物质总量的影响
Fig.2 Effects of different AR1038 inoculation times on the total amount of volatile flavor compounds in Huangjiu
通过风味物质总含量比较(图3-a),发现在发酵第2天(D2,14.79 mg/L)和第9天(D9,14.75 mg/L)接种AR1038组的黄酒风味物质总含量显著高于ST组(10.41 mg/L)。其中醇类物质含量的变化是风味物质总含量差异的主要原因,D2组中丙醇、异戊醇、异丁醇含量分别由ST组中的0.140、1.16、3.69 mg/L显著提升至0.43、2.20、6.38 mg/L。D9组中丙醇、异戊醇、异丁醇含量分别显著提升至0.30 mg/L、1.69 mg/L、6.27 mg/L,表明AR1038接种时序差异显著影响所酿造黄酒中丙醇、异戊醇、异丁醇的含量。在酯类物质中,D2、D5、D9组中的总酯含量均显著高于ST组(图3-b),其中乙酸乙酯、庚酸乙酯、壬酸乙酯、十一酸乙酯、肉豆蔻酸乙酯等以脂肪酸乙酯类物质为主的酯类物质含量显著上升,而乙酸异戊酯、乳酸乙酯、乳酸异戊酯、乙酸苯乙酯等乙酸酯和乳酸酯类物质的含量显著降低,表明AR1038接种时序对不同酯类物质的含量平衡有重要影响。此外,延迟接种AR1038可显著降低黄酒中的乙酸与异丁酸含量(图3-c),并总体降低醛类物质含量(图3-d)。综合可知,延迟接种AR1038有效促进了脂肪酸乙酯、异戊醇和异丁醇的合成。脂肪酸乙酯通常具有令人愉悦的花果香气,然而异丁醇和异戊醇含量过高容易导致不良的黄酒饮用舒适度[19],因此在实际应用中需要综合考虑酯类与醇类物质间的风味平衡。
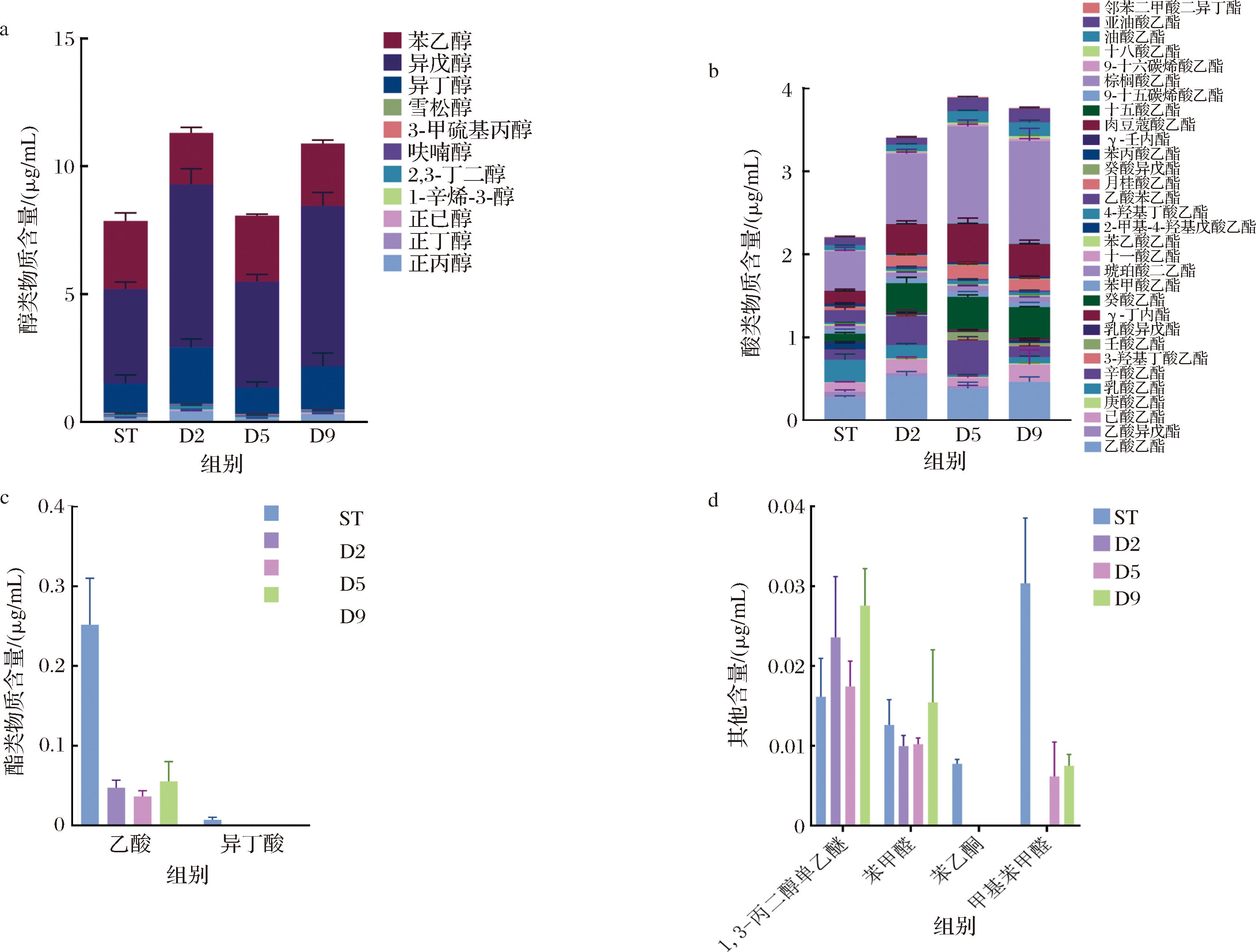
a-不同黄酒的醇类物质含量;b-不同黄酒的酯类物质含量;c-不同黄酒的酸类物质含量;d-不同黄酒的其他物质含量
图3 AR1038接种时序对黄酒不同种类挥发性风味物质的影响
Fig.3 Effects of AR1038 inoculation time on the different volatile flavor compounds in Huangjiu
2.3 基于主成分分析的黄酒特征风味成分
对4组黄酒的挥发性风味化合物进行主成分分析,其中PC1解释了49.3%的样品间差异,PC2解释了15.9%的样品间差异,PC1与PC2共解释了65.2%的样品间差异,表明这两个主成分可以较好的代表不同样品的挥发性风味物质特征。通过得分图可以发现(图4-a),ST组与其余组之间在风味成分上有显著差异,D2组与D5、D9组风味差异较大,而D5组与D9组之间的风味差异较小。由此可见,延迟接种AR1038与投料时接种菌株所酿黄酒的风味特征具有明显差异,但延迟5 d与9 d接种AR1038所得黄酒的风味特征相似,即延迟接种策略对黄酒酿造后发酵阶段的风味特征基本无影响。
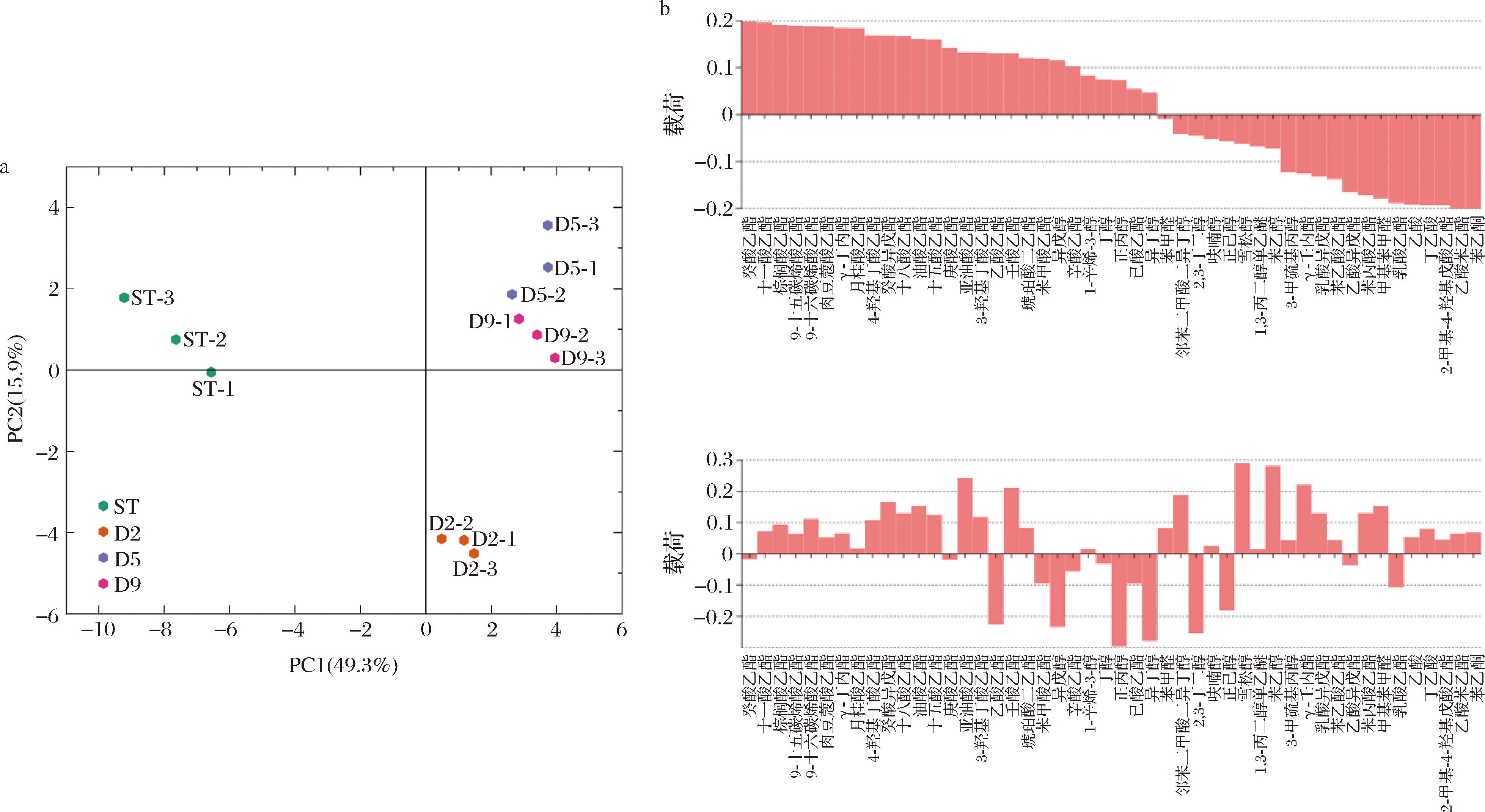
a-不同黄酒的主成分得分图;b-黄酒挥发性风味物质载荷图
图4 不同AR1038接种时序酿造黄酒挥发性风味物质的主成分分析
Fig.4 Principal component analysis of volatile flavor compounds in Huangjiu brewed with different AR1038 inoculation times.
通过载荷图将各组与风味化合物之间进行关联性分析(图4-b),结果表明ST组主要与苯乙酮、乙酸苯乙酯、异丁酸、乙酸、甲基苯甲醛、苯丙酸乙酯、苯乙酸乙酯等风味化合物的含量呈正相关;而D2组的风味特征主要由醇类和脂肪酸乙酯类物质决定,主要与乙酸乙酯、苯甲酸乙酯、异戊醇、辛酸乙酯、丙醇、异丁醇、己酸乙酯高度正相关;D5组与D9组的风味特征主要与酯类物质密切相关,主要与亚油酸乙酯、3-羟基丁酸乙酯、壬酸乙酯、琥珀酸二乙酯、油酸乙酯、十八酸乙酯、癸酸异戊酯等物质的含量呈正相关。
2.4 脂肪酸乙酯在不同黄酒中的变化
脂肪酸乙酯总含量约占黄酒总酯含量的64.92%(ST组)~90.69%(D2组),是酯类物质的主要组成部分,对黄酒花果香气的形成有重要作用。融合魏斯氏菌AR1038的引入可显著促进黄酒中脂肪酸乙酯的合成,因此进一步分析不同AR1038接种时序酿造黄酒中的脂肪酸乙酯产量差异(图5)。黄酒中的脂肪酸乙酯共14种,分别为乙酸乙酯、己酸乙酯、庚酸乙酯、辛酸乙酯、壬酸乙酯、癸酸乙酯、十一酸乙酯、月桂酸乙酯、肉豆蔻酸乙酯、十五酸乙酯、棕榈酸乙酯、十八酸乙酯、油酸乙酯、亚油酸乙酯。其中,D2、D5、D9黄酒中的乙酸乙酯、癸酸乙酯、十一酸乙酯、月桂酸乙酯、肉豆蔻酸乙酯、棕榈酸乙酯含量显著大于ST组。上述物质中,除乙酸乙酯外,其余物质均为长链脂肪酸乙酯,表明延迟接种AR1038菌株能显著提高黄酒中的长链脂肪酸乙酯含量。
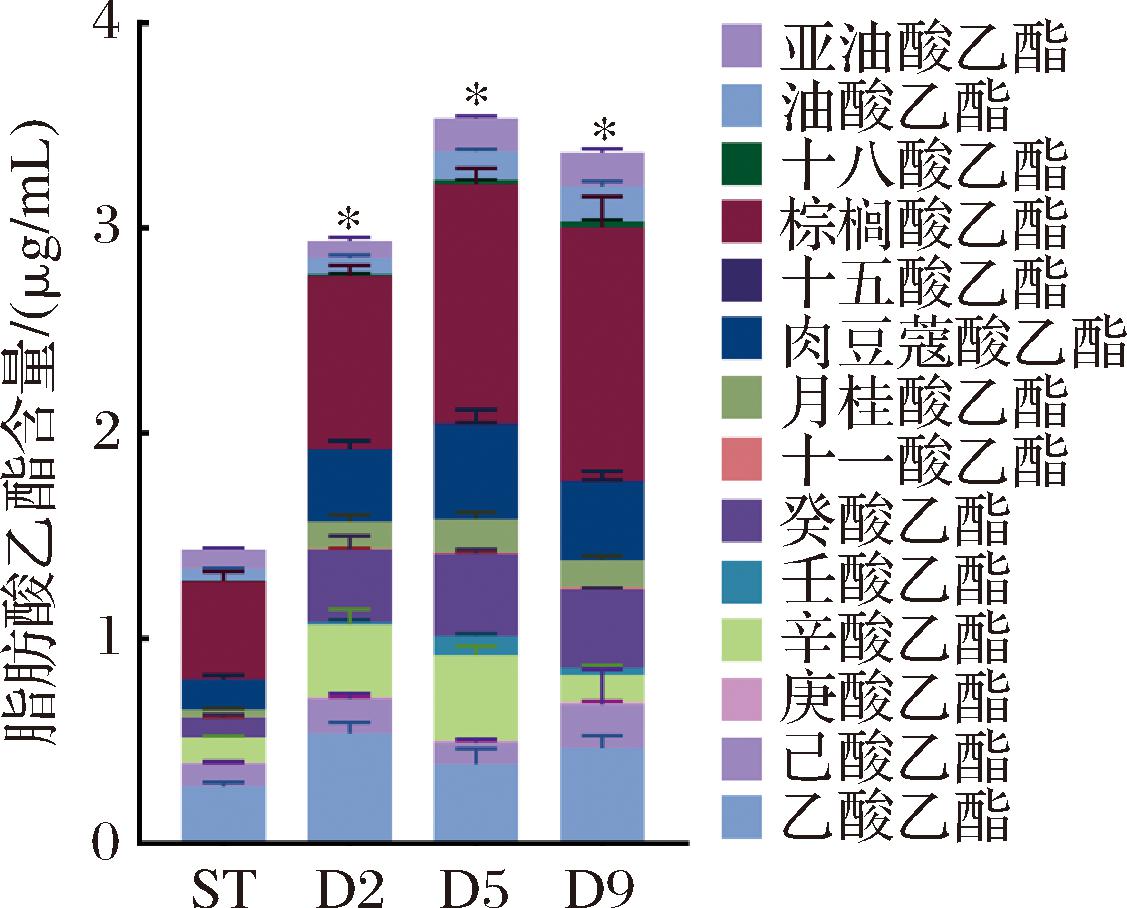
图5 AR1038接种时序对黄酒脂肪酸乙酯的影响
Fig.5 Effect of AR1038 inoculation time on fatty acid ethyl esters in Huangjiu
2.5 黄酒挥发性风味成分的OAV分析
OAV是综合反映香气组分含量和阈值的一个指标,风味物质对黄酒整体风味的贡献程度可以根据香气活力值OAV进行评价[20]。对黄酒中脂肪酸乙酯进行进一步的OAV分析。发现有3种关键脂肪酸乙酯是黄酒中关键风味物质(OAV>1),分别为辛酸乙酯、庚酸乙酯、己酸乙酯,即这3种脂肪酸乙酯对黄酒的风味特征有突出贡献。通过含量比较发现D2、D5、D9黄酒中OAV>1的脂肪酸乙酯总含量均高于ST组。其中,D2和D5组的提升效果相当且显著高于D9组,分别是ST黄酒中OAV>1脂肪酸乙酯含量的2.23倍和2.22倍 (图6-a)。对辛酸乙酯、庚酸乙酯、己酸乙酯分别进行含量分析(图6-b),发现D2与D9组中庚酸乙酯含量显著大于ST组,D2与D5组中辛酸乙酯含量显著大于ST组,表明D2组对OAV>1脂肪酸乙酯含量的提升具有最好的促进效果。综上,延迟接种策略能够显著增加黄酒中关键脂肪酸乙酯的含量,在发酵第2天接种,不仅使所酿黄酒含有最高总关键脂肪酸乙酯含量,还显著增加庚酸乙酯、辛酸乙酯的含量,为最优接种时间。
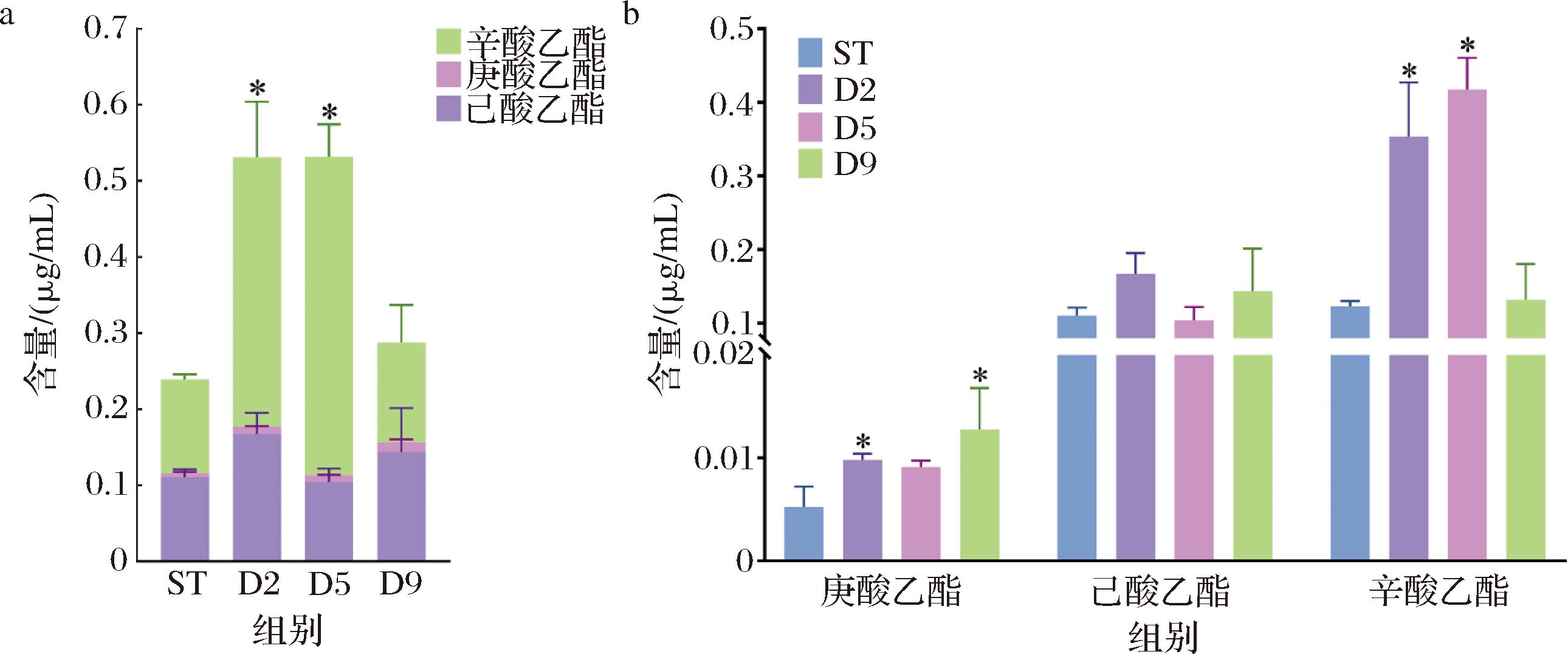
a-不同黄酒的关键脂肪酸乙酯(OAV>1)的总量;b-关键脂肪酸乙酯在不同黄酒中的含量差异
图6 AR1038接种时序对黄酒关键脂肪酸乙酯(OAV>1)的影响
Fig.6 Effect of AR1038 inoculation time on key fatty acid ethyl esters (OAV>1) in Huangjiu
3 结论
本研究系统分析了融合魏斯氏菌AR1038接种时序对黄酒酿造过程中的理化特性及挥发性风味物质的影响,结果表明,接种时序在调控黄酒发酵过程中风味物质的合成方面起到了关键作用。特别是延迟接种策略能够显著降低还原糖的消耗速率,减少酸性物质的积累,从而优化黄酒的酸度和口感。此外,延迟接种AR1038能够有效促进脂肪酸乙酯,尤其是中长链脂肪酸乙酯类化合物的合成,提升了黄酒的花果香气。综合分析表明,发酵开始后第2天进行乳酸菌接种是优化黄酒风味的最佳时机,这一策略能够有效提高关键脂肪酸乙酯的含量,尤其是庚酸乙酯、辛酸乙酯等对风味有突出贡献的成分。这一发现为黄酒酿造工艺的改进提供了新的思路,也为进一步提升黄酒的风味质量提供了理论依据。未来可进一步探讨不同菌种接种时序的综合影响,探索其对黄酒其他风味成分及其整体感官质量的提升。同时,结合发酵过程中环境因子,如温度、湿度等的变化,对接种时序的影响进行系统优化,以期开发出更加优质的黄酒酿造工艺。
[1] 朱斌, 骆佳琪, 关斌, 等.传统黄酒的风味成分及品质控制研究进展[J].中国酿造, 2024, 43 (9):9-13.ZHU B, LUO J Q, GUAN B, et al.Research progress on flavor components and quality control of traditional Huangjiu[J].China Brewing, 2024, 43 (9):9-13.
[2] 刘娅, 刘双平, 刘甜甜, 等.低产杂醇高产酯酵母菌株的选育和共酵对黄酒品质的影响及机制分析[J].食品科学技术学报, 2024, 42 (4):31-44.LIU Y, LIU S P, LIU T T, et al.Breeding of yeast strains with low fusel alcohol yield and high ester yield and effect of co-fermentation on Huangjiu quality and its mechanism analysis[J].Journal of Food Science and Technology, 2024, 42 (4):31-44.
[3] 王莉莉. 黄酒风味及其影响因素的研究进展[J].食品工业, 2024, 45 (9):192-195.WANG L L.Research progress of Huangjiu flavor and its influencing factors[J].The Food Industry, 2024, 45 (9):192-195.
[4] 谷晓东, 李素萍, 杨柳青, 等.红谷黄酒发酵过程中微生物多样性与理化指标、挥发性风味的相关性分析[J].食品工业科技, 2022, 43 (23):133-143.GU X D, LI S P, YANG L Q, et al.Correlation analysis between microbial diversity, physicochemical indexes and volatile flavor during the fermentation of red-millet Huangjiu[J].Science and Technology of Food Industry, 2022, 43 (23):133-143.
[5] 宋建阳, 岑定运, 梁莉莹, 等.南阳红谷黄酒发酵过程中挥发性风味物质与微生物群落相关性分析[J].中国酿造, 2023, 42 (8):135-139.SONG J Y, CEN D Y, LIANG L Y, et al.Correlation analysis between volatile flavor compounds and microbial community of Nanyang red millet Huangjiu during fermentation process[J].China Brewing, 2023, 42 (8):135-139.
[6] 叶书建, 刘甜甜, 毛健, 等.黄酒循环浸米中核心微生物群落组装[J/OL].食品与发酵工业.https://doi.org/10.13995/j.cnki.11-1802/ts.039603.YE S J, LIU T T, MAO J, et al.Assembly of core microbial communities in the soaking rice of Huangjiu[J/OL].Food and Fermentation Industries.https://doi.org/10.13995/j.cnki.11-1802/ts.039603.
[7] 刘彩霞, 刘双平, 徐岳正, 等.乳酸菌强化技术降低黄酒浸米过程生物胺的积累[J].中国食品学报, 2021, 21(5):166-173.LIU C X, LIU S P, XU Y Z, et al.Lactic acid bacteria fortification technology reduces the accumulation of biogenic amines during Huangjiu soaking[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):166-173.
[8] LIU Z B, WANG Z Y, LV X C, et al.Comparison study of the volatile profiles and microbial communities of Wuyi Qu and Gutian Qu, two major types of traditional fermentation starters of Hong Qu glutinous rice wine[J].Food Microbiology, 2018, 69, 105-115.
[9] CAI H Y, ZHANG T, ZHANG Q, et al.Microbial diversity and chemical analysis of the starters used in traditional Chinese sweet rice wine[J].Food Microbiology, 2018, 73, 319-326.
[10] JOHANNA BJÖRKROTH K, SCHILLINGER U, GEISEN R, et al.Taxonomic study of Weissella confusa and description of Weissella cibaria sp.nov., detected in food and clinical samples[J].International Journal of Systematic and Evolutionary Microbiology, 2002, 52(Pt)(1):141-148.
[11] YANG Y J, XIA Y J, YAN X, et al.Insights into whereby raw wheat Qu contributes to the flavor quality of Huangjiu during brewing[J].LWT, 2023, 178:114619.
[12] 董蕴, 王强, 仇港, 等.乳酸菌对红曲黄酒品质的影响研究[J].食品研究与开发, 2020, 41(3):213-218.DONG Y, WANG Q, QIU G, et al.Study on the effect of lactic acid bacteria on the quality of red yeast rice wine[J].Food Research and Development, 2020, 41(3):213-218.
[13] HUANG W K, YANG S Y, W TJEN A P, et al.Isolation of an exopolysaccharide-producing Weissella confusa strain from lettuce and exploring its application as a texture modifying adjunct culture in a soy milk alternative[J].International Journal of Food Microbiology, 2025,428:110992.
TJEN A P, et al.Isolation of an exopolysaccharide-producing Weissella confusa strain from lettuce and exploring its application as a texture modifying adjunct culture in a soy milk alternative[J].International Journal of Food Microbiology, 2025,428:110992.
[14] XIONG H, LEI D, XIONG J, et al.Exploring the mechanism of Weissella cibaria cooperating with Lactiplantibacillus plantarum to improve volatile flavor of Sichuan pickle using dialysis membranes[J].Food Bioscience, 2024,60:104520.
[15] LEE J K, BAEK J H, HAN D M, et al.Description and genomic characteristics of Weissella fermenti sp.nov., isolated from kimchi[J].Journal of Microbiology and Biotechnology, 2023, 33(11):1448-1456.
[16] 洪家丽, 陈敏, 周文斌, 等.乳酸菌对红曲黄酒酿造过程酵母菌生长及风味物质形成的影响[J].中国食品学报, 2020, 20(1):91-100.HONG J L, CHEN M, ZHOU W B, et al.Effects of lactic acid bacteria on the growth of yeast and the formation of flavor compounds in the fermentation of Hongqu glutious rice wine[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(01):91-100.
[17] TIAN S, ZENG W, FANG F, et al.The microbiome of Chinese rice wine (Huangjiu)[J].Current Research in Food Science, 2022, 5, 325-335.
[18] YANG Y J, HU W Y, XIA Y J, et al.Flavor formation in Chinese rice wine (Huangjiu):Impacts of the flavor-active microorganisms, raw materials, and fermentation technology[J].Frontiers in Microbiology, 2020, 11:580247.
[19] YANG Y J, XIA Y J, WANG G Q, et al.Effects of boiling, ultra-high temperature and high hydrostatic pressure on free amino acids, flavor characteristics and sensory profiles in Chinese rice wine[J].Food Chemistry, 2019, 275: 407-416.
[20] ESCUDERO A, GOGORZA B, ![]() M A, et al.Characterization of the aroma of a wine from Maccabeo.Key role played by compounds with low odor activity values[J].Journal of Agricultural and Food Chemistry, 2004, 52(11):3516-3524.
M A, et al.Characterization of the aroma of a wine from Maccabeo.Key role played by compounds with low odor activity values[J].Journal of Agricultural and Food Chemistry, 2004, 52(11):3516-3524.