便秘是一种常见的胃肠道消化系统疾病,在全球的患病率高达15%[1],影响约9.5%的儿童和14%的成人,在我国,便秘的患病率约为8.5%[2],而女性患病群体几乎是男性的3倍。人群出生队列研究表明,性成熟前,儿童便秘患病率并不具有性别差异,而性成熟后便秘群体开始表现出明显的性别差异[3],对此我们猜测女性便秘与性激素的变化有着紧密联系。同时女性在某些特殊生理周期(例如妊娠期、经期等)便秘症状加重,这也映证了性激素在胃肠蠕动中发挥着重要作用。基于此,从调节性激素的角度去筛选缓解便秘的益生菌可能对于缓解女性便秘尤为重要。
影响便秘的因素主要有神经系统、免疫系统、肠道微生物及其代谢产物,这些方面中任何一方出现紊乱或功能障碍都可能会引发便秘[4]。不同干预措施其作用机制也不同。马尾藻提取物能够平衡Cl-和Na+的水平,改善便秘小鼠粪便含水量,增强结肠收缩力,减少肠道转运时间,有效预防便秘[5]。乳双歧杆菌TY-S01能够上调肠道黏蛋白的mRNA表达,下调炎症因子水平,保持粪便含水量,有效预防和改善小鼠便秘症状[6]。副干酪乳杆菌N1115发酵乳可显著提高结肠组织Cajal活性,增强肠蠕动,同时保持肠黏膜形态完整性,对便秘有积极的治疗作用[7]。课题组前期研究发现,应用雌激素受体β(estrogen receptor β,ERβ)抑制剂(他莫昔芬)可成功构建适用于女性便秘的动物模型,同时,雌激素受体β抑制剂(他莫昔芬)处理后,大鼠不仅呈现便秘的状态,同时还伴随有肠神经-免疫互作的失衡[8]。长双歧杆菌CCFM1240具有缓解雌激素受体β抑制剂引起的便秘,同时其在临床上也表现出缓解便秘的效果,但其发挥作用的途径和机制尚不明确,有待进一步探索。
基于此,本研究通过应用ERβ受体抑制剂构建适用于女性便秘的动物模型,拟从肠神经-免疫互作的角度去探究长双歧杆菌CCFM1240缓解雌性大鼠便秘的可能作用机制,同时也为靶向预防和治疗女性便秘提供理论依据。
1 材料及方法
1.1 实验材料
免疫组化试剂盒,上海生工生物工程技术服务有限公司;乙酰胆碱(acetylcholine,ACh)、神经肽P物质(substance P,SP)、5-羟色胺(5-hydroxy tryptamine,5-HT)、白介素6(interleukin 6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素1β(interleukin 1β,IL-1β)ELISA试剂盒,南京森贝伽生物科技有限公司;反转录试剂盒、HiScript Ⅲ RTSuperMix for qPCR试剂盒,南京诺唯赞生物科技有限公司;乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸,国药集团化学试剂公司;CD4单克隆抗体(FITC)、CD25单克隆抗体(APC)、FOXP3单克隆抗体(PE)、大鼠IgG2aKappa Isotype Control(PE)、流式细胞分析染色液,美国eBioscience公司。
1.2 实验设备
5804R型高速冷冻离心机,Eppendorf;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司;ME204E分析天平,瑞士METTLER TOLEDO集团;全自动生化分析仪,深圳迈瑞生物医疗;C100 TouchTM基因扩增仪,美国Bio-Rad 公司;IIumina MiSeq PE300高通量测序仪,美国Illumina公司。
1.3 实验菌株
本实验所使用的2株长双歧杆菌(Bifidobacterium longum)CCFM1240、CCFM1114均来自江南大学食品学院生物技术中心菌种保藏库。实验菌株在使用前需活化3代,活化后置于甘油中,保藏在-80 ℃冰箱。使用前,利用梯度稀释法进行活菌计数。使用时用新的无菌生理盐水稀释菌液,使最终使用的菌液活菌浓度为1×1010 CFU/mL。
1.4 动物实验设计
选用40只6周龄雌性SPF级Sprague Dawley大鼠,购自南京维通利华实验动物技术有限公司。本实验严格遵守国家标准实验动物福利伦理学要求(伦理审核批准文号:JN.No20220615S0800801[221])。在试验期间大鼠自由进水并喂食标准饲料,饲养条件:温度20~26 ℃,相对湿度40%~70%,噪声≤60 dB,动物照度15~20 LX。经1周适应喂养后,将大鼠随机分为4组:正常组(normal control,NC组)每天灌胃1 mL生理盐水,模型组(model,M组)和菌株干预组(L1、L3)每天灌胃1 mL枸橼酸他莫昔芬悬液(40 mg/kg·bw),持续1周后进入干预期。在菌株干预期间,M组每天灌胃1 mL枸橼酸他莫昔芬悬液,2 h后灌胃1 mL生理盐水,菌株干预组每天灌胃1 mL枸橼酸他莫昔芬悬液,2 h后灌胃1 mL菌液,NC组每天灌胃1 mL生理盐水,2 h后再灌胃1 mL生理盐水。实验结束后,对大鼠腹腔注射氯胺酮(100 mg/kg·bw)进行麻醉,腹部主动脉取血至死。血液静置2 h后在4 ℃ 3 000×g条件下离心10 min,血清分装后置于-80 ℃冻存备用。具体动物实验流程设计如图1所示。
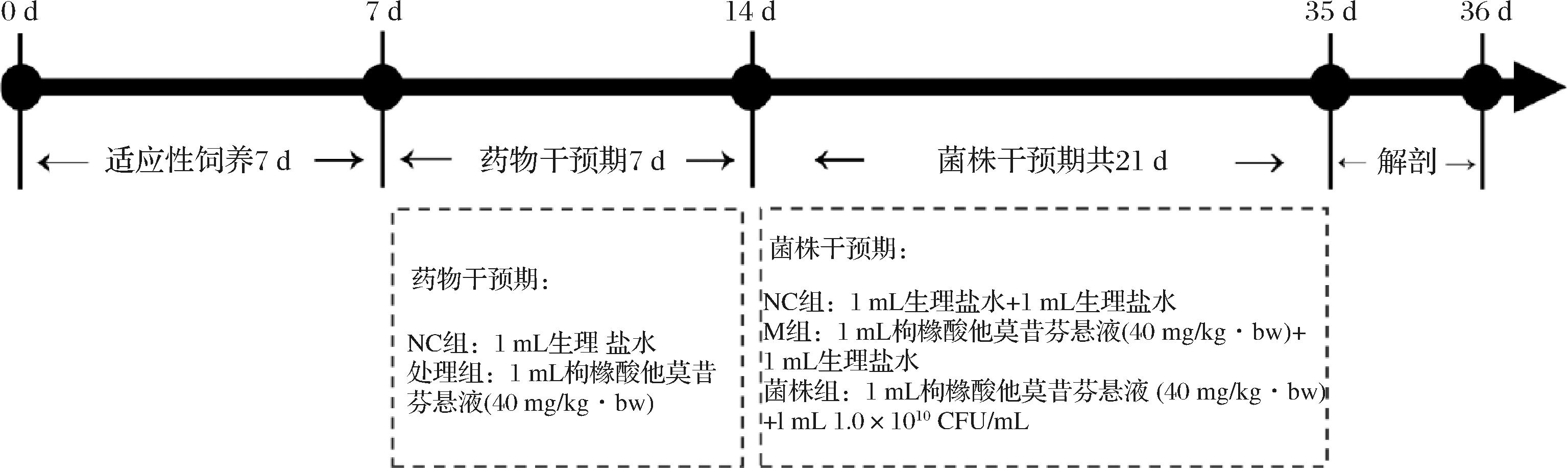
图1 动物实验流程
Fig.1 Animal experiment process
1.5 实验方法
1.5.1 粪便含水率
每周收集粪便用于监测大鼠实验期间粪便含水量的变化。将全部大鼠按组别单独放入干净笼盒,收集新鲜粪便。称取粪便湿重,粪便经冷冻干燥去除粪便中所含水分,再次称重,此质量为粪便干重。按公式(1)计算粪便含水率:
粪便含水率![]()
(1)
1.5.2 排首粒黑便时间
将阿拉伯树胶粉与水以1∶10混合均匀,在电磁炉上不断搅拌加热至透明,然后加入活性炭粉,搅拌均匀并煮沸,待溶液冷却后放置于4 ℃冰箱保存。在实验结束前1 d早上测定大鼠排首粒黑便时间,为保证结果的准确性,在测定排首粒黑便时间之前,大鼠需禁食不禁水过夜。每只大鼠灌胃1 mL上述活性炭,并记录每只大鼠从灌胃至排出第1粒含有活性炭粪便的时间,即为排首粒黑便时间。
1.5.3 小肠推进率
解剖前12 h将大鼠禁食不禁水过夜,每只大鼠灌胃1 mL上述活性炭,30 min后麻醉,腹部主动脉取血至死。打开腹腔剪取从胃至回肠末端,展开全段小肠,避免拉扯,测量无拉伸小肠总长度,以及活性炭自胃到活性炭前端推进距离,按公式(2)计算小肠推进率:
小肠推进率![]()
(2)
1.5.4 实时荧光定量聚合酶链式反应
采用实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)测定大鼠结肠组织中目的基因转录水平。在NCBI网站(https://www.ncbi.nlm.nih.gov/)上查找大鼠相关目的基因的引物序列并委托上海生工生物工程技术服务有限公司进行合成,具体引物信息如表1所示。
表1 目的基因引物序列
Table 1 Target gene primer sequence

目标基因引物序列(5′-3′)产物长度/bpAQP3F-TTGATGAACCGTTGCGGGGAGAR-CTTGAGCCACGGAACCACAGCC118AQP4F-CAGAGAACCCCCTACCTGTGGAR-ATGTAGAAGACGGACTTGGCGA172MUC1F- TGGCTTTGGTCTTCGTCR-CAGATAGCGTCCGTGAGT146MUC2F- CTCCCAAGCACTACTACGAR- GCACAGAGGGCAGCAT100Tph1F- CTCTGAACTCCAGTGGCTTTGR-CATGGTGAATCTGAATGAAGATGA81Tph2F- GTGGATGTGGCCATGGGTTAR-GGAGAGCTCCCGAAACACAA102
1.5.5 大鼠结肠苏木精-伊红(hematoxylin-eosin staining,H&E)染色
将40 g/L的多聚甲醛固定后的结肠组织经流水过夜冲洗,乙醇梯度脱水后浸蜡包埋。使用手动轮转切片机切出5 μm的薄片,放入40 ℃的去离子水中进行展片,用载玻片将其捞出。然后进行脱蜡、苏木精和伊红染色、脱水、透明。染色结束后用中性树胶进行封藏,待中性树胶凝固,用全自动数字切片扫描仪进行观察。
1.5.6 大鼠结肠免疫荧光染色
将包埋后的组织切片置于载玻片上,恒温箱60 ℃熔蜡1 h,二甲苯中浸泡脱蜡,乙醇梯度水化(100%、95%、85%、75%),蒸馏水浸泡清洗后使用煮沸法进行抗原修复(柠檬酸钠-EDTA抗原修复液煮沸后,将载玻片淹没放置,保持沸腾状态10 min,待溶液自然冷却,取出载玻片),蒸馏水与PBST再次浸泡清洗。每张切片滴加适量灭活酶试剂,室温避光15 min后洗涤,滴加适量封闭液于湿盒中封闭30 min。封闭结束后,弃封闭液,滴加一抗4 ℃孵育过夜。次日,室温复温40 min,PBST洗涤后加酶标二抗孵育30 min,清洗干净后进行DAB显色约5 min,蒸馏水终止显色。苏木素体细胞快速染色液复染后用1%盐酸-乙醇脱色反蓝,再用乙醇梯度脱水(75%、85%、95%、100%),二甲苯浸泡2次,吸水纸擦干组织周边后滴加中性树胶封片。
1.5.7 酶联免疫法检测蛋白表达
用ELISA试剂盒测定大鼠血清/结肠中SP、5-HT、ACh、IL-6、TNF-α、IL-1β含量,具体方法参照试剂盒说明书进行。
1.5.8 大鼠结肠内容物的菌群16S rRNA测序分析
使用MP DNA Spin for Faces试剂盒提取大鼠粪便DNA,利用通用引物341F和806R对细菌DNA模板进行V3~V4区特异性扩增。通过琼脂糖凝胶电泳及胶回收试剂盒对PCR产物进行纯化回收。通过Miseq Reagent Kit v3 进行上机测序,获取文库原始数据。采用QIIME 2软件对下机数据进行分析。
1.5.9 大鼠粪便中短链脂肪酸(short-chain fatty acids,SCFAs)的检测
将收集到的大鼠粪便冻干后参照文献[9]的方法进行SCFAs的提取及检测,GC-MS检测选用全波长扫描。采用外标法绘制SCFAs的标准曲线,然后计算粪便中各SCFAs浓度。
1.5.10 大鼠肠系膜淋巴结调节性T细胞(regulatory T cell,Treg)比例的测定
用流式细胞仪对大鼠肠系淋巴结Treg细胞进行测定。具体方法如下:
样本准备:取肠系膜淋巴结(mesenteric lymph node,MLN),在预冷过的PBS溶液中用注射器芯研磨,200目滤网过滤,制备成单细胞悬浮液。300×g离心5 min,弃上清液,用流式细胞缓冲液重悬细胞沉淀,细胞浓度调至2×108 cells/mL。
染色步骤:悬液中加入FITC标记的anti-rat CD4 抗体(1.25 μg/mL)和APC标记的anti-rat CD25抗体(0.6 μg/mL),室温避光孵育30 min对细胞表面染色;之后加入Foxp3 Fixation/Permeabilization固定破膜液于室温避光孵育1 h;最后加入0.5 μg PE标记的anti-rat/mouse Foxp3抗体室温避光孵育1 h对细胞核染色,PE标记的anti-rat IgG2a抗体作为Foxp3的同型对照。染色完成后流式缓冲液重悬上机检测。
1.5.11 数据处理和分析
实验数据用Graphpad Prism 8.0软件统计,采用单因素方差分析检测多组间数据,P<0.05表示差异具有统计学意义。*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1。流式数据在BD LSR Ⅱ流式细胞仪上采集,并使用FlowJo软件进行分析。
2 实验结果
2.1 长双歧杆菌CCFM1240对雌性便秘大鼠有缓解作用
相较于正常组,模型组大鼠的排首粒黑便时间(图2-b,P<0.000 1)显著延长,粪便含水率(图2-c,P<0.05)显著降低,小肠推进率出现降低趋势但无显著性(图2-a),根据“保健食品功能检验与评价方法(2023年版)”中“有助于润肠通便”动物实验的建模方法的评价标准:在粪便含水量为阳性结果的基础上,排首粒黑便时间和小肠推进率结果二选一为阳性结果可知,便秘模型造模成功。菌株干预后,仅有长双歧杆菌CCFM1240(L1)处理组能够显著缩短首粒黑便时间(P<0.000 1)及增加粪便含水率(P<0.001),这表明长双歧杆菌CCFM1240对雌性便秘大鼠具有明显缓解效果。基于此,本文将从修复肠神经和肠屏障的角度解析长双歧杆菌CCFM1240缓解便秘的可能机制,同时以长双歧杆菌CCFM1114(L3)作为阴性对照。
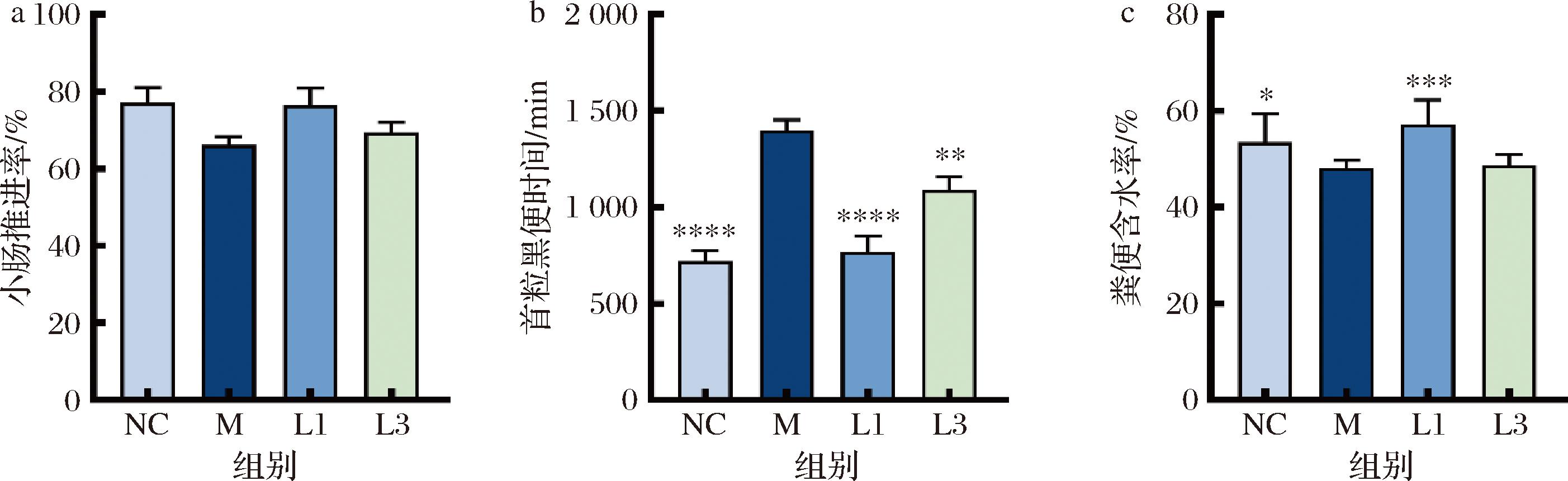
a-小肠推进率;b-首粒黑便时间;c-菌株干预3周后粪便含水率
图2 大鼠便秘相关指标
Fig.2 Constipation-related indicators in rats
注:*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1(下同)。
2.2 长双歧杆菌CCFM1240缓解女性便秘的机制解析
2.2.1 CCFM1240对雌性便秘大鼠肠神经系统的影响
肠神经系统是由许多肠神经元和肠神经胶质细胞组成的复杂神经网络,是调节胃肠功能的重要系统[10]。选用PGP9.5作为定量肠神经元的检测指标,S100β作为肠神经胶质细胞的标记物,结肠免疫组化染色后发现,模型组大鼠结肠神经元数量(PGP9.5)显著降低(图3-a、图3-b),S100β有减少趋势但无显著性(图3-c、图3-d),长双歧杆菌CCFM1240可以显著提高神经元数量(PGP9.5)(P<0.000 1),而S100β的提高并无显著性。因此,我们推测长双歧杆菌CCFM1240可能主要是通过提高肠神经元的数量来修复肠神经系统。
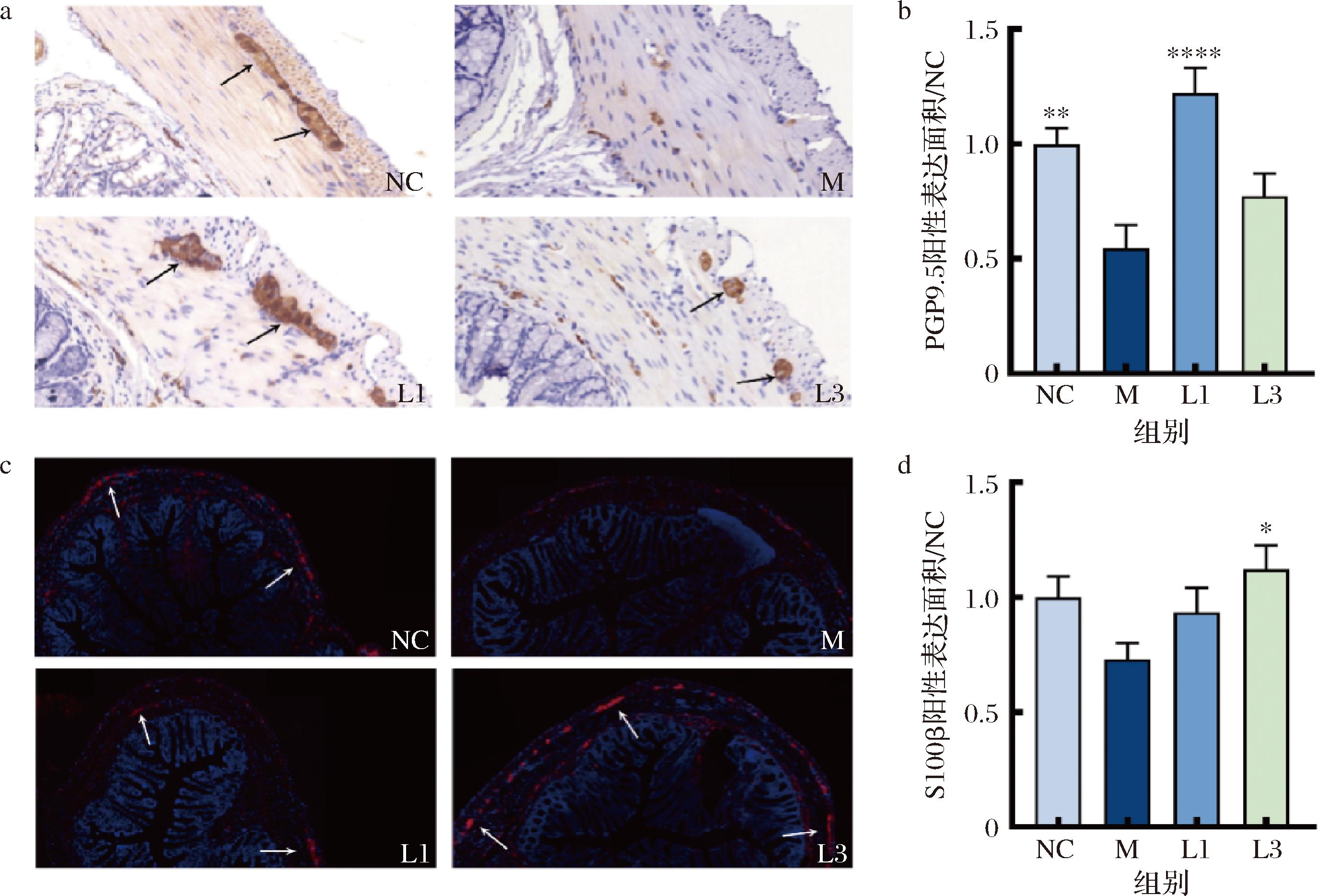
a-PGP9.5免疫组化染色;b-PGP9.5阳性表达相对面积;c-S100β免疫荧光染色;d-S100β阳性表达相对面积
图3 大鼠结肠肠神经元及肠神经胶质细胞标志物的表达
Fig.3 Expression of colonic enteric neurons and neuroglial cell markers in rats
肠神经网络分泌的胃肠动力相关神经递质,可分为兴奋性递质和抑制性递质,其含量的改变会使宿主肠道功能发生变化[11]。通过对大鼠体内便秘相关肠神经递质的分析,如图4所示,大鼠经他莫昔芬造模后,兴奋性递质ACh、SP显著性降低(P<0.05),长双歧杆菌CCFM1240干预后血清和结肠ACh含量均有增加的趋势,但仅有血清中ACh含量显著增加。
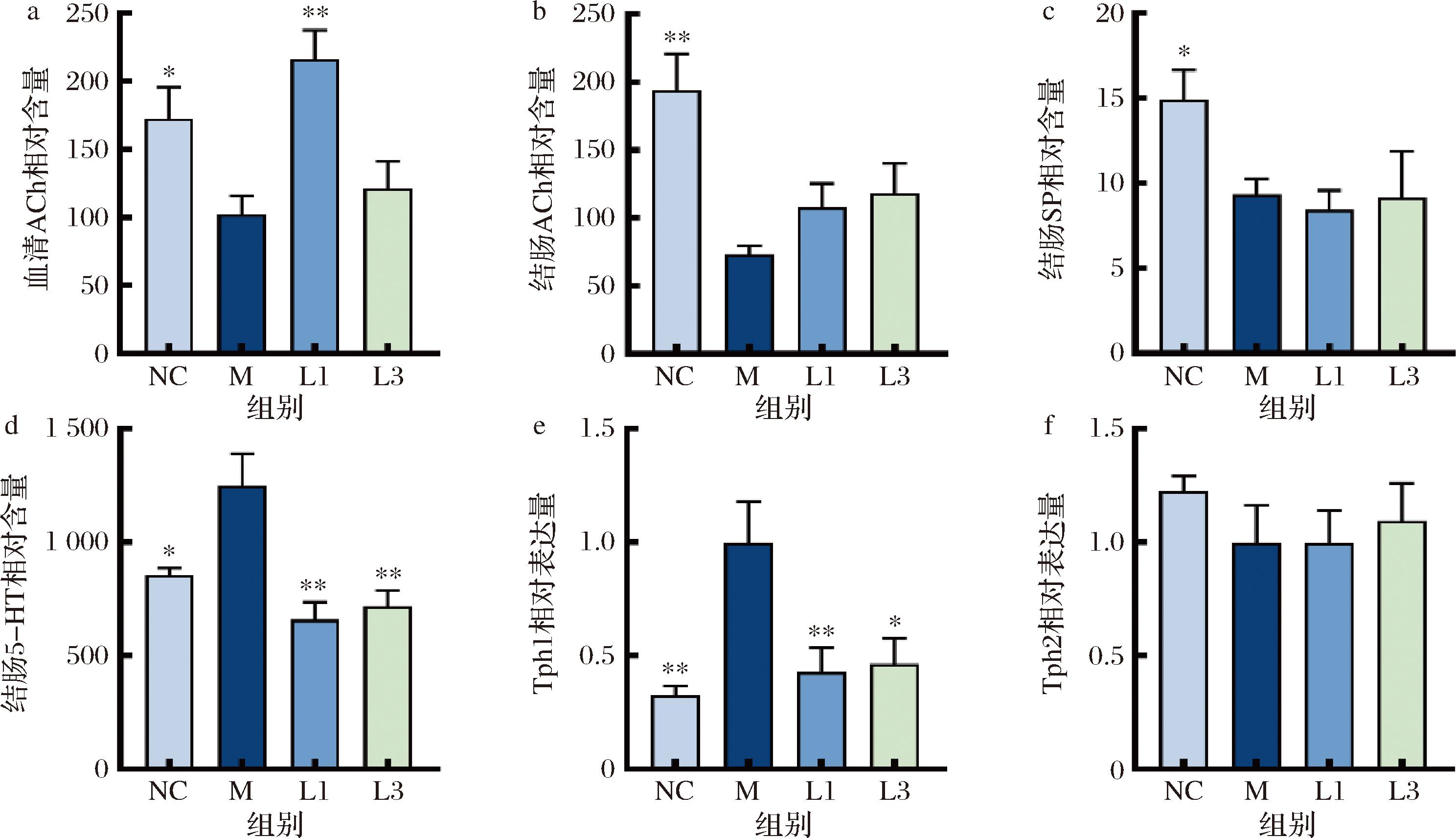
a-血清ACh;b-结肠ACh;c-结肠SP;d-结肠5-HT;e-Tph1;f-Tph2
图4 大鼠有关肠神经递质及相关酶的相对含量分析
Fig.4 Relative content analysis of intestinal neurotransmitters and related enzymes in rats
色氨酸羟化酶Tph是5-HT合成过程中的限速酶,如图4所示,模型组的Tph1表达量和5-HT含量均显著上升(图4-e、图4-d),而Tph2的相对表达量趋势无显著性差异(图4-f)。表明他莫昔芬是通过提高大鼠结肠Tph1表达来促进5-HT的合成。此外,模型组5-HT含量显著升高,而2株菌均能显著下调5-HT含量,说明长双歧杆菌CCFM1240并不是通过调节宿主肠道中5-HT含量发挥作用。然而,很多研究表明口服产5-HT的益生菌能够有效缓解便秘相关症状[12],但5-HT的提升不一定会改善便秘。患有HFHSD诱导的糖尿病Tph1-tdTom雄性小鼠,尽管结肠Tph1细胞密度和5-HT水平增加,但其结肠运动性降低[13],表明5-HT水平上升并不直接增加小鼠肠道运动性。一项研究表明,卵巢激素可通过调节5-HT3受体表达影响约束应激诱导的大鼠结肠功能障碍[14],卵巢切除大鼠结肠5-HT3R mRNA水平显著升高与我们实验结果相类似。因此5-HT水平与便秘之间的关系较复杂,并不存在确切的关系。
基于以上结果猜测,长双歧杆菌CCFM1240可能是通过修复肠神经,主要是提高肠神经元数量(PGP9.5),促进ACh分泌,最终发挥缓解女性便秘的作用。
2.2.2 CCFM1240对雌性便秘大鼠肠道屏障的影响
2.2.2.1 CCFM1240对雌性便秘大鼠肠道生物屏障的影响
本研究利用16S rRNA测序技术对大鼠肠道菌群多样性及相对丰度进行研究。利用Chao1、Shannon指数表征肠道菌群α多样性(图5-a、图5-b),他莫昔芬造模并未对α多样性造成显著影响。同时,肠道菌群β多样性可视化结果显示,模型组便秘大鼠肠道群落结构出现显著差异(P=0.002),长双歧杆菌CCFM1240干预后虽能显著调节肠道菌群结构(P=0.013),但无法逆转造模对群落结构造成的影响。对测序结果进一步分析,他莫昔芬造模后,厚壁菌门/拟杆菌门(F/B)提高了(1.95±0.38)倍,与KASHYAP等[15]的结果一致。然而,菌株干预对结果有影响,但仍无法恢复造模引起的菌群失衡。

a、b-α多样性;c-厚壁菌门/拟杆菌门;d-β多样性;e-属水平LEfSe分析;f-属水平差异菌群;g~j-差异属相对丰度
图5 大鼠粪便菌群多样性及门/属水平分析
Fig.5 Diversity and phylum/genus level analysis of fecal microbiota in rats
基于LEfSe分析各组之间肠道菌群的标志菌属(LDA>3,P<0.05),L1(CCFM1240)组存在的差异菌株Eubacterium coprostanollgenes group是一种重要的健康肠道细菌,能产生SCFAs,CCFM1240干预能够显著提高SCFAs(图7-e)。通过Stamp进行差异菌株分析(图5-f),结果显示,模型组Turicibacter和Clostridium sensu stricto 1显著增加(P<0.000 1),Bacteroides显著下降(P<0.01),长双歧杆菌CCFM1240干预能显著增加便秘大鼠肠道菌群中Pediococcus相对丰度,降低Parabacteroides、Oscillibacter、Ruminococcaceae UGG-010、Ruminiclostridium 9的相对丰度。有研究发现,肠腔中5-HT的增多会增加肠道中Turicibacter的相对丰度[16],本研究结果与前人一致。SCHLUTER等[17]数据表明Clostridium sensu stricto 1与中性粒细胞数量有关,可能参与免疫稳态的调节,模型组中该菌属水平上调一定程度反映大鼠肠道处于炎症状态。Bacteroides能分解葡萄糖或蛋白质产生乙酸、丙酸等,因此模型组SCFAs含量下降(图7-e)的重要原因可能是Bacteroides的减少。Mucispirillum对修复肠黏膜层具有重要意义,他莫昔芬造模后,模型组中Mucispirillum相对丰度显著下调,有害菌属Romboutsia丰度显著上调(P<0.001),长双歧杆菌CCFM1240能恢复肠道中Mucispirillum水平,显著降低Romboutsia丰度。以上结果表明,长双歧杆菌CCFM1240通过调节肠道菌群及其代谢物来有效恢复肠道生物屏障。
2.2.2.2 CCFM1240对雌性便秘大鼠肠道免疫屏障的影响
本文主要针对几个关键炎症因子IL-6、TNF-α、IL-1β进行研究,如图6所示,大鼠便秘造模后,促炎因子IL-6、TNF-α水平显著升高(P<0.05),肠系淋巴结Treg细胞比例显著下降(P<0.01),而IL-1β水平无显著性变化。长双歧杆菌CCFM1240能显著下调IL-6的含量,明显增加Treg比例。雌二醇通过ERβ信号传导增强Foxp3、CD25和GATA3的Treg表达来控制巨噬细胞促炎反应[18]。他莫昔芬诱导会增加细胞凋亡率,抑制ERβ会降低肠系膜淋巴结中Treg比例。综上所述,长双歧杆菌CCFM1240能显著降低促炎因子IL-6含量,增加肠系膜淋巴结中Treg细胞以改善肠道炎症。
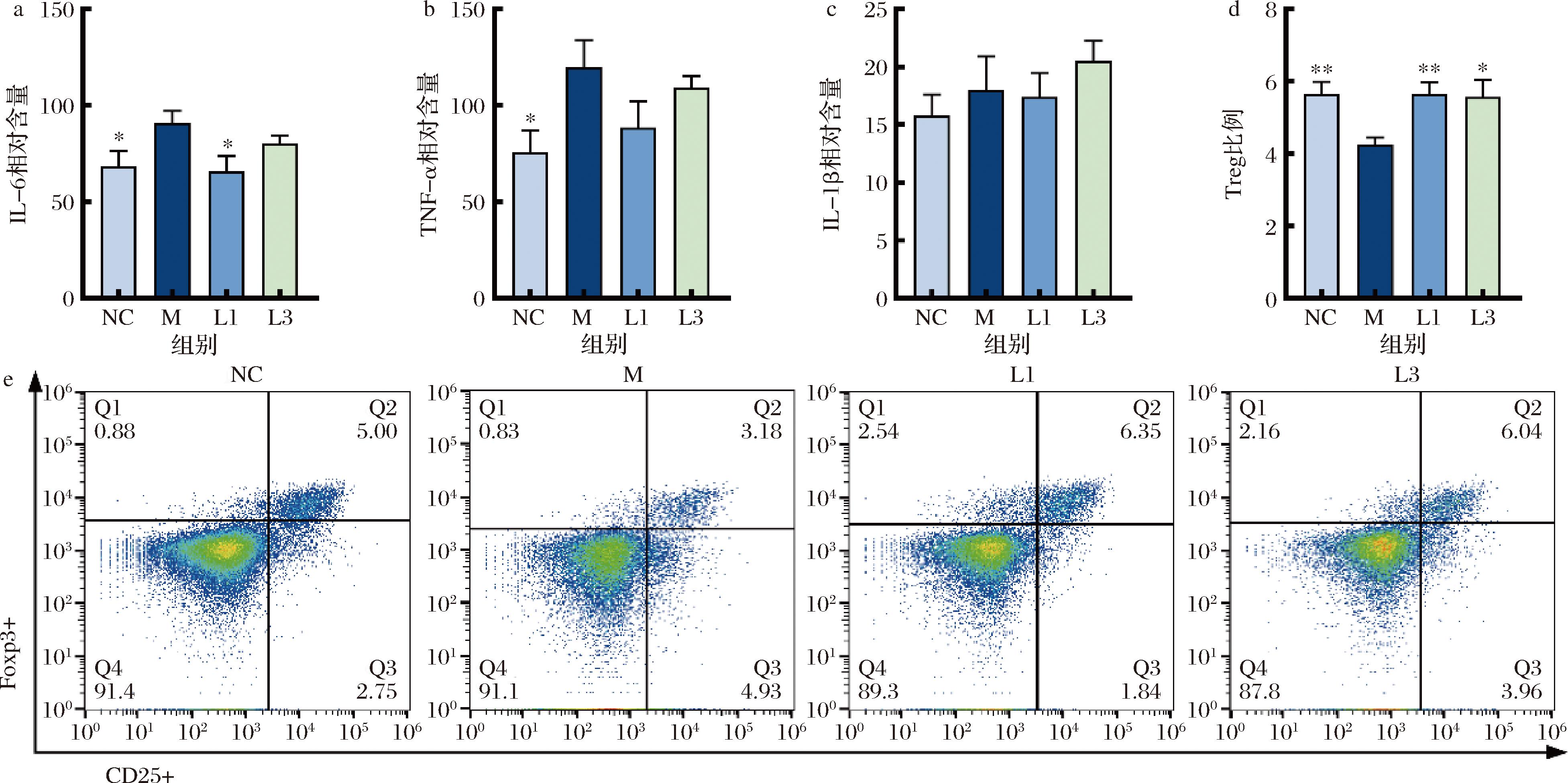
a-IL-6;b-TNF-α;c-IL-1β;d-Treg;e-大鼠肠系淋巴结中 CD4+ CD25+Foxp3+占 T 细胞中的比例
图6 大鼠炎症指标
Fig.6 Indicators of inflammation in rats
2.2.2.3 CCFM1240对雌性便秘大鼠肠道化学屏障的影响
SCFAs可以通过刺激肠上皮细胞生长和液体分泌来加速结肠蠕动[19],主要由微生物发酵碳水化合物或蛋白质产生。通过GC-MS对结肠内容物SCFAs分析,他莫昔芬诱导便秘后SCFAs浓度均显著降低(图7-a)。相较于对照菌株,长双歧杆菌CCFM1240对SCFAs的影响更大,6种短链脂肪酸都有显著提升(P<0.01)。然后,进一步探究SCFAs与肠道微生物之间的相关性(图7-b),结果表明,长双歧杆菌CCFM1240可能是通过提升产SCFAs的微生物丰度来提高SCFAs的浓度。

a-SCFAs;b-SCFAs与菌群相关性分析;c-AQP3;d-AQP4
图7 大鼠结肠中相关基因转录及内容物SCFAs含量和相关性分析
Fig.7 Transcription of related genes and analysis of SCFAs content and correlation in rat colon
水通道蛋白是位于细胞膜上的蛋白质,可协助水的跨膜运输,与粪便含水量有紧密联系。由图7-c和图7-d可知,他莫昔芬造模后,AQP3、AQP4转录水平均显著下调,影响了肠道内水分和离子运输,长双歧杆菌CCFM1240干预能够显著上调AQP3的表达(P<0.05),使得粪便含水量得到明显改善。
2.2.2.4 CCFM1240对雌性便秘大鼠肠道机械屏障的影响
通过结肠H&E染色,观察到正常组结肠组织正常,结肠壁完整,隐窝分化正常,固有层含有丰富的肠腺,杯状细胞排列整齐,模型组中出现炎性浸润淋巴细胞聚集,杯状细胞主要分布在隐窝基底部,U型隐窝减少,黏膜肌层厚度变薄,外肌层未见明显改变。菌株干预下可见杯状细胞明显增多。
MUC1、MUC2均为黏蛋白,能够维护肠道的机械屏障功能。如图8所示,模型组的MUC1表达显著降低(P<0.05),而MUC2表达无显著性变化。这说明他莫昔芬抑制了正常大鼠结肠中MUC1的表达,导致肠道黏液分泌减少。以上结果表明,他莫昔芬给药会造成结肠轻微病理损伤,长双歧杆菌CCFM1240对肠道黏液层损伤起到一定程度修复作用。
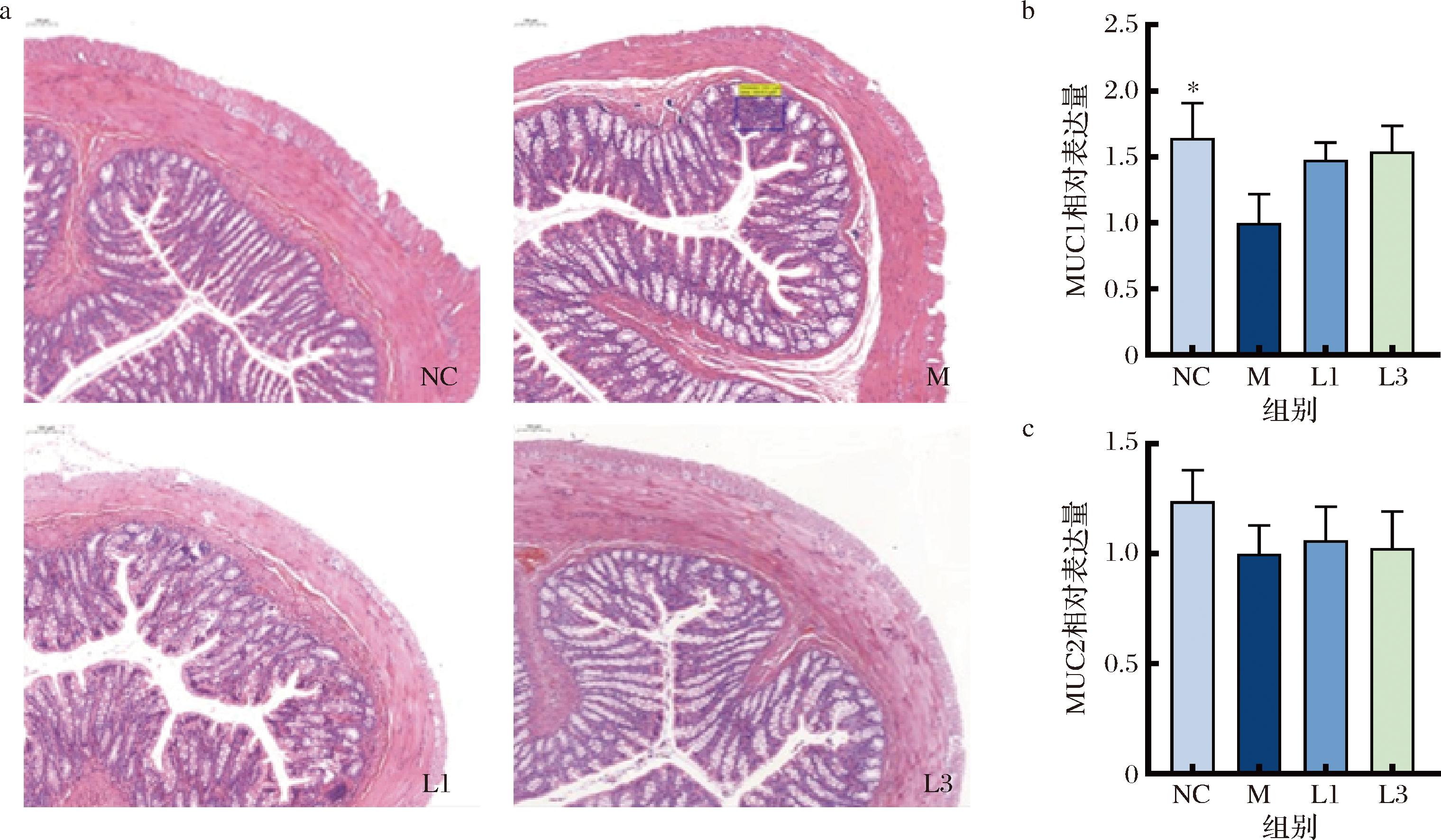
a-结肠H&E染色;b-MUC1;c-MUC2
图8 大鼠结肠H&E染色及黏蛋白转录水平
Fig.8 H&E staining and mucin transcription levels in rat colon
2.3 长双歧杆菌CCFM1240缓解雌性大鼠便秘的相关性分析
为了解析长双歧杆菌CCFM1240缓解女性便秘的可能机制,我们将测量指标、差异菌属与便秘表观指标三者建立相关性。如图9所示,长双歧杆菌CCFM1240显著上调Pediococcus、Mucispirillum的相对丰度,这些菌属与小肠推进率和粪便含水率均呈正相关,Mucispirillum与排首粒黑便时间呈负相关,显著下调Eubacterium coprostanoligenes group、Parabacteroides的相对丰度,这些菌属与小肠推进率和粪便含水率呈负相关,与排首例黑便时间呈正相关。同时,Eubacterium coprostanoligenes group与S100β、结肠Ach呈负相关,与IL-6呈正相关;Ruminiclostridium 9与血清Ach、AQP3呈负相关,与IL-6呈正相关;Ruminococcaceae UCG-010与Treg、AQP3、MUC1呈负相关,与IL-6呈正相关;Oscillibacter与MUC1呈显著负相关,与IL-6、TNF-α呈正相关;Parabacteroides与S100β、Treg、MUC1呈负相关,与IL-6、TNF-α呈正相关;Mucispirillum与6种短链脂肪酸均呈正相关。根据以上相关性分析,我们推测长双歧杆菌CCFM1240干预通过改变肠道菌群,一方面提高6种SCFAs的水平,刺激肠神经系统产生神经递质,从而提高胃肠动力,另一方面通过促进肠道黏蛋白分泌和降低炎症因子水平,减少肠道损伤,修复肠道屏障,达到缓解便秘的效果。
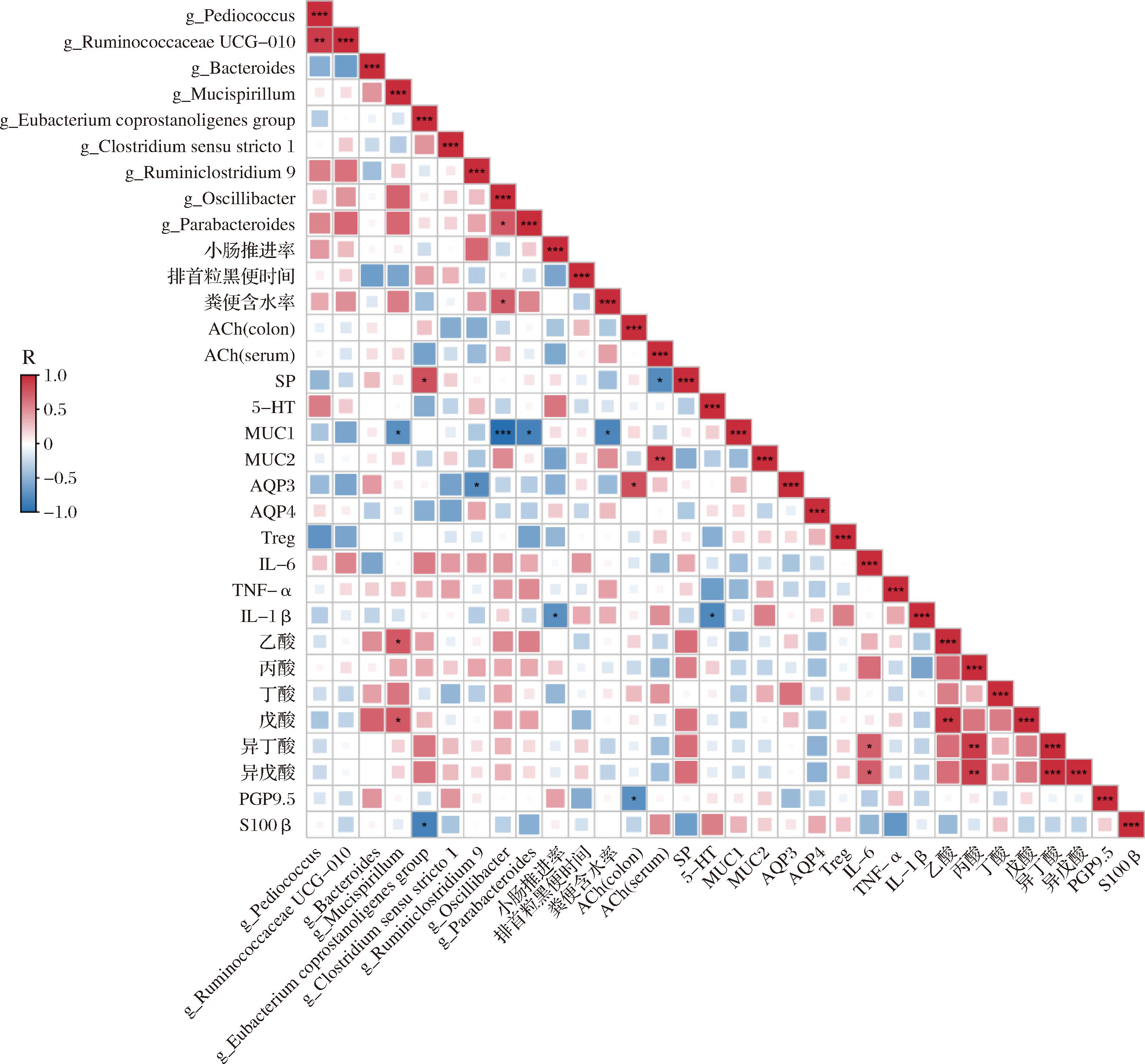
图9 CCFM1240缓解便秘的相关性分析
Fig.9 Correlation analysis of CCFM1240 in relieving constipation
2.4 长双歧杆菌CCFM1240缓解便秘代谢通路的预测
基于16S rRNA基因测序数据结果,使用PICRUSt2进行更深层次的数据挖掘,比较不同组KEGG Pathway,再利用STAMP进行差异分析,筛选出组间有显著差异的pathway。如图10所示,他莫昔芬主要上调了磷酸转移酶系统,从而加速微生物对碳水化合物的运转和代谢[20],葡萄糖被磷酸化,合成多糖,而便秘大鼠肠道微生物结构改变导致体内多糖无法正常降解,同时他莫昔芬下调了脂多糖(lipopolysaccharides,LPS)生物合成。细菌细胞壁成分LPS与胃肠道表达的toll样受体结合异常,直接影响胃肠运动[21]。此外他莫昔芬诱导使得大鼠溶酶体损伤,导致机体产生炎症反应。有效菌属CCFM1240主要增加了铁载体基团非核糖体肽的生物合成、氯环己烷和氯苯的降解以及类固醇激素生物合成。非核糖体肽具有抗菌、抗肿瘤、免疫抑制等多种生物活性[22],说明长双歧杆菌CCFM1240具有免疫修复、解毒的潜力。同时CCFM1240能够促进雌二醇生物合成,在雌二醇信号传导、恢复雌激素受体活性中发挥重要作用。

图10 有效菌株缓解便秘代谢通路预测
Fig.10 Prediction of metabolic pathways for effective bacterial strains to alleviate constipation
3 结论
本研究从肠神经和肠屏障的角度探究了长双歧杆菌CCFM1240缓解雌激素受体β抑制剂诱导的雌性大鼠便秘的效果及可能作用机制。结果表明,长双歧杆菌CCFM1240可缓解由他莫昔芬所诱导的雌性大鼠便秘,其通过调节肠道菌群,提高粪便中SCFAs水平,SCFAs刺激肠神经元分泌ACh等神经递质,从而促进肠蠕动,另一方面则提高Treg细胞比例、降低肠道炎症因子(IL-6)水平修复肠道免疫屏障。本研究也为益生菌缓解女性便秘提供了新的见解。
[1] BHARUCHA A E, LACY B E.Mechanisms, evaluation, and management of chronic constipation[J].Gastroenterology, 2020, 158(5):1232-1249.
[2] VRIESMAN M H, KOPPEN I J N, CAMILLERI M, et al.Management of functional constipation in children and adults[J].Nature Reviews.Gastroenterology &Hepatology, 2020, 17(1):21-39.
[3] CHITKARA D K, TALLEY N J, RICHARD L G, et al.Medical presentation of constipation from childhood to early adulthood:A population-based cohort study[J].Clinical Gastroenterology and Hepatology, 2007, 5(9):1059-1064.
[4] PAN R L, WANG L L, XU X P, et al.Crosstalk between the gut microbiome and colonic motility in chronic constipation:Potential mechanisms and microbiota modulation[J].Nutrients, 2022, 14(18):3704.
[5] KHUITUAN P, HUIPAO N, JEANMARD N, et al.Sargassum plagiophyllum extract enhances colonic functions and modulates gut microbiota in constipated mice[J].Nutrients, 2022, 14(3):496.
[6] TANG T, WANG J, JIANG Y Y, et al.Bifidobacterium lactis TY-S01 prevents loperamide-induced constipation by modulating gut microbiota and its metabolites in mice[J].Frontiers in Nutrition, 2022, 9:890314.
[7] 曹永强, 张健, 郑喆, 等.副干酪乳杆菌N1115发酵乳对小鼠便秘的改善作用[J].食品科学, 2018, 39(1):185-191.CAO Y Q, ZHANG J, ZHENG Z, et al.Therapeutic effect of Lactobacillus paracasei N1115 fermented milk in constipated mice[J].Food Science, 2018, 39(1):185-191.
[8] 梅春霞, 王嘉良, 唐楠, 等.应用雌激素受体β抑制剂建立肠道屏障受损的便秘动物模型[J].食品与发酵工业, 2024, 50(5):35-41.MEI C X, WANG J L, TANG N, et al.Establishment of constipation animal model with impaired intestinal barrier by estrogen receptor β inhibitors[J].Food and Fermentation Industries, 2024, 50(5):35-41.
[9] 毛丙永. 功能性低聚糖对肠道细菌的影响及机制[D].无锡:江南大学, 2015.MAO B Y.Effect and mechanism of functional oligosaccharides on intestinal bacteria [D].Wuxi:Jiangnan University, 2015.
[10] LI Y, LI Y R, JIN Y, et al.Involvement of enteric glial cells in colonic motility in a rat model of irritable bowel syndrome with predominant diarrhea[J].Journal of Chemical Neuroanatomy, 2023, 128:102235.
[11] 张程程. 中国不同地区人群肠道中长双歧杆菌的生理特性及肠道调节功能分析[D].无锡:江南大学, 2021.ZHANG C C.Analysis of physiological characteristics and intestinal regulation function of Bifidobacterium longum in different areas of China[D].Wuxi:Jiangnan University, 2021.
[12] LI B, LI M, LUO Y N, et al.Engineered 5-HT producing gut probiotic improves gastrointestinal motility and behavior disorder[J].Frontiers in Cellular and Infection Microbiology, 2022, 12:1013952.
[13] JIN B, HA S E, WEI L, et al.Colonic motility is improved by the activation of 5-HT2B receptors on interstitial cells of Cajal in diabetic mice[J].Gastroenterology, 2021, 161(2):608-622.
[14] LI T J, YU B P, DONG W G, et al.Ovarian hormone modulates 5-hydroxytryptamine 3 receptors mRNA expression in rat colon with restraint stress-induced bowel dysfunction[J].World Journal of Gastroenterology, 2004, 10(18):2723-2726.
[15] KASHYAP P C, MARCOBAL A, URSELL L K, et al.Complex interactions among diet, gastrointestinal transit, and gut microbiota in humanized mice[J].Gastroenterology, 2013, 144(5):967-977.
[16] FUNG T C, VUONG H E, LUNA C D G, et al.Intestinal serotonin and fluoxetine exposure modulate bacterial colonization in the gut[J].Nature Microbiology, 2019, 4(12):2064-2073.
[17] SCHLUTER J, PELED J U, TAYLOR B P, et al.The gut microbiota is associated with immune cell dynamics in humans[J].Nature, 2020, 588(7837):303-307.
[18] XIONG Y, ZHONG Q, PALMER T, et al.Estradiol resolves pneumonia via ERβ in regulatory T cells[J].JCI Insight, 2021, 6(3):e133251.
[19] LIU W X, LUO X L, TANG J, et al.A bridge for short-chain fatty acids to affect inflammatory bowel disease, type 1 diabetes, and non-alcoholic fatty liver disease positively:By changing gut barrier[J].European Journal of Nutrition, 2021, 60(5):2317-2330.
[20] DEUTSCHER J, FRANCKE C, POSTMA P W.How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria[J].Microbiology and Molecular Biology Reviews, 2006, 70(4):939-1031.
[21] ZHENG Z P, TANG J Y, HU Y N, et al.Role of gut microbiota-derived signals in the regulation of gastrointestinal motility[J].Frontiers in Medicine, 2022, 9:961703.
[22] 姜继鹏, 孙亚楠, 张晨晨, 等.非核糖体肽的生物合成研究进展[J].中国生物工程杂志, 2023, 43(8):86-99.JIANG J P, SUN Y N, ZHANG C C, et al.Advances in the biosynthesis of nonribosomal peptide[J].China Biotechnology, 2023, 43(8):86-99.