冰酒是一种特殊的甜型葡萄酒,是在-8 ℃以下由葡萄树上自然冷冻的葡萄果实酿造而成,因其独特的风味特征备受推崇,素有“酒中极品”、“液体黄金”之美誉[1-2]。威代尔是酿造冰酒的典型品种,其冰酒酒样中挥发性香气成分主要为醇类、酯类、萜烯类和呋喃类化合物,具有玫瑰、蜂蜜、干果及热带水果香味[3-4]。
香气是冰酒品质的重要体现,也是当下葡萄酒研究的热点[5-6]。在葡萄酒发酵过程中,非酿酒酵母发挥着重要作用,产生的高级醇、酯、醛等代谢物质显著影响葡萄酒的香气品质[7],在塑造葡萄酒的香气特征和增强葡萄酒复杂性方面起着积极作用[8]。李红玉等[9]通过将葡萄汁有孢汉逊酵母与安琪酿酒酵母混合发酵‘美乐’和‘赤霞珠’葡萄发现,与安琪酵母单独发酵组相比,葡萄汁有孢汉逊酵母的参与使2种葡萄酒的香气物质含量分别增加51.42%和48.40%,还提高了特征香气物质酯类的香气活力值(odor activity value, OAV);GE等[10]用5株本土非酿酒酵母与F33酿酒酵母混合发酵威代尔冰葡萄酒发现,克拉通覆膜孢酵母YC30与F33同时发酵显著提高了槲皮素、绿原酸和对羟基苯甲酸等单体酚的浓度,且产生了明显的花香和果香香气。目前,针对不同非酿酒酵母与酿酒酵母混合发酵对葡萄酒品质的影响,以及发酵结束后的香气变化的研究较多[11-12],但有关非酿酒酵母单独发酵和发酵过程中香气的变化研究仍相对有限。
在先前工作中,已经优选出了2株能够增强威代尔冰葡萄酒花香味和甜果味香气特征的非酿酒酵母克拉通覆膜孢酵母(Saccharomycopsis crataegensis, Sc)和葡萄汁有孢汉逊酵母(Hanseniaspora uvarum, Hu)[13]。因此,本试验以威代尔冰葡萄为原料,利用本实验室分离优选的2株本土非酿酒酵母分别单独进行发酵,并对发酵过程中不同阶段产生的单体酚和香气成分进行测定分析,研究不同非酿酒酵母单独发酵对冰葡萄酒香气化合物的影响,以期为探究冰葡萄酒发酵过程中风味特征的变化提供理论依据。
1 材料与方法
1.1 材料与试剂
原料:2022年威代尔冰葡萄(种植于宁夏省银川市永宁县玉泉营,由宁夏巴格斯醉美国际酒庄有限公司提供),还原糖340 g/L。
酵母:Hu、Sc,保藏于宁夏农产品质量标准与检测技术研究所。
试剂及标准品:甲醇(色谱纯)、二氯甲烷(色谱纯)、异丙醇、乙腈,美国Sigma-Aldrich公司;表儿茶素、阿魏酸、香草酸、绿原酸、芳樟醇、乙酸乙酯、异丁酸乙酯(纯度均为98%以上),德国默克公司。
1.2 仪器与设备
Milli-Q/Gradient超纯水系统、AOC-6000三合一顶空固相微萃取自动进样器,美国Millipore公司;GC2030-TQ8050 NX气相色谱质谱联用仪,日本Shimadzu公司;Alliance 2695高效液相色谱仪,沃特氏中国公司;SX-500A高压蒸汽灭菌锅,日本KAGOSHIMA公司;ST-50H型恒温摇床,冠森生物科技上海公司。
1.3 实验方法
1.3.1 理化指标的测定
葡萄汁及葡萄酒中总糖、总酸、乙醇体积分数的测定依据GB/T 15038—2006《葡萄酒、果酒通用分析方法(含第1号修改单)》。
1.3.2 冰葡萄酒发酵工艺
葡萄汁的发酵过程参考GE等[13]的方法,并进行适度改进。首先,将2株非酿酒酵母菌株经过活化后,分别接种到已经过杀菌处理的100 mL葡萄汁中(杀菌条件为100 ℃,10 min)。随后,在28 ℃下进行摇床培养4~5 h,使得菌株能够初步适应葡萄汁环境。随后,按照3%的接种量将种子液接入150 mL灭菌葡萄汁中,在摇床上培养约24 h(28 ℃,2.5×g)。发酵液中的菌种生物量达到106 CFU/mL时,将其转移到含有350 mL灭菌葡萄汁的500 mL三角瓶中。在18 ℃下于培养箱中静置培养约18 d,直至发酵液连续3 d失重不再发生变化。发酵结束后,对所有葡萄酒样品进行离心处理5 min(4 000×g,4 ℃),弃去沉淀物,将上清液保存于-20 ℃待测。
1.3.3 发酵过程中的取样
生物量测定:在第1、2、3、5、7、9、11、13、15、18天取1 mL菌液,在WL培养基上进行菌落计数,计算菌株生物量。
单体酚测定:葡萄汁接种酵母2 h后采样,记为发酵第0天,之后分别在发酵第1、2、3、4、5、10、18天采样,共7个采样点。
香气物质测定:葡萄汁接种酵母后,分别在发酵第1、3、5、7、9、11、13、18天采样,共8个采样点。
1.3.4 单体酚的测定[14]
使用Waters xTerra MS C18反向色谱柱,(250 mm×4.6 mm,5 μm)。流动相A为2%乙酸水溶液(体积比),流动相B为由0.5%乙酸与乙腈按50∶50(体积比)混合而成的溶液。洗脱过程按如下梯度进行:在0~50 min,流动相A从10%逐渐增加至55%;随后在50~60 min,流动相A从55%增加至100%;接着在60~65 min,流动相A从100%减少至10%;最后在65~75 min,保持流动相A为10%。柱温30 ℃,流速0.8 mL/min,进样量 20 μL。检测波长设置为280 nm用于黄烷-3-醇类和二氢查耳酮类,320 nm用于羟基肉桂酸类,360 nm用于黄酮醇类。定性分析采用目标化合物与标准品的保留时间比对方法,而定量分析则采用峰面积外标定量法。
1.3.5 香气物质的测定[15]
顶空固相微萃取:称取2 g NaCl、8 mL酒样、10 μL质量浓度为394.08 μg/L的4-甲基-1-戊醇内标物依次置于20 mL顶空瓶中,加盖密封;将CAR/DVB/PDMS萃取纤维头插入顶空瓶中,于45 ℃吸附30 min后,在进样口解吸3 min(250 ℃)。
色谱条件:使用InertCap WAX极性色谱柱(60 m×0.25 mm,0.25 μm);载气为He(99.999%),流速0.8 mL/min;升温程序如下:起始柱温40 ℃,恒温5 min,以3 ℃/min的速率升至120 ℃,再以8 ℃/min升至230 ℃,恒温10 min。
质谱条件:离子源温度230 ℃,电子能量70 eV,传输线温度275 ℃,质谱扫描范围33~450 u。
定性定量分析:以C6~C32烷烃作为基准,用Kovats法计算所有香气成分的保留指数以进行定性分析,并与文献报道比对确认。对有标品的香气组分采用外标定量法进行分析,没有标品的香气组分以4-甲基-1-戊醇作为内标物质进行半定量分析。
1.4 数据分析
使用Excel 2016对数据进行统计分析,Origin 2023b RS1、TBtools(https://github.com/CJ-Chen/TBtools)、R语言进行主成分分析(principal components analysis, PCA)图、堆积图、热图的绘制,利用SIMCA进行正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA)。所有指标均重复测定3次。
2 结果与分析
2.1 理化指标分析
威代尔冰葡萄汁(发酵第0天)和不同非酿酒酵母于发酵第18 d酒样的基本理化特性如表1所示。除总酸外,所有酒样的总糖和乙醇体积分数在组间差异显著(P<0.05)。与冰葡萄汁相比,由Hu和Sc发酵酒样的总糖含量下降了87.03%~87.42%,且生成乙醇浓度均较低,这与LANGENBERG等[16]的研究结果相符。此外,Hu组乙醇产量较低可能是由于发酵过程中其胞内丙酮酸激酶活性降低所致[16],而有关Sc组酒样乙醇降低的具体原因还有待进一步研究。
表1 冰葡萄汁及发酵酒样的基本理化指标
Table 1 Physicochemical characteristics of vidal ice wine juice and fermented wine samples

酒样总糖/(g/L)总酸/(g/L)乙醇体积分数/%葡萄汁336.00±33.88a6.09±0.56a0±0bHu-18d42.26±3.46b5.97±0.10a7.66±0.53aSc-18d43.58±3.72b5.45±0.48a7.46±0.17a
注:Hu-18d代表添加Hu在发酵第18天的酒样;Sc-18d代表添加Sc在发酵第18天的酒样。同列内不同字母代表差异显著(P<0.05)。
2.2 不同非酿酒酵母发酵过程中菌种数量的变化
如图1所示,Hu的数量呈先上升后下降的趋势,在第5天达到最大数量(7.05 lg CFU/mL);而Sc的生物量逐渐上升,在发酵第16天达到最高(6.76 lg CFU/mL)。可明显看出,在发酵前中期,Hu的生物量始终高于Sc;而在发酵后期时,Sc数量略高于Hu,但两者相差不大,几乎都稳定在106CFU/mL,直至发酵结束。可见,Hu繁殖速率更快,其发酵能力总体强于Sc,这与GE等[13]的研究结果一致。
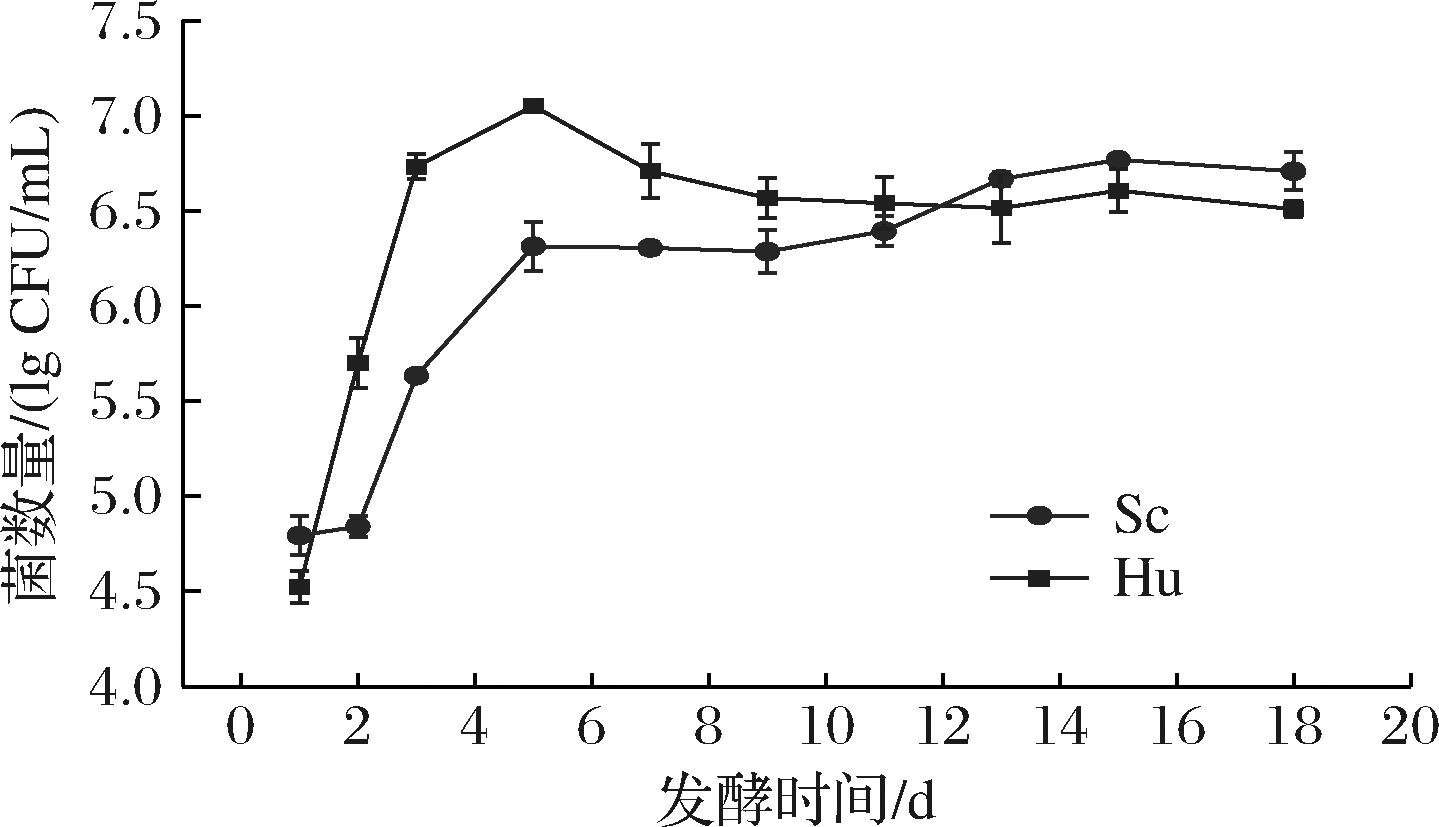
图1 发酵过程中2株非酿酒酵母的生长曲线
Fig.1 Growth curves of two non-Saccharomycesyeast strains during fermentation
2.3 不同非酿酒酵母发酵过程中威代尔冰酒多酚含量的变化
多酚化合物由多种次生代谢产物组成,是存在于葡萄和葡萄酒中的重要成分。葡萄酒中的酚类物质及其衍生物主要包括酚酸类、黄烷醇类、黄酮醇类、香豆素、木脂素、单宁等[17-18]。这些酚类物质的变化直接关系到葡萄酒的感官性质,例如香气成分、颜色深浅、苦涩度以及风味品质等[19]。葡萄酒中多酚组成和含量受葡萄品种、栽培方式、生长环境、成熟度、酿造工艺等多方面影响[20]。
2.3.1 不同非酿酒酵母发酵过程中威代尔冰酒多酚总量的变化
葡萄汁中多酚总量为24.501 mg GAE/L,在酒精发酵过程中,威代尔冰酒总酚含量的变化如图2所示。由Sc和Hu发酵冰酒中的多酚总量均高于葡萄汁,其中发酵第3天时,添加Sc、Hu两组冰酒中的总酚含量分别是葡萄汁中的1.6倍、2.2倍。发酵过程中2种冰酒发酵液中总酚含量变化较大,总体上呈现先上升再下降的趋势。在发酵初始阶段,发酵液中的总酚逐渐被浸提出来,致使酒体内总酚含量逐渐升高,这可能是由于发酵液中酒精含量不断增加以及大量CO2的产生利于多酚浸入酒液[21]。此外,添加Sc、Hu的2组冰酒的多酚含量分别在发酵第1天、第3天时达到峰值,与发酵第0天时相比分别增加了1.6%、24%,之后逐渐降低,至发酵终止趋于平缓,这可能是单宁类等物质发生聚合以及在发酵过程中多酚发生自然氧化的结果[19]。除此之外,在发酵过程中Hu组多酚总量始终高于Sc组,可推测Hu比Sc产多酚能力更佳。
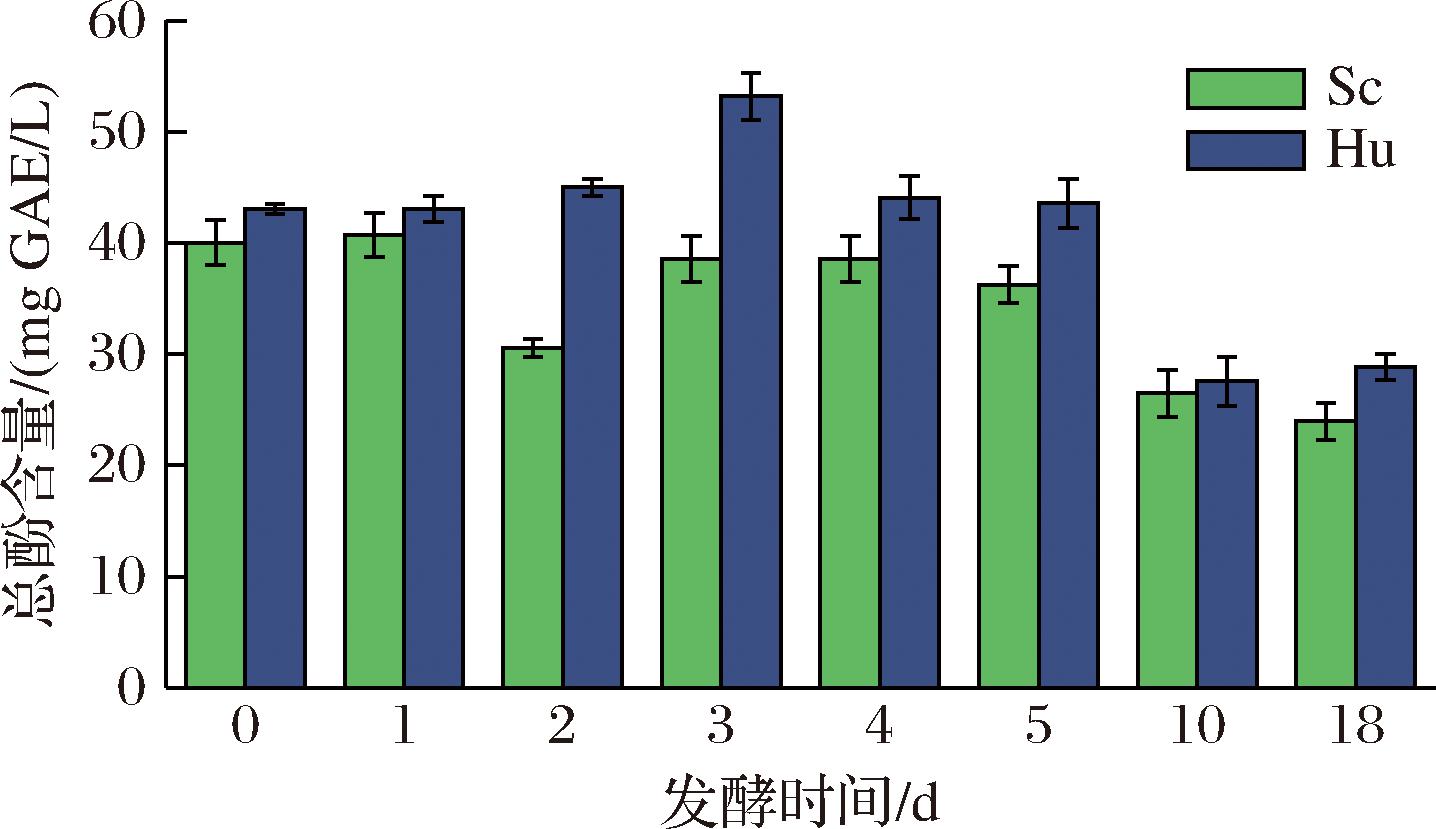
图2 不同发酵策略下威代尔冰酒中的多酚总量
Fig.2 Total polyphenols in Vidal icewine under different fermentation strategies
2.3.2 不同非酿酒酵母发酵过程中威代尔冰酒单体酚含量的变化
为进一步了解Sc和Hu发酵威代尔冰酒过程中酚类物质含量的变化,对测得的16种酚类物质进行聚类分析。
如图3-a所示,16种单体酚主要被分为2类:绿原酸、香草酸、表儿茶素、原儿茶素和芦丁为一类,其余11种单体酚为一类。不同非酿酒酵母发酵过程中主要的单体酚为绿原酸、香草酸和原儿茶素。除此之外,阿魏酸在Sc发酵第18天时含量相对较高,是Hu的2.6倍。由图3-b可知,对于Sc组冰酒而言,表儿茶素和芦丁都在发酵第4天达到最大值,绿原酸、原儿茶素和香草酸则分别在发酵第1天、第2天和第18天达到最大值;如图3-c可知,在Hu组冰酒中,原儿茶素、表儿茶素和芦丁均在发酵第3天达到最大值,绿原酸和香草酸则分别在发酵第5天和第18天达到最大值。
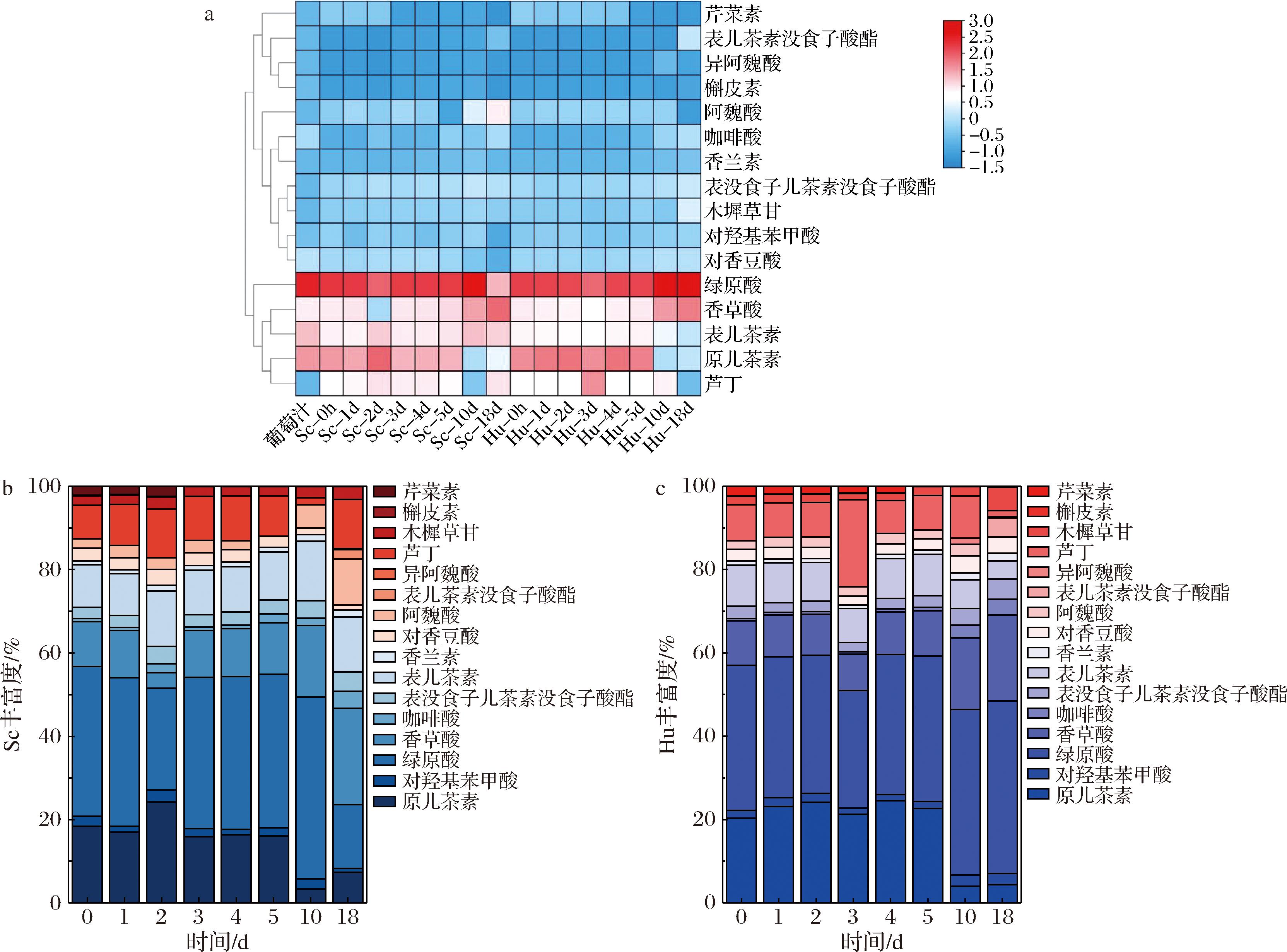
a-聚类热图;b-Sc堆积图;c-Hu堆积图
图3 不同发酵策略下威代尔冰酒单体酚聚类热图及堆积图
Fig.3 Heat map and stacked plot of monomeric phenols in Vidal ice wine under different fermentation strategies
2.4 不同非酿酒酵母发酵过程中威代尔冰酒香气化合物组分分析
2.4.1 挥发性香气物质种类与含量分析
采用顶空-固相微萃取-气相色谱-质谱(headspace solid phase micro-extraction gas chromatography-mass spectrometry, HS-SPME-GC-MS)对不同酵母发酵的威代尔冰酒样本进行综合分析[14,22-23],结果如图4所示。在所有发酵过程中的冰葡萄酒样中共检测到387种挥发性香气化合物,其中醇类物质共85种、乙基酯类19种、乙酸酯类17种、其他酯类26种、酸类18种、酚醛类17种、萜烯类6种、酮类22种、烷烃类46种、醚类6种、呋喃类3种、苯酚类3种、其他类119种。由图4可知,在Sc和Hu所酿冰酒发酵过程中,醇类、酯类、醛酮类香气物质均占比较高,且都在发酵第11天时香气物质总量达到最大值,分别是发酵第1天的3.6倍、1.2倍和2.8倍。其中,添加Hu的冰酒在发酵过程中,醇类、酮类、乙基酯类及乙酸酯类是最主要的香气物质,并且除乙酸酯类外,其他3类香气物质均在发酵第5天达到峰值,与发酵第1天相比分别增加了120.8%、121.8%、2 944.8%,乙酸酯类在发酵第3天达到最大值,与第1天相比增加了8 091.5%(图4-a);Sc组冰酒在发酵过程中,醇类、醛酮类是最主要的香气物质,且均在发酵第3天达到最大值,分别是发酵第1天的1.2倍和1.12倍(图4-b)。另外,除第1天外,由Hu发酵的冰酒在发酵过程中香气物质总量均远高于Sc组。
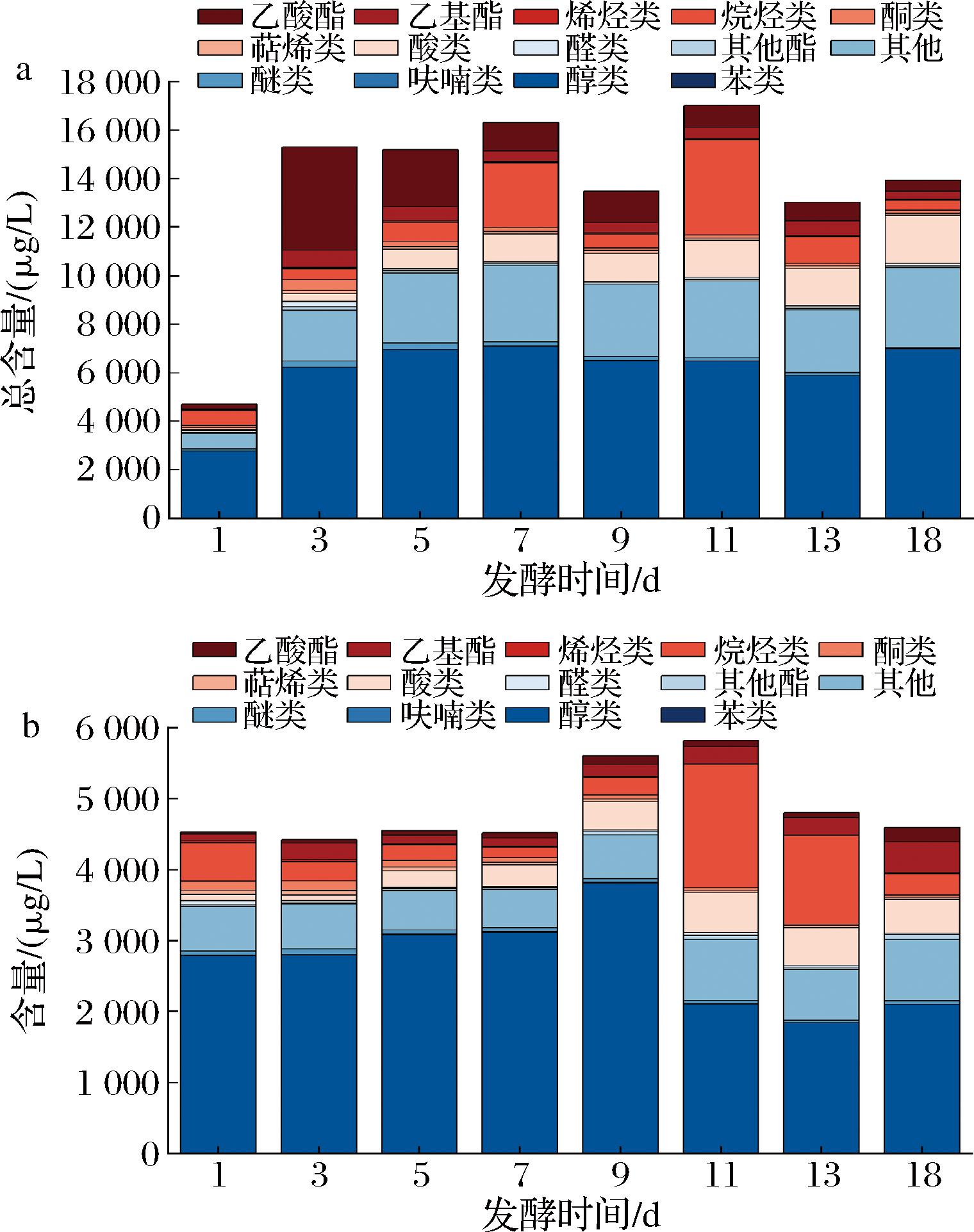
a-Hu;b-Sc
图4 两株非酿酒酵母所酿威代尔冰酒挥发性香气物质组成
Fig.4 Composition of volatile aroma compounds in Vidal ice wine fermented by two non-Saccharomyces yeast strains
2.4.2 OAV分析
当葡萄酒中挥发性物质浓度大于其气味阈值时,认为该物质具有香气活性,有助于葡萄酒香气特征的形成,将其比值称为OAV[24]。本研究中不同非酿酒酵母发酵的冰酒中共24种挥发性香气物质OAV>1,主要包括酯类、醇类和醛酮类。由图5可知,由Hu所酿冰酒的OAV>1的香气物质含量整体上远高于Sc组,且呈现先上升后下降的趋势,在发酵第3天达到最大值,是Sc组的3倍。Hu所酿冰酒在发酵过程中乙酸异戊酯香气活性较高,约为Sc组的12倍,可赋予冰酒水果味和甜味[25]。此外,正庚醇(油腻味)、甲基庚烯酮(水果香气、新鲜清香)、庚酸乙酯(水果香、脂肪味)、辛酸乙酯(菠萝、梨、花香)和乙酸苯乙酯(舒适的花香味)[26-27]仅在Hu发酵组中存在,1-戊醇(类似酒精味)、异戊醛(香蕉、葡萄香味)、2-甲基丁酸(干酪味、酸果香风味)和戊酸乙酯(较明显脂肪臭,菠萝果香气)[28]仅在Sc发酵组中存在。
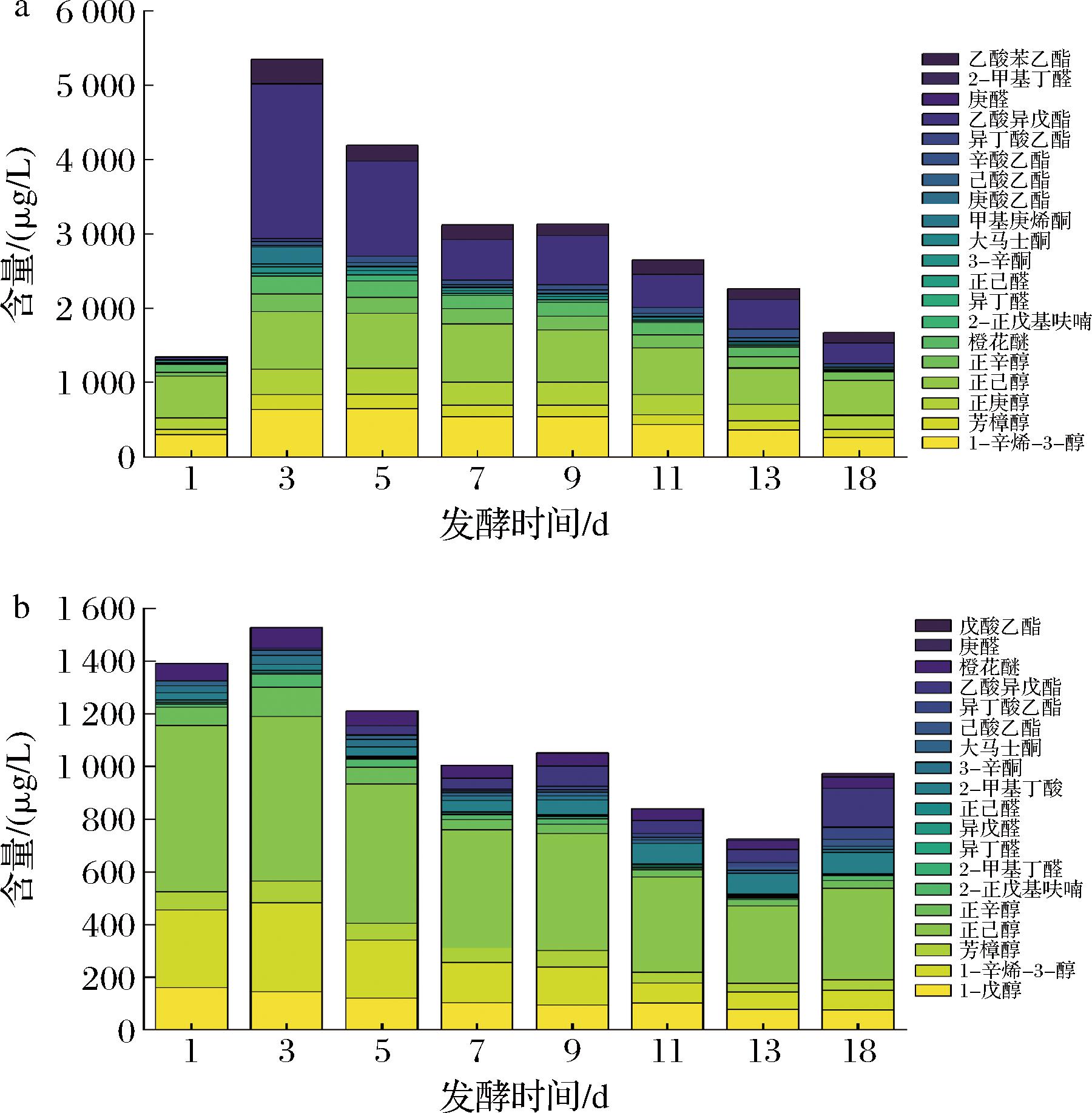
a-Hu;b-Sc
图5 两株非酿酒酵母所酿冰酒香气活性分析(OAV>1)
Fig.5 Aroma activity analysis of ice wine fermented by two non-Saccharomyces yeast strains (OAV>1)
2.4.3 PCA
对冰酒发酵过程中OAV>1的香气物质进行PCA,其中Hu组结果中PC1的贡献率为53.15%,PC2的贡献率为28.66%;Sc组中PC1的贡献率为77.12%,PC2的贡献率为10.43%(图6)。PCA表明,前2个主成分的总贡献率分别达到81.81%、87.55%,基本包含了主要指标的具体信息,可用来进行后续分析[29]。
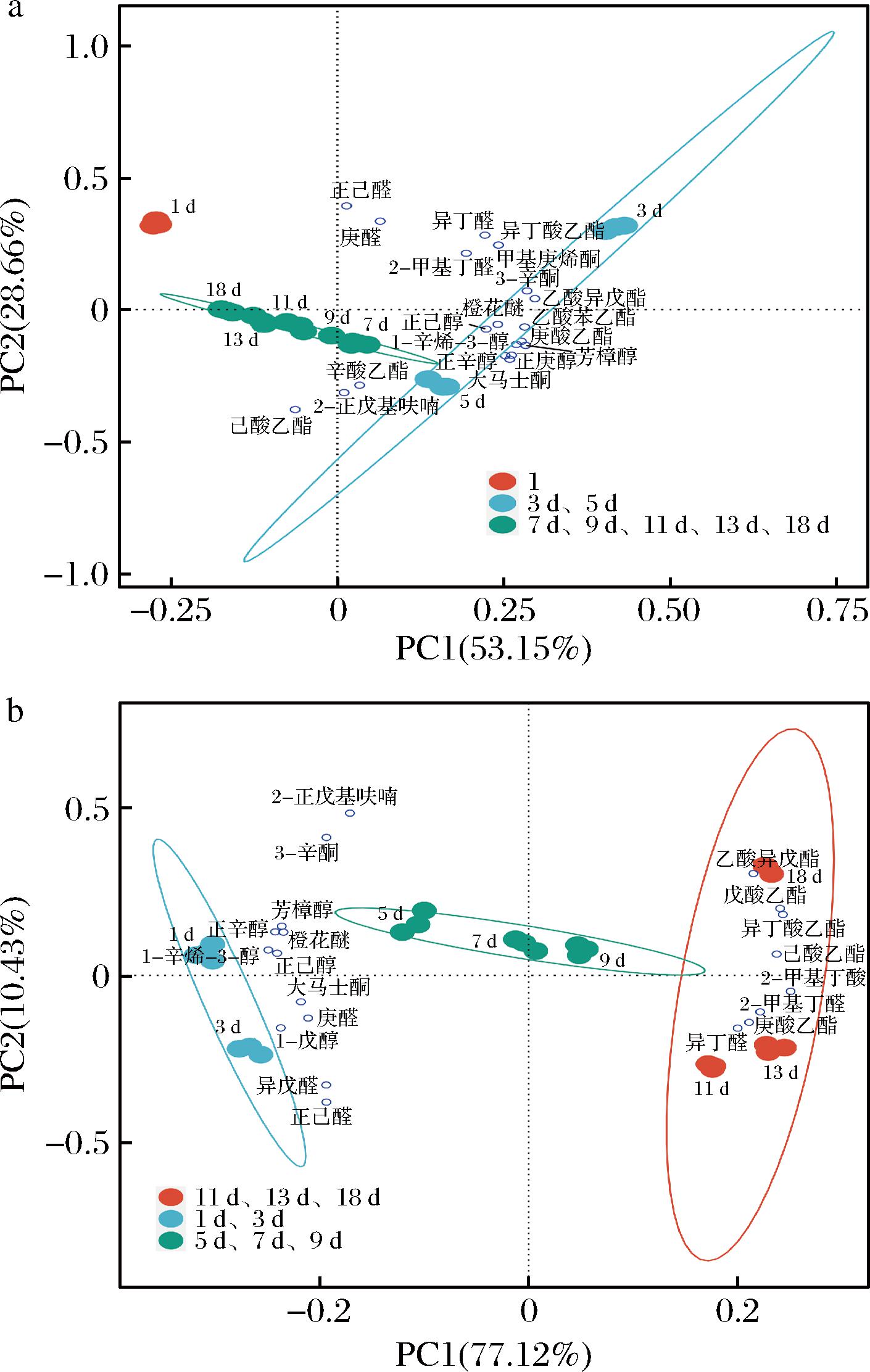
a-Hu;b-Sc
图6 两株非酿酒酵母发酵过程中挥发性香气化合物PCA图
Fig.6 PCA plots of volatile aroma compounds during fermentation of two non-Saccharomyces yeast strains
由图6-a可知,Hu所发酵冰酒在发酵初期(1、3、5 d)香气物质出现分化,在发酵中后期(7、9、11、13、18 d)样本较为聚集,说明在发酵初始阶段发酵液中的挥发性香气物质的种类与数量变化较为显著,发酵5 d后发酵液中的香气物质趋于一种较为稳定的状态,这与前人[6,30-31]的研究一致;其中,发酵第1天与庚醛、正己醛相关性较大,发酵第3天主要与异丁酸乙酯、乙酸异戊酯、芳樟醇、乙酸苯乙酯、甲基庚烯酮、异丁醛、3-辛酮等相关,发酵第5天主要与己酸乙酯、2-正戊基呋喃、辛酸乙酯、大马士酮、正庚醇、庚酸乙酯等相关,发酵中后期香气物质变化相对较小,几乎不影响冰酒的香气主体。从图6-b可看出,Sc所酿冰酒发酵过程可分为前期(1、3 d)、中期(5、7、9 d)、后期(11、13、18 d)3个阶段;其中发酵前期主要与1-辛烯-3-醇、1-戊醇、正辛醇、芳樟醇、橙花醚、正己醇、大马士酮等相关,发酵中期产生香气物质含量较低,这可能是由于在此阶段发酵液中香气成分正处于转化状态所致[32-33],发酵后期主要与乙酸异戊酯、戊酸乙酯、异丁酸乙酯、己酸乙酯、2-甲基丁酸、2-甲基丁醛、庚酸乙酯、异丁醛相关。总体来说,Sc和Hu 2种非酿酒酵母在发酵过程中产生挥发性香气成分的变化趋势有相似之处但也存在较大差异,这与马云青等[31]的研究结果一致。
2.4.4 OPLS-DA模型分析
在PCA的基础上,以OAV>1的香气物质为因变量,不同非酿酒酵母发酵过程中的酒样为自变量,通过OPLS-DA(图7-a)可以实现对2株非酿酒酵母发酵酒样的有效区分。本次试验模型中R2x=0.963、R2y=0.987、Q2=0.982,R2和Q2超过0.5表示模型拟合结果良好[34]。如图7-b所示,经过200次置换检验,Q2回归线与纵轴交点小于0,表明模型无过拟合,验证有效。为进一步分析不同香气成分对区分不同非酿酒酵母发酵威代尔冰酒过程中酒样的贡献率,以变量投影重要性(variable importance projection, VIP)>1为筛选标准[35],筛选出7种在Hu和Sc发酵过程中的差异香气物质(图7-c),包括酯类2种(乙酸异戊酯、乙酸苯乙酯)和醇类5种(1-辛烯-3-醇、正庚醇、正己醇、正辛醇和1-戊醇)。其中乙酸异戊酯VIP值最高,呈果香[10]。此外,由图7-c可看出,除1-戊醇在Sc发酵过程中含量较为突出外,其余6种物质在Hu中含量均较高。
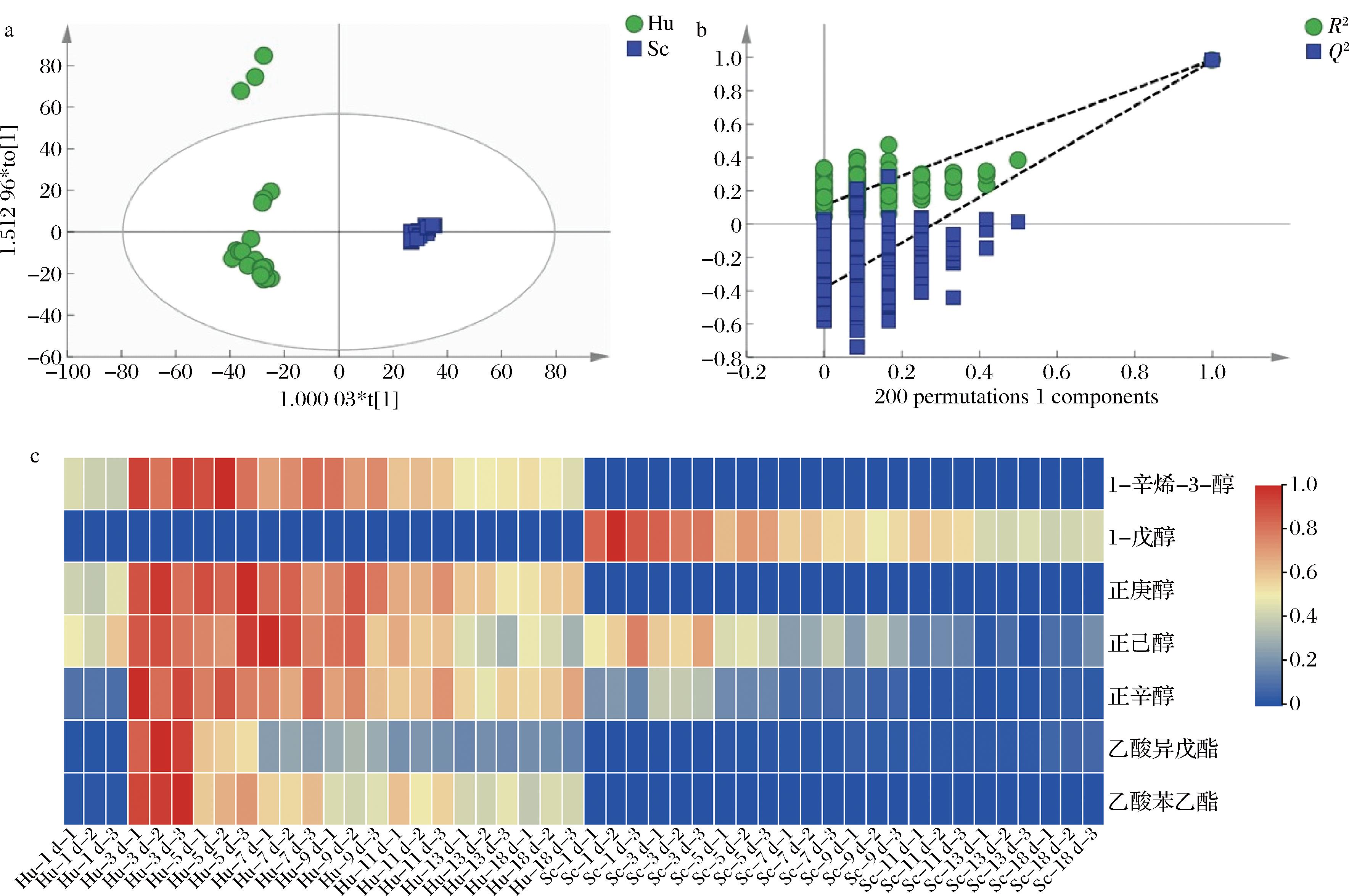
a-OPLS-DA;b-模型置换检验图;c-差异挥发性香气物质热图
图7 两株非酿酒酵母发酵过程中挥发性香气化合物OPLS-DA、模型置换检验图和差异挥发性香气物质热图
Fig.7 OPLS-DA, model permutation test plot, and heat map of differential volatile aroma compounds during the fermentation of two non-Saccharomyces yeasts
3 结论
本试验选用本实验室前期优选的2株非酿酒酵母:Hu和Sc分别单独发酵威代尔冰葡萄酒,结果显示,与葡萄汁相比,由这2株非酿酒酵母所酿冰酒在发酵过程中多酚总量显著提高,且Hu组多酚总量始终高于Sc组。在发酵过程中,2组冰酒中共检测到24种OAV>1的挥发性香气物质,主要包括醇类、酯类和醛酮类。Hu组中OAV>1的香气物质整体含量显著高于Sc组,且在发酵第3天达到最大值,为5.34 mg/L。PCA结果显示,Sc组发酵前期主要与1-辛烯-3-醇、1-戊醇等醇类物质相关,发酵后期主要与乙酸异戊酯、戊酸乙酯等酯类物质相关;Hu组在发酵初期香气物质变化显著,主要与乙酸异戊酯、芳樟醇、乙酸苯乙酯等物质相关,发酵中后期样本较为聚集,挥发性化合物趋于稳定状态,几乎不影响冰酒的主体香气。进一步通过OPLS-DA模型分析并结合VIP值,筛选出7种特征香气物质,可对2株非酿酒酵母发酵过程中酒样进行区分。其中差异最显著的香气物质是乙酸异戊酯,该物质在Hu组发酵前期(3、5 d)酒样中含量较高,可为发酵冰酒带来甜味和果香味。
总体而言,与Sc相比,Hu表现出更强的繁殖能力和产多酚能力,同时在发酵过程中产生的香气物质含量更高,在一定程度上更能提升冰酒风味。后续研究将深入探讨这2株非酿酒酵母的产香机制,并进一步确定不同非酿酒酵母发酵冰酒的感官特性,为冰葡萄酒发酵工艺的创新和优化提供坚实的科学基础。
[1] BOWEN A J, REYNOLDS A G.Aroma compounds in Ontario Vidal and Riesling icewines.I.Effects of harvest date[J].Food Research International, 2015, 76:540-549.
[2] 王蓓, 唐柯, 聂尧, 等.搅拌棒吸附萃取-气质联用分析威代尔冰葡萄酒挥发性成分[J].食品与发酵工业, 2012, 38(11):131-137.WANG B, TANG K, NIE Y, et al.Stir bar sorptive extraction-GC-MS for the analysis of volatile compounds in vidal icewine[J].Food and Fermentation Industries, 2012, 38(11):131-137.
[3] 李艳霞, 马丽艳, 战吉成, 等.威代尔冰葡萄酒香气测定[J].中外葡萄与葡萄酒, 2006(3):10-15.LI Y X, MA L Y, ZHAN J C, et al.Analysis on aromatic compounds in vidal icewine[J].Sino-Overseas Grapevine &Wine, 2006(3):10-15.
[4] 马玥. 威代尔冰葡萄酒关键香气组分及其对冰酒感官贡献的研究[D].无锡:江南大学, 2015.MA Y.The key aroma compounds of Vidal icewine and their contribution to the icewine sensory characteristic[D].Wuxi:Jiangnan University, 2015.
[5] HUANG L, MA Y, TIAN X, et al.Chemosensory characteristics of regional Vidal icewines from China and Canada[J].Food Chemistry, 2018, 261:66-74.
[6] 唐柯, 张小倩, 李记明, 等.威代尔冰葡萄酒发酵过程中香气动态变化规律[J].食品与发酵工业, 2021, 47(1):62-70.TANG K, ZHANG X Q, LI J M, et al.Dynamic changes of aroma during Vidal ice wine fermentation[J].Food and Fermentation Industries, 2021, 47(1):62-70.
[7] 刘沛通, 许丹丹, 许引虎, 等.4株本土非酿酒酵母的发酵特性[J].食品科学, 2021, 42(14):86-93.LIU P T, XU D D, XU Y H, et al.Fermentation characteristics of four indigenous non-Saccharomyces wine yeasts[J].Food Science, 2021, 42(14):86-93.
[8] CIANI M, COMITINI F, MANNAZZU I, et al.Controlled mixed culture fermentation:A new perspective on the use of non-Saccharomyces yeasts in winemaking[J].FEMS Yeast Research, 2010, 10(2):123-133.
[9] 李红玉, 贺艳楠, 李毅丽.混菌发酵对两个品种葡萄酒香气的影响[J].中外葡萄与葡萄酒, 2023(6):99-106.LI H Y, HE Y N, LI Y L.Effect of mixed yeasts fermentation on aroma of wine from two grape varieties[J].Sino-Overseas Grapevine &Wine, 2023(6):99-106.
[10] GE Q, GUO C F, ZHANG J, et al.Effects of simultaneous co-fermentation of five indigenous non- Saccharomyces strains with S.cerevisiae on vidal icewine aroma quality[J].Foods, 2021, 10(7):1452.
[11] MEDINA K, BOIDO E, FARI A L, et al.Increased flavour diversity of Chardonnay wines by spontaneous fermentation and co-fermentation with Hanseniaspora vineae[J].Food Chemistry, 2013, 141(3):2513-2521.
A L, et al.Increased flavour diversity of Chardonnay wines by spontaneous fermentation and co-fermentation with Hanseniaspora vineae[J].Food Chemistry, 2013, 141(3):2513-2521.
[12] SADOUDI M, TOURDOT-MARÉCHAL R, ROUSSEAUX S, et al.Yeast-yeast interactions revealed by aromatic profile analysis of Sauvignon Blanc wine fermented by single or co-culture of non-Saccharomyces and Saccharomyces yeasts[J].Food Microbiology, 2012, 32(2):243-253.
[13] GE Q, GUO C F, YAN Y, et al.Contribution of non-Saccharomyces yeasts to aroma-active compound production, phenolic composition and sensory profile in Chinese Vidal icewine[J].Food Bioscience, 2022, 46:101152.
[14] 葛谦, 曹彩霞, 吴燕, 等.贺兰山东麓产区不同单品种葡萄酒风味物质特征分析[J].食品与发酵工业, 2021, 47(17):256-264.GE Q, CAO C X, WU Y, et al.Flavor characteristics of varieties wines from eastern foot of Helan Mountain[J].Food and Fermentation Industries, 2021, 47(17):256-264.
[15] SEGUINOT P, ROLLERO S, SANCHEZ I, et al.Impact of the timing and the nature of nitrogen additions on the production kinetics of fermentative aromas by Saccharomyces cerevisiae during winemaking fermentation in synthetic media[J].Food Microbiology, 2018, 76:29-39.
[16] LANGENBERG A K, BINK F J, WOLFF L, et al.Glycolytic functions are conserved in the genome of the wine yeast Hanseniaspora uvarum, and pyruvate kinase limits its capacity for alcoholic fermentation[J].Applied and Environmental Microbiology, 2017, 83(22):e01580-17.
[17] 曹栋杰. 发酵前处理与陈酿方式对赤霞珠红葡萄酒品质的影响研究[D].杨凌:西北农林科技大学, 2022.CAO D J.Effects of pre-fermentation treatment and aging methods on the quality of Cabernet Sauvignon red win[D].Yangling:Northwest A&F University, 2022.
[18] 岳泰新. 不同生态区酿酒葡萄与葡萄酒品质的研究[D].杨凌:西北农林科技大学, 2015.YUE T X.Study on wine grape and wine quality from different ecological regions[D].Yangling:Northwest A&F University, 2015.
[19] 孙海燕. 贺兰山东麓干红葡萄酒多酚组分与其抗氧化、抗癌活性的关联性研究[D].杨凌:西北农林科技大学, 2019.SUN H Y.Study on antioxidant and anticancer activity of polyphenols in dry red wines from eastern foot of Helan Mountain in Ningxia[D].Yangling:Northwest A&F University, 2019.
[20] NGUELA J M, TEUF O, BICCA S A, et al.Impact of mannoprotein N-glycosyl phosphorylation and branching on the sorption of wine polyphenols by yeasts and yeast cell walls[J].Food Chemistry, 2023, 403:134326.
[21] KONTOUDAKIS N, ESTERUELAS M, FORT F, et al.Influence of the heterogeneity of grape phenolic maturity on wine composition and quality[J].Food Chemistry, 2011, 124(3):767-774.
[22] CAFFREY A J, LERNO L A, ZWEIGENBAUM J, et al.Direct analysis of glycosidic aroma precursors containing multiple aglycone classes in Vitis vinifera berries[J].Journal of Agricultural and Food Chemistry, 2020, 68(12):3817-3833.
[23] 葛谦, 王小丽, 王云霞, 等.宁夏贺兰山东麓不同产地‘赤霞珠’葡萄酒挥发性香气物质特征分析[J].中国酿造, 2022, 41(2):98-106.GE Q, WANG X L, WANG Y X, et al.Characteristics analysis of volatile aroma substances in ‘Cabernet Sauvignon’ wines from different producing regions at the eastern foot of Helan Mountain in Ningxia[J].China Brewing, 2022, 41(2):98-106.
[24] WANG X C, LI A H, DIZY M, et al.Evaluation of aroma enhancement for “Ecolly” dry white wines by mixed inoculation of selected Rhodotorula mucilaginosa and Saccharomyces cerevisiae[J].Food Chemistry, 2017, 228:550-559.
[25] DE-LA-FUENTE-BLANCO A, S ENZ-NAVAJAS M P, VALENTIN D, et al.Fourteen ethyl esters of wine can be replaced by simpler ester vectors without compromising quality but at the expense of increasing aroma concentration[J].Food Chemistry, 2020, 307:125553.
ENZ-NAVAJAS M P, VALENTIN D, et al.Fourteen ethyl esters of wine can be replaced by simpler ester vectors without compromising quality but at the expense of increasing aroma concentration[J].Food Chemistry, 2020, 307:125553.
[26] 夏鸿川, 张众, 孙丽君, 等.混菌发酵对贺兰山东麓‘赤霞珠’干红葡萄酒香气的影响[J].食品科学, 2022, 43(14):165-175.XIA H C, ZHANG Z, SUN L J, et al.Effect of mixed culture fermentations on the aroma compounds of ‘cabernet sauvignon’ dry red wine produced in the eastern foothill of Helan Mountain[J].Food Science, 2022, 43(14):165-175.
[27] 张文静, 杨诗妮, 杜爽, 等.本土毕赤克鲁维酵母与酿酒酵母混合发酵葡萄酒的增香潜力分析[J].食品科学, 2020, 41(12):84-90.ZHANG W J, YANG S N, DU S, et al.Potential application of mixed starter cultures of indigenous Pichia kluyveri and Saccharomyces cerevisiae to wine aroma enhancement[J].Food Science, 2020, 41(12):84-90.
[28] 赵美, 田秀, 李敏, 等.粟酒裂殖酵母与酿酒酵母共同接种发酵对‘黑比诺’干红葡萄酒品质的影响[J].食品科学, 2021, 42(24):108-116.ZHAO M, TIAN X, LI M, et al.Effect of mixed culture fermentation with Schizosaccharomyces pombe and Saccharomyces cerevisiae on the quality of ‘Pinot Noir’ dry red wine[J].Food Science, 2021, 42(24):108-116.
[29] 李宝丽, 邓建玲, 蔡欣, 等.顶空固相微萃取-气质联用结合主成分分析研究纯葡萄汁的香气成分[J].中国食品学报, 2016, 16(4):258-270.LI B L, DENG J L, CAI X, et al.Studies on aroma components in pure grape juice by HS-SPME-GC-MS coupled with PCA[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(4):258-270.
[30] 孙佳勰, 康文怀, 李慧, 等.桑葚果酒发酵过程中的香气成分变化[J].现代食品科技, 2020, 36(8):307-316; 201.SUN J X, KANG W H, LI H, et al.Changes of aroma composition during fermentation of mulberry wine[J].Modern Food Science and Technology, 2020, 36(8):307-316; 201.
[31] 马云青, 孙佳勰, 毕玉杰, 等.不同酵母对干白葡萄酒发酵过程中香气变化的影响[J].中国酿造, 2021, 40(6):113-118.MA Y Q, SUN J X, BI Y J, et al.Effect of different yeasts on aroma changes during dry white wine fermentation[J].China Brewing, 2021, 40(6):113-118.
[32] 张慧敏, 潘秋红.葡萄酒中挥发性萜烯物质的产生机制及影响因素研究进展[J].食品科学, 2021, 42(13):249-258.ZHANG H M, PAN Q H.Advances in understanding the formation mechanism of terpenoids during winemaking and factors influencing it[J].Food Science, 2021, 42(13):249-258.
[33] FERREIRA V, LOPEZ R.The actual and potential aroma of winemaking grapes[J].Biomolecules, 2019, 9(12):818.
[34] YUN J, CUI C J, ZHANG S H, et al.Use of headspace GC/MS combined with chemometric analysis to identify the geographic origins of black tea[J].Food Chemistry, 2021, 360:130033.
[35] 林冬纯, 魏子淳, 谭艳娉, 等.不同干燥温度对萎凋叶压制白茶饼品质的影响[J].食品科学, 2022, 43(15):109-116.LIN D C, WEI Z C, TAN Y P, et al.Effect of drying temperature on the quality of pressed white tea cake from withered leaves[J].Food Science, 2022, 43(15):109-116.