番茄红素是一种由11个共轭双键及2个非共轭碳碳双键构成的四萜类化合物,主要存在于番茄、西瓜、番石榴和木瓜等蔬菜水果中[1],目前被广泛应用于农业饲料、药物、功能性食品以及化妆品等领域[2]。在已知的天然抗氧化剂中,番茄红素是最有效的单项氧自由基清除剂,其抗氧化活性是β-胡萝卜素的2倍、维生素E的100倍、维生素C的1 000倍[3]。此外,番茄红素可以有效降低DNA损伤、抑制肿瘤细胞增殖和基因突变[4],并可以通过诱导细胞互作,调节激素和免疫系统[5]。多项研究表明血液中的番茄红素浓度与特定解剖部位的癌症风险呈负相关[6],其中,番茄红素对前列腺癌[7-9]、肺癌[10]和胃癌[11]的益处最为明显。因此,如何高效生产番茄红素吸引了广泛的国际关注。
目前,番茄红素的生产方式主要包括天然提取法、化学合成法和微生物发酵法。相较于其他两种方法,微生物发酵法具有生产成本低、效率高、环境友好等优点。微生物法生产番茄红素的菌种包括两类,一类是可以天然合成番茄红素的微生物,例如三孢布拉氏霉菌(Blakeslea trispora)[12]。然而,三孢布拉氏霉菌在传代过程中容易发生退化,导致产量不稳定、生产效率较低[13]。另一类则是能够异源从头合成番茄红素的重组菌株,这类菌株通常是分子操作成熟、遗传背景清晰的模式微生物,例如大肠杆菌(Escherichia coli)和[14]酿酒酵母(Saccharomyces cerevisiae)[15]等。然而,E.coli发酵过程易感染噬菌体且存在分泌内毒素风险[13];S.cerevisiae的发酵周期较长且生产成本较高。
枯草芽孢杆菌(Bacillus subtilis)是一种模式工业微生物,具有诸多优势:(1)是一种安全、非致病微生物,已被美国食品药品监督管理局认证为一般安全(Generally Recognized as Safe,GRAS)微生物;(2)生长速度快,遗传背景清晰,在极端条件(如高温、高压)下生存能力强,并具有多样化的代谢能力,可以利用各种碳源、氮源和能量来源生长;(3)具有丰富的基因编辑工具;(4)与真核生物宿主相比,枯草芽孢杆菌的代谢途径相对较为简单,生长速度快。目前,枯草芽孢杆菌已被用于生产多种功能营养品和酶。然而,使用枯草芽孢杆菌作为底盘细胞合成萜类化合物的研究仍然较少[16]。异戊二烯是萜类化合物合成的基本单元,相较于其他模式微生物,野生的枯草芽孢杆菌具有更强的异戊二烯合成能力[17-18]。因此,枯草芽孢杆菌具有合成萜类化合物的潜力。
本研究首先通过在枯草芽孢杆菌中引入番茄红素的合成基因簇,实现了番茄红素的异源从头合成。通过优化基因簇各基因的表达量并对其进行突变,提高了番茄红素的产量。其次,通过筛选基因簇突变体的表达宿主,进一步提高了番茄红素的产量。最后,对番茄红素代谢网络中关键基因的表达量进行了组合优化,经发酵优化,番茄红素的产量达到91.0 mg/L,较出发菌株提高了363倍。本研究为番茄红素在枯草芽孢杆菌中的高效生产奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本研究所涉及的菌株、质粒如表1所示。
表1 本研究所用菌株和质粒
Table 1 Strains and plasmids used in this study

菌株和质粒特征来源E.coli DH5α克隆宿主本实验室保存pHT-XCR6ColE1 Ampr, RepA Cmr, XylR-PxylA-FnCpf1-NgAgo本实验室保存pcrF19 NM2ColE1, pE194ts Kanr, E.coli和B.subtilis的穿梭载体, crRNA and g基因编辑或敲除框架载体本实验室保存B.subtilis 168 trpC2本实验室保存168KSBS168 衍生菌株, Δepr::XylR-PxylA-comK-comS本实验室保存G600168KS衍生菌株,ΔtrpC2::trpC0,ΔgudB::gudB+, aprE0, nprE0, bpr0, mpr0, nprB0本实验室保存G800G600衍生菌株, vpr0, wprA0本实验室保存G401168KS衍生菌株, ΔtrpC2::trpC0,ΔgudB::gudB+, ΔnprE, ΔaprE, Δbpr本实验室保存G601G401衍生菌株, Δmpr, ΔnprB 本实验室保存pHT-01表达载体本实验室保存pHT01-P43-GFPP43 启动子表达绿色荧光蛋白 (GFP)本实验室保存pHT-Pveg-crtEBI Pveg 启动子表达crtEBI基因簇本研究pHT-P21-crtEBI P21启动子表达crtEBI基因簇本研究pHT-Pveg-crtEBI0Pveg 启动子表达crtEBI0基因簇本研究pHT-P21-crtEBI0 P21启动子表达crtEBI0基因簇本研究pHT-P21-crtEBI1 P21 启动子表达crtEBI0基因簇本研究G800-146SG800 SP146-DXS::DXS本研究G800-146HG800 SP146-IspH::IspH本研究G800-146IG800 SP146-Fni ::Fni本研究G800-146AG800 SP146-IspA::IspA本研究G800-43SG800 P43-DXS ::DXS本研究G800-43HG800 P43-IspH ::IspH本研究G800-43IG800 P43-Fni::Fni本研究G800-43AG800 P43-IspA::IspA本研究G800-3SG800 TP3-DXS::DXS本研究G800-3HG800 TP3-IspH::IspH本研究G800-3IG800 TP3-Fni::Fni本研究G800-146SHG800 SP146-DXS ::DXS, IspH::IspH本研究G800-146SIG800 SP146-DXS::DXS, Fni::Fni本研究G800-146SHIG800 SP146-DXS::DXS, IspH::IspH, Fni::Fni本研究G800-146SHIΔhepTG800 SP146-DXS::DXS, IspH ::IspH, Fni::Fni, ΔhepT本研究G800-146SHIΔhepSG800 SP146-DXS::DXS, IspH::IspH, Fni::Fni, ΔhepS本研究
1.1.2 培养基
LB培养基(g/L):10.00 NaCl,5.00酵母提取物,10.00胰蛋白胨。
TB培养基(g/L):24.00酵母提取物,12.00胰蛋白胨,4 mL/L甘油,2.31 KH2PO4,12.54 K2HPO4·3H2O。
发酵培养基SGS(g/L):12.00酵母提取物,60.00葡萄糖,6.00胰蛋白胨,6.00 (NH4)2SO4,12.50 K2HPO4·3H2O,2.5 KH2PO4,3.00 MgSO4。
发酵培养基SGS-C1(g/L):将发酵培养基SGS中的60.00葡萄糖替换为60.00蔗糖。
发酵培养基SGS-C2(g/L):将发酵培养基SGS中的60.00葡萄糖替换为60.00甘油。
发酵培养基SGS-C3(g/L):将发酵培养基SGS中的60.00葡萄糖替换为30.00葡萄糖,30.00蔗糖。
发酵培养基SGS-C4(g/L):将发酵培养基SGS中的60.00葡萄糖替换为30.00葡萄糖,30.00甘油。
发酵培养基SGS-C5(g/L):将发酵培养基SGS中的60.00葡萄糖替换为30.00甘油,30.00蔗糖。
发酵培养基SGS-N1(g/L):将发酵培养基SGS中的6.00胰蛋白胨变为12.00胰蛋白胨。
发酵培养基SGS-N2(g/L):将发酵培养基SGS中的6.00胰蛋白胨变为24.00胰蛋白胨。
发酵培养基SGS-N3(g/L):将发酵培养基SGS中的6.00胰蛋白胨变为36.00胰蛋白胨。
发酵培养基SGS1(g/L):12.00酵母提取物,30.00葡萄糖,30.00蔗糖,24.00胰蛋白胨,6.00 (NH4)2SO4,12.50 K2HPO4·3H2O,2.50 KH2PO4,3.00 MgSO4。
YN培养基(B.subtilis感受态制备)(g/L):7.00酵母提取物,18.00营养肉汤。
1.2 实验方法
1.2.1 本实验引物与基因序列
crtEIB基因簇以及实验所使用的引物均由苏州金唯智生物科技有限公司合成,见表2。
表2 本研究所用的引物
Table 2 Primers used in this study

引物序列BETAipi-FAAAGAAAGGAGGTTTATTTTATGGTGAGTGGCAGTAAAGCGGBETAipi-RCCGGGGACGTCGACCTGCAGCTAAACGGGACGCTGCCAAApHT-sfGFP-liFAGTGATAGCGGTACCCTCGpHT-sfGFP-liRAAAATAAACCTCCTTTCTTTTACTTACCCTCTATTpveg-fTTATTAACGTTGATATAATTTAAATTTTATTTGACAAAAATGGGCTCGTGTTGTACAATAAATGTpveg-rACATTTATTGTACAACACGAGCCCATTTTTGTCAAATAAAATTTAAATTATATCAACGTTAATAAP21-FCTAGAATGAAAGGGGATTTTATGCTTCAGAACGP21-RAAAATAAACCTCCTTTCTTTTACTTACCCTCdxs-UFTGGCCAGTGCCTCTAGAGTCCTGTCAAAAATGTGCCATGAAAdxs-URAAAATCCCCTTTCATTCTAGTTAGTGATCTCTTGCCGCAATTAdxs-DFAAAGAAAGGAGGTTTATTTTTTGGATCTTTTATCAATACAGGACCCdxs-DRGTTCGTAACAGGTCGACTCTCGTCCTCGCGCGfni-UFTGGCCAGTGCCTCTAGAGTCAAGTCTTCATGTAGAGAAAGCATCfni-URAAAATCCCCTTTCATTCTAGTTATTTTAGTTTATTCAGCTTATCTCCGATfni-DFAAAGAAAGGAGGTTTATTTTGTGACTCGAGCAGAACGfni-DRGTTCGTAACAGGTCGACTCTGATGGGTTTCACCTTTGATCAispH-UFTGGCCAGTGCCTCTAGAGTCTATCAGTCGGTTCGTAAAAACCispH-URAAAATCCCCTTTCATTCTAGTTAAATATATAATCTCGGTTTTGAACTGCCispH-DFAAAGAAAGGAGGTTTATTTTATGGACGTAATTAAAATTTCACCGispH-DRGTTCGTAACAGGTCGACTCTGAAACAGATACAAATCCATTTACATTTCTcr-dxs-fAGATAGCATGAATTTCTGCAATGATACcr-dxs-rAATTGTATCATTGCAGAAATTCATGCTcr-fni-fAGATTCACCAATTATTTTAGTTTATTCcr-fni-rAATTGAATAAACTAAAATAATTGGTGAcr-isph-fAGATGGTTGTCCTCCAATACTGAAGTGcr-isph-rAATTCACTTCAGTATTGGAGGACAACCsp146-fAAAAATAACAAAAACGTGTTGACAATAAAGATTAACCGTGATATAATTAAATAGTGATAGCGGTACCCTCGsp146-rATTTAATTATATCACGGTTAATCTTTATTGTCAACACGTTTTTGTTATTTTTACTAGTATAAAAAACGCCCGGCTP3-fCGTGTTGACAATGTGAATTCCGCATGGTATAATGACAATTAAATCTCAAAAAGGTAGTGATAGCGGTACCCTCGAAGCTGTTP3-rATTGTCATTATACCATGCGGAATTCACATTGTCAACACGTTTTTCATATTTCTACTAGTATAAAAAACGCCCGGCGGCAACcr-HepS-fAGATTGATGATAGGTTTGATCTTGGCTcr-HepS-rAATTAGCCAAGATCAAACCTATCATCAHepS-DFTTTGAGTCCTGCATAATGGTAAATATCACCCTTGTCCCCAA HepS-DRGTTCGTAACAGGTCGACTCTAACTGTGACTTCAGCAGTCHepS-UFTGGCCAGTGCCTCTAGAGTCGCCTGTCTGAATCCGAACHepS-URTGGGGACAAGGGTGATATTTACCATTATGCAGGACTCAAAAGcr-HepT-FAGATTGATAATTAATCAATCCGGGGCGcr-HepT-RAATTCGCCCCGGATTGATTAATTATCAHepT-DF ATAAAAGTCTTTTCCATCATTCATTTCCATCCGATATGCGHepT-DRGTTCGTAACAGGTCGACTCTCGGCAGGCAAAAGCGHepT-UF TGGCCAGTGCCTCTAGAGTCAAACCGGCGGCG HepT-UR CGCATATCGGATGGAAATGAATGATGGAAAAGACTTTTATCATGGTZ-FAGAGTCGACCTGTTACGAACZ-RGACTCTAGAGGCACTGGC
本实验使用引物BETAipi-F、BETAipi-R,从质粒pAC-BETAipi[19]中获得完整的crtEIB基因簇,该质粒购于Addgene公司。其中crtE、crtI、crtB基因均来源于Erwinia herbicola Eho10 (GenBank ID:69517638、66827556、GU721093.1)。以pHT01-P43-GFP质粒模板,含有启动子Pveg的pveg-f和pveg-r作为引物,经反向PCR获得重组质粒pHT01-Pveg-GFP;接着使用引物pHT-sfGFP-liF和pHT-sfGFP-liR将质粒pHT01-Pveg-GFP线性化,使用碧云天(中国)的Seamless Cloning Kit无缝克隆试剂盒将基因簇crtEIB的DNA片段和线性化的质粒pHT01-Pveg-GFP连接,得到番茄红素表达质粒pHT-Pveg-crtEBI。
1.2.2 重组菌株的构建
本实验使用WU等[20]报道的基因编辑系统对菌株进行基因编辑,此编辑系统由两个质粒pHT-XCR6和pcrF19 NM2组成。质粒pHT-XCR6为Cpf1表达载体;质粒pcrF19 NM2为crRNA表达载体,其同源模板插入区中含有mCherry基因,用于插入筛选,根据靶标基因的基因组整合位点,设计相应的crRNA和上下游同源臂,若是进行基因编辑,同源臂应当大于1 000 bp,若是进行基因敲除,同源臂应当大于500 bp。将设计好的crRNA替换到质粒pHT-XCR6上的crRNA位置,上下游同源臂以及整合基因替换到质粒pcrF19 NM2的插入位点。
取LB固体培养基上新鲜划线的菌株接种于YN培养基,37 ℃、220 r/min培养12 h,取450 μL的种子液加入到含有2 mL YN培养基和80 μL 500 g/L的木糖的12 mL摇菌管中,37 ℃、220 r/min培养2 h后加入10%(体积分数)的甘油,保藏在-80 ℃冰箱。取1 000 ng质粒加入到500 μL保藏的感受态中,37 ℃、220 r/min转化2 h。若进行基因编辑,在转化pcrF19 NM2时,37 ℃培养2 h后,4 000 r/min离心2 min,将菌体重悬于500 μL的含有氯霉素、卡那霉素和3%(质量分数)木糖的LB培养基中,30 ℃、220 r/min培养12 h,然后离心浓缩到150 μL并涂布于含有氯霉素、卡那霉素和3%木糖的LB固体培养基,在30 ℃下恒温培养,长出单菌落后即可进行菌落PCR验证是否完成基因编辑。若是进行普通的质粒转化,在37 ℃转化2 h后直接涂布于含有相应抗性的LB固体培养基,37 ℃恒温培养直至长出单菌落。基因编辑成功后在含有1‰ (质量分数)SDS的LB培养基中30 ℃、220 r/min培养12 h可以消除质粒。
1.2.3 重组质粒的构建
分别对质粒载体、基因片段以及启动子进行PCR扩增得到线性化片段,之后使用碧云天(中国)的Seamless Cloning Kit无缝克隆试剂盒进行片段连接,得到的连接产物转化E.coli DH5α感受态,并涂布相应的抗性平板,次日将平板上的单菌落送上海生工测序,将测序正确的单菌落扩大培养,并提取重组质粒。
1.2.4 感受态细胞制备和转化
E.coli感受态制备:按照高效感受态细胞制备试剂盒(生工生物工程有限公司)中的操作手册进行感受态制备。
E.coli感受态转化:将E.coli感受态细胞和待转化质粒冰浴10 min,随后在E.coli感受态细胞中加入1 000 ng质粒,冰浴30 min。之后42 ℃热激90 s,迅速冰浴2 min,接着加入500 μL LB培养基,37 ℃,220 r/min培养1 h。最后,4 000 r/min离心2 min后涂布于相应的抗性平板,37 ℃培养12 h。
B.subtilis感受态制备:将新鲜划线的菌株接种于2 mL YN培养基,37 ℃培养12 h后取500 μL菌液转接到2 mL YN培养基中,并加入80 μL 500 g/L的木糖,37 ℃、220 r/min培养2 h,之后加入10%的甘油保藏。
B.subtilis感受态转化:当使用WU等[20]报道的基因编辑系统进行基因编辑时,先取1 000 ng的pHT-XCR6质粒加入到500 μL B.subtilis感受态中,37 ℃、220 r/min培养2 h,直接涂布相应的抗性平板,37 ℃培养16 h;再将pcrF19 NM2加入到感受态中37 ℃、220 r/min培养2 h。然后,4 000 r/min离心2 min收集菌体,将其重悬于500 μL含有氯霉素、卡那霉素和3%木糖的LB培养基中培养12 h。随后,涂布于含有氯霉素、卡那霉素和3%木糖的LB平板。
1.2.5 番茄红素产量测定
参考LIU等[21]的实验方法,使用乙酸乙酯为番茄红素的萃取剂,采用高效液相色谱法测定发酵液中的番茄红素产量,乙酸乙酯会在液相检测最初出现一个溶剂峰,不会显著干扰番茄红素产量。取600 μL的发酵液,用等量ddH2O洗涤2次后,再用600 μL的ddH2O重悬菌液并加入600 μL的乙酸乙酯。使用FastPrep-24TM 5G高速裂解样品台式均质机(美国MP公司)破碎菌体,12 000 r/min离心8 min后乙酸乙酯和水溶液分层,收集溶解了番茄红素的乙酸乙酯上清液。高效液相色谱检测所使用的色谱柱为C18柱(Symmetry C18 Column, Waters),进样量10 μL,柱温40 ℃,紫外检测器检测波长450 nm,流动相为V(乙腈)∶V(甲醇)∶V(异丙醇)=5∶3∶2,流速1.0 mL/min,检测时间20 min,出峰时间12.4 min。
1.2.6 番茄红素合成基因簇突变文库的构建
以重组质粒pHT-P21-crtEIB0为模板,BETAipi-F和BETAipi-R为引物,使用上海碧云天的QuickMutationTM基因随机突变试剂盒进行易错PCR,获得番茄红素合成基因簇的DNA突变文库。以番茄红素合成基因簇的DNA突变文库为模板,pHT-sfGFP-liF和pHT-sfGFP-liR为引物,PCR扩增获得线性化的载体。利用1.2.3节中的方法构建番茄红素合成基因簇突变体的质粒文库。
2 结果与分析
2.1 番茄红素合成基因簇的异源表达与优化
为实现番茄红素在B.subtilis中的异源合成,将番茄红素合成基因簇crtEIB引入到B.subtilis 168中。首先以pHT-01为质粒骨架,B.subtilis中常用的组成型强启动子Pveg和P21构建番茄红素表达质粒(图1-a),获得重组质粒pHT-Pveg-crtEIB和pHT-P21-crtEIB。将重组质粒与空载质粒pHT-01分别转化进入B.subtilis 168中,获得重组菌株BS168-Pveg-crtEIB,BS168-P21-crtEIB和对照菌株BS168-pHT-01。相较于对照菌株,重组菌株BS168-Pveg-crtEIB和BS168-P21-crtEIB均能合成番茄红素,但产量较低,分别为0.25 mg/L和0.40 mg/L(图1-b)。为进一步提高番茄红素的产量,对番茄红素合成基因簇中基因的翻译强度进行了优化。使用RBS calculator[22]预测基因簇中各基因的翻译水平,结果显示基因crtE、crtI和crtB的核糖体结合位点(ribosome binding sites,RBS)翻译强度分别为1 642 086.00、21.56和2 562.00,相较于基因crtE,基因crtI和crtB的RBS翻译强度过低,这可能是限制番茄红素产量的关键因素之一。因此,使用RBS calculator对基因簇crtEIB的RBS序列进行优化,获得基因簇crtEIB0,其中优化后的crtI和crtB的序列分别为TAGAGGGTAAGGAGGATAATTTT和TAGAGGGAAAGGAGGATTATATT,翻译强度分别为18 857.96和220 220.96(图1-b)。用引物pHT-sfGFP-liF和pHT-sfGFP-liR分别克隆pHT-Pveg-crtEIB和pHT-P21-crtEIB获得其线性化表达载体,并分别用Seamless Cloning Kit无缝克隆试剂盒与优化后的基因簇crtEIB0连接,获得重组质粒pHT-Pveg-crtEIB0和pHT-P21-crtEIB0,分别转入B.subtilis 168中后,获得重组菌株BS168-Pveg-crtEIB0和BS168-P21-crtEIB0,番茄红素产量分别达到0.38 mg/L和0.57 mg/L,较RBS优化前分别提高了52%和43%(图1-c)。
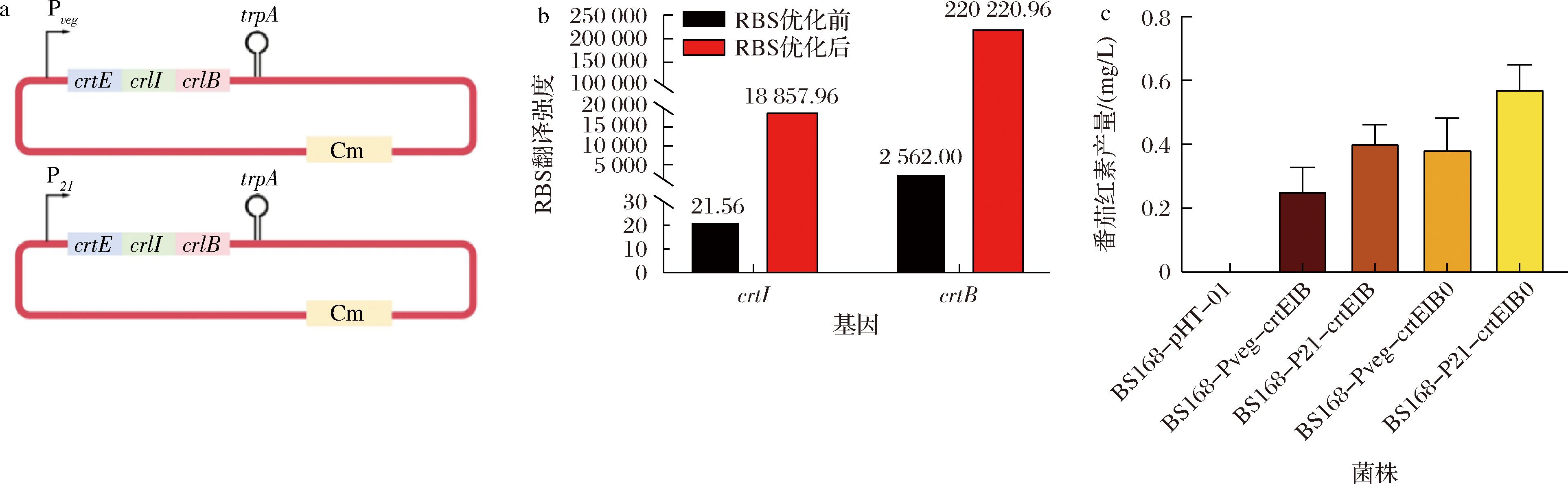
a-番茄红素表达质粒示意图;b-RBS优化前后翻译强度;c-空载对照菌株与重组菌株的摇瓶发酵番茄红素产量
图1 番茄红素合成基因簇的异源表达与优化
Fig.1 Heterologous expression and optimization of lycopene synthesis gene cluster
为了验证优化后的RBS翻译强度是否确实提高,通过SDS-PAGE比较了RBS优化前后crtI蛋白的表达量。首先用等量的ddH2O将BS168-P21-crtEIB和BS168-P21-crtEIB0发酵后的菌液离心洗涤2次,再用ddH2O重悬并将其OD600统一稀释为5,采用1.2.5节中的方法对B.subtilis进行破碎,取破碎后的混合液进行SDS-PAGE实验。已知crtI蛋白的大小为54.5 kDa,如图2所示,泳道2的crtI蛋白条带更明显,证明RBS优化后crtI蛋白的表达量增加。
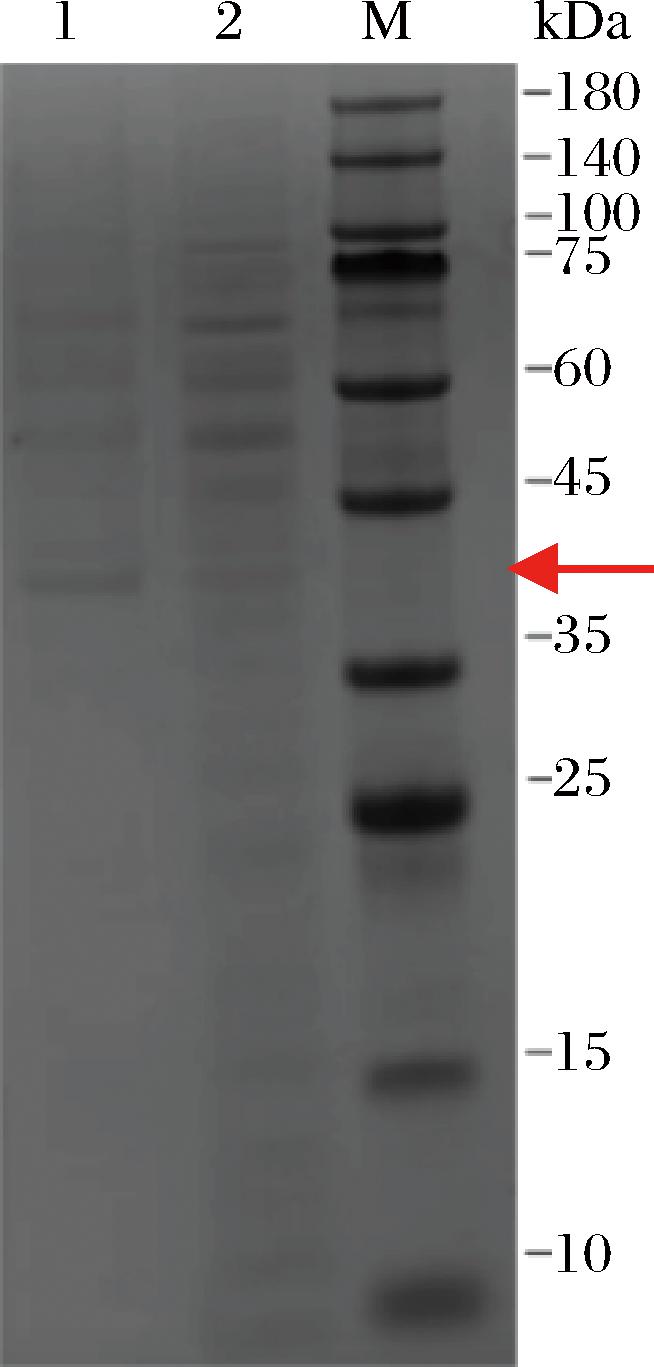
M-Marker;1-未经RBS优化的BS168-P21-crtEIB;2-RBS优化后的BS168-P21-crtEIB0。
图2 RBS优化前后crtI蛋白表达情况
Fig.2 Expression of crtI protein before and after RBS optimization
2.2 番茄红素合成基因簇突变体的筛选
为进一步优化番茄红素合成基因簇中各基因的表达量与活性,使用易错PCR对crtEIB0进行了随机突变,并构建了相应的重组菌株突变文库。由于番茄红素是一种红色的类胡萝卜素,产量较高时会使菌株呈现出红色。因此,可以根据红色深浅初步判断菌株的番茄红素产量。经平板初筛与摇瓶复筛,获得了一株产量达到6.4 mg/L的突变菌株BS168-P21-crtEIB1,产量较对照菌株BS168-P21-crtEIB0提高了10.2倍。测序结果显示,基因簇突变体crtEIB1中crtE基因的倒数第4个碱基对插入了1 bp碱基(GC),导致crtE基因原本的终止子密码子TGA被消除(图3-a)。此外,插入1 bp后crtE与crtI间隔序列的长度变为24 bp,因此在不会导致crtI发生移码突变,且使crtE和crtI基因发生了融合(图3-b)。融合后形成的酶复合体可能会增强其在B.subtilis 168中表达的稳定性、减少了酶之间的距离,从而提高了酶的催化效率[23-26]。

a-未突变基因簇的序列;b-突变后基因簇的序列
图3 番茄红素合成基因簇突变位点
Fig.3 Lycopene synthesis gene cluster mutation site
随后,初步优化了菌株BS168-P21-crtEIB1的发酵培养基,发现其在SGS培养基中的产量高于在TB培养基中的产量,达到6.9 mg/L(图4-a)。然而,相较于菌株BS168-P21-crtEIB0,突变体菌株BS168-P21-crtEIB1的生长状况有所下降(图4-b)。
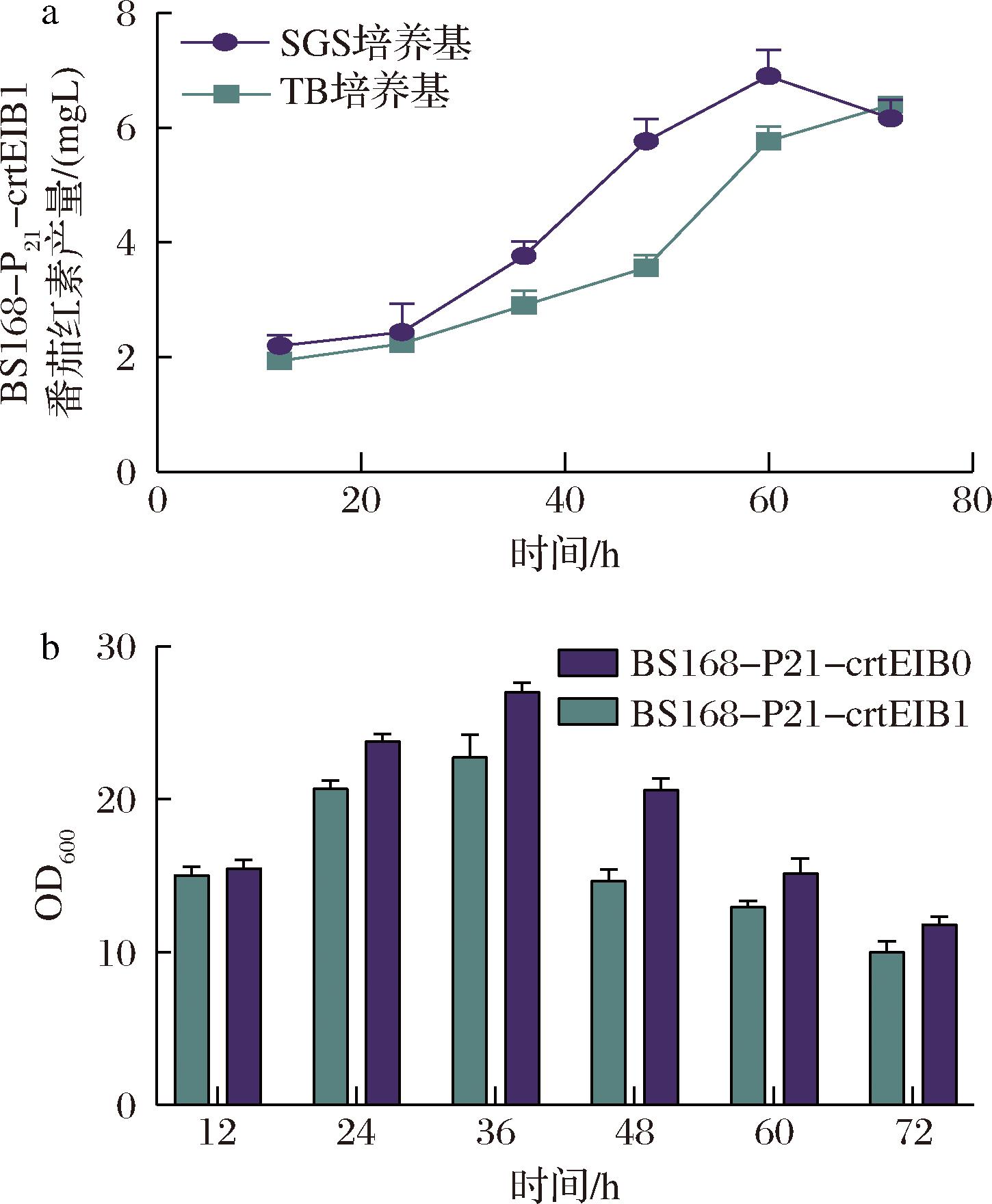
a-不同培养基中番茄红素产量随时间的变化情况;b-突变菌株和对照组细胞生长随时间的变化
图4 突变体菌株的番茄红素合成和生长状况
Fig.4 Lycopene synthesis and growth of mutant strains
2.3 优化底盘菌株以提高番茄红素产量
为进一步提高番茄红素在B.subtilis中的产量,将突变体质粒pHT-Pveg-crtEIB1转化进入实验室前期构建的5株蛋白酶缺陷B.subtilis底盘细胞168KS、G600、G800、G401、G601[27],得到重组菌株168KS-P21-crtEIB1、G600-P21-crtEIB1、G800-P21-crtEIB1、G401-P21-crtEIB1和G601-P21-crtEIB1。发酵结果显示,相较于BS168-P21-crtEIB1,这5株菌的番茄红素产量均有所提高,其中G800-P21-crtEIB1的产量最高,达到15.5 mg/L,较BS168-P21-crtEIB1提高了1.2倍(图5-a)。其次是G600-P21-crtEIB1和G601-P21-crtEIB1,分别达到13.6 mg/L和13.3 mg/L,较BS168-P21-crtEIB1提高了97.1%和92.8%。G401-P21-crtEIB1和168KS-P21-crtEIB1的产量略有提高,达到9.1 mg/L和7.3 mg/L,较G600-P21-crtEIB1提高了31.9%和5.8%。为验证在蛋白酶缺陷菌株中表达番茄红素合成基因簇是否会影响菌株生长,每隔12 h对G800-P21-crtEIB1的生长状况进行检测,结果如图5-b所示,与未经蛋白酶改造的对照菌株BS168-P21-crtEIB1相比,G800-P21-crtEIB1的生长未受到明显抑制。
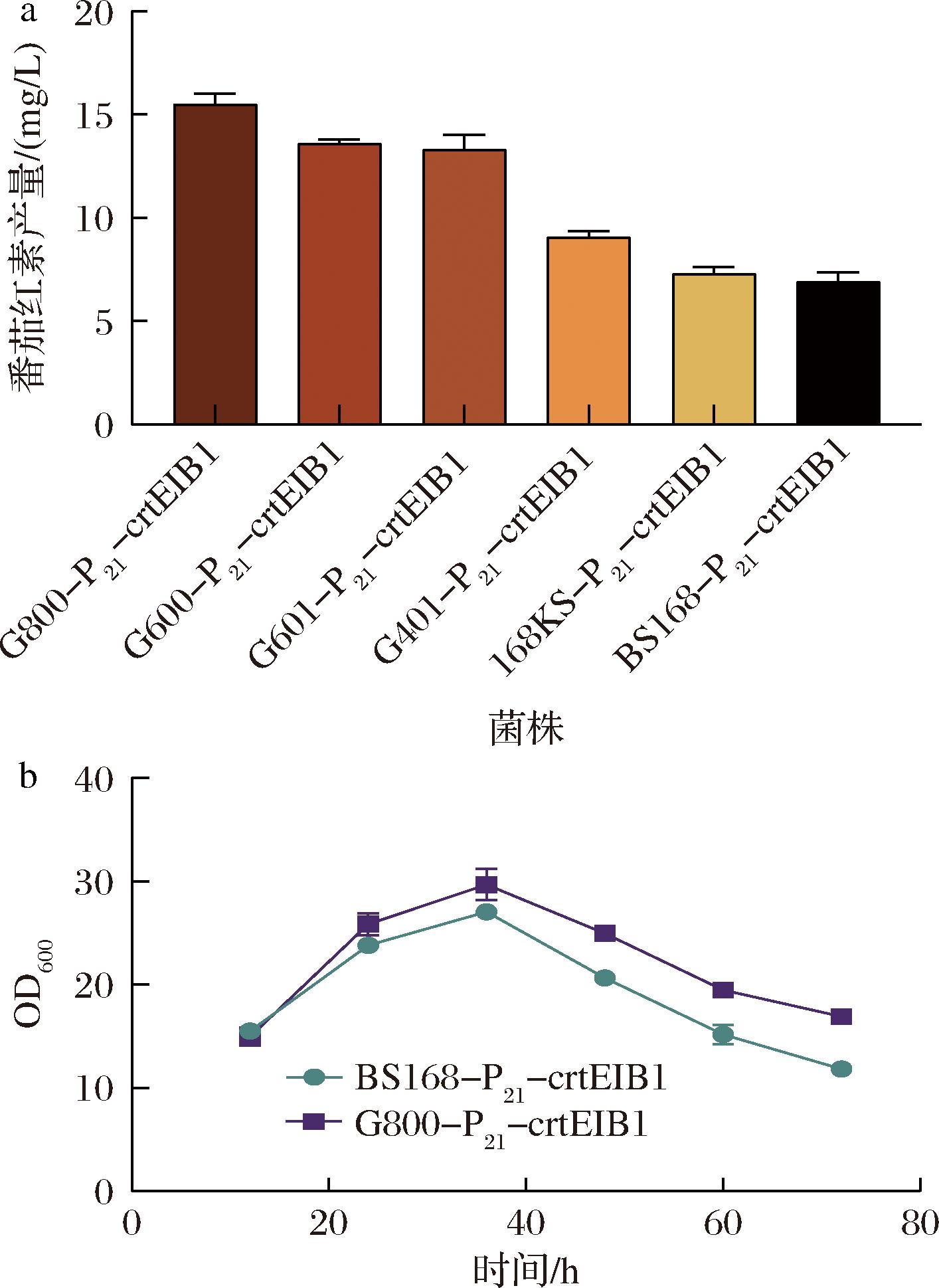
a-重组蛋白酶缺乏菌株的番茄红素产量;b-对照菌株和蛋白酶缺陷菌株G800-P21-crtEIB1的细胞生长情况
图5 重组蛋白酶缺陷菌株的番茄红素产量和菌株生长状况
Fig.5 Lycopene production and growth of recombinant proteinase-deficient strains
2.4 番茄红素代谢途径的优化
异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)及其异构体二甲烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)是合成番茄红素的前体物质。IPP和DMAPP的供给不足会降低番茄红素的合成效率[28]。在B.subtilis中,IPP和DMAPP的生成途径为2-C-甲基-D-赤藻糖醇-4-磷酸(2-C-methyl-D-erythritol 4-phosphate,MEP)途径(图6)。MEP途径会以丙酮酸(pyruvate,Pyr)和3-磷酸甘油醛(glyceraldehyde 3-phosphate,G-3-P)为前体,经8步酶促反应,生成IPP和DMAPP,其中涉及的酶依次为1-脱氧木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)、1-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)、2-C-甲基-D-赤藓糖醇4-磷酸胞苷基转移酶(C-methyl-D-erythritol-4-phosphocytidine transferase,IspD)、CDP-ME激酶(CDP-ME kinase,ispE)、2-C-甲基-D-赤藓醇-2,4-环焦磷酸合成酶(2-C-methyl-D-erythritol-2,4-cyclic pyrophosphate synthase,ispF)、(E)-4-羟基-3-甲基丁-2-烯基二磷酸合成酶[(E)-4-hydroxy-3-methylbut-2-enyl-diphosphate synthase,ispG]、4-羟基-3-甲基丁-2-烯基二磷酸还原酶(4-hydroxy-3-methylbut-2-enyl diphosphate reductase,IspH)、2型异戊烯基二磷酸异构酶(type 2 isopentenyl diphosphate isomerase,Fni)。其中,DXS通常被认为是影响MEP代谢通量的关键限速酶[29];Fni可以协调IPP和DMAPP的比例,促使萜类化合物的合成[30-31]。IspH催化合成IPP和DMAPP的前体物质4-羟基-3-甲基丁烯基1-二磷酸(4-hydroxy-3-methylbut-2-enyl pyrophosphate,HMBPP)是一种有毒中间代谢物[32-33]。此外,高水平的IPP和DMAPP积累会对细胞生长产生毒性[34-35]。因此,需要合理优化MEP途径的代谢流。

图6 本研究中枯草芽孢杆菌番茄红素合成途径
Fig.6 Lycopene synthesis pathway of Bacillus subtilisin this study
使用活性依次减弱的3个启动子TP3、P43和SP146,对MEP途径中4个关键基因DXS、IspH、Fni和IspA的表达量进行优化,获得重组菌株G800-146S、G800-146H、G800-146I、G800-146A、G800-43S、G800-43H、G800-43I、G800-43A、G800-3S、G800-3H、G800-3I和G800-3A。将DXS的启动子替换为SP146和P43后,番茄红素产量分别提高至33.1 mg/L和22.3 mg/L,较G800-P21-crtEIB1提高了113.5%和43.9%,而当使用更强的启动子TP3时,番茄红素产量减少(图7-a)。Fni的启动子替换为SP146和P43后,番茄红素产量分别达到21.5 mg/L和16.6 mg/L,较G800-P21-crtEIB1提高了38.7%和7.1%,当使用更强的启动子TP3时,番茄红素产量减少(图7-a)。IspH的启动子替换为SP146后,番茄红素产量达到17.9 mg/L,较G800-P21-crtEIB1提高了15.2%,而替换为更强的启动子P43和TP3时,番茄红素产量均减少。将IspA的启动子替换为SP146、P43和TP3启动子,番茄红素的产量均会有不同程度的下降。此外,发酵结果显示,除了菌株G800-43S,番茄红素产量提高的菌株的生长状况均有所提升,相反地,产量下降的菌株生长状况均有所下降(图7-b)。

a-关键基因启动子改造后番茄红素的产量(*:启动子替换为SP146,**:启动子替换为P43,***:启动子替换为TP3);b-关键基因启动子改造后菌株的生长状况(*:启动子替换为SP146,**:启动子替换为P43,***:启动子替换为TP3);c-在G800-146S的基础上,用启动子SP146代替原 有的IspH和Fni启动子后番茄红素的产量;d-在G800-146SHI的基础上,分别敲除hepT和hepS基因后番茄红素的产量
图7 番茄红素合成途径关键基因的表达优化
Fig.7 Expression optimization of key genes in lycopene synthesis pathway
随后,对基因DXS、IspH和Fni的表达量进行组合优化。在产量最高的菌株G800-146S的基础上,进一步用SP146启动子分别或同时替换IspH和Fni的启动子,构建菌株G800-146SH、G800-146SI和 G800-146SHI。G800-146SH和G800-146SI的产量分别达到39.3 mg/L和42.5 mg/L,较G800-146S分别提高了18.7%和28.4%,G800-146SHI产量最高,达到了47.5 mg/L,较G800-P21-crtEIB1提高了43.5%(图7-c)。
hepT和hepS是番茄红素代谢网络中的竞争途径基因,催化法尼基焦磷酸(farnesyl pyrophosphate,FPP)流向维生素K2合成途径。因此,在菌株G800-146SHI的基础上分别敲除基因hepT和hepS,获得菌株G800-146SHIΔhepT和G800-146SHIΔhepS。发酵结果显示,G800-146SHIΔhepT的产量为41.5 mg/L,相较菌株G800-146SHI有所降低;而G800-146SHIΔhepS的产量达到77.4 mg/L,较G800-146SHI提高了62.9%(图7-d)。
2.5 发酵条件的优化
为了进一步提高番茄红素产量,优化了菌株G800-146SHIΔhepS的摇瓶发酵温度、碳源和氮源。结果显示G800-146SHIΔhepS的最适发酵温度为30 ℃,此时产量为80.1 mg/L(图8-a)。在30 ℃的培养条件下,继续优化摇瓶发酵的碳源和氮源,结果显示当发酵培养基中的碳源组成为12 g/L酵母粉、30 g/L葡萄糖和30 g/L蔗糖时(SGS-C3),番茄红素的摇瓶产量最高,达到85.3 mg/L(图8-b);当发酵培养基中的氮源组成分别为24 g/L (SGS-N2)和36 g/L (SGS-N3)胰蛋白胨时,番茄红素产量提升至84.8 mg/L 和85.0 mg/L,考虑到氮源的转化率,选择24 g/L的胰蛋白胨作为后续的培养基氮源(图8-c)。最终,对培养基中的碳源与氮源进行组合优化,番茄红素的产量达到91.0 mg/L,且发酵液显示出明显的红色(图8-d)。
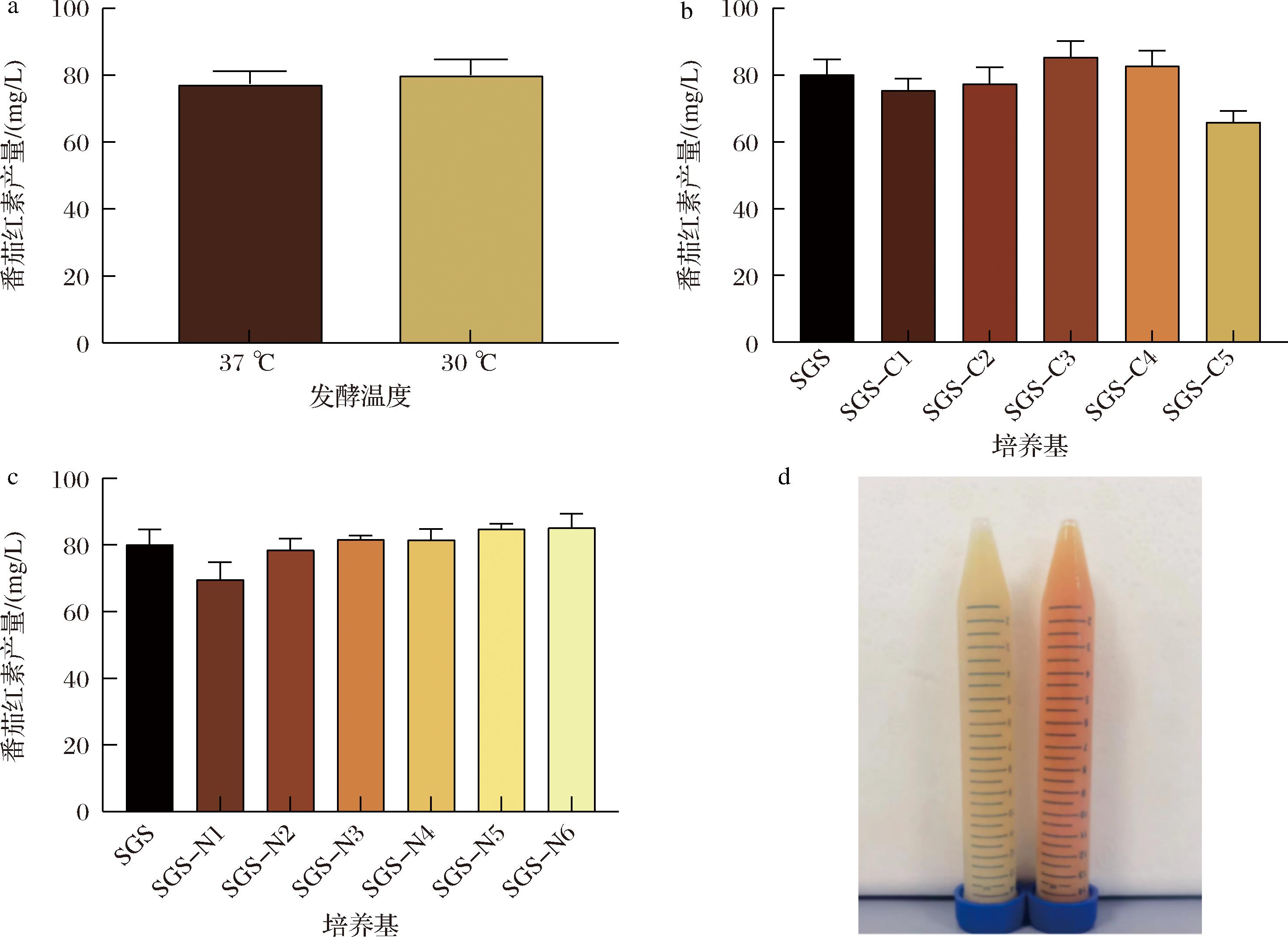
a-优化摇瓶发酵温度对番茄红素产量的影响;b-优化摇瓶发酵碳源对番茄红素产量的影响;c-优化摇瓶发酵氮源对番茄红素产量的影响;d-枯草芽孢杆菌168(左)和G800-146SHIΔhepS(右)摇瓶发酵的培养基颜色变化
图8 发酵条件优化
Fig.8 Optimization of fermentation conditions
3 结论与展望
本研究首先通过启动子、RBS优化和易错PCR随机突变对番茄红素合成途径基因簇进行优化,获得了一个能够显著提高番红素产量的重组基因簇突变体crtEIB1。随后,将其引入实验室前期构建的5个枯草芽孢杆菌底盘菌株 (G601、G401、G800、168KS、G600),筛选得到最适合番茄红素生产的底盘菌株B.subtilis G800。为进一步获得番茄红素高产菌株,利用不同强度的启动子(SP146、P43、TP3)对番茄红素前体供应途径中4个关键酶(DXS、IspH、Fni、IspA)的表达量进行了组合优化,并敲除了竞争途径基因hepS/hepT,最终使番茄红素产量达到77.4 mg/L。通过后续温度和培养基优化,使番茄红素在摇瓶发酵中的产量达到91.0 mg/L,较出发菌株提高了363倍。
本研究仅对番茄红素的前体合成途径、竞争途径和合成基因簇进行了优化改造,在后续实验中,可对B.subtilis中的中心代谢途径进行改造,从而增大番茄红素合成途径的代谢通量。此外,可以利用动态调控策略全局优化番茄红素代谢网络各个模块的代谢通量,提高番茄红素的合成效率。
[1] HERN NDEZ-ALMANZA A, MONTA
NDEZ-ALMANZA A, MONTA EZ J, MART
EZ J, MART NEZ G, et al.Lycopene:Progress in microbial production[J].Trends in Food Science &Technology, 2016, 56:142-148.
NEZ G, et al.Lycopene:Progress in microbial production[J].Trends in Food Science &Technology, 2016, 56:142-148.
[2] 陆婉瑶, 刘孟涛, 赵抒娜, 等.番茄红素产品的市场趋势调研与法规分析[J].中国食品添加剂, 2023, 34(11):236-247.LU W Y, LIU M T, ZHAO S N, et al.Marketing trends research and regulation analysis of lycopene products[J].China Food Additives, 2023, 34(11):236-247.
[3] TORREGROSA-CRESPO J, MONTERO Z, FUENTES J L, et al.Exploring the valuable carotenoids for the large-scale production by marine microorganisms[J].Marine Drugs, 2018, 16(6):203.
[4] YANG C M, YEN Y T, HUANG C S, et al.Growth inhibitory efficacy of lycopene and β-carotene against androgen-independent prostate tumor cells xenografted in nude mice[J].Molecular Nutrition &Food Research, 2011, 55(4):606-612.
[5] 冯雪, 程鑫颖, 薛强, 等.番茄红素对小鼠免疫调节功能的影响[J].中国食品添加剂, 2023, 34(8):198-204.FENG X, CHENG X Y, XUE Q, et al.Effects of lycopene on immune regulation in mice[J].China Food Additives, 2023, 34(8):198-204.
[6] 陈垚, 吕志敏, 孙川喻, 等.番茄红素增强免疫力功能的研究[J].预防医学论坛, 2017, 23(5):390-392;395.CHEN Y, LYU Z M, SUN C Y, et al.Study on immunity enhancing function of lycopene[J].Preventive Medicine Tribune, 2017, 23(5):390-392;395.
[7] GIOVANNUCCI E.Tomatoes, tomato-based products, lycopene, and cancer:Review of the epidemiologic literature[J].Journal of the National Cancer Institute, 1999, 91(4):317-331.
[8] 姜利宁. 番茄红素对人前列腺癌的抑制作用及机制研究[D].石家庄:河北医科大学, 2019.JIANG L N.The inhibitory effect and its mechanisms of lycopene on human prostate cancer[D].Shijiazhuang:Hebei Medical University, 2019.
[9] MIRAHMADI M, AZIMI-HASHEMI S, SABURI E, et al.Potential inhibitory effect of lycopene on prostate cancer[J].Biomedicine &Pharmacotherapy, 2020, 129:110459.
[10] MUSTRA RAKIC J, LIU C, VEERAMACHANENI S, et al.Lycopene inhibits smoke-induced chronic obstructive pulmonary disease and lung carcinogenesis by modulating reverse cholesterol transport in ferrets[J].Cancer Prevention Research, 2019, 12(7):421-432.
[11] KIM M J, KIM H.Anticancer effect of lycopene in gastric carcinogenesis[J].Journal of Cancer Prevention, 2015, 20(2):92-96.
[12] 安娜特雷莎·马科斯罗德里格斯, 安东尼奥·埃斯特雷利亚德卡斯特罗, 哈维尔·科斯塔佩雷斯, 等.生产番茄红素的改良方法, 获得的番茄红素的制剂和应用:中国,CN1617934[P].2005-05-18.RODRIGUEZ M A, DE CASTRO A E, PEREZ J C, et al.Improved method for production of lycopene, preparation and application of lycopene obtained: China, CN1617934[P].2005-05-18.
[13] 石彬, 邓小敏.生物技术合成番茄红素的研究进展[J].华中农业大学学报, 2023, 42(4):244-253.SHI B, DENG X M.Research progress of lycopene synthesis by biotechnology[J].Journal of Huazhong Agricultural University, 2023, 42(4):244-253.
[14] SUN T, MIAO L T, LI Q Y, et al.Production of lycopene by metabolically-engineered Escherichia coli[J].Biotechnology Letters, 2014, 36(7):1515-1522.
[15] ZHOU K, YU C, LIANG N, et al.Adaptive evolution and metabolic engineering boost lycopene production in Saccharomyces cerevisiae via enhanced precursors supply and utilization[J].Journal of Agricultural and Food Chemistry, 2023, 71(8):3821-3831.
[16] SCHEWE H, MIRATA M A, SCHRADER J.Bioprocess engineering for microbial synthesis and conversion of isoprenoids[J].Advances in Biochemical Engineering/Biotechnology, 2015, 148:251-286.
[17] GUAN Z, XUE D, ABDALLAH I I, et al.Metabolic engineering of Bacillus subtilis for terpenoid production[J].Applied Microbiology and Biotechnology, 2015, 99(22):9395-9406.
[18] ZHOU K, ZOU R Y, ZHANG C Q, et al.Optimization of amorphadiene synthesis in Bacillus subtilis via transcriptional, translational, and media modulation[J].Biotechnology and Bioengineering, 2013, 110(9):2556-2561.
[19] CUNNINGHAM F X Jr, GANTT E.A study in scarlet:Enzymes of ketocarotenoid biosynthesis in the flowers of Adonis aestivalis[J].The Plant Journal, 2005, 41(3):478-492.
[20] WU Y K, LIU Y F, LYU X Q, et al.CAMERS-B:CRISPR/Cpf1 assisted multiple-genes editing and regulation system for Bacillus subtilis[J].Biotechnology and Bioengineering, 2020, 117(6):1817-1825.
[21] LIU J H, WANG X L, JIN K, et al.In silico prediction and mining of exporters for secretory bioproduction of terpenoids in Saccharomyces cerevisiae[J].ACS Synthetic Biology, 2023, 12(3):863-876.
[22] SALIS H M, MIRSKY E A, VOIGT C A.Automated design of synthetic ribosome binding sites to control protein expression[J].Nature Biotechnology, 2009, 27(10):946-950.
[23] JING Y W, GUO F, ZHANG S J, et al.Recent advances on biological synthesis of lycopene by using industrial yeast[J].Industrial &Engineering Chemistry Research, 2021, 60(9):3485-3494.
[24] KANG W, MA T, LIU M, et al.Modular enzyme assembly for enhanced cascade biocatalysis and metabolic flux[J].Nature Communications, 2019, 10(1):4248.
[25] RABEHARINDRANTO H, CASTA O-CEREZO S, LAUTIER T, et al.Enzyme-fusion strategies for redirecting and improving carotenoid synthesis in S.cerevisiae[J].Metabolic Engineering Communications, 2019, 8:e00086.
O-CEREZO S, LAUTIER T, et al.Enzyme-fusion strategies for redirecting and improving carotenoid synthesis in S.cerevisiae[J].Metabolic Engineering Communications, 2019, 8:e00086.
[26] CHEAH L C, LIU L, STARK T, et al.Metabolic flux enhancement from the translational fusion of terpene synthases is linked to terpene synthase accumulation[J].Metabolic Engineering, 2023, 77:143-151.
[27] LI Y, WU Y K, LIU Y F, et al.A genetic toolkit for efficient production of secretory protein in Bacillus subtilis[J].Bioresource Technology, 2022, 363:127885.
[28] MA Y S, ZU Y X, HUANG S W, et al.Engineering a universal and efficient platform for terpenoid synthesis in yeast[J].Proceedings of the National Academy of Sciences of the United States of America, 2023, 120(1):e2207680120.
[29] VOLKE D C, ROHWER J, FISCHER R, et al.Investigation of the methylerythritol 4-phosphate pathway for microbial terpenoid production through metabolic control analysis[J].Microbial Cell Factories, 2019, 18(1):192.
[30] MA Y W, MCCLURE D D, SOMERVILLE M V, et al.Metabolic engineering of the MEP pathway in Bacillus subtilis for increased biosynthesis of menaquinone-7[J].ACS Synthetic Biology, 2019, 8(7):1620-1630.
[31] NETI S S, PAN J J, POULTER C D.Mechanistic studies of the protonation-deprotonation reactions for type 1 and type 2 isopentenyl diphosphate:Dimethylallyl diphosphate isomerase[J].Journal of the American Chemical Society, 2018, 140(40):12900-12908.
[32] LI Q Y, FAN F Y, GAO X, et al.Balanced activation of IspG and IspH to eliminate MEP intermediate accumulation and improve isoprenoids production in Escherichia coli[J].Metabolic Engineering, 2017, 44:13-21.
[33] 陈泰驰. 枯草芽孢杆菌代谢调控及过程优化发酵生产七烯甲萘醌[D].无锡:江南大学, 2020.CHEN T C.Genetic engineering and process optimization of Bacillus subtilis for menaquinone-7 production[D].Wuxi:Jiangnan University, 2020.
[34] BANERJEE A, WU Y, BANERJEE R, et al.Feedback inhibition of deoxy-D-xylulose-5-phosphate synthase regulates the methylerythritol 4-phosphate pathway[J].Journal of Biological Chemistry, 2013, 288(23):16926-16936.
[35] WANG Q, QUAN S, XIAO H.Towards efficient terpenoid biosynthesis:Manipulating IPP and DMAPP supply[J].Bioresources and Bioprocessing, 2019, 6(1):6.