紫皮石斛又名齿瓣石斛,是一种药食同源资源,药用历史悠久[1]。已有大量研究表明,紫皮石斛富含多糖、黄酮、生物碱、菲类、联苄类等活性成分,石斛多糖可通过多种途径起到降血糖、消炎、抗氧化、调节代谢、增强免疫等功效[2]。石斛多糖是一种富含O-乙酰基结构的葡甘露聚糖,连接单糖的共价键主要为β-(1→4)糖苷键[3]。纤维素酶、壳聚糖酶[4]、葡聚糖酶[5-6]和β-甘露聚糖酶[7-8]均能水解β-(1→4)糖苷键,如纤维素酶包括β-1,4-外葡聚糖酶、β-1,4-内葡聚糖酶和β-1,4-葡萄糖苷酶,其中β-1,4-外葡聚糖酶可以从末端切下纤维二糖;β-葡聚糖酶除了作用于葡聚糖的β-(1→4)糖苷键外,还可以作用于β-(1→3)糖苷键,包含内切酶和外切酶;β-甘露聚糖酶是一种内切酶,能够水解含β-(1→4)甘露糖苷键的甘露寡糖、甘露多糖(包括甘露聚糖、半乳甘露聚糖、葡萄甘露聚糖等)。
石斛保健产品研发以铁皮石斛为主,对紫皮石斛及其他种类石斛研究较少。产品形式主要集中在胶囊、片剂和颗粒[9],而茶饮、果饮、石斛酒较少,其中石斛酒大多数为浸酒和配制酒。浸酒对石斛活性成分的利用率较低且口感单一,配制酒则需对有效成分进行提取,工艺较为复杂。将石斛与其他药食同源类植物复配,混菌发酵开发养生保健酒,产生的代谢物可以用作益生元,并形成风味物质,改善口感。同时,通过酶解技术可以破坏植物细胞壁,促进多糖等有效成分的溶出,并降低多糖分子质量,促进人体对活性成分的吸收。
2023年云南龙陵紫皮石斛鲜条产量达1.2万t,浸泡石斛酒是当地的特色产品,尚无发酵酒产品。本研究以龙陵紫皮石斛鲜条为原料,确定石斛多糖酶解条件及酶解产物分子质量分布,考察紫皮石斛多糖在酒中的溶解性,用石斛多糖酶解液复配桑葚、枸杞、桂圆进行混合酵母发酵制备石斛酒,进一步分析石斛酒的有效成分,评价其抗氧化能力。
1 材料与方法
1.1 材料与仪器
紫皮石斛,云南省龙陵县富民石斛专业合作社;桑葚、枸杞、桂圆,北京同仁堂;黄豆粉,河南省商丘市柘城县马培中农产品;白砂糖,云南保山当地散装甘蔗白糖;纤维素酶(2万U/g)、葡聚糖酶(2万U/g)、β-甘露聚糖酶(10万U/g)、酸性蛋白酶(5万U/g)、风味蛋白酶(1.5万U/g),河南万邦化工科技有限公司;酵母,安琪酵母股份有限公司;DPPH、ABTS阳离子自由基、苹果酸、琥珀酸、柠檬酸,均为分析纯,上海阿拉丁生化科技股份有限公司;芦丁,上海麦克林生化科技有限公司;福林酚,北京索莱宝科技有限公司;氯仿、正丁醇、柠檬酸三钠、乙酸、乙醇、过硫酸钾、水杨酸、过氧化氢、FeSO4、Na2CO3、NaNO2、Al(NO3)3、NaOH、葡萄糖、苯酚、浓硫酸,均为国产分析纯。
高效液相色谱1515(配有示差折光检测器2414),美国Waters公司;RE-52A型旋转蒸发仪,上海亚荣生化仪器厂;HZQ-F160型振荡培养箱,中国科学院武汉仪器厂;EUROSTAR 40型电动搅拌器,德国IKA公司;PB12X1-101B型破壁机,美的集团股份有限公司;Multiskan FC酶标仪,美国Thermo Fisher公司。
1.2 实验方法
1.2.1 紫皮石斛多糖酶解液分子质量测定
将鲜石斛烘干,粉碎后过40目筛,50 ℃烘干24 h,按照1∶50(g∶mL)加入无水乙醇,160 r/min搅拌脱脂24 h后,过6层纱布,烘干。之后提取多糖,按照1∶15(g∶mL)加水,200 r/min磁力搅拌,70 ℃水提1 h,反复提取3次,合并滤液,3 700 r/min离心15 min,取上清液,旋蒸浓缩后加入4倍体积无水乙醇4 ℃醇沉过夜,抽滤后多次醇洗,固体于50 ℃烘干。再对多糖进行脱蛋白操作,按照1∶5(g∶mL)加水溶解多糖后按照1∶3体积比加入Sevag试剂[V(氯仿)∶V(正丁醇)=4∶1],30 ℃,200 r/min,摇床振荡20 min脱蛋白,3 000 r/min离心10 min,取上清液重复上述操作除蛋白5次,加入5倍无水乙醇醇沉后干燥得到粗多糖。
以未酶解石斛多糖溶液为对照,将粗多糖溶于pH 4.8的柠檬酸-柠檬酸三钠缓冲溶液中,取5 mL 5 g/L多糖溶液,分别加入0.01 g纤维素酶、0.01 g葡聚糖酶、0.02 g β-甘露聚糖酶、0.01 g纤维素酶及0.02 g β-甘露聚糖酶,于50 ℃酶解4 h后,按照4∶1(mL∶mL)加入无水乙醇除酶,12 000 r/min离心10 min,过0.22 μm滤膜后,高效凝胶色谱测定分子质量分布。
1.2.2 石斛多糖在酒中的溶解性
称取200 g鲜石斛,加入800 mL水匀浆,添加1%(质量分数)的纤维素酶,于50 ℃水浴锅中,200 r/min机械搅拌酶解1 h,80 ℃灭酶30 min,过6层纱布后,4 ℃静置过夜,得上清液为200 g/L石斛酶解液。将200 g鲜石斛,加入800 mL水匀浆,于50 ℃水浴锅中,200 r/min机械搅拌1 h,80 ℃保温30 min,过6层纱布后,4 ℃静置过夜,得上清液为200 g/L石斛原浆。将20%石斛酶解液和20%石斛原浆按照体积比5%、10%、15%、20%、30%、40%、50%添加无水乙醇模拟不同度数的酒,24 h后取样5 000 r/min离心10 min,测定上清液多糖含量。
1.2.3 石斛发酵酒的制备
按照料液比1∶5加入黄豆粉,等比例加入酸性蛋白酶及风味蛋白酶,酶添加总量为1 500 U/g,55 ℃酶解8 h,90 ℃灭酶10 min,10 000 r/min离心10 min,取上清液。在石斛纤维素酶水解液中加入250 g/L白砂糖和5.3%(体积分数)黄豆粉酶解液,混合物在90 ℃下灭菌30 min。各称取2.5 g耐高温活性干酵母和白葡萄酒果酒酵母至50 mL无菌水中,35 ℃活化20 min后接种,耐高温活性干酵母∶白葡萄酒果酒酵母=3∶7,接种量为0.05%,在30 ℃、200 r/min摇床中发酵1周。以不接菌作为对照。复配发酵石斛酒,10%鲜石斛的纤维素酶水解液为单方1,石斛(鲜)∶桑葚(干)∶枸杞(干)∶桂圆(干)复配比例为10∶1∶1∶0.1为复方1;220 g/L鲜石斛的纤维素酶水解液为单方2,石斛∶桑葚∶枸杞∶桂圆复配比例为22∶3∶1∶0.1为复方2。
1.2.4 总多糖、总黄酮及总酚含量测定
1.2.4.1 苯酚硫酸法测定总多糖含量[10]
葡萄糖105 ℃烘干2 h,取适当浓度的葡萄糖溶液200 μL,加入200 μL 5%(体积分数)苯酚,1 mL硫酸,混匀,沸水浴20 min后,冷水浴5 min,于488 nm处测定吸光值,绘制标准曲线。取200 μL稀释一定倍数的样品,加入1 mL乙醇,醇沉过夜后,12 000 r/min,离心10 min,弃掉上清液,醇洗2次后,沉淀加入1 mL水溶解,按照上述方法测定总多糖含量。
1.2.4.2 福林酚法测定总酚含量[11]
配制0.1 mg/mL没食子酸,取200 μL稀释适当倍数的没食子酸溶液,分别加入200 μL 1 mol/L福林酚溶液,600 μL 75 g/L的Na2CO3溶液和1 mL水,混匀,75 ℃水浴10 min,冷却后于765 nm处测吸光值。将样品溶液代替没食子酸溶液,测定样品中总酚含量。
1.2.4.3 Al(NO3)3-NaNO2-NaOH法测定总黄酮含量[11]
取不同体积0.3 g/L芦丁溶液,补水至1.2 mL,加入200 μL 50 g/L NaNO2,反应6 min后加入200 μL 100 g/L Al(NO3)3,混匀反应6 min后加入2 mL 50 g/L NaOH溶液,摇匀静置15 min,510 nm测定吸光值。
1.2.5 有机酸含量测定
酒中有机酸含量采用Waters高效液相色谱折光示差检测器检测,色谱柱为BioRad HPX-87H柱,流动相为5 mmol/L的稀硫酸,流动相流速为0.6 mL/min。
1.2.6 抗氧化活性测定
1.2.6.1 DPPH自由基清除能力测定
参照KUSZNIEREWICZ等[12]方法测定。将稀释10倍的样品溶液,等比例加入0.2 mmol/L DPPH无水乙醇溶液,充分混匀后避光放置30 min,以25 μg/mL 维生素C为阳性对照,稀释相同倍数,在517 nm波长处测定吸光度。DPPH自由基清除率按公式(1)计算:
自由基清除率![]()
(1)
式中:A1,样品溶液吸光度;A2,本底吸光度;A0,空白样品吸光度
1.2.6.2 ABTS阳离子自由基清除能力测定
参考万景瑞等[13]的方法测定。2.45 mmol/L K2S2O8溶液与7 mmol/L ABTS溶液1∶1(mL∶mL)混匀,避光静置12 h后,用无水乙醇稀释50倍左右,在734 nm下吸光值为0.7±0.02,得到ABTS阳离子自由基溶液。取200 μL稀释10倍的样品溶液,加入2.8 mL ABTS阳离子自由基溶液,37 ℃避光反应10 min,于734 nm处测定吸光度,以0.1 g/L 维生素C为阳性对照。参照公式(1)计算ABTS阳离子自由基清除率。
1.2.6.3 羟自由基(·OH)清除能力测定
参考常飞等[14]的方法测定。取2 mL稀释10倍的样品溶液,6.0 mmol/L FeSO4和6.0 mmol/L水杨酸各300 μL,再加入1 mL 6.0 mmol /L 的H2O2溶液启动反应,于37 ℃水浴30 min,3 000 r/min离心10 min,取上清液于510 nm波长处测定吸光度,以1 g/L 维生素C为阳性对照。参照公式(1)计算·OH清除率。
1.3 数据处理
每组试验均重复3次,结果表示为“平均值±标准差”,利用Origin Pro 2018软件处理数据并绘图。
2 结果与分析
2.1 紫皮石斛及其酶解液中多糖分子质量分布
免疫调节活性是石斛多糖最重要的生物活性之一。有研究表明,天然多糖分子主要通过细胞膜上的Toll样受体的识别发挥免疫调节作用[15],而这种识别作用与石斛多糖分子质量密切相关,分子质量较小的多糖更易被细胞吸收,易被受体识别,引起免疫应答[16]。由图1中峰形可以看出,紫皮石斛多糖主要有两大组分,其中分子质量较小的组分(图1-a左峰)几乎与是否酶解无关,3种酶对其都没有降解作用。而分子质量较大的组分(图1-a右峰)经酶解后降解成小分子,说明该组分多糖主要由β-1,4糖苷键连接。由表1可知,与紫皮石斛原液相比,经酶解后其数均分子质量、重均分子质量及Z均分子质量均降低,其中纤维素酶酶解后紫皮石斛多糖的分子质量降低最显著,数均分子质量由7.88×103 Da降至5.01×102 Da,重均分子质量由1.82×104 Da降至6.79×103 Da,Z均分子质量由3.75×104 Da降至1.79×104 Da,多分散系数由2.32扩大至13.54。纤维素酶水解后紫皮石斛多糖的数均分子质量、重均分子质量及Z均分子质量比β-甘露聚糖酶更小;β-甘露聚糖酶及纤维素酶复合酶水解的效果介于2个酶单独水解之间。葡聚糖酶多分散系数增大幅度较小(表1),表明其多糖分子质量分布较窄,且其数均分子质量较大,为3.10×103 Da。有文献报道,使用中性蛋白酶和纤维素酶复合酶水解铁皮石斛,得到的石斛多糖得率为43.85%[17]。陈立弟[18]通过响应面优化铁皮石斛多糖提取条件,水提多糖得率为15.7%,纤维素酶解多糖得率为25.6%,较未酶解提升63.06%,且酶解保护了多糖的微观结构。另有研究表明,低分子质量多糖片段抑制肿瘤细胞增殖作用较强[19],具有良好的免疫调节活性[20]。
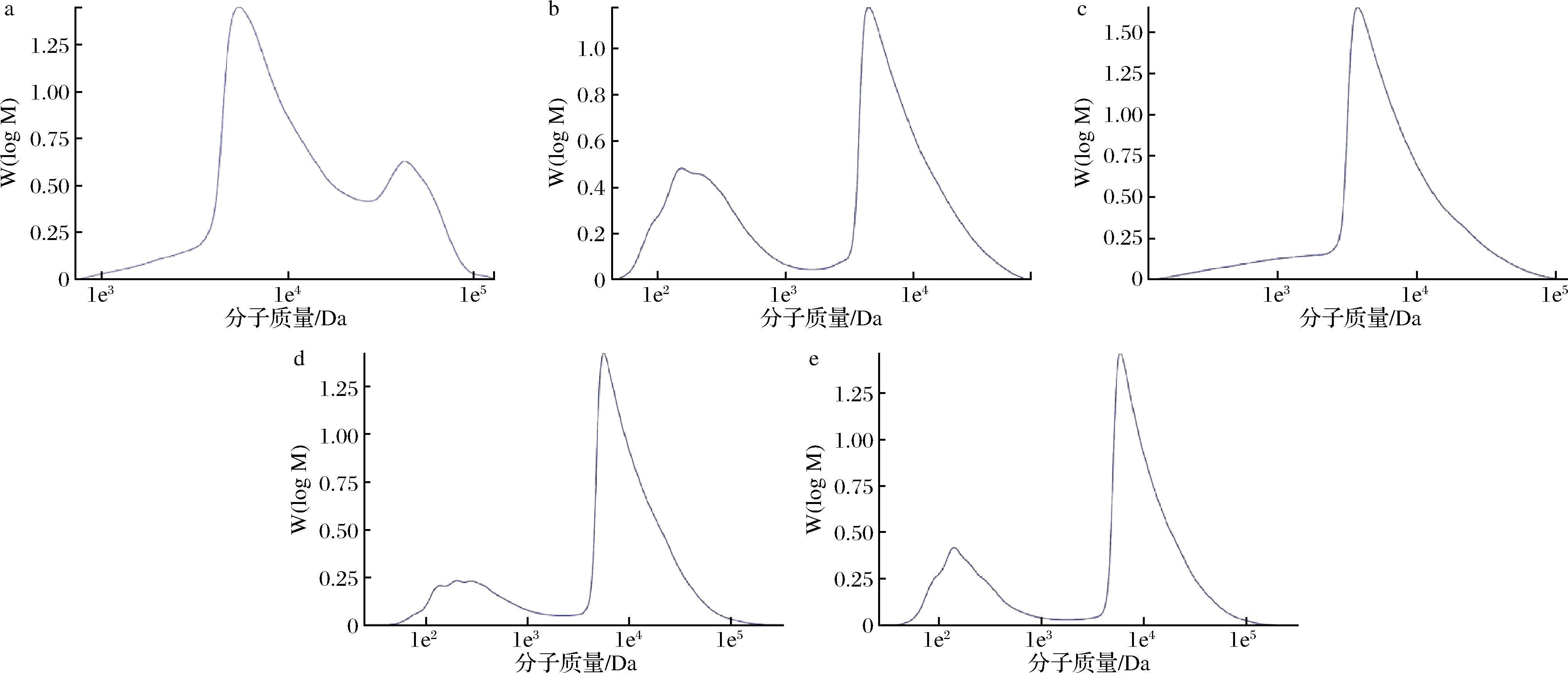
a-石斛原液;b-纤维素酶水解液;c-葡聚糖酶水解液;d-β-甘露聚糖酶水解液;e-纤维素酶和β-甘露聚糖酶复合酶水解液
图1 紫皮石斛原液和酶解液中多糖分子质量分布
Fig.1 Molecular weight distribution of D.devonianum polysaccharides hydrolysed without or with enzyme
表1 酶解后石斛多糖分子质量分布
Table 1 Molecular weight distribution of D.devonianum polysaccharides after enzymolysis
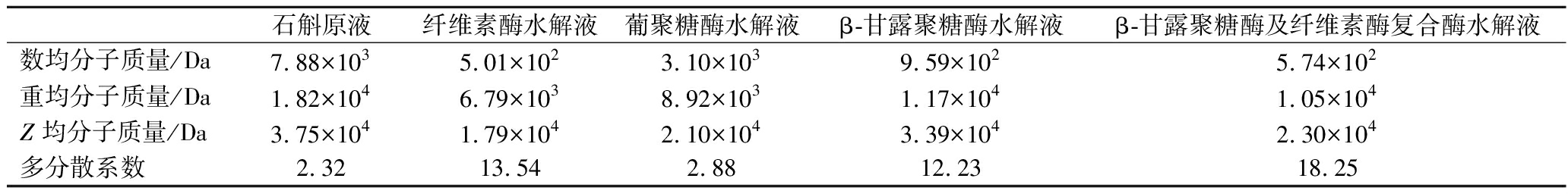
石斛原液纤维素酶水解液葡聚糖酶水解液β-甘露聚糖酶水解液β-甘露聚糖酶及纤维素酶复合酶水解液数均分子质量/Da7.88×1035.01×1023.10×1039.59×1025.74×102重均分子质量/Da1.82×1046.79×1038.92×1031.17×1041.05×104Z均分子质量/Da3.75×1041.79×1042.10×1043.39×1042.30×104多分散系数2.3213.542.8812.2318.25
2.2 乙醇对石斛多糖溶解度的影响
多糖不易溶于高度酒中,发酵后低度酒中存在多糖含量较低的问题。任运红等[21]使用产乳酸芽孢杆菌DU-106和酿酒酵母菌171发酵铁皮石斛酒,酒精度为5.2%vol,多糖含量仅为4.99 g/L。由图2可知,随着无水乙醇含量的增加,石斛多糖沉出,含量降低,当无水乙醇含量低于15%时,石斛原浆多糖含量明显降低,而石斛酶解液多糖含量几乎不变。由此可得出当石斛酒低于15%vol时,可保留石斛多糖成分,因此制备的石斛发酵酒的酒精度应当在10~15%vol为宜。当乙醇含量低于15%时,石斛酶解液多糖含量可达11.10 g/L。当无水乙醇含量大于20%时,石斛酶解液多糖含量较石斛原浆含量降低缓慢,且当无水乙醇含量为50%时,石斛酶解液多糖含量为3.61 g/L,高于石斛原浆多糖含量0.68 g/L。表明经纤维素酶水解,产生的小分子质量石斛多糖,可在高浓度乙醇中保留,而石斛原浆多糖分子质量较大,几乎不溶解于高浓度乙醇,纤维素酶水解对石斛高度酒的制备具有明显优势。然而,汪江波等[22]利用超声波细胞破碎技术提取石斛多糖,得到的51%vol石斛配制酒中多糖含量达到20.71 g/L。醇沉时间是影响测得多糖含量高低的重要原因之一,不同的醇沉时间测定的多糖含量存在较大差异。随着醇沉时间增加,沉淀越多,上清液中多糖含量减少。廖彭莹等[23]对杨桃根多糖醇沉工艺进行优化,醇沉12 h时,得到的多糖含量最高。
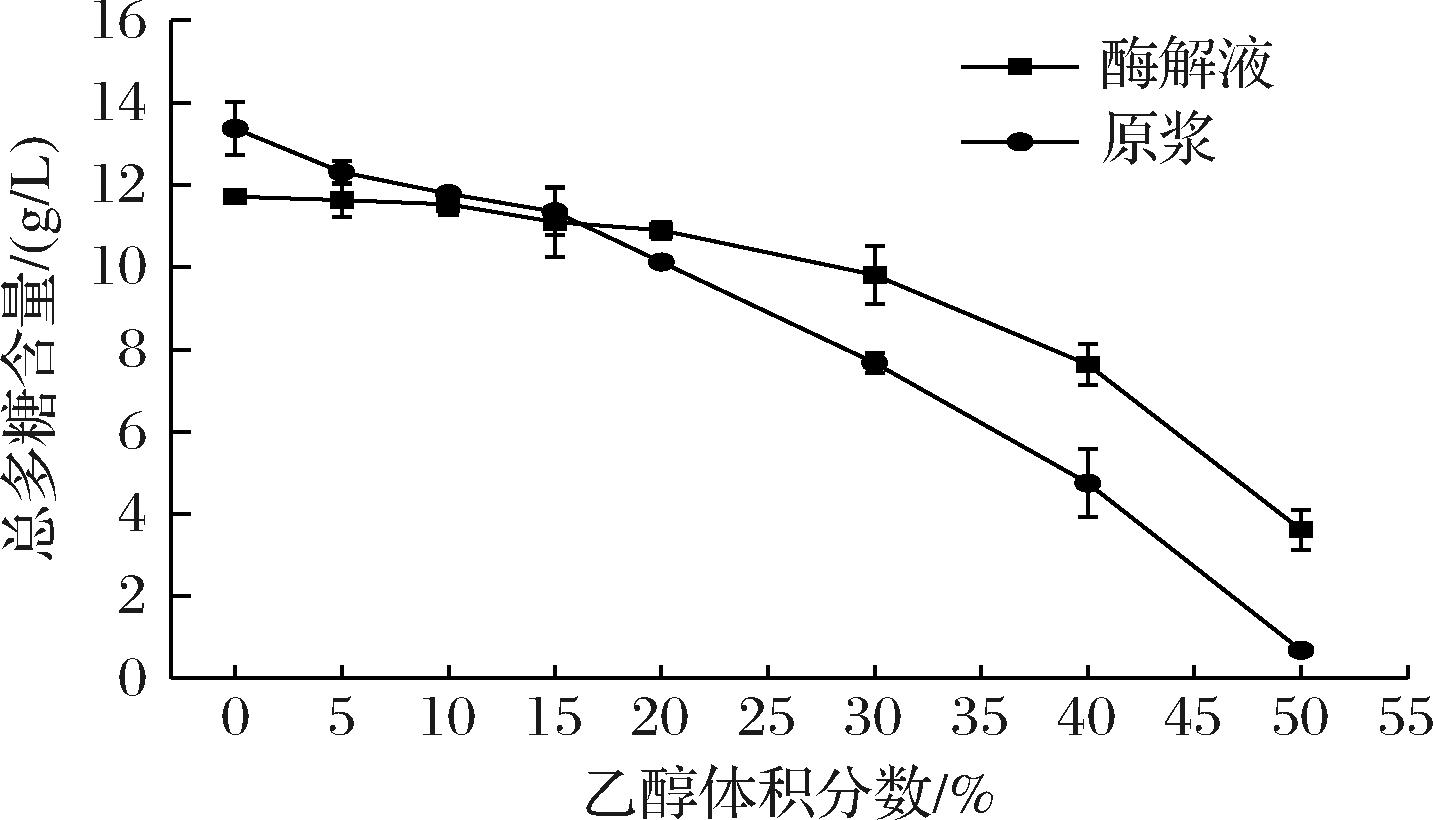
图2 乙醇对石斛原浆和酶解液中多糖溶解度的影响
Fig.2 Influence of ethanol concentration on solubility of polysaccharides in origin fluid and enzymatic hydrolysate of D.devonianum
2.3 石斛酒中有机酸种类及含量
紫皮石斛富含多糖,但黄酮及酚类含量较少,复配制备石斛发酵酒,不同原料之间可以优势互补,改善酒的口感,提升石斛酒品质[24]。因此本文对单方和复方发酵进行比较,复方2参考董悦生等[25]制备的具有降糖功效的复配石斛原浆,并在此基础上进行改进。有机酸是功能性食品中需要检测的重要活性成分。菌种、原料、发酵条件等都会对果酒发酵前后有机酸种类、含量产生影响。有机酸可以平衡果酒风味、口感和色泽,甚至对酒中各类化学物质含量产生影响[26]。由表2可知,石斛酒中有机酸主要为柠檬酸、苹果酸、琥珀酸及乙酸4种有机酸。苹果酸是石斛酒中含量最高的有机酸,呈味时间长,略苦涩。柠檬酸呈现清爽的酸味,而琥珀酸既酸又略带苦味,其参与果酒中酯类物质的代谢及酒味的合成[27]。乙酸是由乙醇氧化而来,具有强烈刺激,是酒类主要挥发酸,应尽量减少乙酸的产生。复方1柠檬酸、苹果酸、琥珀酸及乙酸含量分别为0.4、2.12、0.58、1.22 g/L,较单方1,4种有机酸含量均升高。复方2柠檬酸、琥珀酸含量分别为0.78、1.16 g/L,较单方2,2种有机酸含量升高。苹果酸和乙酸含量分别为1.20、1.32 g/L,较单方2,2种有机酸含量降低。
表2 石斛酒酒精度及有机酸含量
Table 2 Alcohol content and organic acid content ofD.devonianum wine
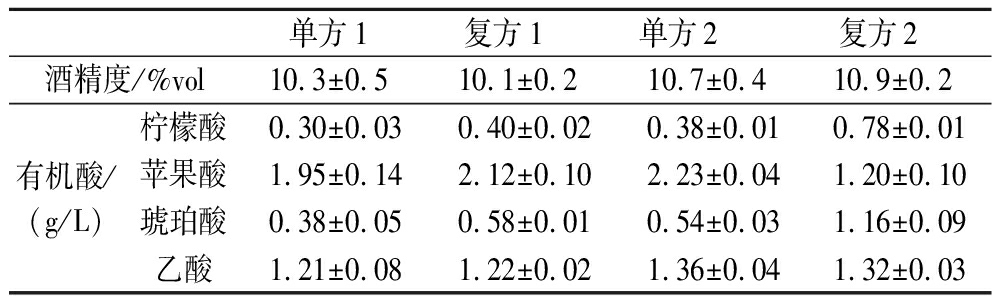
单方1复方1单方2复方2酒精度/%vol10.3±0.5 10.1±0.2 10.7±0.4 10.9±0.2 有机酸/(g/L)柠檬酸0.30±0.030.40±0.020.38±0.010.78±0.01苹果酸1.95±0.142.12±0.102.23±0.041.20±0.10琥珀酸0.38±0.050.58±0.010.54±0.031.16±0.09乙酸1.21±0.081.22±0.021.36±0.041.32±0.03
2.4 石斛酒中有效成分含量
植物多糖、黄酮和多酚类化合物是天然抗炎症和抗氧化剂的主要来源,具有潜在的保健功效。由图3-a可知,单方1及复方1发酵后多糖含量降低,单方2及复方2发酵后多糖含量分别升高16.47%、1.86%,其中复方2多糖含量达到11.18 g/L。发酵前后多糖含量变化与菌种、氮源、接种量等因素密切相关。王丹等[28]利用酵母菌、霉菌、乳杆菌发酵铁皮石斛多糖,发现只有霉菌发酵后多糖含量升高,这可能是由于霉菌酶系发达,在发酵过程中能够将淀粉等其他物质转换为可溶性糖。秦哲[29]筛选出一株能够提高黄芪多糖含量的黑曲霉,发酵后黄芪多糖含量提高了22%,且发酵前后黄芪多糖的结构没有发生较大变化。除此之外,微生物生长状态也会引起发酵前后多糖含量的变化。在发酵过程中,多糖含量变化与菌体生长代谢密切相关,当生长代谢受阻时会利用一部分多糖,当生长代谢旺盛时会分泌一些胞外多糖。白海等[30]对中药渣固态发酵前后蛋白质和多糖含量的变化进行研究,发现当为微生物提高适量的氮源,接种量、发酵时间等发酵条件适宜时,利于微生物生长,促使药渣中的蛋白质、多糖含量增加,并且混菌发酵存在一定的协同增效作用,促进了多糖的代谢合成。

a-总多糖含量;b-黄酮含量;c-总酚含量
图3 发酵前后有效成分含量变化
Fig.3 Changes of active ingredient content before and after fermentation
由图3-b及图3-c可知,复方发酵酒较单方,黄酮含量及总酚含量得到明显提升,复方2黄酮含量达到0.53 g/L,总酚含量达到0.58 g/L。汪江波等[22]利用超声波细胞破碎技术制备铁皮石斛配制酒,其石斛多酚、石斛总黄酮含量分别为0.39、0.21 g/L。单方1及单方2发酵后黄酮含量分别提高1.84、2.85倍,总酚含量分别提高14.30%、12.69%。而复方1及复方2发酵后黄酮含量和总酚含量降低。发酵过程中,菌体可以将简单的酚类物质转化,也可以解聚大分子酚类化合物,可能导致了发酵过程中的总酚和总黄酮含量降低[31]。
2.5 石斛酒的抗氧化活性
发酵能够将共轭酚类化合物转化为游离形式,从而增强抗氧化活性,是一种增加多酚化合物的生物利用率、保护细胞应对氧化应激的有效方式[32]。通过测定酒中DPPH自由基、ABTS阳离子自由基、·OH清除能力来评价不同复配酒的抗氧化活性。由图4-a和图4-b可以发现总酚含量、黄酮含量与DPPH自由基清除活性、ABTS阳离子自由基清除活性呈现正相关,相较于多糖,黄酮和酚类化合物具有更好的自由基清除能力。NARDINI等[33]对果酒中生物活性成分进行表征,并对果酒抗氧化活性进行研究,结果表明抗氧化活性与多酚、黄酮类化合物和总酚酸含量之间的强相关性,酚类化合物在果酒抗氧化性能中起着核心作用。

a-DPPH自由基;b-ABTS阳离子自由基;c-·OH
图4 不同石斛复配酒自由基清除差异
Fig.4 The difference of free radical scavenging in different D.devonianum mixed wine
通过发酵,单方1、复方1、单方2 DPPH自由基清除率分别提升39.34%、8.48%、4.97%。25 mg/L 维生素C DPPH自由基清除率为32.60%,与单方1及单方2 DPPH自由基清除效果相近。复方2稀释10倍后DPPH自由基清除率可达88.17%,是25 mg/L 维生素C效果的2.7倍。发酵后,单方1、复方1、单方2、复方2 ABTS阳离子自由基清除率分别提升67.47%、0.06%、9.79%、2.67%。0.1 g/L 维生素C ABTS阳离子自由基清除率为19.06%,复方2 ABTS阳离子自由基清除率可达84.16%,是0.1 g/L 维生素C效果的4.42倍。发酵后,复方1及单方2 ·OH清除率分别提升2.72%、9.88%。1 g/L 维生素C ·OH清除率为47.36%,复方2 ·OH清除率可达88.17%,是1 g/L 维生素C效果的1.86倍。复配酒发酵后抗氧化活性增强与发酵后总多酚和黄酮含量降低并不矛盾。有研究表明,槲皮素、根皮素等物质通过羟基与糖或糖苷缀合,发酵过程中,槲皮素糖苷化合物和根皮苷结构中葡萄糖分子被菌体分解代谢,可以产生具有很强的抗氧化活性的槲皮素、根皮素[31-32]。
3 结论与讨论
酶解技术能够破坏植物细胞壁,有利于有效成分的释放,提高药食同源植物的生物利用度,将在未来药食同源类食品开发中广泛应用。使用纤维素酶解紫皮石斛多糖效果明显,得到501 Da小分子质量多糖,且小分子质量多糖更易在高度酒中保留,为石斛酒的制备奠定基础。石斛多糖可以在低度酒中保留,发酵前后,多糖含量变化与微生物生长状态密切相关。单用石斛发酵,黄酮和总酚含量均较低,复方发酵较单方具有明显优势。通过复方发酵使得复配酒中含有更高的黄酮和总酚,分别为0.53、0.58 g/L,DPPH自由基、ABTS阳离子自由基及·OH清除能力均较高,黄酮和酚类物质在复配酒抗氧化活性中起着核心作用。该研究拓宽了紫皮石斛保健产品的种类,为石斛产业提供理论支持,有利于紫皮石斛及石斛酒的发展。
[1] 吴蓓丽, 赵铮蓉, 刘骅, 等.紫皮石斛研究进展[J].中成药, 2020, 42(11):2990-2998.WU B L, ZHAO Z R, LIU H, et al.Research progress of Dendrobium nobile[J].Chinese Traditional Patent Medicine, 2020, 42(11):2990-2998.
[2] 刘袆帆, 郭烁璇, 林映妤, 等.石斛多糖的构效关系研究进展[J].现代食品科技, 2021, 37(1):308-338.LIU H F, GUO S X, LIN Y Y, et al.The relationship between the structure and function of Dendrobium polysaccharides:A review[J].Modern Food Science and Technology, 2021, 37(1):308-338.
[3] DENG Y, LI M, CHEN L X, et al.Chemical characterization and immunomodulatory activity of acetylated polysaccharides from Dendrobium devonianum[J].Carbohydrate Polymers, 2018, 180:238-245.
[4] 马强, 杨焱, 张忠, 等.猴头菌子实体粉的复合酶解及其功能特性[J].食用菌学报, 2022, 29(2):54-64.MA Q, YANG Y, ZHANG Z, et al.Multienzyme complex hydrolysis of Hericium erinaceus fruiting body powder and in vitro activity of the released polysaccharides[J].Acta Edulis Fungi, 2022, 29(2):54-64.
[5] YANG L, ZI C T, CHEN D K, et al.Target acquisition of anti-aging manno-oligosaccharide that triggers ECM process via TGF-β/Smads-SIRT1 signalling pathway[J].Carbohydrate Polymers, 2023, 302:120380.
[6] 李世杰, 李勇, 曾海英.茯苓多糖的酶解工艺及抑菌性研究[J].中国酿造, 2018, 37(5):177-180.LI S J, LI Y, ZENG H Y.Hydrolysis technology and bacteriostatic activity of polysaccharide from Poria cocos[J].China Brewing, 2018, 37(5):177-180.
[7] 刘冰. 霍山石斛(栽培)多糖化学结构系统解析及抗胃癌活性构效关系研究[D].合肥:合肥工业大学, 2019.LIU B.Systematic analysis of chemical structure and structure-activity relationship of polysaccharide from Dendrobium huoshanense (cultivated)[D].Hefei:Hefei University of Technology, 2019.
[8] 刘金龙, 毕文刚, 王安江, 等.小孢根霉C97102734及应用:中国,CN105602859A[P].2016-05-25.LIU J L, BI W G, WANG A J, et al. Rhizopusmicrosporus C97102734 and its application:China,CN105602859A[P]. 2016-05-25.
[9] 罗昭勇, 姜艳, 余晓历, 等.石斛多糖的结构特征、生物活性、构效关系及产品开发进展[J].食品工业科技, 2024, 45(15):429-442.LUO Z Y, JIANG Y, YU X L, et al.Research progress on structure characteristics, biological activity, structure-activity relationship and product development of Dendrobium polysaccharides[J].Science and Technology of Food Industry, 2024, 45(15):429-442.
[10] 范传颍, 陶正明, 吴志刚.苯酚硫酸法与蒽酮硫酸法测定铁皮石斛中多糖含量的比较[J].浙江农业科学, 2013, 54(7):799-801.FAN C Y, TAO Z M, WU Z G.Comparison between phenol-sulfuric acid method and anthrone sulfuric acid method for determination of polysaccharide content in Dendrobium candidum[J].Journal of Zhejiang Agricultural Sciences, 2013, 54(7):799-801.
[11] 王海敏, 虞海霞, 董蕊, 等.苕子蜜总酚酸和总黄酮含量测定及抗氧化活性的研究[J].食品科学, 2010, 31(1):54-57.WANG H M, YU H X, DONG R, et al.Antioxidant activities and contents of total phenolic acid and total flavonoids in Vicia villosa Roth honey[J].Food Science, 2010, 31(1):54-57.
[12] KUSZNIEREWICZ B, PIEKARSKA A, MRUGALSKA B, et al.Phenolic composition and antioxidant properties of Polish blue-berried honeysuckle genotypes by HPLC-DAD-MS, HPLC postcolumn derivatization with ABTS or FC, and TLC with DPPH visualization[J].Journal of Agricultural and Food Chemistry, 2012, 60(7):1755-1763.
[13] 万景瑞, 蒋鹏飞, 史冠莹, 等.三种发酵酒活性成分、抗氧化活性及其香气成分对比分析[J].食品工业科技, 2020, 41(21):253-260; 265.WAN J R, JIANG P F, SHI G Y, et al.Comparative analysis of active ingredients, antioxidant activity and aromatic components of three kinds of fermented wine[J].Science and Technology of Food Industry, 2020, 41(21):253-260; 265.
[14] 常飞, 杨雪果, 肖士成, 等.脱脂羊脑蛋白水解多肽的分离纯化及抗氧化活性[J].食品科学, 2016, 37(1):33-39.CHANG F, YANG X G, XIAO S C, et al.Purification and antioxidant activity of peptides derived from defatted goat brain protein[J].Food Science, 2016, 37(1):33-39.
[15] URIBE-QUEROL E, ROSALES C.Control of phagocytosis by microbial pathogens[J].Frontiers in Immunology, 2017, 8:1368.
[16] 赵小丹, 刘玉, 陶新玉, 等.不同相对分子质量的铁皮石斛多糖对细胞免疫活性的影响[J].中国药学杂志, 2023, 58(11):997-1004.ZHAO X D, LIU Y, TAO X Y, et al.Study on cellular immune activity of Dendrobium officinale polysaccharide with different molecular weight[J].Chinese Pharmaceutical Journal, 2023, 58(11):997-1004.
[17] 薛燕, 敢小双, 黄开丽, 等.铁皮石斛多糖复合酶法提取工艺及其抗氧化性[J].食品工业科技, 2018, 39(3):215-219; 225.XUE Y, GAN X S, HUANG K L, et al.Extraction process of polysaccharide by compound enzymatic method of Dendrobium officinale and its antioxidant activity[J].Science and Technology of Food Industry, 2018, 39(3):215-219; 225.
[18] 陈立弟. 铁皮石斛多糖的提取、抗氧化活性及其多糖/介孔二氧化硅纳米粒的制备研究[D].深圳:深圳大学, 2017.CHEN L D.Study on extraction and antioxidant activity of Dendrobium candidum polysaccharide and preparation of polysaccharide/mesoporous silica nanoparticles[D].Shenzhen:Shenzhen University, 2017.
[19] 柯汉女. 不同分子量铁皮石斛多糖分离及抗肿瘤、抗氧化活性研究[D].广州:广州中医药大学, 2016.KE H N.Isolation of polysaccharides from Dendrobium officinale with different molecular weight and their antitumor and antioxidant activities[D].Guangzhou:Guangzhou University of Chinese Medicine, 2016.
[20] 童微. 分子量及分子修饰对铁皮石斛多糖免疫调节活性的影响[D].南昌:南昌大学, 2017.TONG W.Effects of molecular weight and molecular modification on immunomodulatory activity of Dendrobium candidum polysaccharide[D].Nanchang:Nanchang University, 2017.
[21] 任运红, 徐雅囡, 钟淳菲, 等.铁皮石斛发酵酒品质特性研究[J].中国酿造, 2020, 39(5):92-96.REN Y H, XU Y N, ZHONG C F, et al.Quality characteristics of fermented Dendrobium candidum wine[J].China Brewing, 2020, 39(5):92-96.
[22] 汪江波, 蒋祥瑞, 叶成玉, 等.铁皮石斛配制酒制备工艺优化及其体外抗氧化活性研究[J].中国酿造, 2022, 41(2):156-163.WANG J B, JIANG X R, YE C Y, et al.Optimization of preparation technology of Dendrobium officinale blended liquor and its antioxidant activity in vitro[J].China Brewing, 2022, 41(2):156-163.
[23] 廖彭莹, 陈敏玉, 孙雪芹.杨桃根多糖醇沉工艺优化研究[J].广州化工, 2022, 50(15):65-68.LIAO P Y, CHEN M Y, SUN X Q.Optimization of alcohol precipitation process of polysaccharide from Averrhoa carambola root[J].Guangzhou Chemical Industry, 2022, 50(15):65-68.
[24] 赵婕, 袁倩, 张序, 等.混合发酵对早酥梨-美乐低醇桃红果酒品质的影响[J].食品与发酵工业, 2022, 48(22):119-127.ZHAO J, YUAN Q, ZHANG X, et al.Effect of mixed fermentation on the quality of Zaosu pear-Merlot low-alcohol rose fruit wine[J].Food and Fermentation Industries, 2022, 48(22):119-127.
[25] 董悦生, 刘浩东, 修志龙, 等.一种复配石斛原浆及其制备方法和应用:CN 113456757 B[P].2022-10-21.DONG Y S, LIU H D, XIU Z L, et al.Compound Dendrobium protoplasm, preparation method and application:CN 113456757 B[P].2022-10-21.
[26] 滕达, 司静涛, 赵进, 等.基于高效液相色谱法分析梨酒发酵前后有机酸变化[J].食品研究与开发, 2023, 44(17):153-159.TENG D, SI J T, ZHAO J, et al.Detection of organic acids in pear juice and pear wine by high performance liquid chromatography[J].Food Research and Development, 2023, 44(17):153-159.
[27] 曾竟蓝, 马胤鹏, 秦丹, 等.果酒中有机酸的作用及检测方法研究[J].中国酿造, 2018, 37(6):183-187.ZENG J L, MA Y P, QIN D, et al.Research on effect and detection method of organic acids in fruit wine[J].China Brewing, 2018, 37(6):183-187.
[28] 王丹, 袁永俊, 谭青云, 等.不同菌种发酵对铁皮石斛多糖及其生物活性的影响[J].中国调味品, 2019, 44(9):39-43.WANG D, YUAN Y J, TAN Q Y, et al.Effects of different strains fermentation on polysaccharide and biological activity of Dendrobium candidum[J].China Condiment, 2019, 44(9):39-43.
[29] 秦哲. 黄芪发酵后主要有效成分变化分析及多糖对大鼠实验性肝纤维化影响[D].兰州:甘肃农业大学, 2012.QIN Z.Changes of main effective components of Astragalus after fermentation and effects of polysaccharides on experimental hepatic fibrosis in rats[D].Lanzhou:Gansu Agricultural University, 2012.
[30] 白海, 高阳, 刘丽敏, 等.中药渣固态发酵前后蛋白质和多糖含量的变化[J].山西大同大学学报(自然科学版), 2021, 37(1):84-87.BAI H, GAO Y, LIU L M, et al.Changes of protein and polysaccharide content in Chinese medicine residue before and after solid state fermentation[J].Journal of Shanxi Datong University (Natural Science Edition), 2021, 37(1):84-87.
[31] 李仲禧. 苹果汁植物乳杆菌发酵对多酚化合物抗氧化活性的影响[D].上海:上海海洋大学, 2019.LI Z X.Effect of Lactobacillus plantarum fermentation on antioxidant activity of polyphenols in apple juice[D].Shanghai:Shanghai Ocean University, 2019.
[32] CAI Y Z, SUN M, JIE XING, et al.Structure-radical scavenging activity relationships of phenolic compounds from traditional Chinese medicinal plants[J].Life Sciences, 2006, 78(25):2872-2888.
[33] NARDINI M, GARAGUSO I.Characterization of bioactive compounds and antioxidant activity of fruit beers[J].Food Chemistry, 2020, 305:125437.