发酵肉制品是利用微生物或酶的发酵作用,在自然或人工控制条件下,使原料肉经历一系列生物化学和物理变化,提供延长肉制品保藏期的特性,且最终产生出具有特殊风味、色泽和质地的肉制品[1]。中国传统的发酵肉制品大多分布于我国的浙江、云南和贵州等地[2],其中酸肉是发酵肉制品具有代表性的种类之一,以香气怡人,清爽上口,食之不腻为特点,常作为待客的最佳肉制品[3]。常见的微生物发酵剂有乳酸菌和葡萄球菌等,乳酸菌占主导地位[4]。
乳酸菌在肉制品发酵过程中起到抑制有害微生物生长[5-6]、降低亚硝胺含量[7]、保健能力[8]、改善肉制品的风味和口感[9-10]以及抗氧化能力[11],因此,乳酸菌经常被作为一种安全无害的功能性微生物,被广泛应用于食品和医药领域[12]。乳酸菌在发酵过程中可以参与各种复杂的通路,这是乳酸菌常被用于发酵肉制品中且对其产品品质起决定性作用的关键原因之一。HU等[13]发现通过接种4种乳酸菌(清酒、植物LBMDJ2、希腊W.HRB6和乳酸LCB0)可以促进总游离氨基酸和挥发性化合物的产生,改善肉制品的风味;TIAN等[14]研究发现通过接种瑞士乳杆菌TR1-1-3和ZF22丰富风味化合物的类型和数量来改善发酵香肠风味;WANG等[15]发现通过接种植物乳植杆菌C7和华氏葡萄球菌S6d可达到pH降低加速、可滴定酸增加、蛋白质和脂质含量降低的效果,以此来改善发酵肉的风味品质。随着人们对发酵肉制品的品质和风味要求不断提高,乳酸菌在不同发酵环境下的适应性、耐受性和发酵特性也受到更高的关注。目前,发现在非乳制品的基质中的乳酸菌生长速度较慢,需要进行优化。因此,选取适合肉制品发酵环境并具有强发酵特性的乳酸菌成为研究人员关注的焦点,这对于改善发酵肉制品的品质和风味具有重要意义。
本文为了解不同乳酸菌菌株生长特性及发酵特性的差异,选择实验室酸肉中分离出来的3种优势乳酸菌菌株植物乳植杆菌、戊糖片球菌、乳酸片球菌,通过对菌株生长曲线与产酸曲线、耐受性、蛋白降解能力以及脂肪水解能力测定等指标进行分析,以期为后续发酵肉制品的开发及品质研究提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料
菌株:植物乳植杆菌、戊糖片球菌、乳酸片球菌分离于河南农业大学食品加工与安全实验室的自制酸肉。
1.1.2 试剂与仪器
中性红指示剂、溴甲酚紫指示剂,上海阿拉丁生化科技股份有限公司;所有化学试剂均为国产试剂;MRS液体培养基,青岛海博生物技术有限公司;选择培养基在MRS液体培养基的基础上添加15 g/L的琼脂[16]、2%、4%、6%、8%(NaCl与MRS体积比,下同)的7 mol/L NaCl、50、100、150 mg/kg NaNO2、添加10 g/L的葡萄糖、5 g/L乙酸钠、1.6%(体积分数)的溴甲酚紫溶液、5 g/L干酪素、150 g/L的猪油和中性红指示剂[17]。
AIRTECH-SW-CJ-2FD无菌操作台,美国Airtech公司;HI99163手持pH计,德国Hanna公司;TU-1901紫外分光光度仪,北京普析通用仪器有限公司;Synergy H1酶标仪,北京质研科技有限公司;VORTEX-2GENIE涡旋振荡器,美国Scientific Industries公司。实验所用厨房用具使用前均已进行灭菌处理。
1.2 试验方法
1.2.1 菌株的生长特性
1.2.1.1 菌株生长曲线
经活化后的菌株调整OD600值至0.1~0.65,接种于MRS液体培养基中,37 ℃培养30 h,用酶标仪测定菌液的OD600。
1.2.1.2 菌株产酸曲线
经活化后的菌株调整OD600值至0.1~0.65,接种于MRS液体培养基中,37 ℃培养24 h,用pH计测定菌液的pH值。
1.2.1.3 菌株不同温度下生长能力的测定
经活化后的菌株调整OD600值至0.1~0.65,接种于MRS液体培养基中,分别于27、32、37、42、47、52 ℃条件下培养24 h,用酶标仪在波长600 nm下测定菌液的OD值。
1.2.1.4 菌株间的拮抗试验
参照王馨[18]的方法并稍作修改,观察划线相交处是否有菌落长出。
1.2.2 菌株的耐受性
1.2.2.1 菌株耐盐性测定
参照徐鑫等[19]的方法并稍作修改,将活化后的菌株接种于NaCl含量为0%、2%、4%、6%、8%的5组MRS液体培养基中培养,用酶标仪在波长600 nm下测定OD值。
1.2.2.2 菌株耐亚硝酸盐性测定
参照张秋会等[20]的方法进行修改,将活化后的菌株接种于NaNO2含量为0、50、100、150 mg/kg的4组MRS液体培养基中培养,用酶标仪在波长600 nm下测定OD值。
1.2.2.3 菌株耐酸性测定
参照焦阳阳[21]的方法进行修改,将活化后的菌株接种于pH值为3、3.5、4、4.5、5、5.5、6的9 mL液体培养基中培养,用酶标仪在波长600 nm下测定OD值。
1.2.2.4 致死温度的测定
参照刘素纯等[22]的方法进行修改,将培养基温度恒定为55、60、65、70、75、80 ℃等6个不同温度,接种处于对数期的等量(2 mL,108 CFU/mL)被分离的菌悬液,保温30 min后,立即取出放入冰水中使温度迅速下降至常温后,在37 ℃培养48 h,观察菌株生长。
1.2.3 菌株的发酵性能的研究
1.2.3.1 葡萄糖降解能力测定
活化第二代后用生理盐水或PBS调整OD600值至0.1~0.65,接种2%在葡萄糖产气培养基,37 ℃恒温培养24 h,观察培养基的颜色是否由紫色变为黄色(产酸)同时观察小导管中有无气泡产生(产气),选择阴性菌株。
1.2.3.2 蛋白质降解能力测定
将培养好的菌液取0.1 mL滴入添加5 g/L干酪素的固体MRS培养基中,涂布均匀,于37 ℃恒温条件下培养48 h。当酪蛋白被分解后,观察菌落周围出现的透明环,根据现象判定菌株有无蛋白质降解活性[22]。
1.2.3.3 脂肪降解能力测定
在MRS固体培养基中添加150 g/L的猪油和中性红指示剂,制成无菌平板,取等量(0.1 mL,105 CFU/mL)被分离菌株的菌悬液于平板表面涂布均匀,30 ℃培养48 h观察,若该菌株能分解脂肪产生脂肪酸,则在平板上出现红色透明斑点,即为阳性,否则为阴性[22]。
1.3 数据分析
1.3.1 绘图分析
试验结果使用Excel软件进行统计分析,使用Origin 8.5软件进行绘图。
1.3.2 一级模型的拟合
应用统计软件Excel,分别将3种菌株在不同盐浓度、不同亚硝酸盐浓度和不同酸度下培养后获得的乳酸菌的生长数据,用Gompertz模型拟合其生长数据,计算Rm和λ。Gompertz方程如公式(1)所示:
(1)
式中:AOD(t),吸光度终值;Amax,最大吸光度;rm,最大生长速率;λ,生长延滞期;e,自然对数的底数,取值2.718。
2 结果与分析
2.1 三种乳酸菌的生长特性
2.1.1 三种乳酸菌的生长曲线
通过测定菌株生长曲线,明确菌株在不同时间段的生长情况,得出使用菌株的最佳时间。对3种菌株进行生长曲线研究,结果如图1和图2所示。结果表明3种菌株有0~4 h的延滞期,4 h后进入对数生长期菌体数量急速增长,12 h左右进入稳定期,菌液浓度趋于平缓,其中植物乳植杆菌的OD值明显高于戊糖片球菌和乳酸片球菌,2种方式绘制的生长曲线图结果保持一致,由图2可知植物乳植杆菌的最大活菌数为7.8×1010 CFU,另外2种菌株的最大活菌数分别为:戊糖片球菌3.5×1010 CFU、乳酸片球菌3.8×1010 CFU。
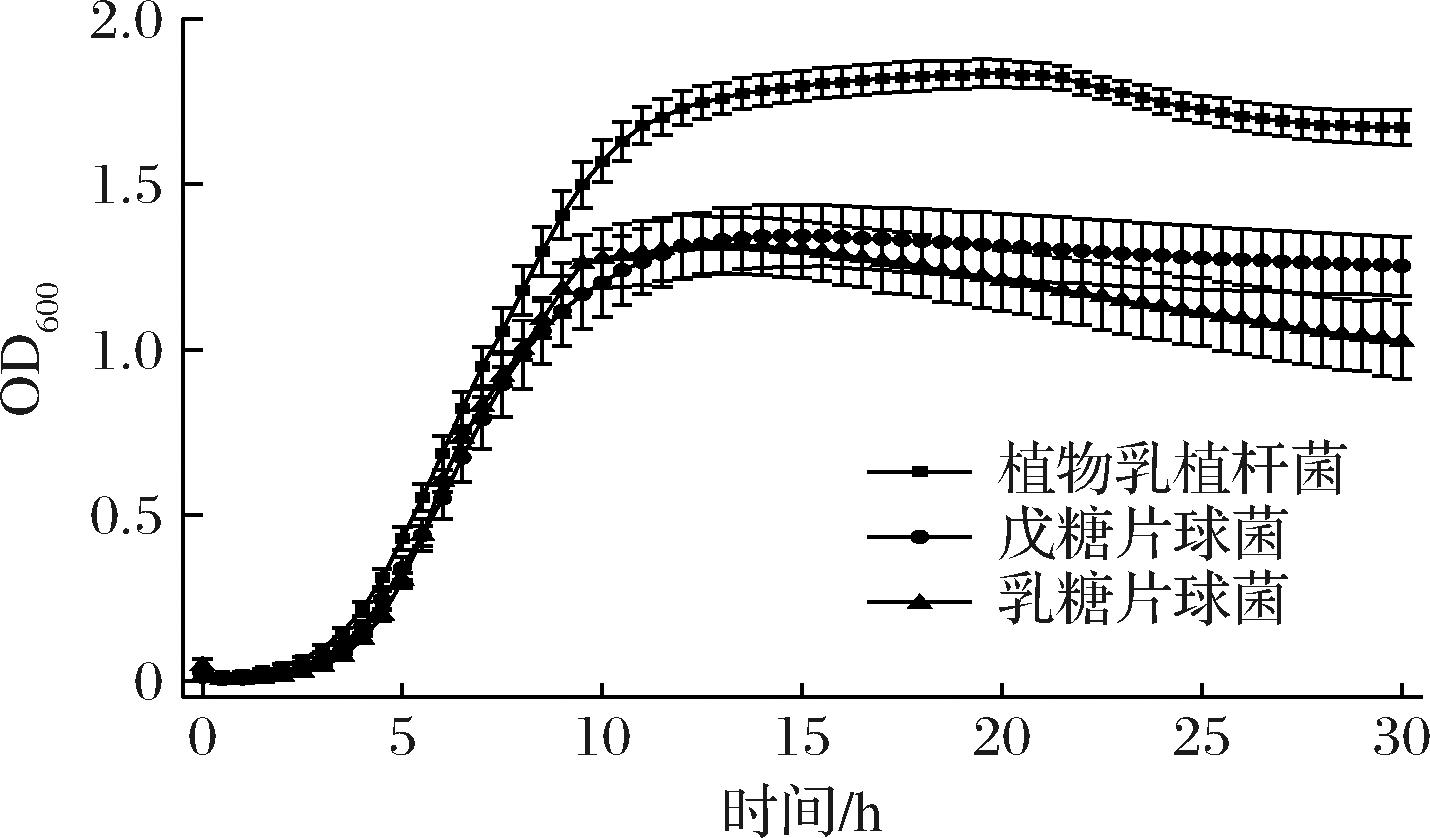
图1 三种乳酸菌生长曲线
Fig.1 Growth curves of three lactic acid bacteria
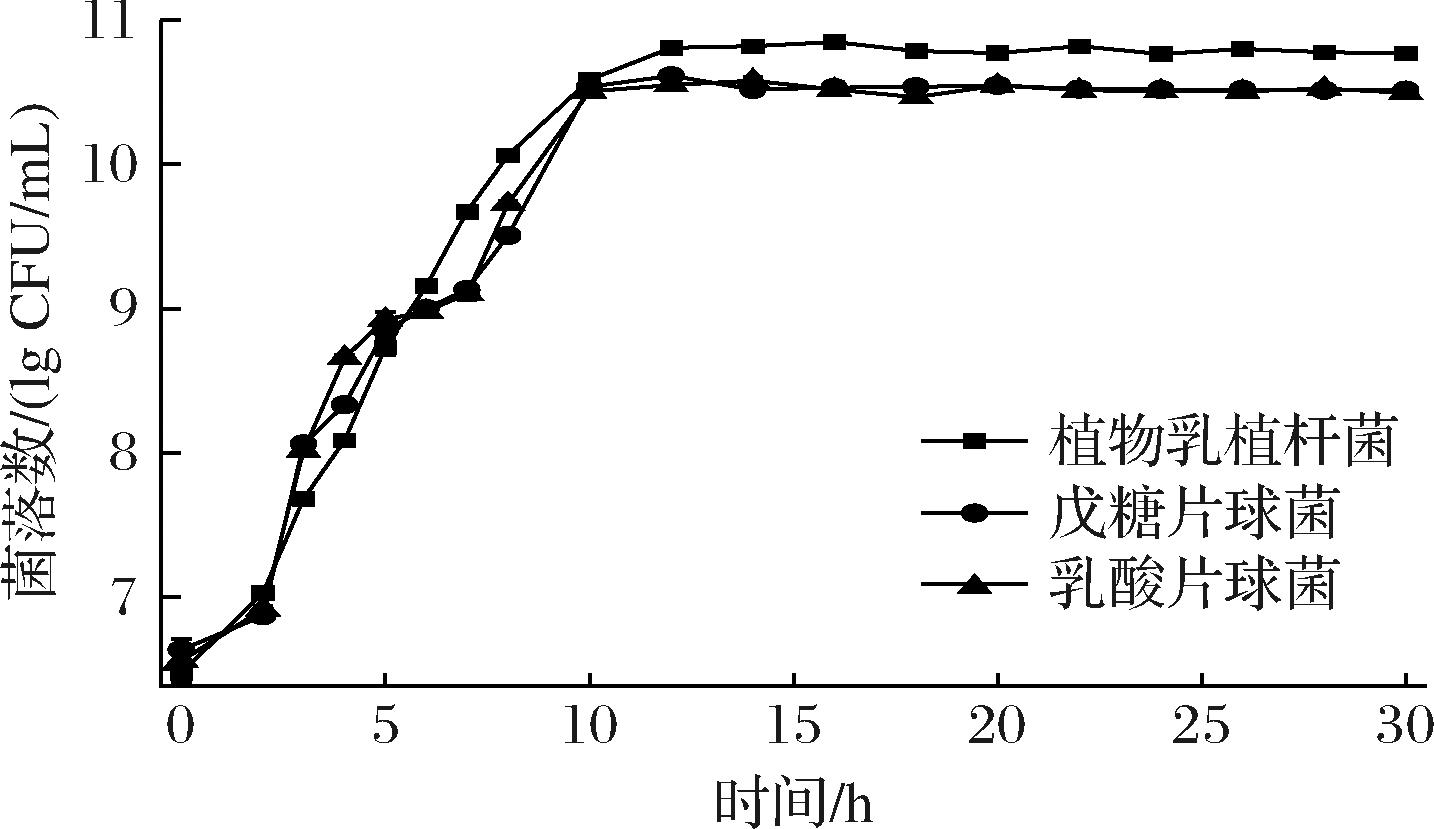
图2 三种乳酸菌菌落计数生长曲线
Fig.2 Colony count growth curves of three lactic acid bacteria
2.1.2 三种乳酸菌的产酸曲线
pH值是评价发酵肉制品的重要指标之一,pH值过高,不能有效抑制其他杂菌的生长,pH值过低,对风味口感有很大影响。此外,乳酸菌的产酸能力可以更好地促进内源酸性蛋白酶的增加,以达到促进蛋白质降解的目的[23]。结果如图3所示,3种菌株产酸速率呈现出先快后慢直至不变的趋势;产酸速度最大时间段分别为植物乳植杆菌3~14 h、戊糖片球菌和乳酸片球菌为3~10 h;戊糖片球菌和乳酸片球菌的产酸能力较强,其达到较低酸度(pH<4)所用的时间比植物乳植杆菌少,曾雪峰等[24]在湘西传统醋鱼中筛选分离乳酸菌的实验发现,产酸能力最强的Lp-15在16 h后pH<4.0,其余菌株产酸能力均小于Lp-15;与本实验相比表明戊糖片球菌和乳酸片球菌的产酸能力相对占有优势,这在肉制品发酵过程中可以快速地提供酸性环境及良好的抑菌环境。
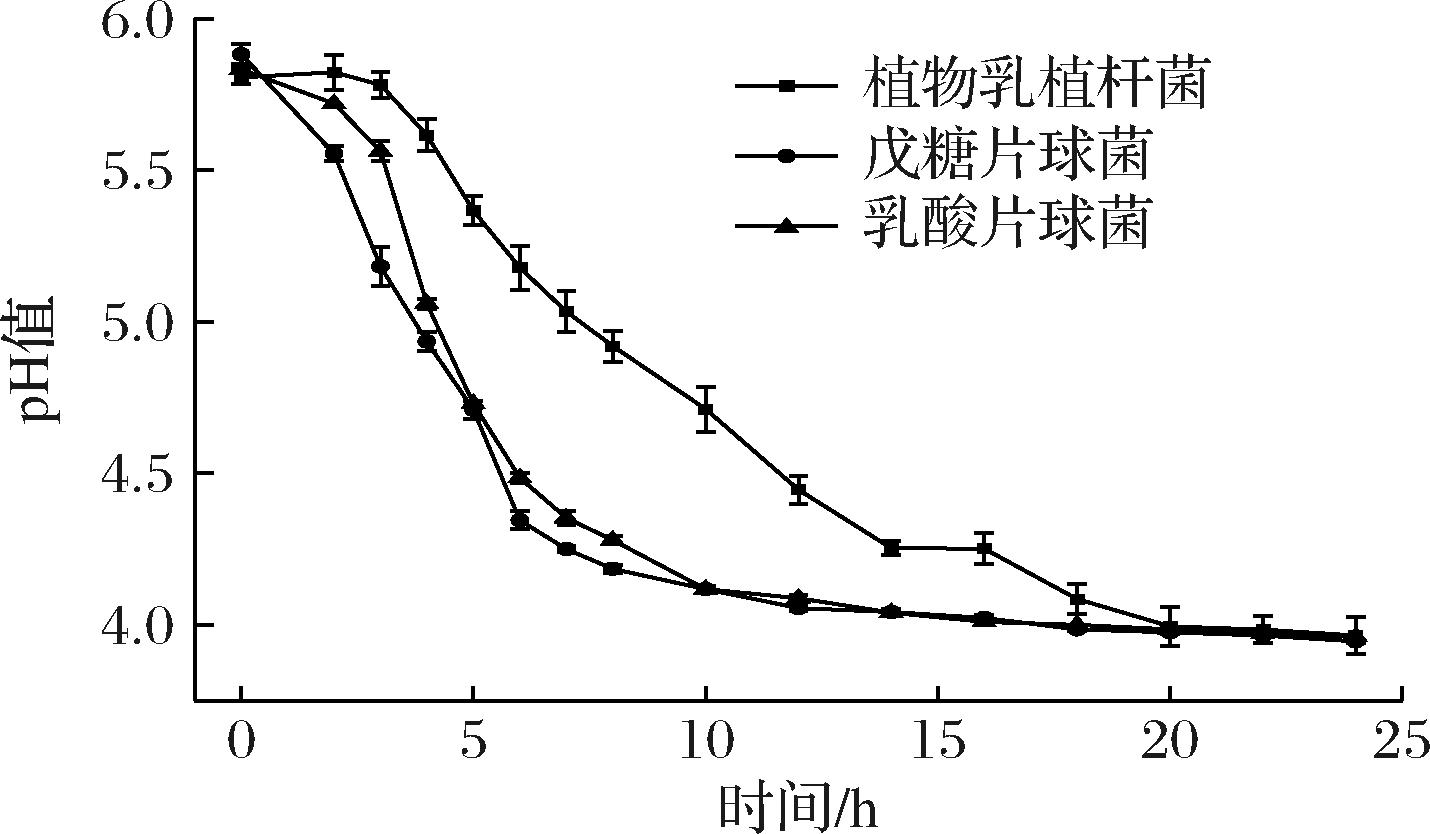
图3 三种乳酸菌产酸曲线
Fig.3 Acid production curves of three lactic acid bacteria
2.1.3 三种菌株在不同温度下生长能力的研究
由图4可知不同温度对菌株影响不同。这3种菌株在27~42 ℃的温度下均能够到达较强的生长能力,植物乳植杆菌和戊糖片球菌在47~57 ℃与其他温度相比OD值呈现明显的差异,可以推测出该2种菌株在47~57 ℃的温度条件下是几乎没有活力的;乳酸片球菌的在47 ℃条件下的生长能力要明显比其他2种菌株的生长能力强,在57 ℃条件下几乎没有活力,说明乳酸片球菌的耐热能力要强于其他2种菌株。
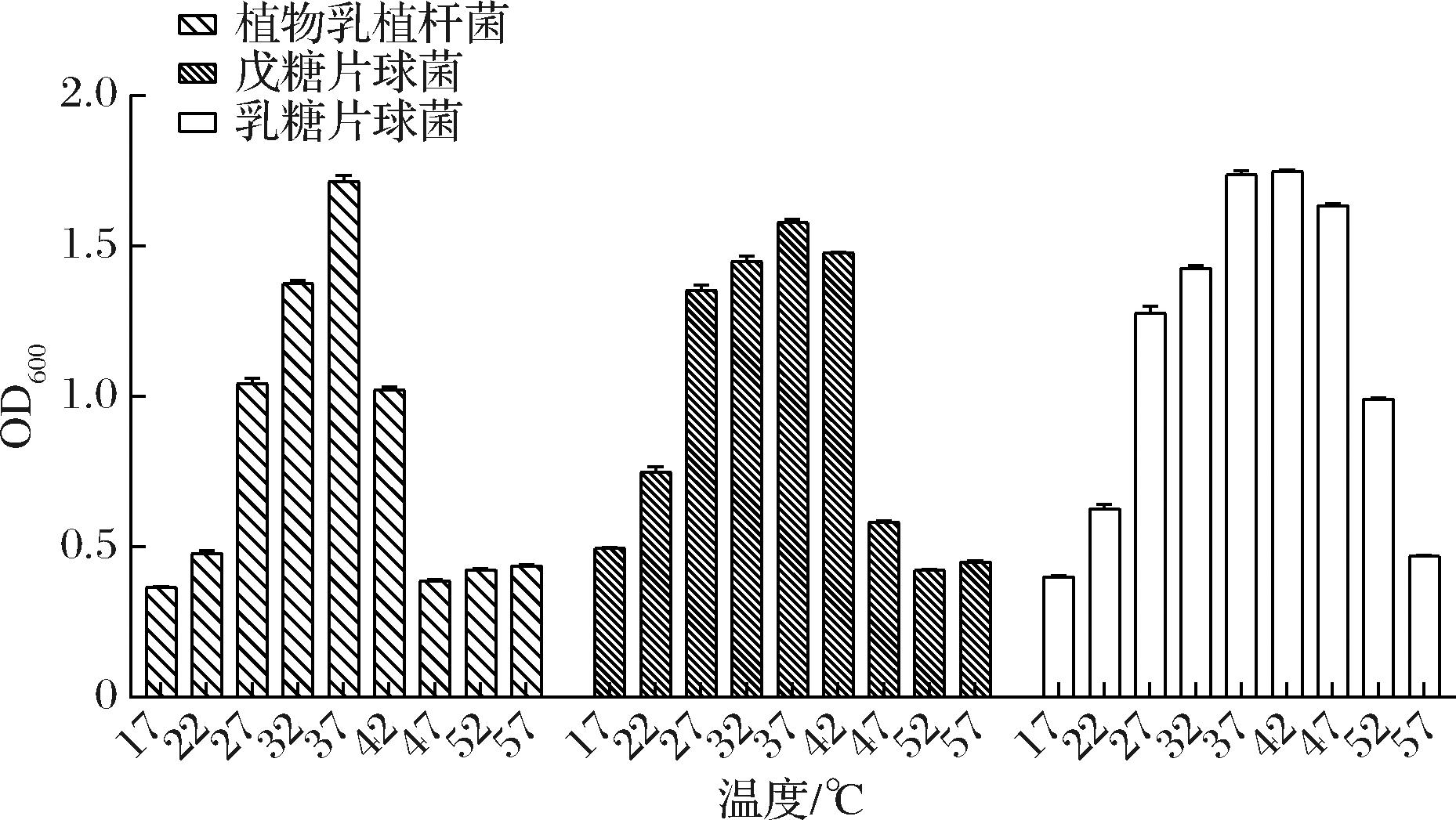
图4 三种型乳酸菌在不同温度下的生长能力
Fig.4 Growth ability of three types of lactic acid bacteria at different temperatures
2.1.4 三种乳酸菌间拮抗试验的研究
如图5所示,用接种针在MRS固体平板上做两两相交划线接种,37 ℃培养24 h后观察。两两划线相交处均有菌落长出,则证明这3种菌种间没有拮抗作用,可以混合培养,共同生长。
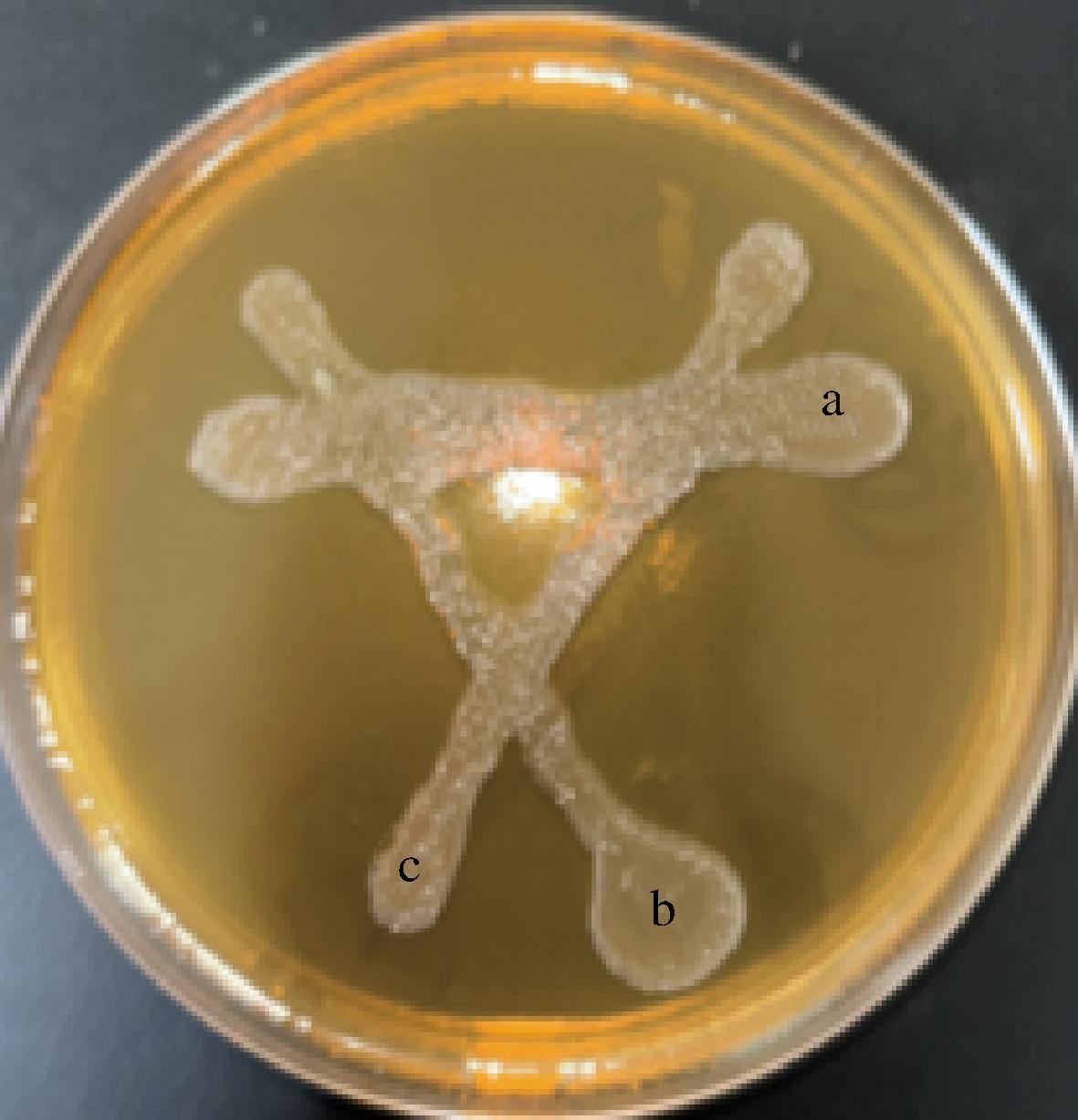
a-植物乳植杆菌;b-戊糖片球菌;c-乳酸片球菌。
图5 三种乳酸菌间拮抗作用
Fig.5 Antagonism between three lactic acid bacteria
2.2 三种乳酸菌的耐受性试验结果
2.2.1 三种乳酸菌耐盐能力
发酵肉制品中的菌株能在高盐的环境下生存,是一个必要的自身因素,因此在肉制品发酵的过程中,参与发酵的微生物需要对盐有耐受性[25]。双指数函数Gompertz方程被普遍用于拟合微生物生长与时间的关系,运用Origin软件拟合3种菌株在添加量为0%、2%、4%、6%、8%的耐盐培养基中乳酸菌的生长数据。由表1可以得出判定系数R2的值在0.9以上,表明Gompertz模型能很好的描述不同盐浓度下乳酸菌的生长。利用Gompertz模型求得的乳酸菌生长动力学参数,λ越小,延滞期越短;Rm越大,生长速率越快,表征菌株的生长能力越好耐受性越强;如表1所示,3种乳酸菌对盐有一定的耐受性,随着盐浓度的增加,3种菌株的生长速度逐渐减小,延滞期逐渐增长,说明盐浓度对菌株的生长有一定的抑制能力;在相同盐浓度环境下各种菌株的生长状态不同,表明不同菌株对盐的耐受能力有差异;3种菌株在盐添加量为4%时都有较好的生长能力;3种菌株在盐添加量为6%~8%时生长速率较低,延滞期较长,对3种菌株的生长能力有明显的抑制作用;戊糖片球菌在盐添加量为8%时几乎丧失了生长能力。
表1 不同盐浓度下3种菌株的生长动力学模型及参数
Table 1 Growth kinetics model and parameters of three strains under different salt concentrations

菌株NaCl添加量/%乳酸菌生长动力学模型R2AmaxRmλ植物乳植杆菌0Y=1.779 12exp{-exp[0.303 03×e×(3.934 07-t)/1.779 12+1]}0.992 721.779 120.303 033.672 34植物乳植杆菌2Y=1.632 87exp{-exp[0.221 84×e×(3.934 07-t)/1.632 87+1]}0.994 861.632 870.221 843.934 07植物乳植杆菌4Y=1.511 88exp{-exp[0.178 59×e×(4.882 67-t)/1.511 88+1]}0.995 541.511 880.178 594.882 67植物乳植杆菌6Y=1.533 72exp{-exp[0.088 94×e×(7.215 89-t)/1.533 72+1]}0.995 611.533 720.088 947.215 89植物乳植杆菌8Y=0.790 59exp{-exp[0.790 59×e×(5.756 93-t)/0.790 59+1]}0.995 800.790 590.039 155.756 93戊糖片球菌0Y=1.336 05exp{-exp[0.273 23×e×(3.741 03-t)/1.336 05+1]}0.993 541.336 050.273 233.741 03戊糖片球菌2Y=1.453 3exp{-exp[0.258 47×e×(3.983 86-t)/1.453 3+1]}0.998 051.453 300.258 473.983 86戊糖片球菌4Y=1.381 69exp{-exp[0.210 2×e×(4.049 93-t)/1.381 69+1]}0.998 001.381 690.210 204.049 93戊糖片球菌6Y=0.969 85exp{-exp[0.085 44×e×(7.679 58-t)/0.969 85+1]}0.999 400.969 850.085 447.679 58戊糖片球菌8Y=0.060 6exp{-exp[0.002 18×e×(2.659 84-t)/0.060 6+1]}0.997 720.060 600.002 182.659 84乳酸片球菌0Y=1.102 86exp{-exp[0.344 17×e×(4.128 32-t)/1.102 86+1]}0.924 551.102 860.344 174.128 32乳酸片球菌2Y=1.238 21exp{-exp[0.270 07×e×(3.780 12-t)/1.238 21+1]}0.959 271.238 210.270 073.780 12乳酸片球菌4Y=1.102 33exp{-exp[0.183 64×e×(4.027 05-t)/1.102 33+1]}0.918 901.102 330.183 644.027 05乳酸片球菌6Y=0.544 25exp{-exp[0.054 3×e×(3.831 21-t)/0.544 25+1]}0.944 940.544 250.054 303.831 21乳酸片球菌8Y=0.332 62exp{-exp[0.032 34×e×(5.693 75-t)/0.332 62+1]}0.997 530.332 620.032 345.693 75
2.2.2 三种乳酸菌耐亚硝酸盐能力
在制作发酵肉制品时,添加亚硝酸盐的主要目的是为了提升产品的色泽,改善口感,并减少有害菌的繁殖[26]。所以在筛选肉制品发酵所用的菌株时,必须考虑菌株对亚硝酸盐的耐受性。运用Origin软件拟合3种菌株在0、50、100、150 mg/kg亚硝酸盐含量的培养基中乳酸菌的生长数据。由表2可知判定系数R2的值在0.9以上,表明Gompertz模型能很好的描述不同亚硝酸盐浓度下乳酸菌的生长状况。利用Gompertz模型求得的乳酸菌生长动力学参数,λ越小,延滞期越短;Rm越大,生长速率越快,表征菌株的生长能力越好耐受性越强;3种乳酸菌的亚硝酸盐耐受能力如表2所示,随着亚硝酸盐浓度的增加,3种菌株生长均受到不同的影响。植物乳酸菌生长能力随着亚硝酸盐浓度的增加呈现递减趋势;与对照组相比戊糖片球菌和乳酸片球菌的λ值相差不大,表明亚硝酸盐的加入可能对2种菌株延滞期影响小;Amax在亚硝酸盐浓度添加量为50 mg/kg时增加,加强了菌株的生长能力,在100、150 mg/kg的含量下减少,表示其生长能力随浓度增加呈现减小趋势。刘丽莉等[27]在发酵肉制品的乳酸菌筛选实验中发现亚硝酸盐添加量为150 mg/kg时,Lp、3号、4号、5号菌株的最高OD值为0.716,与本实验结果相比,在亚硝酸盐的添加量为150 mg/kg时植物乳植杆菌的OD值为1.057、戊糖片球菌的OD值为0.822,其耐亚硝酸盐能力优于Lp、3号、4号、5号菌株。
表2 不同亚硝酸盐浓度下3种菌株的生长动力学模型及参数
Table 2 Growth kinetics models and parameters of three strains under different nitrite concentrations

菌株亚硝酸盐添加量/(mg/kg)乳酸菌生长动力学模型R2AmaxRmλ植物乳植杆菌0Y=1.779 12exp{-exp[0.303 03×e×(3.672 34-t)/1.779 12+1]}0.992 721.779 120.303 033.672 34植物乳植杆菌50Y=1.542 17exp{-exp[0.180 84×e×(3.119 18-t)/1.542 17+1]}0.997 871.542 170.180 843.119 18植物乳植杆菌100Y=1.254 37exp{-exp[0.178 59×e×(2.851 95-t)/1.254 37+1]}0.995 671.254 370.178 592.851 95植物乳植杆菌150Y=0.979 21exp{-exp[0.103 52×e×(1.803 93-t)/0.979 21+1]}0.977 930.979 210.103 521.803 93戊糖片球菌0Y=1.336 05exp{-exp[0.273 23×e×(3.741 03-t)/1.336 05+1]}0.993 541.336 050.273 233.741 03戊糖片球菌50Y=1.337 61exp{-exp[0.273 99×e×(3.613 59-t)/1.337 61+1]}0.997 411.337 610.273 993.613 59戊糖片球菌100Y=1.138 97exp{-exp[0.237 62×e×(3.764 94-t)/1.138 97+1]}0.997 81.138 970.237 623.764 94戊糖片球菌150Y=0.812 92exp{-exp[0.169 38×e×(3.361 47-t)/0.812 92+1]}0.994 140.812 920.169 383.361 47乳酸片球菌0Y=1.098 38exp{-exp[0.345 48×e×(4.131 53-t)/1.098 38+1]}0.920 381.098 380.345 484.131 53乳酸片球菌50Y=1.125 35exp{-exp[0.252 5×e×(3.602 22-t)/1.125 35+1]}0.980 411.125 350.252 53.602 22乳酸片球菌100Y=0.892 94exp{-exp[0.163 47×e×(3.418 3-t)/0.892 94+1]}0.994 050.892 940.163 473.418 3乳酸片球菌150Y=0.657 01exp{-exp[0.164 74×e×(3.931 83-t)/0.657 01+1]}0.926 020.657 010.164 743.931 83
2.2.3 三种乳酸菌耐酸能力
运用Origin软件拟合3种菌株在pH值在3.0、3.5、4.0、4.5、5.0、5.5、6.0酸度下的培养基中乳酸菌的生长数据。由表3可知判定系数R2的值在0.9以上,表明Gompertz模型能很好地描述不同酸度下乳酸菌的生长状况。利用Gompertz模型求得的乳酸菌生长动力学参数,λ越小,延滞期越短;Rm越大,生长速率越快,表征菌株的生长能力越好耐受性越强;由表3可知,3种乳酸菌对酸性环境有一定的耐受性,随着pH的不断减小,菌株的生长能力整体呈现减弱的趋势,说明环境pH降低后,乳酸菌的生长能力受到一定程度的抑制,甚至死亡;3种乳酸菌的耐酸能力比较近似,pH值在5.0~6.0时,与对照组相比,Rm数值更大,表明pH值在5.0~6.0的酸性环境对于3种菌株的生长能力可能有一定的促进作用。在pH值为4.0时,植物乳植杆菌的OD值为0.732、戊糖片球菌的OD值为0.251、乳酸片球菌的OD值为0.408,李宁等[28]对筛得的NR-1菌株进行耐酸性试验,结果发现NR-1在pH值为4.0的酸度下OD值仅为0.05;本实验结果表明这3种菌株其耐酸性远远优于NR-1,在pH值不低于4.0环境中仍可以保持较好的活力,都满足了发酵肉制品所需要的酸性环境,所以在后续的发酵应用中能适应酸性较强的发酵产品。
表3 不同pH值下3种菌株的生长动力学模型及参数
Table 3 Growth kinetic models and parameters of three strains at different pH values

菌株培养基pH值乳酸菌生长动力学模型R2AmaxRmλ植物乳植杆菌空白Y=1.537 15exp{-exp[0.193 58×e×(5.153 75-t)/1.537 15+1]}0.993 031.537 150.193 585.153 75植物乳植杆菌6.0Y=1.707 58exp{-exp[0.240 14×e×(5.475 49-t)/1.707 58+1]}0.995 651.707 580.240 145.475 49植物乳植杆菌5.5Y=1.675 15exp{-exp[0.217 13×e×(5.506 97-t)/1.675 15+1]}0.996 271.675 150.217 135.506 97植物乳植杆菌5.0Y=1.470 98exp{-exp[0.137 83×e×(5.371 24-t)/1.470 98+1]}0.999 011.470 980.137 835.371 24植物乳植杆菌4.5Y=1.442 83exp{-exp[0.098 36×e×(7.641 97-t)/1.442 83+1]}0.999 341.442 830.098 367.641 97植物乳植杆菌4.0Y=1.353 49exp{-exp[0.060 47×e×(11.445 45-t)/1.353 49+1]}0.999 441.353 490.060 4711.445 45植物乳植杆菌3.5Y=0.684 65exp{-exp[0.046 77×e×(28.406 0 4-t)/0.684 65+1]}0.996 320.684 650.046 7728.406 04植物乳植杆菌3.0—————戊糖片球菌空白Y=1.424 27exp{-exp[0.290 49×e×(3.058 78-t)/1.424 27+1]}0.994 101.424 270.290 493.058 78戊糖片球菌6.0Y=1.392 65exp{-exp[0.300 02×e×(3.072 99-t)/1.392 65+1]}0.993 901.392 650.300 023.072 99戊糖片球菌5.5Y=1.432 26exp{-exp[0.291 84×e×(3.166 34-t)/1.432 26+1]}0.995 801.432 260.291 843.166 34戊糖片球菌5.0Y=1.421 22exp{-exp[0.224 35×e×(3.710 79-t)/1.421 22+1]}0.998 811.421 220.224 353.710 79戊糖片球菌4.5Y=1.096 3exp{-exp[0.111 36×e×(5.138 07-t)/1.096 3+1]}0.999 241.096 300.111 365.138 07戊糖片球菌4.0Y=0.373exp{-exp[0.008 54×e×(6.459 88-t)/0.373+1]}0.999 190.373 000.008 546.459 88戊糖片球菌3.5—————戊糖片球菌3.0—————乳酸片球菌空白Y=1.619 88exp{-exp[0.172 95×e×(5.927 65-t)/1.619 88+1]}0.998 351.619 880.172 955.927 65
续表3
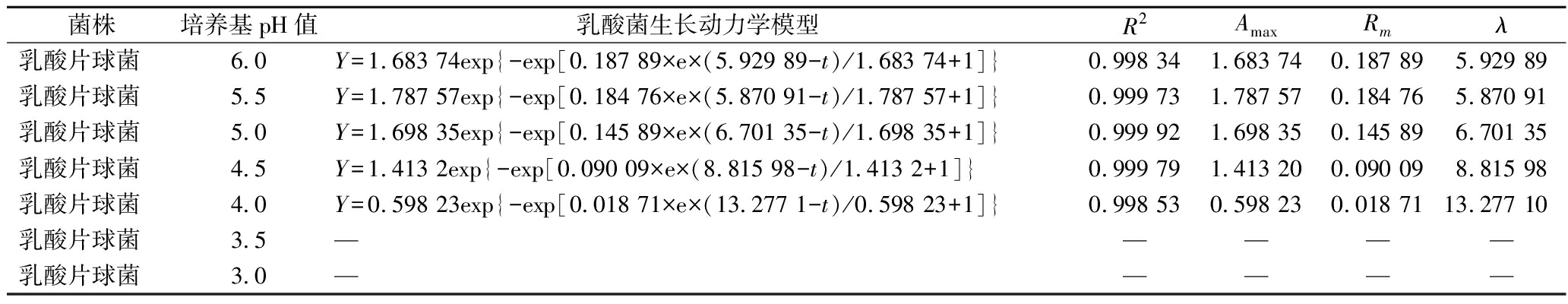
菌株培养基pH值乳酸菌生长动力学模型R2AmaxRmλ乳酸片球菌6.0Y=1.683 74exp{-exp[0.187 89×e×(5.929 89-t)/1.683 74+1]}0.998 341.683 740.187 895.929 89乳酸片球菌5.5Y=1.787 57exp{-exp[0.184 76×e×(5.870 91-t)/1.787 57+1]}0.999 731.787 570.184 765.870 91乳酸片球菌5.0Y=1.698 35exp{-exp[0.145 89×e×(6.701 35-t)/1.698 35+1]}0.999 921.698 350.145 896.701 35乳酸片球菌4.5Y=1.413 2exp{-exp[0.090 09×e×(8.815 98-t)/1.413 2+1]}0.999 791.413 200.090 098.815 98乳酸片球菌4.0Y=0.598 23exp{-exp[0.018 71×e×(13.277 1-t)/0.598 23+1]}0.998 530.598 230.018 7113.277 10乳酸片球菌3.5—————乳酸片球菌3.0—————
注:“—”代表该实验条件下菌株没有生长能力。
2.2.4 三种乳酸菌致死温度的测定
为了解3种乳酸菌耐高温能力的强弱,通过实验得到最高致死温度的限值,以便确保在加工过程中菌株不会因高温工序而失去活性。结果如表4所示,3种乳酸菌的致死温度均为70 ℃以下,在基本的加工温度范围之内,符合作为肉制品发酵剂的基本温度条件。
表4 三种菌株在不同温度处理后的生长情况 单位:CFU Table 4 Growth of the threes trains after different temperature treatments

温度/℃植物乳植杆菌戊糖片球菌乳酸片球菌553.41×1073.81×1076.41×108604.56×1056.44×1054.64×106651.2×1032.0×1033.4×10370———75———80———
注:“—”代表该实验条件下菌株没有生长能力。
2.3 三种乳酸菌发酵特性的研究
2.3.1 三种乳酸菌降解葡萄糖能力的研究
由表5可知,3种菌株对葡萄糖有一定的降解能力,3种菌株在发酵过程中,通过对葡萄糖等带水化合物的降解过程中产生一系列的酸,使其分解成小分子,进一步促进了产品风味的丰富度;3种菌株在降解葡萄糖的过程中不产气,能够保证产品的形态不会被破坏。
表5 三种菌株葡萄糖产气实验结果
Table 5 Glucose gas production experimental results of threes trains
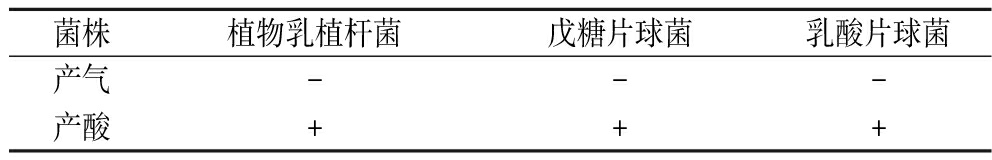
菌株植物乳植杆菌戊糖片球菌乳酸片球菌产气---产酸+++
注:“+”代表实验结果呈阳性,“-”代表实验结果呈阴性。
2.3.2 三种乳酸菌蛋白质降解能力的研究
蛋白质的处理和变化对肉制品的品质至关重要[29]。肉制品在发酵过程中,蛋白酶和微生物酶通过水解反应的发生,产生多种能够影响食品的风味和质地的物质。通过深入研究这些物质的生成机制和作用机理,可以为食品加工技术的改进提供理论支持[30]。由图6~图8可知,3种乳酸菌菌落周围出现了明显的圆环,表明3种菌株都具有一定的蛋白降解能力;刘丽莉等[27]在发酵肉制品中筛选出来的乳酸菌Lp不具有蛋白质降解的功能,本试验中的3种菌株均具有蛋白降解能力,因此3种菌株对于肉制品的发酵过程中丰富风味、良好质地创造了有利的条件。
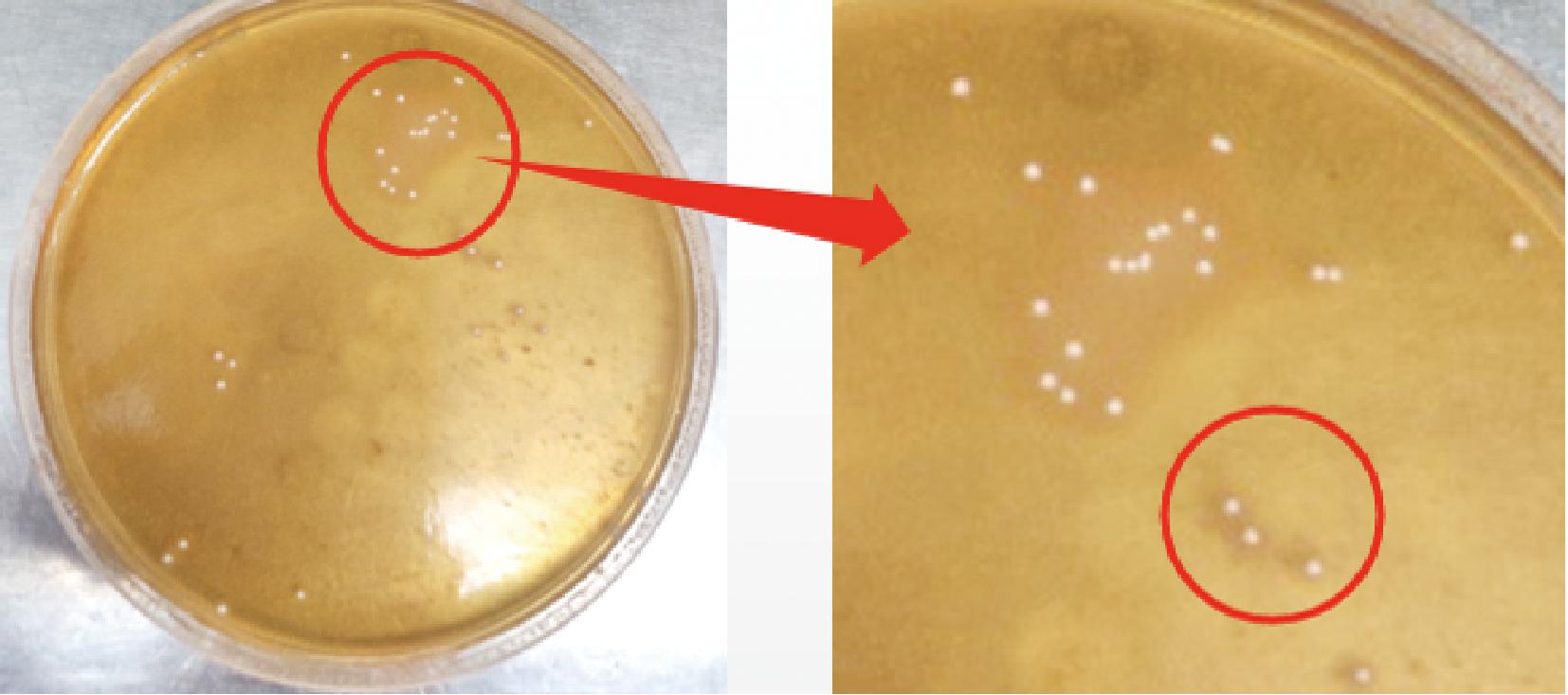
图6 植物乳植杆菌降解蛋白结果
Fig.6 Protein degradation results of Lactiplantibacillus plantarum
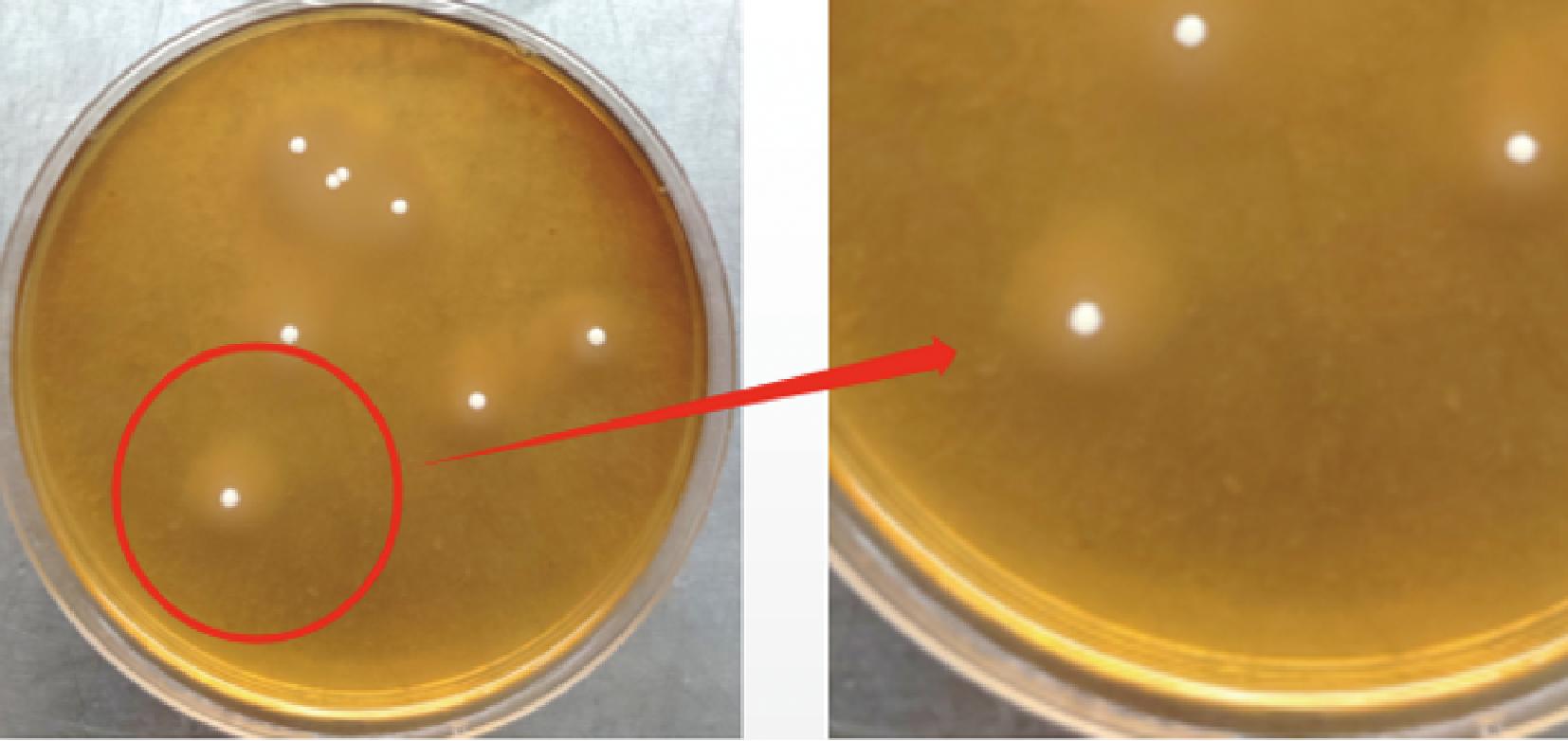
图7 戊糖片球菌降解蛋白结果
Fig.7 Protein degradation results of Pediococcus pentosaceus
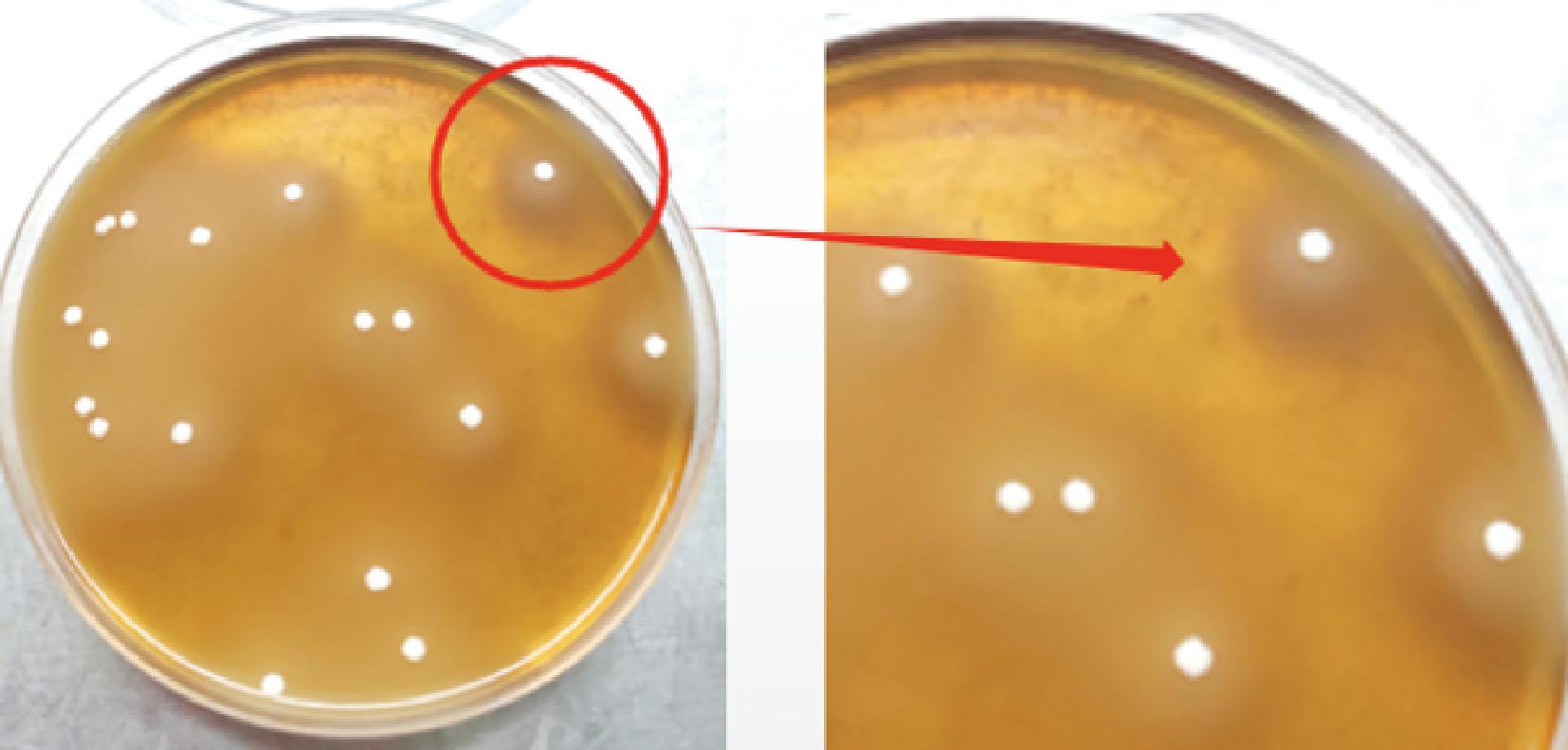
图8 乳酸片球菌降解蛋白结果
Fig.8 Protein degradation results of Pediococcus acidilactici
2.3.3 三种乳酸菌脂肪降解能力的研究
在发酵过程中,肉制品中的脂肪被微生物分解为游离脂肪酸,为发酵肉制品提供芳香化合物,赋予肉制品特殊的风味[31]。由图9~图10可知,戊糖片球菌和乳酸片球菌能分解脂肪产生脂肪酸,则在平板上出现红色透明斑,表现为阳性;植物乳杆菌未出现明显红色,则为阴性表明其降解脂肪能力差。王淼[32]在筛选降脂乳酸菌实验中发现,各个菌株间的酶活性差异较大,从4.47%~55.15%。本实验结果符合菌株间酶活性差异较大的特点。

图9 戊糖片球菌降解脂肪结果
Fig.9 Results of fat degradation by P. pentosaceus
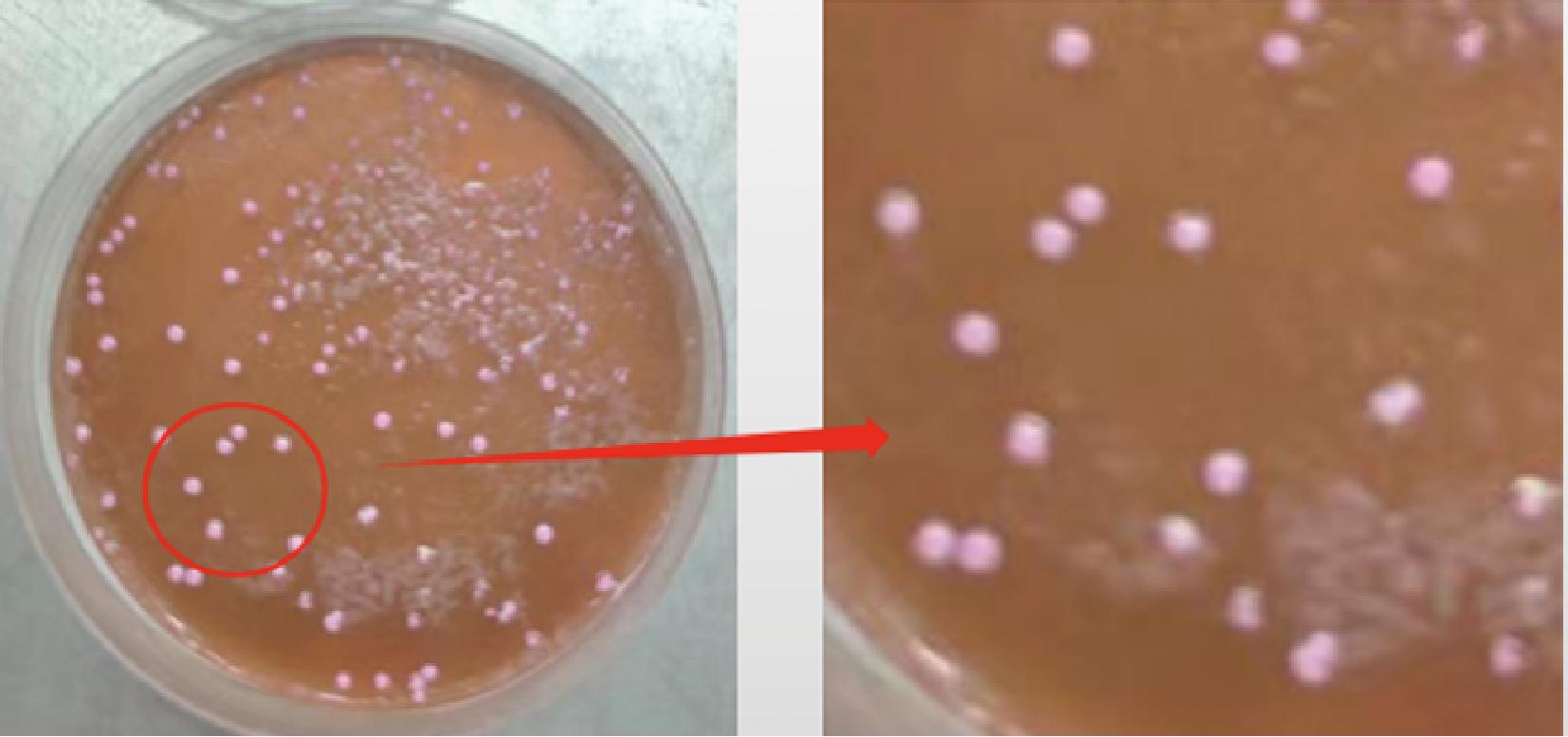
图10 乳酸片球菌降解脂肪结果
Fig.10 Results of fat degradation by P. acidilactici
3 结论与讨论
3株可以共生的乳酸菌中,植物乳酸菌的生长能力尤为突出;戊糖片球菌和乳酸片球菌在产酸方面表现出色,脂肪降解能力较强。研究结果表明这3种乳酸菌具有较强的产酸能力、耐受性能好、降解蛋白能力强及脂肪降解强的优良特征。本试验通过研究酸肉中筛选分离出的3种乳酸菌的生长能力、耐受性和发酵特性,发现3种性能优良的乳酸菌在动物基质发酵的潜在益生菌,为后续发酵肉制品的开发及品质研究提供参考依据。
[1] 田文广, 张俊杰, 石亚萍, 等.发酵肉制品的研究进展[J].肉类工业, 2022(2):54-57.TIAN W G, ZHANG J J, SHI Y P, et al.Research progress of fermented meat products[J].Meat Industry, 2022(2):54-57.
[2] 王娟强, 齐婧, 李贺楠, 等.发酵肉制品食品安全风险分析及监管建议[J].肉类研究, 2021, 35(8):54-63.WANG J Q, QI J, LI H N, et al.Fermented meat products:Quality and safety risk analysis and supervisory suggestions[J].Meat Research, 2021, 35(8):54-63.
[3] 米瑞芳, 陈曦, 熊苏玥, 等.传统自然发酵酸肉中细菌群落多样性与风味品质分析[J].食品科学, 2019, 40(2):85-92.MI R F, CHEN X, XIONG S Y, et al.Bacterial community diversity and flavor characteristics of traditional naturally fermented sour meat[J].Food Science, 2019, 40(2):85-92.
[4] 李思源, 沙坤, 孙宝忠, 等.功能性微生物在发酵肉制品中的应用研究进展[J].肉类研究, 2019, 33(12):56-60.LI S Y, SHA K, SUN B Z, et al.A review of application of functional microorganisms in fermented meat products[J].Meat Research, 2019, 33(12):56-60.
[5] ERDOGMU S F, ERI
S F, ERI MI
MI U C, UGUZ C.Isolation and identification of lactic acid bacteria from fermented meat products and evaluation of their antimicrobial effect[J].Czech Journal of Food Sciences, 2021, 39(4):289-296.
U C, UGUZ C.Isolation and identification of lactic acid bacteria from fermented meat products and evaluation of their antimicrobial effect[J].Czech Journal of Food Sciences, 2021, 39(4):289-296.
[6] 高芳, 包亚莉, 华晓青, 等.乳酸菌对发酵肉制品抑菌作用及风味特征的影响研究进展[J].食品科学, 2023, 44(9):194-201.GAO F, BAO Y L, HUA X Q, et al.Lactic acid bacteria:A review of their inhibitory effect on harmful microbes and effect on flavor characteristics of fermented meat products[J].Food Science, 2023, 44(9):194-201.
[7] 李佳怡, 葛渠锋, 李珏, 等.乳酸菌源亚硝化抑制剂对酱牛肉中N-亚硝胺形成的影响[J].肉类研究, 2023, 37(8):1-7.LI J Y, GE Q F, LI J, et al.Effect of nitrosation inhibitors from lactic acid bacteria on the formation of N-nitrosamines in sauced beef[J].Meat Research, 2023, 37(8):1-7.
[8] HAN Q, KONG B H, CHEN Q, et al.In vitro comparison of probiotic properties of lactic acid bacteria isolated from Harbin dry sausages and selected probiotics[J].Journal of Functional Foods, 2017, 32:391-400.
[9] MEI L, PAN D M, GUO T T, et al.Role of Lactobacillus plantarum with antioxidation properties on Chinese sausages[J].LWT, 2022, 162:113427.
[10] XIAO Y Q, LIU Y N, CHEN C G, et al.Effect of Lactobacillus plantarum and Staphylococcus xylosus on flavour development and bacterial communities in Chinese dry fermented sausages[J].Food Research International, 2020, 135:109247.
[11] ZHANG H, LIU J M, WEN R, et al.Metabolomics profiling reveals defense strategies of Pediococcus pentosaceus R1 isolated from Harbin dry sausages under oxidative stress[J].LWT, 2021, 135:110041.
[12] 翟清燕, 郑世超, 李新玲, 等.乳酸菌的分类鉴定及在食品工业中的应用[J].食品安全质量检测学报, 2019, 10(16):5260-5265.ZHAI Q Y, ZHENG S C, LI X L, et al.Classification and identification of lactic acid bacteria and application in food industry[J].Journal of Food Safety &Quality, 2019, 10(16):5260-5265.
[13] HU Y Y, TIAN Y, ZHU J M, et al.Technological characterization and flavor-producing potential of lactic acid bacteria isolated from traditional dry fermented sausages in NorthEast China[J].Food Microbiology, 2022, 106:104059.
[14] TIAN J J, YANG X Q, ZHANG K P, et al.Influence of Lactobacillus helveticus ZF22 and TR1-1-3 strains on the aromatic flavor of fermented sausages[J].Frontiers in Nutrition, 2023, 9:1058109.
[15] WANG M, WANG C M, YANG C, et al.Effects of Lactobacillus plantarum C7 and Staphylococcus warneri S6 on flavor quality and bacterial diversity of fermented meat rice, a traditional Chinese food[J].Food Research International, 2021, 150:110745.
[16] 李珊珊. 传统发酵肉制品中发酵菌株的分离筛选及在牛肉发酵香肠中的应用初探[D].郑州:河南农业大学, 2021.LI S S.Separation screening of fermented strain fron traditional fermented meat products and application in beef fermented sausages [D].Zhengzhou:Henan Agricultural University, 2021.
[17] 张秋会, 孟高歌, 王晗, 等.自然发酵腊肉中细菌的分离鉴定及其发酵特性[J].中国食品学报, 2023, 23(7):161-168.ZHANG Q H, MENG G G, WANG H, et al.Isolation and identification of bacteria from naturally fermented bacon and its fermentation characteristics[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(7):161-168.
[18] 王馨. 用于发酵工程的乳酸菌筛选及复配菌剂研究[D].哈尔滨:哈尔滨工业大学, 2021.WANG X.Screening of lactic acid bacteria used in fermentation engineering and engineering and research on compound bacteria [D].Harbin:Harbin Institute of Technology, 2021.
[19] 徐鑫, 王茜茜, 王晓蕊, 等.传统农家大酱中耐盐性乳酸菌的分离与鉴定[J].食品与发酵工业, 2014, 40(11):33-40.XU X, WANG Q Q, WANG X R, et al.Isolation and identification of salt-resistant lactic acid bacteria in farmers’ soybean paste[J].Food and Fermentation Industries, 2014, 40(11):33-40.
[20] 张秋会, 王晗, 祝超智, 等.自然发酵腊肉中酵母菌的分离鉴定及其发酵特性研究[J].食品与发酵工业, 2022, 48(14):113-117.ZHANG Q H, WANG H, ZHU C Z, et al.Isolation and identification of yeast from natural fermented Chinese bacon and its fermentation characteristics[J].Food and Fermentation Industries, 2022, 48(14):113-117.
[21] 焦阳阳. 发酵对半干型牛肉干品质的影响研究[D].郑州:河南农业大学, 2021.JIAO Y Y.Effect of fermentation on quality of semi-dried beef jerky[D].Zhengzhou:Henan Agricultural University, 2021.
[22] 刘素纯, 胡茂丰, 李宗军.自然发酵肉制品中乳酸菌的分离及特性研究[J].食品与机械, 2006, 22(2):62-65.LIU S C, HU M F, LI Z J.On isolation and characteristics of lactic acid bacteria from natural fermentated meat products[J].Food &Machinery, 2006, 22(2):62-65.
[23] 艾雨晴, 陈松骏, 秦娟, 等.微生物产蛋白酶的研究进展[J].食品工业科技, 2021, 42(19):451-458.AI Y Q, CHEN S J, QIN J, et al.Advances in proteases producted by microorganisms[J].Science and Technology of Food Industry, 2021, 42(19):451-458.
[24] 曾雪峰, 夏文水.湘西传统酸鱼中乳酸菌的分离及特性研究[J].食品与发酵工业, 2012, 38(12):40-44.ZENG X F, XIA W S.Characterization of lactic acid bacteria isolated from Xiangxi traditional low salt fermented fish(Suan Yu)[J].Food and Fermentation Industries, 2012, 38(12):40-44.
[25] 汤兴宇, 王浩东, 吴念, 等.食盐对传统发酵肉成熟过程中微生物菌群、理化性质及盐溶性蛋白特性的影响[J].肉类研究, 2020, 34(10):1-7.TANG X Y, WANG H D, WU N, et al.Effect of salt on microbial flora, physicochemical properties and salt-soluble protein characteristics of traditional fermented meat during fermentation[J].Meat Research, 2020, 34(10):1-7.
[26] SHEN Q Y, ZENG X Q, KONG L Y, et al.Research progress of nitrite metabolism in fermented meat products[J].Foods, 2023, 12(7):1485.
[27] 刘丽莉, 杨协力.发酵肉制品中乳酸菌菌种筛选研究[J].农业机械学报, 2006, 37(8):229-231.LIU L L, YANG X L.Screening of lactic acid bacteria in fermented meat products[J].Transactions of the Chinese Society for Agricultural Machinery, 2006, 37(8):229-231.
[28] 李宁, 王元健, 武运, 等.天山北麓葡萄酒苹乳发酵阶段乳酸菌的筛选及性能评价[J].食品与发酵工业, 2025,51(2):151-159.LI N, WANG Y J, WU Y, et al.Screening and performance evaluation of lactic acid bacteria in malolactic fermentation stage of wine in northern Tianshan mountains[J].Food and Fermentation Industries, 2025,51(2):151-159.
[29] 刘肖, 韦诚, 周才琼.发酵对酸肉蛋白质降解及酸鲜品质特征的影响[J].食品与发酵工业, 2018, 44(12):129-136.LIU X, WEI C, ZHOU C Q.The effects of fermentation on protein degradation and sour and umami quality of Za-pork[J].Food and Fermentation Industries, 2018, 44(12):129-136.
[30] 周天硕, 赵家圆, 孟彩云, 等.发酵肉制品中生物活性肽的研究进展[J].肉类研究, 2022, 36(12):67-71.ZHOU T S, ZHAO J Y, MENG C Y, et al.Progress in research on bioactive peptides in fermented meat products[J].Meat Research, 2022, 36(12):67-71.
[31] 葛芮瑄, 罗玉龙, 剧柠.传统发酵肉制品中微生物菌群对风味形成的研究进展[J].微生物学通报, 2022, 49(6):2295-2307.GE R X, LUO Y L, JU N.Research progress on the microbial flora affecting flavor formation of traditional fermented meat products[J].Microbiology China, 2022, 49(6):2295-2307.
[32] 王淼. 降脂乳酸菌的筛选及其益生特性和潜在机制的研究[D].南宁:广西大学, 2023.WANG M.Screening of lipid-lowering lacticacid bacteria and study of their probiotic properties and potential mechanisms[D].Nanning:Guangxi University, 2023.