酸马乳是乳酸菌和酵母菌等发酵菌共同发酵生马乳而得到的一种低乙醇含量的乳饮料,富含蛋白、维生素、矿物质、有机酸和有机醋等营养成分[1],至今仍是游牧民族喜爱的饮品之一。酸马乳可以预防并辅助治疗高血脂、高血压、冠心病等心血管疾病,这与其中富含多种类型的乳酸菌等有益菌有着密切的联系[2]。
乳酸菌作为人与动物肠道中极其重要的菌群之一,参与机体的许多生理功能,如稳定血脂[3]、改善胰岛素抵抗[4]、免疫调节[5],同时对肠道菌群也有调节作用[6]。相关研究表明乳酸菌在体内外均有降解胆固醇的作用[7]。目前,关于其体外降解胆固醇的机制主要有以下2种观点:一个是KLAVER等[8]最早提出的,胆汁酸肝-肠代谢所必需的胆盐水解酶(bile salt hydrolase,BSH)能够将结合型胆盐水解为游离型胆盐,从而使自由胆盐能够与胆固醇共沉淀排出,从而实现降低胆固醇效果的共沉淀理论;另一个是GILLILAND等[9]提出的胆固醇可以被乳酸同化并吸附在细胞表面,从而降低胆固醇含量的同化吸收理论。因其降胆固醇机制发生在肠道中,所以必须得耐受肠道的高胆盐和高酸性环境。目前国内外常用的体外筛选方法有2种[10-11],一种是评估候选菌株能否表现出BSH活性,另一种是测定培养基中胆固醇的残留量来快速评估候选菌株的清除能力。研究表明,BSH可协助益生菌在肠胃环境中最大化地发挥益生作用,通过调控代谢过程从而改善宿主健康[12]。乳酸菌功能的不断研究与开发,对益生菌市场产生了积极的影响,与此同时,对益生菌与高脂血症关系的深入研究,将有助于揭示益生菌调控血脂代谢平衡的作用机制,为今后选择合适的益生菌辅助或替代药物治疗高脂血症提供依据。因此寻找性能稳定、安全、有效的乳酸菌菌种,使之用于功能性乳酸菌和制品的开发具有重要的意义。
本研究从传统发酵马乳中分离纯化发酵菌,并对所分离的菌株进行形态学和生理生化鉴定,再对其生长曲线、耐胆盐、耐胃酸以及耐药性等益生特性进行评价。进而定性评估益生菌能否表现出BSH活性,同时通过胆固醇氧化酶法评估菌株在体外的胆固醇清除能力,最后采用16S rRNA基因测序法进一步鉴定菌株归属,为后续体内试验及辅助降脂益生菌制剂的生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 酸马乳样品
样品来源于新疆伊犁哈萨克自治州尼勒克县不同牧区的牧民家中,通过传统发酵方式得到的发酵马乳。收集发酵马乳时,将其混匀,于50 mL无菌离心管中,密封和记录收集时间后放入冰盒内,保持较低的温度,在12 h内运回实验室,及时对样品中发酵菌进行分离培养,剩余样品贮存于-80 ℃冰箱备用。
1.1.2 试剂
革兰氏染色试剂盒、3%过氧化氢酶试剂、氧化酶试纸、明胶生化管、靛基质试剂盒,海博生物技术有限公司;牛磺胆酸钠、巯基乙酸钠、无水CaCl2、牛胆盐、胆固醇(以上均为分析纯)、人工胃液(无菌),上海源叶生物科技有限公司;抗生素药物敏感性测试纸片,温州市康泰生物科技有限公司;MRS肉汤、MRS琼脂培养基,索莱宝科技(北京)有限公司;胰蛋白胨植胨酵母(trypticase-phytone-yeast extract, TPY)琼脂培养基,海博生物技术有限公司。
1.1.3 培养基与菌悬液的配制
MRS-CHOL培养基:参照文献[13]配制。称取1.0 g胆固醇,于100 mL容量瓶中用无水乙醇定容至刻度,无菌环境下用0.22 μm微孔滤膜过滤除菌。将3.0 g/L胆盐添加到MRS肉汤中,121 ℃灭菌20 min,加入上一步配制的胆固醇溶液使培养基内胆固醇质量浓度为1.0 g/L。
复合菌的制备:参照文献[14]制备。高剂量复合发酵菌:含同一样品分离的不同发酵菌株(×1010 CFU/mL)。低剂量复合发酵菌:含同一样品分离的不同发酵菌株(×108 CFU/mL),-80 ℃冻存备用。
1.2 仪器与设备
电子分析天平,梅特勒-托利多仪器(上海)有限公司;恒温水浴锅,上海精宏实验设备SJLE公司;SX-500蒸汽灭菌锅,Tomy Digital Biology公司;HYQX-Ⅲ型厌氧培养箱,上海新诺仪器集团有限公司;CHT210R大容量高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;XSP-BM-2CA生物显微镜,上光实业有限公司;Multiskan GO酶标仪,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 分离纯化源于发酵马乳的发酵菌
取所需量的MRS固体和TPY固体培养基,配制、灭菌、无菌条件下倒板待凝固后,将采集的发酵马乳样品混匀,各样品取1.0 mL用无菌生理盐水稀释,将不同梯度稀释液分别吸取100 μL于固体平板用一次性无菌涂布棒进行涂布,于37 ℃厌氧培养箱中厌氧培养24~48 h。不纯的培养板挑取单一菌进行划线培养。将得到的单一菌体进行革兰氏染色,将革兰氏染色阳性、过氧化氢酶阴性的菌初步定为乳酸菌[15]。并对纯化后的单一菌株进行生理生化鉴定,同时部分菌株于冻存管中-80 ℃冻存。
1.3.2 形态学、生理生化鉴定
通过观察菌落的大小、质地、隆起程度、边缘、透明度、光滑度、光泽和色泽等特征对分离的乳酸菌株进行形态学鉴定;经革兰氏染色、过氧化氢酶、氧化酶、明胶液化、吲哚试验、45 ℃生长和耐6.5%(质量分数)NaCl生长试验和不同糖类、碳源的发酵试验等进行生理生化鉴定。
1.3.3 发酵菌益生特性研究
1.3.3.1 发酵菌生长曲线的测定
将活化后的待测发酵菌,在MRS肉汤培养基中按3%接种量接种,37 ℃厌氧箱中培养72 h,平行测定3个培养管的OD600值,取均值以培养时间h为横坐标,OD600值为纵坐标,绘制各发酵菌的生长曲线。
1.3.3.2 耐受胆盐能力的测定
将MRS肉汤培养基中添加的牛胆盐质量浓度调至3.0 g/L,灭菌、室温冷却至30~40 ℃。将活化后的待测菌按3%的接种量接种到含胆盐的MRS肉汤中,同时以不含胆盐的培养基作为对照组,在37 ℃的厌氧箱中培养3 h取样,测各菌液的OD600值。3次平行,存活率按公式(1)计算。
存活率![]()
(1)
1.3.3.3 耐受人工胃液能力的测定
将活化后的待测发酵菌接种于MRS肉汤中37 ℃生长温度下厌氧培养24 h后,离心(8 000 r/min,10 min,4 ℃),用pH 7.2的PBS洗涤2次,接种于3.2 g/L胃蛋白酶、pH值为2.0的人工胃液中,再次在37 ℃厌氧箱中厌氧培养,于0、3 h取样,平板计数法测定活菌数。3次平行,存活率按公式(2)计算。
存活率![]()
(2)
1.3.4 发酵菌安全性评价
根据世界卫生组织推荐的药敏纸片琼脂扩散法(K-B法)[16],首先称取所需量的MRS固体培养基,配制后进行灭菌,无菌条件下倒入培养皿,待其凝固。取100 μL浓度为×108 CFU/mL的菌悬液,使用一次性无菌涂布棒均匀涂布于琼脂表面,每个培养皿上均匀间隔地贴上4张不同药敏纸片。将封口后翻转平皿,然后在37 ℃厌氧箱中培养24~48 h,随后使用电子游标卡尺测量并记录抑菌圈的直径。参照CLSI M-100《抗菌药物敏感性试验执行标准》,判读敏感性。每种药片重复3次。
表1 药敏纸片种类、含药量及判断标准
Table 1 Types of drug-sensitive paper tablets, drug content and determination criteria
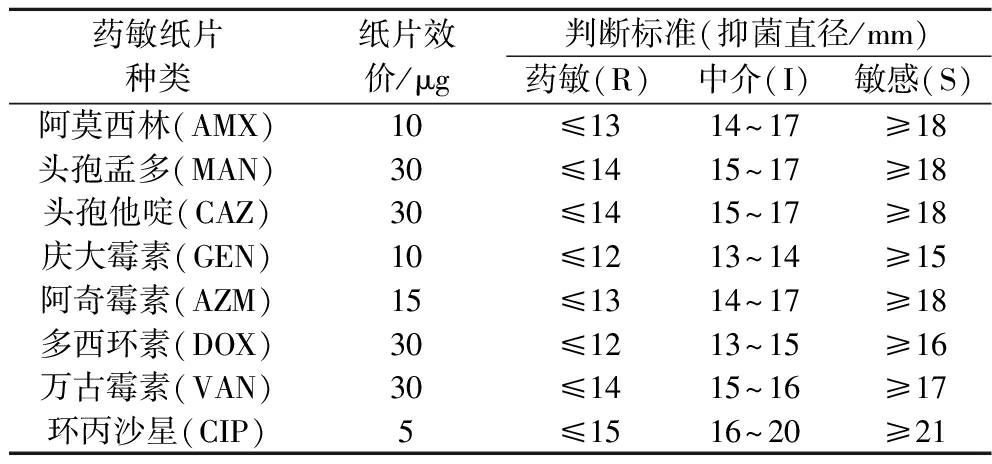
药敏纸片种类纸片效价/μg判断标准(抑菌直径/mm)药敏(R)中介(I)敏感(S)阿莫西林(AMX)10≤1314~17≥18头孢孟多(MAN)30≤1415~17≥18头孢他啶(CAZ)30≤1415~17≥18庆大霉素(GEN)10≤1213~14≥15阿奇霉素(AZM)15≤1314~17≥18多西环素(DOX)30≤1213~15≥16万古霉素(VAN)30≤1415~16≥17环丙沙星(CIP)5≤1516~20≥21
1.3.5 体外评估发酵菌胆固醇清除能力
1.3.5.1 定性测定发酵菌BSH活性
将3.0 g/L牛磺胆酸钠、2.0 g/L巯基乙酸钠、0.37 g/L无水CaCl2溶液添加至MRS固体培养基中,灭菌、倒板待凝固后,将无菌滤纸片在108~109 CFU/mL待测菌液中浸泡数秒钟后贴至平板中,在37 ℃厌氧箱中厌氧培养72 h。滤纸片周围的非透明颗粒状白色菌落或非透明晕圈表示BSH活性[17]。
1.3.5.2 发酵菌胆固醇降解能力的测定
参照杨晴等[13]的方法并进行微调。按3%接种量将乳酸菌悬液以及低、高剂量复合益生菌悬液分别接种于含1.0 g/L胆固醇的MRS肉汤培养基中,以去除胆固醇的MRS肉汤培养基为实验空白对照,37 ℃生长温度培养48 h。培养结束后向250 μL酶液中分别加入2.5 μL的待测样品上清液、实验空白对照液、6.55 mmol/L标准品和蒸馏水,37 ℃孵育10 min,测定OD500值,每个待测菌及待测复合菌平行测定3次。待测菌株对胆固醇的降解率的计算如公式(3)和公式(4)所示:
c(胆固醇)![]()
(3)
式中:A1,待测样品OD500值;A2,空白对照OD500值;A标,标准品OD500值;A0,蒸馏水OD500值。
胆固醇降解率![]()
(4)
式中:c0,接种待测菌前培养基中胆固醇的含量,mmol/L;c1,接种菌株48 h时培养基中胆固醇的含量,mmol/L。
1.3.6 基因学鉴定
结合耐胆盐、耐胃酸、耐药性以及体外胆固醇降解能力将分离筛选的菌株委托中国科学院微生物研究所进行16S rRNA基因序列测定,以此确定菌株归属。
2 结果与分析
2.1 发酵菌的分离结果
从传统发酵马乳中共分离、筛选出4株发酵菌纯培养物,经肉眼观察菌落形态特征和镜检细胞形态以及革兰氏染色阳性和3%过氧化氢酶阴性,确定4株菌为乳酸菌,分别标记为Ni2A、Ni2B、Ni2C和Ni2D。
2.2 形态学和生理生化鉴定结果
形态学水平上:分离到的4株菌质地湿润、边缘整齐、光滑且有光泽的凸起的菌落,各菌株形态学特征如图1所示,具体形态学描述如表2所示。
图1 发酵马乳中分离的发酵菌菌落特征
Fig.1 Characterization of fermenting bacteria colonies isolated from fermented mare’s milk
表2 发酵马乳中分离的发酵菌形态特征
Table 2 Morphological characterization of fermenting bacteria isolated from fermented mare’s milk

菌株大小质地隆起程度边缘透明度光滑度光泽度颜色Ni2A较小湿润凸起齐不透明光滑有白Ni2B较小较湿凸起齐不透明光滑有乳白Ni2C中等湿润微凸齐不透明光滑有乳白Ni2D大较湿扁平齐不透明光滑有乳白偏黄
生理生化水平上:分离到的4株菌的氧化酶、吲哚试验呈阴性,均不液化明胶,有1株可在45 ℃生长,4株菌都不能在6.5%NaCl中生长。用API 50 CH试剂条测定菌株对不同糖、碳源的利用能力,阳性结果表示菌株能够利用该底物,阴性则不能利用。通过结果发现,4株菌均对甘油、赤癣醇、D-阿拉伯糖、L-木糖、D-木糖、阿东醇、肌醇、L-山梨糖、β-甲基-D-木糖甙、α-甲基-D-甘露糖甙呈阴性,均对L-鼠李糖呈阳性。均不能利用淀粉、α-甲基-D-葡萄糖甙、糖原、D-松二糖、木糖醇、D-塔格糖、D-来苏糖、D-岩藻糖、D-阿拉伯糖醇、L-岩藻糖、L-阿拉伯糖醇、葡萄糖酸盐和2-酮基-葡萄糖酸盐等。各菌株的具体生理生化特征如表3所示。
表3 发酵菌的生理生化特征
Table 3 Physiological and biochemical characterization of fermenting bacteria
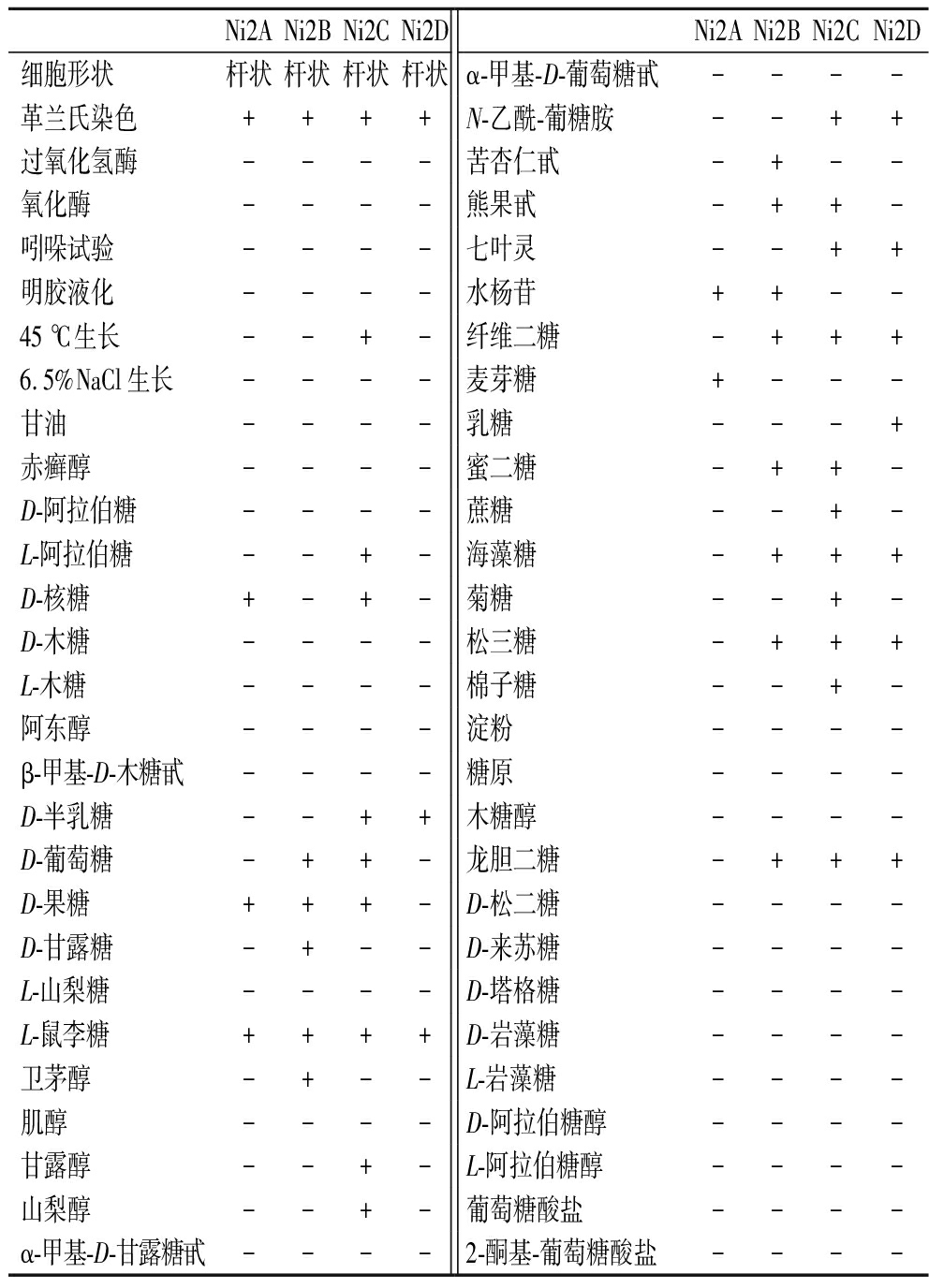
Ni2ANi2BNi2CNi2DNi2ANi2BNi2CNi2D细胞形状杆状杆状杆状杆状α-甲基-D-葡萄糖甙----革兰氏染色++++N-乙酰-葡糖胺--++过氧化氢酶----苦杏仁甙-+--氧化酶----熊果甙-++-吲哚试验----七叶灵--++明胶液化----水杨苷++--45 ℃生长--+-纤维二糖-+++6.5%NaCl生长----麦芽糖+---甘油----乳糖---+赤癣醇----蜜二糖-++-D-阿拉伯糖----蔗糖--+-L-阿拉伯糖--+-海藻糖-+++D-核糖+-+-菊糖--+-D-木糖----松三糖-+++L-木糖----棉子糖--+-阿东醇----淀粉----β-甲基-D-木糖甙----糖原----D-半乳糖--++木糖醇----D-葡萄糖-++-龙胆二糖-+++D-果糖+++-D-松二糖----D-甘露糖-+--D-来苏糖----L-山梨糖----D-塔格糖----L-鼠李糖++++D-岩藻糖----卫茅醇-+--L-岩藻糖----肌醇----D-阿拉伯糖醇----甘露醇--+-L-阿拉伯糖醇----山梨醇--+-葡萄糖酸盐----α-甲基-D-甘露糖甙----2-酮基-葡萄糖酸盐----
注:表中“+”为阳性结果;“-”为阴性结果。
2.3 发酵菌益生特性
2.3.1 发酵菌生长曲线
如图2所示,4株乳酸菌在MRS肉汤中的生长性能良好但进入对数生长期的时间有所差异。在测定时间24 h内明显观察到4株菌均进入对数生长期,菌株Ni2B、Ni2C在接种后16 h进入对数生长期为最早,菌株Ni2D时间为18 h,菌株Ni2A在接种后20 h进入对数生长期为最晚。在测定时间48 h后各菌株从对数期逐个进入稳定期,OD600值不再显著上升。
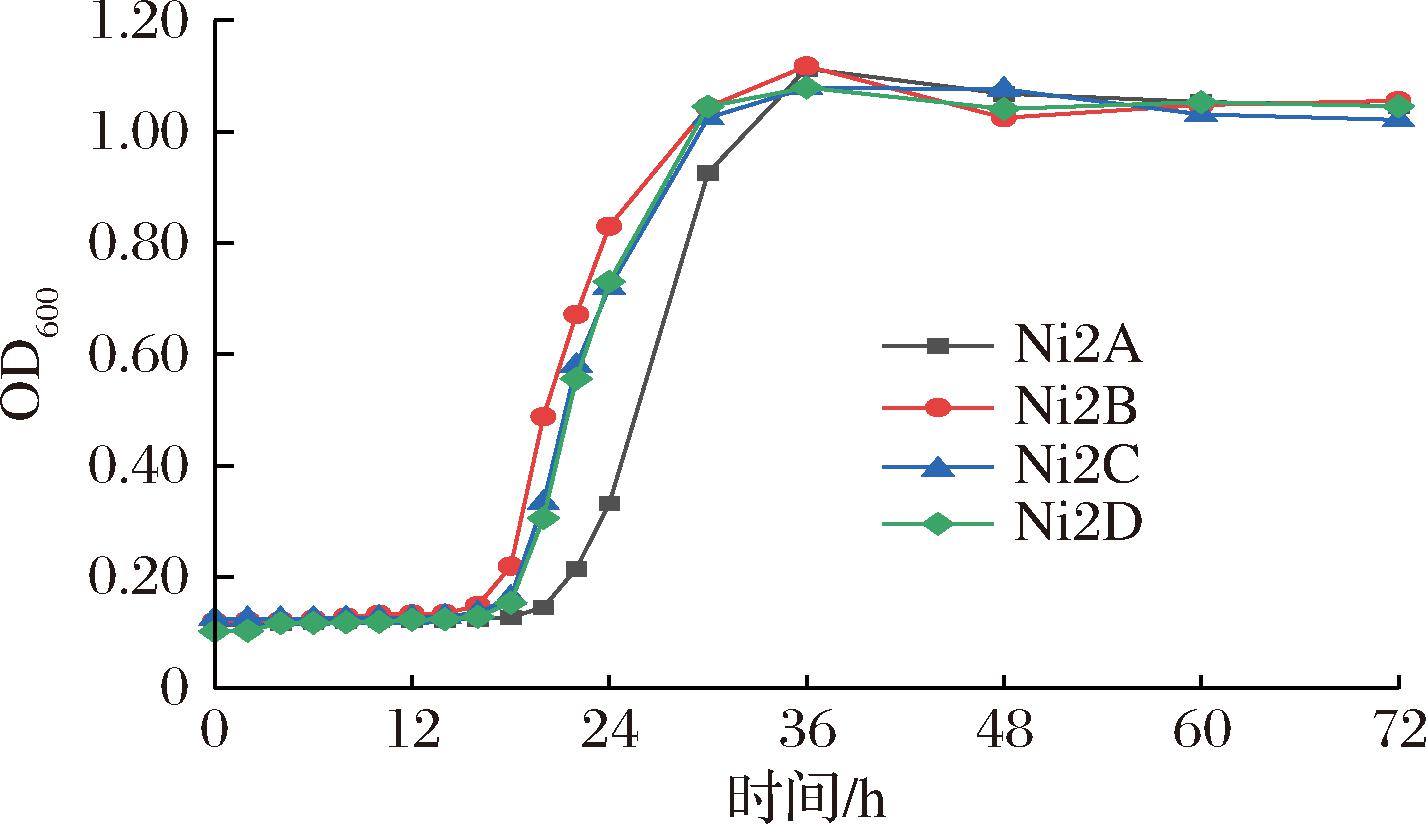
图2 发酵菌生长曲线
Fig.2 Growth curves of fermenting bacteria
2.3.2 发酵菌对胆盐的耐受性结果
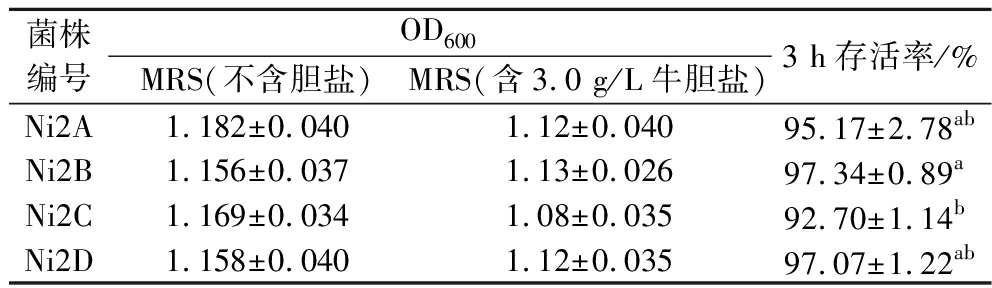
正常人体内胆盐质量浓度为0.3~3.0 g/L,益生菌适应肠道高胆盐环境是其能否被定义为益生菌的重要标准之一。由表4所示,将4株乳酸菌在3.0 g/L的高胆盐条件下厌氧培养3 h后,与对照组相比菌株Ni2A、Ni2B、Ni2C和Ni2D相对存活率均在90%以上。王佳敏等[18]从新疆传统奶酪中分离的乳酸菌在0.3%质量分数的胆盐条件下处理3 h后,存活率为96.89%,本实验分离的4株菌在相同条件下均有较好的耐高胆盐能力,其中Ni2B菌株存活率最高,为97.34%。
表4 各菌株对胆盐的耐受性(n=3)
Table 4 Tolerance to bile salts in various strains of bacteria(n=3)
菌株编号OD600MRS(不含胆盐)MRS(含3.0 g/L牛胆盐)3 h存活率/%Ni2A1.182±0.0401.12±0.04095.17±2.78abNi2B1.156±0.0371.13±0.02697.34±0.89aNi2C1.169±0.0341.08±0.03592.70±1.14bNi2D1.158±0.0401.12±0.03597.07±1.22ab
注:不同小写字母表示差异性显著(P<0.05)(下同)。
2.3.3 发酵菌对人工胃液的耐受性结果
益生菌在肠道消化过程中存活下来才能发挥其益生作用。不同的饮食结构可引起胃液pH值的波动,通常情况下胃液的pH值在3.0左右,但在食用酸性食物或空腹的情况下,可低至1.5左右。由表5所示,将4株乳酸菌在人工胃液(pH 2.0)中培养3 h后,与0 h相比,菌株Ni2A、Ni2B、Ni2C和Ni2D的相对存活率分别为63.86%、49.77%、87.67%、39.77%。雷雪艳等[19]从内蒙古地区自然发酵乳中分离出的4株乳酸菌在人工胃液(pH 3.0)中培养3 h后的存活率在23.36%~77.78%。本实验分离的Ni2C菌株在人工胃液(pH 2.0)条件下处理后存活率最高,为87.67%。
表5 各菌株对人工胃液的耐受性(n=3)
Table 5 Tolerance of various bacteria to artificial gastric fluids(n=3)

菌株0 h活菌数/(CFU/mL)3 h活菌数/(CFU/mL)3 h存活率/%Ni2A(8.30±0.36)×108(5.30±0.26)×10863.86±1.72bNi2B(7.83±0.21)×108(3.90±0.20)×10849.77±1.33cNi2C(8.10±0.26)×108(7.10±0.17)×10887.67±0.87aNi2D(4.70±0.44)×108(1.87±0.15)×10839.77±2.12d
2.4 药敏试验结果
细菌耐药性可分为天然性耐药和获得性耐药,抗生素是乳酸菌产生外源获得性抗性的首要原因,世界卫生组织已将抗生素耐药性列为了全球公共卫生面临的十大威胁之一[20]。即使乳酸菌改善机体许多生理功能,在发酵食品中的含量也丰富,但仍需对其进行安全性评价。选用8种常见抗生素对4株菌进行药敏实验,结果见图3所示。
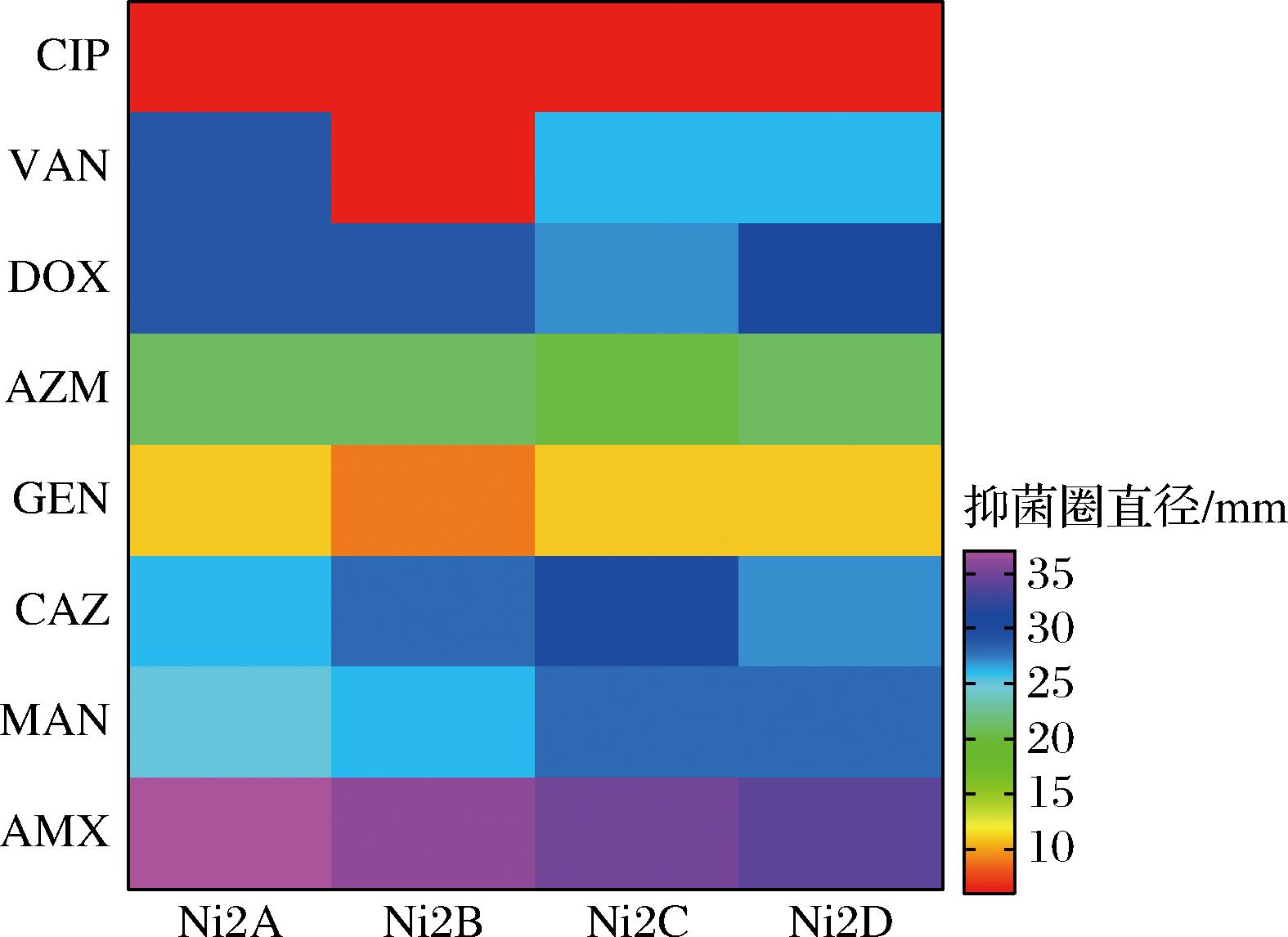
AMX-阿莫西林;MAN-头孢孟多;CAZ-头孢他啶;GEN-庆大霉素;AZM-阿奇霉素;DOX-多西环素;VAN-万古霉素;CIP-环丙沙星。
图3 根据抑菌圈直径对乳酸菌的抗生素耐药性的热图分析
Fig.3 Heatmap analysis of the antibiotic tolerance of lactic acid bacteria based on the diameters of the inhibition zone
热图通过颜色梯度变化表示抑菌圈直径大小,可呈现出待测菌对抗生素药物的敏感程度,颜色从红色到紫色的过程代表抑菌圈直径的递增。阿莫西林、头孢孟多、头孢他啶、阿奇霉素、多西环素的颜色分布处在绿色、蓝色和紫色之间,即菌株对它们表现敏感,而橙色区域主要在庆大霉素,表明菌株对其中度敏感,与相关的研究报道一致[21]。红色区域主要集中在环丙沙星和部分万古霉素,表明这2种抗生素对菌株无抑菌作用,表现出耐药性。在乳酸菌抗生素耐药的表型特征中,对抑制蛋白质合成(87.5%)和抑制细胞壁合成(62.5%)的抗生素药物的抵抗力最大[22],多数研究表明,其对喹诺酮类药物也具有固有耐药性[23]。
2.5 体外评估发酵菌胆固醇清除能力
2.5.1 定性测定发酵菌BSH活性
如果乳酸菌能够显示出BSH活性,那么在添加胆汁盐底物的培养基中,就可以把结合型胆盐转变成自由胆盐,之后与胆固醇结合,形成复合体[8]。在酸性环境中,自由胆盐与Ca2+结合形成白色沉淀[24]。如图4-b所示,2株菌的滤纸片周围可以观察到非透明白色沉淀圈,其余2株菌滤纸片周围观察到颗粒状白色菌落,表明该4株菌均具有BSH活性。基于滤纸片周围产生的沉淀圈的大小,能够初步推测出菌株Ni2B、Ni2C具有较好的BSH活性。
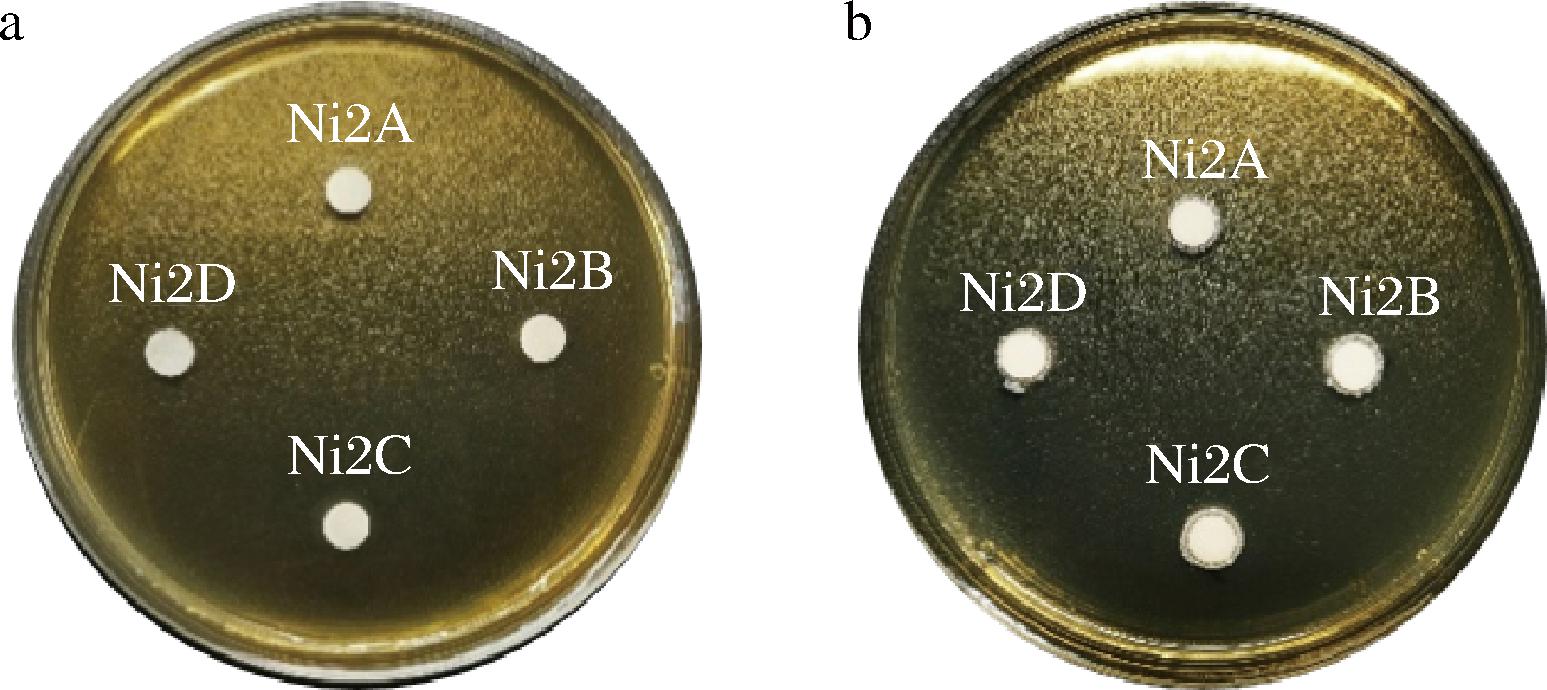
a-未添加胆盐的MRS琼脂培养基;b-添加胆盐的MRS琼脂培养基
图4 BSH活性定性检测
Fig.4 Qualitative assay of BSH activity
2.5.2 发酵菌对胆固醇的降解能力
胆固醇氧化酶法测定总胆固醇是胆固醇通过胆固醇酯酶、胆固醇氧化酶、过氧化物酶的作用最终形成红色醌化合物。相关研究表明,胆盐存在的条件有利于乳酸菌更好的吸收胆固醇[25]。如图5所示,各单一菌株及低、高剂量复合菌对培养基中胆固醇的清除率在(76.46±1.26)%~(87.96±0.43)%。单一菌株中,Ni2A对培养基中胆固醇的清除率最高,为(86.19±1.43)%。复合菌的低剂量对培养基中胆固醇的清除率为(87.96±0.43)%,高于其高剂量复合菌对培养基中胆固醇的清除率(79.27±0.81)%。杨晴等[13]采用同样的方法从青海地区自然发酵的牦牛乳中筛选出胆固醇降解率高于70%的6株菌,其中降解率最高为(74.21±1.58)%。
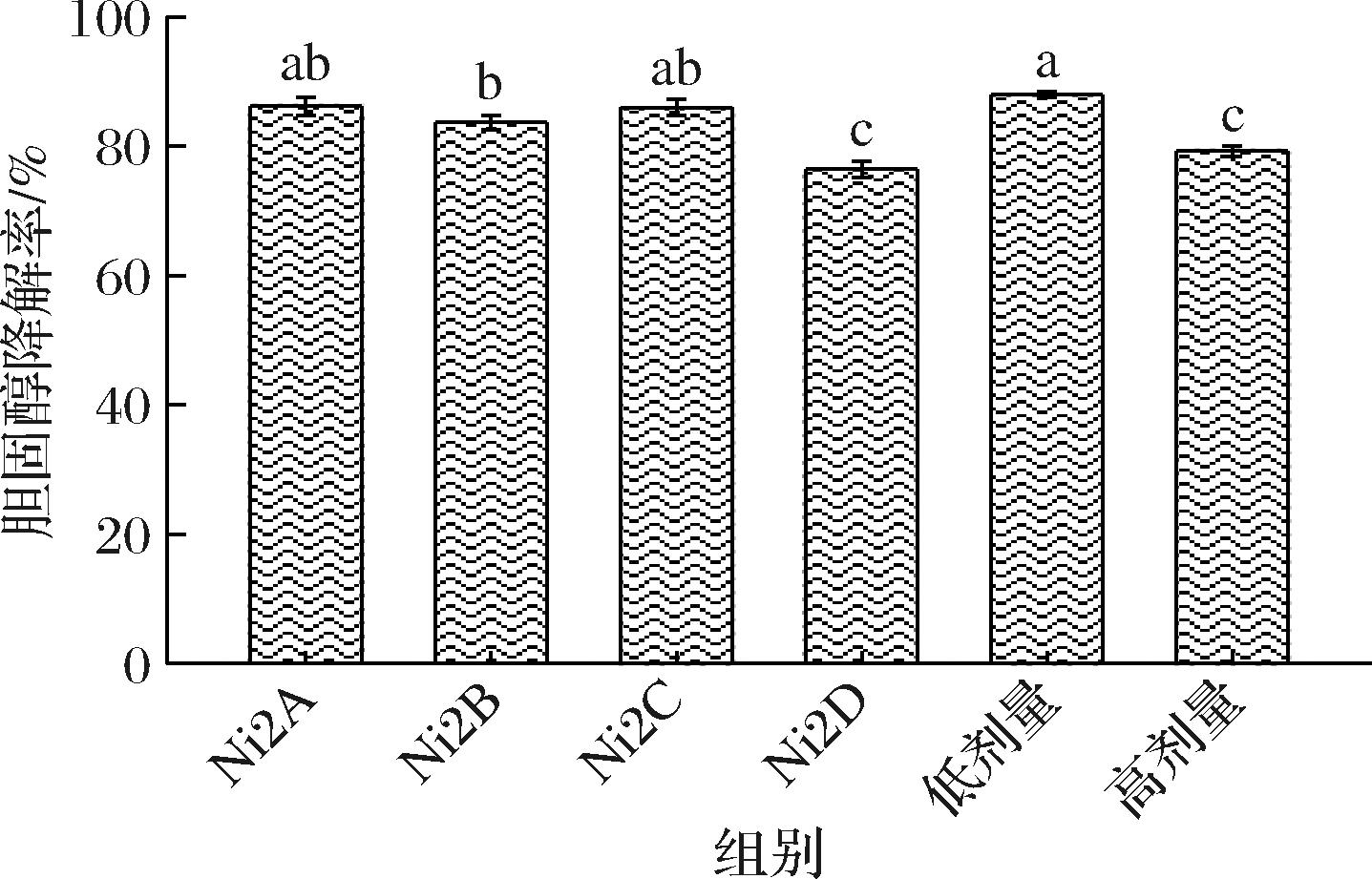
图5 各菌株对培养基中胆固醇的清除能力(n=3)
Fig.5 Removal of cholesterol from the medium by each strains(n=3)

图6 基于16S rRNA基因序列的乳酸菌系统发育树
Fig.6 Phylogenetic tree of lactic acid bacteria based on 16S rRNA gene sequences
2.6 16S rRNA基因序列分析结果
将Ni2A、Ni2B、Ni2C和Ni2D等4株菌经16S rRNA基因、pheS基因等实验数据等综合分析,参考《伯杰氏系统细菌学手册》以及International Journal of Systematic and Evolutionary Microbiology有关研究论文鉴定为植物乳植杆菌(Lactiplantibacillus plantarum)。
3 结论与讨论
酸马乳中的发酵微生物群落结构复杂,由于发酵后的酸马乳的酸度和贮藏时间与其中的菌群结构有着一定的关系,所以乳杆菌属的菌株通常被认为是自然发酵酸马奶中的优势菌株[26]。本研究从新疆伊犁哈萨克自治州尼勒克县不同牧区的牧民家中采集传统发酵方式得到的酸马乳样品,并分离筛选出4株革兰氏染色阳性、接触酶阴性的乳酸菌菌株,并用形态学和生理生化指标对分离菌株进行了鉴定。最后对测定益生特性、耐药性以及体外胆固醇降解能力的4株菌进行16S rRNA基因序列的鉴定,经同源性比较确定4株菌均为Lactiplantibacillus plantarum。
对宿主有益、无毒性和无致病作用,能够耐受胆汁和胃液的腐蚀,以活菌的状态到达肠道并能在肠道内增殖的菌群被称为益生菌[27],而乳酸菌作为常见的有益菌也应当具备以上条件。本研究经菌株生长曲线的测定来确定菌株的迟缓期、对数生长期和稳定期。经3.0 g/L高胆盐培养和pH 2.0人工胃液培养,确定待测菌是否能够耐受胆汁和胃液的腐蚀。结果表明,分离筛选的4株菌均具有较好的耐胆盐和耐胃酸的能力,能够以活菌状态到达和定植在肠道中发挥其益生作用。同时,益生菌的安全性对机体来说也至关重要,而益生菌的获得性耐药性是它产生安全问题的主要原因[20],因此检测益生菌对抗生素的敏感性可以有效的避免菌株将耐药基因传递给宿主。本研究药敏试验中,待测菌对万古霉素和环丙沙星,部分菌株对庆大霉素表现出耐药,这是因为乳酸菌对以上抗生素的固有耐药性[21-24]。
在新疆北部牧区人们喜食传统发酵乳品,其具有调节血脂等作用。传统发酵乳品富含传统发酵菌和生物活性肽,新疆牧区保留丰富的益生菌资源,但工业化的推进使一些菌株濒临灭绝,因此对其进行深入的研究非常迫切[28]。本研究最后经BSH活性定性检测和胆固醇氧化酶法等2种体外方法对分离菌株的胆固醇清除能力进行评估。结果表明,4株菌具有BSH活性,4株菌降胆固醇机制可能是在以牛磺胆酸钠为胆汁盐底物的培养基中,其将结合型胆盐转变成游离型胆盐,自由胆盐可与胆固醇共沉淀,从而达到降低胆固醇水平。而在培养基中胆固醇残留量的测定中,4株菌在体外都具有良好的降解胆固醇的能力,但单一菌与复合菌、低剂量复合菌与高剂量复合菌在清除能力上有所差异。大量研究表明乳酸菌在体外的降胆固醇机制主要以菌体吸收和共沉淀为主,因此不同单一菌在胆固醇降解率上存在的差异,分析其由于不同菌株对胆固醇的吸收和共沉淀能力不同有关[29]。本研究中Ni2A菌株的BSH活性不是最高的,而清除培养基中胆固醇的能力是最好的,该结果说明两者之间的关系并非相辅相成。KIMOTO等[30]研究具有清除胆固醇能力的乳酸菌,培养后发现培养基中并不存在游离胆酸盐,说明该菌株是通过菌体吸收机制来去除胆固醇,而不是BSH作用,验证了菌株BSH活性与其降胆固醇能力之间并无必然的联系;复合菌降胆固醇能力高于单一菌可能与该组中各菌株的共生特点、降胆固醇作用叠加或协同作用有关[31],对于复合菌的胆固醇清除作用和具体机制仍需深入研究。综上所述,本研究分离筛选的4株菌具有益生菌的基本特性和较高的安全性,同时在体外具有较好的降胆固醇能力,4株菌均可做为潜在益生菌,并为后期的体内研究提供理论基础。
[1] 李倩, 李海, 黄新新, 等.鲜马乳与发酵酸马乳常规营养成分的比较分析[J].中国乳品工业, 2022, 50(7):19-23.LI Q, LI H, HUANG X X, et al.Comparative analysis of conventional nutritional components of fresh horse milk and fermented sour milk[J].China Dairy Industry, 2022, 50(7):19-23.
[2] XUE W K, YUAN X X, JI Z J, et al.Nutritional ingredients and prevention of chronic diseases by fermented koumiss:A comprehensive review[J].Frontiers in Nutrition, 2023, 10:1270920.
[3] MENG J, DONG P P, ZHU M X, et al.Anti-obesity effects of Lactiplantibacillus plantarum BHP03 on high-fat diet mice and its regulatory function on intestinal microbiota[J].Food Bioscience, 2024, 61:104786.
[4] WANG Y M, WU Y C, SAILIKE J, et al.Fourteen composite probiotics alleviate type 2 diabetes through modulating gut microbiota and modifying M1/M2 phenotype macrophage in db/db mice[J].Pharmacological Research, 2020, 161:105150.
[5] RIAZ RAJOKA M S, WU Y G, MEHWISH H M, et al.Lactobacillus exopolysaccharides:New perspectives on engineering strategies, physiochemical functions, and immunomodulatory effects on host health[J].Trends in Food Science &Technology, 2020, 103:36-48.
[6] BURAKOVA I, SMIRNOVA Y, GRYAZNOVA M, et al.The effect of short-term consumption of lactic acid bacteria on the gut microbiota in obese people[J].Nutrients, 2022, 14(16):3384.
[7] FAN X K, LING N, LIU C L, et al.Screening of an efficient cholesterol-lowering strain of Lactiplantibacillus plantarum 54-1 and investigation of its degradation molecular mechanism[J].Ultrasonics Sonochemistry, 2023, 101:106698.
[8] KLAVER F A, VAN DER MEER R.The assumed assimilation of cholesterol by Lactobacilli and Bifidobacterium bifidum is due to their bile salt-deconjugating activity[J].Applied and Environmental Microbiology, 1993, 59(4):1120-1124.
[9] GILLILAND S E, NELSON C R, MAXWELL C.Assimilation of cholesterol by Lactobacillus acidophilus[J].Applied and Environmental Microbiology, 1985, 49(2):377-381.
[10] 刘剑桥, 吴酉芝, 冉军舰, 等.乳杆菌体外降解胆固醇特性研究[J].中国乳品工业, 2023, 51(2):25-31.LIU J Q, WU Y Z, RAN J J, et al.Study on cholesterol degradation characteristics of Lactobacillus in vitro[J].China Dairy Industry, 2023, 51(2):25-31.
[11] OSTADZADEH M, HABIBI NAJAFI M B, EHSANI M R.Lactic acid bacteria isolated from traditional Iranian butter with probiotic and cholesterol-lowering properties:In vitro and in situ activity[J].Food Science &Nutrition, 2023, 11(1):350-363.
[12] 冯鑫, 丁源, 郭怡冰, 等.胆盐水解酶降胆固醇的研究进展[J].现代食品科技, 2021, 37(11):1-8.FENG X, DING Y, GUO Y B, et al.Research progress on the cholesterol-lowering effects of bile salt hydrolase[J].Modern Food Science and Technology, 2021, 37(11):1-8.
[13] 杨晴, 王荣春, 孙玥, 等.降胆固醇乳酸菌的筛选鉴定及其性能研究[J].食品与发酵工业, 2023, 49(3):46-52.YANG Q, WANG R C, SUN Y, et al.Screening, identification and properties of cholesterol lowering lactic acid bacteria[J].Food and Fermentation Industries, 2023, 49(3):46-52.
[14] 孙昕,加勒哈斯别克·塞力克,王艳明,等.乳源性复合益生菌降胆固醇能力研究[J].新疆医科大学学报,2020,43(08):1102-1106.SUN X, SAILIKE J, WANG Y M, et al.The cholesterol-lowering ability of milk-borne composite probiotics[J].Journal of Xinjiang Medical University, 2020, 43(08):1102-1106.
[15] 娜日苏, 如意, 刘文俊, 等.中东亚不同地区酸马奶中乳酸菌分离鉴定及优良菌株筛选[J].食品与发酵工业, 2023, 49(17):120-126.NA R S, RU Y, LIU W J, et al.Isolation and identification of lactic acid bacteria in koumiss in different regions of Central and East Asia and screening of excellent strains[J].Food and Fermentation Industries, 2023, 49(17):120-126.
[16] SAMEDI L, CHARLES A L.Isolation and characterization of potential probiotic Lactobacilli from leaves of food plants for possible additives in pellet feeding[J].Annals of Agricultural Sciences, 2019, 64(1):55-62.
[17] 任大勇, 曲天铭, 杨柳, 等.东北传统发酵食品中降胆固醇乳酸菌的筛选及其降解机制[J].食品科学, 2019, 40(22):199-206.REN D Y, QU T M, YANG L, et al.Screening of lactic acid bacterial isolates from traditional fermented foods in NorthEast China for cholesterol-lowering property and mechanism of action analysis[J].Food Science, 2019, 40(22):199-206.
[18] 王佳敏, 胡美丽, 李宇辉.新疆传统奶酪中抗氧化乳酸菌筛选及培养条件优化[J].食品与发酵工业, 2023, 49(4):45-51.WANG J M, HU M L, LI Y H.Screening and optimization of culture conditions for antioxidant lactic acid bacteria in Xinjiang traditional cheese[J].Food and Fermentation Industries, 2023, 49(4):45-51.
[19] 雷雪艳,赵丽霞,李瑜,等.内蒙古地区自然发酵乳中乳酸菌的分离鉴定及优良菌株筛选[J].食品与发酵工业,2025,51(1):11-17.LEI X Y, ZHAO L X, LI Y, et al.Isolation and identification as well as screening of excellent lactic acid bacteria from natural fermented milk in Inner Mongolia[J].Food and Fermentation Industries, 2025,51(1):11-17.
[20] World Health Organization.Antimicrobial Resistance[EB/OL].(2022-07-20)[2024-12-26].Available online:https://www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance.
[21] CAMPEDELLI I, MATHUR H, SALVETTI E, et al.Genus-wide assessment of antibiotic resistance in Lactobacillus spp[J].Applied and Environmental Microbiology, 2018, 85(1):e01738-18.
[22] SHAHALI A, SOLTANI R, AKBARI V.Probiotic Lactobacillus and the potential risk of spreading antibiotic resistance:A systematic review[J].Research in Pharmaceutical Sciences, 2023, 18(5):468-477.
[23] GUO H L, PAN L, LI L N, et al.Characterization of antibiotic resistance genes from Lactobacillus isolated from traditional dairy products[J].Journal of Food Science, 2017, 82(3):724-730.
[24] 玛丽娜·库尔曼, 包怡红.传统酵素源高效降胆固醇菌株的筛选、鉴定及胆盐水解酶活性分析[J].中国食品学报, 2021, 21(1):266-275.KUERMAN M, BAO Y H.Screening, identification of cholesterol-lowering abilities of strains from traditional ferments and analysis of bile salt hydrolase activity[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(1):266-275.
[25] 李晓军, 刘斌, 李云旭, 等.一株具降胆固醇功能乳酸菌的机制研究[J].中国微生态学杂志, 2014, 26(5):522-525.LI X J, LIU B, LI Y X, et al.The mechanism of cholesterol-lowering activity of a lactic acid bacteria[J].Chinese Journal of Microecology, 2014, 26(5):522-525.
[26] 刘文俊, 多拉娜, 刘亚华, 等.基于纯培养方法和PacBio三代测序技术研究蒙古国传统酸马奶中乳酸菌多样性[J].中国食品学报, 2019, 19(4):27-37.LIU W J, DUO L N, LIU Y H, et al.Lactic acid bacteria diversity in Mongolia traditional koumiss based on culture-dependent and PacBio sequencing technology[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(4):27-37.
[27] 阿热爱·巴合提,谭春明,李平兰.益生菌的分类及其多领域应用研究现状[J].生物加工过程,2022,20(1):88-94.BAHETI A, TAN C M, LI P L.Classification and applications of probiotics[J].Chinese Journal of Bioprocess Engineering, 2022, 20(1):88-94.
[28] SONNENBURG J L, SONNENBURG E D.Vulnerability of the industrialized microbiota[J].Science, 2019, 366(6464):eaaw9255.
[29] 高媛, 黄芳芳, 王家旺, 等.益生菌降胆固醇的机制及其评价策略研究进展[J].食品科学, 2023, 44(21):322-329.GAO Y, HUANG F F, WANG J W, et al.Research progress on cholesterol-lowering mechanism and evaluation strategies for probiotics[J].Food Science, 2023, 44(21):322-329.
[30] KIMOTO H, OHMOMO S, OKAMOTO T.Cholesterol removal from media by lactococci[J].Journal of Dairy Science, 2002, 85(12):3182-3188.
[31] 国立东, 王丽群, 蒋琛, 等.乳酸菌调控体内胆固醇代谢综述[J].中国乳品工业, 2016, 44(2):32-36.GUO L D, WANG L Q, JIANG C, et al.Regulation of cholesterol metabolism in vivo by lactic acid bacteria:A review[J].China Dairy Industry, 2016, 44(2):32-36.