乳酸菌是一类可以利用可发酵碳水化合物产生大量乳酸的细菌统称。在发酵食品工业中有着极其重要的作用,乳酸菌可以通过代谢活动产生乳酸和一些特殊风味物质,从而赋予食品特有的品质[1]。乳酸菌具有调节肠道菌群平衡、改善免疫能力、促进机体生长发育、抑制有害菌群生长的功效。目前乳酸菌干燥制剂是消费市场及工业的主要商品形式,其具有运输成本低、容易保藏等特点。研究发现将复原脱脂奶与蔗糖混合作为喷雾干燥中植物乳植杆菌的保护性载体,其中的乳钙可以在细胞壁表面形成保护壳保护菌体[2]。PERDANA等[3]将寡聚糖和多种单糖、双糖作为喷雾干燥过程中植物乳植杆菌的保护性载体,发现较高玻璃态转化温度和较低分子质量的糖类,糖的羟基在细胞脱水时可以代替水分子与蛋白质、细胞膜相互作用形成氢键,维持细胞结构的稳定,能够较好地保持菌的活性。
喷雾干燥过程中,DNA、RNA、蛋白质和核糖体等,都受到不同程度的热损伤。ANANTA等[4]用流式细胞术得出细胞膜热损伤的主要部位,而细胞膜的损伤是细菌死亡的最主要原因。其中核糖体的损伤也是热致死的关键因素。高温会使细胞内核糖体大量损失,导致不能满足乳酸菌的基本生命活动所需的最低含量而失活[5]。乳酸菌的热损伤主要发生在干燥后期,所以出口温度越高,停留时间越长,存活率越低。
进口温度是影响喷雾干燥粉末理化性质的重要因素。喷雾干燥产品的粒度也取决于进口温度,温度升高导致水分蒸发加快,使得微球快速形成从而没有足够的时间收缩,导致得到的粒径较大。控制出口温度是提高乳酸菌存活率的关键,出口温度越低乳酸菌的存活率越高,且一般不高于90 ℃。当出口温度从80 ℃降到60 ℃时,唾液链球菌嗜热亚种MK-10存活率由12.7%提高到69.5%,但同时水分含量也由4.4%升高到6.3%[6]。国内外主要研究的是喷雾干燥过程中乳酸菌的损伤机制;进出口温度对乳酸菌喷雾干燥过程中温度、水分以及乳酸菌活力分布的影响。通过将海藻糖负载到细胞内等措施,加强对细胞膜的保护效果,或者对细胞进行热预适应处理,提高喷雾干燥的存活率[1]。但是通过改变前期乳酸菌发酵过程的培养基的研究相对较少。酚类化合物也可以通过与乳酸菌表层蛋白形成复合物来解毒。单宁与蛋白质之间的结合主要是通过单宁的酚羟基与蛋白质肽键的羰基之间形成氢键。外界环境变化时,菌体的表面蛋白等膜表面成分作为菌体与环境交流的介质,通过调节相关信号通路来应对环境变化,或者通过共价或非共价相互作用掩埋在大分子化合物中,以此减少细胞受到的损伤[7]。因此,本实验通过添加蓝莓和乳清蛋白作为乳酸菌的培养基,发酵形成大分子聚合物,添加不同保护剂、进而探究喷雾干燥过程中不同进口温度等因素对菌体的影响,以及蓝莓乳清蛋白发酵产物喷雾干燥菌粉结构表征。
1 材料与方法
1.1 实验材料
蓝莓样品,采摘自大兴安岭的野生蓝莓(51°55′N,124°34′E);乳清蛋白粉,上海昊岳食品科技有限公司提供;植物乳植杆菌67、副干酪乳酪杆菌grx701,益生菌与乳品深加工省高校重点实验室(扬州大学);MRS肉汤、MRS固体培养基、0.9%生理盐水、盐酸、NaOH、海藻糖、谷氨酸钠、甘油、脱脂乳粉、木糖醇、蔗糖,国药集团化学试剂有限公司。
1.1.1 样品预处理
用煮沸的去离子水清洗容器(榨汁机、纱布、烧杯、铁桶、勺子等)。将蓝莓放入冷水中解冻后倒400 g蓝莓至榨汁机中榨汁,并用纱布进行过滤。
MRS培养基样:用去离子水配制100 mL的MRS液体培养基,装入瓶中。
乳清蛋白样:向量杯中加入100 g的去离子水以及6 g的乳清蛋白粉和6 g的蔗糖,装入瓶中。
蓝莓乳清蛋白混合样:取16.67 mL蓝莓汁倒入量杯中并用去离子水定容至100 mL,然后加入6 g的乳清蛋白粉和6 g的蔗糖,装入瓶中。
分别在配好的蓝莓乳清蛋白混合样和乳清蛋白样中加入用去离子水清洗好的转子,在800 r/min,室温下水合20 min。
用NaOH溶液将调配好的蓝莓乳清蛋白混合样品和乳清蛋白样品的pH值调节至6.5。
先将水浴锅预热至85 ℃,样品松开瓶盖放入后,即调温至95 ℃,温度上升到95 ℃后计时5 min后拿出拧紧瓶盖,并降至室温。MRS液体培养基采用高压蒸汽灭菌(121 ℃,15 min)。
接菌发酵:在无菌环境中,向样品中接入二代植物乳植杆菌和副干酪乳酪杆菌各1.5 mL(100 mL),37 ℃恒温培养12 h。
本研究所用的保护剂均为食品级。
保护剂1:12%脱脂乳粉,1.5%谷氨酸钠,4%海藻糖,4%甘油(以上均为质量分数,下同)。
保护剂2:12%脱脂乳粉,1.5%谷氨酸钠,4%海藻糖,4%木糖醇。
保护剂3:12%脱脂乳粉,1.5%谷氨酸钠,4%海藻糖,13%蔗糖。
保护剂用去离子水配制,由于脱脂乳粉难溶解,可单独用一个量杯并分配多一点的去离子水,且需要加入转子(去离子水清洗)在800 r/min室温下水合20 min后倒入锥形瓶中,采用高压蒸汽灭菌115 ℃灭20 min。其余的于一个新的量杯中用玻璃棒搅拌溶解后倒入锥形瓶中,采用高压蒸汽灭菌121 ℃灭15 min。灭菌完成后,先在无菌操作台中紫外20 min,然后将两瓶混合摇匀。
1.2 实验方法
1.2.1 活菌数测定
制备1瓶100 mL MRS培养基样、2瓶100 mL蓝莓乳清蛋白混合样、2瓶100 mL乳清蛋白样,3种样中各取1瓶按照1∶1的体积比添加100 mL保护剂1,剩余2瓶添加100 mL 0.9%灭菌生理盐水,然后接菌发酵12 h。采用平板计数法测定活菌数。
1.2.2 喷雾干燥实验
泵蠕动速度10 r/min、风机频率25 Hz、通针设定为5。实验前将料液罐、喷嘴和料液管等用无菌水清洗,安装好后预热30 min,使达到预设温度[8]。
制备3瓶100 mL MRS发酵样、4瓶100 mL蓝莓乳清蛋白混合发酵样、4瓶乳清蛋白发酵样。然后从3种发酵样中各取3瓶按照1∶1的体积比例分别添加保护剂1、保护剂2、保护剂3,剩余的2瓶添加100 mL 0.9%灭菌生理盐水。在进口温度120 ℃,出口温度60 ℃下进行喷雾干燥,将收集到的11罐菌粉立刻放入干燥器中,防止受潮[9]。
1.2.3 菌粉水分含量测定
分别称取菌粉2 g左右,在105 ℃的烘箱中干燥3 h后取出放入干燥器中冷却至室温,然后称量,重复上述操作直至最后两次称量的质量差小于1.0 mg,即烘干后菌粉的质量[10],水分含量按公式(1)计算。
水分含量![]()
(1)
式中:m1,烘干前菌粉的质量,g;m2,烘干后菌粉的质量,g。
水分活度采用水分活度测试仪进行测定。
1.2.4 菌粉扫描电镜观察
蓝莓乳清蛋白混合发酵样添加保护剂1,在进口温度分别为120、150 ℃和180 ℃,出口温度60 ℃喷雾干燥后的菌粉,黏于操作台上用铂金进行在样品表面镀上一层金膜,时间150 s。最后用扫描电镜观察,电压20 kV,放大倍数分别为200、500、2 000[10]。
1.2.5 傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)分析
MRS发酵样添加保护剂1、蓝莓乳清蛋白混合发酵样添加保护剂1、蓝莓乳清蛋白混合发酵样不加保护剂、乳清蛋白发酵样添加保护剂1、乳清蛋白发酵样不加保护剂,在进口温度为120 ℃,出口温度60 ℃喷雾干燥后的菌粉。用FTIR仪表征喷雾干燥后菌粉的结构变化,光谱范围为3 800~500 cm-1[11]。
1.3 数据统计与分析
数据均采用SPSS.22软件进行数据差异显著性分析。结果用“平均值±标准差”表示,n=3。P<0.05代表具有显著差异。
2 结果与分析
2.1 不同保护剂对喷雾干燥菌体存活率的影响
乳酸菌在喷雾干燥过程中,约有3/5的时间处于略高于出口温度的干燥环境中,因此,保护剂的添加可以减少干燥过程中热应力及高温胁迫所带来的损伤,从而有效地提升菌体细胞活性。海藻糖通过磷脂双分子层与氢键相互作用以增强细胞膜稳定性,还可以防止细胞膜发生相变。在喷雾干燥进口温度120 ℃,出口温度60 ℃的条件下,考察了不同保护剂对喷雾干燥菌体存活率的影响。由图1可知,乳酸菌发酵蓝莓乳清蛋白样品在不添加保护剂的情况下,经喷雾干燥后菌体存活率高于乳清蛋白单独发酵样品(P<0.05),经MRS培养的乳酸菌在喷雾干燥后存活率为0。说明在不添保护剂的条件下,乳清蛋白蓝莓混合发酵对乳酸菌在高温胁迫下具有一定的保护作用。蓝莓乳清蛋白混合发酵样品添加保护剂1后的热保护性较好,活菌数和菌体存活率显著高于保护剂2和保护剂3。说明甘油不仅对乳酸菌的冷冻起着保护作用,对喷雾干燥也具有一定的保护作用。MRS培养基培养的乳酸菌在添加保护剂2后进行喷雾干燥,菌体存活率高于保护剂1和保护剂3(P<0.05)。当保护剂相同的条件下,乳清蛋白蓝莓混合发酵经喷雾干燥后菌体存活率高于MRS培养基和乳清蛋白单独培养(P<0.05)。由此可知,蓝莓和乳清蛋白混合培养对乳酸菌的抗热胁迫能力具有一定的增强作用,可以提高对菌体在高温环境中的耐受能力。
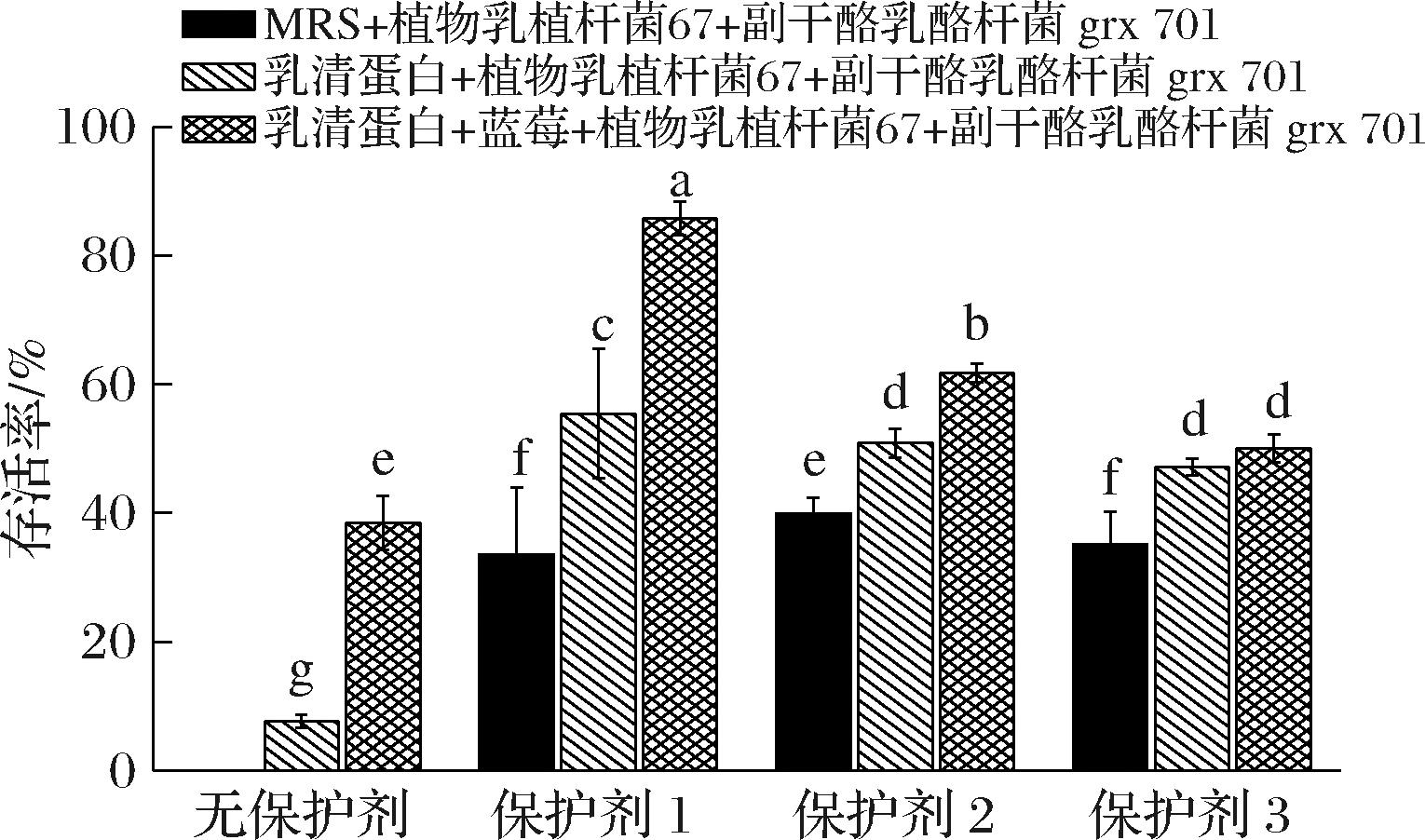
图1 喷雾干燥对不同发酵体系乳酸菌存活率的影响
Fig.1 Effect of spray drying on survival rate of lactic acid bacteria from different fermentation system
2.2 喷雾干燥进口温度对菌体存活率的影响
为考察蓝莓乳清蛋白混合发酵体系对菌体的保护作用,采用喷雾干燥进口温度分别为120、150 ℃和180 ℃,出口温度60 ℃,保护剂1条件下喷雾干燥,并进行活菌数测定。如图2-a所示,随着喷雾干燥进口温度的增加,喷雾干燥后菌体的数量显著降低,进口温度为120 ℃时,活菌数和存活率(图2-b)显著高于进口温度150 ℃和 180 ℃(P<0.05)。喷雾干燥后活菌数降低,乳清蛋白发酵复合物以及蓝莓乳清蛋白混合发酵复合物在喷雾干燥的过程中,添加保护剂组菌体活力显著高于不添加保护剂组(P<0.05)。同时添加保护剂组的蓝莓乳清蛋白混合发酵体系菌体存活率高于MRS培养基发酵菌体。说明蓝莓乳清蛋白混合发酵可以提高菌体对高温的耐受,主要是与菌体发酵过程中与蓝莓和乳清蛋白的活性成分相互作用,在菌体表面形成了包裹,提高菌体对高温的耐受能力,喷雾干燥后仍有较高的活菌数和存活率。蓝莓和乳清蛋白在发酵的过程中,蛋白质中的酰胺键和花青素以氢键的形式连接,形成花青素乳清蛋白复合物,该复合物再与菌体表面蛋白相互作用形成保护,提高其对外界环境的保护能力[12]。当喷雾干燥进口温度达到150 ℃ 和180 ℃ 时,活菌数仍然可以达到107 CFU/mL,而且加保护剂组活菌数和存活率都高于不加保护剂组。

a-活菌数;b-存活率
图2 喷雾干燥进口温度对发酵样活菌数及存活率的影响
Fig.2 Influence of spray drying inlet temperature on the number of viable bacteria and survival rate of fermented samples
2.3 喷雾干燥菌粉水分活度和水分含量分析
喷雾干燥过程中,热损伤和脱水损伤是引起乳酸菌死亡的2个主要原因。细胞膜是脱水过程中主要的损伤位点。水分子与细胞结构通过氢键结合,在脱水过程中的稳定性会被破坏。特别是细胞膜,会发生凝胶化及反向六角相变化,导致细胞膜失去作为细胞与外界环境的屏障作用。同时细胞膜的通透性也会发生改变,对外界环境的敏感性增加,导致胞内酶外流,甚至会导致细胞膜塌陷破裂[13]。关键的细胞组分,包括DNA、RNA、蛋白质,膜和核糖体,可能会在喷雾干燥过程中由于细胞与热空气的接触,造成不可逆的热损伤。水分含量会影响菌体在贮藏期间的稳定性,水分含量过高会增加有害菌的繁殖,含量过低会降低乳酸菌的活力[14]。由图3-a可知,蓝莓乳清蛋白混合发酵菌粉含水量高于MRS培养基菌粉和乳清蛋白发酵菌粉。菌体细胞在喷雾干燥过程中迅速失去水分,当有保护剂存在时,保护剂中的蛋白、糖类与菌体相互作用,降低了脱水速度。随着喷雾干燥进口温度的升高,菌粉水分含量的变化不显著,说明进口温度对水分含量的影响不明显,蓝莓和乳清蛋白在菌体表面形成的保护和保护剂都会降低菌体在喷雾干燥过程中的过度脱水。由图3-b可知,随着进口温度增加,菌粉的水分活度降低,对于蓝莓乳清蛋白混合发酵菌粉水分活度随着进口温度的增加降低(P<0.05),在120 ℃和150 ℃的进口温度时,蓝莓乳清蛋白混合发酵菌粉在有保护剂存在时,水分活度低于无保护剂的菌粉,说明,保护剂的存在可以进一步提高菌体表面对温度的敏感性,水分结合能力降低,大部分自由水随温度升高,迅速散失,因此,有保护剂存在下菌粉水分活度降低。在无保护剂的条件下,蓝莓乳清蛋白混合发酵菌粉进口温度为180 ℃时,水分活度与150 ℃喷雾干燥菌粉差异显著(P<0.05)。蓝莓乳清蛋白混合发酵菌粉水分活度高于乳清蛋白单独发酵菌粉。与蓝莓和乳清蛋白发酵后形成的多孔结构有关,吸水能力增加,对水分子的结合能力增加。蓝莓乳清蛋白混合发酵过程有助于菌粉水分活度的保持,以及对高温环境的耐受能力。在干燥阶段,多酚的许多羟基取代了水分子,保持了细胞生物大分子在水合状态下的原始自然结构。一些大分子纤维在细菌周围形成保护层,抵抗细胞的损伤[12]。
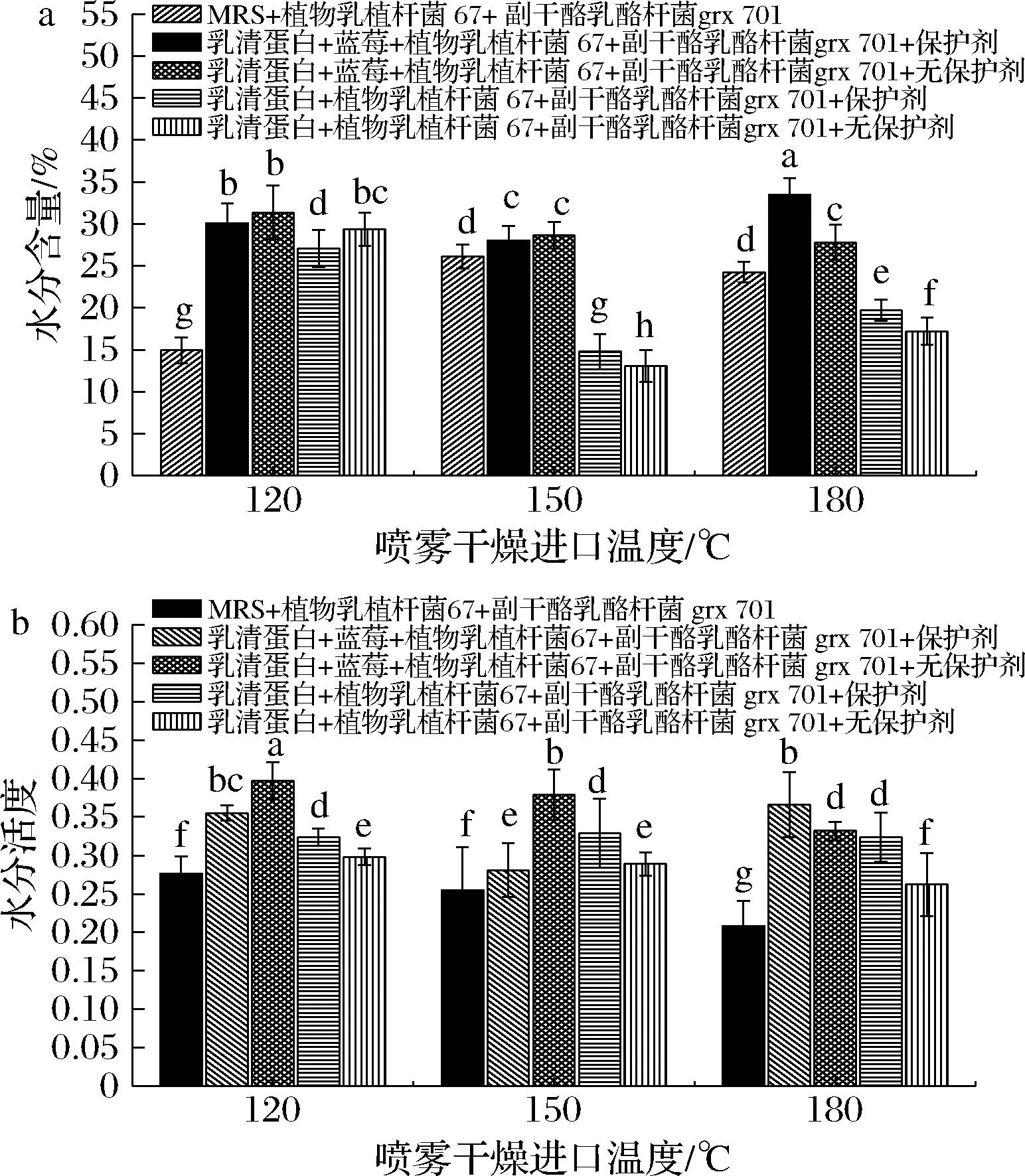
a-水分含量;b-水分活度
图3 喷雾干燥进口温度对菌粉水分含量和水分活度的影响
Fig.3 Effect of inlet temperature of spray drying on moisture content and water activity of bacterial powder
2.4 喷雾干燥菌粉表面形态
蓝莓乳清蛋白混合发酵后与保护剂(12%脱脂乳粉、4%海藻糖、4%甘油、1.5%谷氨酸钠)按照1∶1混合,进口温度分别为120、150 ℃和180 ℃,出口温度60 ℃,获得发酵菌粉,采用扫描电镜观察乳清蛋白蓝莓喷雾干燥菌粉表面形态。如图4所示,当进口温度为120 ℃和150 ℃时,蓝莓乳清蛋白混合发酵菌粉表面光滑,颗粒感明显,且150 ℃进口温度菌粉颗粒的分散性好于120 ℃进口温度。当进口温度为180 ℃ 时,粉末的交联现象明显。说明进口温度过高会使蛋白甚至是菌体表面活性物质发生交联,产生块状结构,从而造成大部分菌体死亡。

a-1~a-3-120 ℃进口温度喷雾干燥样品;b-1~b-3-150 ℃进口温度喷雾干燥样品;c-1~c-3-180 ℃进口温度喷雾干燥样品
图4 喷雾干燥进口温度对蓝莓乳清蛋白发酵菌粉表面形态的影响
Fig.4 Influence of spray drying inlet temperature on the surface morphology of blueberry whey protein ferment
2.5 FTIR分析
由图5可知,由植物乳植杆菌67和副干酪乳酪杆菌grx701发酵组分、蓝莓和乳清蛋白混合体系在喷雾干燥3 800~500 cm-1的红外光谱。蓝莓乳清蛋白发酵的混合体系中乳清蛋白的二级结构发生了变化,表现为酰胺I带和酰胺Ⅱ带的轻微移位。酰胺带的变化进一步证实了乳清蛋白和蓝莓花青素之间的相互作用,这依赖于C—N和N—H基团。上述酰胺带的移位表明,蓝莓花青素主要与乳清蛋白中的C—O、C—N 和N—H基团结合。同时,有报道称花青素与蛋白质的相互作用是通过氢键的形成发生的,其中酚羟基与蛋白质的某些基团(如—OH和—NH2基团)的相互作用起着至关重要的作用。在所有样品的光谱中,由于O—H基团的拉伸,在3 600~3 000 cm-1波数范围内出现了较窄的吸收峰。在1 700~1 600 cm-1波数范围内出现较宽的吸收峰,这是吸收水分子振动的结果[12]。由图5-b可知,蓝莓与乳清蛋白混合体系的FTIR光谱在3 600~3 100 cm-1处呈现较宽波段的强吸收峰,这是由于O—H基团的拉伸和振动吸收所致。峰出现在3 000~2 800 cm-1波数范围内,这是由于—NH2的拉伸作用。此外,C—O—C基团在1 100~950 cm-1波数范围内的特殊峰是由拉伸和振动产生的。850~750 cm-1处的峰值是乳清蛋白中芳环延伸的—CH[15]。在无保护剂的作用下,对比乳清蛋白蓝莓混合发酵样品和乳清蛋白单独发酵样品红外光谱可知,在酰胺Ⅲ处,乳清蛋白单独发酵样品的峰强度显著低于蓝莓乳清蛋白混合发酵样品,同时在3 400~3 200 cm-1附近乳清蛋白蓝莓混合发酵样品的—OH峰增强,说明有多酚/花色苷等化合物的存在[16],另外,在波数3 500~3 100 cm-1和3 000~2 800 cm-1处,NH2基团的强度增加,说明在蓝莓存在的条件下,蛋白与菌体之间的相互作用增强。在添加保护剂后,在酰胺带I、酰胺带Ⅱ和酰胺带Ⅲ中的峰强度增加主要与保护剂中的脱脂乳粉有关,羟基峰的增加主要与保护剂中的海藻糖有关。

a-波数为500~2 000 cm-1;b-波数为2 600~3 800 cm-1
图5 不同发酵体系喷雾干燥FTIR分析
Fig.5 FTIR analysis of different fermentation system after spray drying
3 结论
本研究探索了MRS培养基、乳清蛋白单独培养、蓝莓乳清蛋白混合培养乳酸菌后再添加保护剂,进行喷雾干燥后,乳酸菌菌粉的活性。在进口温度120 ℃,出口温度60 ℃的条件下,蓝莓乳清蛋白混合培养后添加保护剂1对喷雾干燥菌粉中乳酸菌的保护效果好,存活率可以达到91%,且菌粉有较好的分散性。蓝莓乳清蛋白混合发酵菌粉水分活度均高于MRS培养基菌粉,与蓝莓中活性成分结合水的能力有关。FTIR显示蓝莓乳清蛋白发酵的混合体系中乳清蛋白的二级结构发生了变化,表现为酰胺I带和酰胺II带的发生移位,主要与乳清蛋白和蓝莓花青素之间的相互作用有关。今后将对乳清蛋白、蓝莓、乳酸菌在发酵过程中的相互作用位点,以及相关结构进行深入的研究,为以乳清蛋白和蓝莓作为混合培养基,开发高菌株存活率的益生菌喷雾干燥菌粉提供理论依据和技术指导。
[1] YANG H, HUANG P, HAO L Y, et al.Enhancing viability of dried lactic acid bacteria prepared by freeze drying and spray drying via heat preadaptation[J].Food Microbiology, 2023, 112:104239.
[2] ZHU Z, LUAN C G, ZHANG H X, et al. Effects of spray drying on Lactobacillus plantarum Bm-1 viability, resistance to simulated gastrointestinal digestion, and storage stability[J]. Drying Technology, 2016, 34 (2): 177-184.
[3] PERDANA J, FOX M B, CHEN S W, et al.Interactions between formulation and spray drying conditions related to survival of Lactobacillus plantarum WCFS1[J].Food Research International, 2014, 56:9-17.
[4] ANANTA E, VOLKERT M, KNORR D.Cellular injuries and storage stability of spray-dried Lactobacillus rhamnosus GG[J].International Dairy Journal, 2005, 15(4):399-409.
[5] LEE J, KALETUNÇ G.Evaluation of the heat inactivation of Escherichia coli and Lactobacillus plantarum by differential scanning calorimetry[J].Applied and Environmental Microbiology, 2002, 68(11):5379-5386.
[6] BIELECKA M, MAJKOWSKA A.Effect of spray drying temperature of yoghurt on the survival of starter cultures, moisture content and sensoric properties of yoghurt powder[J].Food /Nahrung, 2000, 44(4):257-260.
[7] JIANG X Y, SHEKARFOROUSH E, MUHAMMED M K, et al.Probing surface properties of lactic acid bacteria - Comparative modification by anhydride and aldehyde grafting[J].Surfaces and Interfaces, 2023, 38:102848.
[8] 黄先敏. 天麻速溶茶的工艺流程及配方研究[J].昭通学院学报, 2022, 44(5):49-51.HUANG X M.The study on the technological process and formula of Gastrodia elata BL instant tea[J].Journal of Zhaotong University, 2022, 44(5):49-51.
[9] 刘斌. 喷雾干燥过程中益生菌菌活变化与细胞膜损伤历程研究[D].苏州:苏州大学, 2017.LIU B.Study on the changes of probiotic bacteria activity and the process of cell membrane damage during spray drying[D].Suzhou:Soochow University, 2017.
[10] 盛琪, 佴逸凡, 赵伟, 等.乳状液粒径对微胶囊储藏稳定性的影响[J].食品研究与开发, 2023, 44 (9):91-96.SHENG Q, MI Y F, ZHAO W, et al.Effect of emulsion particle size on storage stability of microcapsules[J].Food Research and Development, 2023, 44 (9):91-96.
[11] 张瑞华, 刘鹭, 逄晓阳, 等.喷雾干燥温度对酪蛋白胶束粉理化性质及微观结构的影响[J].中国食品学报, 2019, 19(10):126-132.ZHANG R H, LIU L, PANG X Y, et al.Effect of spray drying temperature on the physicochemical properties and microstructure of micellar casein powder[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(10):126-132.
[12] WANG W Q, ZHANG J L, YU Q, et al.Structural and compositional changes of whey protein and blueberry juice fermented using Lactobacillus plantarum or Lactobacillus casei during fermentation[J].RSC Advances, 2021, 11(42):26291-26302.
[13] JIANG J Y, MA C, SONG X N, et al.Spray drying co-encapsulation of lactic acid bacteria and lipids:A review[J].Trends in Food Science &Technology, 2022, 129:134-143.
[14] WANG N, FU N, CHEN X D.The extent and mechanism of the effect of protectant material in the production of active lactic acid bacteria powder using spray drying:A review[J].Current Opinion in Food Science, 2022, 44:100807.
[15] WANG W Q, SHENG H B, ZHOU J Y, et al.The effect of a variable initial pH on the structure and rheological properties of whey protein and monosaccharide gelation via the Maillard reaction[J].International Dairy Journal, 2021, 113:104896.
[16] WANG W Q, YUAN P P, ZHOU J Y, et al.Effect of temperature and pH on the gelation, rheology, texture, and structural properties of whey protein and sugar gels based on Maillard reaction[J].Journal of Food Science, 2021, 86(4):1228-1242.