驼乳是一种特色动物乳,具有丰富的营养物质和生物活性因子,近年来越来越受消费者喜爱。驼乳的蛋白质和脂肪含量高,含有多种维生素及钙、铁、锌、磷等矿物质,可为人体提供所需的营养物质。不同于牛乳,驼乳不含β-乳球蛋白,具有较高的β-酪蛋白相对含量和较小的乳脂肪球直径、以及较多的乳铁蛋白等活性成分,且驼乳更易被人体消化吸收[1-2],适用于婴幼儿配方奶粉的生产。
在乳品加工行业,通常采用热处理杀菌以保证产品质量和微生物安全。驼乳中的大多数活性成分热敏性高,热处理杀菌会对乳中的活性成分包括活性蛋白[如免疫球蛋白G(immunoglobulins,IgG)、乳铁蛋白]、抗菌酶(如乳过氧化物酶、多胺氧化酶)、活性肽(如胰岛素)等造成破坏[3],导致驼乳诸多健康功效的损失[4]。为了保护这些生物活性成分,非热除菌工艺的使用尤为重要。微滤是一种有效的非热除菌技术[5],其基于乳中各组分粒径大小的不同,通过选择性物理截留手段来实现细菌、芽胞和体细胞的去除,能保持乳中的营养成分和生物活性物质,提升驼乳品质和保质期。
目前,关于脱脂乳的热处理杀菌和微滤除菌技术的研究,主要集中在微生物的去除效率及对具有生物活性的蛋白和酶的保留上,较少关注热处理杀菌和微滤除菌对乳消化性的影响。另外,乳中活性蛋白(如IgG)、活性肽(如胰岛素)等活性成分生理活性的发挥往往需要其在胃肠道中抗消化,即能保持完整的分子结构,如具有完整结构的免疫球蛋白可在幼体肠道内结合抗原形成复合物,保护机体免受抗原侵害,也可被吸收进入血液中进一步发挥保护作用[6]。因此,研究活性成分在胃肠道消化过程中的变化对高活性驼乳制品的开发具有重要意义。本研究以鲜驼乳为原料,经碟式离心获得脱脂驼乳,对脱脂乳分别进行巴氏杀菌和微滤除菌,将不同处理方法获得的脱脂乳分别进行婴幼儿体外模拟胃肠消化,采用激光共聚焦显微镜、SDS-PAGE、高效液相体积排阻色谱、ELISA等手段,比较巴氏杀菌和微滤除菌对脱脂驼乳消化性的影响,为高活性驼乳制品的加工提供理论依据,促进驼乳应用于婴配奶粉的生产。
1 材料与方法
1.1 材料与试剂
双峰驼乳,内蒙古阿拉善左旗地区;胃蛋白酶(P6887)、胰蛋白酶(T1426)、胆汁盐、胃酶抑制素A、苯甲磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、邻苯二甲醛(O-phthaldialdehyde,OPA),美国Sigma公司;IGG-16驼乳IgG ELISA试剂盒,美国Life Diagnostics公司;DE2935胰岛素ELISA试剂盒,德国Demeditec公司。
1.2 仪器与设备
NRSDR10A碟片式乳脂分离机,宜兴海德分离机械有限公司;HP-20T管式杀菌机,上海浩朋机电科技有限公司;GCM-03陶瓷膜分离系统,国初科技(厦门)有限公司;1.4 μm孔径陶瓷膜,法国Tami公司;LSM-880激光共聚焦扫描显微镜,蔡司光学仪器(上海)国际贸易有限公司;TSKgel 2000SWXL(300 mm×7.8 mm)体积排阻色谱柱,日本TOSOH公司。
1.3 实验方法
1.3.1 驼乳的脱脂和除菌处理
驼乳脱脂:将生驼乳预热至45 ℃后,采用碟片式离心机于45 ℃、9 000 r/min转速下进行脱脂,收集脱脂乳,即得脱脂生乳,采用GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中第三法—碱水解法进行测定,其脂肪含量<0.1%(质量分数)。
脱脂乳微滤除菌:采用孔径为1.4 μm、膜面积为0.16 m2的陶瓷膜对脱脂生乳进行微滤处理,操作温度为45 ℃,跨膜压力差为75 kPa,过滤后即得微滤乳。
脱脂乳巴氏杀菌:采用72 ℃、15 s的巴氏杀菌工艺对脱脂生乳进行热处理,即得巴氏杀菌乳。
1.3.2 婴幼儿体外模拟胃肠消化
参考DUPONT等[7]的婴幼儿体外消化模型,配置模拟胃液,含94 mmol/L NaCl溶液、13 mmol/L KCl溶液、724.3 U/mL胃蛋白酶,调整pH值至5.3。乳样品在37 ℃条件下平衡2~3 min,与模拟胃液以体积比63∶37混合,复调pH值至5.3,取样时间点为0、1、5、10、30 min和60 min,加入胃酶抑制素A(7.3 μmol/L)以终止反应。胃消化结束,将余下的胃消化物与模拟肠液(42.1 U/mL胰蛋白酶、8.2 mmol/L胆汁、10 mmol/L KCl、249 mmol/L NaCl、pH 6.6)按照体积比62∶38混合,取样时间点为0、2、5、10、30 min和60 min,加入5.0 mmol/L PMSF溶液以终止反应。
1.3.3 胃絮凝物结构观测
参考罗桂心[8]的方法,采用激光共聚焦显微镜观测胃消化物中絮凝物结构。取200 μL胃消化物与2 μL 0.2 mg/mL FITC溶液混合,置于玻底培养皿中。激发波长设置为488 nm,发射波长为498~532 nm,选用10倍物镜。取胃消化1 min时的消化物,于100×g离心5 min,收集沉淀,于105 ℃烘干6 h,称量并计算沉淀的含水量,即为絮凝物的持水量。
1.3.4 蛋白降解率测定
参考LAEMMLI[9]的方法,采用SDS-PAGE测定蛋白降解率,浓缩胶和分离胶浓度分别为4%和12%(均为质量分数)。将消化物稀释至蛋白质量浓度为2 mg/mL,与含β-巯基乙醇的样品缓冲液混合,沸水浴3 min,上样量10 μL。采用考马斯亮蓝R-250染色,采用5%甲醇和7.5%冰醋酸(均为体积分数)混合溶液脱色。采用Image Lab 3.0软件对电泳条带进行半定量分析,即对各泳道中完整蛋白条带的灰度值进行测定,消化过程中完整蛋白条带灰度值占消化前对应完整蛋白条带灰度值的比例,即为蛋白残留率。
1.3.5 游离氨基含量测定
参考BAVARO等[10]的方法,取消化物与62 g/L三氯乙酸溶液等体积混合,于10 000×g离心30 min,收集上清液。取胃消化物所得前述离心上清液,加水稀释4倍;取肠消化物所得前述离心上清液,加水稀释8倍。取0.15 mL稀释液与3 mL OPA溶液混合,避光反应15 min,于340 nm波长处测定吸光度。采用0~3 mmol/L的亮氨酸溶液作为标品。
1.3.6 蛋白水解物分子质量分布测定
参考李志宾[11]的方法,将消化物稀释至蛋白质量浓度为2 mg/mL,与8 mol/L尿素溶液等体积混合,采用0.45 μm尼龙膜过滤。采用TSKgel 2000SWXL色谱柱,流动相含乙腈、水和三氟乙酸,体积比为40∶60∶0.1,上样量50 μL,检测波长220 nm。采用的分子质量标准品为细胞色素C(12 384 Da)、杆菌肽(1 422 Da)、Gly-Gly-Tyr-Arg(451 Da)和Gly-Gly-Gly(189 Da)。
1.3.7 IgG含量测定
采用IGG-16 ELISA试剂盒,根据试剂盒说明书的要求处理样品,于450 nm波长下测量吸光度值。
1.3.8 胰岛素效价测定
采用DE2935 ELISA试剂盒,根据试剂盒说明书的要求处理样品,于450 nm波长下测量吸光度值。
1.4 数据分析
采用SPSS 20.0软件对数据进行统计分析,采用Duncan检验,P<0.05表示差异显著。
2 结果与分析
2.1 胃消化过程中絮凝物结构的变化
前期研究发现脱脂生驼乳经微滤除菌处理后,细菌总数和大肠菌群数均达到与巴氏杀菌相同的去除率,芽胞数和体细胞数降至不可被检出,而巴氏杀菌对芽胞数和体细胞数均无显著影响[12]。将不同除菌方式获得的脱脂驼乳进行体外婴幼儿模拟胃液消化,在模拟胃液中不同除菌处理的驼乳均形成了疏松的絮凝物,并且随着消化时间的延长,酪蛋白逐渐被胃蛋白酶水解,絮凝物的颗粒尺寸逐渐减小,絮凝物的量逐渐变少(图1)。驼乳在与婴幼儿模拟胃液混合后,体系的pH值降低至5.3,接近酪蛋白的等电点,使酪蛋白胶束所携带的负电荷不足以维持胶束在体系中的稳定。此外,胃蛋白酶水解了位于胶束表面的κ-酪蛋白,使维持胶束空间位阻的表面毛发层结构遭到破坏,导致酪蛋白胶束聚集形成了网络结构。袁佳洁[13]发现牛乳酪蛋白溶液在成人模拟胃液中形成大且坚硬的凝块,而羊乳酪蛋白溶液在成人模拟胃液中形成疏松的絮凝结构,这可能是由于羊乳比牛乳酪蛋白具有更高的β-酪蛋白相对含量[8]。在乳中,β-酪蛋白通常被认为是易于消化的。驼乳含有更高的β-酪蛋白含量,占总酪蛋白的67%,与人乳酪蛋白中β-酪蛋白的占比非常接近,因此相对于牛乳和羊乳,其在胃液中更难絮凝[14]。
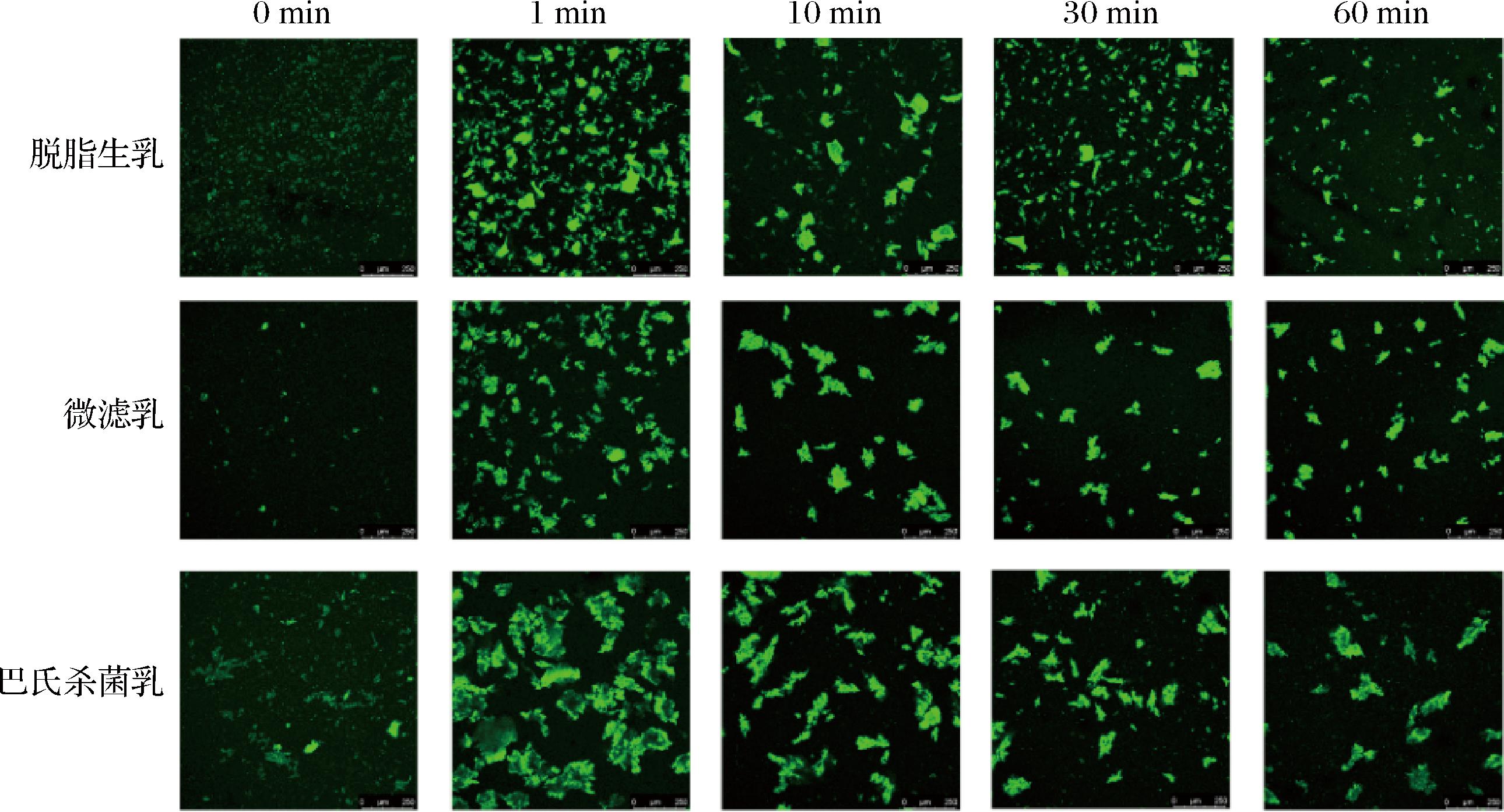
图1 不同处理脱脂驼乳胃絮凝物的结构
Fig.1 Structure of gastric clots of camel skim milk after different treatments
不同除菌处理的驼乳在体外模拟婴幼儿胃消化阶段的整体絮凝情况不同,絮凝物的尺寸由小到大的顺序基本为脱脂生乳<微滤乳<巴氏杀菌乳。在消化反应1 min时,巴氏杀菌乳形成了较大尺寸的絮凝,而脱脂生乳和微滤乳形成了中等尺寸的絮凝。在消化中期(30 min)时,脱脂生乳和微滤乳形成的絮凝尺寸减小,而巴氏杀菌乳仍存在大量较大的絮凝颗粒。到了消化末期(60 min),脱脂生乳的絮凝颗粒几乎消失,表明酪蛋白被消化成小分子的肽段。相比脱脂生乳,微滤乳在胃消化前期和中期具有相似的絮凝表现,而在胃消化后期仍残留部分的絮凝颗粒。巴氏杀菌乳在整个消化阶段始终保持着较大的絮凝颗粒,这可能是因为加热导致了乳中酪蛋白水解抗性的提高[15]。BARBÉ等[16]发现,90 ℃加热5 min会导致脱脂乳在小猪胃中的保留时间更长,这可能与蛋白质的化学修饰有关,包括乳糖基化、以及酪蛋白-乳清相互作用,导致消化过程絮凝物结构不同,从而影响胃排空时间。
不同除菌处理驼乳的胃消化物中絮凝物的持水量如图2所示。持水量的多少反映了絮凝结构的松散程度,持水量高的凝块具有质软、疏松的结构。其中微滤乳的持水量和脱脂生乳的持水量接近,巴氏杀菌乳的持水量显著低于微滤乳和脱脂生乳。
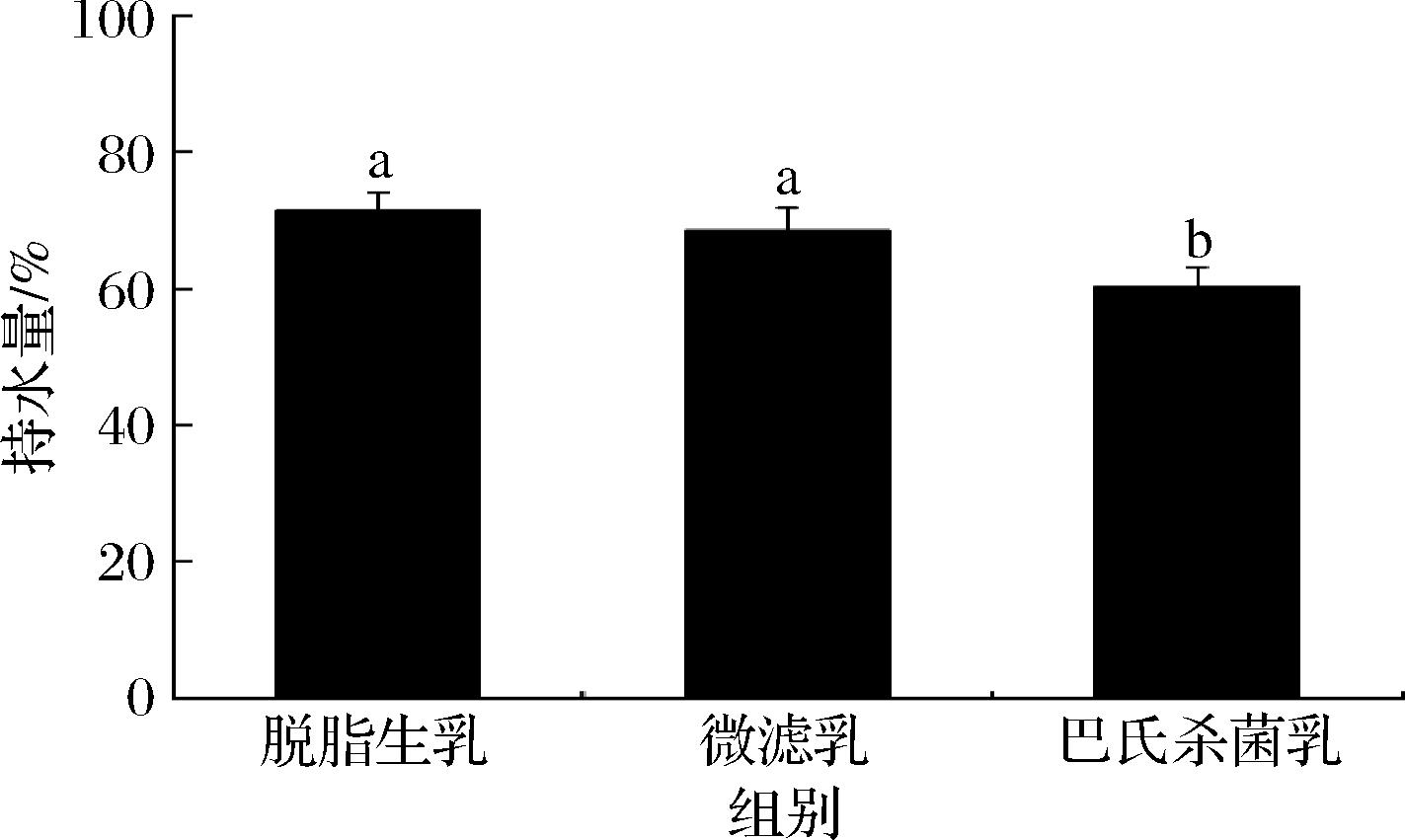
图2 不同处理脱脂驼乳胃絮凝物的持水量
Fig.2 Moisture content of gastric clots of camel skim milk after different treatments
注:不同字母代表组间均值在P<0.05水平上具有显著性差异。
2.2 胃肠消化过程中蛋白的降解
如图3所示,在胃消化阶段,不同除菌处理的驼乳对应于酪蛋白区域的条带强度均随消化时间的延长逐渐减弱,与此同时,在酪蛋白条带的下方出现了多条新的条带,并且这些条带随消化时间逐渐下移,表明胃蛋白酶对酪蛋白的逐步水解,形成了较小分子质量的多肽;对应于α-乳白蛋白的条带强度没有明显的变化。脱脂生乳与婴幼儿模拟胃液混合0~10 min时酪蛋白对应的条带强度迅速减弱,在消化10~30 min时酪蛋白的降解速度减慢,直到消化60 min时对应酪蛋白的条带几乎消失。酪蛋白条带半定量分析结果表明(图4),微滤乳中酪蛋白在婴幼儿模拟胃液中的降解情况与脱脂生乳接近,而巴氏杀菌降低了驼乳酪蛋白在婴幼儿模拟胃液中的消化速率,提高了消化终点的蛋白保留率,这与不同除菌处理驼乳的絮凝情况能很好的对应(图1)。
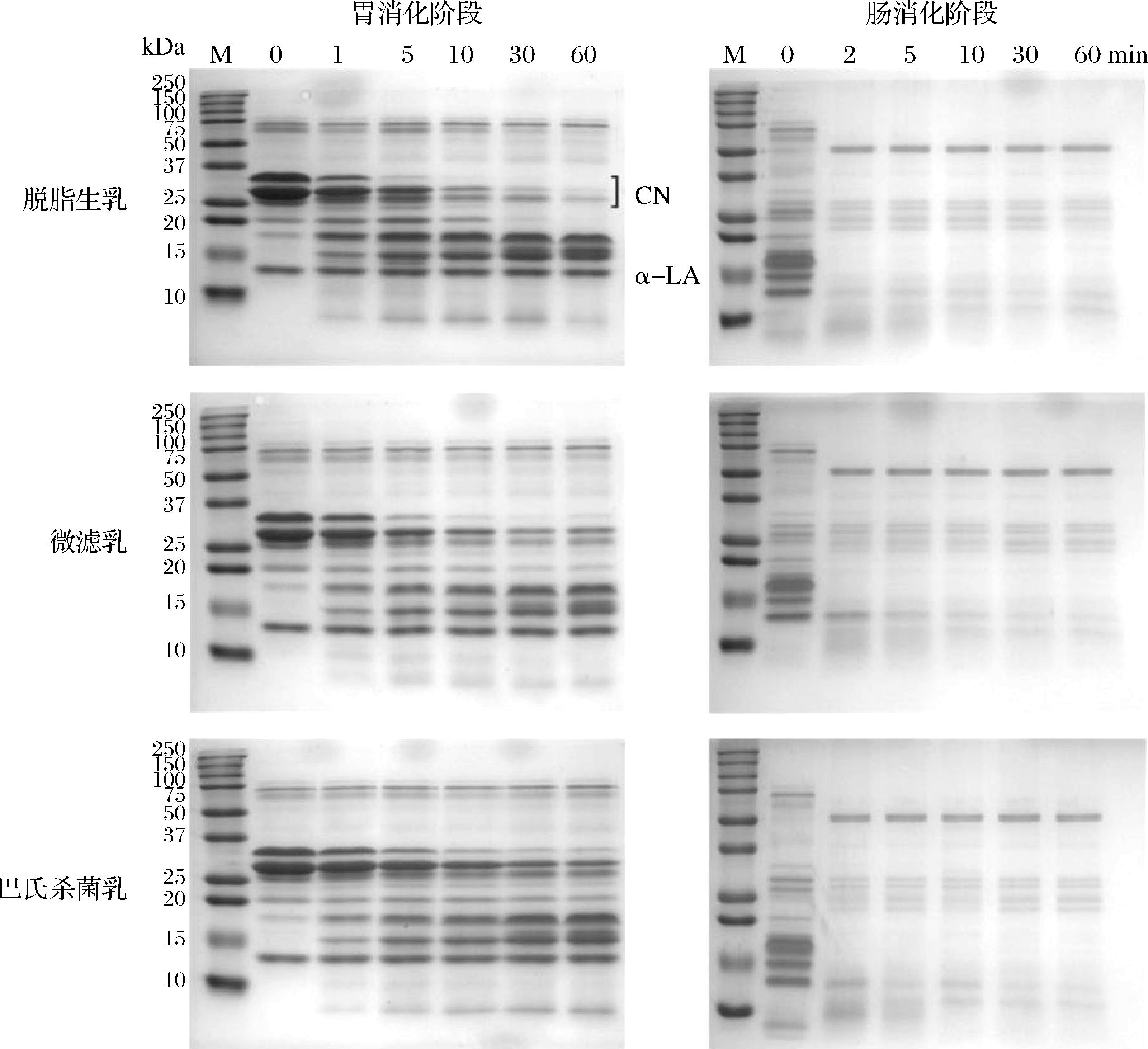
M-蛋白标品;CN-酪蛋白;α-LA-α-乳白蛋白。
图3 不同处理脱脂驼乳胃肠道消化物的SDS-PAGE图
Fig.3 SDS-PAGE patterns of gastric and intestinal digesta of camel skim milk after different treatments
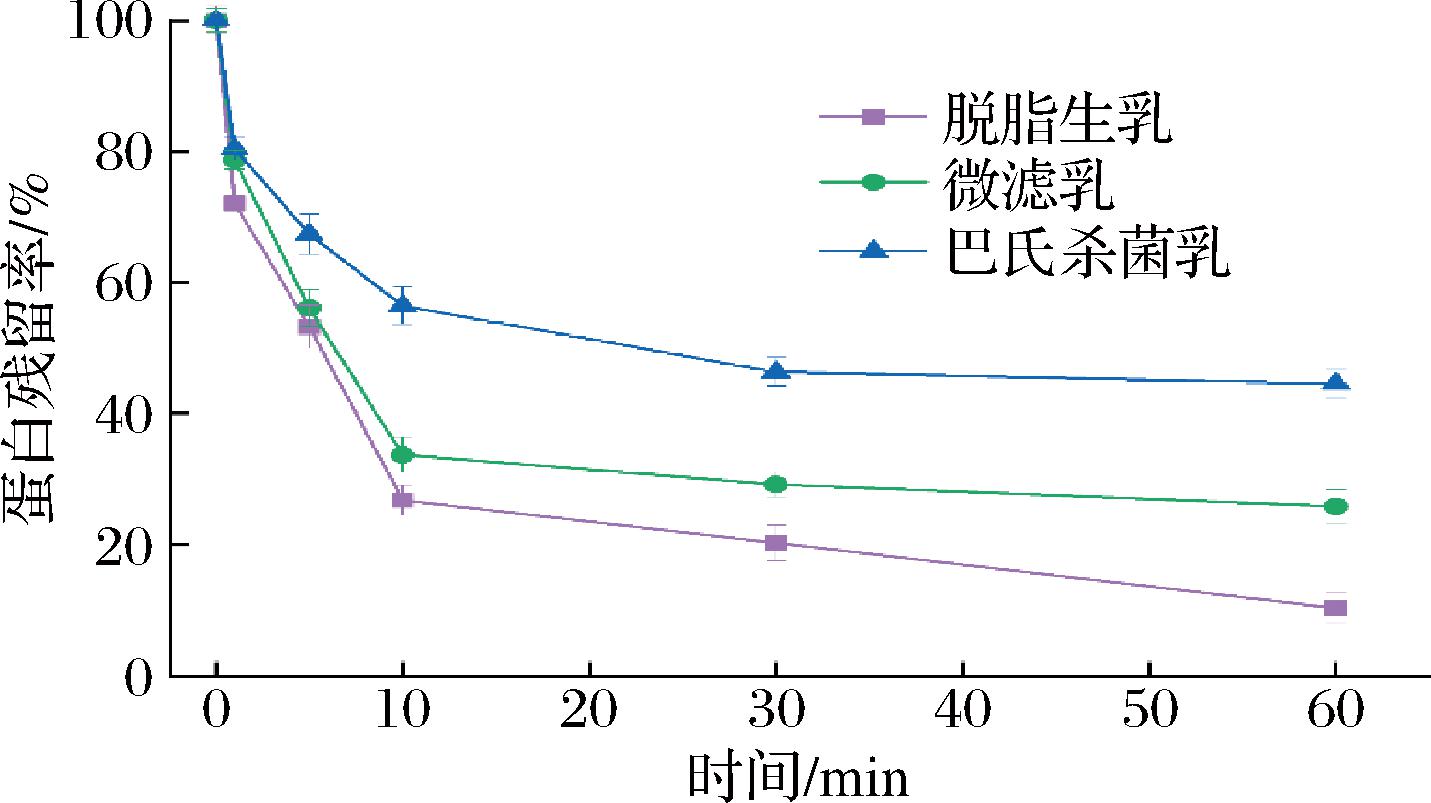
图4 不同处理脱脂驼乳胃消化物中完整酪蛋白的残留率
Fig.4 Percentages of remaining intact caseins in gastric digesta of camel skim milk after different treatments
在肠消化阶段,微滤乳和巴氏杀菌乳经胃消化后残留的部分酪蛋白在与肠液接触2 min时酪蛋白对应的条带完全消失,表明胰蛋白酶可以迅速水解驼乳酪蛋白;脱脂生乳的α-乳白蛋白在与肠液接触2 min时对应的条带完全消失,而微滤乳和巴氏杀菌乳中的α-乳白蛋白在与肠液接触2 min时对应的条带仍肉眼可见,直至5 min时完全消失。SMITS等[17]利用反相液相色谱法发现鲜驼乳和喷雾干燥驼乳粉的复溶液在体外模拟胃肠液中具有相同的水解情况:驼乳酪蛋白在胃消化阶段完全被水解,而乳清蛋白在胃消化阶段几乎不水解,但在肠消化2 min内完全水解,这与本文的研究结果相一致。
2.3 胃肠消化过程中游离氨基的生成
蛋白在水解过程中肽键的断裂会导致α-氨基的释放,因此利用OPA法测量游离氨基的相对量可以量化蛋白质的降解程度。如图5所示,在胃消化阶段,不同除菌处理的驼乳在消化过程中释放的游离氨基量随着消化时间的增加而逐渐增加,而游离氨基的释放速率逐渐变小。在胃消化初期(0~10 min),微滤乳的消化速率与脱脂生乳接近,而巴氏杀菌乳的消化速率相对较低,表明热处理后脱脂驼乳中的蛋白更难被胃蛋白酶水解,这与巴氏杀菌乳具有更大的胃絮凝(图1)及较高的蛋白残留率(图4)结果相一致。如图5所示,在胃消化结束(60 min)时,微滤乳所释放的游离氨基与脱脂生乳接近,而巴氏杀菌乳释放的游离氨基低于微滤乳和脱脂生乳。在肠消化阶段,不同除菌处理的驼乳蛋白均能在2 min内被胰蛋白酶迅速水解,并具有相似的游离氨基释放量。
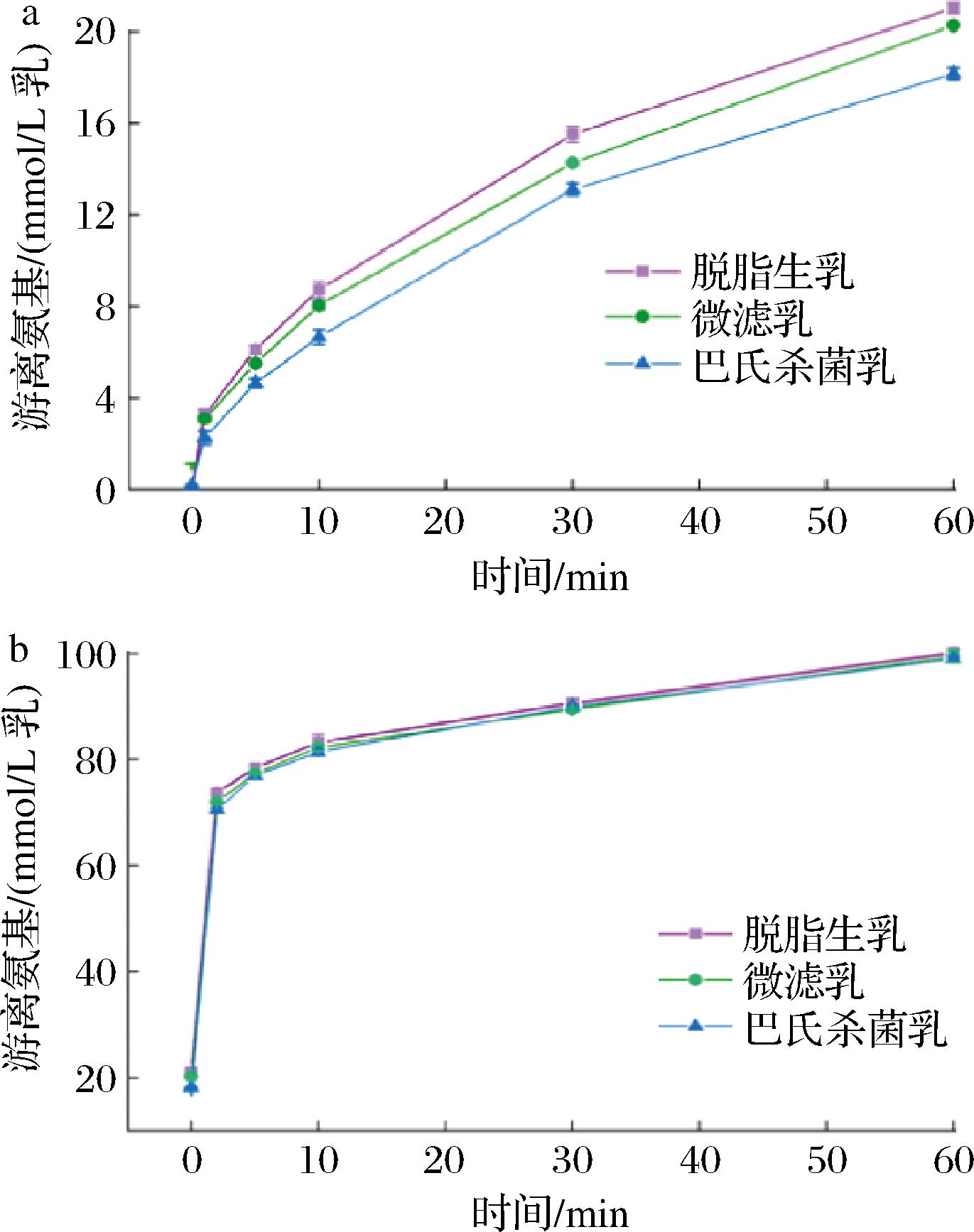
a-胃消化;b-肠消化
图5 不同处理脱脂驼乳胃肠消化物中游离氨基的含量
Fig.5 Amounts of free amino groups in gastric and intestinal digesta of camel skim milk after different treatments
2.4 胃肠消化过程中蛋白水解物分子的质量分布
脱脂生乳、微滤乳、巴氏杀菌乳在体外模拟婴幼儿胃消化结束(60 min)和肠消化结束(60 min)时的蛋白水解物分子质量分布如图6所示。根据蛋白水解物相对丰度,将胃消化产生蛋白水解物的分子质量划分为<1 kDa、1~5 kDa、5~10 kDa和>10 kDa这4个范围。在胃消化结束(60 min)时,不同除菌处理驼乳的蛋白水解物主要集中在1~5 kDa(占比29.1%~42.1%)和>10 kDa(占比31.8%~40.2%)的范围内,其次是在5~10 kDa的范围。经胃消化的微滤乳在<5 kDa范围的蛋白水解物占比与脱脂生乳相接近,而巴氏杀菌乳在<5 kDa范围的蛋白水解物占比更低,表明巴氏杀菌导致了驼乳蛋白在婴幼儿胃液中消化性的降低。在肠消化结束(60 min)时,不同除菌处理驼乳的蛋白水解物主要集中在<0.5 kDa的范围内(占比78.3%~81.5%),且具有相似的蛋白水解物分子质量分布,表明胰蛋白酶可以对胃消化后的蛋白水解物进行快速水解,这与肠阶段的游离氨基释放结果相一致(图5)。
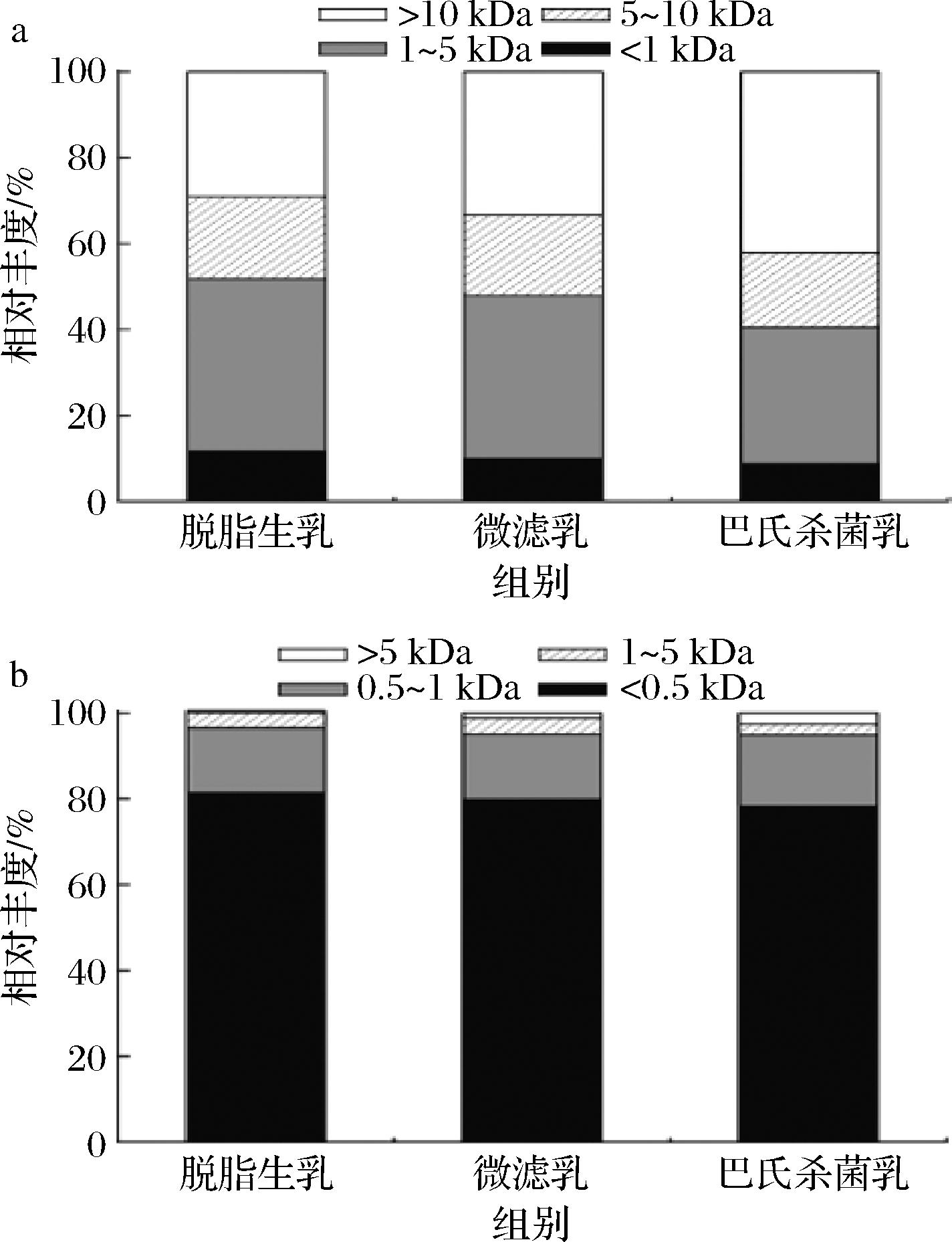
a-胃消化;b-肠消化
图6 不同处理脱脂驼乳胃肠道消化物中蛋白水解物的分子质量分布
Fig.6 Molecular weight distribution of protein hydrolysate in gastric and intestinal digesta of camel skim milk after different treatments
2.5 胃肠消化过程中IgG含量的变化
IgG是驼乳中最主要的免疫蛋白,为新生骆驼提供了针对外源感染的被动免疫保护[18]。免疫球蛋白不耐热,75 ℃下加热5 min会导致可检测的IgG含量减少40%,95 ℃下加热15 s会导致IgG不能被检出,巴氏杀菌的商业乳通常可以保留生乳中25%~75%的IgG[19-20]。免疫球蛋白与其他乳蛋白相比对胃肠消化的抵抗能力相对更强,其中IgG是肠道消化中最慢的乳清蛋白之一[20]。
如图7-a所示,脱脂生乳的IgG质量浓度为269.3 mg/L;微滤乳的IgG浓度与脱脂生乳相似,为265.9 mg/L;巴氏杀菌乳的IgG质量浓度明显下调,为226.1 mg/L。这表明微滤能更好的保留驼乳中的IgG,而72 ℃下15 s的巴氏杀菌会损失驼乳中16%的IgG。在胃消化60 min时,脱脂生乳和微滤乳中IgG质量浓度分别下降至238.3 mg/L和232.1 mg/L,而巴氏杀菌乳IgG质量浓度下降至180.2 mg/L。在肠消化阶段(图7-b),不同除菌处理驼乳中的Ig G在消化前10 min内水解迅速,之后水解速率大幅度降低,肠消化结束时,仍有135.6~154.9 mg/L的IgG保留,表明IgG耐消化,可利于其生理活性的发挥。
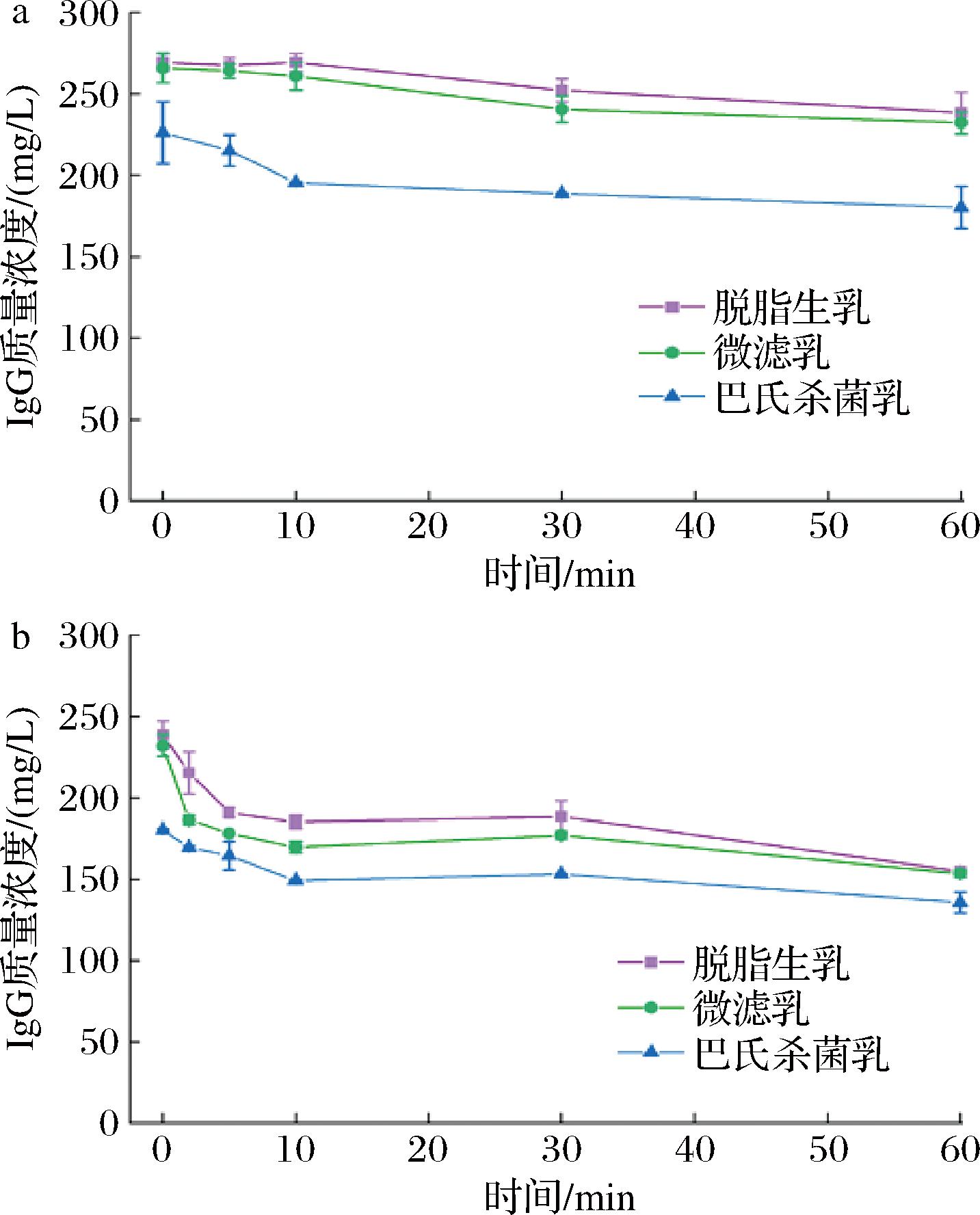
a-胃消化;b-肠消化
图7 不同处理脱脂驼乳胃肠消化物中IgG的含量
Fig.7 Amounts of IgG in gastric and intestinal digesta of camel skim milk after different treatments
2.6 胃消化过程中胰岛素效价的变化
大量研究表明,驼乳能降低血糖,降低胰岛素抵抗,改善血脂,对糖尿病患者有益,这可能是由于驼乳含有更高浓度的胰岛素,约为牛乳的3倍[21]。如图8所示,不同除菌处理驼乳含有的胰岛素效价相接近。在胃消化阶段前期(0~10 min),微滤乳的胰岛素效价下降速率与脱脂生乳相接近,而巴氏杀菌乳的胰岛素效价下降速率更快,表明巴氏杀菌加快了驼乳中胰岛素在模拟婴幼儿胃液中的水解速率,可能是因为热处理后胰岛素结构展开导致了其对胃蛋白酶的抵抗力下降。在胃消化30 min时,不同除菌处理驼乳中的胰岛素效价下降速率均明显减慢。在胃消化结束(60 min)时,不同除菌处理驼乳中的胰岛素效价均降至较低值,仅有7.4%~19.0% 胰岛素保留,表明胰岛素难以抵抗胃蛋白酶的水解。ABOU-SOLIMAN等[22]研究了胃蛋白酶和胰酶对驼乳胰岛素效价的影响,发现30 min的胃消化即可使胰岛素完全失活,与本文结果一致。
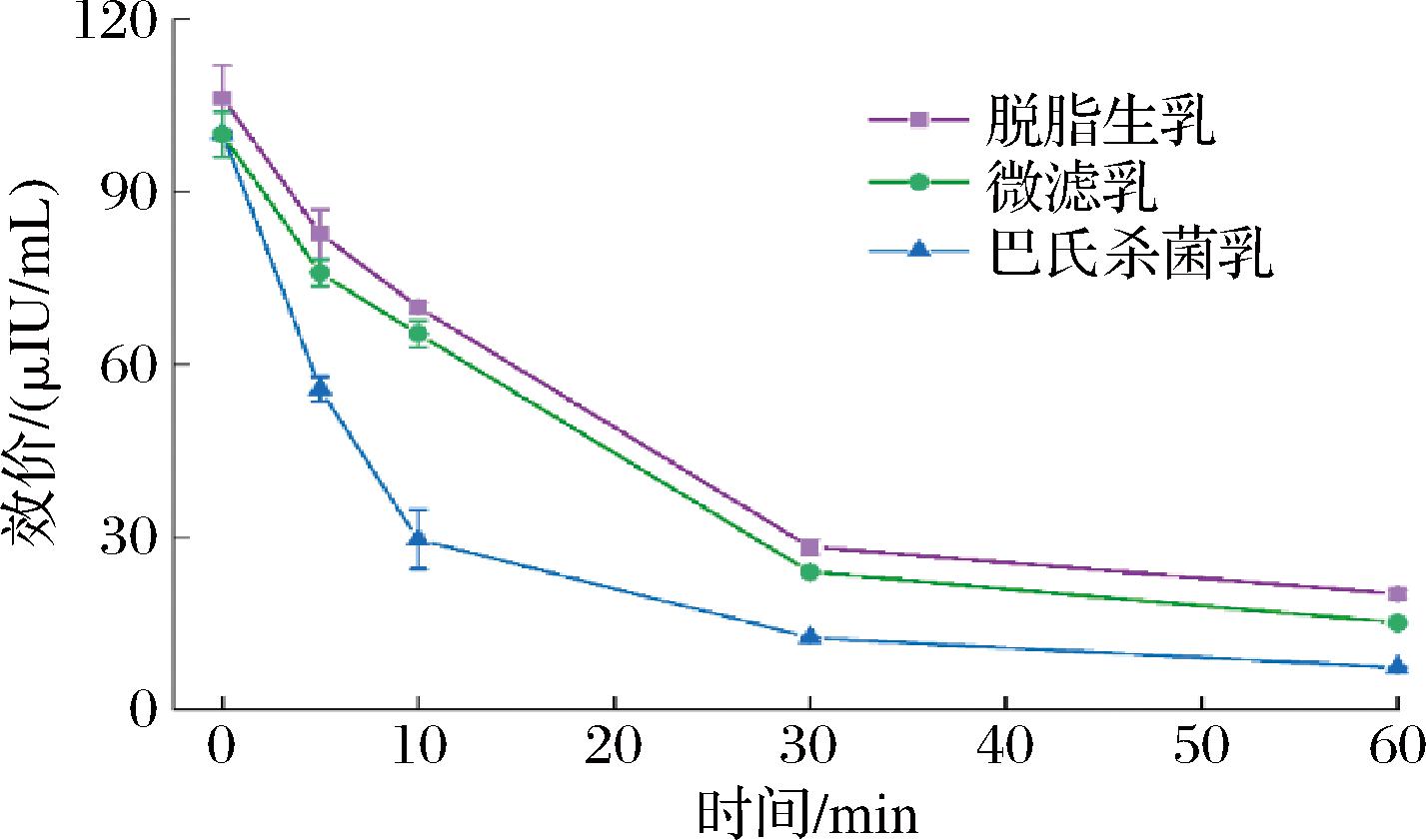
图8 不同处理脱脂驼乳胃消化物中胰岛素的效价
Fig.8 The titer of insulin in gastric digesta of camel skim milk after different treatments
3 结论与讨论
采用婴幼儿体外胃肠道消化模型,比较了脱脂生驼乳、微滤驼乳和巴氏杀菌驼乳消化性的差异。微滤乳与脱脂生乳在胃消化过程中具有更接近的絮凝物结构和持水量、酪蛋白残留率、游离氨基释放量和蛋白水解物分子质量分布。巴氏杀菌则导致脱脂驼乳在模拟胃液中形成了更大、更致密的絮凝物,阻碍酪蛋白的水解、游离氨基的释放以及更小分子质量多肽的生成。此外,微滤更大程度地保留了脱脂驼乳中的IgG,且使IgG和胰岛素在消化过程中的保留更多。本研究揭示了不同除菌工艺对驼乳消化性的影响,可为高活性驼乳制品的生产提供理论依据。
[1] KASKOUS S, PFAFFL M W.Bioactive properties of minor camel milk ingredients-an overview[J].Journal of Camel Practice and Research, 2017, 24(1):15.
[2] 豆智华, 杨迎春, 姚怀兵, 等.牛乳和驼乳中酪蛋白的差异蛋白组学分析[J].中国乳品工业, 2022, 50(7):15-18.DOU Z H, YANG Y C, YAO H B, et al.Differential proteomic analysis of casein in bovine milk and camel milk[J].China Dairy Industry, 2022, 50(7):15-18.
[3] BORAD S G, SINGH A K, KAPILA S, et al.Influence of unit operations on immunoglobulins and thermal stability of colostrum fractions[J].International Dairy Journal, 2019, 93:85-91.
[4] 郭银萍, 赵晓璇, 姚萍, 等.热处理对羊乳和骆驼乳中美拉德反应产物和挥发性风味物质的影响[J].中国乳品工业, 2023, 51(9):4-9.GUO Y P, ZHAO X X, YAO P, et al.Effect of heat treatment on Maillard products and volatile flavor substances in goat milk and camel milk[J].China Dairy Industry, 2023, 51(9):4-9.
[5] GOSCH T, APPRICH S, KNEIFEL W, et al.Improved isolation of bioactive components of bovine colostrum using cross-flow microfiltration[J].International Journal of Dairy Technology, 2013, 66(2):175-181.
[6] ZHENG W, ZHAO W J, WU M, et al.Microbiota-targeted maternal antibodies protect neonates from enteric infection[J].Nature, 2020, 577(7791):543-548.
[7] DUPONT D, MANDALARI G, MOLLE D, et al.Comparative resistance of food proteins to adult and infant in vitro digestion models[J].Molecular Nutrition &Food Research, 2010, 54(6):767-780.
[8] 罗桂心. 山羊乳酪蛋白组分的分离及消化性研究[D].无锡:江南大学, 2023.LUO G X.Study on fractionation and digestibility of caprine casein fractions[D].Wuxi:Jiangnan University, 2023.
[9] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227(5259):680-685.
[10] BAVARO S L, MAMONE G, PICARIELLO G, et al.Thermal or membrane processing for infant milk formula:Effects on protein digestion and integrity of the intestinal barrier[J].Food Chemistry, 2021, 347:129019.
[11] 李志宾. 牛乳活性乳清蛋白及酪蛋白胶束的膜分离制备研究[D].无锡:江南大学, 2022.LI Z B.Membrane-based fractionation and manufacture of bovinemilk bioative serum proteins and casein micelles[D].Wuxi:Jiangnan University, 2022.
[12] 刘羿飞, 彭小雨, 潘丽娜, 等.不同除菌处理对脱脂驼乳与稀奶油中活性蛋白质的影响[J].食品与生物技术学报, 2024, 43(5):72-80.LIU Y F, PENG X Y, PAN L N, et al.Effects of different sterilization treatments on bioactive proteins in camel skim milk and cream[J].Journal of Food Science and Biotechnology, 2024, 43(5):72-80.
[13] 袁佳洁. 羊乳胶束态酪蛋白热诱导稳定性和消化性的研究[D].无锡:江南大学, 2023.YUAN J J.The research of heat-induced stability and digestibility of caprine micellar caseins[D].Wuxi:Jiangnan University, 2023.
[14] 刘雪风. 驼乳酪蛋白胶束结构及其稳定性研究[D].呼和浩特:内蒙古农业大学, 2023.LIU X F.Study on the structure and stability of camel casein micelles[D].Hohhot:Inner Mongolia Agricultural University, 2023.
[15] MULET-CABERO A I, MACKIE A R, WILDE P J, et al.Structural mechanism and kinetics of in vitro gastric digestion are affected by process-induced changes in bovine milk[J].Food Hydrocolloids, 2019, 86:172-183.
[16] BARBÉ F, MÉNARD O, LE GOUAR Y, et al.The heat treatment and the gelation are strong determinants of the kinetics of milk proteins digestion and of the peripheral availability of amino acids[J].Food Chemistry, 2013, 136(3-4):1203-1212.
[17] SMITS M, HUPPERTZ T, ALTING A, et al.Composition, constituents and properties of Dutch camel milk[J].Journal of Camel Practice and Research, 2011, 18:1-6.
[18] ALAVI F, SALAMI M, EMAM-DJOMEH Z, et al.Nutraceutical Properties of Camel Milk[M].Amsterdam:Elsevier, 2017.
[19] CHEN C-C, CHANG H M.Effect of thermal protectants on the stability of bovine milk immunoglobulin G[J].Journal of Agricultural and Food Chemistry, 1998, 46(9):3570-3576.
[20] HURLEY W L, THEIL P K.Perspectives on immunoglobulins in colostrum and milk[J].Nutrients, 2011, 3(4):442-474.
[21] MIRMIRAN P, EJTAHED H S, ANGOORANI P, et al.Camel milk has beneficial effects on diabetes mellitus:A systematic review[J].International Journal of Endocrinology and Metabolism, 2017, 15(2):e42150.
[22] ABOU-SOLIMAN N H I, AWAD S, DESOUKY M M.Effect of digestive enzymes on the activity of camel-milk insulin[J].International Journal of Dairy Technology, 2020, 73(2):341-344.