再制干酪是近年来迅速发展的乳制品,其制备过程包括在反应容器中混合天然干酪、水、乳化盐以及其他必要成分,并经过65~140 ℃的加热、搅拌剪切以及乳化等多道工序加工而成[1]。通常,干酪中含有20%~30%的蛋白质,每100 g干酪可提供人体膳食所需蛋白质的30%~50%[2]。相较于天然干酪,再制干酪具有更长的货架期和更丰富的风味,因此受到消费者的青睐。在全球乳制品行业中,再制干酪是一种非常重要的乳制品,其中欧盟国家(荷兰、德国等)是全球最大的干酪出口国,但是发展中国家对于再制干酪的生产仍处于起步阶段,因此对再制干酪的研究尤为迫切[3-4]。再制干酪的生产工艺多样,制作过程中各种成分可能对其品质产生积极或消极的影响[5],进而影响消费者的感官体验。因此,在生产过程中了解每种成分的作用和功能对再制干酪的品质和质量提升具有重要意义。
干酪制作过程中,乳化是最关键的步骤之一,其主要目的是使脂肪分布更均匀,形成更稳定的产品[6]。乳化程度不足会导致再制干酪的质地不均匀,严重影响感官质量[7]。SHIRASHOJI等[8]使用了4种不同乳化盐(柠檬酸钠、Na2HPO4、六偏磷酸钠和焦磷酸四钠)制作了不同的再制干酪切片,结果发现使用Na2HPO4和六偏磷酸钠制成的再制干酪具有糊状和易碎的质地,而使用焦磷酸四钠制成的再制干酪具有坚韧和橡胶质地。陈苓等[9]对6种不同乳化盐制得的再制干酪的蛋白二级结构进行分析,结果发现所有干酪的酪蛋白结构以β-折叠为主,而添加Na2HPO4和六偏磷酸钠制作的再制干酪中的蛋白结构无α-螺旋结构。因此,不同乳化剂能够赋予再制干酪不同的质地和功能。最近,磷脂(phospholipid,P)作为乳化剂对再制干酪的理化性质的影响受到了广泛关注。磷脂是一种两性分子,在生物膜中扮演不可或缺的角色[10],它能作为乳化剂影响干酪的结构和功能,特别是脂肪球的大小和分布、蛋白质网络的结构[11],这些变化最终影响再制干酪的流变特性和结构特性等。谷氨酰胺转氨酶(glutamine transaminase,TG)是干酪制作中常用的增稠剂,通过蛋白多肽链上的酰基转移反应促进蛋白质之间的交联,从而形成紧密的网状凝胶结构[12-13]。TG还会使蛋白改性,显著影响干酪的理化性质[14]。然而磷脂和TG对再制干酪(processed cheese, SOS)理化性质的影响还尚未可知。
SOS主要用于披萨、汉堡、三明治等预制食品,因此其质构、熔融性、流变性等至关重要[15-16]。本研究旨在探讨磷脂对SOS流变性能等的影响,并解释微观结构的变化,更有效地提高加工干酪的功能特性,并有助于优化再制干酪的质量品质。
1 材料与方法
1.1 材料与试剂
切达奶酪、黄油、酪蛋白、脱脂乳粉、变性淀粉、柠檬酸钠、食用盐,奶酪博士(上海)科技有限公司;磷脂,安徽中创磷脂科技有限公司;TG,上海东圣生物科技有限公司;帕马森芝士粉,上海华宝孔雀香精香料有限公司;β-胡萝卜素,森鑫香精色素科技(中国)有限公司。
1.2 仪器与设备
WDRO.06-0.7全自动小型电加热蒸汽发生器,上海华信热力机械有限公司;熔融锅,德国Stephan公司;PE SP2傅里叶红外光谱仪,德国 Bruker公司;DHG-907385-Ш电热恒温鼓风干燥箱,上海一恒科学仪器有限公司;TA-XT Plus质构仪,英国Stable Micro Systems公司;MCR302高级旋转流变仪,安东帕(上海)商贸有限公司;TM 300 台式扫描电镜,日立科学仪器(北京)有限公司;NMI20-060核磁共振成像分析仪,苏州纽迈分析仪器股份有限公司。
1.3 实验方法
1.3.1 再制干酪的制备
SOS的实验配料质量设定为1.5 kg,其中高达干酪51%(质量分数,下同)、黄油11%、酪蛋白4%、脱脂乳粉8.45%、柠檬酸钠2%、食用盐1.2%、帕马森芝士粉0.1%、β-胡萝卜素0.025%。在SOS的配方基础上添加0.1%的磷脂,记为SOS-P;在SOS的配方基础上添加0.1%的TG,记为SOS-TG;在SOS的配方基础上添加0.1%的磷脂和0.1%的TG,记为SOS-P-TG。
按照上述配方,将所有原料加入已提前预热的熔融锅中,真空度设置为0.06 MPa,首先将熔融锅转速设置为50%,搅拌预混2 min,然后蒸汽直喷加热至50 ℃,保温8 min,继续蒸汽加热至90 ℃,保温1 min,最后将样品倒入模具中,4 ℃冷却过夜,待用。
1.3.2 再制干酪融化性分析
将4 ℃储存下的4种干酪样品于室温放置30 min,然后切成50 mm×10 mm×10 mm的长方体并放入带橡胶塞的玻璃管底部。在(100±3) ℃的烘箱中加热60 min。加热结束后取出玻璃管于室温冷却静置15 min,测定融化干酪流动的长度。干酪流动的长度代表干酪的融化性。
1.3.3 再制干酪的质构特性分析
采用TA-XT Plus质构仪对再制干酪样品的质构特性进行分析。将4种干酪样品切成2 cm×2 cm×2 cm正方体,在室温下保持30 min后再测定。参考LI等[17]的方法,并略做修改。质构仪参数设定:测试前探头下降速率、测试速率、测试后探头回程速率均为1.00 mm/s;下压变形50%;触发力值5.0 g;探头类型P/50。测定干酪样品的硬度、弹性、咀嚼性、黏附性。每组干酪测定3次取平均值。
1.3.4 再制干酪流变学特性的测定
采用MCR302高级旋转流变仪对干酪进行温度(25~90 ℃)和频率扫描(0~100 Hz)。将干酪于室温下平衡30 min,均匀切成直径10 mm、厚度2 mm的薄片,置于流变测试平台上。温度扫描时,测试拉力0.5%;温度25~90 ℃,升温速度5 ℃/min;频率1 Hz。频率扫描时,温度25 ℃;频率范围0.1~100 Hz。
1.3.5 再制干酪的红外光谱图测定
将不同再制干酪置于真空冷冻干燥器48 h以去除水分,然后将干酪研磨成粉末状,取适量样品涂抹在KBr晶体上,在室温下采集红外光谱图,光谱范围为500~400 cm-1。
1.3.6 再制干酪微观结构的测定
再制干酪微观结构的测定参照李红娟等[18]的方法,略做修改。干酪使用灭菌刀切成1 cm×1 cm×1 cm的薄片,4 ℃下浸泡在2.5%(质量分数)的戊二醛溶液中,固定4 h。用pH 7.2的PBS清洗3次后,再用70%、90%、100%(均为体积分数,下同)的乙醇梯度洗脱以除去水分。然后用正己烷脱脂3次,最后再用100%乙醇脱水3次。处理后的样品置于真空冷冻干燥器48 h,然后在扫描电子显微镜(scanning electron microscope,SEM)下扫描观察。
1.3.7 再制干酪质子密度成像的测定
将干酪切成相同大小放入磁场中心位置的射频线圈的中心,采用核磁共振成像分析仪对干酪质子密度进行测定。
1.3.8 再制干酪水分组成的测定
参照LI等[19]的方法,略做修改。采用核磁共振成像分析仪对干酪中水分进行测定。CPMG脉冲序列参数为:主频21 MHz;频率偏置39 834.42 Hz;90°脉宽11 μs;180°脉宽1 118.64 μs;回波时间1.0 ms;回波个数20;采样频率100 kHz;射频延时0.08 ms;累加次数4次。
1.4 数据处理
所有数据以“平均值±标准差”表示。使用SPSS 25.0软件进行单因素方差分析,以测试不同干酪质构之间的差异,显著性水平定义为 P<0.05。使用Origin 2021绘制图。
2 结果与分析
2.1 磷脂对再制干酪融化性的影响
融化性是干酪在加热时流动的能力,是评价干酪品质的重要指标之一,与干酪的质构密切相关[20]。干酪的融化性应保持在一定的范围内,以确保其在高温下仍然保持一定的形状和结构。为了探究磷脂对干酪融化性的影响,采用(100±3) ℃烘箱加热干酪的方法,以长度表示融化性。结果如图1所示,SOS干酪融化后长度为5.26 cm,添加了磷脂后SOS-P干酪的融化长度显著提升为5.71 cm,而添加了TG的SOS-TG的融化长度与SOS无显著差异。磷脂和TG两者混合的干酪融化长度最长,为6.23 cm。结果表明磷脂可以增加干酪的融化性能,而当单独使用TG时对干酪的融化性没有改变,两者混合使用对干酪融化性改变最大。有研究表明,干酪的融化性受脂肪乳化程度和蛋白质之间互作强度的影响,乳化程度越低、蛋白质之间互作强度越弱,融化性就越高[21]。磷脂可通过置换干酪中不溶性磷酸钙-副酪蛋白磷酸盐网络中的磷酸钙复合物,改善酪蛋白的乳化特性,使脂肪分布更均匀,但是融化性反而也增高,可能原因是与蛋白质间的互作能力对干酪的融化性起主导作用[22],此外磷脂会影响脂质双分子层的结构,会使得脂质分子之间的排列更加松散,也可能导致再制干酪整体的熔点下降。而TG通常被用作增稠剂,可以促进蛋白质之间的相互交联[13],形成弹性结构,因此干酪的融化性低。两者混合使用时,干酪融化性升高的原因可能是因为磷脂抑制了TG的活性,降低了蛋白质间作用强度。
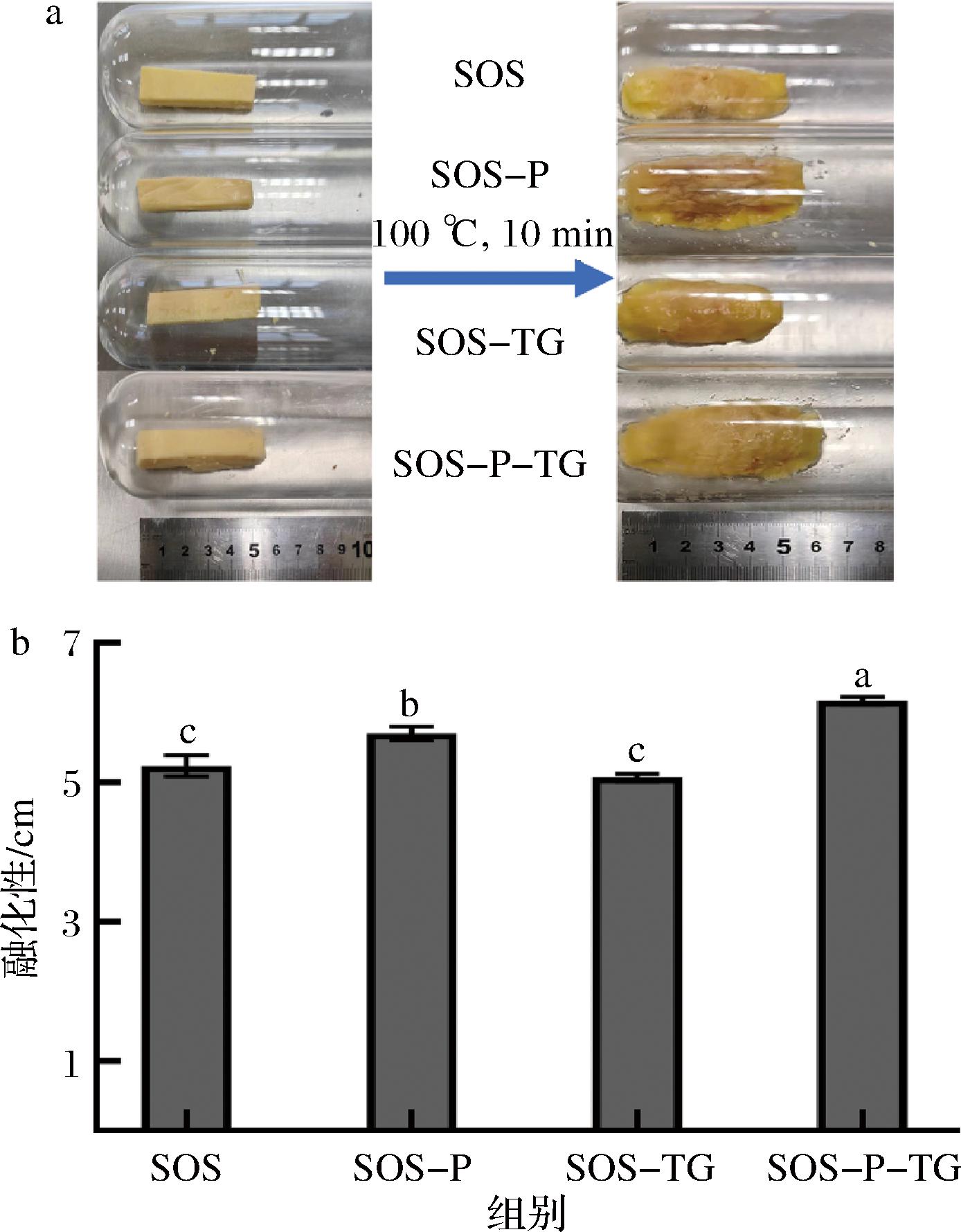
a-干酪融化过程;b-干酪融化长度
图1 磷脂对再制干酪融化性的影响
Fig.1 Effect of phospholipids on the melting properties of processed cheese
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 磷脂对干酪质构特性的影响
为了探究磷脂对干酪质构的影响,采用TA-XT Plus质构仪对干酪的质构进行分析。结果如表1所示,磷脂和TG的添加使干酪的硬度、咀嚼性显著升高,对弹性、黏聚性无显著影响。与我们结果相似的是,KAPOOR等[23]认为磷脂的含量对干酪的硬度起到积极作用,并且磷脂能增加干酪的乳化性,而乳化程度与硬度也呈正相关[17]。TG可以增强蛋白质之间的交联,形成紧密的网状结构,从而导致干酪的硬度增加。此外,磷脂和TG共同添加使得干酪制作过程中水的添加量减少,从而使其具有较好的硬度和咀嚼性。综上所述,磷脂和TG均可以提升干酪的硬度和咀嚼性,当两者混合使用时对咀嚼性提升效果更大。
表1 再制干酪的质构特性
Table 1 Textural properties of processed cheese
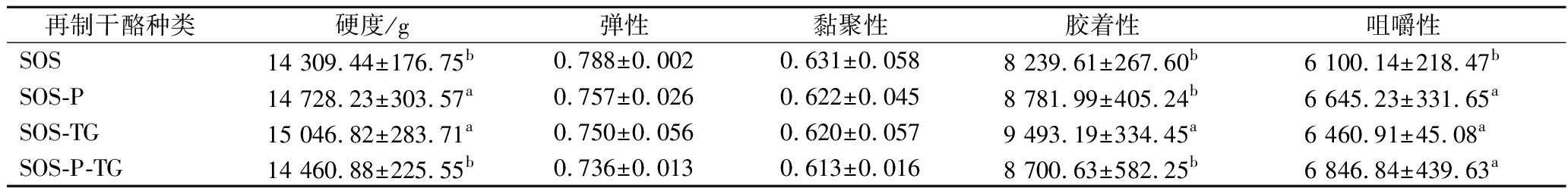
再制干酪种类硬度/g弹性黏聚性胶着性咀嚼性SOS14 309.44±176.75b0.788±0.0020.631±0.0588 239.61±267.60b6 100.14±218.47bSOS-P14 728.23±303.57a0.757±0.0260.622±0.0458 781.99±405.24b6 645.23±331.65aSOS-TG15 046.82±283.71a0.750±0.0560.620±0.0579 493.19±334.45a6 460.91±45.08aSOS-P-TG14 460.88±225.55b0.736±0.0130.613±0.0168 700.63±582.25b6 846.84±439.63a
注:同一列不同字母表示组间差异显著(P<0.05)。
2.3 磷脂对再制干酪流变学特性的影响
干酪的流变特性由储能模量(G′)和损耗模量(G″)表示。G′和G″指物体发生形变时因可逆或不可逆的弹性形变导致损失能量的大小,前者代表了弹性的大小,后者代表黏性的大小[24]。为了探究磷脂对干酪流变性能的影响,采用MCR302高级旋转流变仪在25~90 ℃和0~100 Hz(25 ℃)下对干酪的流变特性进行检测。结果如图2-a所示,所有干酪的G′和G″随着温度的增加逐渐下降,表明温度的增加能显著降低干酪的弹性的黏性。所有干酪的G′>G″,并且G′下降幅度更大,表明随着温度的增加,干酪的流变特性仍以弹性为主。具体而言,在所有温度下SOS的G′和G″均大于其余3种干酪(SOS>SOS-P=SOS-P-TG>SOS-TG),SOS-P和SOS-P-TG变化趋势相似,SOS-TG最低。这表明磷脂和TG的添加降低了干酪的弹性和黏度,这一结果与质构结果对应。图2-b显示,随着频率增加所有干酪的G′逐渐上升,而G″趋于平缓,无显著变化。这表明频率的变化主要影响干酪的弹性,对黏性无显著影响。李红娟等[25]研究表明干酪乳化程度越高,脂肪球直径减少,流动性就减弱,而磷脂和TG均能促进脂肪球在干酪中分布。综上所述,磷脂和TG的添加使得干酪乳化程度加深,蛋白质空隙减少,脂肪球分散更均匀,从而导致流动性下降。
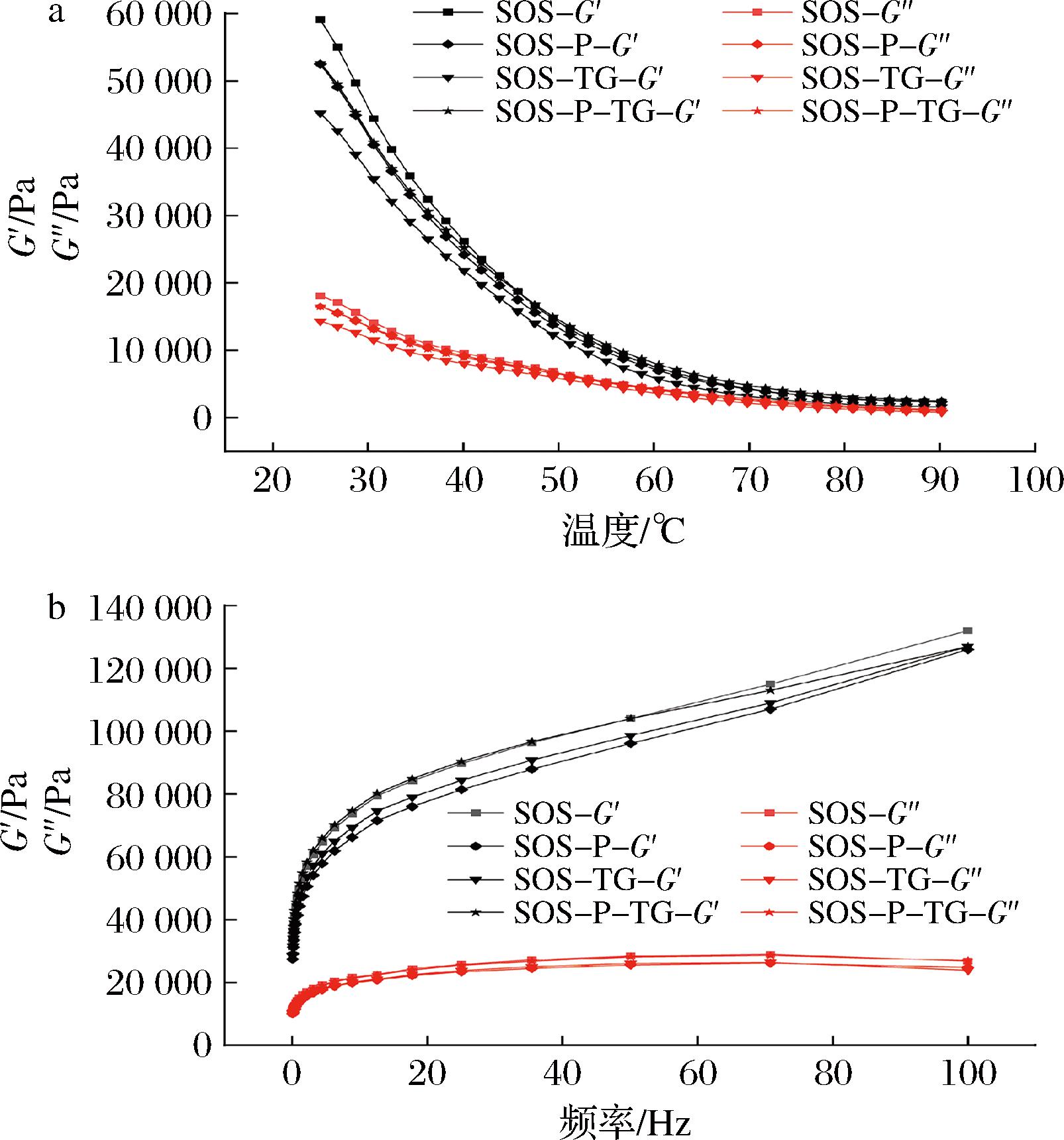
a-25~90 ℃;b-0~100 Hz
图2 不同再制干酪的流变特性
Fig.2 Rheological properties of different processed cheeses
2.4 再制干酪的傅里叶变换红外光谱分析
傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)可以检测蛋白中的二级和三级结构[26]。为了探究磷脂和TG的添加对干酪蛋白结构的影响,采用FTIR对不同干酪进行分析。结果如图3所示,4种再制干酪的红外谱图具有相同的特征峰,说明磷脂和TG的添加没有产生新的官能团,对干酪中蛋白质的结构没有影响。样品在3 500~3 200 cm-1的吸收峰代表分子间氢键O—H伸缩振动。SOS、SOS-P、SOS-P-TG在羟基振动处吸收峰均在3 284 cm-1附近,而SOS-TG在3 289 cm-1,说明TG使干酪中蛋白之间的氢键强度降低,而磷脂的添加使干酪保持了一定的稳定性。综上,磷脂和TG并不是通过改变蛋白结构影响再制干酪品质,为此进一步研究其三维网状结构和水分分布,以阐明其对再制干酪品质的影响机理。
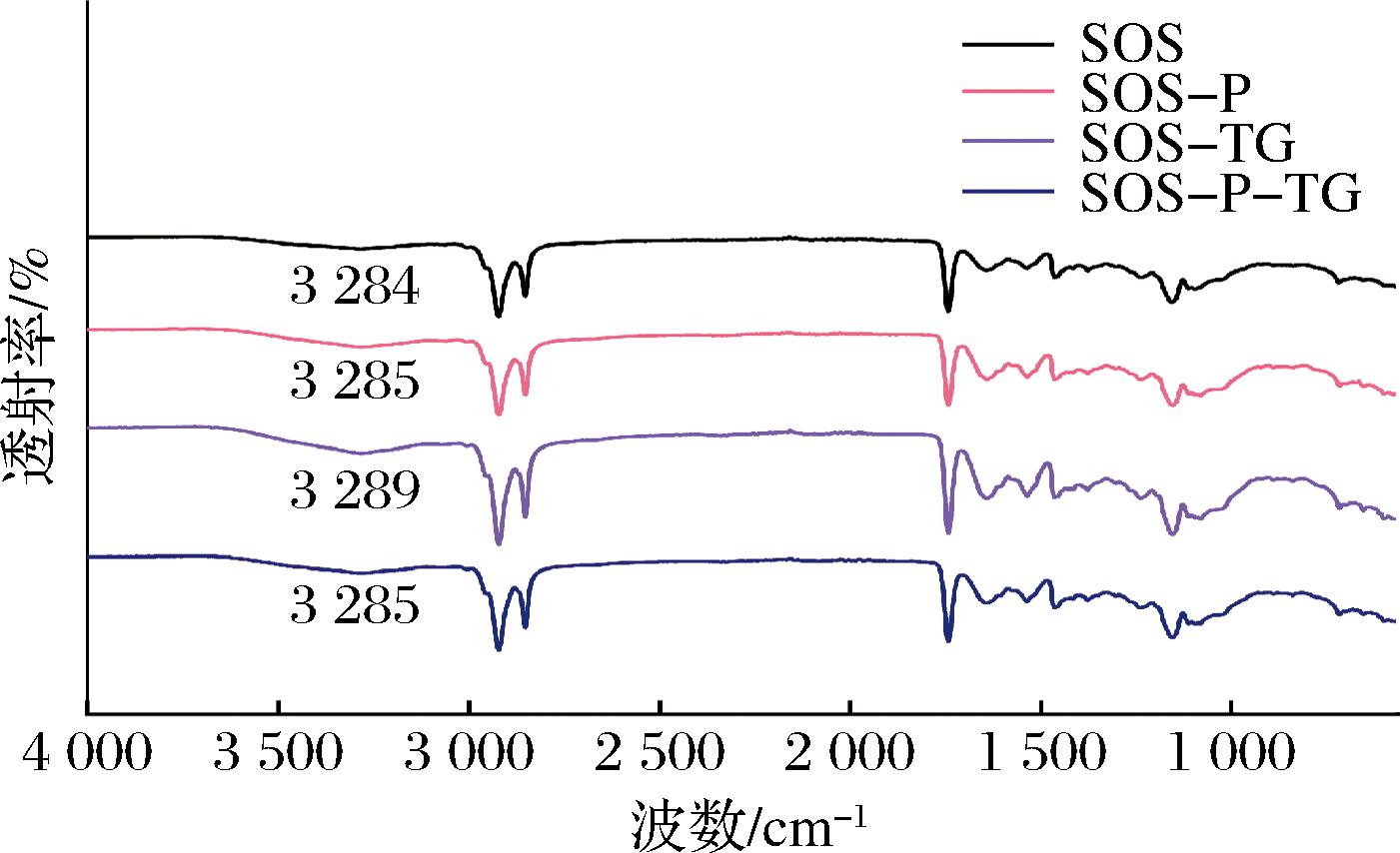
图3 不同再制干酪的红外吸收光谱图
Fig.3 Infrared absorption spectra of different processed cheeses
2.5 磷脂对再制干酪微观结构的影响
为了探究磷脂的添加对干酪生产过程中微观结构的影响,采用扫描电子显微镜(×500)对不同干酪进行测定。结果如图4所示,不同再制干酪的微观结构差异显著。SOS再制干酪呈现一种致密的组织状,这是由于再制干酪中酪蛋白互相结合聚集,形成网状结构,而脂肪球填充在网状结构之间,形成致密的组织状[9]。SOS-P再制干酪的质地更光滑细腻,具有层状结构。磷脂作为一种乳化剂可以使再制干酪中的脂肪球分散均匀,减少脂肪颗粒的大小,从而使干酪的结构更加均匀细腻[27]。并且磷脂具有两亲性,在干酪中易形成脂质双分子层,因此可以观察到明显的层状结构,这可能是添加磷脂导致再制干酪融化性增加的主要原因。TG对干酪微观结构的影响与磷脂类似,使干酪结构呈现出交联的网状结构。TG可催化特定氨基酸残基(如谷氨酰胺和赖氨酸)之间的结合,从而在蛋白质分子之间形成共价键,这些交联有助于形成更有内聚力的蛋白质网络[28]。磷脂和TG的共同作用使干酪的网络结构更加紧密,但是脂肪球大小明显不均匀,可能是它们共同使用会减弱其对酪蛋白的乳化效果。这些结果与干酪的质构、流变特性相对应。

a-SOS;b-SOS-P;c-SOS-TG;d-SOS-P-TG
图4 不同再制干酪的扫描电镜图
Fig.4 Scanning electron micrographs of different processed cheeses
2.6 不同再制干酪的磁共振成像
食品中水分含量大小可以反映其稳定性和货架期。磷脂通过与亲水和疏水成分的相互作用,影响水分在干酪中的分配。为了探究磷脂对再制干酪中水分含量的影响,采用磁共振成像(magnetic resonance imaging, MRI)技术从微观角度分析。H质子密度越大,颜色就越红,表明食品中水分含量越高;反之,H质子密度越小,颜色就越蓝,表明食品中水分含量越低[29-30]。由图5可知,SOS-TG样品整体呈现红色,表明此时样品中水分含量高,且结合紧密,分布均匀。其余3种干酪边缘处呈现绿色,表明样品中的水分发生迁移导致损耗,其中SOS-P损耗程度最高。可能原因是磷脂与干酪中的部分蛋白质发生相互作用,导致氢键、疏水相互作用等被破坏,从而失去对水的束缚力,造成水分损耗[31]。另一种原因可能是干酪在储存过程中长时间暴露于空气中,导致水分损耗。
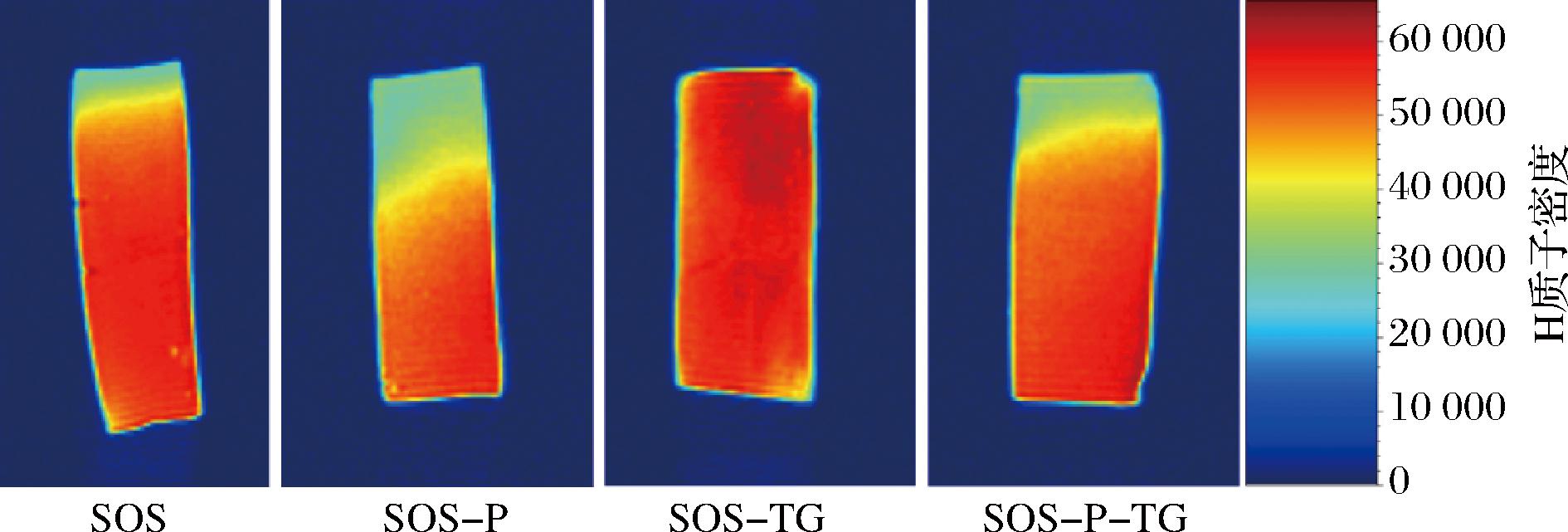
图5 不同再制干酪的MRI图
Fig.5 MRI maps of different processed cheeses
2.7 磷脂对再制干酪中水分存在形式的影响
为了探究磷脂对再制干酪中水分分布的影响,采用低场核磁共振仪器进行检测。按照水分和物料的结合程度强弱可分为4种不同状态水分[32]:横向弛豫时间在0.1~1 ms的强结合水,用T20表示;1~10 ms的弱结合水,用T21表示;10~100 ms的不易流动水,用T22表示;>100 ms的自由水,用T23表示。结果如图6所示,4种再制干酪中水分类型主要为强结合水和不易流动水。强结合水含量T20由高到低为:SOS>SOS-P-TG>SOS-TG>SOS-P,分别占各自总峰面积的6.513%、5.852%、3.651%、6.486%。不易流动水含量T22由高到低为:SOS>SOS-TG>SOS-P-TG>SOS-P,分别占各自总峰面积的81.904%、96.349%、94.148%、93.514%。磷脂和TG的添加使干酪中的强结合水和不易流动水的含量显著降低,降低了强结合水的比例,同时提高了不易流动水的比例。这是因为磷脂作为一种乳化剂能够降低再制干酪中水相和脂肪相之间的界面张力,从而改变干酪中水分分布。并且磷脂有助于干酪中的蛋白质形成更均匀网状结构,从而影响水分的保持和分布。
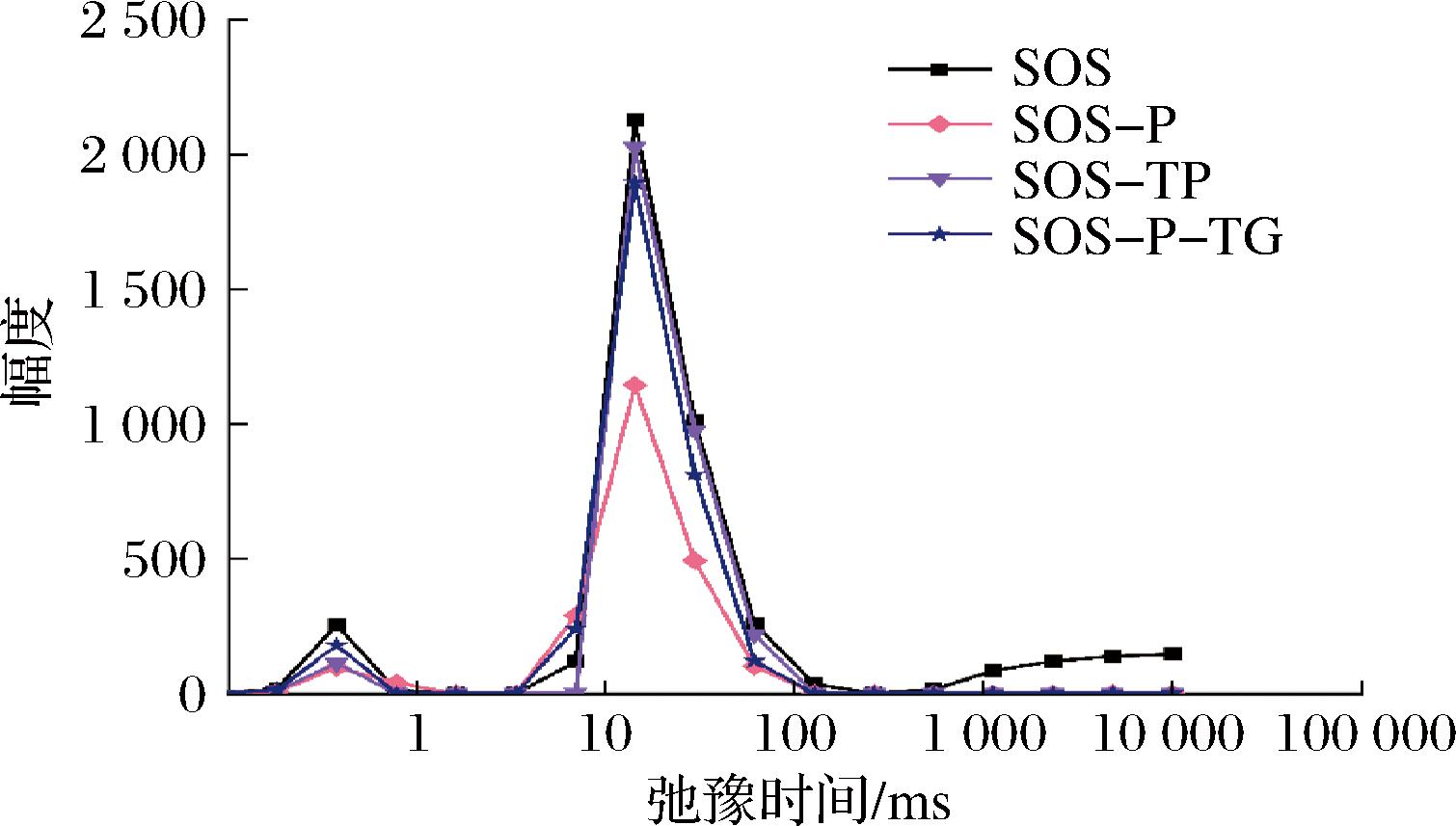
图6 不同再制干酪的水分分布
Fig.6 Moisture distribution in different processed cheeses
3 结 论
磷脂对再制干酪的影响包括分子相互作用、物理特性和流变特性等。本实验旨在探究磷脂对再制干酪的质构、流变、微观等多维度的影响,以推进高品质再制干酪产品的开发。磷脂的添加并未改变干酪的蛋白结构,使其保持一定的稳定性。质构研究表明,磷脂通过提升干酪乳化效果从而提升了干酪的熔融性、硬度和咀嚼性,降低了流动性。微观结构表明,磷脂减少了干酪中蛋白质之间的空隙,使脂肪球分散更均匀细腻。同时,降低了干酪中脂肪相和水相之间的张力,从而降低干酪中水分含量,改变了水分存在形式。这些发现有助于了解磷脂与蛋白质的相互作用关系,能够为改善再制干酪的品质提供理论依据,充分发挥磷脂的功能特性。此外,再制干酪的组分复杂多样,磷脂与其他组分之间相互影响关系仍需进一步探究。
[1] FU W, WATANABE Y, INOUE K, et al.Effects of pre-cooked cheeses of different emulsifying conditions on mechanical properties and microstructure of processed cheese[J].Food Chemistry, 2018, 245:47-52.
[2] CHOURASIA R, ABEDIN M M, CHIRING PHUKON L, et al.Biotechnological approaches for the production of designer cheese with improved functionality[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1):960-979.
[3] KOURKOUTAS Y, BOSNEA L, TABOUKOS S, et al.Probiotic cheese production using Lactobacillus casei cells immobilized on fruit pieces[J].Journal of Dairy Science, 2006, 89(5):1439-1451.
[4] SHEIKHA A E.Revolution in fermented foods:From artisan household technology to the era of biotechnology[M]//Molecular Techniques in Food Biology.New York:John Wiley &Sons, 2018:241-260.
[5] PANIKUTTIRA B, O’SHEA N, TOBIN J T, et al.Process analytical technology for cheese manufacture[J].International Journal of Food Science &Technology, 2018, 53(8):1803-1815.
[6] TALBOT-WALSH G, KANNAR D, SELOMULYA C.A review on technological parameters and recent advances in the fortification of processed cheese[J].Trends in Food Science &Technology, 2018, 81:193-202.
[7] ZUBER F, MÉGARD D, CHEFTEL J C.Continuous emulsification and gelation of dairy ingredients by HTST extrusion cooking:Production of processed cheeses[J].International Journal of Food Science &Technology, 1987, 22(6):607-626.
[8] SHIRASHOJI N, ABE T, TAKAHASHI K, et al.Influence of emulsifying salts on functionality of sliced process cheese[J].Journal of Animal Science, 2006, 84:423.
[9] 陈苓, 刘会平.不同乳化盐对Mozzarella再制干酪结构的影响[J].食品科学, 2013, 34(15):104-108.CHEN L, LIU H P.Effects of different emulsifying salts on the structure of cheese prepared from mozzarella[J].Food Science, 2013, 34(15):104-108.
[10] 王霁月. 外源性磷脂添加对乳脂肪球结构和功能的影响[D].无锡:江南大学, 2021.WANG J Y.Effect of exogenous phospholipids on the structure and function of milk fat globules[D].Wuxi:Jiangnan University, 2021.
[11] 陈龙, 林艳春, 王冬梅, 等.不同大豆蛋白卵磷脂相互作用对乳化特性的影响[J].食品工业, 2018, 39(2):222-225.CHEN L, LIN Y C, WANG D M, et al.The effect of different soybean protein and lecithin on emulsifying properties[J].The Food Industry, 2018, 39(2):222-225.
[12] JOYE I J, LAGRAIN B, DELCOUR J A.Use of chemical redox agents and exogenous enzymes to modify the protein network during breadmaking-A review[J].Journal of Cereal Science, 2009, 50(1):11-21.
[13] LI H J, LIU Y, SUN Y J, et al.Properties of polysaccharides and glutamine transaminase used in mozzarella cheese as texturizer and crosslinking agents[J].LWT, 2019, 99:411-416.
[14] 刘贺, 李君, 庚平, 等.转谷氨酰胺酶对Cheddar干酪力学性质的影响[J].食品与发酵工业, 2014, 40(6):70-75.LIU H, LI J, GENG P, et al.Effects of transglutaminase treatment on mechanical properties of Cheddar cheeses[J].Food and Fermentation Industries, 2014, 40(6):70-75.
[15] GUINEE T P, CARI M, KAL
M, KAL B M.Pasteurized processed cheese and substitute/imitation cheese products[J].Cheese:Chemistry, Physics and Microbiology, 2004, 2:349-394.
B M.Pasteurized processed cheese and substitute/imitation cheese products[J].Cheese:Chemistry, Physics and Microbiology, 2004, 2:349-394.
[16] KAPOOR R, METZGER L E.Process cheese:Scientific and technological aspects:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2008, 7(2):194-214.
[17] LI H J, QIN A R, YU H M, et al.Effects of pre-emulsification with heat-treated whey protein on texture and microstructure of processed cheese[J].LWT, 2020, 124:109185.
[18] 李红娟, 王祎, 刘燕, 等.热烫拉伸融化过程对Mozzarella干酪品质、分子间作用力及微观结构的影响[J].食品科学, 2020, 41(3):30-36.LI H J, WANG Y, LIU Y, et al.Effects of thermal, stretching and melting treatments on quality, intermolecular force and microstructure of mozzarella cheese[J].Food Science, 2020, 41(3):30-36.
[19] LI X, MA L Z, TAO Y, et al.Low field-NMR in measuring water mobility and distribution in beef granules during drying process[J].Advanced Materials Research, 2012, 550-553:3406-3410.
[20] 夏文水, SINDAYIKENGERA S.食品中乳蛋白的重要作用[J].食品与生物技术学报, 2005, 24(6):100-105.XIA W S, SÉVERIN S.Significance of milk proteins in food[J].Journal of Wuxi University of Light Industry, 2005, 24(6):100-105.
[21] CUNHA C R, VIOTTO W H.Casein peptization, functional properties, and sensory acceptance of processed cheese spreads made with different emulsifying salts[J].Journal of Food Science, 2010, 75(1):C113-C120.
[22] 蒋玉菡. DBD等离子体对卵白蛋白界面性质影响及低磷低盐再制干酪应用研究[D].广州:华南理工大学, 2021.JIANG Y H.Effects of DBD plasma on the interfacial properties of ovalbumin and its application in low phosphorus and low salt content processed cheese[D].Guangzhou:South China University of Technology, 2021.
[23] KAPOOR R, METZGER L E, BISWAS A C, et al.Effect of natural cheese characteristics on process cheese properties[J].Journal of Dairy Science, 2007, 90(4):1625-1634.
[24] XU X B, GUPTA N.Determining elastic modulus from dynamic mechanical analysis:A general model based on loss modulus data[J].Materialia, 2018, 4:221-226.
[25] 李红娟, 李梦凡, 袁玉京, 等.再制干酪乳化过程中理化、功能特性及微观结构的变化[J].食品科学, 2023, 44(4):78-84.LI H J, LI M F, YUAN Y J, et al.Physicochemical, functional and microstructural changes during the emulsification process of processed cheese[J].Food Science, 2023, 44(4):78-84.
[26] KATHRINE ESAGER Ø, CHRISTENSEN L B, WIKING L, et al.Detecting interactions between starch and casein in imitation cheese by FTIR and Raman spectroscopy[J].Food Chemistry Advances, 2023, 2:100322.
[27] HICKEY C D, DIEHL B W K, NUZZO M, et al.Influence of buttermilk powder or buttermilk addition on phospholipid content, chemical and bio-chemical composition and bacterial viability in Cheddar style-cheese[J].Food Research International, 2017, 102:748-758.
[28] WANG W Q, ZHANG L W, HAN X, et al.Cheese whey protein recovery by ultrafiltration through transglutaminase (TG) catalysis whey protein cross-linking[J].Food Chemistry, 2017, 215:31-40.
[29] ZHU Z W, ZHOU Q Y, SUN D W.Measuring and controlling ice crystallization in frozen foods:A review of recent developments[J].Trends in Food Science &Technology, 2019, 90:13-25.
[30] 刁华玉, 林松毅, 梁瑞, 等.南极磷虾肉冻融循环过程水分的迁移及微观结构变化[J].中国食品学报, 2022, 22(6):242-250.DIAO H Y, LIN S Y, LIANG R, et al.Moisture migration and microstructure changes of Antarctic krill meat during multiple freeze-thaw cycles[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(6):242-250.
[31] 吴劲轩, 夏文银, 夏川林, 等.磷脂与食品中蛋白质相互作用机制及对蛋白质特性的影响研究进展[J].食品工业科技, 2020, 41(17):345-351.WU J X, XIA W Y, XIA C L, et al.Interaction mechanism between phospholipids and food proteins and effect on protein properties:A review[J].Science and Technology of Food Industry, 2020, 41(17):345-351.
[32] 王小荟. 基于磁共振技术的牛肉冷冻贮藏品质无损检测方法研究[D].大连:大连工业大学, 2019.WANG X H.Nondestructive method for beef quality measurenment during frozen and chilling storage based on magnetic resonance technology[D].Dalian:Dalian Polytechnic University, 2019.