花色苷是一种存在于植物中的天然多酚类化合物,广泛存在于紫红色水果、蔬菜和谷物中[1]。花色苷以其独特的结构和丰富的生物活性而备受关注,它是由花青素与多种糖在自然状态下形成的,其基本结构为3,5,7-三羟基-2苯基苯并吡喃[2]。糖基化发生在环上特定的碳原子(3,5,7,3′和5′)上,常见的花色苷为3-糖基化或3,5-糖基化[3]。花色苷由于羟基、甲氧基或糖基在不同位置可被分为多种类型,其中,矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside, C3G)则是花色苷的主要类型之一[4]。花色苷的特殊结构赋予其诸多生理活性,包括抗氧化[5]、抗炎[6]、抗肿瘤[7]、降糖[8]等。因此,以C3G为代表的花色苷在医药、保健品和食品工业中具有广泛的应用前景。
牛血清白蛋白(bovine serum albumin, BSA)是动物血浆中含量最丰富的蛋白质,其结构稳定,具有丰富的α-螺旋和β-折叠结构[9]。BSA在生物体内承担着多种功能,包括携带与运输生物分子(如药物、激素等)[10]、调节体液渗透压[11]、参与免疫反应[12]等。BSA作为一种理想的生物材料,被广泛用于生物学实验中,如蛋白质结构与功能研究、生物分子的载体和稳定剂、细胞培养基的组分等[13]。此外,BSA还在医药、饮食营养和食品加工等方面有着重要的应用。在食品工业中,乳清蛋白可作为乳化剂、稳定剂、营养强化剂,应用于婴儿配方奶粉、乳制品、肉制品、运动营养品、功能性食品等产品中,提高营养价值和口感[14]。BSA作为乳清蛋白中的重要成分,是否可以单独用于改善食品的质地和稳定性还鲜有研究,比如在加工过程中帮助改善乳化和泡沫稳定性,并将其利用在某些蛋白质饮料、蛋白质棒和奶制品中。
近年来,研究人员开始关注BSA与C3G之间的相互作用,以探索其在生物体内的可能影响和应用前景。多种实验手段和计算模拟方法被用来探索BSA与C3G之间的相互作用。其中,光谱技术和分子对接技术被广泛应用于研究二者的结合过程和机制,并进一步探究相互作用对它们结构和功能的影响[15-16]。
目前的研究表明,BSA与C3G之间的相互作用可能会影响它们的稳定性、构象和生物活性。TANG等[2]研究中紫外可见光谱、红外光谱和同步荧光光谱数据表明,C3G的存在改变了BSA的二级结构,其α-螺旋含量降低,β-折叠结构增加。TANG等[17]将C3G加入到BSA溶液中,发现BSA的α-螺旋含量增加,推断其原因是与C3G的相互作用削弱了BSA与水分子之间的溶剂化作用,且C3G分子中的亲水性葡萄糖苷基团与BSA表面的亲水性侧链(赖氨酸、谷氨酸等)相互作用,增强BSA分子的稳定性,有助于维持或促进α-螺旋结构的形成。YANG等[18]通过分子动力学模拟研究BSA和C3G的结合机理中揭示了静电相互作用的重要性。HOSSEIN等[19]在研究pH 3.0条件下C3G与BSA结合稳定性中发现,C3G分子引起了BSA结构的部分展开,但不足以显著改变其变性温度,在BSA的II位点发现了稳定的C3G分子,且其以静态和动态猝灭机制相结合,BSA-C3G复合物中约93%的结合位点被氢键和范德华力占据。
研究表明BSA与C3G的结合会导致BSA构象发生变化,这种结构变化可能影响BSA的蛋白特性、稳定性及功能,进而影响其与其他生物分子的相互作用。基于以上背景,本研究旨在通过光谱技术、分子模拟等手段来探究BSA与C3G之间的结合方式、结合位点,并了解二者之间的相互作用对蛋白结构和蛋白物理特性等的影响。将BSA与C3G结合的研究不仅有助于改善食品的营养质量和功能性,还可以探索其在各种加工条件下的适用性,这些研究为开发新型食品成分和改进现有产品提供了理论依据和实验基础,有望为更好地理解BSA和C3G在生物体内的相互作用提供重要的理论支持,也为其在医学、保健品等领域的应用提供科学依据。
1 材料与方法
1.1 材料与试剂
C3G(纯度≥98%),成都乐美天医药科技有限公司;BSA(纯度≥80%),上海源叶生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
F-7000荧光光谱仪,株式会社日立制作所;Thermo Nicolet iS10傅里叶变换红外光谱仪,赛默飞世尔科技有限公司;Chirascan plus圆二色光谱仪,英国应用光物理公司;XMTB电热恒温水浴锅,余姚市东方电工仪器厂;UV-6100紫外可见分光光度计,上海元析仪器有限公司;XW-80A涡旋振荡器,海门市其林贝尔仪器制造有限公司;TS-100B恒温摇床,上海天呈实验仪器制造有限公司;FM200A高速分散机,上海弗鲁克流体机械制造有限公司;3H2ORI高速冷冻离心机,湖南赫西仪器装备有限公司。
1.3 实验方法
1.3.1 BSA-C3G混合溶液的配制
将BSA用PBS(0.01 mol/L, pH 7.4)溶解,制得浓度为10 μmol/L的蛋白溶液,将C3G溶解于柠檬酸-柠檬酸钠溶液(0.1 mol/L, pH 3.0),配制终浓度为10、20、40、60、80、100 μmol/L的C3G溶液,将BSA与C3G按照体积比1∶1混匀,置于4 ℃备用。
1.3.2 BSA-C3G物理性质分析
1.3.2.1 傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)
将C3G溶液(20 μmol/L)与BSA溶液(20 μmol/L)充分混合后进行真空冷冻干燥得到冻干粉。将冻干粉末样品与KBr混合压片后进行全波段(4 000~400 cm-1)扫描,分辨率为4 cm-1,共扫描32次,其中,该实验使用空白KBr分离器调整基线水平并归一化差异光谱。
1.3.2.2 圆二色光谱(circular dichroism,CD)
将C3G(20 μmol/L)与BSA(20 μmol/L)蛋白溶液按照体积比1∶1混合,于200~260 nm波长下进行光谱扫描,扫描速度为60 nm/min,分辨率为0.2 nm,响应时间为0.5 s,狭缝宽度为1 nm。
1.3.2.3 荧光光谱
分子三级结构变化可通过蛋白活性位点处所富含的氨基酸(如色氨酸和酪氨酸)的变化来考察。将不同浓度的C3G(0、10、20、40、60、80、100 μmol/L)与BSA(10 μmol/L)溶液分别按照体积比1∶1混合均匀后,测定不同温度(298、308、318 K)下蛋白配体荧光光谱的变化。其中,石英比色皿光程为1.0 cm,荧光激发波长为280 nm,发射波长为290~450 nm,激发及发射狭缝为5 nm。
1.3.2.4 荧光猝灭分析
荧光机理可用Stern-Volmer方程描述,通过荧光猝灭光谱可算出结合常数(KA)、结合位点数(n)以及热力学参数,计算方法如公式(1)、公式(2)所示:
F0/F=1+KsvCQ=1+Kqτ0Cq
(1)
lg[(F0-F)/F]=logKA+nlogCq
(2)
式中:F0,BSA单独荧光强度;F,BSA在给定浓度猝灭剂(C3G)时的荧光强度;CQ,猝灭剂(C3G)浓度,μmol/L;Ksv,Stern-Volmer动态猝灭常数,L/mol;Kq,生物大分子猝灭速率常数,L/(mol·s);τ0,无猝灭剂存在下的荧光团寿命,约为10-8 s;KA,猝灭剂与荧光团之间的结合常数,L/mol;n,结合位点数。使用实验数据的非线性最小二乘进行拟合计算。
1.3.2.5 热力学分析
蛋白质-配体平衡的能量学可以用吉布斯自由能(ΔG)、结合焓(ΔH)和熵(ΔS)来表征。计算方法如公式(3)~公式(5)所示:
ΔG=-RTlnKA
(3)
lnKA=(-ΔH/R)(1/T)+(ΔS/R)
(4)
ΔG=ΔH-TΔS
(5)
式中:ΔH,焓变,kJ/mol;ΔS,熵变,kJ/mol;ΔG,吉布斯自由能变化,J/(mol·K);T,绝对温度,K;R,气体常数,8.314 J/(mol·K);KA,结合常数,L/mol。
1.3.3 BSA-C3G蛋白功能特性分析
1.3.3.1 粒径和电位
采用粒径分析仪,通过动态光散射测定BSA-C3G复合溶液的粒径和电位。其中,装载量1 mL,稀释倍数20倍,室温平衡2 min。
1.3.3.2 表面疏水性
通过8-苯胺基-1-萘磺酸铵(8-anilino-1-naphthalenesulfonic acid, ANS)荧光探针法测定表面疏水性的变化。分别将2 mL的BSA和BSA-C3G溶液与10 μL 的ANS溶液(8 mmol/L)混合均匀,避光静置15 min后测定其荧光强度。测定条件:激发波长370 nm,扫描发射波长400~600 nm,电压400 V,狭缝宽度10 nm。
1.3.3.3 溶解性
取6支洁净离心管,配制总体积为5 mL的考马斯亮蓝(体积为4 mL)混合溶液,使混合体系中BSA的终质量浓度为50 μg/mL,C3G终浓度分别为0、5、10、15、20、30 μg/mL。混合溶液静置5 min后测定595 nm处吸光度,通过BSA标准曲线计算出上清液中的BSA含量,按照公式(6)计算出BSA与C3G结合后的溶解性。
溶解性![]()
(6)
1.3.3.4 持水性
取6支洁净离心管分别称重编号,每管中加入0.2 g的BSA,再分别加入0、0.002 5、0.005、0.01、0.015、0.02 g的C3G,用1 mL蒸馏水溶解,使用涡旋振荡器混匀后后室温静置20 min,于4 000 r/min离心15 min,倒掉上清液后称重,根据公式(7)计算BSA与C3G结合后的持水性。
持水性![]()
(7)
式中:m0,样品总质量,g;m1,离心管质量,g;m2,沉淀物和离心管总质量,g。
1.3.3.5 持油性
取6支洁净离心管分别称重并编号,每管中加入1.0 g的BSA,再分别加入0、0.012 5、0.025、0.05、0.075、0.1 g的C3G,用1 mL核桃油溶解,涡旋振荡后室温静置20 min后离心(4 000 r/min,15 min),倒掉上清液后称量沉淀物和离心管质量,根据公式(8)计算BSA与C3G结合后的持油性。
持油性![]()
(8)
式中:m0,样品总质量,g;m1,离心管质量,g;m2,沉淀物和离心管总质量,g。
1.3.3.6 乳化性
取6支洁净离心管,每管加入2 mL 浓度为100 μmol/L 的BSA溶液分别与0、20、40、60、80、100 μL 的C3G(100 μmol/L)溶液混合后,再依次加入100、80、60、40、20、0 μL的蒸馏水,最终每管加入1 mL核桃油,用均质机均质1 min后形成乳化液,用移液枪迅速从底部吸取乳状液50 μL于10 mL洁净离心管,加入10 g/L SDS溶液至5 mL,以不加乳液的10 g/L SDS作为空白,测定0、10 min时500 nm波长处的吸光度,根据公式(9)和(10)计算BSA与C3G结合后的乳化活力指数(emulsification activity index, EAI)和乳化稳定指数(emulsification stability index, ESI)。
EAI=100×A0
(9)
ESI/%=A10/A0
(10)
式中:A0,0 min时的吸光值;A10,10 min时的吸光值。
1.3.3.7 起泡性
将分别将3 mL的BSA溶液(100 μmol/L)与1 mL不同浓度C3G溶液(20、40、60、80、100 μmol/L)充分混合,涡旋振荡8 min后记录液体、液体-泡沫总体积,再分别记录振荡后静置10、20、30、40 min后的液体-泡沫总体积,其中,将与C3G等体积的的蒸馏水作为空白对照。根据公式(11)和(12)计算BSA与C3G结合后的起泡能力(foaming capacity, FC)和泡沫稳定性(foam stability, FS)。
FC/%=(V1-V2/V0)×100
(11)
FS/%=(V1-V3/V0)×100
(12)
式中:V0,BSA与C3G初混合总体积,mL;V1,涡旋振荡8 min后液体-泡沫总体积,mL;V2,涡旋振荡8 min后液体总体积,mL;V3,静置后某时刻的液体-泡沫总体积,mL。
1.3.4 分子对接
分子对接计算旨在预测已知三维结构的小分子和受体之间的结合行为。从RCSB PDB网站下载BSA蛋白结构,在TCMSP网站下载C3G mol2结构,使用AutoDock软件完成蛋白和小分子之间的分子对接,使用PyMOL分析对接结果。
1.4 数据处理
每个实验重复3次,结果用“平均值±方差”表示,采用SPSS 25软件对实验数据进行方差分析(P<0.05),使用Origin 2021进行绘图。
2 结果与分析
2.1 BSA-C3G复合物的相互作用分析
2.1.1 FTIR分析
FTIR可用来检测蛋白质和其他配体结合时的二级结构。蛋白质在红外波段有多个特征吸收条带,主要有酰胺I带(1 600~1 700 cm-1,C![]() O伸缩振动)、酰胺Ⅱ带(<1 548 cm-1,N—H弯曲振动及C—N伸缩振动)及酰胺A带(3 300~3 400 cm-1,N—H伸缩振动)[20]。如图1所示,加入C3G之后,BSA的各酰胺带发生移动,酰胺I带从1 667 cm-1红移到1 658 cm-1,酰胺A带从3 372 cm-1变为3 417 cm-1,表明C3G和BSA发生结合,且酰胺I带、Ⅱ带峰强度的减弱说明了蛋白质α-螺旋结构减少,可能是C3G的羟基、氧原子通过疏水作用力、氢键以及静电引力等与BSA的C
O伸缩振动)、酰胺Ⅱ带(<1 548 cm-1,N—H弯曲振动及C—N伸缩振动)及酰胺A带(3 300~3 400 cm-1,N—H伸缩振动)[20]。如图1所示,加入C3G之后,BSA的各酰胺带发生移动,酰胺I带从1 667 cm-1红移到1 658 cm-1,酰胺A带从3 372 cm-1变为3 417 cm-1,表明C3G和BSA发生结合,且酰胺I带、Ⅱ带峰强度的减弱说明了蛋白质α-螺旋结构减少,可能是C3G的羟基、氧原子通过疏水作用力、氢键以及静电引力等与BSA的C![]() O、N—H、C—N基团发生相互作用,导致蛋白肽链重排,使得二级结构发生改变[21]。本研究中C3G的加入使BSA的α-螺旋结构减少的结果与TANG等[17]研究结果趋势相反,推测其可能是与BSA和C3G的添加比例不同有关,过高浓度的C3G可能会使得原本紧密排列的α-螺旋结构松弛。
O、N—H、C—N基团发生相互作用,导致蛋白肽链重排,使得二级结构发生改变[21]。本研究中C3G的加入使BSA的α-螺旋结构减少的结果与TANG等[17]研究结果趋势相反,推测其可能是与BSA和C3G的添加比例不同有关,过高浓度的C3G可能会使得原本紧密排列的α-螺旋结构松弛。
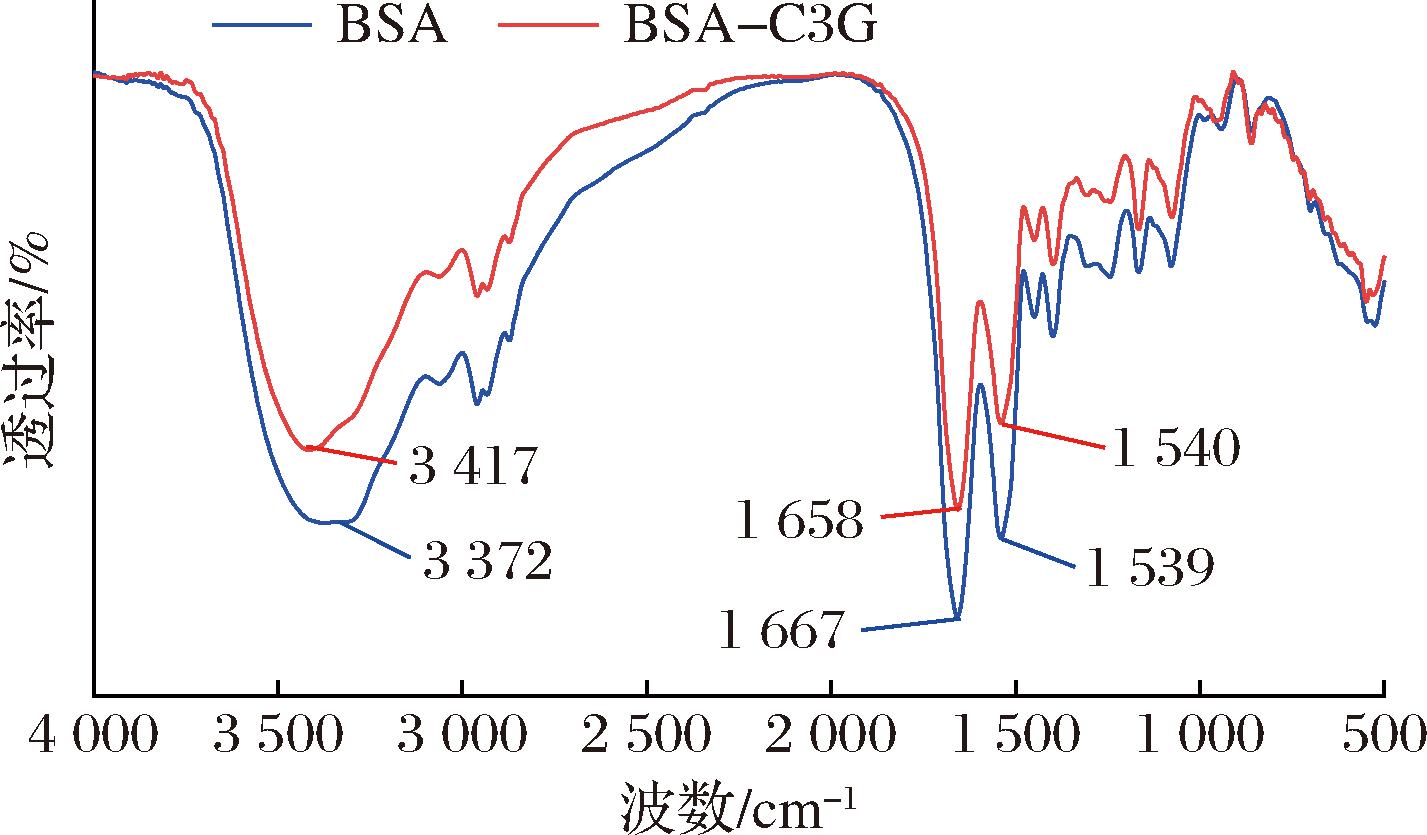
图1 BSA及BSA-C3G复合物的红外光谱图
Fig.1 FTIR spectra of BSA and BSA-C3G complex
2.1.2 圆二色谱分析
通过圆二色谱检测了蛋白质二级结构的变化。由图2可知,BSA光谱在208 nm和222 nm处出现2个明显负峰,是蛋白质中α-螺旋结构的特征峰[17]。加入C3G后,BSA的CD信号减弱,表明C3G与BSA中主链氨基酸残基结合破坏了其氢键网络结构,这与本文FTIR结果一致。由表1可知,BSA与C3G结合后α-螺旋含量下降,β-折叠含量增加,无规卷曲含量升高,说明C3G使BSA蛋白结构趋于松散,这与ZANG等[22]的研究结果一致。
表1 BSA及BSA-C3G复合物的二级结构含量 单位:%
Table 1 Secondary structure analysis of BSA and BSA-C3G complex

样品α-螺旋β-折叠β-转角无规卷曲BSA31.818.117.232.9BSA-C3G31.118.517.333.1
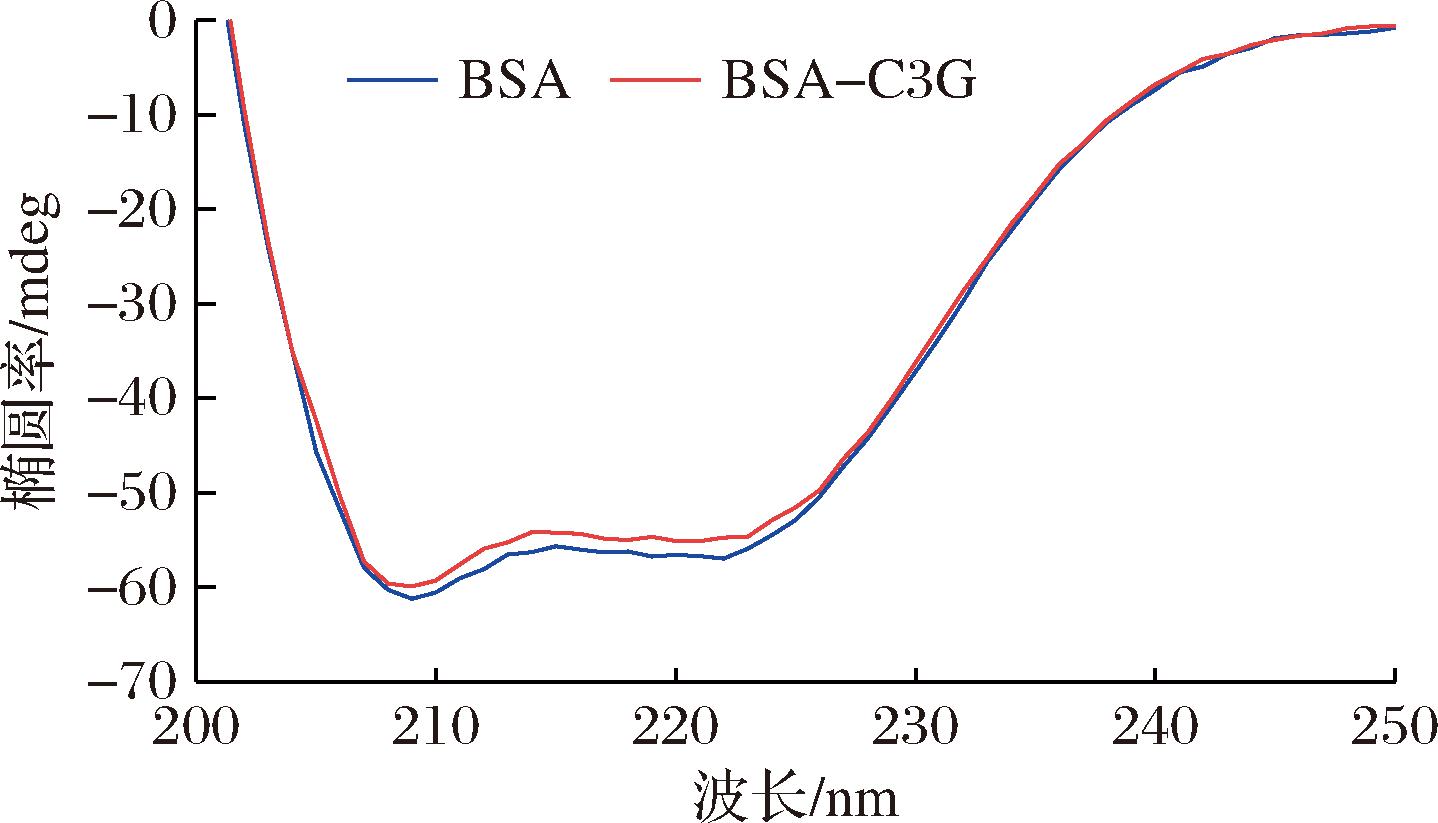
图2 BSA及BSA-C3G复合物的圆二色谱图
Fig.2 Circular dichroism spectra of BSA and BSA-C3G complex
2.1.3 荧光光谱分析
荧光光谱法是研究蛋白质与多酚结合前后结构变化的一种常用技术[23],其原理是猝灭剂的存在会使蛋白质内源荧光基团发生改变,在激发波长为280 nm处时,色氨酸和酪氨酸发射荧光,蛋白构象的微弱变化会造成其荧光值的改变。图3显示了C3G加入前后BSA在280 nm激发时的荧光发射光谱,随着C3G添加浓度的增加,BSA荧光值逐渐降低。当C3G浓度达到100 μmol/L时,BSA发光强度由1 928下降至1 016,表明C3G使BSA中的色氨酸和酪氨酸发生了典型的内源性荧光猝灭。BSA的最大发射波长(λmax)由337 nm红移至338 nm,表明C3G可降低BSA中色氨酸和酪氨酸残基附近微环境的疏水性,增强亲水性和极性[24]。
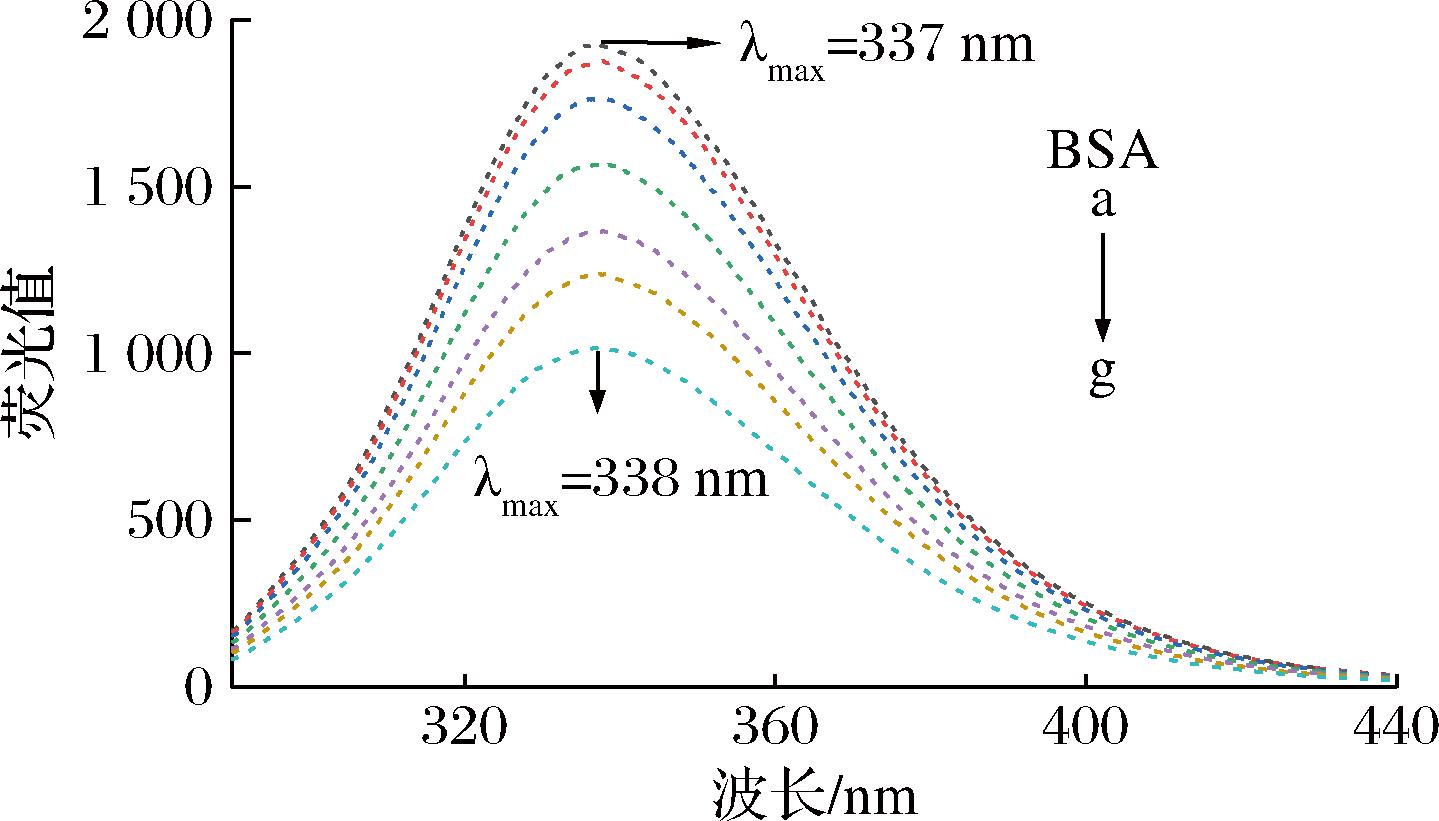
图3 C3G对BSA的荧光猝灭图谱
Fig.3 Quenching of BSA intrinsic fluorescence by C3G 注:a~g C3G浓度分别为0、10、20、40、60、80、100 μmol/L。
2.1.4 荧光猝灭机理分析
荧光猝灭是指荧光分子与其它分子发生作用后出现光强度降低、发光时间缩短乃至停止发光的现象。荧光猝灭可以分为动态猝灭和静态猝灭。动态猝灭作用机制主要通过分子扩散及分子间碰撞,具有Ksv随温度升高而增大的特点;静态猝灭作用机制主要是荧光分子与猝灭剂发生反应生成非荧光性物质,具有Ksv随温度升高而减小的特点[25]。为探究C3G对BSA的猝灭机理,基于公式(1)作出298、308和318 K温度下的Stern-Volmer图,如图4所示,C3G与BSA的Stern-Volmer曲线表现出很好的线性关系,说明二者之间只存在一种猝灭关系[26]。根据Stern-Volmer图计算出BSA与C3G作用后的动态猝灭常数Ksv和猝灭速率常数Kq。由表2可看出,BSA-C3G的Ksv随温度的升高而降低,且Kq均远大于最大碰撞猝灭常数[2.0×1010 L/(mol·s)][23],表明C3G对BSA的猝灭过程是二者形成基态络合物引起的静态猝灭。
表2 不同温度下C3G与BSA结合后的猝灭常数
Table 2 Quenching constants of C3G combined with BSA at different temperatures
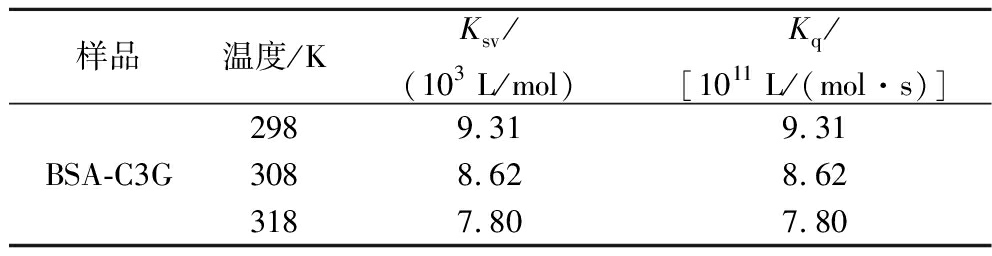
样品温度/KKsv/(103 L/mol)Kq/[1011 L/(mol·s)]BSA-C3G2989.319.313088.628.623187.807.80
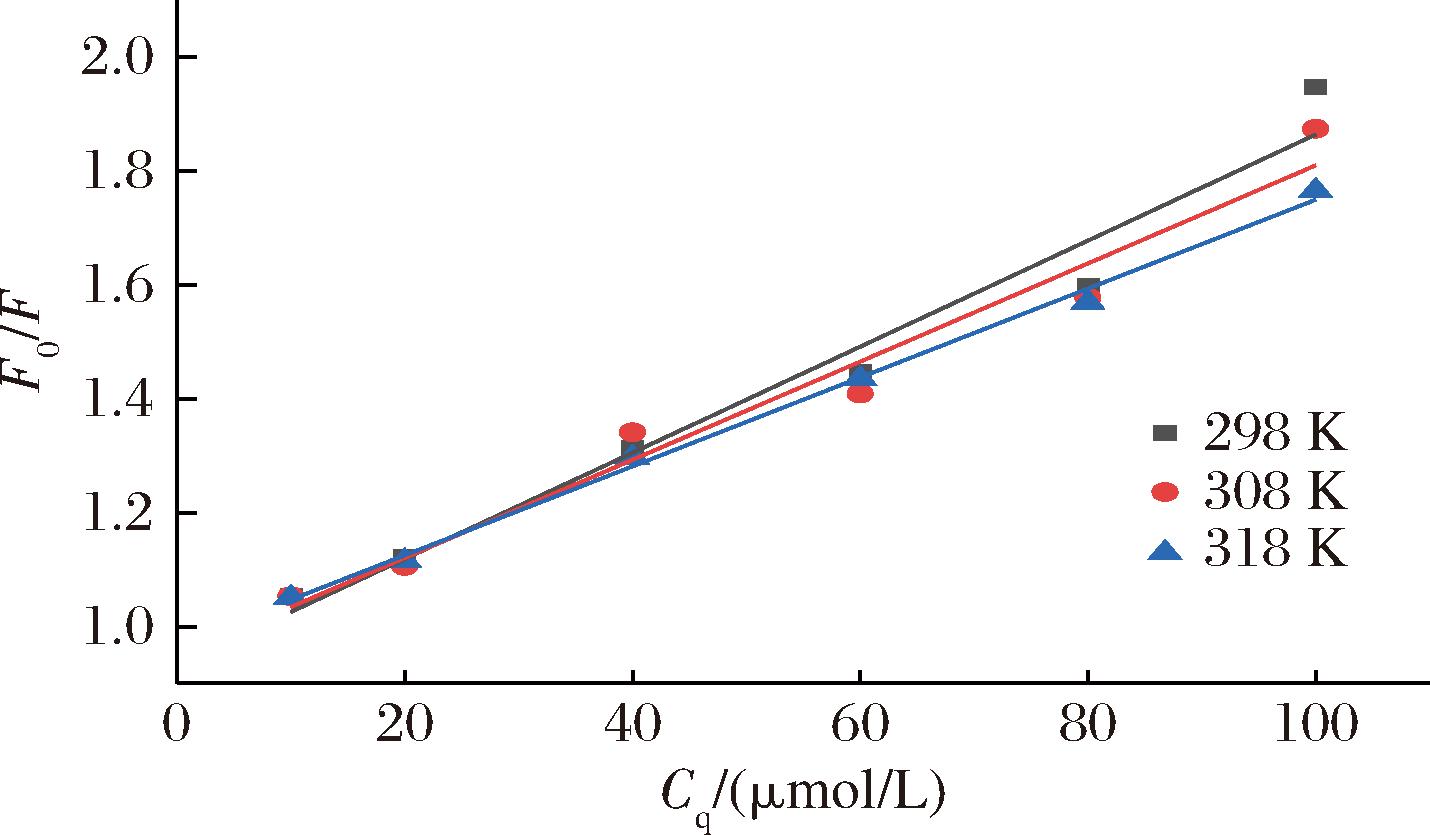
图4 不同温度下BSA-C3G复合物相互作用的Stern-Volmer曲线
Fig.4 Stern-Volmer curves of BSA-C3G complex interaction at different temperatures
2.1.5 结合常数、结合位点数及热力学参数分析
静态猝灭参数根据公式(2)计算得出,并以lg[(F0-F)/F]为纵坐标,lgCq为横坐标作图后得出结合力KA和结合位点数n。KA越大表明物质间结合力越强。由表3可知,随着温度的升高,KA值逐渐下降,说明温度对复合物的稳定性有影响,可能是升温导致蛋白结构发生变化,降低了BSA与C3G之间的结合力。表3中C3G与BSA之间的结合位点数n均约为1,且未发生明显的热诱导变化,说明C3G与BSA是按照摩尔比为1∶1左右的比例相结合,且温度对结合位点数几乎没有影响。
表3 不同温度下BSA与C3G的结合常数(KA)、结合位点数(n)及热力学参数
Table 3 Binding constants (KA), number of binding sites (n) and thermodynamic parameters of BSA and C3G at different temperatures

样品温度/KKA/(×104 L/mol)nΔH/(kJ/mol)ΔG/(kJ/mol)ΔS/[J/(mol·K)]BSA-C3G2985.725 2±0.188 71.204 8±0.042 7-27.1437.093085.298 0±0.317 41.201 8±0.071 9-16.09-27.8538.193183.794 3±0.143 41.171 7±0.032 5-27.8837.06
为探究BSA与C3G结合主要作用力,对其进行热力学分析。如表4所示,蛋白质与生物小分子之间的非共价结合力可通过热力学参数来判断,主要包括范德华力、氢键、静电相互和疏水相互作用。因此,由表3中的热力学参数可知,BSA与C3G之间主要是静电引力(ΔH<0,ΔS>0)。这与HOSSEIN等[19]研究中的BSA-C3G复合物主要作用力为氢键和范德华力不同,可能是本研究中更高的C3G浓度会增强二者之间带电残基相互吸引,静电作用增强。
表4 不同热力学参数对应的作用力类型
Table 4 Types of forces corresponding to different thermodynamic parameters

热力学参数作用力类型ΔH>0,ΔS>0疏水相互作用ΔH>0,ΔS<0静电相互作用、疏水相互作用ΔH<0,ΔS<0范德华力、氢键或质子化ΔH<0,ΔS>0静电相互作用
2.1.6 分子对接
图5展示了BSA与C3G的分子对接模型。对接结果中,蓝色虚线表示为氢键作用,其余作用力位点为疏水相互作用。C3G位于BSA内腔区域,共有5个氨基酸残基参与了与C3G的结合。其中Ser-299、Ser-269、Asp-226、Asp-300和Arg-335与C3G共形成8个氢键,氢键的形成增强了二者结合的非共价作用强度,也可能是C3G的加入改变了BSA的附属结构,防止结构域交换,使得复合物更加稳定[27]。
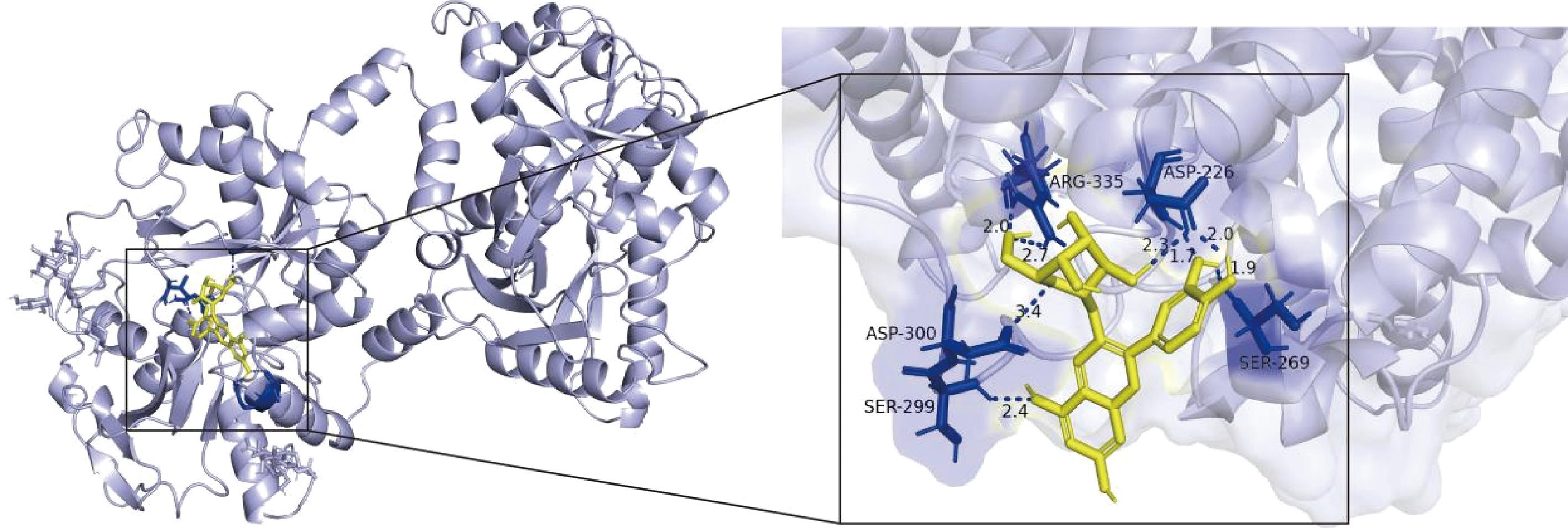
图5 BSA-C3G分子对接模型
Fig.5 Molecular docking model of BSA-C3G
2.2 BSA-C3G蛋白功能特性分析
2.2.1 C3G对BSA粒径和电位的影响
如图6-a所示,在C3G的存在下,BSA粒径从(244.75±9.69) nm增加至(644.70±24.75) nm,可能是C3G与BSA之间的相互作用导致蛋白质结构发生扩展变化,使其体积增大[28],这一结果与本研究的圆二色谱结果一致。多分散性指数(polymer dispersity index,PDI)反映了纳米粒子群的尺寸分布,PDI越大,分子质量分布越宽。结果表明C3G的加入导致蛋白分子质量分布增大。Zeta电位绝对值与溶液稳定性呈正相关,可用于评估溶液系统的稳定性[29]。如图6-c所示,在C3G的存在下,BSA的zeta电位绝对值从(10.80±0.14) mV下降到(0.87±0.04) mV,这可能是由于在BSA-C3G复合物中静电结合位点的形成和电荷中性化效应,使BSA分子表面电荷分布发生改变,这种改变导致了其zeta电位的下降。
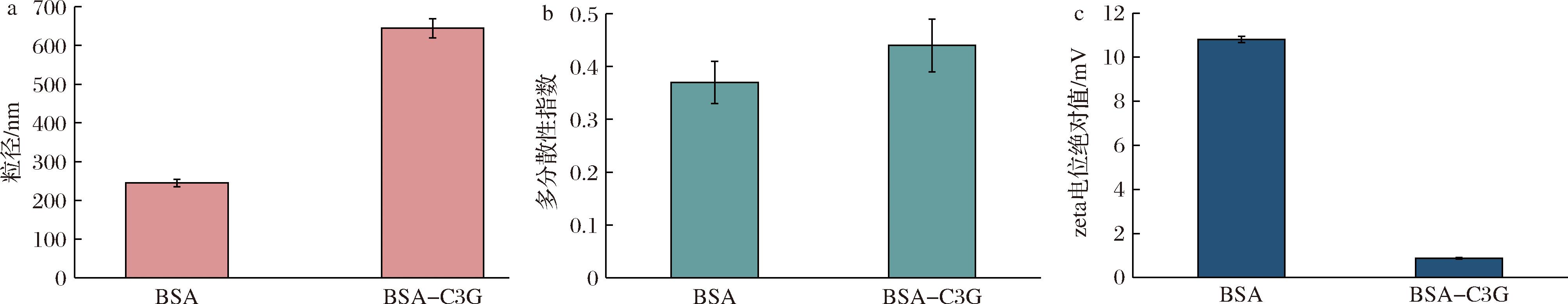
a-粒径;b-PDI;c-zeta电位绝对值
图6 BSA与C3G复合前后粒径、PDI和zeta电位绝对值的变化
Fig.6 Particle size, PDI and zeta potential values with and without C3G in BSA
2.2.2 C3G对BSA溶解性的影响
溶解性是蛋白质的重要功能特性之一。由图7可知,在5 mL溶液体系中,随着C3G添加量的增加,溶液中BSA含量呈现先升高后降低的趋势,当C3G溶液添加量为0.2 mL时,BSA溶解度达到最大值48.75%,较未添加C3G组提高了7.40%。C3G含量较大时吸光度随之下降,吸光度与蛋白浓度呈正比,即BSA溶解度出现降低,这可能是体系中C3G浓度增大,导致蛋白质结合位点被占据,三维网状结构变小,导致光散射降低,吸光度下降[30]。
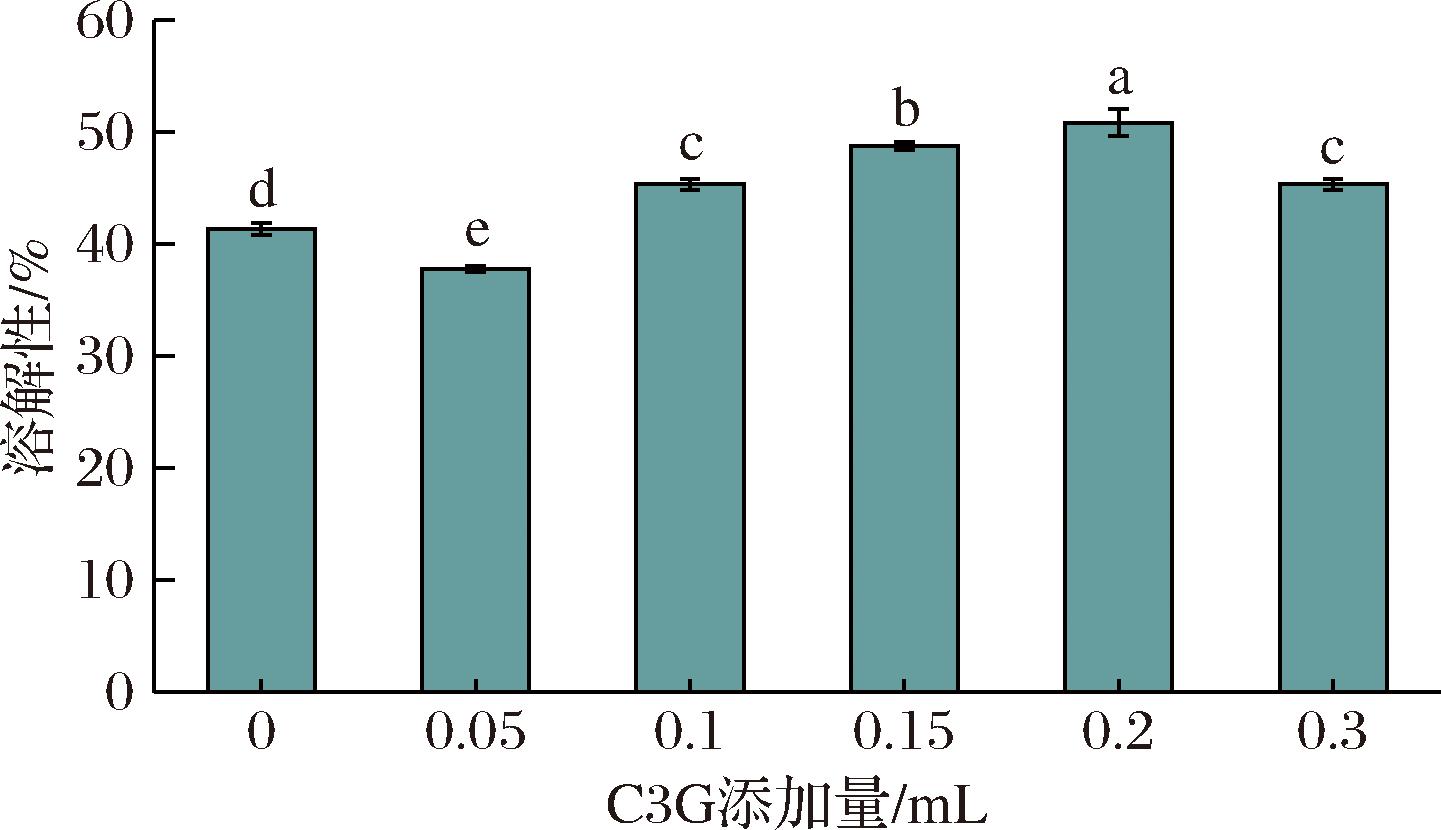
图7 C3G对BSA溶解性的影响
Fig.7 The effect of C3G on the solubility of BSA
注:不同小写字母代表差异显著(P<0.05)(下同)。
2.2.3 C3G对BSA持水性的影响
由图8可知,当体系中C3G添加量为15 mg时,BSA持水性达到146.00%的最大值,较未添加C3G组提高了27.51%。随着C3G含量的增加,BSA与C3G的活性基团会以非共价形式结合形成可溶性络合物,水分子可进入蛋白质空间结构内部进而提高BSA的持水性能。高浓度的C3G可能会影响BSA在水溶液中的溶解度或稳定性,导致BSA分子更容易发生聚集或沉淀现象,从而降低其在水中的持水性。
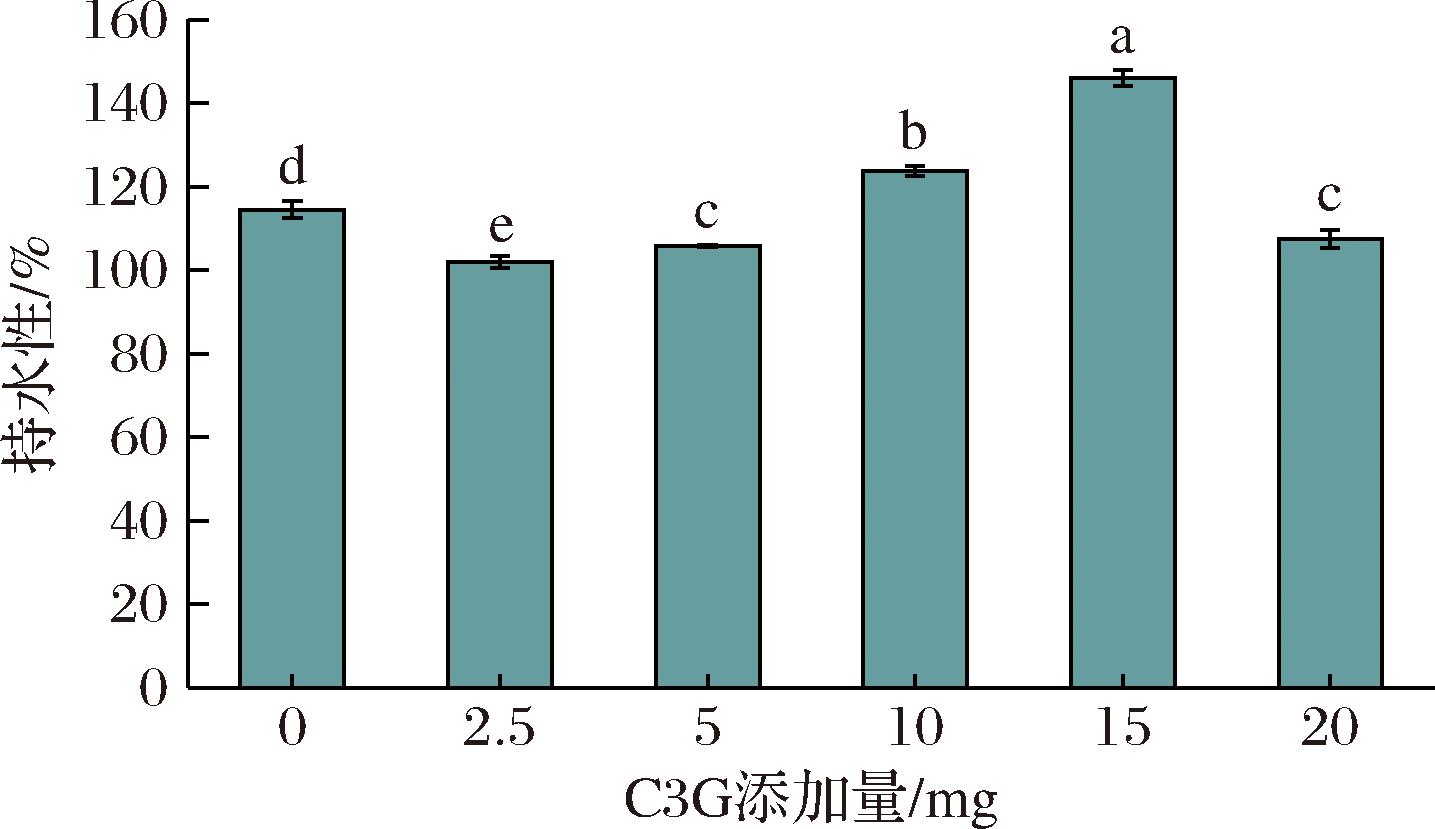
图8 C3G对BSA持水性的影响
Fig.8 Effect of C3G on the water-holding capacity of BSA
2.2.4 C3G对BSA持油性的影响
蛋白质持油性能会影响食品的口感与营养[31]。由图9所示,C3G可显著提高BSA的持油性能,当体系中C3G添加量为50 mg时,BSA持油性达到最大,较空白组提高了32.39%。C3G可能在BSA表面形成稳定的复合物,使得BSA分子的表面疏水性增强。BSA本身具有较好的表面活性,能够包裹油脂分子形成乳液,C3G的加入可能进一步增强这种包覆能力,提高其稳定性。
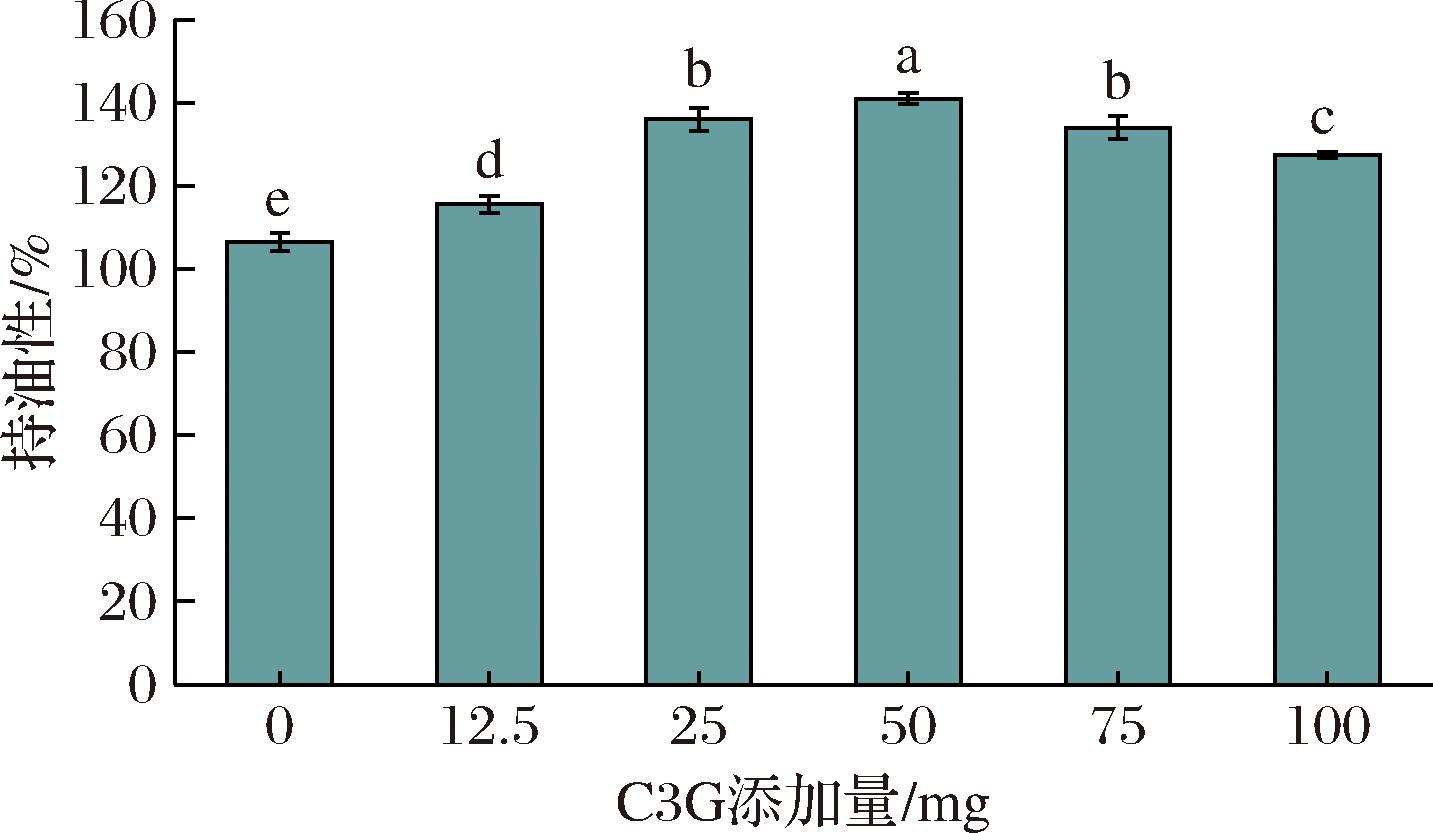
图9 C3G对BSA持油性的影响
Fig.9 Effect of C3G on the oil-holding capacity of BSA
2.2.5 C3G对BSA乳化性的影响
在食品加工中,蛋白质常被用作乳化剂来提升乳液稳定性[32]。如图10所示,随着C3G浓度的增加,BSA的乳化性和乳化后稳定性先升高后降低,可能是适量的C3G可以通过与BSA的非共价相互作用增强BSA分子的结构稳定性,有利于维持乳化后乳液的稳定性,而当C3G浓度超过一定阈值时,过量的C3G可能会竞争性地结合到BSA的表面位点或特定结合位点上,这种竞争性结合会导致BSA分子之间的空间结构变化或部分中性化,从而降低其在乳化界面上的有效包覆能力。当体系中C3G的添加量为40和60 μL时,BSA乳化性能效果较好,这是因为C3G使BSA去结构化,使其蛋白结构松散,更易于在两相界面吸附、重排、去折叠,从而提高其乳化性。
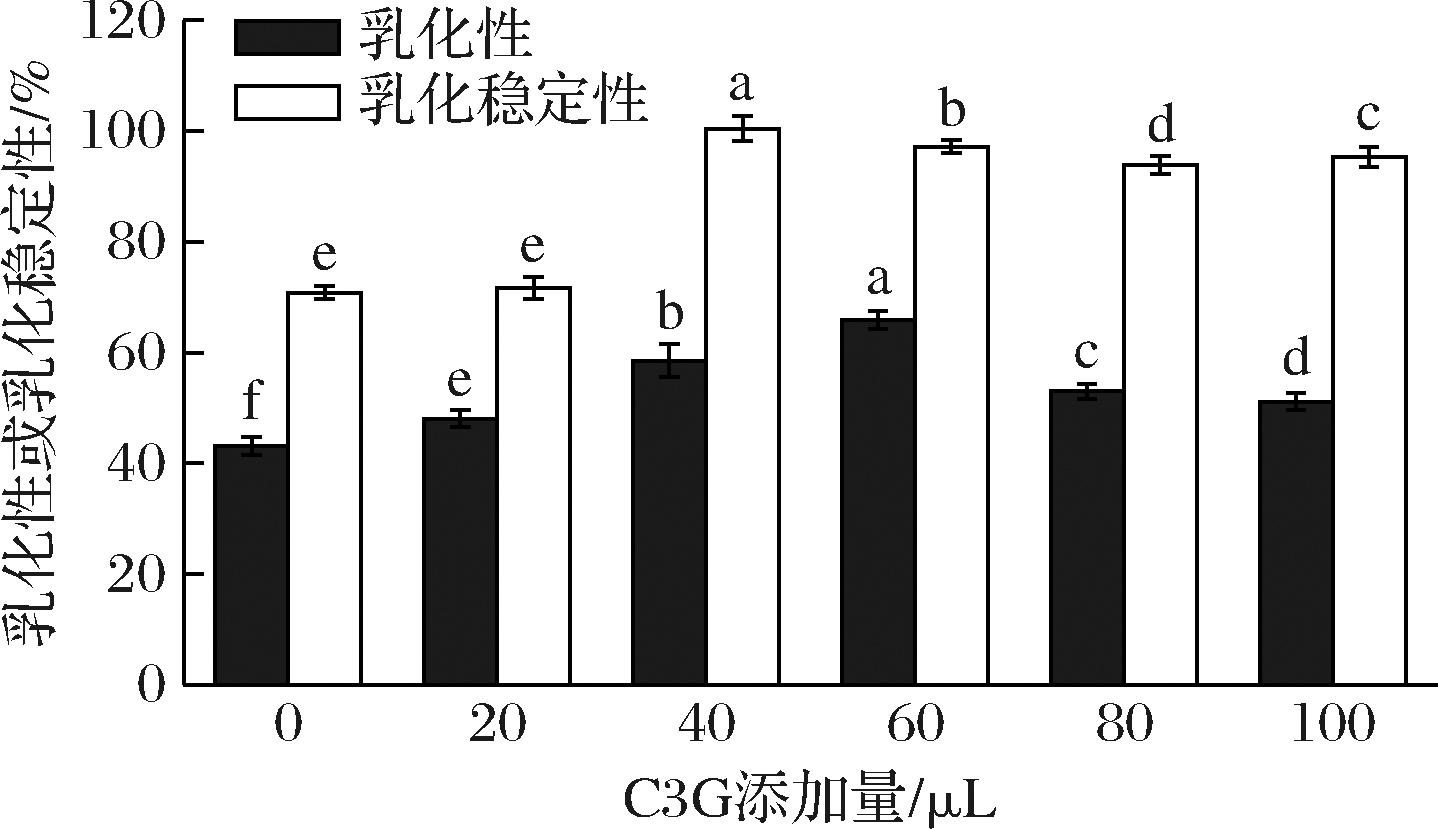
图10 C3G对BSA乳化性和乳化稳定性的影响
Fig.10 Effect of C3G on emulsification and stability of BSA
2.2.6 C3G对BSA起泡性的影响
起泡性和泡沫稳定性分别与蛋白结构伸展和其形成的黏性膜有关[33]。由图11可知,当添加的C3G浓度为20 μg/mL时,BSA起泡性达到最大,较未添加C3G组提高了43.69%;且放置10 min后,泡沫稳定性较未添加C3G组提高了28.05%。C3G对BSA起泡性的提升可能是由于C3G的加入导致BSA分子部分伸展,使更多的疏水基团被暴露,使其在气体与水之间形成弹性薄膜,包裹更多的气体分子,因此提高了BSA的起泡能力和泡沫稳定性。在起泡过程中,BSA通常通过其疏水性区域在气-液界面上形成分子层,从而稳定泡沫。然而,高浓度的C3G可能影响BSA分子的二级和三级结构,使其失去正常的泡沫稳定性,同时过多的C3G也可能促使BSA分子在溶液中发生聚集或沉淀,导致泡沫形成后易于破裂或不稳定。
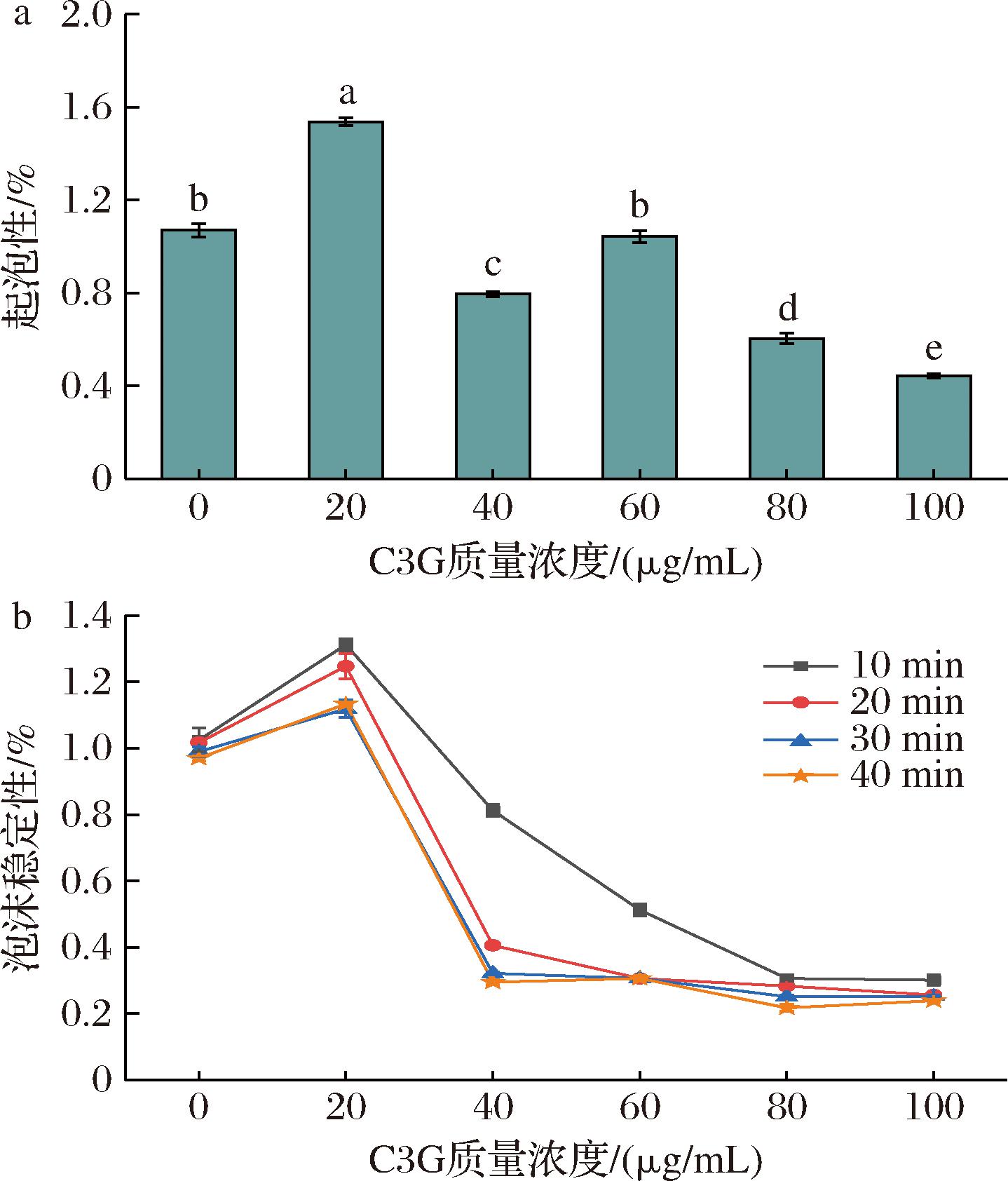
a-起泡性;b-泡沫稳定性
图11 C3G对BSA起泡性和泡沫稳定性的影响
Fig.11 Effect of C3G on foaming properties and foam stability of BSA
3 结论
本文研究表明,C3G可与BSA以非共价作用发生结合,并改变BSA的蛋白结构和蛋白特性。傅里叶红外光谱显示C3G与BSA结后合,酰胺I带和A带发生红移且峰强度减弱。圆二色光谱结果表明C3G使BSA蛋白结构变得松散,BSA二级结构发生改变,α-螺旋含量下降,β-折叠含量增加,无规卷曲含量升高。荧光光谱证实了C3G对BSA的猝灭过程是二者形成基态络合物引起的静态猝灭,且热力学和分子对接也揭示了二者作用力主要为静电引力和氢键作用。通过探究BSA的物理特性发现,C3G的加入可降低BSA的zeta电位绝对值,增大BSA粒径使其结构域扩展、表面静电斥力减小。同时适量添加量下的C3G显著增强了BSA的溶解性、持水性和持油性,以及改善了其泡沫性能和乳化性能。本研究对蛋白饮料体系中加入多酚等物质以提高其蛋白特性具有潜在的应用价值。
[1] ZHANG H M, JIA C L, XIAO Y H, et al.Enhanced stability and bioavailability of mulberry anthocyanins through the development of sodium caseinate-konjac glucomannan nanoparticles[J].Food Chemistry, 2024, 439:138150.
[2] TANG L, ZHANG D, XU S H, et al.Different spectroscopic and molecular modeling studies on the interaction between cyanidin-3-O-glucoside and bovine serum albumin[J].Luminescence, 2014, 29(2):168-175.
[3] AYVAZ H, CABAROGLU T, AKYILDIZ A, et al.Anthocyanins:Metabolic digestion, bioavailability, therapeutic effects, current pharmaceutical/industrial use, and innovation potential[J].Antioxidants, 2022, 12(1):48.
[4] CAO Y, ZHAO B F, LI Y G, et al.Investigation of the difference in color enhancement effect on cyanidin-3-O-glucoside by phenolic acids and the interaction mechanism[J].Food Chemistry, 2023, 411:135409.
[5] GONÇALVES A C, FALC O A, ALVES G, et al.Antioxidant activity of the main phenolics found in red fruits:An in vitro and in silico study[J].Food Chemistry, 2024, 452:139459.
O A, ALVES G, et al.Antioxidant activity of the main phenolics found in red fruits:An in vitro and in silico study[J].Food Chemistry, 2024, 452:139459.
[6] BASHLLARI R, MOLONIA M S, MUSCAR C, et al.Cyanidin-3-O-glucoside protects intestinal epithelial cells from palmitate-induced lipotoxicity[J].Archives of Physiology and Biochemistry, 2023, 129(2):379-386.
C, et al.Cyanidin-3-O-glucoside protects intestinal epithelial cells from palmitate-induced lipotoxicity[J].Archives of Physiology and Biochemistry, 2023, 129(2):379-386.
[7] SOOD R, SANJAY, CHOI H K, et al.Potential anti-cancer properties of malvidin and its glycosides:Evidence from in vitro and in vivo studies[J].Journal of Functional Foods, 2024, 116:106191.
[8] YE X, CHEN W, YAN F J, et al.Exploring the effects of cyanidin-3-O-glucoside on type 2 diabetes mellitus:Insights into gut microbiome modulation and potential antidiabetic benefits[J].Journal of Agricultural and Food Chemistry, 2023, 71(50):20047-20061.
[9] ZHANG R J, KOU S B, HU L, et al.Exploring binding interaction of baricitinib with bovine serum albumin (BSA):Multi-spectroscopic approaches combined with theoretical calculation[J].Journal of Molecular Liquids, 2022, 354:118831.
[10] HUSSAIN I, FATIMA S, AHMED S, et al.Biophysical and molecular modelling analysis of the binding of β-resorcylic acid with bovine serum albumin[J].Food Hydrocolloids, 2023, 135:108175.
[11]  AKAR D, ÜSTÜN E.Manganese-based CO-releasing molecules in body fluids:Zetasizer and bovine serum albumin interaction analysis[J].Russian Journal of Inorganic Chemistry, 2023, 68(9):1303-1312.
AKAR D, ÜSTÜN E.Manganese-based CO-releasing molecules in body fluids:Zetasizer and bovine serum albumin interaction analysis[J].Russian Journal of Inorganic Chemistry, 2023, 68(9):1303-1312.
[12] XU X H, HU J Y, XUE H Q, et al.Applications of human and bovine serum albumins in biomedical engineering:A review[J].International Journal of Biological Macromolecules, 2023, 253:126914.
[13] WU Z Q, YUAN C, XIA Q, et al.Pre-coating cRGD-modified bovine serum albumin enhanced the anti-tumor angiogenesis of siVEGF-loaded chitosan-based nanoparticles by manipulating the protein Corona composition[J].International Journal of Biological Macromolecules, 2024, 267:131546.
[14] 任雁, 赵丹, 张烨, 等.乳清蛋白的功能成分及其主要应用[J].中国食品添加剂, 2007, 18(1):142-146.REN Y, ZHAO D, ZHANG Y, et al.The functional ingredients of whey protein and the major application[J].China Food Additives, 2007, 18(1):142-146.
[15] CHENG Y, CHEN X, YANG T, et al.Storage stability and multi-spectroscopy analysis of the ternary complex induced by mulberry anthocyanin extract interacting with whey protein isolate and rutin under acidic conditions[J].Food Hydrocolloids, 2023, 143:108911.
[16] ZHANG Z Y, YU Q Q, ZHAO S, et al.Determining role of structure in the stability increase of purple sweet potato anthocyanins bound to proteins[J].Food Frontiers, 2024, 5(2):722-734.
[17] TANG L, LI S, BI H N, et al.Interaction of cyanidin-3-O-glucoside with three proteins[J].Food Chemistry, 2016, 196:550-559.
[18] YANG P Q, WANG W X, XU Z Z, et al.New insights into the pH dependence of anthocyanin-protein interactions by a case study of cyanidin-3-O-glucoside and bovine serum albumin[J].Food Hydrocolloids, 2023, 140:108649.
[19] HOSSEIN RAZAVIZADEGAN JAHROMI S, FARHOOSH R, HEMMATEENEJAD B, et al.Characterization of the binding of cyanidin-3-glucoside to bovine serum albumin and its stability in a beverage model system:A multispectroscopic and chemometrics study[J].Food Chemistry, 2020, 311:126015.
[20] KALIRAJAN R, MURALIDHARAN V, JUBIE S, et al.Synthesis of some novel pyrazole-substituted 9-anilinoacridine derivatives and evaluation for their antioxidant and cytotoxic activities[J].Journal of Heterocyclic Chemistry, 2012, 49(4):748-754.
[21] 王晨雨, 陈成诚, 甘宇鑫, 等.基于多光谱技术对原儿茶酸抑制低密度脂蛋白氧化及其与牛血清白蛋白相互作用的研究[J].光谱学与光谱分析, 2024, 44(6):1762-1772.WANG C Y, CHEN C C, GAN Y X, et al.The inhibition effect of protocatechuic acid on low-density lipoprotein oxidation and the interaction between this acid with bovine serum albumin based on multi-spectral techniques[J].Spectroscopy and Spectral Analysis, 2024, 44(6):1762-1772.
[22] ZANG Z H, CHOU S R, GENG L J, et al.Interactions of blueberry anthocyanins with whey protein isolate and bovine serum protein:Color stability, antioxidant activity, in vitro simulation, and protein functionality[J].LWT, 2021, 152:112269.
[23] CONDURACHE N N, APRODU I, GRIGORE-GURGU L, et al.Fluorescence spectroscopy and molecular modeling of anthocyanins binding to bovine lactoferrin peptides[J].Food Chemistry, 2020, 318:126508.
[24] ATTARIBO T, JIANG X Z, HUANG G Q, et al.Studies on the interactional characterization of preheated silkworm pupae protein (SPP) with anthocyanins (C3G) and their effect on anthocyanin stability[J].Food Chemistry, 2020, 326:126904.
[25] SHAHABADI N, MAGHSUDI M, KIANI Z, et al.Multispectroscopic studies on the interaction of 2-tert-butylhydroquinone (TBHQ), a food additive, with bovine serum albumin[J].Food Chemistry, 2011, 124(3):1063-1068.
[26] HE Z Y, XU M Z, ZENG M M, et al.Interactions of milk α- and β-casein with malvidin-3-O-glucoside and their effects on the stability of grape skin anthocyanin extracts[J].Food Chemistry, 2016, 199:314-322.
[27] 张潇. 花楸花色苷与酪蛋白作用对稳定性的影响[D].沈阳:辽宁大学.2018.ZHANG X.The mechanism of the interaction of A,nthocyanins(Aronia melanocarpa Elliot)binding in protein[D].Shengyang:Liaoning University, 2018.
[28] WU S F, WANG X C, BAO Y X, et al.Molecular insight on the binding of monascin to bovine serum albumin (BSA) and its effect on antioxidant characteristics of monascin[J].Food Chemistry, 2020, 315:126228.
[29] KONG F H, KANG S M, TIAN J L, et al.Interaction of xylitol with whey proteins:Multi-spectroscopic techniques and docking studies[J].Food Chemistry, 2020, 326:126804.
[30] 岳鑫. 红松种鳞多酚稳定性及其与乳清蛋白相互作用的研究[D].哈尔滨:东北林业大学, 2019.YUE X.Study on stability of polyphenols from Korean pine seed scales and their interaction with whey protein[D].Harbin:Northeast Forestry University, 2019.
[31] 张令文, 李欣欣, 王雪菲, 等.不同品种小麦面筋蛋白的功能性质[J].食品工业科技, 2022, 43(12):77-83.ZHANG L W, LI X X, WANG X F, et al.Functional properties of gluten from different wheat cultivars[J].Science and Technology of Food Industry, 2022, 43(12):77-83.
[32] 望运滔, 王营娟, 白艳红.预处理技术改善蛋白质乳化性研究进展[J].食品与机械, 2020, 36(5):211-215.WANG Y T, WANG Y J, BAI Y H.Recent advances in pretreatment techniques to improve the emulsifying property of proteins[J].Food &Machinery, 2020, 36(5):211-215.
[33] 周若楠. 预热超声对菠萝蜜种子分离蛋白起泡特性及其机制的研究[D].南昌:南昌大学, 2021.ZHOU R N.Study on the foaming properties and its mechanism of jackfruit seed protein isolate induced by preheating and ultrasound treatments[D].Nanchang:Nanchang University, 2021.