高血压是一种常见的生理疾病,其特征是动脉收缩压和舒张压的持续升高,当收缩压达到140 mmHg或舒张压达到90 mmHg时将会引起高血压。此外,高血压作为心血管疾病的主要病症之一,可能诱发一系列健康问题并增加某些疾病的风险,如脑卒、冠心病、心力衰竭、中风以及慢性肾脏疾病等[1]。肾素-血管紧张素和激肽释放酶系统是机体调节血压平衡的重要途径,其中的血管紧张素转换酶(angiotensin converting enzyme, ACE)在血压调节机制中扮演着至关重要的角色,其通过催化血管紧张素I向血管紧张素II(强效的血管收缩剂)的转化过程,显著促进后者的生成,增强血管收缩作用,进而引发机体血压升高[1]。因此,对ACE活性的有效抑制被视为降低血压的一种有效策略[2]。目前临床上广泛应用多种降压药物实现对血压的有效控制,包括化学合成的卡托普利和赖诺普利等,但都不可避免地伴随一定的副作用,如头痛、心率加快、头晕、咳嗽、味觉障碍和皮疹等[1]。鉴于当前对新型无副作用ACE抑制剂的迫切需求,食源性ACE抑制肽因其天然、安全性高、无副作用、易于消化吸收、市场接受度高等优势成为潜在的有益替代品。
蛋白含量丰富的食品原料是制备生物活性肽的重要来源,目前已经从天然植物和动物中鉴定出多种ACE抑制肽:SANGIORGIO等[3]从大豆蛋白水解物中鉴定出ACE抑制肽NDRP;ZHENG等[4]从油棕仁谷蛋白水解物中鉴定出4种ACE抑制肽(ADVFNPR、VVLYK、LPILR和VIEPR),并发现它们显著降低EA.hy926细胞中血管收缩因子内皮素1的含量,并在自发性高血压大鼠中显示出抗高血压作用;ZHANG等[5]从水稻麸皮蛋白中鉴定出2种ACE抑制肽(FDGSPVGY和VFDGVLRPGQ),其半抑制浓度(half inhibitory concentration, IC50)分别为94.05 μmol/L和85.59 μmol/L,并表现出良好的体外ACE抑制活性。因此,从天然产物中分离出新型有效的ACE抑制肽可能在未来抗高血压方面发挥积极作用。传统发酵豆类调味品是日常饮食中很好的植物蛋白来源,它们经微生物发酵有效提高了大豆生物活性多肽的含量,腐乳是其中一种典型的传统发酵豆制品的代表,有必要挖掘腐乳中的ACE抑制肽。
构效关系是预测分子的生物活性与结构定量关系的数学模型,其中量子化学计算、定量构效关系(quantitative structure-activity relationship, QSAR)模型和分子对接已被广泛应用于活性肽的筛选。与传统解析方法(分离纯化多肽-活性判别-质谱测序)相比,计算机辅助筛选活性肽更加快速高效,大大缩短了从原料到多肽的时间,促进了新型活性肽的挖掘。IGBOKWE等[6]利用量子化学和分子对接从薏苡仁中鉴定出3条新型抗氧化肽;建立定量构效模型是研究多肽结构与功能活性关系的另一个重要手段,郭星晨等[7-8]通过3种描述符建立ACE抑制二肽和五肽的定量构效模型,并预测出多肽的IC50值。然而,鲜见ACE抑制四肽的量子化学及QSAR研究。
因此,本研究以油腐乳为研究对象,采用Nano-LC-MS/MS分析鉴定其中的多肽;其次,通过不同数据库筛选油腐乳中无毒、溶解性好、非致敏的ACE抑制四肽;最后,通过分子对接-量子化学计算-QSAR模型联合筛选高活性ACE抑制四肽,并探究ACE抑制四肽与IC50值之间的构效关系,以期为食源性ACE抑制肽的快速筛选和构效关系的解析提供理论参考。
1 材料与方法
1.1 材料与试剂
油腐乳,云南羊泉生物科技股份有限公司;CuSO4、酒石酸钾钠、NaOH、三氯乙酸、甲酸、乙腈(分析纯),天津福晨化学试剂有限公司;蛋白磷酸肽、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(N-[3-(2-furylacryloyl)]-L- phenyalanyl-glycyl-glycine,FAPGG)、ACE和N-2-羟乙基哌嗪-N-2-乙磺酸(2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES)缓冲液,北京索莱宝生物科技有限公司;超滤管,Merck Millipore科技有限公司;C18 SPE固相萃取柱,美国Agilent科技有限公司;娃哈哈纯净水,杭州娃哈哈集团有限公司。
双缩脲试剂的配制:称取1.5 g CuSO4和6.0 g酒石酸钾钠溶于500 mL纯净水中,混匀后加入300 mL 质量分数10%的NaOH溶液,然后使用纯净水定容至1 000 mL备用。
1.2 仪器与设备
T18 basic高速分散机,德国IKA公司;TGL-16G低温高速离心机,宁波新芝生物科技股份有限公司;SHZ-DIII循环水式减压抽滤机,上海秋佐科学仪器有限公司;FD-1A-80真空冷冻干燥机,河北念欣实验仪器有限公司;JJ-6H数显恒温磁力搅拌器,金坛双捷实验仪器厂;DH 3600恒温培养箱,天津泰斯特仪器有限公司;Multiskan Spectrum酶标仪、Easy-nano-LC 1200纳流液相色谱仪、Orbitrap Fusion Lumos质谱仪,美国Thermo Scientific公司。
1.3 实验方法
1.3.1 油腐乳水提物的制备
将样品与纯净水以料液比1∶4(g∶mL)混合,1 000 r/min分散5 min,双层纱布过滤,滤液10 000×g离心10 min,一部分上清液过0.45 μm滤膜后冻干保存备用,另一部分滤液分别采用100、30、10 kDa和3 kDa超滤离心管3 000 ×g离心15 min,各透过液经C18 SPE固相萃取柱除去盐和糖,冻干后的样品-20 ℃保存。
1.3.2 多肽总含量的测定
参考马菲菲[9]的方法并稍作修改。将冻干样品配制为5 mg/mL溶液,与10%(体积分数,下同)三氯乙酸溶液1∶1(体积比)涡旋混合,静置10 min后6 000 r/min离心10 min,收集上清液并使用5%(体积分数,下同)的三氯乙酸溶液定容至50 mL。与双缩脲试剂以3∶2(体积比)混合,室温静置30 min,540 nm测定吸光度。
标准曲线的绘制:配制10 mg/mL蛋白磷酸肽标准液,采用5%三氯乙酸梯度稀释,540 nm分别测定其吸光度。以吸光度A为纵坐标,蛋白磷酸肽的浓度C为横坐标,绘制标准曲线。按公式(1)计算样品多肽含量:
样品多肽含量![]()
(1)
式中:ρ,多肽标准液质量浓度,mg/mL;N,样品溶液稀释倍数;V,待测溶液体积,mL;m,样品质量,mg。
1.3.3 ACE抑制活性的测定
参考ZHANG等[5]的方法测定。采用HEPES缓冲液复溶冻干样品,分别将其浓度配制为0.2、0.4、0.6、0.8 mg/mL和1.0 mg/mL,化学合成药物卡托普利(Captopril)作为阳性对照组。样品组中依次加入40 μL样品溶液、50 μL 1.0 mmol/L FAPGG和10 μL 0.1 U/mL ACE底物;空白组依次加入40 μL HEPES缓冲液、50 μL 1.0 mmol/L FAPGG、10 μL 0.1 U/mL ACE底物。340 nm处测定吸光度值,空白组和样品组的吸光度值分别记为A1和B1;37 ℃孵育30 min后,再次测定340 nm处的吸光度值,其吸光度值分别为A2和B2。ACE抑制率按公式(2)计算:
ACE抑制率![]()
(2)
1.3.4 多肽的鉴定
参考SONG等[10]的方法鉴定多肽。0.1%(体积分数)的甲酸复溶冻干样品后进行分析,色谱条件:色谱柱为PepMap C18,75 μm×25 cm;流动相为0.1%甲酸乙腈溶液;上样量3 μL;线性洗脱,0~60 min;洗脱速度为300 nL/min;柱温设置为40 ℃。质谱条件:离子源喷雾电压2 kV;母离子扫描范围(m/z)为100~2 000;质谱扫描方式为数据依赖采集;碎裂模式为碰撞诱导解离;归一化碰撞能量30。MS1分辨率120 000,离子自动增益控制为7×105,最大注入时间100 ms;MS2分辨率50 000,离子自动增益控制5×104,最大注入时间86 ms。数据分析:串联质谱图经过PEAKS Studio version X软件处理和分析,对Uniprot glycine max数据库进行匹配;数据库匹配时的参数碎片离子质量容许的误差0.02 Da;母离子质量容许误差10 ppm;最大漏切数2;蛋白卡值-10 lgP≥20;至少含1 unique peptide;肽段卡值-10lgP≥20。
1.3.5 ACE抑制肽的筛选
参考ZHANG等[11]的方法并稍作修改,筛选腐乳中的ACE抑制肽:(a)使用Peptide Ranker数据库筛选活性评分>0.5的多肽,活性评分越高,肽具有生物活性的概率越高;(b)使用AHTpin数据库预测活性肽是否为ACE抑制肽;(c)使用Swiss Target Prediction数据库筛选具有ACE潜在靶点且置信度>0.5的多肽;(d)分别使用ToxinPred、AllerTOP v.2.0和PepCalc筛选出无毒、无致敏性和良好溶解性的多肽;(e)使用admetSAR 2.0筛选出人体小肠吸收(human intestinal absorption, HIA)和血脑屏障(blood brain barrier, BBB)良好的多肽。所需生物信息学筛选网站的具体信息见表1。
表1 所需的生物信息学网站
Table 1 Bioinformatics websites used in this study

网站网址功能Peptide Rankerhttp://distilldeep.ucd.ie/Pep-tideRanker/多肽活性预测数据库Swiss Target Predictionhttp://www.swisstargetpredic-tion.ch/多肽靶点预测工具Toxin Pred 2.0https://webs.iiitd.edu.in/raghava/toxinpred2/多肽毒性预测工具Aller TOP v.2.0http://www.ddg-pharmfac.net/AllerTOP/feedback.py多肽致敏源预测工具PepCalchttp://pepcalc.com/多肽溶解性预测工具admetSAR 2.0http://lmmd.ecust.edu.cn/ad-metsar2/药物代谢动力学在线预测工具AHTPDBhttps://webs.iiitd.edu.in/raghava/ahtpdb/ACE抑制肽数据库RCSB PDBhttps://www.rcsb.org/蛋白质数据库
1.3.6 量子化学计算
参考文献[6]的方法,使用Chem Draw 22.2.0构建多肽的分子模型,并利用Gaussian 09 W高精度的密度泛函理论的B3LYP/6-31G(d, p)基组对多肽的构象进行几何优化直到无虚频,确定肽的最终分子构象,并计算其单点能、前线分子轨道、电荷分布和福井函数等,使用Gauss View 6.0和VMD 1.9.3程序可视化结果构象。
1.3.7 QSAR
参考郭星晨等[7]的建模方法,收集文献与AHTPDB数据库中已知IC50值的ACE抑制肽(150个)构建数据集,随机选取120个样本作为训练集构建模型,30个样本作为测试集验证模型,并分析模型的标准回归系数,剔除对lg(IC50)影响不显著的特征值,重新建立得到最佳模型[7]表示活性。采用HELLBERG等[12]及AA index数据库[13]提出的Z-scales、VHSE和SVHEHS 3种氨基酸描述符表征多肽序列,应用偏最小二乘法(partial least square, PLS)将氨基酸残基的疏水性、立体性和氨基酸侧链的电性作为自变量,lg(IC50)作为因变量进行多元线性回归分析并建立QSAR模型。
1.3.8 分子对接
参考文献[5-6]的方法,通过Chem Draw 22.2.0构建多肽配体结构;通过PDB蛋白数据库获得ACE受体蛋白(PDB ID:1O86),使用Discovery studio 2019对受体蛋白进行去水、加氢处理。多肽配体能量最小化后获得最低能量构象,再与ACE受体蛋白进行对接,对接活性腔参数为x=38.977、y=38.645、z=50.183、半径18 Å。对接完成后,使用Discovery studio 2019和PyMOL可视化对接结果。
1.4 数据统计与分析
每组实验均设置3次以上平行实验,采用SPSS 23.0软件进行显著性分析。通过Graphpad Prism 9.5.1软件计算IC50值,并使用Origin 2022绘图。模型建立及分析使用MATLAB 2023b完成。
2 结果与讨论
2.1 油腐乳中多肽及其ACE抑制活性分析
如图1-a所示,随着油腐乳发酵时间的延长,其多肽含量显著升高(P<0.05),在发酵90 d时多肽含量达到最高为(1 535.79±58.13) mg/100 g,这是因为油腐乳中的蛋白在发酵过程中被微生物的酶分解为小分子肽[14]。由于酶在发酵过程中不断富集,所以在发酵90 d时多肽的含量最高,这与HENG等[15]的研究结果一致。因此,此时含有活性肽的可能性更大,故后续对发酵90 d的腐乳进行分析。

a-油腐乳发酵过程中多肽含量的变化;b-不同分子质量多肽的ACE抑制率及IC50值;c-不同浓度样品的ACE抑制率变化
图1 油腐乳中多肽含量变化及各超滤组分的ACE抑制活性分析
Fig.1 Changes of peptides content in oil sufu and analysis of ACE inhibitory activity of ultrafiltration component
注:FSC-RM表示未经分子质量分离的油腐乳多肽,即包含所有分子质量肽的组分;Captopril表示阳性药物卡托普利组;与发酵前组/30~100 kDa组相比,####P<0.000 1;两两比较/与FSC-RM相比,****P<0.000 1,***P<0.001,**P<0.01,ns无显著性差异。
超滤能够以离心力为动力,使用膜分离快速筛选不同分子质量的组分,实现对不同分子质量肽的富集和筛选,被广泛应用于蛋白水解物中多肽的筛选[9,16]。本研究利用超滤截留不同分子质量的多肽,获得4个组分分别为30~100 kDa、10~30 kDa、3~10 kDa和<3 kDa,并测量各个组分的ACE抑制率及IC50值,结果见图1-b和图1-c。由图1-b可知,不同分子质量多肽的ACE抑制活性存在显著差异(P<0.05)。其中,<3 kDa多肽的ACE抑制活性最高(72.22±2.04)%,与阳性药物卡托普利组(97.26±0.57)%的抑制率最接近,其次是3~10 kDa多肽(62.31±4.04)%,最后是FSC-RM(28.19±2.16)%、10~30 kDa多肽(31.91±1.33)%和30~100 kDa多肽(17.53±1.24)%。这可能是因为一般2~10肽具有较高的生物活性[16-17],因此<3 kDa多肽的ACE抑制活性显著高于其他组分。
如图1-b所示,ACE抑制率随样品质量浓度的增长而升高;同一质量浓度下时,3~10 kDa多肽和<3 kDa多肽的ACE抑制率显著高于其他组(P<0.01)。4种超滤组分的IC50值依次为(489.6±4.2) μg/mL(<3 kDa)、(688.5±81.88) μg/mL(3~10 kDa)、(1 506.33±38.4) μg/mL(10~30 kDa)、(2 380.33±408.17) μg/mL(30~100 kDa)。不同浓度多肽的ACE抑制率变化如图1-c所示:ACE抑制率随浓度的增长而升高,且分子质量较小的多肽具有更好的抑制效果。结果表明<3 kDa多肽对ACE活性具有最高的抑制作用,这与SARKAR等[18]从蚕蛹水解出的天然降压肽结果一致,故对其进行进一步的分析。
2.2 油腐乳中多肽的鉴定及ACE抑制肽的虚拟筛选
腐乳样品经过nano-HPLC-MS/MS分析获得其多肽的序列,使用多种数据库预测多肽的生物活性、ACE抑制活性及靶点、毒性、致敏性和溶解性等生物信息学信息,共筛选出7条无毒、溶解性好、具有ACE抑制潜力的四肽(表2)。此外,这7条肽在样品中具有较高的相对丰度且均大于1×106,即表明这些肽在样品中具有较高的含量[16]。
表2 数据库筛选得到的7条潜在ACE抑制肽
Table 2 Seven potential ACE inhibitory peptides identified through database screening
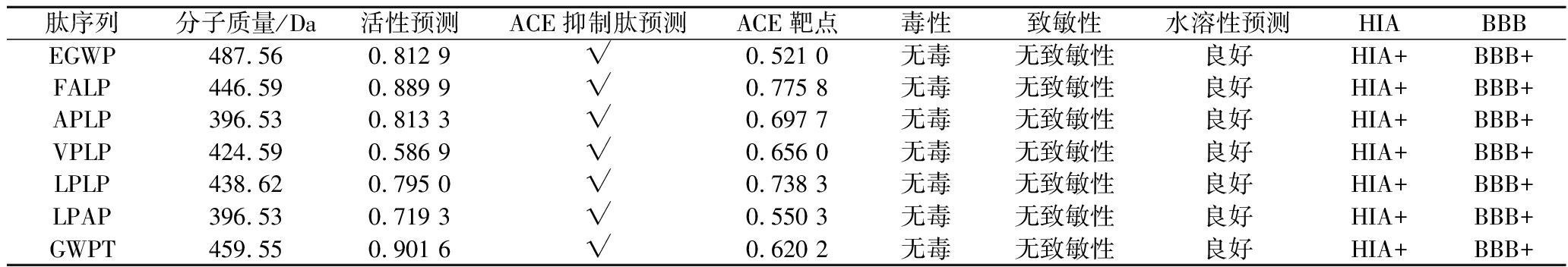
肽序列分子质量/Da活性预测ACE抑制肽预测ACE靶点毒性致敏性水溶性预测HIABBBEGWP487.560.812 9√0.521 0无毒无致敏性良好HIA+BBB+FALP446.590.889 9√0.775 8无毒无致敏性良好HIA+BBB+APLP396.530.813 3√0.697 7无毒无致敏性良好HIA+BBB+VPLP424.590.586 9√0.656 0无毒无致敏性良好HIA+BBB+LPLP438.620.795 0√0.738 3无毒无致敏性良好HIA+BBB+LPAP396.530.719 3√0.550 3无毒无致敏性良好HIA+BBB+GWPT459.550.901 6√0.620 2无毒无致敏性良好HIA+BBB+
2.3 油腐乳中ACE抑制肽的分子对接分析
蛋白质(酶)和小分子(配体)之间的相互作用在增强或抑制蛋白或酶的生物学功能中起主要作用,常使用分子对接技术对其进行分析与预测[19]。如图2所示,筛选的四肽与ACE的结合较为紧密(3D分子对接结构模型图),表明了ACE和油腐乳中的四肽具有较好的匹配性,这为腐乳多肽结合到ACE的活性位点提供了可能。由氨基酸残基相互作用结合模式2D模型可知,筛选的腐乳四肽与ACE的相互作用主要为盐桥、碳氢键、常规氢键、Pi-供体氢键、烷基相互作用、Pi-烷基相互作用和Pi-Pi堆积相互作用。其中,氢键是主要的相互作用力,对模型的稳定性贡献最大,这主要是因为氢键数量的增加有助于ACE抑制剂和ACE受体之间形成稳定的复合物[20-21]。其中,APLP与ACE上的Glu 143、His 353、Ala 354、Ser 355、Ala 356、Trp 357、His 387、Phe 391、His 410、Phe 512和His 513形成氢键相互作用、疏水相互作用及静电相互作用,C端脯氨酸Pro与Zn 701形成金属受体相互作用,增强了其活性;EGWP与ACE氨基酸的Gln 281、His 353、Ala 354、Ala 356、Glu 384、Lys 511、His 513、Tyr 520、Arg 522和Tyr 523位点形成氢键相互作用、疏水相互作用及静电相互作用,色氨酸Trp与Zn 701形成金属受体相互作用,增强了其活性;FALP与ACE氨基酸的Asn 70、Glu 143、His 353、Ala 354、Ser 355、Ala 356、Phe 512、His 513和Val 518位点形成氢键相互作用、疏水相互作用及静电相互作用,C端脯氨酸Pro与Zn 701形成金属受体相互作用,增强了其活性;GWPT与ACE氨基酸的Ala 354、Ala 356、Asp 358、Tyr 394、Arg 402、Glu 403、Pro 407、His 410和Glu 411位点形成氢键相互作用、疏水相互作用及静电相互作用,C端苏氨酸Thr与Zn 701形成金属受体相互作用,增强了其活性;LPAP与ACE氨基酸的Ala 356、Asp 358、Tyr 394、Arg 402、Glu 403、Pro 407、His 410和Val 518位点形成氢键相互作用、疏水相互作用及静电相互作用,C端脯氨酸Pro与Zn 701形成金属受体相互作用,增强了其活性;LPLP与ACE氨基酸的Tyr 69、Glu 143、His 353、Ala 354、Ser 355、Ala 356、His 387、Phe 391、His 513和Val 518位点形成氢键相互作用、疏水相互作用及静电相互作用,C端脯氨酸Pro与Zn 701形成金属受体相互作用,增强了其活性;VPLP与ACE氨基酸的Asn 66、Glu 143、His 353、Ala 354、Ser 355、Ala 356、Phe 391、Phe 512、His 513和Val 518位点形成氢键相互作用、疏水相互作用及静电相互作用,C端脯氨酸Pro与Zn 701形成金属受体相互作用,增强了其活性。此外,在肽-ACE复合物中还存在其他相互作用力,如EGWP和ACE的Lys 511和Arg 522残基之间的静电相互作用,FALP和ACE的His 353、His 513残基之间的疏水相互作用,GWPT和ACE的活性催化位点Zn 701残基之间的金属离子相互作用,这意味着蛋白质与配体之间存在有利的非键相互作用,并有助于多肽与ACE之间形成稳定结合[22]。

a-APLP;b-EGWP;c-FALP;d-GWPT;e-LPAP;f-LPLP;g-VPL
图2 ACE抑制四肽与ACE受体(PDB∶1O86)分子对接结果
Fig.2 Molecular docking results of ACE inhibitory tetrapeptide with ACE receptor (PDB∶1O86) molecules
注:左图是分子对接3D结构模型图,右图是氨基酸残基相互作用结合模式2D模型图。
如表3所示,7条ACE抑制四肽与ACE受体的结合能在-86.827 9 kJ/mol和-55.162 9 kJ/mol之间,表明多肽与ACE受体具有较稳定的相互作用。EGWP与ACE受体之间的结合能(-86.827 9 kJ/mol)最低,其分子对接模型最稳定,这可能是因为其与ACE受体的活性位点形成了10个氢键(最多)密切相关[21],且形成氢键的残基为ACE的S1活性口袋中的Ala 354、Glu 384和Tyr 523,S2活性口袋中的Gln 281、His353、Lys 511、His 513和Tyr 520。另外6条肽的结合能低于EGWP的结合能,虽然它们也与ACE形成氢键,但数量较少(3~5),且其主要结合位点为Gln 281、His 353、Ala 354、Glu 384、Lys 511、His 513、Tyr 520和Tyr 523(图2),这与XIANG等[22]从大蒜蛋白中发现的2种ACE抑制肽(MGR和HDCF)的对接结果一致。
表3 七条ACE抑制四肽与ACE受体的结合能
Table 3 Binding energy of 7 ACE inhibitory peptides to ACE receptors
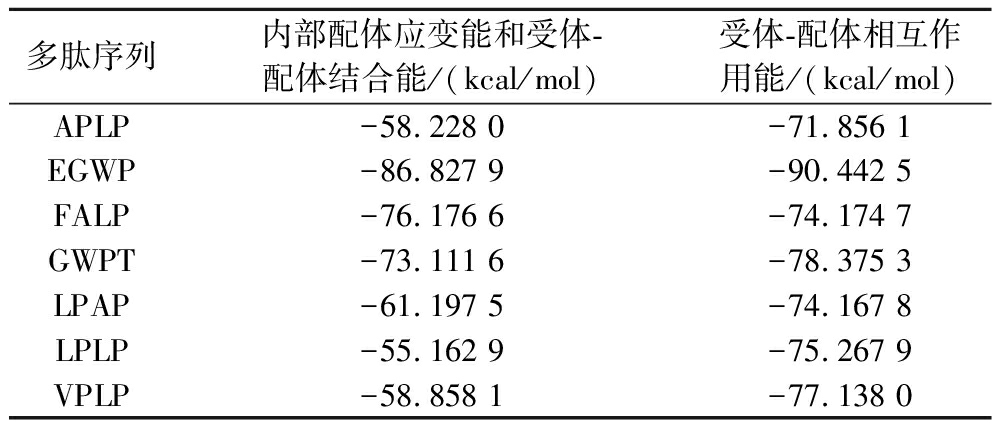
多肽序列内部配体应变能和受体-配体结合能/(kcal/mol)受体-配体相互作用能/(kcal/mol)APLP-58.228 0-71.856 1EGWP-86.827 9-90.442 5FALP-76.176 6-74.174 7GWPT-73.111 6-78.375 3LPAP-61.197 5-74.167 8LPLP-55.162 9-75.267 9VPLP-58.858 1-77.138 0
2.4 油腐乳中ACE抑制肽的量子化学计算
2.4.1 多肽的构象优化
利用B3LYP基组对多肽构象进行优化,7条肽均无虚频并得到它们的优势构象,最终构象结果如图3所示,多肽中含有电负性较大的O和N原子,分子间相互作用可能更大,因此更容易与ACE受体进行结合形成氢键。从图3中可以看出多肽EGWP的空间结构较为舒展,更容易进入ACE受体的活性腔形成氢键,可以竞争性抑制血管紧张素Ⅱ的产生从而降低血压;其他6条肽的空间结构较为紧凑,这可能与能量优化和肽分子内的相互作用有关[23]。
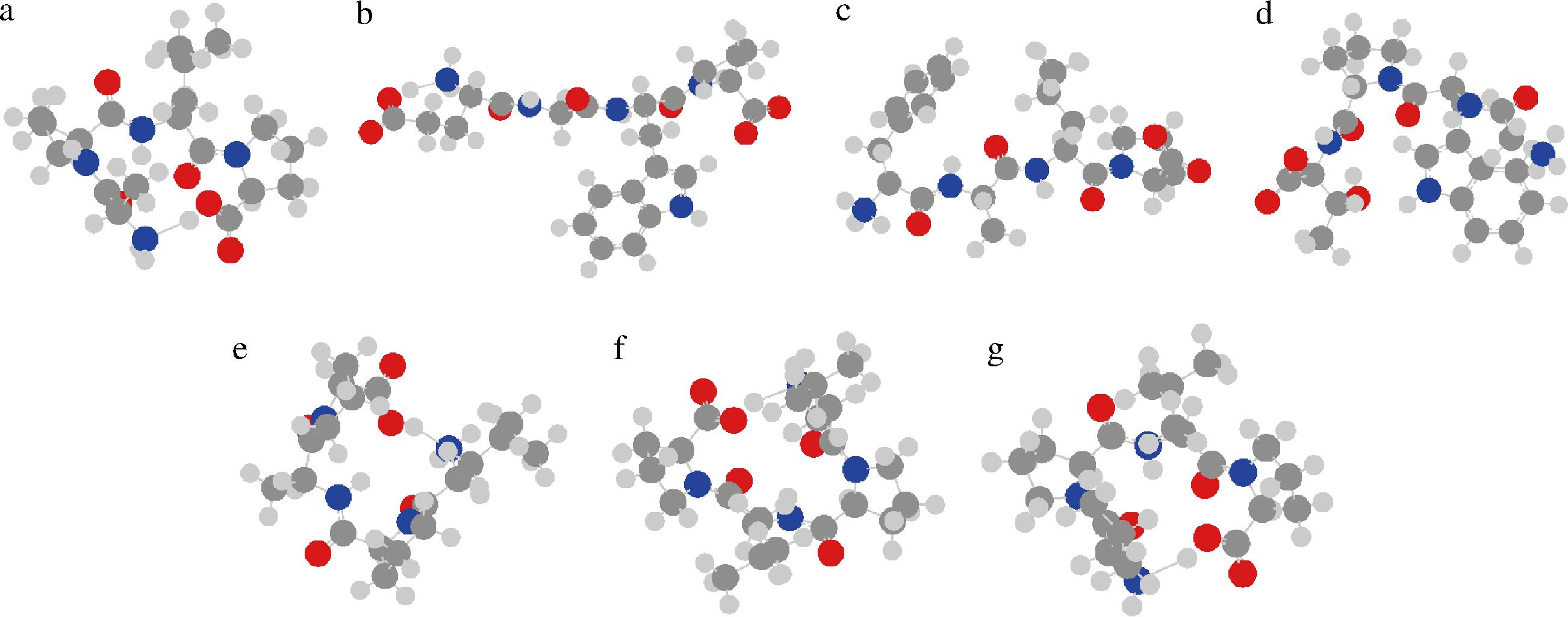
a-APLP;b-EGWP;c-FALP;d-GWPT;e-LPAP;f-LPLP;g-VPLP
图3 七条潜在ACE抑制肽的最优构象
Fig.3 Optimal conformation of 7 potential ACE inhibitory peptides
注:红色表示O原子;蓝色表示N原子;黑色表示C原子;灰色表示H原子。
2.4.2 前线分子轨道分布
前线分子轨道理论认为,分子同样具有不同能级的轨道,经过电子排布后,其中的最高已占轨道(highest occupied molecular orbital, HOMO)和最低未占轨道(lowest unoccupied molecular orbital, LUMO)被认为是分子发生反应的关键,这两个轨道被称为前线轨道。其中HOMO轨道上的电子具有较高能量,性质较为活泼,在发生反应时经常发生电子得失,并决定分子反应的空间位点[23]。因此,对多肽进行前线分子轨道分析能够反应肽分子的活泼性和活性位点。
7条肽的前线轨道如图4所示:肽APLP的HOMO轨道主要分布在N端的脯氨酸上,EGWP的HOMO轨道主要分布在C端的脯氨酸上,FALP的HOMO轨道主要分布在C端的脯氨酸上,GWPT的HOMO轨道主要分布在C端的苏氨酸上,LPAP的HOMO轨道主要分布在C端的脯氨酸上,LPLP的HOMO轨道主要分布在N端的脯氨酸上,VPLP的HOMO轨道主要分布在N端的脯氨酸上。由此可知,HOMO轨道的电子云主要集中在肽两端的脯氨酸上,当多肽分子与受体对接时,这些位置更可能失去电子从而与受体成键,即两端具有脯氨酸残基的多肽可能具有较强的ACE抑制活性,这与ZHANG等[24]的结果相一致。
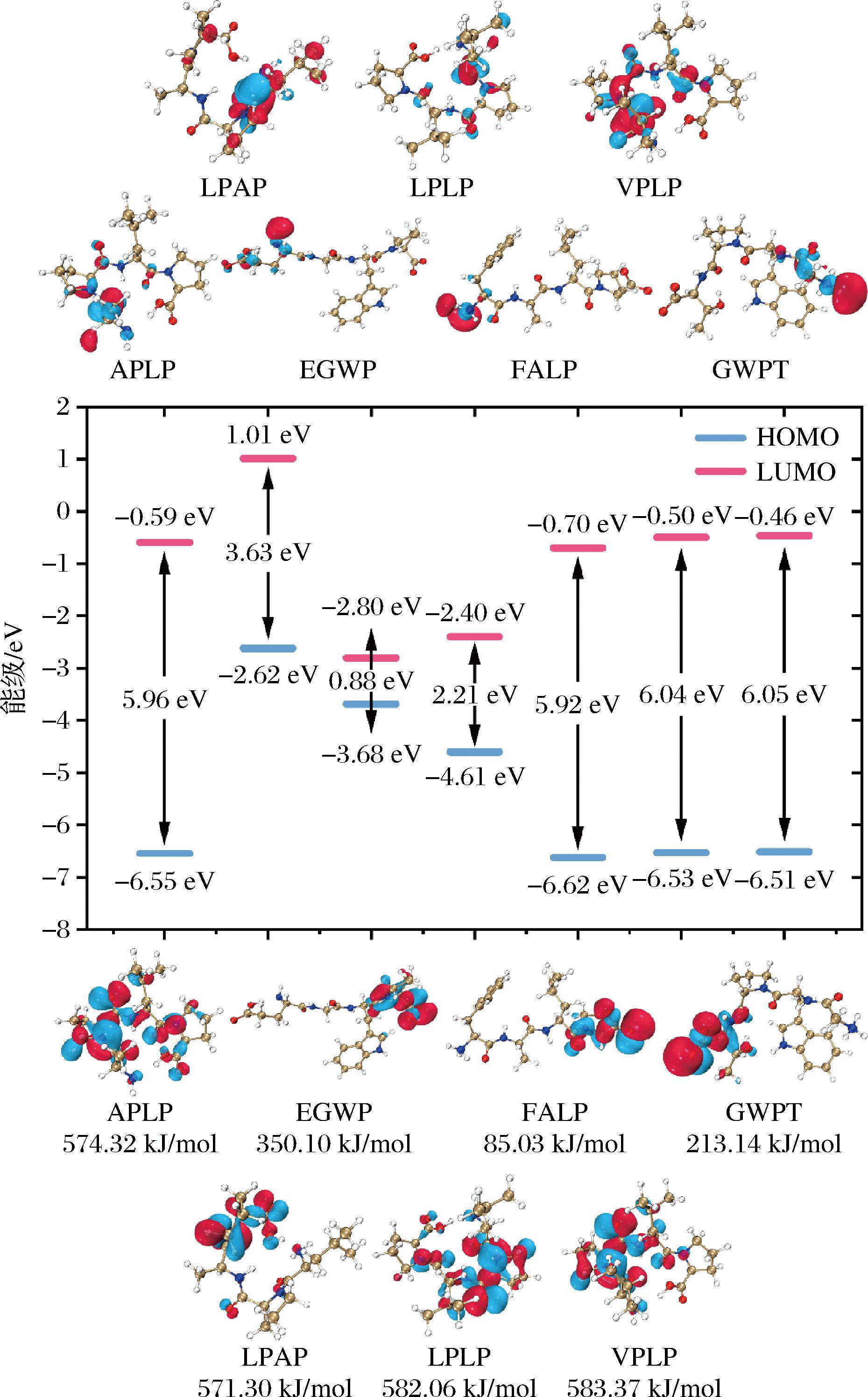
图4 七条ACE抑制肽的前线分子轨道分布
Fig.4 HOMO and LUMO orbit distribution of seven inhibitory peptides
注:多肽从左至右分别为APLP、EGWP、FALP、GWPT、LPAP、LPLP和VPLP;红色为正相位,蓝色为负相位。
进一步对多肽的HOMO和LUMO轨道的能量进行分析,结果见表4。EHOMO越大,表明该轨道电子越不稳定,供电子能力越强;ELUMO越低,表明该轨道电子越稳定,接受电子能力越强;两者的差值(ΔEL-H)可以用于表征多肽分子的电子从基态跃迁到激发态所需要的能量,ΔEL-H值越小则表明多肽的反应活性越强[23]。EHOMO的排序为EGWP>FALP>GWPT>VPLP>LPLP>APLP>LPAP,其中EGWP拥有最高的供电子能力;ELUMO的排序为FALP
表4 七条ACE抑制肽的偶极矩、总能量和前线分子轨道能量
Table 4 Dipole moment, total energy, and frontier molecular orbital energy of 7 ACE inhibitory peptides

肽编号序列偶极矩/(C·m)总能量ERHF/HartreeEHOMO/eVELUMO/eVΔEL-H/eV1APLP4.673 1-1 338.570 3-6.547 1-0.591 85.955 22EGWP10.141 0-1 693.932 9-2.619 41.010 93.630 33FALP41.200 7-1 492.144 0-3.682 5-2.800 90.881 64GWPT27.297 6-1 581.024 6-4.606 3-2.396 22.210 15LPAP9.819 2-1 338.581 5-6.622 2-0.698 25.923 96LPLP4.674 2-1 456.520 9-6.532 1-0.496 66.035 57VPLP4.386 4-1 417.194 8-6.510 9-0.461 86.049 1
2.4.3 电荷分布与静电势
分子轨道理论指出多肽化合物的活性与原子的净电荷密切相关,电荷集中的部位一般是多肽的活性位点[23]。因此,进一步对肽分子的电负性进行分析,结果如图5所示。7条肽的电荷分布规律相近,多肽的正电荷主要分布在C原子和H原子上,负电荷主要分布在O原子和N原子上,电负性较大的O原子更容易成为肽的反应活性中心。由图5可知,多肽FALP的Mulliken负电荷主要集中在N端苯丙氨酸的N原子和C端脯氨酸羧基的O原子上;GWPT的负电荷主要集中在N端苯丙氨酸的N原子和C端脯氨酸羧基的O原子上;EGWP的负电荷主要集中在N端苯丙氨酸的N原子和C端脯氨酸羧基的O原子上。这些结果与分子对接相近,表明这3条肽与ACE结合良好,更可能通过以上位点与受体结合从而发挥ACE抑制作用。这一推论与图2的分子对接结果相一致。
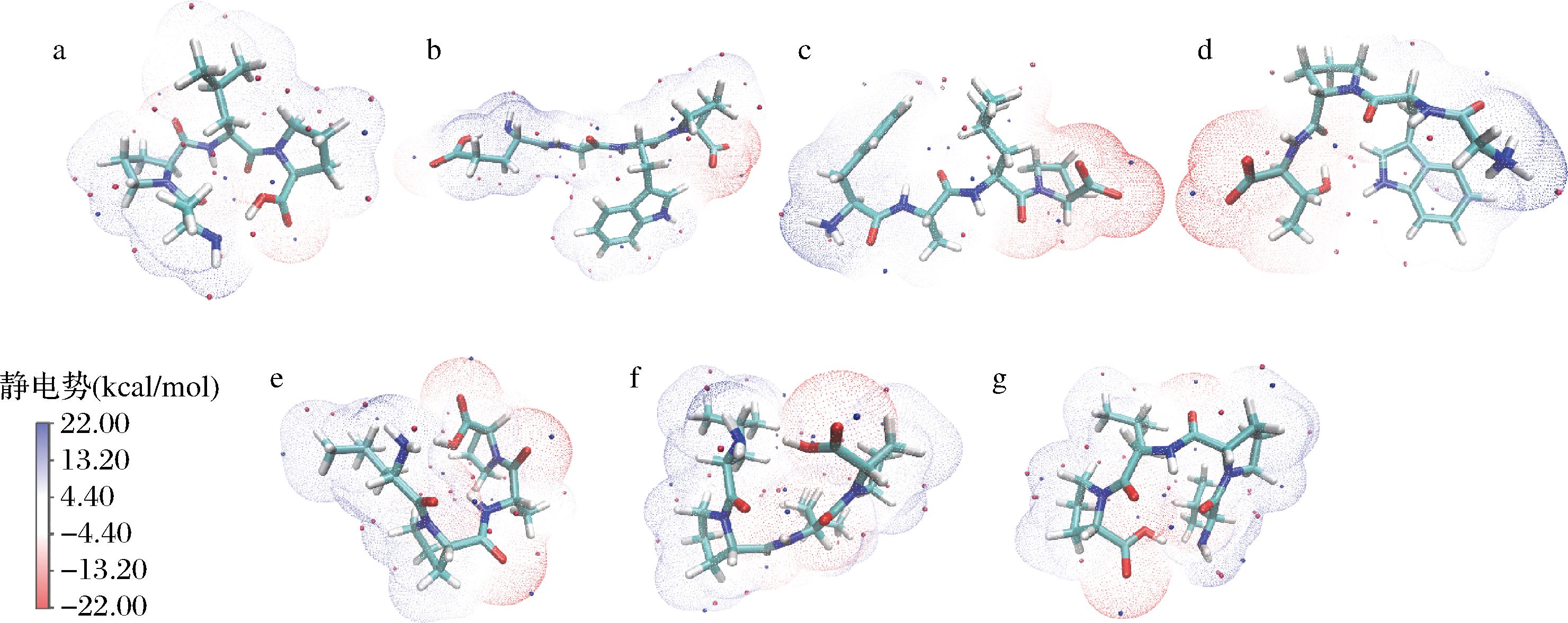
a-APLP;b-EGWP;c-FALP;d-GWPT;e-LPAP;f-LPLP;g-VPLP
图5 七条ACE抑制肽的静电势图
Fig.5 Electrostatic potential diagrams of 7 ACE inhibitory peptides
2.5 油腐乳中ACE抑制肽QSAR模型的建立与分析/预测影响
以自组建的150个ACE抑制四肽作为数据集,各氨基酸的疏水性、立体性和电性特征值作为自变量,lg(IC50)值作为因变量,得到基于PLS的QSAR数据回归预测模型,基于Z-scales、VHSE和SVHEHS氨基酸描述符得模型拟合情况如图6所示。当R2>0.6时,认为模型相关性较高,能够解释的样本占比较高;R2的值越接近1则表明模型的拟合程度越好[7-8]。由图6-a可知,基于Z-scales描述符建立的训练集模型具有最高的拟合度(R2=0.691 3),同时测试集的R2也大于0.6,表明该模型可以较为准确地预测ACE抑制活性;VHSE描述符所建立的训练集模型的R2(R2=0.661 6,图6-b)比Z-scales的略低,而SVHEHS描述符所建立的训练集模型的R2(R2=0.723 8,图6-c)比Z-scales的高,但两者测试集模型验证时的R2均低于0.6,拟合度较差,这可能是由于氨基酸描述符特征值的引入增多,误差变量增多,从而造成拟合能力高于预测能力[7-8],因此两者不能准确地分析QSAR和预测ACE抑制四肽的活性,这与郭星晨等[7-8]的研究结果相似。故选择Z-scales氨基酸描述符建立QSAR模型进行下一步分析。

a-Z-scales;b-VHSE;c-SVHEHS
图6 三种氨基酸描述符对ACE抑制四肽活性实际值与预测值的相关图
Fig.6 Correlation plot of experimental and predicted ACE inhibitory tetrapeptide activity for three amino acid descriptors
采用Z-scales描述符建立的QSAR模型中特征值的标准回归系数如图7-a所示。X2(N端第1个氨基酸的立体特征)、X4(第2个氨基酸的疏水特征)、X10(第4个氨基酸的疏水特征)、X11(第4个氨基酸的立体特征)和X12(第4个氨基酸的电性特征)与四肽的lg(IC50)呈正相关,X1(N端第1个氨基酸的疏水特征)、X3(N端第1个氨基酸的电性特征)、X5(即第2个氨基酸的立体特征)、X6(第2个氨基酸的电性特征)、X7(第3个氨基酸的疏水特征)、X8(第3个氨基酸的立体特征)和X9(第3个氨基酸的电性特征)与四肽的lg(IC50)呈负相关。其中,X5对四肽的ACE抑制活性影响最大;而X1、X2和X12的标准回归系数较小(绝对值<0.05),因此对模型影响不显著,故剔除这3个自变量重新构建模型,得到原回归方程为Y=0.907 9-0.355 5X3+0.144 0X4-0.152 7X5-0.057X6-0.153 3X7-0.292 1X8-0.139 2X9+0.332 9X10+0.286 2X11。综上,ACE抑制四肽两端氨基酸残基的参数特征对活性影响更明显,且氨基酸疏水特征越小和立体性越小、电性越大,其活性越强。

a-模型的标准回归系数直方图;b-训练集实际活性值和预测值的相关性图;c-测试集实际活性值和预测值的相关性图;d-训练集模型预测值对比;e-测试集模型预测值对比
图7 Z-scales描述符对ACE抑制四肽活性的拟合情况
Fig.7 Fitting of the Z-scales descriptor to ACE inhibitory tetrapeptide activity
如图7-b和图7-c所示,优化后的QSAR模型训练集和测试集R2分别为0.681 88和0.728 3,其R2均大于0.6,表明了该模型能够解释150个样本中的占比较大,相关性高,拟合度好。通过测试集检验模型的稳定性和预测能力,测试集R2为0.728 3,并计算其余30个样本四肽的预测值;样本实际值和预测值如图7-d和图7-e所示,所建模型得到的活性预测值与实际值具有良好的线性关系,表明模型能够较准确的预测ACE抑制四肽的活性。
通过Z-scales描述符对EGWP、FALP和GWPT 3种ACE抑制四肽的疏水性、立体性和电性进行分析,得到各氨基酸的特征值并带入回归方程中预测。预测出EGWP的抑制活性为27.841 μmol/L,FALP的抑制活性为87.573 μmol/L,GWPT的抑制活性为0.069 μmol/L,多肽GWPT的IC50值显著小于EGWP和FALP,可能是C端的苏氨酸(T)具备较小的立体性特征引起的[12]。
3 结论
通过研究不同发酵时间的油腐乳的ACE抑制活性,发现超滤分离出4个不同分子质量的多肽组分,随着分子质量的降低,显示出更高的ACE抑制活性;通过nano-HPLC-MS/MS和数据库筛选出7种潜在的ACE抑制四肽,即APLP、EGWP、FALP、GWPT、LPAP、LPLP和VPLP;使用分子对接进一步分析多肽与受体的结合模式,发现7种肽主要通过与受体S1和S2活性口袋的Ala 354、Glu 384、Tyr 523、Gln 281、His353、Lys 511、His 513和Tyr 520等残基位点形成氢键、疏水、静电和金属键相互作用,从而发挥出ACE抑制作用;量子化学计算发现HOMO轨道主要分布在多肽两端的氨基和羧基上;电荷分布结果显示多肽在氨基和羧基靠近C-H键的O原子和N原子具有更高的电负性,更易与受体进行结合;多肽EGWP、FALP和GWPT的能级差较小,具有更高的分子反应活性,推测其ACE抑制活性更好;通过3种氨基酸描述符建立QSAR模型,结果显示四肽两端氨基酸残基的参数特征对IC50值影响更显著,且氨基酸疏水性和立体性越小、电性越大,其活性越强;使用拟合效果最好的Z-scales模型对3条高反应活性肽的IC50值进行预测,其IC50值分别为27.841、87.573 μmol/L和0.069 μmol/L。这些结果表明,通过计算机辅助筛选可以快速筛选出具有高ACE抑制活性的肽段,同时QSAR模型也是筛选预测ACE抑制肽的有效方法,这对ACE抑制肽的快速筛选和活性预测具有积极作用。后期可以考虑采用细胞和动物实验验证其活性。
[1] KAUR A, KEHINDE B A, SHARMA P, et al.Recently isolated food-derived antihypertensive hydrolysates and peptides:A review[J].Food Chemistry, 2021, 346:128719.
[2] SHUKLA P, CHOPADA K, SAKURE A, et al.Current trends and applications of food-derived antihypertensive peptides for the management of cardiovascular disease[J].Protein and Peptide Letters, 2022, 29(5):408-428.
[3] SANGIORGIO S, VIDOVI N, BOSCHIN G, et al.Preparation, characterization and in vitro stability of a novel ACE-inhibitory peptide from soybean protein[J].Foods, 2022, 11(17):2667.
N, BOSCHIN G, et al.Preparation, characterization and in vitro stability of a novel ACE-inhibitory peptide from soybean protein[J].Foods, 2022, 11(17):2667.
[4] ZHENG Y J, LI Y, ZHANG Y L, et al.Purification, characterization, synthesis, in vitro ACE inhibition and in vivo antihypertensive activity of bioactive peptides derived from oil palm kernel glutelin-2 hydrolysates[J].Journal of Functional Foods, 2017, 28:48-58.
[5] ZHANG L Y, MIAO J Y, GUO J B, et al.Two novel angiotensin I-converting enzyme (ACE) inhibitory peptides from rice (Oryza sativa L.) bran protein[J].Journal of Agricultural and Food Chemistry, 2023, 71(9):4153-4162.
[6] IGBOKWE C J, FENG Y Q, LOUIS H, et al.Novel antioxidant peptides identified from coix seed by molecular docking, quantum chemical calculations and invitro study in HepG2 cells[J].Food Chemistry, 2024, 440:138234.
[7] 郭星晨, 李玉豪, 马金璞, 等.基于氨基酸描述符对血管紧张素转化酶抑制五肽定量构效关系分析[J].食品科学, 2024, 45(13):38-48.GUO X C, LI Y H, MA J P, et al.Quantitative structure-activity relationship analysis of angiotensin-converting enzyme inhibitory pentapeptides based on amino acid descriptors[J].Food Science, 2024, 45(13):38-48.
[8] 郭星晨, 李华鑫, 张钰璇, 等.三种描述符对食源性血管紧张素转化酶抑制二肽定量构效关系研究[J].食品与发酵工业, 2024, 50(10):290-297.GUO X C, LI H X, ZHANG Y X, et al.Quantitative structure-activity relationship of angiotensin converting enzyme inhibitor dipeptides based on three descriptors[J].Food and Fermentation Industries, 2024, 50(10):290-297.
[9] 马菲菲. 银杏种仁ACE抑制肽的分离纯化、鉴定及抑制机理的研究[D].合肥:合肥工业大学, 2019.MA F F.Isolation, purification, identification and inhibition mechanism of ACE inhibitory peptides from ginkgo seeds[D].Hefei:Hefei University of Technology, 2019.
[10] SONG W T, FU J X, ZENG Q, et al.Improving ACE inhibitory activity of hazelnut peptide modified by plastein:Physicochemical properties and action mechanism[J].Food Chemistry, 2023, 402:134498.
[11] ZHANG J W, TU Z C, WEN P W, et al.Peptidomics screening and molecular docking with umami receptors T1R1/T1R3 of novel umami peptides from oyster (Crassostrea gigas) hydrolysates[J].Journal of Agricultural and Food Chemistry, 2024, 72(1):634-646.
[12] HELLBERG S, SJÖSTRÖM M, SKAGERBERG B, et al.Peptide quantitative structure-activity relationships, a multivariate approach[J].Journal of Medicinal Chemistry, 1987, 30(7):1126-1135.
[13] 刘静, 彭剑秋, 管骁.基于多元线性回归的血管紧张素转化酶抑制肽定量构效关系建模研究[J].分析科学学报, 2012, 28(1):16-22.LIU J, PENG J Q, GUAN X.Modeling the QSAR of ACE inhibitory peptides based on MLR[J].Journal of Analytical Science, 2012, 28(1):16-22.
[14] 魏冠棉. 油腐乳发酵过程中质地与风味的变化及其形成路径分析[D].无锡:江南大学, 2019.WEI G M.Study on the changes of texture and flavor of oil furu and their formation pathways during fermentation[D].Wuxi:Jiangnan University, 2019.
[15] HENG X Y, CHEN H Y, LU C X, et al.Study on synergistic fermentation of bean dregs and soybean meal by multiple strains and proteases[J].LWT, 2022, 154:112626.
[16] 曲亭菲. 基于多肽组学与生物信息学的海参活性肽筛选及活性研究[D].大连:大连海洋大学, 2023.QU T F.The screening and activities research of sea cucumber-derived peptides based on peptidomics and bioinformatics[D].Dalian:Dalian Ocean University, 2023.
[17] CASTRO-J COME T P, ALC
COME T P, ALC NTARA-QUINTANA L E, TOVAR-PÉREZ E G.Optimization of sorghum kafirin extraction conditions and identification of potential bioactive peptides[J].BioResearch Open Access, 2020, 9(1):198-208.
NTARA-QUINTANA L E, TOVAR-PÉREZ E G.Optimization of sorghum kafirin extraction conditions and identification of potential bioactive peptides[J].BioResearch Open Access, 2020, 9(1):198-208.
[18] SARKAR P, PECORELLI A, WOODBY B, et al.Evaluation of anti-oxinflammatory and ACE-inhibitory properties of protein hydrolysates obtained from edible non-mulberry silkworm pupae (Antheraea assama and Philosomia ricinii)[J].Nutrients, 2023, 15(4):1035.
[19] ZHAO W Z, XUE S Y, YU Z P, et al.Novel ACE inhibitors derived from soybean proteins using in silico and in vitro studies[J].Journal of Food Biochemistry, 2019, 43(9):e12975.
[20] LIANG F Q, SHI Y M, SHI J Y, et al.A novel Angiotensin-I-converting enzyme (ACE) inhibitory peptide IAF (Ile-Ala-Phe) from pumpkin seed proteins:In silico screening, inhibitory activity, and molecular mechanisms[J].European Food Research and Technology, 2021, 247(9):2227-2237.
[21] ZHONG C, SUN L C, YAN L J, et al.Production, optimisation and characterisation of angiotensin converting enzyme inhibitory peptides from sea cucumber (Stichopus japonicus) gonad[J].Food &Function, 2018, 9(1):594-603.
[22] XIANG L, ZHENG Z J, GUO X J, et al.Two novel angiotensin I-converting enzyme inhibitory peptides from garlic protein:In silico screening, stability, antihypertensive effects in vivo and underlying mechanisms[J].Food Chemistry, 2024, 435:137537.
[23] 黄晶晶, 周迎芹, 罗章, 等.皖浙花猪干腌火腿源血糖调节肽的分离纯化、鉴定及量子化学表征[J].食品科学, 2024, 45(3):25-33.HUANG J J, ZHOU Y Q, LUO Z, et al.Isolation, purification, identification and quantum chemical characterization of blood glucose-regulating peptides derived from dry-cured ham of wanzhe spotted pigs[J].Food Science, 2024, 45(3):25-33.
[24] ZHANG T, LI M, FU X D, et al.Purification and charicterization of angiotensin I-converting enzyme (ACE) inhibitory peptides with specific structure X-Pro[J].European Food Research and Technology, 2019, 245(8):1743-1753.