丙烯醛(acrolein,ACR)是一种结构简单、反应活性强[1]的不饱和羰基化合物,广泛存在于各类加工食品中,如烘焙食品(面包、烤肉)、油炸食品(甜甜圈、炸鸡、薯片)、咖啡、酒精饮料、乳酪等,其含量为10~11 300 μg/kg[2-5]。主要源自加工过程中油脂过氧化反应[6]、美拉德反应[7-8]和微生物代谢中甘油脱水[9]。随食品摄入体内的ACR可与DNA、蛋白质、核酸、磷脂发生交联反应,引发细胞毒性和致畸性。目前已有研究表明,ACR能破坏人体的呼吸系统[10]、心血管系统[11]、神经系统[12]、视觉系统[13],甚至损伤DNA[14],近年来引起了国内外医学界和食品界研究人员的的高度重视。因此,有效捕获并清除食品中产生的ACR,降低其对人体健康的风险,是当前亟待解决的科学问题。
国内外已有多项研究报道,天然多酚类、黄酮类化合物、生物碱等在一定程度上可以捕获并清除ACR。例如根皮素、橙皮苷、染料木素和杨梅素等[15-18]。此外,根据本课题组以往的研究发现,多酚类化合物之间的复配对ACR也有协同抑制作用[19]。虽然多酚、黄酮具有良好的ACR捕获功效,但由于一些天然活性产物尚未被批准为食品添加剂,且热稳定性差,导致其在食品中的应用仍存在局限性。因此,研究和开发适用于食品中的ACR抑制剂,提高食品加工安全、降低ACR的摄入和预防慢性疾病具有十分重要的现实意义。
香辛料是加工食品和烹饪食品常用的食品添加剂,常用的天然香辛料,八角、香叶、豆蔻、姜黄等,其中富含多种多酚类化合物,如木犀草素、高良姜素、槲皮素(quercetin,QUE)和姜黄素(curcumin,CUR)等[20];此外,已作为食品增味剂的5′-鸟苷酸二钠(disodium 5′-guanylate,GMP)、5′-肌苷酸二钠(disodium 5′-inosinate,IMP)、茶氨酸(theanine,THE)与谷氨酸钠(monosodium glutamate,MSG)等,均具有伯氨基或仲氨基,ZHONG等[21],JIANG等[22]研究表明GMP、IMP、THE均具有捕获ACR的活性。而香辛料通常多种同时使用,因此,我们筛选多种香辛料,旨在考察哪些组合可以协同捕获加工过程中产生的ACR,在风味增香的同时,兼具捕获有害物ACR的作用,提升香辛料的实用效能。与此同时开发食用型耐高温ACR抑制剂的配方。
本研究拟通过模拟食品加工条件,从常用食品添加剂、香辛料中筛选出7种,首先研究其单独使用对ACR抑制活性的剂量范围,得到半抑制率浓度,进而采用Chou-Talalay方法考察GMP分别与其他化合物联用时抑制ACR的效能,并将具有协同增效作用的组合应用于实际烤肉体系,验证其食用效果,从而开发出耐高温、食品级ACR抑制剂配方。以期为切实解决食品加工中产生的化学危害物的安全隐患奠定理论基础,为提高食品质量提供理论依据。
1 材料与方法
1.1 材料与试剂
IMP、GMP(纯度98%),上海源叶生物科技有限公司;槲皮素、姜黄素(色谱纯),上海麦克林生化试剂有限公司;MSG(纯度≥98%),莲花健康产业集团股份有限公司;茶氨酸(纯度98%),阿拉丁试剂(上海)有限公司;没食子酸丙酯、乙酸(分析纯),上海国药集团化学试剂有限公司;甲醇、乙腈(色谱纯),德国Merck公司;丙烯醛(纯度98%),山东西亚化学工业有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH,纯度>98%),梯希爱(上海)化成工业发展有限公司。
1.2 仪器与设备
1260高效液相色谱仪,安捷伦科技(中国)有限公司;Nanopure超纯水机,美国Thermo Fisher Scientific科技公司;ZQTY-70台式振荡培养箱,上海知楚仪器有限公司;HYQ-3 110涡旋混匀器,美国Crystal公司;PWC 253分析天平,精度0.1 mg,英国ADAM公司;HH-S恒温油浴锅,常州市亿能实验仪器厂;PHS-3E数字式PH计,上海仪电科学仪器股份有限公司。
1.3 实验条件
1.3.1 高效液相色谱法的建立
1.3.1.1 DNPH溶液的配制
精确称取62.5 mg DNPH于47.0 mL乙腈中,并加入3.0 mL HCl溶液(0.1 mol/L),涡旋混匀后超声30 min,溶解后置于4 ℃冰箱中避光储存,有效期为7 d。
1.3.1.2 样品衍生化
参照本实验室前期研究[19],于2 mL离心管中加入500 μL的ACR溶液(0.5 mmol/L)和300 μL的DNPH (6.3 mmol/L)溶液,充分混匀后于37 ℃恒温摇床中,220 r/min避光反应2 h,结束后冰浴,经0.22 μm微孔有机过滤膜过滤后,使用高效液相色谱-二极管列阵检测器(high performance liquid chromatography-diode array detection,HPLC-DAD)检测ACR-DNPH衍生物的含量。体系中ACR抑制率按公式(1)计算:
ACR抑制率![]()
(1)
1.3.1.3 标准曲线的建立
配制0.1 mol/L、pH 7.4的PBS,并稀释ACR储备液,梯度稀释至2、10、25、50、100、250、500、1 000 μmol/L,并按照上述方法衍生化,用HPLC-DAD测定衍生物含量,以ACR标准浓度为横坐标,衍生物峰面积为纵坐标,建立标准曲线。
1.3.1.4 高效液相色谱条件
仪器:Agilent 1260高效液相色谱仪;色谱柱:Waters Symmetry C18色谱柱(250 mm×4.6 mm i.d.,5 μm);紫外检测器;波长372 nm;柱温30 ℃;流速1.0 mL/min;进样量20 μL;流动相0.1%(体积分数)甲酸水溶液(A);乙腈溶液(B);洗脱梯度0~10 min:70% B。
1.3.2 ACR抑制剂的选取
风味香辛料中富含多种多酚类化合物,本文筛选了QUE、CUR、没食子酸丙酯(propyl gallate,PG)、MSG和THE 5种ACR抑制剂。以及2种含氮化合物(GMP和IMP)作为食品中常见风味物质,可为食物增添风味。其中QUE来源于小茴香、草果、山奈、砂仁等多种香辛料;CUR来源于生姜、姜黄等香辛料;PG为油脂抗氧化剂;MSG为食品增味剂;THE是茶叶中的一种氨基酸,主要起生津润甜的作用,同时具备多种生理功能,如舒缓神经、保护神经细胞;MSG具有较好的抗氧化性。
1.3.3 7种物质高温下单独使用对ACR抑制率的测定
配制含1%(体积分数,下同)二甲基亚砜(dimethyl sulfoxide,DMSO)的0.1 mol/L,pH 7.0的PBS,用PBS配制不同浓度的以下溶液和1 mmol/L的ACR溶液,在每个防爆管中分别加入1 mL ACR溶液(0.5 mmol/L)和1 mL化合物DMSO溶液,其浓度分别为:a)GMP溶液浓度:0.5、1.0、2.0、3.0、5.0 mmol/L;b)IMP溶液浓度:0.25、0.5、1、1.5、2.0 mmol/L;c)QUE溶液浓度:0.125、0.25、0.5、1、2.0 mmol/L;d)CUR溶液浓度:0.125、0.25、0.5、1、1.5 mmol/L;e)PG溶液浓度:0.125、0.25、0.5、1、1.5、2.0 mmol/L;f)THE溶液浓度:0.25、0.5、1、1.5、2.0 mmol/L;g)MSG溶液浓度:0.5、1.0、2.0、3.0、5.0 mmol/L。空白组用含1% DMSO的PBS代替样品,涡旋混匀后,于100 ℃恒温水浴30 min,结束后取500 μL反应液,根据1.3.1节中方法进行衍生化,用HPLC-DAD检测衍生物含量,计算不同浓度下,各物质对ACR的抑制率。每个样品均做3组平行。计算出反应30 min时,7种化合物对ACR的半数抑制浓度(IC50)。
1.3.4 二元联用对ACR抑制活性的研究
1.3.4.1 联用原理
采用恒定比添加剂量,以近似两物质或多物质的IC50之比为比率,以接近IC50数值为中点值,按照0.125、0.25、0.5、1、2、4倍的中点剂量联合。联用效果可通过Fa-CI图进行分析。CI<1,CI=1,CI>1分别表示协同,叠加和拮抗作用[23]。
1.3.4.2 GMP与其他6种化合物二元联用对ACR的抑制
用含1% DMSO的PBS(0.1 mol/L,pH 7)配制6组混合液,分别为GMP+IMP、GMP+QUE、GMP+CUR、GMP+PG、GMP+MSG、GMP+THE,每组分别配制有6种终浓度,包括0.125×IC50、0.25×IC50、0.5×IC50、1×IC50、2×IC50、4×IC50。用等体积的PBS溶液代替相应化合物作为对照组。在上述混合液中,加入等比例的浓度为1.0 mmol/L的ACR,涡旋混匀后,置于100 ℃水中反应30 min,反应结束后冰浴冷却,按1.3.1节的方法衍生化并测定衍生物含量,计算抑制率和联合作用指数CI,分析GMP与6种化合物的联合作用效果,筛选出与GMP具有协同作用的化合物。
1.3.5 二元联用在烤肉体系对ACR抑制活性的研究
1.3.5.1 烤肉样品制备
猪五花样品清水洗净后,绞肉机绞碎(肥瘦比3∶7,质量比,分开),每个肉饼20 g(肥肉6 g,瘦肉14 g),置于培养皿(6.0 cm×1.0 cm)中。根据协同时GMP和THE/MSG/QUE的配比,使得最终质量比分别为3.450∶0.288、3.450∶0.831和3.450∶0.241,因此GMP+THE/MSG/QUE烤肉组设置如下,每组均设3个平行。a)空白组:20 g肉饼、1 g食用油;b)GMP组:20 g肉饼、1 g食用油、3.0 mg GMP;c)THE组:20 g肉饼、1 g食用油、0.3 mg THE;d)MSG组:20 g肉饼、1 g食用油、0.8 mg MSG;e)QUE组:20 g肉饼、1 g食用油、0.2 mg QUE;f)G+T复配组:20 g肉饼、1 g食用油、3.0 mg GMP和0.3 mg THE;g)G+M复配组:20 g肉饼、1 g食用油、3.0 mg GMP和0.8 mg MSG;h)G+Q复配组:20 g肉饼、1 g食用油、3.0 mg GMP和0.2 mg QUE。每组按照上述配方在密闭容器中腌制样品2 h后,将猪肉压制成饼状(直径6.0 cm,厚度约1.0 cm),双面刷油1 mL,置于CRTF32K烤箱,180 ℃上下火烤制30 min,烤至15 min时翻面。烤制结束后,将样品沥干水分或油,冷却至室温,储藏至-80 ℃冰箱以备进一步分析。
1.3.5.2 烤肉样品处理
粉碎烤肉样品,称取3.0 g样品于50 mL离心管中,加入5.0 mL蒸馏水,涡旋3 min,超声60 min,8 000 r/min离心10 min,结束后取上清液。再向残渣中加入5.0 mL甲醇-水(1∶1,体积比)混合溶液,重复以上操作,再次取上清液并合并,涡旋混匀,8 000 r/min离心15 min,取上清液按1.3.1节进行衍生化和HPLC分析。
1.3.6 草菇与THE二元联用在烤肉体系对ACR抑制活性及其机制的研究
1.3.6.1 烤肉样品制备
除将含等量GMP的草菇1.5 g,替代GMP以及去除MSG/QUE组和G+M/G+Q组外其他同1.3.5节。
1.3.6.2 烤肉样品处理
样品前处理及衍生化分析处理同1.3.5节。同时另取上清液以备HPLC-MS/MS检测。
1.3.6.3 色谱质谱条件
色谱条件:仪器:Waters Q-IMS-TOF SYNAPT XS。色谱柱:ACQUITY UPLC BEH C18 (2.1 mm×100 mm,i.d.,1.7 μm);柱温40 ℃;流速0.4 mL/min;进样量10 μL;流动相A 0.1%(体积分数)甲酸水溶液,流动相B乙腈;洗脱梯度:0~2 min 5% B;2~5 min 5%~35% B;5~5.1 min 35%~95% B;5.1~6 min 95% B;6.1~8 min, 95%~5% B。
质谱条件:ESI离子源;正/负离子扫描;检测模式MRM;毛细管电压1.5 kV;脱溶剂气温度500 ℃;脱溶剂气流速1 000 L/h;锥孔气流速150 L/h;雾化器流速7.0 bar;碰撞气流速0.15 mL/min。用MassLynx 4.2软件采集分析数据。
1.4 数据处理
文中所有实验均做3组平行。采用Excel 2019软件整理实验数据;使用GraphPad Prism和SPSS 26.0软件进行绘图与统计分析;使用单因素方差分析(one-way analysis of variance,ANOVA)和Tukey’s多重比较比较显著性差异,P<0.05表示存在显著性差异,并用Dunnett法处理数据,结果以“平均值±标准差”表示。
2 结果与分析
2.1 高效液相色谱检测ACR含量
以DNPH为衍生化试剂,将ACR衍生化为DNPH-ACR,采用HPLC测定衍生物含量。由图1可知,经反相色谱柱分离后,DNPH保留时间为3.2 min,ACR-DNPH保留时间为6.4 min,基线分离良好,无其他干扰杂质峰。该方法可在8 min内完成样品中ACR含量的检测,便捷有效。
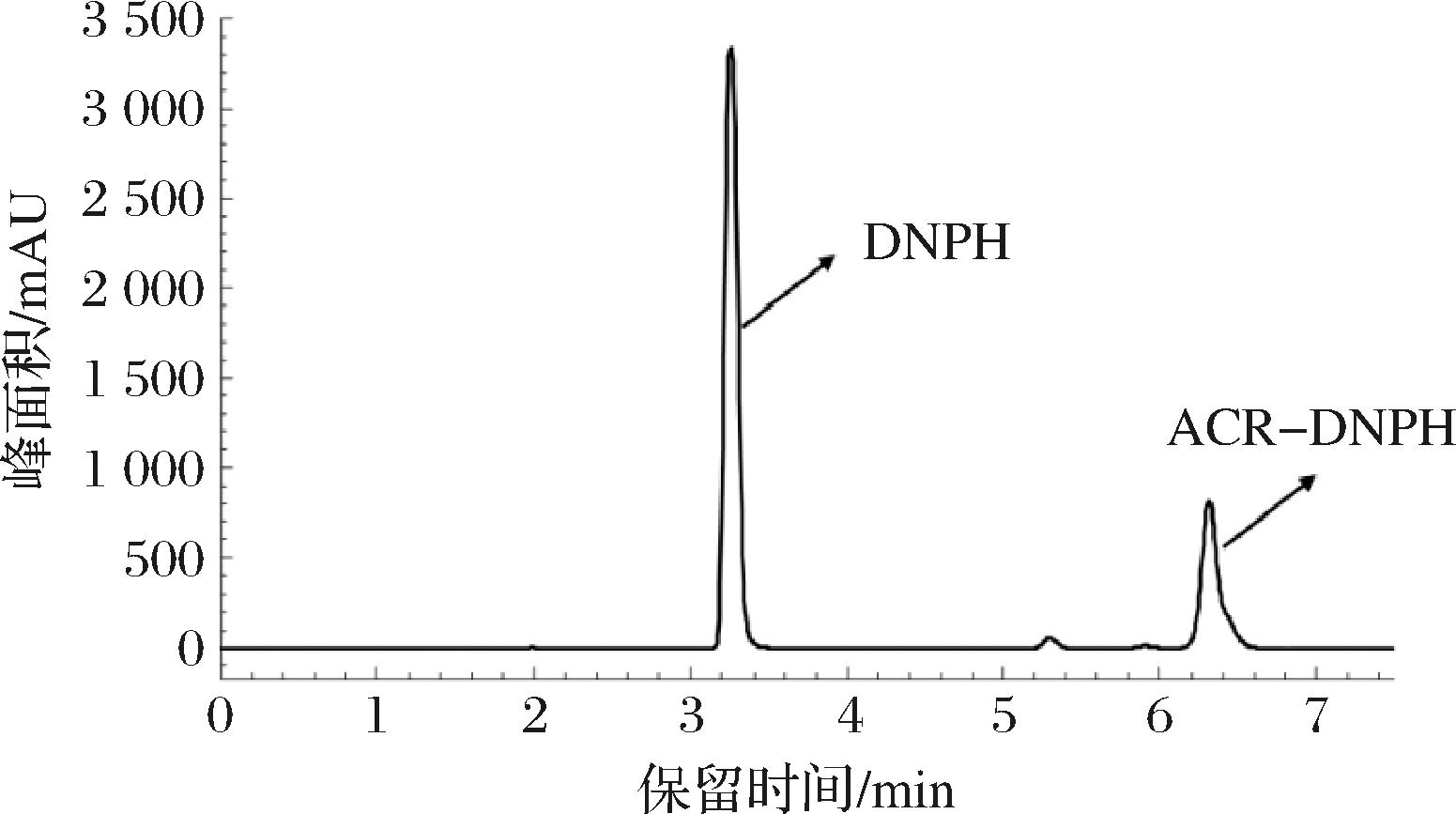
图1 丙烯醛-2,4-二硝基苯肼衍生物高效液相色谱分析图谱
Fig.1 HPLC of the derivant of ACR-DNPH
以ACR标准浓度作为横坐标,纵坐标为ACR衍生物的峰面积,分别绘制低浓度和高浓度范围标准曲线,由图2-a可知,在低浓度范围内(2~75 μmol/L),其线性关系良好,得到线性方程:y=1 290x-1 952.5(R2=0.999 8);由图2-b可知,在高浓度范围内(100~1 000 μmol/L),其线性关系良好,得到线性方程:y=1 270.9x+8 107.5(R2=0.999 7)。
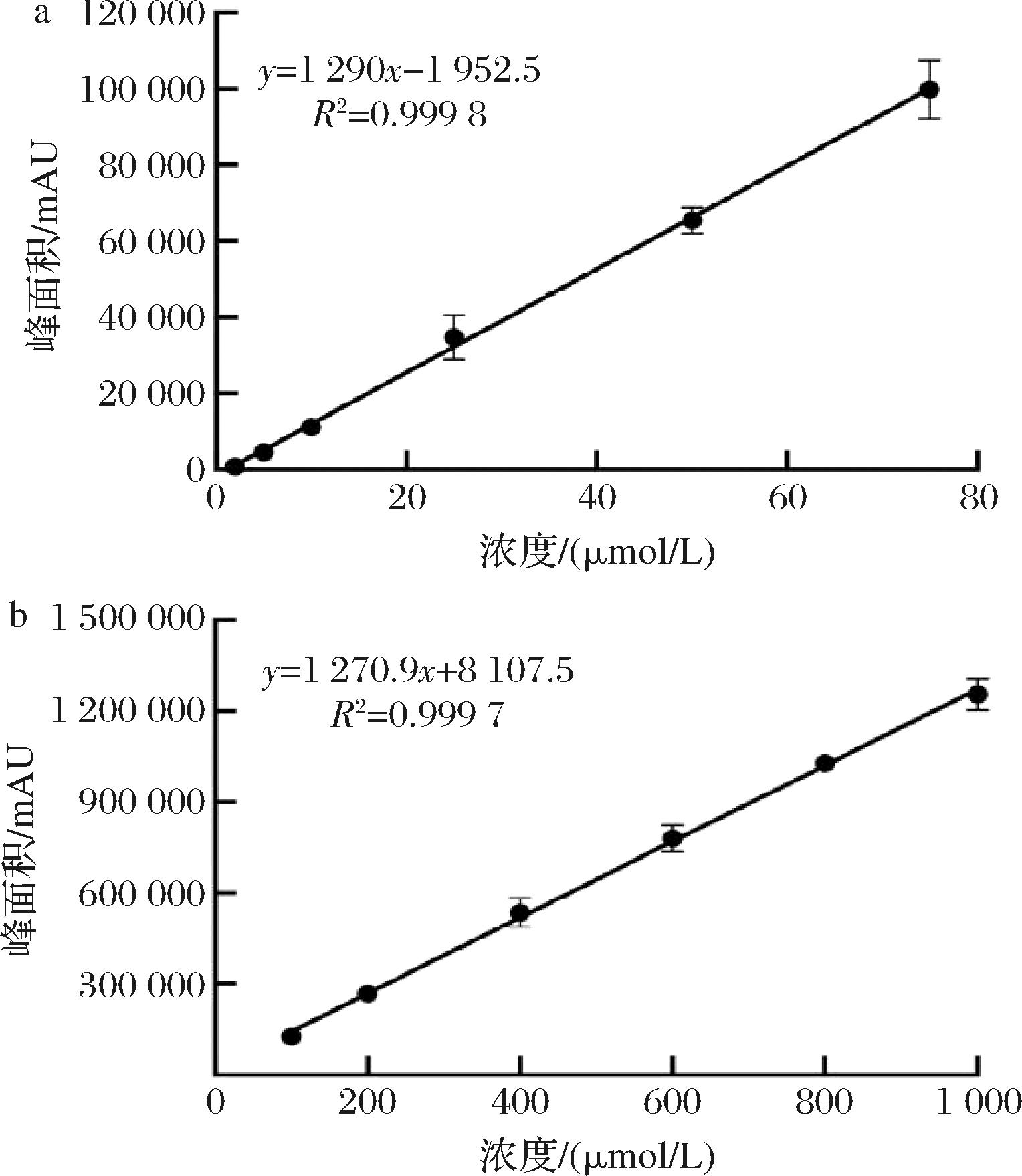
a-2~75 μmol/L;b-100~1 000 μmol/L
图2 丙烯醛标准曲线
Fig.2 Acrolein standard curve
2.2 七种抑制剂单独使用对ACR抑制活性的影响
本实验研究了7种香辛料中常见化合物(鸟苷酸二钠、肌苷酸二钠、没食子酸丙酯、槲皮素、姜黄素、谷氨酸钠和茶氨酸)在模拟高温加工下对ACR的抑制。由图3可知,在100 ℃、pH 7.0的模拟食品加工条件下,鸟苷酸二钠、肌苷酸二钠、没食子酸丙酯、槲皮素、姜黄素、谷氨酸钠、茶氨酸7种化合物,均具有捕获体系中的ACR的能力,且随着浓度的增加,对ACR的清除效果提高。其中以多酚类槲皮素和姜黄素活性最好,清除率最高能达到70%以上。相比之下,风味料等清除活性较弱,由此,拟考察这些ACR抑制剂之间是否存在协同增效性。
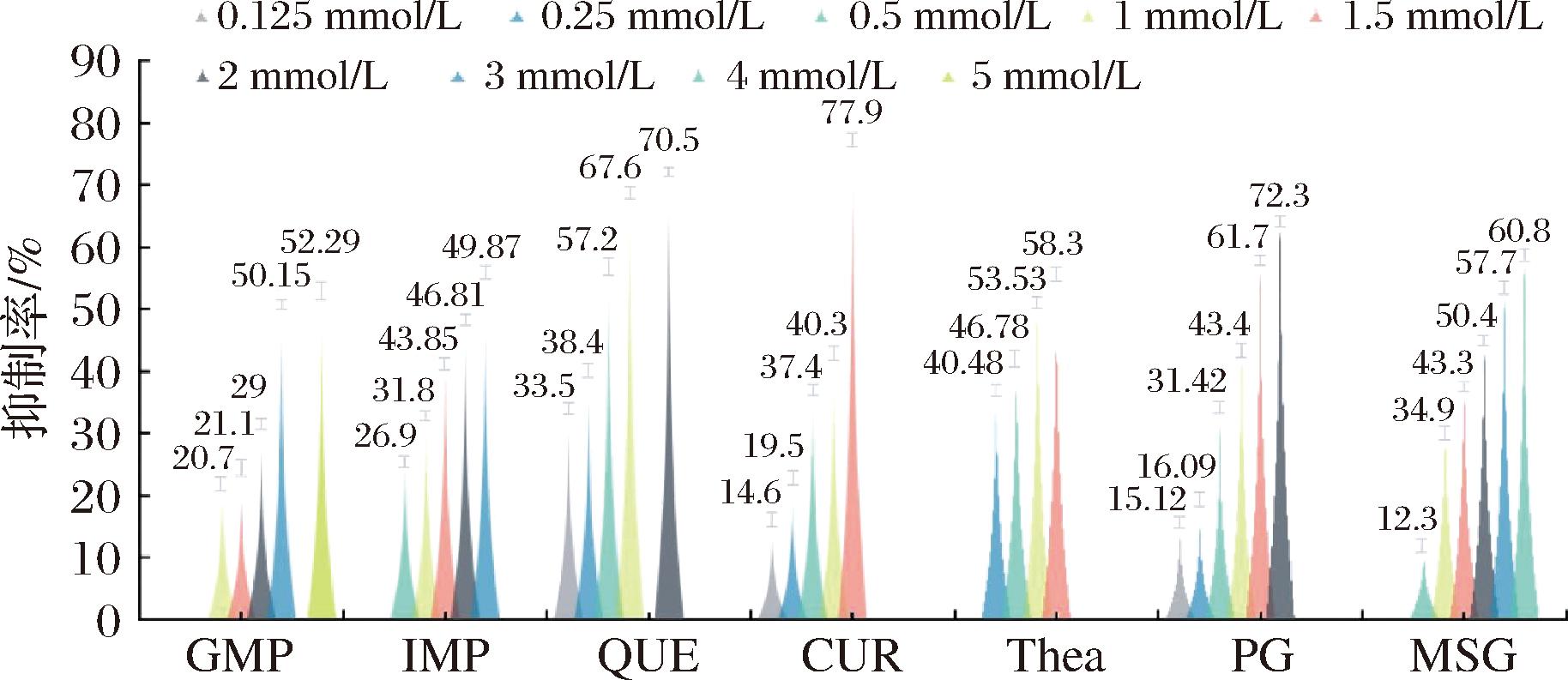
图3 不同浓度化合物对ACR的抑制作用
Fig.3 Inhibitory effects of compounds with different concentrations on ACR
基于不同浓度化合物(0.125~5 mmol/L)对ACR的抑制作用,计算出单独使用7种抑制剂对ACR的IC50,如表1所示。由CHOU等[23]研究可知,IC50值越小,则其抑制活性的能力越强,表1结果表明,7种抑制剂对ACR的抑制活性高到低依次为槲皮素、姜黄素、茶氨酸、没食子酸丙酯、谷氨酸钠、肌苷酸二钠和鸟苷酸二钠。
表1 七种化合物对丙烯醛的半抑制率IC50 单位:mmol/L Table 1 Half maximal inhibitory concentration (IC50) of seven compounds on acrolein
化合物名称鸟苷酸二钠肌苷酸二钠谷氨酸钠没食子酸丙酯茶氨酸姜黄素槲皮素IC504.1563.6862.1891.2250.8290.8310.394
2.3 二元联用对ACR的抑制效果
GMP是一种食品增鲜剂,广泛应用于食品加工及烹饪过程中,且通常与其他添加剂或食源性组分共存,但这些具有抑制ACR活性的物质之间是否存在协同效应,尚未有相关文献报道。由GU等[20]研究得知,与IMP相比,GMP对ACR的抑制更具长效性与稳定性,且GMP的抑制活性并不理想,故拟以GMP为出发点,研究GMP分别与IMP及5种化合物联用是否可发挥协同效应提高其对ACR的抑制活性。
如图4所示,根据Chou-Talalay组合定理,应用CompuSyn软件对混合抑制剂在不同效应时产生的组合指数CI值进行分析,得到了图4中的抑制率-联合指数曲线(Fa-CI),在100 ℃、反应30 min、pH 7.0条件下,GMP与QUE、MSG、THE、CUR、IMP联用,在一定浓度范围内对ACR的清除具有协同效应,而GMP与PG联用则具有拮抗作用。
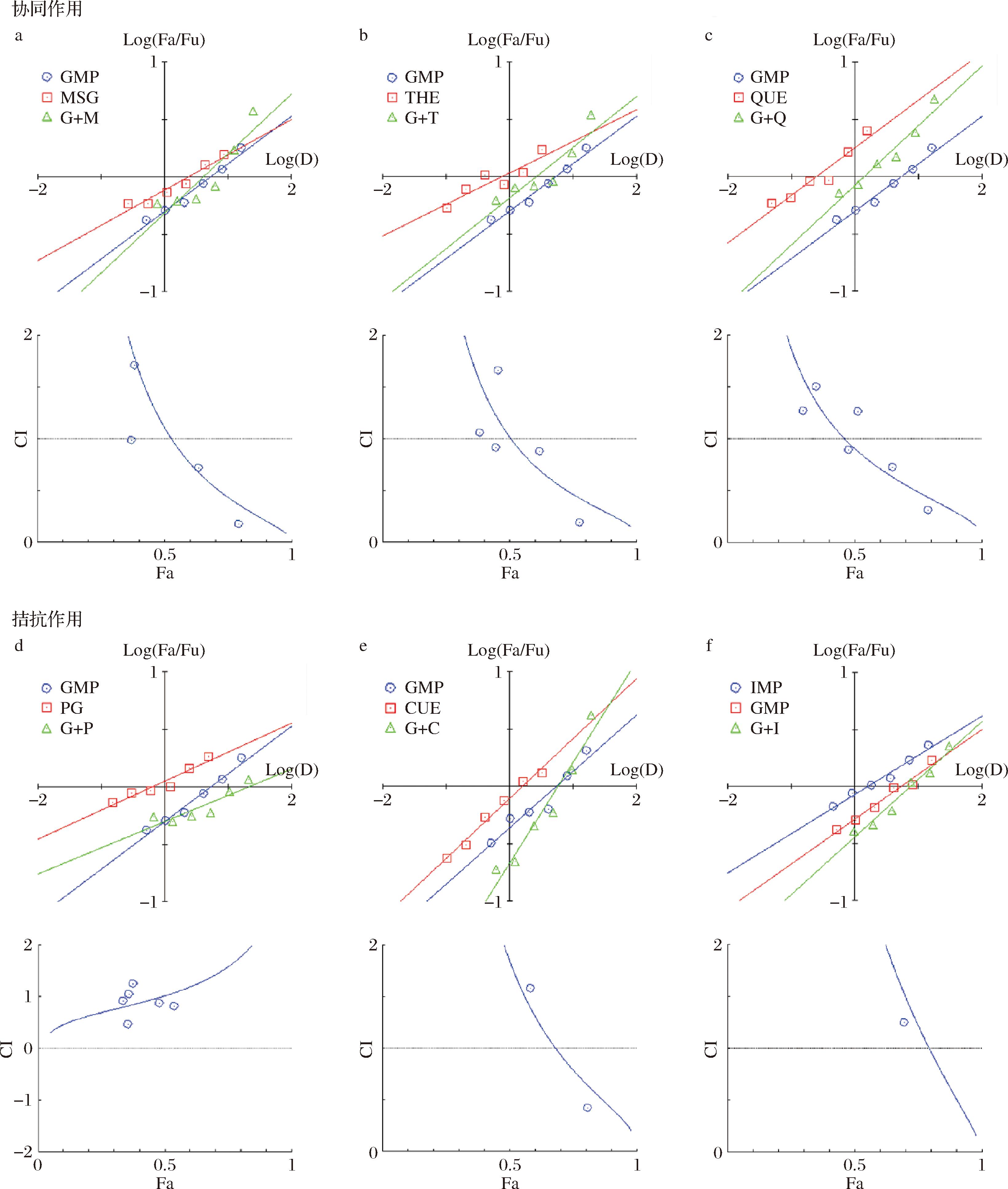
a-GMP与MSG;b-GMP与THE;c-GMP与QUE;d-GMP与PG;e-GMP与CUE;f-GMP与IMP
图4 GMP与6种化合物单独作用及联合作用对ACR抑制作用及联合指数Fa-CI曲线
Fig.4 Inhibitory effect and combined index Fa-CI curve of GMP and six compounds on ACR, both individually and in combination
注:不同大写字母代表不同抑制剂之间的显著性;不同小写字母代表浓度不同的显著性(P<0.05)。
由图4-a可知,低浓度复配时,GMP与MSG联用的CI>1,呈拮抗效应;当复配浓度进一步提升,GMP浓度在8.132~16.624 mmol/L、MSG浓度在4.378~8.756 mmol/L时,两者按IC50比例联用可发挥协同抑制ACR的效果(CI<1)。由图4-b可知,GMP为8.132~16.624 mmol/L、THE为1.658~3.316 mmol/L时,两者按IC50比例联用同样有协同作用(CI<1),且随着复配浓度升高,协同抑制作用更加显著。由图4-c可知,GMP浓度在2.078~16.624 mmol/L、QUE浓度在0.197~1.576 mmol/L时,GMP与QUE联用,对ACR的抑制作用表现出协同性(CI<1)。由图4-d可知,GMP与PG联用后的CI值始终大于1,呈拮抗效应。由图4-e和图4-f可知,当GMP浓度为0.519~8.312 mmol/L,CUR浓度为0.104~1.662 mmol/L时,以及GMP浓度为0.519~16.624 mmol/L,IMP浓度为0.461~14.744 mmol/L时,GMP与CUR/IMP联用对ACR的抑制具有拮抗作用(CI>1)。
由此推断,GMP与MSG、THE、QUE联合使用可发挥协同作用大大提升GMP对ACR的抑制活性,且增强效果与抑制剂复配浓度范围相关,这与ZHONG等[21]发表的多酚化合物之间的复配与浓度的关系相符。因此,选择适当的联用浓度,对于GMP与其他抑制剂间的协同效应起着关键性作用。
2.4 GMP和THE/MSG/QUE联用对猪肉饼烤制中产生的ACR抑制效果
由2.3节可知,GMP与THE/MSG/QUE联用,在一定浓度范围内,对体系中ACR的清除均具有较好的协同效应,因此,分别将GMP与这3种抑制剂复配拟应用于烤猪肉饼实际体系中,考察其对烤肉过程中产生的ACR的抑制活性。如图5所示,当烤猪肉饼中分别单独添加GMP、THE、MSG和QUE时,对ACR的抑制率分别为40.76%、37.55%、38.93%和36.34%;将GMP分别和THE/MSG/QUE联用加入烤猪肉饼后,其对烤肉饼中ACR的抑制率则分别达到62.23%、54.80%和51.66%,表明其均具有协同增效作用。该结果与2.3节中结果相一致,由此可知,GMP与THE/MSG/QUE可以在实际烤肉体系中联合使用,从而发挥其协同增效抑制ACR的作用。其中GMP和THE联用的效果最佳,对ACR的抑制率是单独使用GMP/THE的1.6倍。推测其原因为 GMP与THE具有多个捕获ACR的活性位点[20-21],在烤肉腌制和烤制的过程中,两者可以互相促进对方捕获烤肉中产生的ACR形成加合产物,从而有效降低烤肉中ACR的含量,该协同效应的作用机制和途径目前仍有待进一步研究。
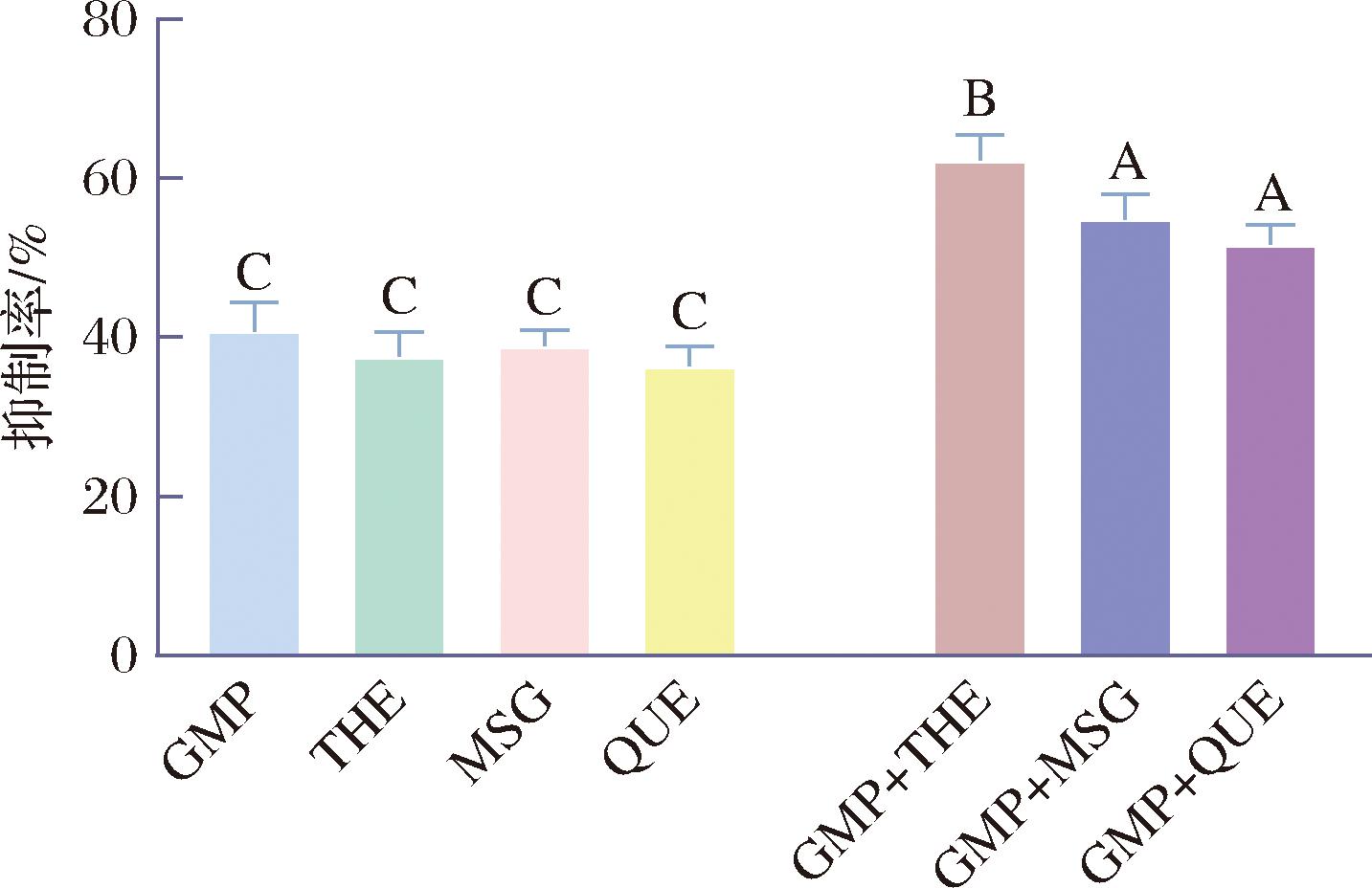
图5 GMP和THE/MSG/QUE单用或联用对烤猪肉饼中ACR的抑制效果
Fig.5 Inhibitory effect of GMP and THE/MSG/QUE alone or in combination on ACR in roasted pork patties
注:不同大写字母表示各个样品的显著差异(P<0.05)(图6同)。
2.5 草菇-猪肉饼添加THE对烤制中产生ACR的抑制效果
由2.4节的结果可知,GMP与THE复配协同增效最为显著,拟将其协同效应进一步拓展其应用范围。GMP不仅可以作为食品添加剂不限量添加到食品中,且食用菌菇产品中含量丰富,干重含量高达1%~3%[24-26]。此外,THE常常作为风味增鲜剂可直接添加到食品中。文献报道草菇的GMP含量最高[24],我们从市场上选取了GMP含量高的草菇,以含等量GMP的草菇替代GMP,按照2.3节结果中GMP与THE最佳复配比例添加到肉饼配方,考察其对ACR的抑制效果。
如图6所示,以等量GMP相当的草菇添加到肉饼中,其对ACR的的抑制率可达38.38%,与直接添加GMP纯品的抑制效果相当,且不存在显著性差异(P<0.05),表明可以使用含等量GMP的草菇对其进行代替;此外,草菇与THE复配对ACR的抑制率可达59.73%,显著高于单独使用草菇和THE的抑制率,且所表现的抑制效果与GMP+THE组相当,两者间不存在显著性差异(P<0.05)。由此可知,一定量的草菇加入肉饼馅中,不仅可以提高肉饼风味,可以作为GMP的替代品,发挥等量GMP对ACR的抑制效果,同时草菇与THE联合使用具有协同增效的作用,可以大大降低高温加工中产生的ACR。THE不仅风味增鲜,同时具有放松、改善睡眠、提升免疫力之功效。因此,本研究通过改善肉饼配方,添加草菇和THE有效降低了化学危害物ACR含量。
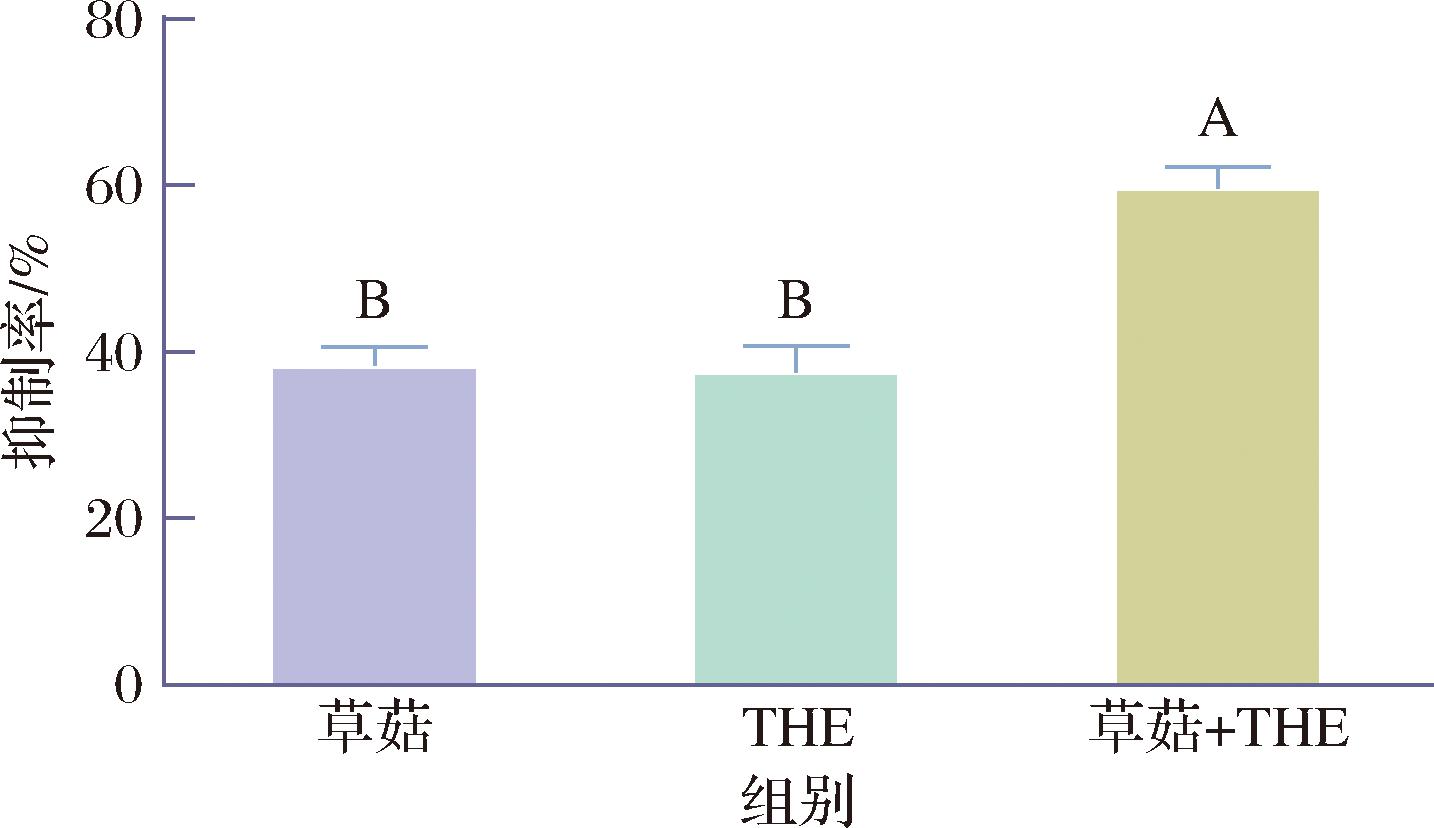
图6 草菇和THE在烤猪肉饼中单用或联合对ACR的抑制效果
Fig.6 Inhibitory effect of mushrooms and THE alone or in combination on ACR in roasted pork patties
2.6 草菇-猪肉饼添加THE对烤制中产生ACR的抑制作用机制
团队前期研究发现GMP和THE均能与ACR发生加合反应,形成其相应的加合产物[20-21],从而达到降低有害ACR的效果。为了进一步验证草菇中的GMP和THE在肉饼烤制过程中发挥清除ACR作用,同时考察在烤猪肉饼中抑制ACR的作用路径,使用HPLC-MS/MS检测烤制后肉饼样品中上述物质的变化。如图7所示,在肉饼样品中分别检出了加合物GMP-ACR、THE-2ACR-1、THE-2ACR-2,其保留时间和MS2中碎片与实验室前期合成并用NMR鉴定结构的3种加合物[20-21]一致;此外,在肉饼样品中也检测到母离子质量为m/z 231 [M+H]+的物质,比THE的母离子质量m/z 175 [M+H]+高56个质量单位(MWACR=56),且在其MS2中产生了m/z 175 [M-56+H]+的碎片离子,推测是由于丢失了1个ACR基团而形成,因此初步判断该物质为THE捕获1分子ACR形成的加合物THE-ACR,与实验室前期在理论体系中的研究一致[21]。由此,可证明以草菇中的GMP与THE复配后,两者均可以有效地捕获实际食品体系产生的ACR,形成各自的加合物,且THE形成的加合物种类更多,从而达到协同抑制烤肉饼中的ACR效果。该结果为GMP和THE能联合应用于食品体系作用路径提供了有效理论依据。

a-GMP;b-GMP-ACR;c-THE;d-THE-ACR;e-THE-2ACR-1;f-THE-2ACR-2
图7 草菇中的GMP、THE与烤猪肉饼中产生的ACR形成的加合物质谱图
Fig.7 Mass spectrum of the adducts formed by GMP or THE in mushrooms and ACR produced in roasted pork patties
3 结论
本文从食品添加剂和香辛料中筛选出的7种化合物,考察其对ACR抑制率,得到半抑制浓度,并根据Chou-Talalay方法进行复配,研究了其在模型中和实际烤肉饼中对ACR的抑制效果。结果显示7种化合物均能有效抑制ACR的产生,且GMP分别与THE、MSG和QUE按照IC50恒定比联用,在一定浓度范围内具有协同抑制ACR的作用,因此,将GMP与这3种抑制剂按照优化的复配比例添加到烤猪肉饼中进一步验证了其协同效应,其中GMP与THE复配时效果最佳,抑制率可达到62.23%,约为GMP/THE单用的1.6倍。此外,以草菇代替GMP联用THE于实际的烤肉体系中,其对烤肉中ACR的抑制率可达59.73%,抑制效果与GMP+THE组间不存在显著性差异,且高于烤肉体系中单独使用GMP和THE的抑制率,由此,证明了以草菇代替GMP清除食品体系中ACR的可行性,其协同作用机制为两者均能捕获ACR形成各自的加合物,从而达到叠加降低烤肉饼中形成的ACR效果。本研究表明风味料的复配可有效抑制高温加工中ACR的产生,为耐高温食源性ACR抑制剂的开发提供理论基础;且为进一步开发风味料的组合配方,提高风味料的兼具增味剂、ACR抑制剂的双效性提供了研究新思路。
[1] ALVARENGA G F, DE RESENDE MACHADO A M, BARBOSA R B, et al.Correlation of the presence of acrolein with higher alcohols, glycerol, and acidity in cachaças[J].Journal of Food Science, 2023, 88(4):1753-1768.
[2] YIN Z, GUO H Y, JIANG K Y, et al.Morin decreases acrolein-induced cell injury in normal human hepatocyte cell line LO2[J].Journal of Functional Foods, 2020, 75:104234.
[3] FERON V J, TIL H P, DE VRIJER F, et al.Aldehydes:Occurrence, carcinogenic potential, mechanism of action and risk assessment[J].Mutation Research/Genetic Toxicology, 1991, 259(3-4):363-385.
[4] SPONHOLZ W R.Analyse und vorkommen von aldehyden in Weinen[J].Zeitschrift Für Lebensmittel-Untersuchung und Forschung, 1982, 174(6):458-462.
[5] BEN HAMMOUDA I, FREITAS F, AMMAR S, et al.Comparison and characterization of volatile compounds as markers of oils stability during frying by HS-SPME-GC/MS and Chemometric analysis[J].Journal of Chromatography B, 2017, 1068:322-334.
[6] LEE C H, CHEN K T, LIN J A, et al.Recent advances in processing technology to reduce 5-hydroxymethylfurfural in foods[J].Trends in Food Science &Technology, 2019, 93:271-280.
[7] YAYLAYAN V A, KEYHANI A.Origin of carbohydrate degradation products in L-Alanine/D-[(13)C] glucose model systems[J].Journal of Agricultural and Food Chemistry, 2000, 48(6):2415-2419.
[8] YAYLAYAN V A, HARTY-MAJORS S, ISMAIL A A.Monitoring carbonyl-amine reaction and enolization of 1-hydroxy-2-propanone (Acetol) by FTIR spectroscopy[J].Journal of Agricultural and Food Chemistry, 1999, 47(6):2335-2340.
[9] RAMIREZ GARCIA A, HURLEY K, MARASTONI G, et al.Pathogenic and commensal gut bacteria harboring glycerol/diol dehydratase metabolize glycerol and produce DNA-reactive acrolein[J].Chemical Research in Toxicology, 2022, 35(10):1840-1850.
[10] JIN L, LORKIEWICZ P, XIE Z, et al.Acrolein but not its metabolite, 3-Hydroxypropylmercapturic acid (3HPMA), activates vascular transient receptor potential Ankyrin-1 (TRPA1):Physiological to toxicological implications[J].Toxicology and Applied Pharmacology, 2021, 426:115647.
[11] ZHU Y J, LIU M J, FU W R, et al.Association between serum aldehydes and hypertension in adults:A cross-sectional analysis of the national health and nutrition examination survey[J].Frontiers in Cardiovascular Medicine, 2022, 9:813244.
[12] CHANG X X, WANG Y D, ZHENG B, et al.The role of acrolein in neurodegenerative diseases and its protective strategy[J].Foods, 2022, 11(20):3203.
[13] HIKISZ P, JACENIK D.The tobacco smoke component, acrolein, as a major culprit in lung diseases and respiratory cancers:Molecular mechanisms of acrolein cytotoxic activity[J].Cells, 2023, 12(6):879.
[14] MONOGRAPHS VOL 128 GROUP I A R C.Carcinogenicity of acrolein, crotonaldehyde, and arecoline[J].The Lancet.Oncology, 2021, 22(1):19-20.
[15] ZHOU Q, GONG J, WANG M F.Phloretin and its methylglyoxal adduct:Implications against advanced glycation end products-induced inflammation in endothelial cells[J].Food and Chemical Toxicology, 2019, 129:291-300.
[16] ZHONG Y Q, LIANG Y, JIA M W, et al.Synephrine, as a scavenger and promoter, cooperates with hesperidin to reduce acrolein levels[J].Food Chemistry, 2024, 431:136896.
[17] HUANG Q J, ZHU Y D, LYU L S, et al.Translating in vitro acrolein-trapping capacities of tea polyphenol and soy genistein to in vivo situation is mediated by the bioavailability and biotransformation of individual polyphenols[J].Molecular Nutrition &Food Research, 2020, 64(1):1900274.
[18] ZHANG D M, JIANG X Y, XIAO L B, et al.Mechanistic studies of inhibition on acrolein by myricetin[J].Food Chemistry, 2020, 323:126788.
[19] LU Y, LIU J, TONG A Q, et al.Interconversion and acrolein-trapping capacity of cardamonin/alpinetin and their metabolites in vitro and in vivo[J].Journal of Agricultural and Food Chemistry, 2021, 69(40):11926-11936.
[20] GU H H, SI B, YANG C, et al.Elimination of acrolein by disodium 5′-guanylate or disodium 5′-inosinate at high temperature and its application in roasted pork patty[J].Journal of Agricultural and Food Chemistry, 2023, 71(50):20314-20324.
[21] ZHONG Y Q, LU Y L, LYU L S.Theanine in tea:An effective scavenger of single or multiple reactive carbonyl species at the same time[J].Journal of Agricultural and Food Chemistry, 2023.
[22] JIANG X Y, LYU H F, LU Y, et al.Trapping of acrolein by curcumin and the synergistic inhibition effect of curcumin combined with quercetin[J].Journal of Agricultural and Food Chemistry, 2021, 69(1):294-301.
[23] CHOU T C.Drug combination studies and their synergy quantification using the Chou-Talalay method[J].Cancer Research, 2010, 70(2):440-446.
[24] WANG J, GUO L Q, LIN J F.Composition of transgenic Volvariella volvacea tolerant to cold stress is equivalent to that of conventional control[J].Journal of Agricultural and Food Chemistry, 2009, 57(6):2392-2396.
[25] HU S, FENG X, HUANG W, et al.Effects of drying methods on non-volatile taste components of Stropharia rugoso-annulata mushrooms[J].LWT, 2020, 127:109428.
[26] CHEN J N, HUANG X H, ZHENG J, et al.Comprehensive metabolomic and lipidomic profiling of the seasonal variation of blue mussels (Mytilus edulis L.):Free amino acids, 5’-nucleotides, and lipids[J].LWT, 2021, 149:111835.