纳米银(AgNPs)具有显著的抗菌作用,因其优异的稳定性、高催化效率和吸附能力,在水污染处理、生物医学等多个领域的应用日益广泛[1-3]。AgNPs的制备方法主要有物理法、化学法和生物法三大类。物理法如超声波、机械粉碎等,制备的AgNPs虽然纯度高,但能耗较大,生产成本较高。化学法包括化学还原法、电化学法、微乳液法等,优点是制备成本低、产量大,但制备过程中不可避免会使用分散剂和稳定剂等,可能会对环境造成污染。近年来,利用自然界中的微生物、真菌[4]和植物浸取液中的活性成分[5-6]作为还原剂和保护剂,来制备AgNPs被广泛关注。这种方法条件温和、可避免使用有毒的化学试剂,环境友好且易于控制,非常适合AgNPs的绿色制备。
连翘叶,源自木犀科植物连翘[Forsythia suspensa (Thunb.) Vahl],是一种富含药用价值的植物部位[7]。尽管连翘的干燥果实在中国传统医药中更为著名,常用于清热解毒、消肿散结等,但连翘叶亦蕴含着丰富的药用价值。与连翘果实相似,连翘叶的化学成分主要包括木脂素类、苯乙醇苷类、黄酮类和三萜酸类等,有研究表明连翘叶中活性成分如连翘苷、连翘酯苷等含量远高于连翘果实[8-10]。其中木脂素类(如连翘苷、连翘脂素等)和苯乙醇苷类(如连翘酯苷A、B、C、D等)均显示出良好的抗氧化活性[11-12]。在本研究中,我们采用连翘叶提取液绿色合成AgNPs,同时对制备得到的AgNPs活性进行初步研究,旨在为AgNPs的绿色制备及其应用提供重要的理论依据和实践指导。
1 材料与方法
1.1 材料与设备
1.1.1 试剂及材料
AgNO3,天津市赢达稀贵化学试剂厂;无水乙醇,天津市富宇精细化工有限公司;NaOH,天津市天力化学试剂有限公司;NaCl、KMnSO4,天津市科密欧化学试剂有限公司;琼脂粉、酵母提取物、胰蛋白胨,北京奥博星生物技术有限责任公司;四硝基苯酚,西陇科学股份有限公司;甲基橙,国药集团化学试剂有限公司;亚甲基蓝,比克曼生物科技有限公司;罗丹明B、DPPH,上海麦克林生化科技股份有限公司;大肠杆菌ATCC 25922,上海保藏生物技术中心。
1.1.2 仪器设备
DF-101S磁力搅拌器,邦西仪器科技(上海)有限公司;LGJ-10D真空冷冻干燥机,北京四环科学仪器厂;X-8紫外可见分光光度计,上海元析仪器有限公司。
1.2 实验方法
1.2.1 连翘叶提取液的制备
连翘叶采摘于陕西天士力植物药业有限责任公司园区内,阴干5~10 d,粉碎,称取5 g连翘叶粉末,加入10倍量的不同体积分数的乙醇溶液,于80 ℃水浴提取1 h。待提取液冷却至室温后,5 000 r/min离心5 min,收集上清液备用。
1.2.2 连翘叶提取液绿色合成AgNPs
准确称取85 mg AgNO3,加入20 mL去离子水于烧杯中,磁力搅拌器搅拌至完全溶解,形成透明的溶液。向AgNO3溶液中加入一定量的连翘叶提取液,磁力搅拌一定时间后,溶液由橙黄色变为棕褐色,说明有AgNPs生成。连翘叶绿色合成AgNPs的过程如图1所示。
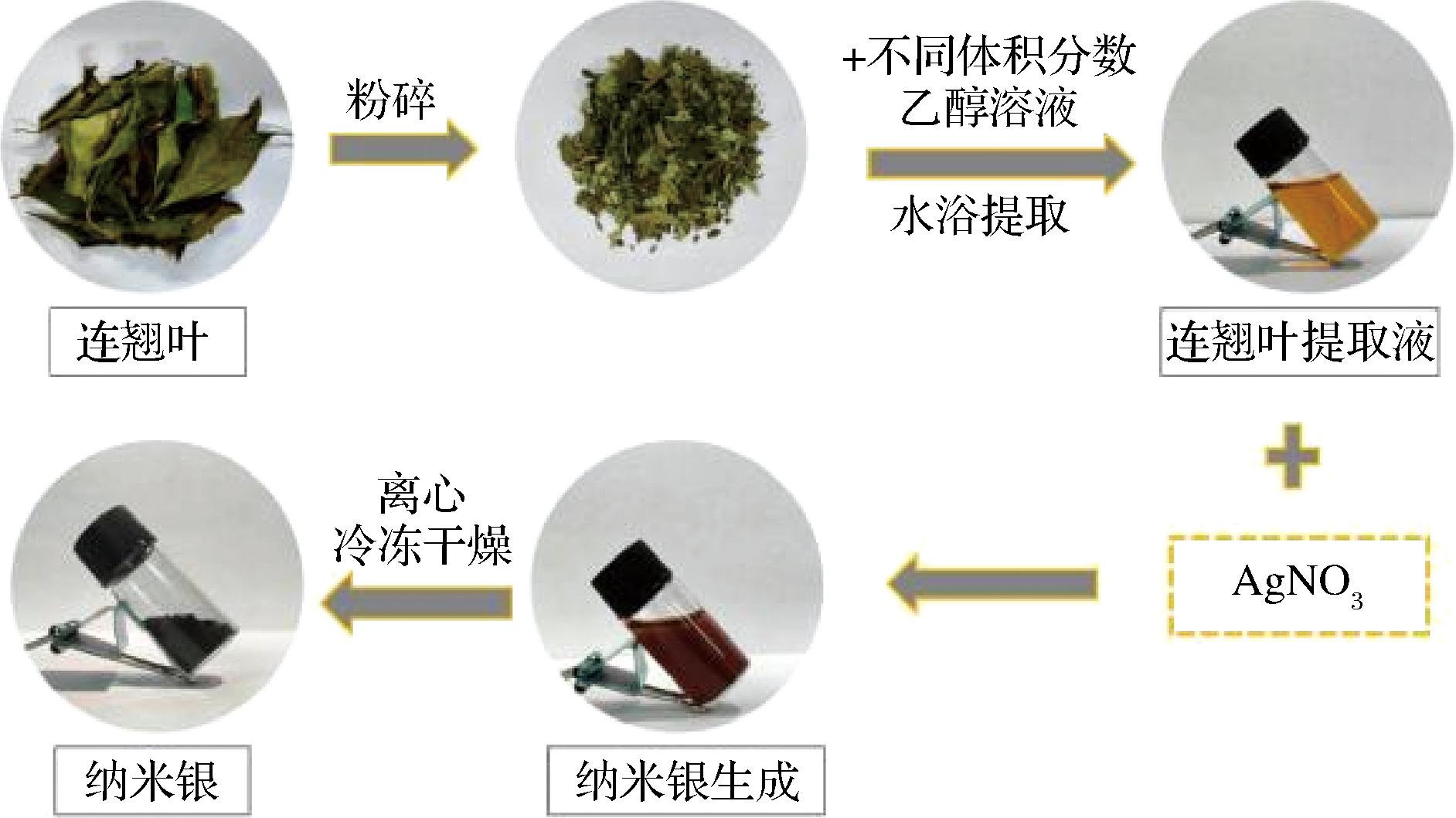
图1 连翘叶提取液绿色合成AgNPs的工艺路线示意图
Fig.1 Schematic diagram of the green synthesis process of AgNPs using Forsythia suspensa leaf extract
1.2.3 绿色合成AgNPs的工艺优化
1.2.3.1 单因素试验
按照上述方法,通过单因素试验分别探究了不同乙醇体积分数(30%、40%、50%、60%、70%),连翘叶提取液的不同添加量(1、2、3、4、5 mL)以及不同反应时间(25、35、45、50、55、60、65、70、75、80 min)对AgNPs合成的影响。
1.2.3.2 正交试验
在单因素试验的基础上,以乙醇体积分数,连翘叶提取液的添加量,反应时间为主要考察因素,进行三因素三水平正交试验,进一步优化连翘叶提取液绿色合成AgNPs制备工艺。
1.2.3.3 验证试验
按照正交试验中确定的最优工艺参数,进行3次平行实验制备AgNPs,采用紫外分光光度法检测溶液在300~800 nm波长范围内的吸收情况。
1.2.4 结构表征
采用UV-Vis、X射线衍射(X-ray diffraction,XRD)、傅里叶变换红外(Fourier transform infrared spectroscopy,FTIR)、扫描电子显微镜(scanning electron microscope,SEM)等方法对绿色制备合成的AgNPs进行结构表征。
1.2.5 AgNPs对有机染料的催化活性评价
1.2.5.1 AgNPs对对硝基苯酚(p-nitrophenol,4-NP)的催化还原活性评价
参照文献[13-14]的方法,稍作修改。取100 μL新鲜配制的KBH4(0.5 mol/L)溶液,加入2.5 mL 4-NP(0.2 mmol/L)的溶液中充分混匀。加入10 μL AgNPs(2.25 mg/mL)溶液,采用UV-Vis分光-光度法对混合溶液在300~600 nm范围内进行连续全波长扫描,通过监测约400 nm 处的峰吸光度变化,考察AgNPs对4-NP的催化还原活性。
1.2.5.2 AgNPs对亚甲基蓝、甲基橙、罗丹明B的催化降解活性评价
参照文献[13-14]的方法,稍作修改。取0.5 mL新鲜配制的KBH4(0.06 mol/L)溶液,分别加入到2 mL亚甲基蓝(0.1 mmol/L)、甲基橙(0.05 mmol/L)、罗丹明B(0.02 mmol/L)溶液中充分混匀。向混合溶液中加入10 μL AgNPs(2.25 mg/mL)溶液。每隔一定时间取样采用UV-Vis分光-光度法对混合溶液在300~800 nm范围内进行连续全波扫描,通过监测各目标降解物在最大吸收波长处吸光度值的变化,考察AgNPs对亚甲基蓝、甲基橙、罗丹明B的催化降解活性。
1.2.5.3 有机染料及降解液对绿豆种子萌发的影响
参照文献[15-17]的方法,稍作修改。将绿豆种子用流水冲洗30 min后,于0.5%(质量分数)的KMnO4溶液中浸泡15 min,去离子水将种子清洗至无KMnO4。各实验组分别吸取处理液200 μL,加入到铺有双层滤纸的12孔板培养皿中,随后将种子均匀地放入培养皿中(6粒/皿),每个处理组设置3个平行。每天补充水以保持滤纸湿润,并使用无菌水作为空白对照。在25 ℃无光照的条件下培养,72 h后统计萌发率,120 h后测量根长和茎长。
1.2.6 AgNPs抗氧化活性评价
参照文献[18]的方法,稍作修改。以维生素C为阳性对照,采用DPPH自由基清除法来评价AgNPs抗氧化活性。取0.5 mL不同浓度的AgNPs溶液,加入2.5 mL DPPH溶液(0.1 mmol/L)和1 mL的无水乙醇,混合均匀后,避光保存30 min,于517 nm处测量吸收值。同时,以维生素C作为阳性对照进行相同操作,根据公式(1)计算DPPH自由基的清除率:
DPPH自由基清除率![]()
(1)
式中:A1,样品与DPPH混合溶液OD值;A0,去离子水与DPPH混合溶液OD值;A2,样品与去离子水混合溶液OD值。
1.2.7 AgNPs对大肠杆菌抑菌活性评价
1.2.7.1 最小抑菌浓度(minimal inhibitory concentration,MIC)和最小杀菌浓度(minimal bactericidal concentration,MBC)测定
采用二倍稀释法确定MIC和MBC[18]。将大肠杆菌的菌液在37 ℃、150 r/min的摇床振荡条件下培养至对数生长期,并将菌液稀释至1×106 CFU/mL备用。准备10支15 mL的灭菌离心管,编号为1~10号,向每个离心管中先后加入10 mL LB液体培养基和100 μL稀释后的菌液,待混匀后,分别加入500 μL梯度稀释的AgNPs溶液,于37 ℃恒温培养箱中培养24、48 h。在培养0、24、48 h时,取适量菌液测定600 nm波长处吸光度值,观察菌液浑浊情况;同时分别于培养24、48 h时取适量菌液接种至固体培养基,于37 ℃恒温培养箱中继续培养24 h,观察菌落生长情况。
1.2.7.2 滤纸片法测定AgNPs对大肠杆菌抑菌活性
取4个滤纸片分别浸入AgNPs溶液、连翘叶提取液、AgNO3溶液和去离子水中20 s,将浸泡后的滤纸片放置在已接种的固体培养基上,放入恒温培养箱中,于37 ℃避光条件下培养24 h,设置3个平行实验。
1.2.8 数据统计分析
数据通过Origin 2021软件进行绘图,SPSS软件进行统计学分析。
2 结果与分析
2.1 AgNPs绿色合成工艺条件优化的结果
2.1.1 单因素试验结果
选取乙醇体积分数、反应时间以及连翘叶提取液的添加量3个因素,通过单因素试验优化AgNPs合成工艺,结果如图2所示。连翘叶提取液制备过程中,乙醇体积分数对AgNPs合成的影响如图2-a所示。在乙醇体积分数低于60%时,随着乙醇体积分数的提高,AgNPs生成量逐渐增加。当体积分数高于60%时,AgNPs生成量降低,且在大约660 nm处出现杂峰,因此50%乙醇连翘叶提取液效果最好。由图2-b可知,随着反应时间的延长,AgNPs生成量逐渐增加,当反应进行到75 min时,AgNPs的UV-Vis图谱显示出显著的吸收峰高度和狭窄的峰形。进一步延长反应时间,并未引起AgNPs溶液颜色和吸收峰的明显变化。由图2-c可知,随着连翘叶提取液添加量的增加,AgNPs生成量呈明显增加趋势,当连翘叶提取液添加量>3 mL时,生成量增加较为缓慢。
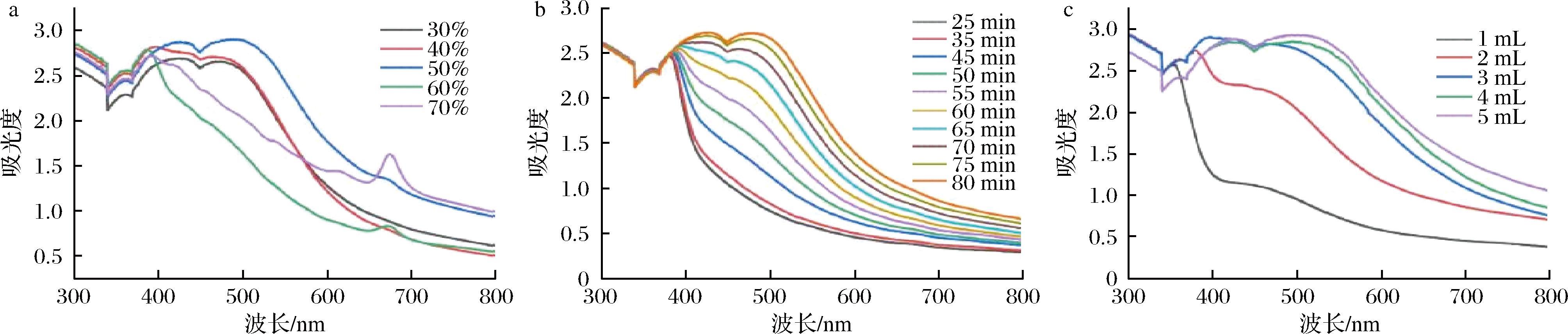
a-乙醇体积分数;b-反应时间;c-连翘叶提取液添加量
图2 单因素优化连翘叶提取液绿色合成AgNPs制备工艺
Fig.2 Single-factor optimization of the green synthesis process of AgNPs using F. suspensa leaf extract
2.1.2 正交试验结果
在单因素试验的基础上,以乙醇体积分数、反应时间、提取液的添加量为主要因素,进行三因素三水平正交试验进一步优化AgNPs合成的工艺条件,具体试验条件见下表1,试验结果见图3。
表1 正交试验设计表
Table 1 Orthogonal experimental design
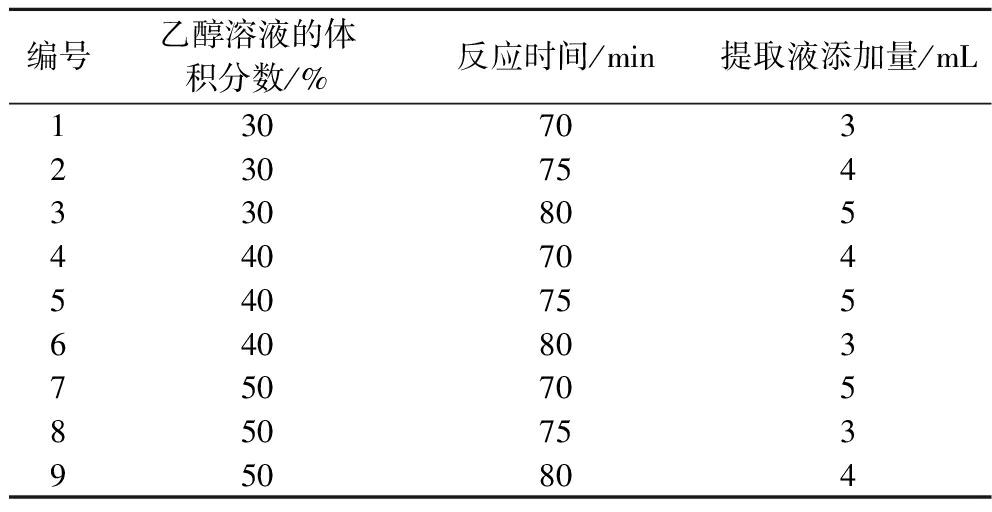
编号乙醇溶液的体积分数/%反应时间/min提取液添加量/mL130703230754330805440704540755640803750705850753950804
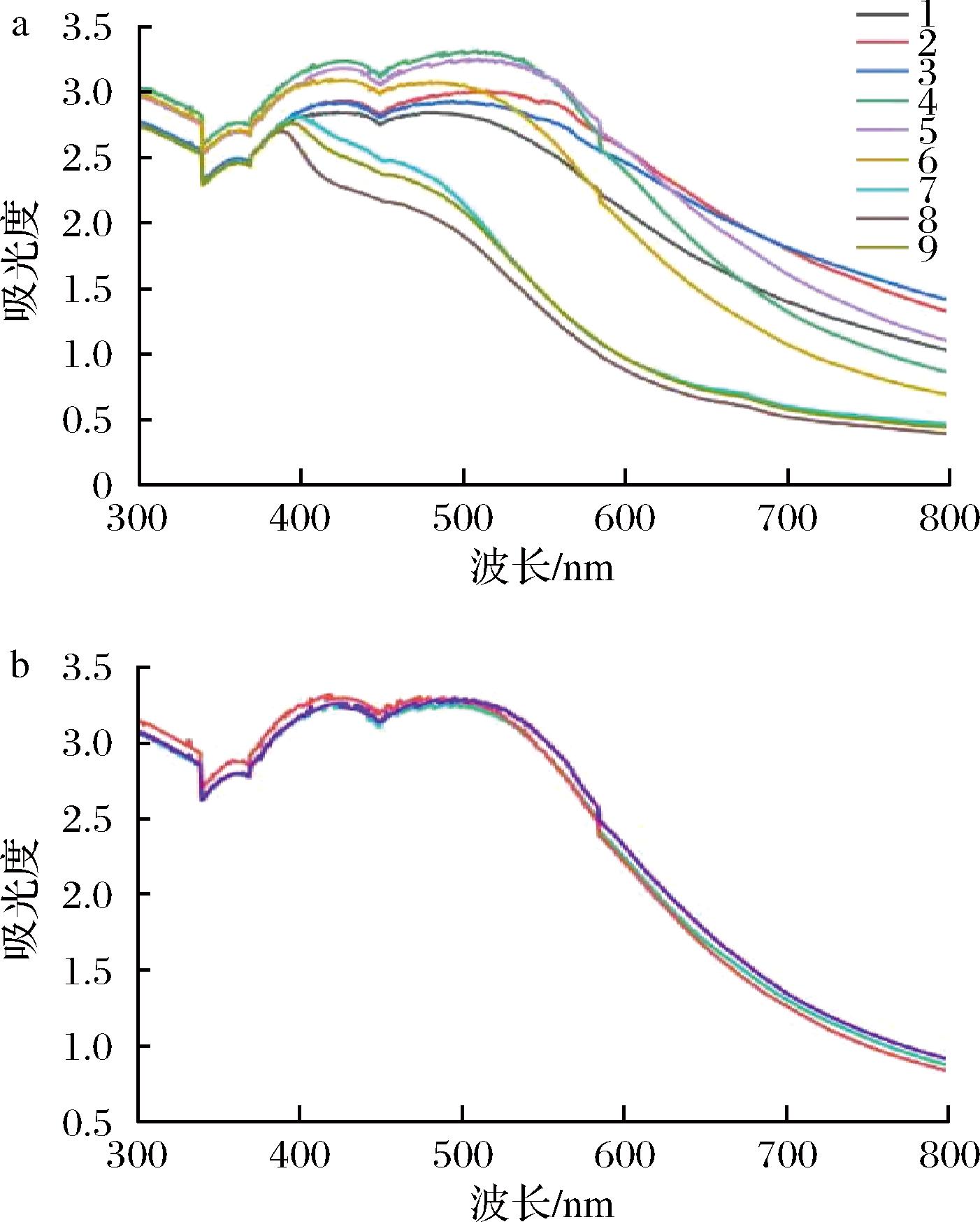
a-正交优化试验;b-验证试验
图3 连翘叶提取液绿色合成AgNPs正交优化试验及验证试验
Fig.3 Orthogonal optimization experiment and verification experiment for the green synthesis of AgNPs usingF. suspensa leaf extract
由图3-a可知,第1、2、3、6、7、8、9组AgNPs生成量明显低于第4、5组实验。第5组实验的峰值与第4组实验基本一致,但第4组实验的峰稍窄,说明在产量相差不多的情况下,第4组实验得到的AgNPs杂质更少。因此,我们选择第4组实验的合成条件作为最佳合成条件。为了确认研究结果的可靠性和有效性,将第4组实验平行重复3次,将3次实验的UV-Vis图谱放在同一坐标中,如图3-b所示,3次实验的吸收峰基本一致,重现性较好。
2.2 结构表征
2.2.1 UV-Vis表征结果
对最优工艺条件下制备的AgNPs进行UV-Vis光谱分析[1,4,18]。连翘叶提取液呈橙黄色透明,AgNPs生成后溶液呈棕褐色(图4插图)。同时由图4可知,AgNPs在400~500 nm范围内有吸收,且约426 nm处有显著吸收峰,而连翘叶提取液在该波长范围内没有吸收,进一步确认了AgNPs的成功合成。
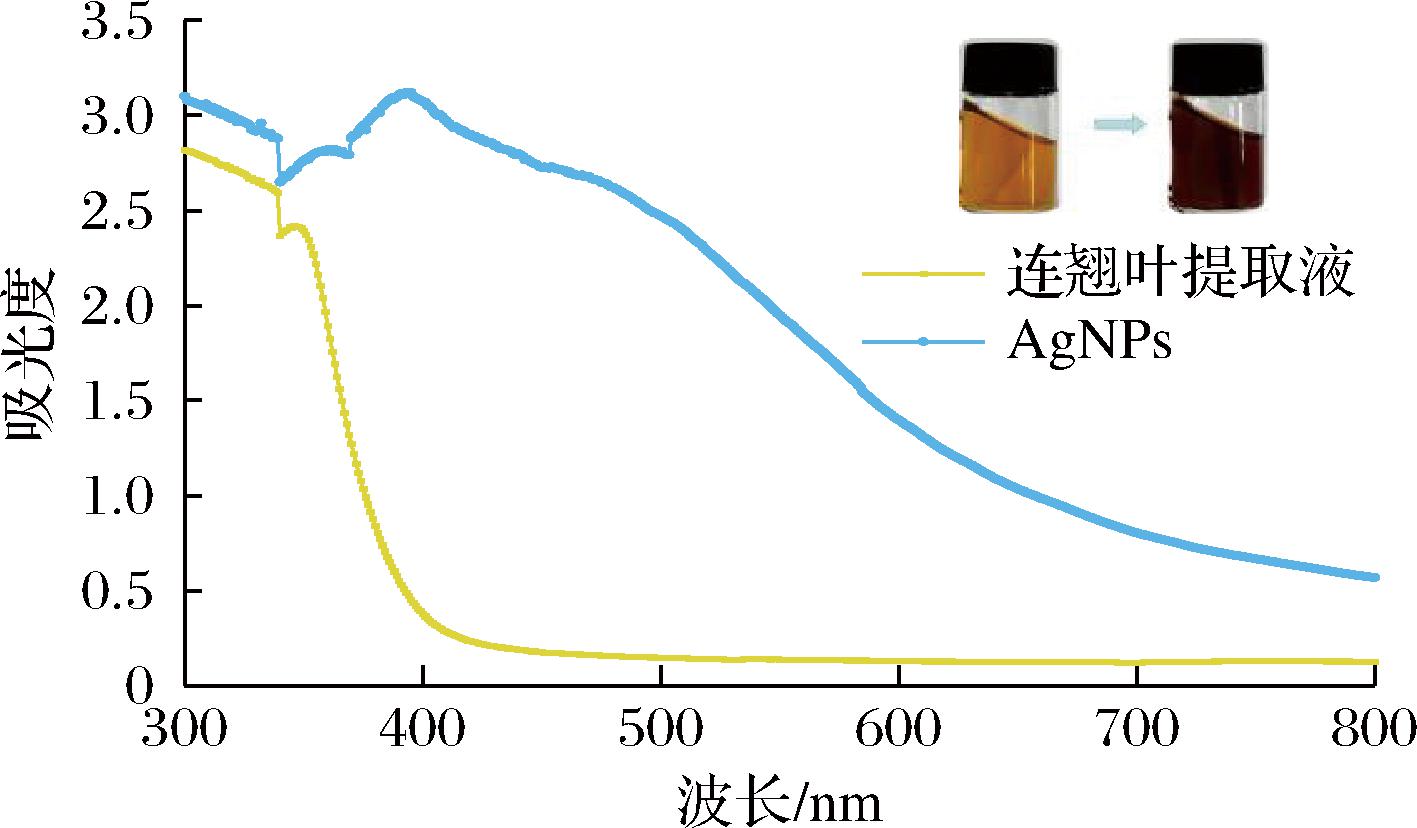
图4 连翘叶提取液和绿色合成AgNPs的UV-Vis图
Fig.4 UV-Vis spectra of F. suspensa leaf extract and green synthesized AgNPs
2.2.2 SEM表征结果
由图5知,绿色合成的AgNPs粒径大小较为均匀,粒径分布在40~70 nm之间,同时还可以观察到一些较大的粒子团簇,可能是由于AgNPs间存在强烈的相互吸引力,在制备过程中发生了聚集[6,19]。

图5 绿色合成AgNPs的SEM图
Fig.5 SEM images of green synthesized AgNPs
2.2.3 XRD表征结果
通过XRD对绿色合成的AgNPs晶体结构进行表征。由图6 XRD图谱可知,在2θ为38.10°、44.18°、64.47°、77.32°和81.60°处,AgNPs出现了明显的衍射峰,这些峰分别对应于标准银晶体的(111)、(200)、(220)、(311)和(222)晶面(参照JCPDS标准卡片编号87-0717),表明制备的AgNPs具有典型的面心立方结构[13,19]。此外,图中在27.40°、32.25°、46.33°、54.78°、57.64°有衍射杂峰存在,为AgCl的衍射峰,可能是由于连翘叶提取物中存在Cl-与AgNO3发生反应引起的。
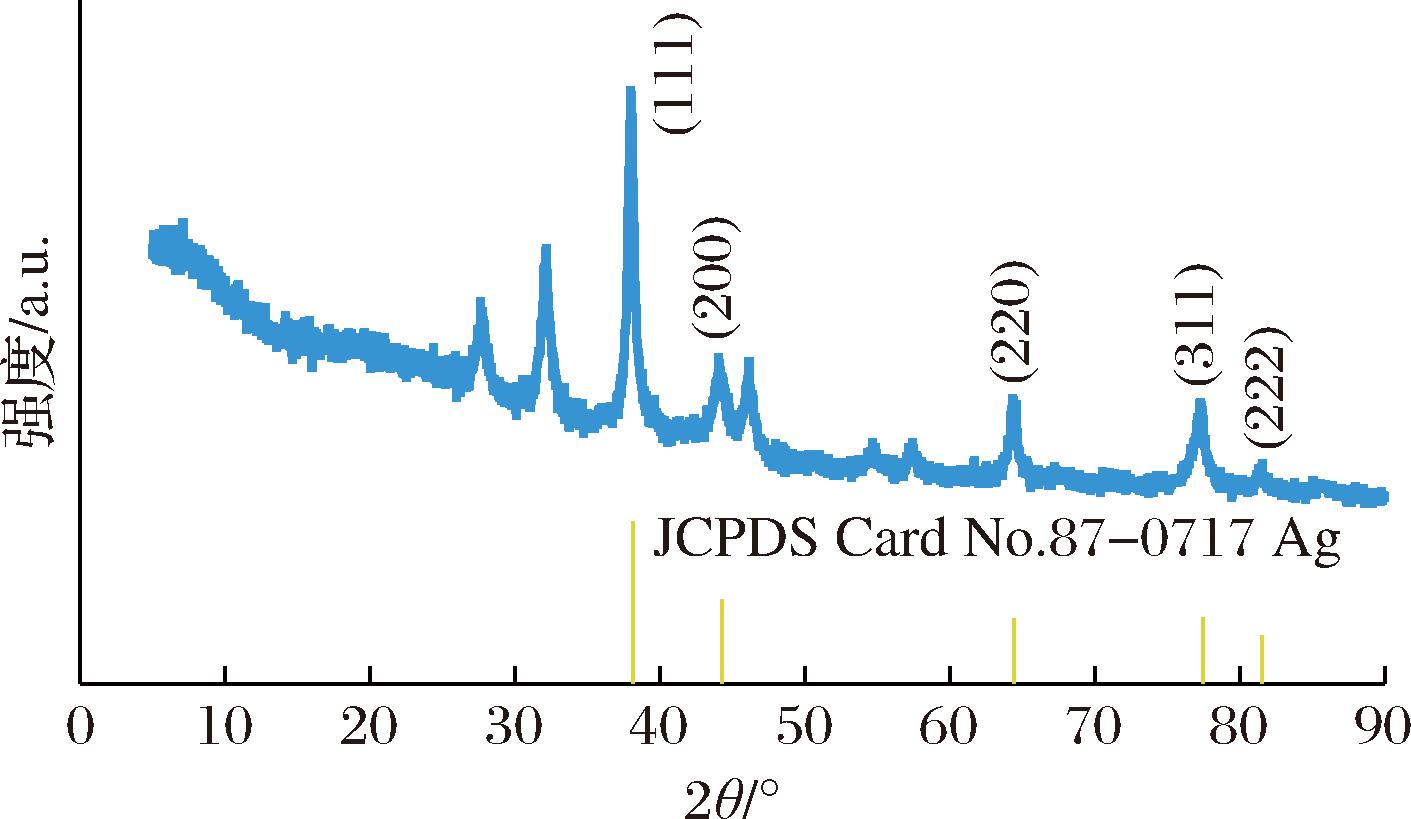
图6 绿色合成AgNPs的XRD图谱
Fig.6 XRD patterns of green synthesized AgNPs
2.2.4 FTIR表征结果
如图7所示,FTIR分析显示,AgNPs在3 346.44、2 918.71、1 603.43、1 361.03、1 262.88、1 035.45 cm-1处呈现了明显的吸收峰,这些峰分别代表了—OH的伸缩振动、—C—H的伸缩振动、—C![]() O的伸缩振动、C
O的伸缩振动、C![]() C的伸缩振动、—C—H键的变形振动以及—C—O键的伸缩振动。这些有机基团可能来源于连翘叶中丰富的木脂素、黄酮等生物活性成分。在银离子还原过程中,这些成分可能参与了反应,并最终吸附在合成的AgNPs表面[4,13,20-21]。
C的伸缩振动、—C—H键的变形振动以及—C—O键的伸缩振动。这些有机基团可能来源于连翘叶中丰富的木脂素、黄酮等生物活性成分。在银离子还原过程中,这些成分可能参与了反应,并最终吸附在合成的AgNPs表面[4,13,20-21]。
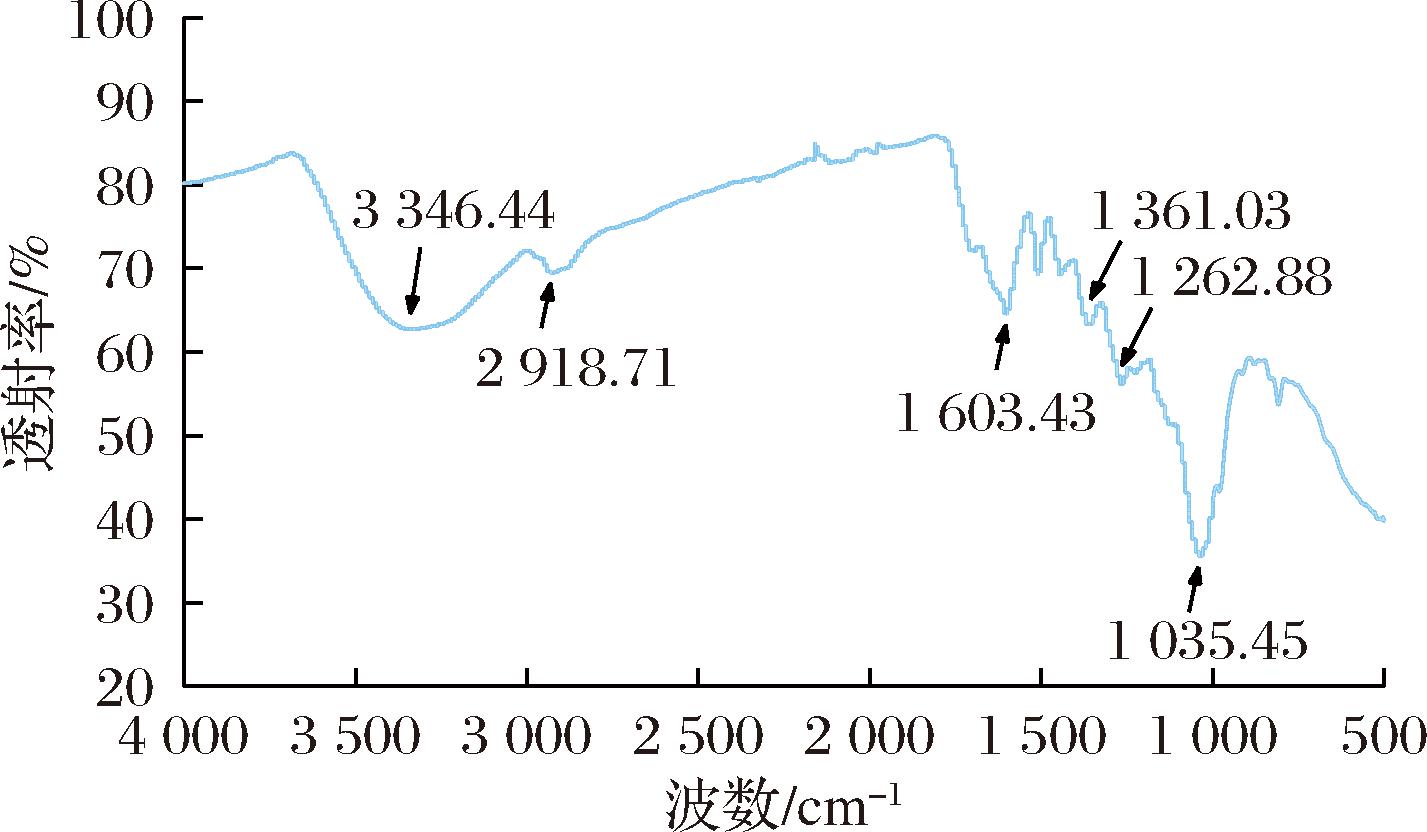
图7 绿色合成AgNPs的FTIR图
Fig.7 FTIR spectra of green synthesized AgNPs
2.3 化学合成法与绿色合成法制备AgNPs比较
在前述优化得到的最佳工艺条件下,采用连翘叶提取物为还原剂制备AgNPs;同时以NaBH4为还原剂制备AgNPs,将2种方法制备得到的AgNPs粒径分布和XRD图谱进行对比分析。由图8可知,绿色合成制备得到的AgNPs的XRD图谱杂峰更少,同时粒径较小且均匀。
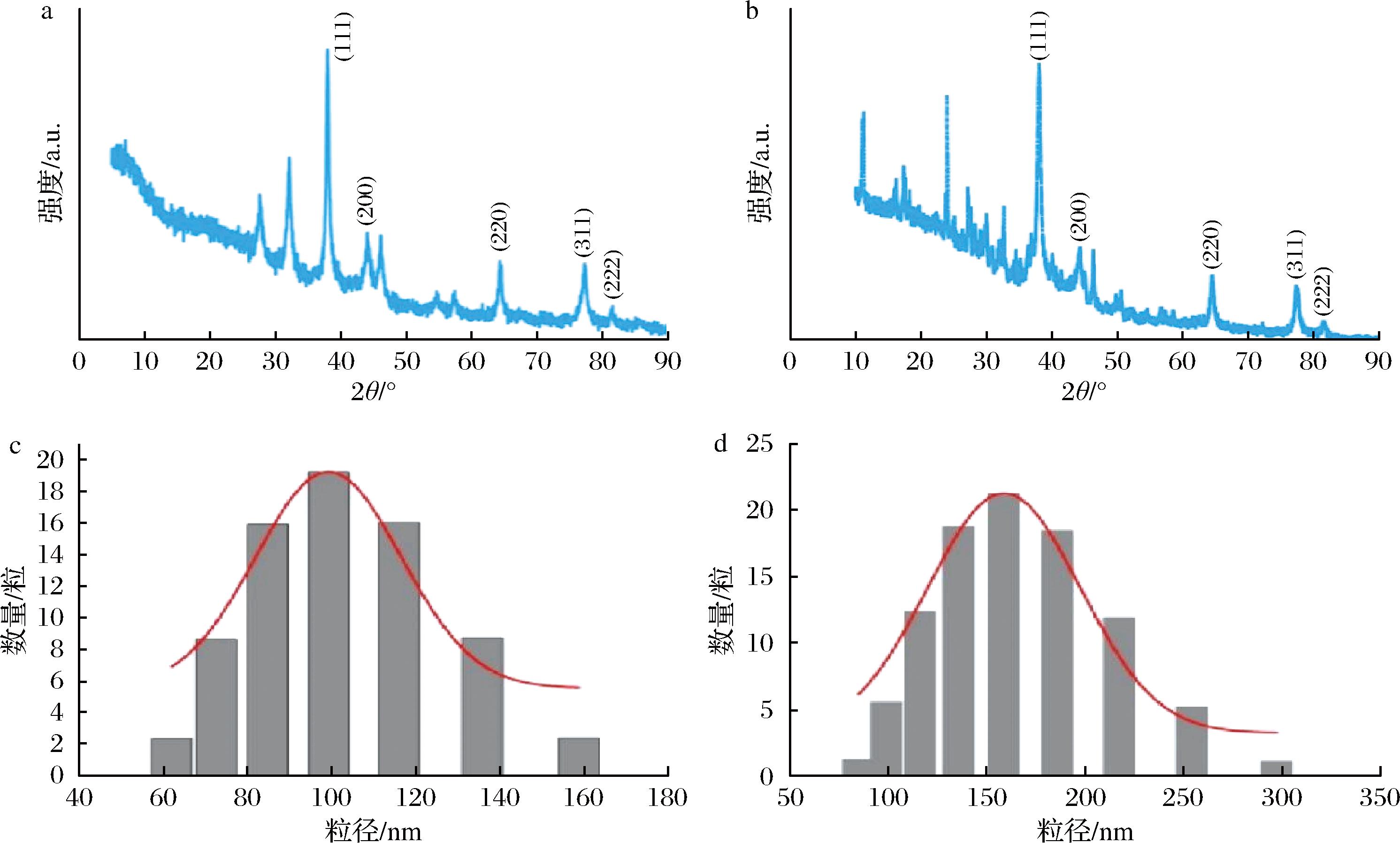
a-绿色合成AgNPs的XRD图谱;b-化学还原法合成AgNPs的XRD图谱;c-绿色合成AgNPs的粒径分布图;d-化学还原法合成AgNPs的粒径分布图
图8 绿色合成及化学还原法合成AgNPs的XRD图谱与粒径分布图
Fig.8 XRD patterns and particle size distribution of AgNPs synthesized by green synthesis and chemical reduction method
2.4 活性评价
2.4.1 AgNPs催化活性评价结果
2.4.1.1 AgNPs 对4-NP的催化还原结果
选择4-NP作为模型化合物,评估连翘叶提取液绿色合成AgNPs的催化性能[13]。4-NP为淡黄色溶液,加入KBH4后,颜色由淡黄色转变为亮黄色,并在UV-Vis光谱中于410 nm处出现特征吸收峰。由图9-a可知,向混合液中加入AgNPs溶液后,410 nm处的特征吸收峰强度随着时间的延长逐渐减弱,说明在AgNPs的催化作用下,4-NP逐渐被还原。19 min时,410 nm处的特征吸收峰基本消失,降解率达91.08%(图9-b)。由图9-a可知,随着时间的延长,反应液的颜色由亮黄色逐渐变为无色,进一步证实了4-NP的降解。
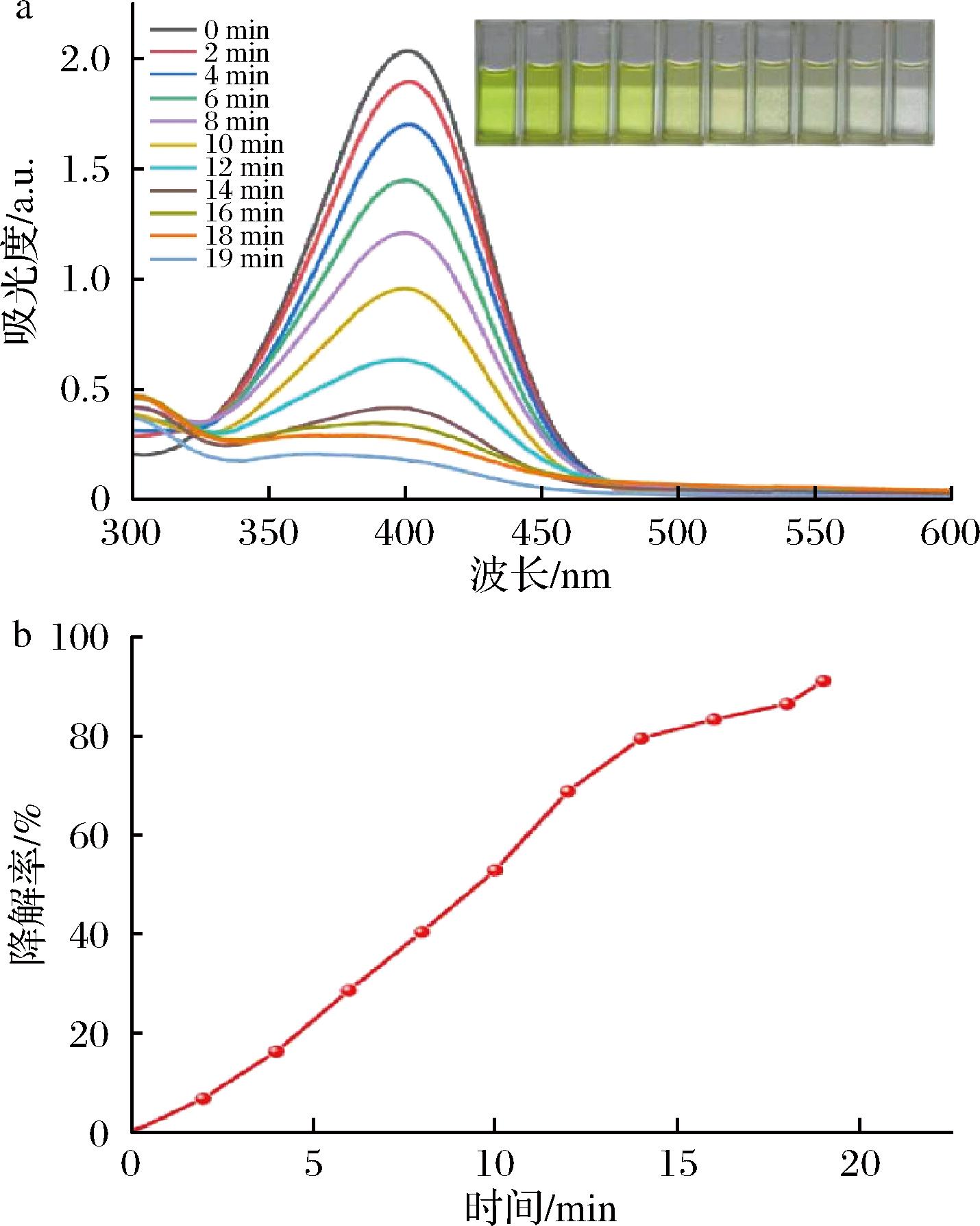
a-UV-Vis光谱图;b-降解率图
图9 绿色合成AgNPs 催化降解4-NP的UV-Vis光谱图和降解率图
Fig.9 UV-Vis spectra and degradation rates of 4-NP catalytically degraded by green synthesized AgNPs
2.4.1.2 AgNPs对亚甲基蓝、甲基橙、罗丹明B的催化降解结果
由图10-a和图10-b可知,在还原剂KBH4的条件下,随着时间的延长,AgNPs对亚甲基蓝的降解率逐渐增加。28 min时位于669 nm处的特征吸收峰已基本消失,降解率达90.03%;由图10-c、图10-d可知,向混合液中加入AgNPs溶液后,甲基橙位于467 nm处的特征吸收峰强度随着时间的延长逐渐减弱,在14 min时,特征吸收峰已基本消失,降解率达94.64%;由图10-e和图10-f可知,向混合液中加入AgNPs溶液后,罗丹明B于557 nm处的特征吸收峰强度随着时间的延长逐渐减弱,在7 min时,特征吸收峰已基本消失,降解率达93.00%,以上实验结果均表明AgNPs具有较高的催化降解有机污染物活性。

a-亚甲基蓝UV-Vis光谱图;b-亚甲基蓝降解率图;c-甲基橙UV-Vis光谱图;d-甲基橙降解率图;e-罗丹明B UV-Vis光谱图;f-罗丹明B降解率图
图10 绿色合成AgNPs催化降解亚甲基蓝、甲基橙、罗丹明B的UV-Vis光谱图及降解率图
Fig.10 UV-Vis spectra and degradation rates of methylene blue, methyl orange, and rhodamine B catalytically degraded by green synthesized AgNPs
2.4.1.3 有机染料及降解液对绿豆种子萌发的影响实验结果
为了更深入地探究连翘叶提取液绿色合成AgNPs在降解4-NP、亚甲基蓝、甲基橙和罗丹明B 4种有机染料过程中,降解液及其中间产物的安全性和潜在毒性,本研究采用了绿豆种子作为实验对象,以评估4-NP、亚甲基蓝、甲基橙、罗丹明B、AgNPs、连翘叶提取液以及各有机染料降解液对绿豆种子萌发过程的具体影响,结果见图11。

a-绿豆种子在12孔板中萌发情况示意图;b-120 h绿豆种子生长情况;c-各实验组对绿豆茎长的影响;d-各实验组对绿豆根长的影响
图11 AgNPs、连翘叶提取液、4-NP、亚甲基蓝、甲基橙、罗丹明B以及降解液对绿豆种子萌发的影响
Fig.11 Effects of AgNPs, F. suspensa leaf extract, 4-NP, methylene blue, methyl orange, rhodamine B, and degradation solutions on mung bean seed germination
由图11-a可知,72 h所有实验组绿豆种子萌发率为100%。如图11-b所示,生长20 h后与空白对照相比,AgNPs、连翘叶提取液、4种有机染料原液对绿豆的生长均有不同程度的抑制作用;经AgNPs催化降解后,各降解液对绿豆种子茎长的影响与空白对照组相比,无显著性差异(图11-c);与空白对照组相比,各降解液一定程度上抑制了绿豆种子根的生长(图11-d),但与原液相比,抑制作用明显降低。综上所述,AgNPs在高效催化降解目标污染物的同时,也可显著降低目标污染物的潜在毒性。
2.4.2 抗氧化实验结果
以维生素C为阳性对照,对连翘叶提取液绿色合成的AgNPs抗氧化活性进行评价,结果见图12。当维生素C质量浓度达为0.3 mg/mL时,其清除率达到100%;随着AgNPs质量浓度的增加,其DPPH自由基清除效率也逐步提高,当质量浓度为0.55 mg/mL时,清除率达到了93.5%。
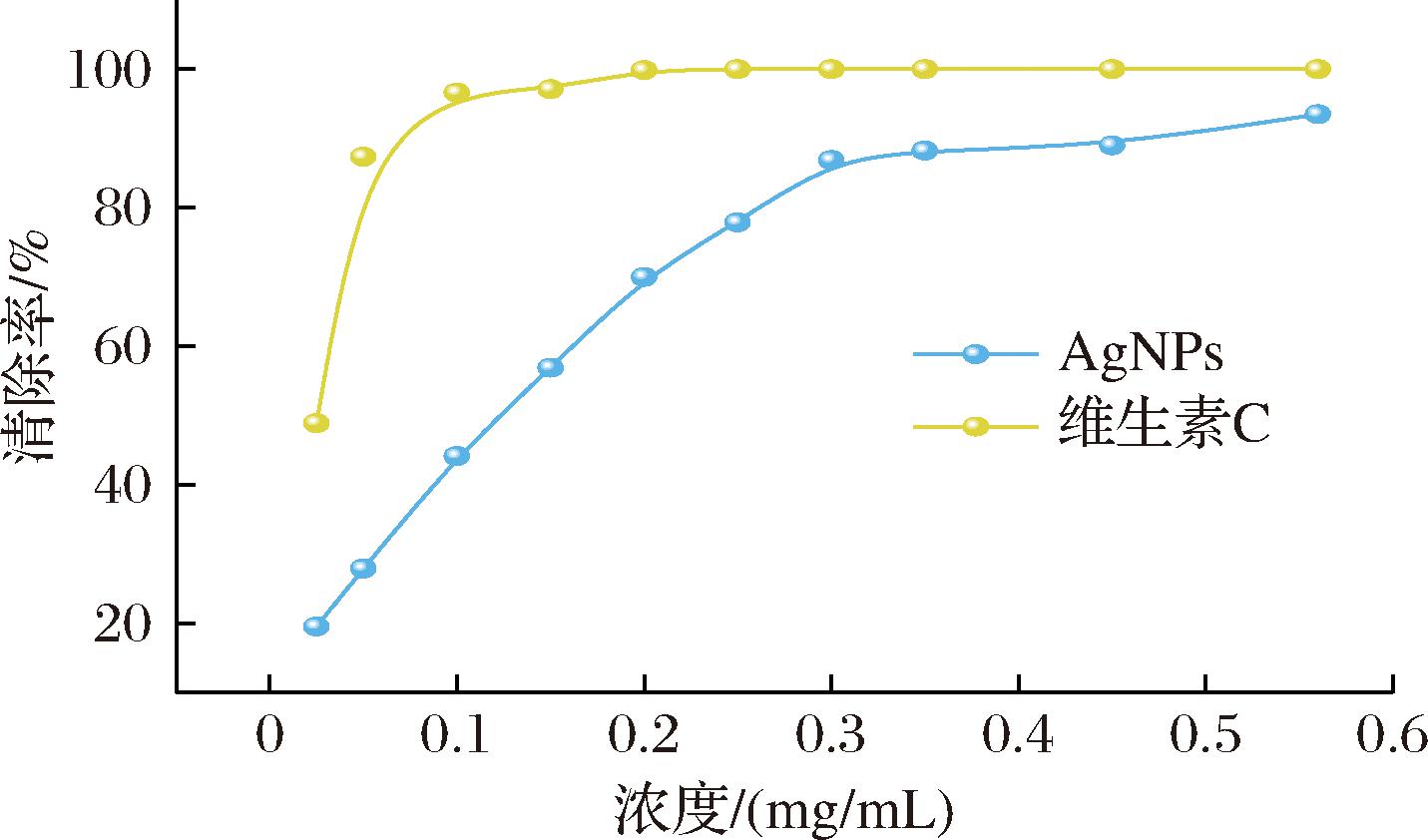
图12 绿色合成AgNPs DPPH 自由基清除活性
Fig.12 DPPH radical scavenging activity of green synthesized AgNPs
2.4.3 抑菌实验结果
2.4.3.1 最小抑菌浓度及最小杀菌浓度
采用大肠杆菌作为供试菌种,通过二倍稀释法测定了连翘叶提取液绿色合成的AgNPs对大肠杆菌的MIC和MBC,实验中供试菌种经振荡培养一定时间后,观察离心管,若离心管菌液为澄清,表明该浓度下AgNPs能抑制菌体的生长,则记为阴性“-”,反之,若离心管菌液变浑浊,表明该浓度下AgNPs不能抑制菌体的生长,则记为阳性“+”[18]。同时取部分菌液均匀涂布于LB固体培养基上,培养24 h后观察菌落生长情况,实验结果见表2、图13。
表2 AgNPs对大肠杆菌最小抑菌浓度的测定
Table 2 Determination of the minimum inhibitory concentration of AgNPs against E.coli
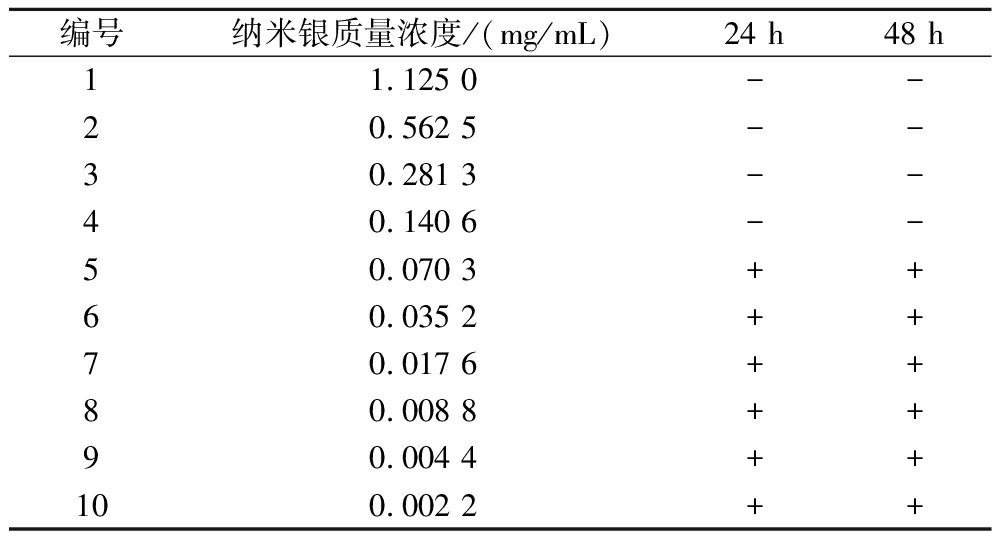
编号纳米银质量浓度/(mg/mL)24 h48 h11.125 0--20.562 5--30.281 3--40.140 6--50.070 3++60.035 2++70.017 6++80.008 8++90.004 4++100.002 2++
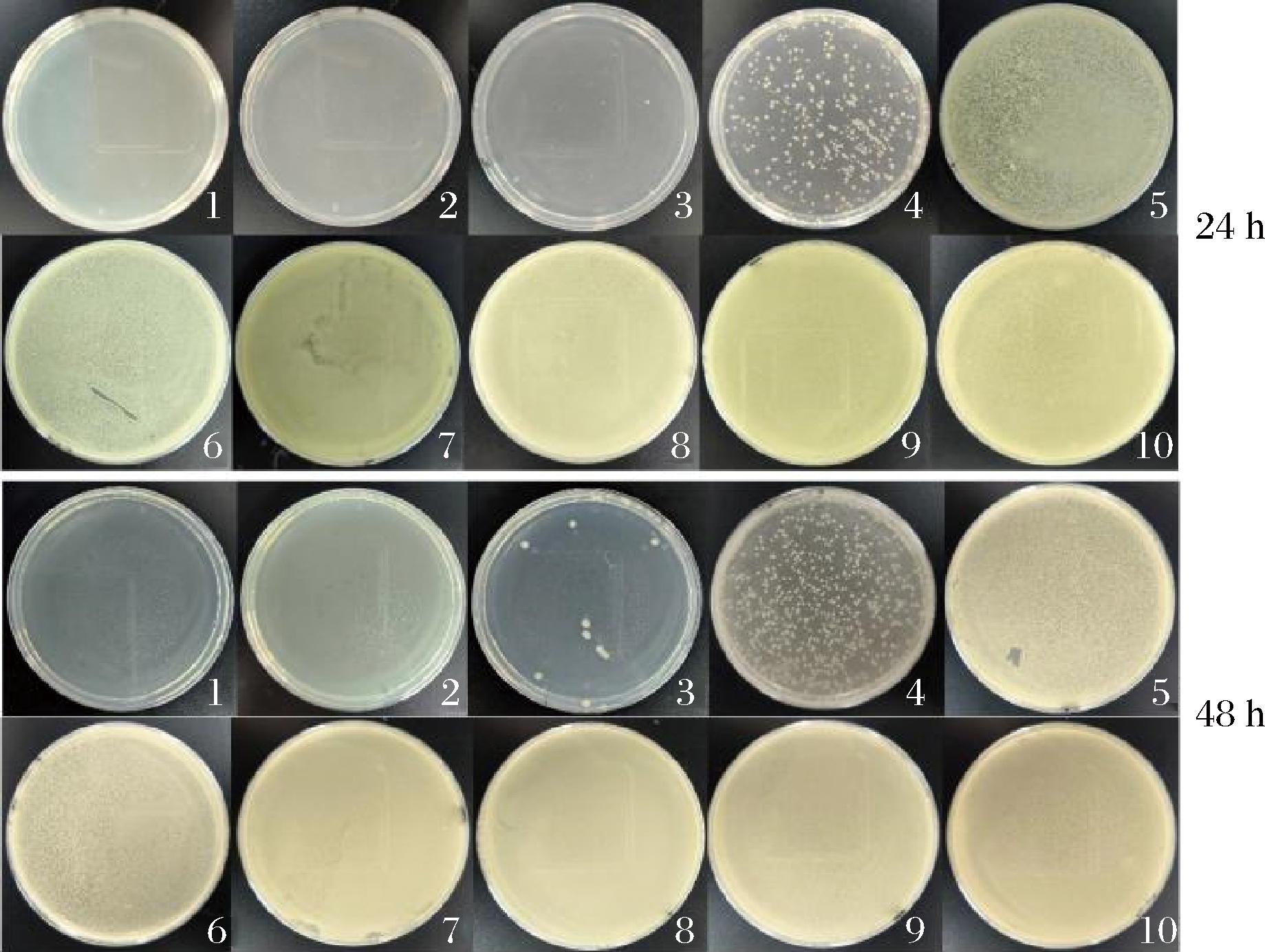
图13 AgNPs对大肠杆菌菌落生长的影响
Fig.13 Effects of AgNPs on the colony growth of E.coli
由表2可知,大肠杆菌经振荡培养培养24、48 h,AgNPs质量浓度超过0.070 3 mg/mL时,菌悬液标记为“-”,确定AgNPs对大肠杆菌的MIC值为0.140 6 mg/mL。由图13可知,当AgNPs质量浓度为0.140 6 mg/mL,仍有部分大肠杆菌存活,而当质量浓度为0.281 3 mg/mL,大肠杆菌基本被完全杀灭,因此确定AgNPs对大肠杆菌的MBC值为0.281 3 mg/mL。
2.4.3.2 滤纸片法抑菌实验结果
采用滤纸片法考察连翘叶提取液绿色合成AgNPs对大肠杆菌的抑菌活性。由图14可知,与阴性对照组(去离子水组)相比,连翘叶提取液的抑菌效果不明显,AgNO3及AgNPs均具有较明显的抑菌作用,且AgNPs的抑菌活性明显高于AgNO3,进一步证实连翘叶提取液绿色合成AgNPs的优异抑菌活性。
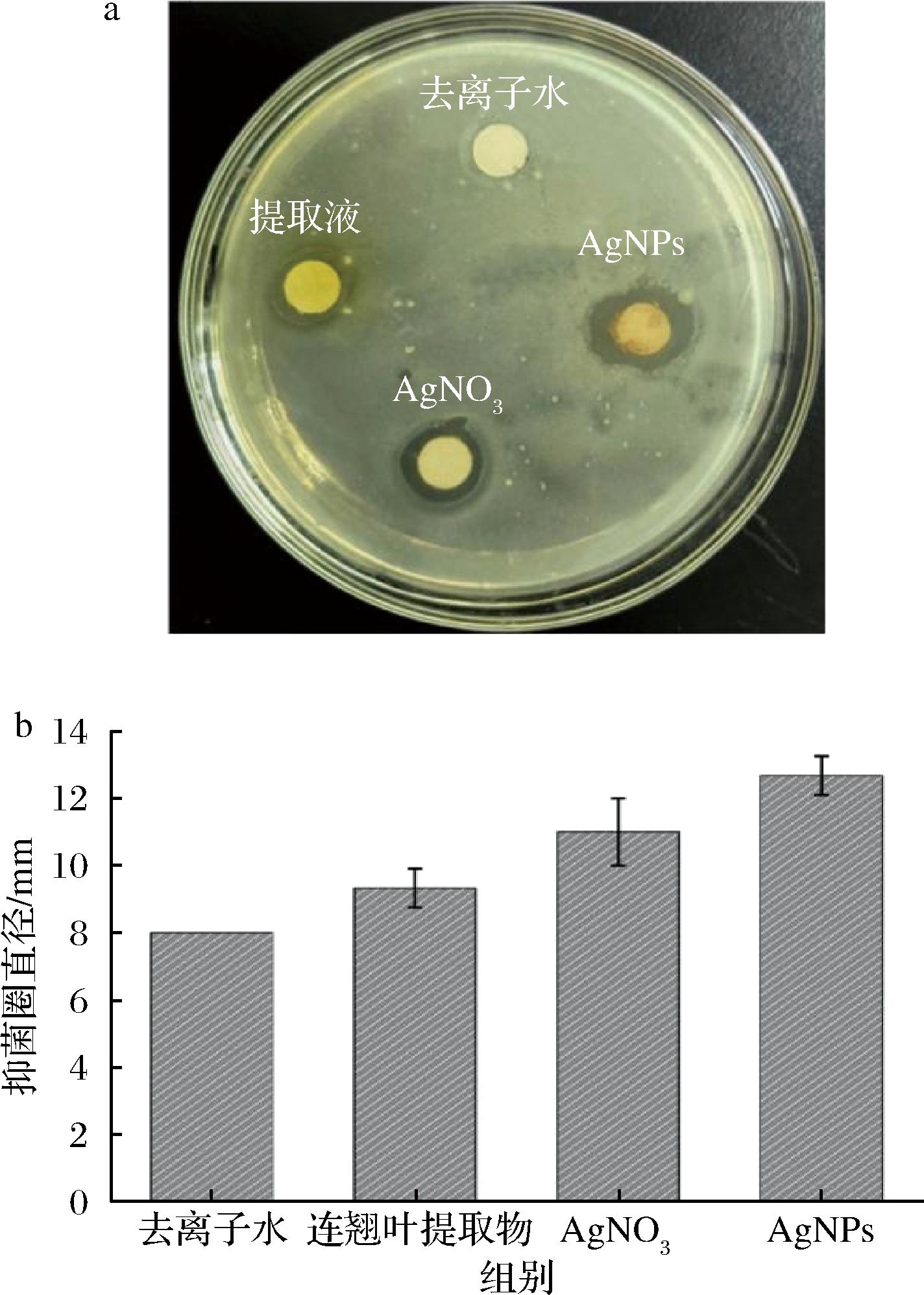
a-抑菌圈照片;b-抑菌圈直径比较
图14 抑菌圈法测定AgNPs对大肠杆菌抑制作用
Fig.14 Antibacterial activity of AgNPs against E.colidetermined by the inhibition zone method
3 结论与讨论
本研究以AgNO3为原料,通过连翘叶提取液中还原性成分,一步绿色合成AgNPs。通过单因素试验和正交试验确定最佳合成工艺为乙醇体积分数40%、反应时间70 min,连翘叶提取物添加量4 mL,这是一种更经济、环境友好且易于获得的合成方法。采用UV-Vis、SEM、FTIR和XRD等方法对AgNPs进行结构表征,AgNPs在400~500 nm范围内有吸收,且约426 nm处有显著吸收峰,制备的AgNPs具有典型的面心立方结构,大小较为均匀,粒径范围在40~70 nm之间。同时,连翘叶提取液绿色合成的AgNPs展现出显著的生物活性:对4-NP、亚甲基蓝、甲基橙和罗丹明B这4种有机染料均有较高的降解率;AgNPs 在0.55 mg/mL的质量浓度时对DPPH的清除率为93.5%;AgNPs对大肠杆菌的最小抑菌浓度是0.140 6 mg/mL,最小杀菌浓度为0.281 3 mg/mL。综上所述,连翘叶提取液绿色合成AgNPs是一种环保的方法,经该方法制备得到的AgNPs具有较高的催化降解、抗氧化及抗菌活性,在污水处理、医疗、生物活性材料等领域具有潜在的应用。
[1] YE M Q, YANG W W, ZHANG M X, et al.Biosynthesis, characterization, and antifungal activity of plant-mediated silver nanoparticles using Cnidium monnieri fruit extract[J].Frontiers in Microbiology, 2023, 14:1291030.
[2] TAKCI D K, GENC S, TAKCI H A M.Cinnamon-based rapid biosynthesis of silver nanoparticles;its characterization and antibacterial properties[J].Journal of Crystal Growth, 2023, 623:127416.
[3] DEVASVARAN K, ALALLAM B, YUNUS M A, et al.Microwave-assisted green synthesis of silver nanoparticles using alkaline extracted crude polysaccharide of C.Nutans:Optimisation, characterisation, toxicity, anticancer potential and antibacterial studies[J].Journal of Drug Delivery Science and Technology, 2023, 86:104688.
[4] 苟琴, 张振.臭常山内生真菌绿色合成纳米银的优化、表征及催化活性研究[J].食品与发酵工业, 2023, 49(23):149-155.GOU Q, ZHANG Z.Optimization, characterization, and catalytic activity of green synthesis of silver nanoparticles by endophytic fungus from Orixa japonica[J].Food and Fermentation Industries, 2023, 49(23):149-155.
[5] 姚平. 植物多酚纳米银的绿色制备及其对合成染料的催化降解[D].苏州:苏州大学, 2019.YAO P.Green synthesis of silver nanoparticles by plant-intermediate polyphenols and their catalytic degradation on synthetic dyes[D].Suzhou:Soochow University, 2019.
[6] ANIS S N S, LIEW W C, MOHD MARSIN A, et al.Microwave-assisted green synthesis of silver nanoparticles using pineapple leaves waste[J].Cleaner Engineering and Technology, 2023, 15:100660.
[7] 王学方. 连翘叶化学成分的提取分离及抗氧化和抗肿瘤作用研究[D].郑州:河南农业大学, 2022.WANG X F.Studies on extraction and isolation of chemical constituents from Forsythia Suspensa leaves and their antioxidant and anti-tumor effects[D].Zhengzhou:Zhengzhou University, 2022.
[8] 田淑芳, 韩旭, 谭奥飞, 等.一测多评法同时测定连翘和连翘叶中多种成分[J].河南大学学报(医学版), 2024, 43(2):96-102.TIAN S F, HAN X, TAN A F, et al.Simultaneous quantitative determination of 7 components in Forsythiae Fructus and Forsythia suspense leaves by QAMS method[J].Journal of Henan University (Medical Science), 2024, 43(2):96-102.
[9] WANG D H, WANG M Y, SHEN W H, et al.Analysis of chemical compounds and toxicological evaluation of Forsythia suspensa leaves tea[J].Food Science and Biotechnology, 2021, 30(2):305-314.
[10] LI J, QIN Q, ZHA S H, et al.Green extraction of forsythoside A, phillyrin and phillygenol from Forsythia suspensa leaves using a β-cyclodextrin-assisted method[J].Molecules, 2022, 27(20):7055.
[11] LIU Y R, YANG L, WANG J Z, et al.New lignans and phenylethanoid with antioxidant activity from aerial parts of Forsythia suspensa (Thunb.) Vahl[J].Natural Product Research, 2023, 37(5):725-733.
[12] GUO J, TANG J K, WANG B F, et al.Phillygenin from Forsythia suspensa leaves exhibits analgesic potential and anti-inflammatory activity in carrageenan-induced paw edema in mice[J].Journal of Food Biochemistry, 2022, 46(12):e14460.
[13] 程体艳, 张振.菊苣叶提取物绿色合成纳米银的表征及其生物活性研究[J].食品与发酵工业, 2024, 50(15):119-125.CHENG T Y, ZHANG Z.Characterization and bioactivity of green synthesis nano-silver from chicory leaf extract[J].Food and Fermentation Industries, 2024, 50(15):119-125.
[14] KONDURI V V, KALAGATUR N K, GUNTI L, et al.Green synthesis of silver nanoparticles from Hibiscus tiliaceus L. leaves and their applications in dye degradation, antioxidant, antimicrobial, and anticancer activities[J].South African Journal of Botany, 2024, 168:476-487.
[15] 孟繁茵, 杨振.探讨高效促进种子萌发的新策略[J].天津科技, 2014, 41(5):55-58.MENG F Y, YANG Z.On new strategy of promoting seed germination with high efficiency[J].Tianjin Science &Technology, 2014, 41(5):55-58.
[16] CHAUHAN P, KUMARI M, CHAUDHARY S, et al.Seed germination studies on Chickpeas, Barley, Mung beans and Wheat with natural biomass and plastic waste derived C-dots[J].Science of The Total Environment, 2022, 837:155593.
[17] SUN Y H, WANG W J, ZHENG F Y, et al.Phytotoxicity of iron-based materials in mung bean:Seed germination tests[J].Chemosphere, 2020, 251:126432.
[18] 邱泽奎. 白芨提取物生物合成纳米银及其生物活性研究[D].福州:福建农林大学, 2022.QIU Z K.Biosynthesis of silver nanoparticles using bletilla striata extract and its biological activities[D].Fuzhou:Fujian Agriculture and Forestry University, 2022
[19] KHATUN M, KHATUN Z, KARIM M R, et al.Green synthesis of silver nanoparticles using extracts of Mikania cordata leaves and evaluation of their antioxidant, antimicrobial and cytotoxic properties[J].Food Chemistry Advances, 2023, 3:100386.
[20] SMIRNOV O, DZHAGAN V, YESHCHENKO O, et al.Effect of pH of Ganoderma lucidum aqueous extract on green synthesis of silver nanoparticles[J].Advances in Natural Sciences:Nanoscience and Nanotechnology, 2023, 14(3):035009.
[21] HAJIZADEH M, SADEGHIAN SARAYAN M, TALEGHANI A, et al.Evaluation of antimicrobial and antioxidant effects of silver nanoparticles synthesized with leaves of Lepidium draba L[J].Journal of Radiation Research and Applied Sciences, 2024, 17(3):101004.