金枪鱼、金枪鱼族(Thunnini)所属鲭科,大洋暖水性洄游鱼类,广泛分布于热带和亚热带海域。2023年我国渔业年鉴统计,我国金枪鱼的年捕捞量达32万t[1]。金枪鱼在生产加工过程中会产生大量的副产物,约占鱼体总量的40%~46%,其中仅鱼皮就占鱼体的5%,而金枪鱼皮中含有大量的胶原蛋白(collagen,COL)[2]。金枪鱼是鲭科仅存可将体温维持在比周围水体温度高的三类物种之一。一般情况下,金枪鱼可将体温维持在高于周围环境3~7 ℃的温度范围内[3]。BLANCO等[4]发现不同鱼类中所提取的COL的变性温度有很大差异,可能是由鱼类生存环境温度差异和鱼类体温差异造成的,环境温度越低其COL变性温度越低,提取过程中更需要控制低温条件。基于金枪鱼的栖息环境及生存特性分析,金枪鱼皮胶原蛋白(tuna skin collagen,TSCO)在理论上具有更高的变性温度,相比于冷水鱼类更易于提取,具有很大的研究价值和潜能。
COL的提取方法有酸法、碱法、酸法联合胃蛋白酶辅助提取法等。酸法提取通过控制酸浓度和提取温度,主要提取可溶性COL,但酸法污染性大。碱法提取通过去除COL非螺旋末端肽段来促使COL纤维溶出,但该过程极易引起COL解螺旋。胃蛋白酶能够在特定氨基酸位点切割肽链,从而促进COL溶解于酸或碱溶液中,常作为酸提取法的辅助手段,但过度酶解会使COL变性。尽管酶能加速提取进程,但提取效率仍然不高[5]。因此,迫切需要找到一种绿色且高效的方法来缩短提取时间,并使所得COL适用于食品领域。
深共熔溶剂(deep eutectic solvents,DESs)是一种新型的绿色溶剂,通常由2种或以上的天然化合物和水以一定物质的量比混合而成,其组分来源广泛,毒性低,多为可生物降解的天然成分[6]。DESs包括通过氢键连接的两个或多个组分(即氢键供体和氢键受体),其中氢键受体一般为季铵盐类[如氯化胆碱、甜菜碱(betaine,Bet)、酒石酸胆碱];氢键供体大部分是多糖、多元醇、羧酸等。除氢键外,其他类型的相互作用(如π-π堆积、卤素键和主客体相互作用)也有助于DESs的形成[7]。
目前已经证明Bet-有机酸-水[8]、氯化胆碱-乙二醇/丙二醇/丙三醇[9]、氯化胆碱-乳酸[10]等多种DESs均能有效提取植物中的物质,如酚类、萜烯类化合物、皂苷、以及花青素等[11]。其原理是通过断裂自身氢键,再与目标产物以氢键方式结合,达到分离目标产物和其他杂质的目的,能大大提升提取效率[6]。近年来,已有学者将DESs应用于动物原料中天然产物的提取。BISHT等[12]制备了尿素-乳酸组分的DESs来改良传统酸法提取COL,发现其能显著提高产率。BATISTA等[13]发现DESs在蓝鲨鱼皮COL的提取上也有较好的表现。因此,认为将DESs用于动物源COL的提取有望解决传统提取方法所面临的困境。
本研究以尿素、乳酸、Bet、柠檬酸(citric acid,CA)和木糖醇这几种常用于组成DESs的天然化合物作为DESs基料提取TSCO。以提取率和TSCO高级结构的完整度为评价指标确定提取效果较好的溶剂组合,随后探究提取条件如组分比例、提取转速、温度和时间。最后通过柱层析法纯化粗提TSCO并进行表征评价,以期为DESs在动物源COL的提取方面的应用提供理论依据和实践基础。
1 材料与方法
1.1 材料与试剂
长鳍金枪鱼皮,浙江平太荣生物科技有限公司。
COL标准品、羟脯氨酸(hydroxyproline,Hyp)标准品、葡聚糖凝胶,上海源叶生物科技有限公司;木糖醇、CA、Bet、D-乳酸、尿素、NaOH、冰乙酸,上海麦克林生化科技有限公司。
1.2 仪器与设备
HWS-24电热恒温水浴锅,上海一恒科学仪器有限公司;HSH-6D磁力搅拌器,日本亚速旺公司;H1850R高速冷冻离心机,湖南湘仪仪器有限公司;Kjeltec8400全自动凯氏定氮仪,丹麦FOSS公司;148085基础电泳仪,美国 BIO-RAD 公司;FD-1-50 Plus真空冷冻干燥机,北京博医康实验仪器有限公司;L-8800氨基酸自动分析仪、Hitachi S3400扫描电子显微镜,日本东京日立公司;Nicolet傅里叶红外光谱仪(Fourier transform infrared spectroscopy,FTIR),美国赛默飞公司;UV-2300紫外分光光度计,上海紫柯仪器有限公司。
1.3 实验方法
1.3.1 金枪鱼皮的基本营养成分测定
水分含量测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》直接干燥法。灰分含量测定参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》高温灼烧法。蛋白质含量测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法。脂肪含量测定参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》,索氏抽提法。
1.3.2 TSCO含量测定
参照GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》测定样品中Hyp的含量,乘以相关系数[14]可得样品中COL的含量,COL纯度计算如公式(1)所示:
COL纯度![]()
(1)
式中:W1,样品中COL含量,g/100 g;W0,总蛋白含量,g/100 g。
1.3.3 DESs的制备和表征
将木糖醇-CA-水(water, W)、Bet-CA-W、Bet-乳酸-W、尿素-乳酸-W、尿素-CA-W几种不同组合,按1∶1∶10 物质的量比混合,60 ℃水浴加热溶解后制成DESs,将其分别命名为DES-1、DES-2、DES-3、DES-4、DES-5。并用pH计和密度计分别测定不同DESs pH值和密度,以表征其作为TSCO提取剂的能力。
1.3.4 TSCO的提取
金枪鱼皮前处理:鱼皮解冻后去鳞,自来水清洗多次以除去表面油脂和色素,沥水、冻干后备用。
脱脂脱色:取适量冻干鱼皮浸泡于0.1 mol/L NaOH溶液2 h,料液比1∶50(g∶mL),期间不断搅拌以增加脱除效率,纱布过滤并沥干水分;重复以上步骤3次;最后一次浸泡后,纱布过滤并用蒸馏水反复冲洗鱼皮至滤出液为中性,沥干鱼皮中水分后备用。
提取:将上一步处理好的鱼皮以1∶20(g∶mL)的料液比与DESs混合,放入搅拌子;装有混合物的烧杯放入提前预热好的磁力搅拌器上反应;一定时间后,提取液在5 000 r/min离心20 min;取上清液装入孔径200 kDa的透析袋中,蒸馏水透析60 h;冻干后得到TSCO粗提物。TSCO提取率按公式(2)计算:
TSCO提取率![]()
(2)
式中:M1,粗提取物中TSCO含量,g/100 g;M2,冻干鱼皮中TSCO含量,g/100 g。
1.3.5 提取工艺研究
1.3.5.1 组分物质的量比对TSCO提取率的影响
控制提取过程中转速800 r/min、温度40 ℃、时间120 min,设置Bet-CA-W物质的量比分别为1∶1∶10、1∶1∶20、1∶1∶30、1∶2∶10、1∶2∶20、1∶2∶30、1∶3∶10、1∶3∶20、1∶3∶30、2∶1∶10、2∶1∶20、2∶1∶30、3∶1∶10、3∶1∶20、3∶1∶30,测定不同组分物质的量比下的TSCO提取率。
1.3.5.2 提取转速对TSCO提取率的影响
控制Bet-CA-W物质的量比2∶1∶30,提取过程中温度40 ℃、时间120 min,设置转速分别为400、600、800、1 000、1 200、1 400 r/min,测定不同转速下的TSCO提取率。
1.3.5.3 提取温度对TSCO提取率的影响
控制Bet-CA-W物质的量比2∶1∶30,提取过程中转速1 000 r/min、时间120 min,设置温度分别为20、30、40、50、60、70 ℃,测定不同温度下的TSCO提取率。
1.3.5.4 提取时间对TSCO提取率的影响
控制Bet-CA-W物质的量比2∶1∶30,提取过程中转速1 000 r/min、温度60 ℃,设置时间分别为60、120、180、240、300、360 min,测定不同提取时间下的TSCO提取率。
1.3.6 TSCO的纯化
采用葡聚糖凝胶G-50层析柱纯化TSCO粗提物。超纯水浸泡葡聚糖凝胶过夜使其充分膨胀;2.6 cm×50 cm层析柱,湿法灌柱,以0.1 mol/L乙酸平衡层析柱;取适量的TSCO粗提物溶解于0.1 mol/L乙酸,0.22 μm水相膜过滤后上样至平衡好的层析柱;以0.1 mol/L乙酸进行洗脱,每5 mL收集一次馏分并测定其在220 nm处的紫外吸光度值,绘制收集体积与吸光度的折线图,取半峰高内所有馏分,透析后冻干,得纯化的TSCO。
1.3.7 TSCO的表征
1.3.7.1 紫外可见光谱扫描
参考VEERURAJ等[15]的方法稍有改动,取适量冻干后的TSCO溶于0.5 mol/L冰乙酸中,配制成1 mg/mL 的TSCO溶液,10 000 r/min离心5 min,取上清液测定200~400 nm波长范围的吸光度,速度2 nm/s,以0.5 mol/L冰乙酸为空白对照,绘制吸光度随波长变化的曲线图。
1.3.7.2 FTIR扫描
称取适量冻干后TSCO样品,对其进行单点ATR模式样品采集,室内干燥。以空气为背景,扫描波数范围4 000~500 cm-1,速度0.2 cm/s。使用Spectrum V 10.4.3软件进行光谱分析;使用Peak Fit v4.12软件,选择了1 600~1 700 cm-1的区域分析TSCO的二级结构。
1.3.7.3 SDS-PAGE
取适量TSCO样品用0.02 mol/L PBS配制质量浓度为1.50 mg/mL的TSCO溶液,和上样缓冲液以4∶1的体积比混匀,沸水浴5 min;上样量15 μL,施加电压80 V到样品形成一条直线后,将电压升高至120 V;停止后,将电泳胶用考马斯亮蓝染色剂染色1 h;随后脱色过夜至电泳胶成透明状。
1.3.7.4 微观结构观察
用扫描电子显微镜观察冻干TSCO的微观形态。取适量样品用导电胶带固定在样品盘上,在15 mA下离子溅射镀金60 s,以提高其导电性。在5 kV的加速电压下,观察TSCO的表面结构(×90)。
1.3.8 数据分析
所有实验均重复3次,数据结果以“平均值±标准差”表示。采用SPSS 19.0软件,通过单因子方差分析方法,并采用Duncan’s法比较各组数据间的差异显著型,其中不同小写字母表示不同组间的数据差异显著(P<0.5)。采用Origin 2018软件对所得数据进行作图。
2 结果与分析
2.1 金枪鱼皮的基本营养成分分析
由表1可知,金枪鱼鱼皮粗蛋白含量为36.89%,占干重的62.82%,其中COL占总蛋白含量的70.69%,高于罗非鱼皮[16]、鳕鱼皮[17]等常用的水产COL提取原料。金枪鱼鱼皮是良好的水产COL来源,具有较好的开发潜力。
表1 金枪鱼皮的基本营养成分及COL含量 单位:g/100 g Table 1 Basic nutritional composition and collagen content of the tuna skin
水分灰分粗蛋白粗脂肪COL含量41.28±0.454.64±0.1736.89±1.3019.16±0.1726.08±1.56
2.2 不同DESs提取TSCO的制备与表征
2.2.1 不同DESs的状态及其对TSCO的提取率
图1可知4种DESs在室温状态下为透明液体,由于DES-5在60 ℃溶解,当温度降至室温后又结晶凝固,重新加热至60 ℃不能溶解,考虑到COL具有热不稳定性[4],为保证提取COL的完整三螺旋结构,后续实验不再选用DES-5溶剂进行。

图1 不同DESs图片
Fig.1 Pictures of different DESs
有研究表明,酸法提取COL的提取效果与COL在不同pH值的酸溶液中的溶解性有关[5]。由表2可知,4种DESs均为酸性但pH值不同。在氢键供体、氢键受体与水分比例为1∶1∶10,提取转速800 r/min、温度40 ℃、时间120 min的条件下,DES-2的TSCO提取率最高,达到86.20%。通过比较4种DESs的TSCO提取率与pH值可知二者无明显相关性,表明DESs在提取TSCO时不依靠其酸溶性。
表2 不同DESs的特性及提取率
Table 2 Characterizations and extraction rate of different DESs
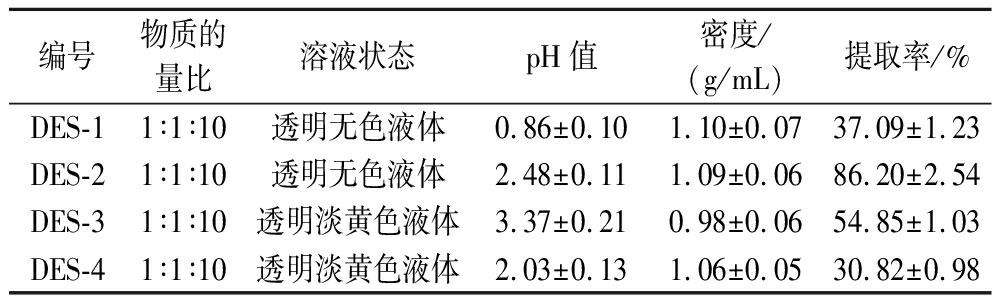
编号物质的量比溶液状态pH值密度/(g/mL)提取率/%DES-11∶1∶10透明无色液体0.86±0.101.10±0.0737.09±1.23DES-21∶1∶10透明无色液体2.48±0.111.09±0.0686.20±2.54DES-31∶1∶10透明淡黄色液体3.37±0.210.98±0.0654.85±1.03DES-41∶1∶10透明淡黄色液体2.03±0.131.06±0.0530.82±0.98
DESs主要依靠氢键与活性物质结合的方式提取COL,因此提取效率与DESs中氢键的数量、氢键键能、氢键与活性物质的结合效率等有主要关系[7]。根据每种组成成分所含氢键受体和氢键供体数量可确定,在氢键供体与氢键受体物质的量比为1∶1时(水分子形成的氢键忽略不计),4种DESs中1 mol的氢键数量分别为4、2、1、1个。当氢键数量相同时DES-4提取率小于DES-3,表明Bet所形成的氢键对TSCO的提取更有效;当氢键数量更多时,对TSCO提取率由大到小排序为DES-2>DES-3>DES-4,表明CA与Bet间形成的氢键对TSCO的提取效率最高。
2.2.2 不同DESs提取TSCO的SDS-PAGE分析
如图2所示,4种DESs提取的TSCO与COL标品的电泳条带具有一致性,在135 kDa左右有2个α链条带,其中较宽且颜色较深的为α1链、较窄且颜色较浅的为α2链,245 kDa左右有一条β链,还有更大分子质量的γ链。Ⅰ型COL通常是由3条α链组织,其中包含两条α1链和一条α2链[18]。表明4种DESs所提取的为Ⅰ型COL,且保留了较为完整的大分子质量多肽链。
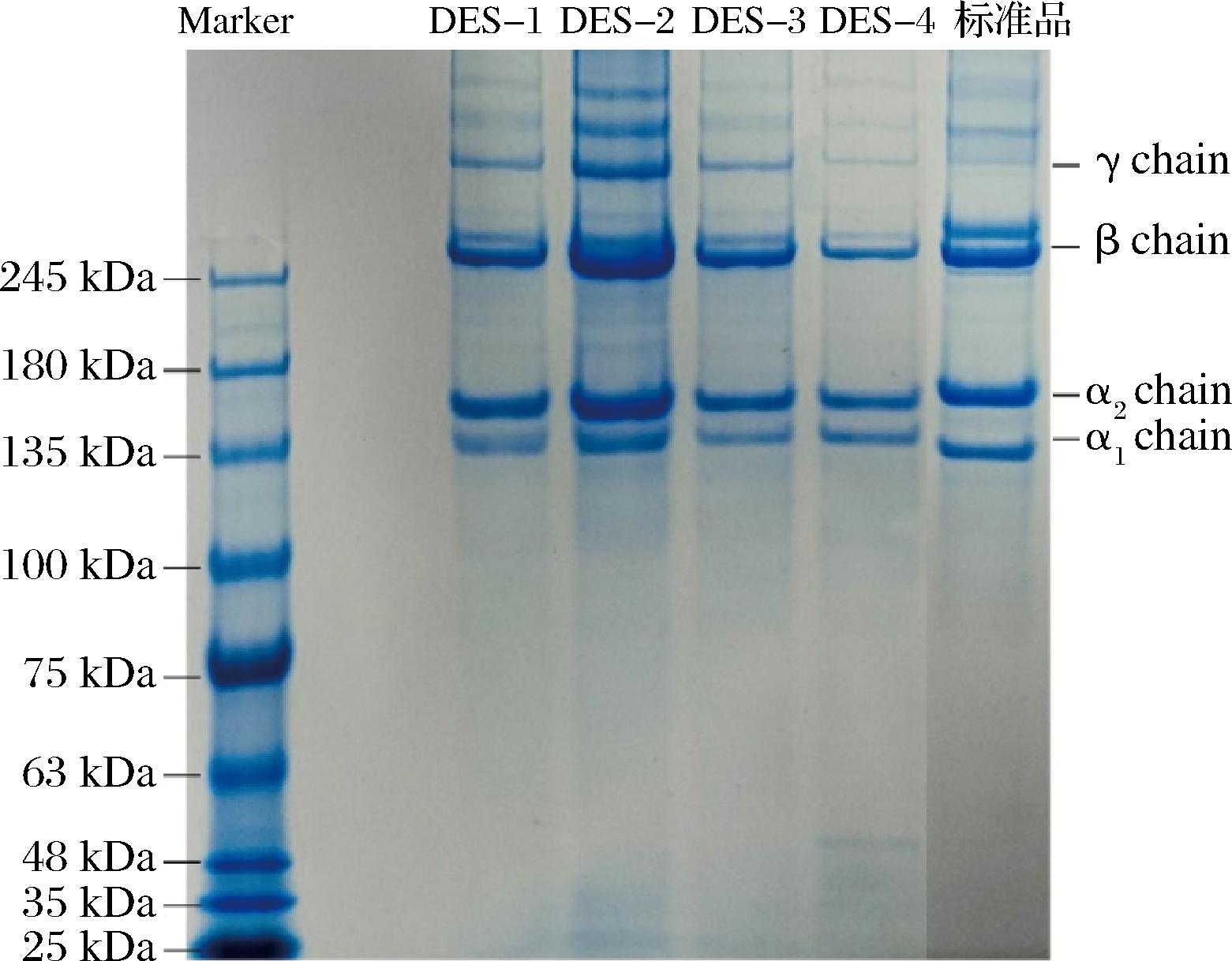
图2 不同DESs提取的TSCO蛋白的电泳结果
Fig.2 SDS-PAGE results of TSCO extracted from different DESs
2.2.3 不同DESs提取TSCO的红外光谱和二级结构分析
如图3-a所示,4种DESs提取的TSCO红外光谱图与COL标品相似。COL在红外光谱下的主要特征峰有酰胺A、酰胺B、酰胺I、酰胺Ⅱ、酰胺Ⅲ带吸收峰[19]。其中3 300 cm-1附近为酰胺A带吸收峰,表明具有N—H基团同时N—H参与氢键生成[19]。2 930 cm-1附近为酰胺B带吸收峰,一般与CH2基团有关。1 637 cm-1处为酰胺I带吸收峰,主要由羰基(C![]() O)伸缩振动产生,与COL的二级结构息息相关。1 551 cm-1处为酰胺Ⅱ带吸收峰,主要由C—N、N—H两个基团产生[20]。酰胺Ⅲ带参与生成COL的三螺旋结构,4种溶剂提取的TSCO在1 239 cm-1处均产生了明显的酰胺Ⅲ带吸收峰,表明所提取的是具有完整三螺旋结构的COL[21]。其中DES-1与DES-2所提取的TSCO酰胺Ⅲ吸收峰更高,表明在提取过程中对TSCO高级结构的破坏更少。另外,与COL标品相比,提取TSCO在1 720~1 740 cm-1处产生了一个较弱的吸收峰,可能是由于在提取过程中产生了副反应,生成了酮类、酯类物质,使得C
O)伸缩振动产生,与COL的二级结构息息相关。1 551 cm-1处为酰胺Ⅱ带吸收峰,主要由C—N、N—H两个基团产生[20]。酰胺Ⅲ带参与生成COL的三螺旋结构,4种溶剂提取的TSCO在1 239 cm-1处均产生了明显的酰胺Ⅲ带吸收峰,表明所提取的是具有完整三螺旋结构的COL[21]。其中DES-1与DES-2所提取的TSCO酰胺Ⅲ吸收峰更高,表明在提取过程中对TSCO高级结构的破坏更少。另外,与COL标品相比,提取TSCO在1 720~1 740 cm-1处产生了一个较弱的吸收峰,可能是由于在提取过程中产生了副反应,生成了酮类、酯类物质,使得C![]() O基团的吸收峰发生偏移。
O基团的吸收峰发生偏移。
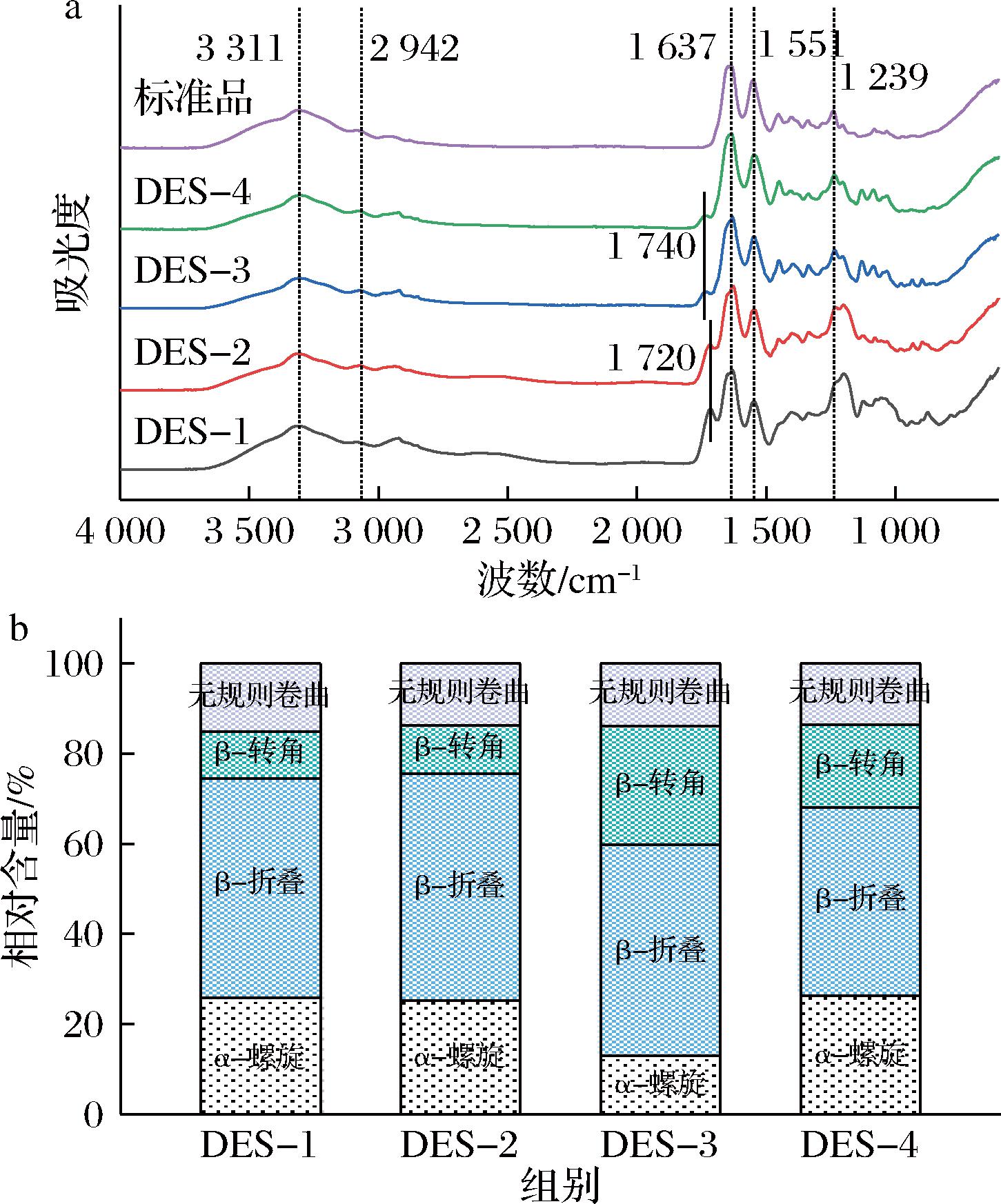
a-FTIR;b-二级结构分析
图3 不同DESs提取的TSCO的FTIR图和二级结构分析图
Fig.3 FTIR spectra and secondary structure analysis of TSCO extracted by different DESs
如图3-b所示,所有的DESs法提取的TSCO无规则卷曲占比低于20%,与传统酸法相比对COL的结构破坏更小。同时DES-1、DES-2、DES-4提取的TSCO中α-螺旋含量也高于酸法提取的TSCO,进一步表明DESs法提取的TSCO能够保留更为完整和有序的高级结构[12]。另外,在4种不同的DESs组合中,DES-3提取的TSCO含有的β-转角明显增多、α-螺旋明显减少,同样DES-4组合提取的TSCO中β-转角含量较DES-1、DES-2两组有所增加,这可能是由于在提取过程中乳酸破坏了TSCO的高级结构,使DES-3和DES-4组合提取的胶原蛋白产生一定程度的变性[22]。相比之下,DES-1、DES-2溶剂组合提取的TSCO结构更加完整,是较为合适的DESs组合。
2.2.4 不同DESs提取TSCO的紫外光谱分析
蛋白质中的芳香族氨基酸,例如酪氨酸(Tyr)、色氨酸(Trp)中含有苯环,在280、251 nm的特定波长下能够产生明显吸收峰[23]。区别于其他类蛋白质,COL中这些氨基酸含量较少,其紫外吸收峰主要是由C![]() O、羧基(COOH)、酰胺基团(CO—NH2)产生,出峰位置在230 nm处,也是COL的特征吸收峰[24]。如图4所示,4种DESs提取的TSCO在234 nm处产生了明显的吸收峰,与COL标品保持一致,表明所提取的为I型COL。另外,特征峰出峰位置发生了偏移,可能是由于在提取过程中暴露了更多发色基团;在280 nm处产生了一个较弱的宽峰,可能由暴露出的少量Tyr产生。对比4组TSCO的紫外吸收光谱,其中DES-2提取的TSCO在280 nm处的峰最为平缓,Tyr等发色基团暴露最少。进一步说明了DES-2对TSCO高级结构的解螺旋、解折叠等破坏作用最小。
O、羧基(COOH)、酰胺基团(CO—NH2)产生,出峰位置在230 nm处,也是COL的特征吸收峰[24]。如图4所示,4种DESs提取的TSCO在234 nm处产生了明显的吸收峰,与COL标品保持一致,表明所提取的为I型COL。另外,特征峰出峰位置发生了偏移,可能是由于在提取过程中暴露了更多发色基团;在280 nm处产生了一个较弱的宽峰,可能由暴露出的少量Tyr产生。对比4组TSCO的紫外吸收光谱,其中DES-2提取的TSCO在280 nm处的峰最为平缓,Tyr等发色基团暴露最少。进一步说明了DES-2对TSCO高级结构的解螺旋、解折叠等破坏作用最小。
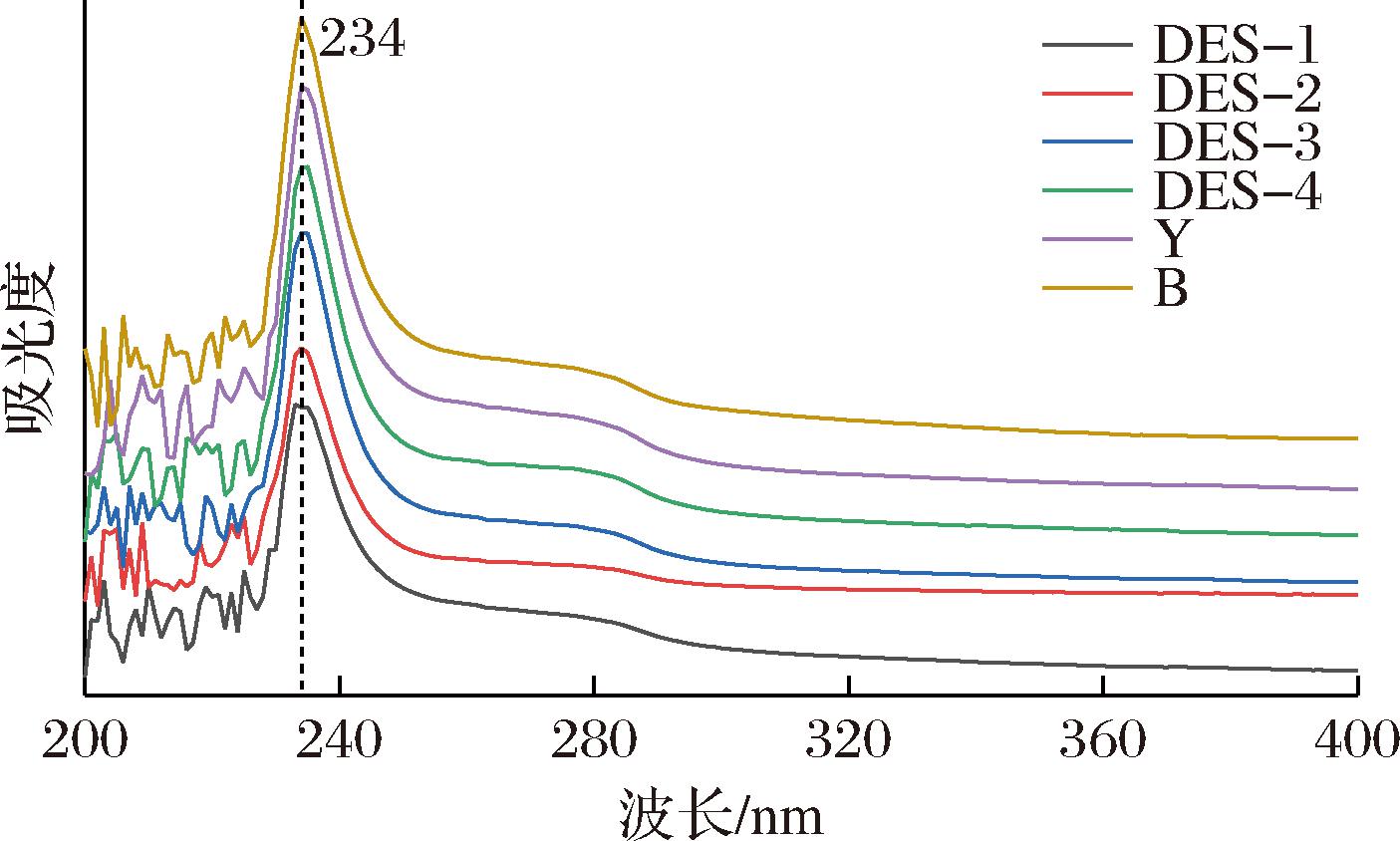
Y表示胶原蛋白标准品;B表示传统碱法提取胶原蛋白。
图4 不同DESs提取的TSCO的紫外光谱图
Fig.4 UV spectra of TSCO extracted from different DES solvents
2.3 不同条件对DESs提取TSCO的影响
DESs主要通过断裂溶剂内部氢键,再重新与提取物以氢键方式结合,因此DESs中氢键的含量和键能对提取效率有重要影响,改变氢键供体与氢键受体的物质的量比,溶液中的氢键数量也随之改变[5]。2.2节实验结果表明DES-2溶剂对TSCO的提取效率最高,结构破坏最小,因此,选取DES-2即Bet-CA-W组合进行进一步研究。在这一组合中,CA为氢键供体,Bet为氢键受体,每个CA分子含氢键供体数为4,每个Bet含氢键受体数为2[25]。在DESs中,水的主要作用是改变溶剂的黏度,增加溶剂的流动性,从而减少溶剂中的传质限制。另一方面水分子也可以参与氢键的形成,但与水分子形成的氢键键能较弱,对提取效果的影响相对有限[26]。温度是影响提取效率的主要外界因素之一,主要是由于温度会影响DESs的黏度和流动性。一般情况下,温度越高溶剂黏度越低、流动性越大。除此之外,温度也会通过影响传质效率从而影响提取效果[27]。WU等[28]研究表明,不含水的DESs会呈现出非牛顿流体特征,因此溶剂受到的剪切力会影响其状态,当DESs中含水量增加时,其流变特性又会发生改变。另外,TSCO提取过程中搅拌子高速旋转产生的剪切力会影响DESs的状态和料液接触程度,从而影响提取效果。因此,本研究首先通过对DES-2中3个组分的比例进行调整,并选取提取过程中的转速、温度、时间3个外界因素作为变量,以提取率作为参考值,来确定最后的提取条件。
2.3.1 组分比例
由图5-a可知,在CA物质的量比不变时,Bet占比越大,提取率越高,但随着水分添加量逐渐增多,Bet含量增加对提取率的影响逐渐减少,水分物质的量比为30时,TSCO提取率随Bet物质的量比增多呈先上升后下降的趋势;当Bet物质的量比<3时,提取率与水分占比成正相关,但Bet物质的量比为3时,提取率与水分占比呈负相关。由图5-b可知,当Bet物质的量比不变时,提取率与CA占比呈负相关,且这相关性不随水分占比的增加而改变;CA占比较低时,增加水分占比会提高TSCO的提取率,随着CA占比的增加,水分增加对提取率的提高逐渐变少,CA物质的量比为3时不同水分占比下的提取率没有显著差异。
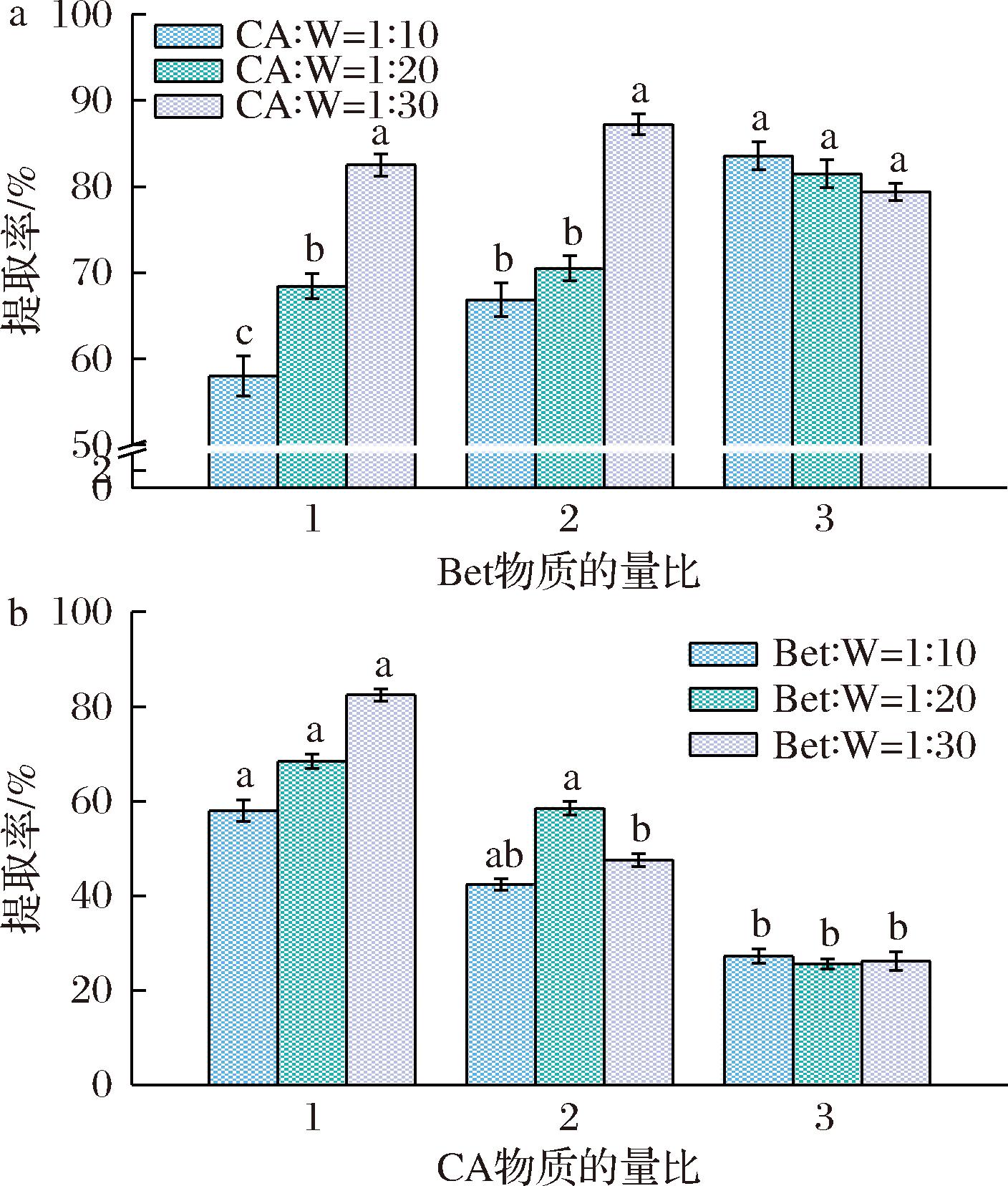
a-Bet及水分占比;b-CA及水分占比
图5 溶剂组分占比对提取率的影响
Fig.5 Influence of the percentage of solvent components on the extraction rate
注:a图中不同小写字母表示Bet占比不同时差异显著,b图中小写字母不同表示CA占比不同时差异显著(P<0.05)。
综上,适量的水分能够增加DESs的提取率,但当水分占比过高时,由于料液比不变,相同质量的DESs中的有效成分Bet-CA含量降低,会影响其对TSCO的提取效果。DES-2中,Bet含有氢键受体的数量为2,CA含氢键供体的数量为4,理论上当Bet∶CA=2∶1时能够形成稳定氢键的数量最多,实验结果显示在Bet∶CA∶W=2∶1∶30时提取率最高为87.24%,表明DESs中稳定氢键的数量越多,对TSCO的提取率越高。实验过程中发现,CA对DES-2黏度有较大的影响,添加CA量越多,溶剂黏度越大、流动性越差,因此会降低对TSCO的提取率;同时,未与Bet形成氢键的CA溶解于水中形成强酸性溶液,一部分TSCO溶解于CA溶液后,在较高的提取温度下变性沉淀,导致提取率降低。
2.3.2 不同提取条件
在2.3.1节所得的溶剂组分比例下,对提取条件如转速、温度、时间进行研究。如图6所示,随着以上3种提取条件的增加,提取率均呈先上升后下降的趋势。较大的剪切力、较高的温度以及较长的提取时间均可能导致TSCO的结构被破坏从而容易受到环境的影响而变性,最后导致提取率降低。另外,当温度过低时(20、30 ℃)也不利于TSCO的提取,低温会降低TSCO的溶解度从而使溶液的黏度过大,不利于后续透析、纯化等操作的进行。通过以上实验,得出TSCO的最高提取率为98.74%,此时的提取条件为转速为1 000 r/min、提取温度60 ℃、提取时间180 min。
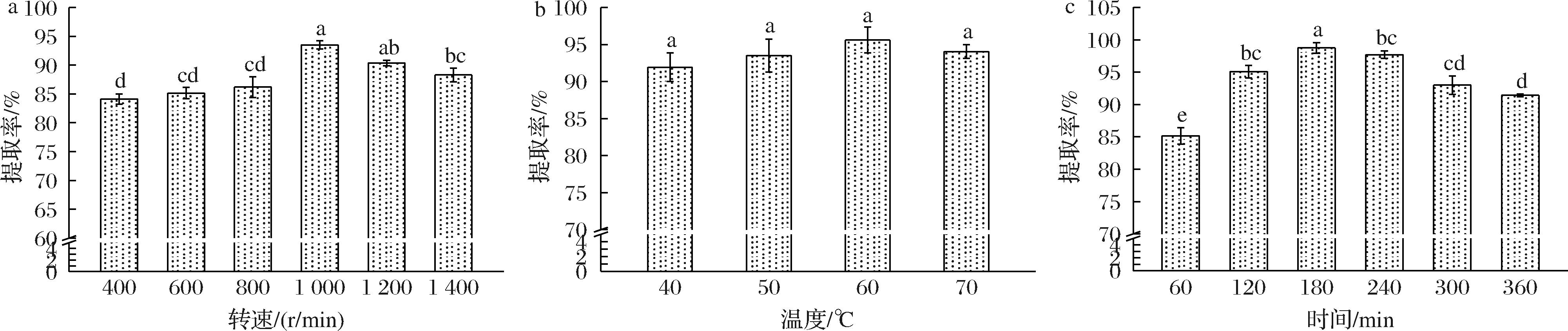
a-转速;b-温度;c-提取时间
图6 不同提取条件对提取率的影响
Fig.6 Effect of different extraction conditions on the extraction rate
2.4 TSCO粗提物的表征
为确保在本实验确定的提取条件下所得TSCO粗提物依旧保持较为完整的三螺旋结构,进一步对其进行表征分析。由图7可知,TSCO粗提物具有COL的特征峰,同时α-螺旋含量高于COL标品,表明在提取过程没有破坏其高级结构。
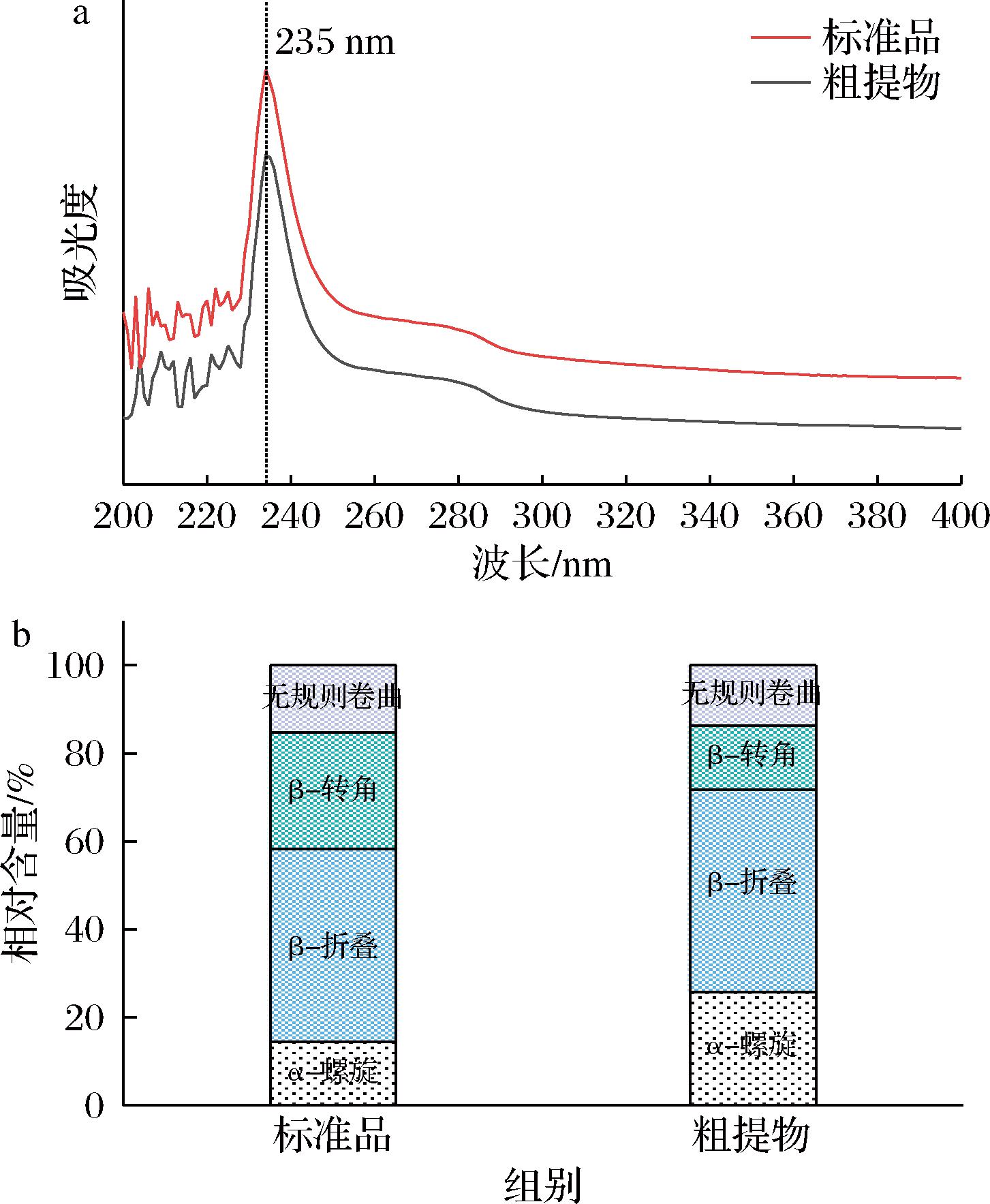
a-FTIR图;b-二级结构分析
图7 TSCO粗提物及纯化TSCO的FTIR图和二级结构分析图
Fig.7 FTIR spectra and secondary structure analysis of TSCO crude extract and purified TSCO
图8为DESs法和酸法提取的TSCO粗提物的微观结构,可以明显看出DESs法提取的TSCO呈网格状有序排列。表明DESs通过氢键结合的方式能够有效的保持TSCO的有序结构,减少传统酸法提取时不断使COL溶解、沉淀再溶解而产生的结构破坏。

a-DESs法提取纯化后CO;b-酸法提取CO
图8 不同方法提取的TSCO的扫描电镜图
Fig.8 SEM images of TSCO extracted by different methods
2.5 TSCO的纯化效果评价
纯化过程中接收馏分的吸光度变化如图9-a所示,选取图中灰色范围内的馏分进行透析冻干后,测定其Hyp含量以确定纯化后TSCO的纯度为91.4%,高于粗提TSCO(67.7%)和COL标品(80.4%)。如图9-b纯化前后TSCO电泳图所示,经柱层析纯化后,分子质量135 kDa的条带明显减少,说明纯化效果良好。
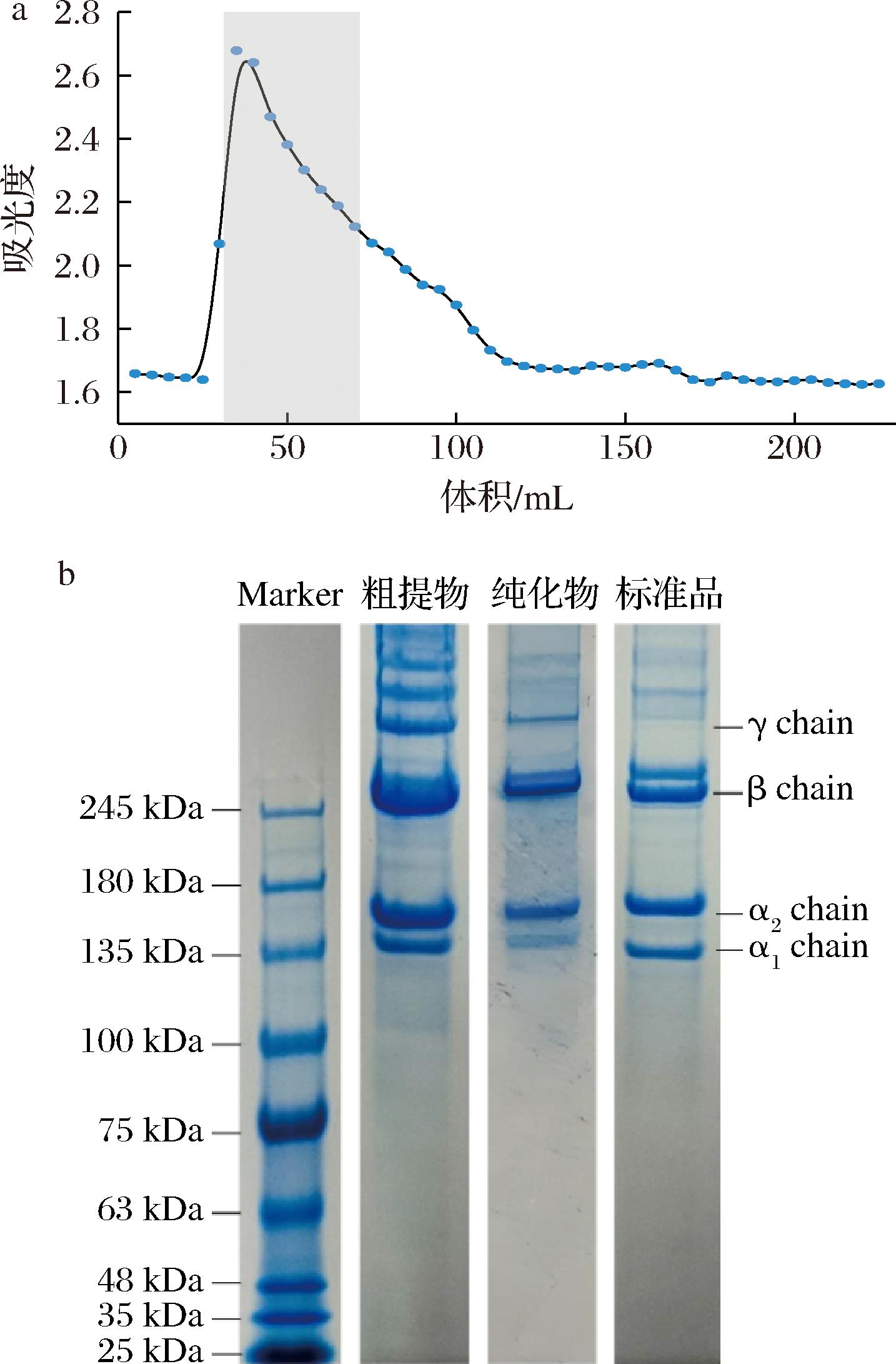
a-纯化过程中不同馏分吸光度变化曲线;b-TSCO粗提物及纯化TSCO的电泳图
图9 TSCO的纯化效果表征图
Fig.9 Characterization plot of the purification effect of TSCO
3 结论
本研究采用尿素、乳酸、Bet、CA、木糖醇5种可生物降解的天然成分制备了不同组合的DESs用于TSCO的提取。结果表明,与传统酸法相比,DESs法提取效率更高、耗时更短且无需控制低温条件,同时提取的TSCO结构更加有序且高级结构完整。研究发现,DESs对TSCO的提取效率主要与溶剂中氢键的含量及其与提取物结合的效率有关,而与溶剂的pH值无关,其中Bet-CA-W的DESs组合对TSCO的提取效率最高。通过单因素试验,确定了Bet、CA、W的物质的量比为2∶1∶30,并进一步改进提取条件,最终确定在转速1 000 r/min、提取温度60 ℃、提取时间180 min的条件下提取率最高,达98.74%。粗提TSCO的纯度为67.7%,经柱层析纯化后TSCO纯度达到91.4%,高于所购买的COL标准品(以Hyp含量为评价标准)。这些结果表明,使用天然产物制备的DESs在高效提取TSCO方面具有显著优势。未来研究可以进一步优化提取工艺,探索其他天然产物组合的可能性,对提取的TSCO进行更深入的功能性研究,评估其在食品、医药和化妆品等领域的应用潜力。并研究DESs法在工业规模上的应用的可行性,促进这一绿色提取方法的商业化。
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会.中国渔业统计年鉴—2023[M].北京:中国农业出版社, 2023.Ministry of Agriculture and rural fisheries Administration, National Fisheries Technology Extension Center, China Society of Fisheries.China Fishery Yearbook-2023[M].Beijing:Agricultural Press of China, 2023.
[2] 高飞, 徐剑宏, 王晋, 等.金枪鱼营养价值及加工现状研究进展[J].食品研究与开发, 2023, 44(15):212-218.GAO F, XU J H, WANG J, et al.Research progress on the nutritional value and processing status of tuna[J].Food Research and Development, 2023, 44(15):212-218.
[3] JAFARI H, LISTA A, SIEKAPEN M M, et al.Fish collagen:Extraction, characterization, and applications for biomaterials engineering[J].Polymers, 2020, 12(10):2230.
[4] BLANCO M, V ZQUEZ J A, PÉREZ-MART
ZQUEZ J A, PÉREZ-MART N R I, et al.Collagen extraction optimization from the skin of the small-spotted catshark (S.canicula) by response surface methodology[J].Marine Drugs, 2019, 17(1):40.
N R I, et al.Collagen extraction optimization from the skin of the small-spotted catshark (S.canicula) by response surface methodology[J].Marine Drugs, 2019, 17(1):40.
[5] LAASRI I, BAKKALI M, MEJIAS L, et al.Marine collagen:Unveiling the blue resource-extraction techniques and multifaceted applications[J].International Journal of Biological Macromolecules, 2023, 253(Pt 6):127253.
[6] OSAMEDE AIROUYUWA J, SIVAPRAGASAM N, ALI REDHA A, et al.Sustainable green extraction of anthocyanins and carotenoids using deep eutectic solvents (DES):A review of recent developments[J].Food Chemistry, 2024, 448:139061.
[7] TAGHAVI DEHAGHANI M S, ESFANDIARI Z, ROSTAMABADI H, et al.Application of amino acid-based natural deep eutectic solvents in extraction of different analytes:A review study[J].Trends in Food Science &Technology, 2024, 147:104448.
[8] ZAHRINA I, NASIKIN M, MULIA K.Evaluation of the interaction between molecules during betaine monohydrate-organic acid deep eutectic mixture formation[J].Journal of Molecular Liquids, 2017, 225:446-450.
[9] THU HANG N, THI THU HA D, HANG NGA N, et al.Deep eutectic solvent combined with soybean as an efficient approach to enhance the content of apigenin in the Chrysanthemum indicum L.extract[J].Food Chemistry, 2024, 445:138793.
[10] BEN TEZ-CORREA E, BAST
TEZ-CORREA E, BAST AS-MONTES J M, ACU
AS-MONTES J M, ACU A-NELSON S, et al.Effect of choline chloride-based deep eutectic solvents on polyphenols extraction from cocoa (Theobroma cacao L.) bean shells and antioxidant activity of extracts[J].Current Research in Food Science, 2023, 7:100614.
A-NELSON S, et al.Effect of choline chloride-based deep eutectic solvents on polyphenols extraction from cocoa (Theobroma cacao L.) bean shells and antioxidant activity of extracts[J].Current Research in Food Science, 2023, 7:100614.
[11] LIANG X, WANG S, ZHOU J, et al.A novel deep eutectic solvent/switchable-hydrophilicity solvent/H2O system with enhanced CO2 switchability for integrated extraction of phenolics, flavonoids and essential oil from Flos Chrysanthemi Indici flower[J].Separation and Purification Technology, 2024, 336:126315.
[12] BISHT M, MARTINS M, DIAS A C R V, et al.Uncovering the potential of aqueous solutions of deep eutectic solvents on the extraction and purification of collagen type I from Atlantic codfish (Gadus morhua)[J].Green Chemistry, 2021, 23(22):8940-8948.
[13] BATISTA M P, FERN NDEZ N, GASPAR F B, et al.Extraction of biocompatible collagen from blue shark skins through the conventional extraction process intensification using natural deep eutectic solvents[J].Frontiers in Chemistry, 2022, 10:937036.
NDEZ N, GASPAR F B, et al.Extraction of biocompatible collagen from blue shark skins through the conventional extraction process intensification using natural deep eutectic solvents[J].Frontiers in Chemistry, 2022, 10:937036.
[14] ALVES V R, GONÇALVES S, DAGUER H, et al.Development of a new method for the determination of 4-hydroxyproline as a measurement of collagen content in meat products and dietary supplements by cyclodextrin-assisted electrokinetic chromatography[J].Journal of Food Composition and Analysis, 2023, 122:105431.
[15] VEERURAJ A, ARUMUGAM M, AJITHKUMAR T, et al.Isolation and characterization of collagen from the outer skin of squid (Doryteuthis singhalensis)[J].Food Hydrocolloids, 2015, 43:708-716.
[16] SUN S S, GAO Y H, CHEN J D, et al.Identification and release kinetics of peptides from tilapia skin collagen during alcalase hydrolysis[J].Food Chemistry, 2022, 378:132089.
[17] SILVA I, VAZ B M C, SOUSA S, et al.Gastrointestinal delivery of codfish skin-derived collagen hydrolysates:Deep eutectic solvent extraction and bioactivity analysis[J].Food Research International, 2024, 175:113729.
[18] SHARMA U, CARRIQUE L, VADON-LE GOFF S, et al.Structural basis of Homo- and heterotrimerization of collagen I[J].Nature Communications, 2017, 8:14671.
[19] ABRAHAM E T, OECAL S, MÖRGELIN M, et al.Collagen’s primary structure determines collagen:HSP47 complex stoichiometry[J].Journal of Biological Chemistry, 2021, 297(6):101169.
[20] QIN L, BI J R, LI D M, et al.Unfolding/refolding study on collagen from sea cucumber based on 2D Fourier transform infrared spectroscopy[J].Molecules, 2016, 21(11):1546.
[21] HEIDARI M G, REZAEI M, PEZESHK S.Ultrasound-mediated technique for facilitating collagen recovery from yellowfin (Thunnus albacares) skin:Insight into the structure, functional and antioxidant specification[J].Journal of Aquatic Food Product Technology, 2024, 33(2):139-160.
[22] LIU D S, WEI G M, LI T C, et al.Effects of alkaline pretreatments and acid extraction conditions on the acid-soluble collagen from grass carp (Ctenopharyngodon idella) skin[J].Food Chemistry, 2015, 172:836-843.
[23] AHN H, GONG D J, LEE H H, et al.Mechanical properties of porcine and fish skin-based collagen and conjugated collagen fibers[J].Polymers, 2021, 13(13):2151.
[24] LIU Y W, MA D H, WANG Y H, et al.A comparative study of the properties and self-aggregation behavior of collagens from the scales and skin of grass carp (Ctenopharyngodon idella)[J].International Journal of Biological Macromolecules, 2018, 106:516-522.
[25] GRISALES-MEJ A J F, CEDE
A J F, CEDE O-FIERRO V, ORTEGA J P, et al.Advanced NADES-based extraction processes for the recovery of phenolic compounds from Hass avocado residues:A sustainable valorization strategy[J].Separation and Purification Technology, 2024, 351:128104.
O-FIERRO V, ORTEGA J P, et al.Advanced NADES-based extraction processes for the recovery of phenolic compounds from Hass avocado residues:A sustainable valorization strategy[J].Separation and Purification Technology, 2024, 351:128104.
[26] ALCALDE R, AGUILAR N, ESCOBEDO-MONGE M A, et al.On the properties of water in betaine-based deep eutectic solvents[J].Journal of Molecular Liquids, 2024, 406:124871.
[27] MILANI G, VIAN M, CAVALLUZZI M M, et al.Ultrasound and deep eutectic solvents:An efficient combination to tune the mechanism of steviol glycosides extraction[J].Ultrasonics Sonochemistry, 2020, 69:105255.
[28] WU L F, LI L, CHEN S J, et al.Deep eutectic solvent-based ultrasonic-assisted extraction of phenolic compounds from Moringa oleifera L.leaves:Optimization, comparison and antioxidant activity[J].Separation and Purification Technology, 2020, 247:117014.