Monacolin K(MK)是一种聚酮类化合物,能通过竞争性高效抑制胆固醇合成过程中限速酶——3-羟基-3-甲基戊二酰辅酶A还原酶(hydroxy methylglutaryl coenzyme A reductase, HMGR)的活性,从而降低血液中的胆固醇水平,因此被广泛用作降脂药物[1]。此外,MK还具有抗炎抗菌、抗癌防癌、保护神经和改善抑郁症等作用[2]。MK主要由微生物发酵转化形成,尤其以红曲菌为代表。红曲菌是一种好氧、耐酸、可食用的腐生丝状真菌,可在25~40 ℃的温度范围和2.0~8.0的pH范围内生长[3]。大量研究表明,与合成MK相比,红曲菌代谢的MK具有更低的结晶度和更高的溶解度,且具有更显著的降胆固醇、抗癌、降血脂等功效[4-6]。但MK产量受到菌株、基质、发酵条件等因素影响[7]。
近几年来,随着大健康产业与“大食物观”发展,特色杂粮越来越受到关注。杂粮与微生物结合产生了大批功能性食品。以薏苡酯、薏苡素、黄酮、多酚、谷维素等为主的薏米红曲、苦荞红曲等功效作用被深度挖掘[8-10]。MK是红曲菌重要的次级代谢产物之一,其生产工艺、功效作用等研究在大米基质中较为透彻,但在杂粮基质上的研究较少,还有待深入。ZHANG等[11]、林琳等[12]研究发现采用红曲菌株发酵,小米、荞麦等基质合成MK的效果比大米更好。杂粮能有效刺激红曲菌相关合成MK基因簇的高表达,从而提高MK产量。同时红曲也能促进杂粮中其他生物活性组分的高效释放。课题组前期研究也表明,与小米、燕麦和薏米相比,苦荞蒸煮后黏性较小,颗粒松散,有助于紫红曲菌在颗粒表面均匀生长[13]。利用紫红曲发酵苦荞,能显著富集芦丁、槲皮素和反式肉桂酸等酚类化合物[8];发酵薏米,能显著增加α-生育酚、γ-谷维素、薏苡酯和亚油酸等含量[14-15]。而杂粮红曲发酵实现MK大量富集的工艺及产品特性的研究少见报道。
因此,鉴于MK的特征性功效,以杂粮红曲开发为依托,本课题从红曲菌株、杂粮基质、发酵工艺三层面开展研究,以高产MK为靶向目标,优化杂粮红曲发酵工艺,评价产品品质,探讨杂粮红曲发酵工艺可行性、产品品质优特性。旨为高MK红曲产品研发、杂粮精深加工延伸产业链,奠定理论基础、提供技术支撑。
1 材料与方法
1.1 实验材料
紫色红曲菌(Monascus purpureus)CGMCC 3.4629由实验室保存、橙色红曲菌(Monascus aurantiacus)CGMCC 3.890和锈色红曲菌(Monascus rubiginosus)CGMCC 3.7196由贵州省农业科学院生物技术研究所贺圣凌老师惠赠。红曲菌株在PDA培养基上30 ℃培养7 d后,活菌数达106 CFU/mL,用于后续接种。
洛伐他汀、芦丁、没食子酸、槲皮素、山奈酚标准品(纯度≥98%)、D(+)-无水葡萄糖标准品(纯度≥98%),北京索莱宝科技有限公司。组胺、色胺、尸胺、腐胺、精胺、亚精胺、苯乙胺、酪胺标准品(纯度>99%)、丹磺酰氯,上海Sigma公司。甲醇、乙腈、冰乙酸等均为色谱纯,上海阿拉丁公司;其他试剂均为分析纯。
大米,贵州贵元米业公司;薏米,贵州兴仁薏仁米电商公司;苦荞,贵州东方神谷公司;燕麦、小米,贵州峰晟食品公司。
1.2 种子液制备
将3株可用于食品生产的红曲菌分别于斜面PDA培养基上30 ℃培养6 d后,添加30 mL无菌蒸馏水,制备成孢子悬液。取1.5 mL孢子悬液接种到含有0.9 g大米粉的30 mL液体中,30 ℃、180 r/min培养3 d[15]。
1.3 杂粮红曲固态发酵
杂粮原料分别用蒸馏水浸泡8 h后沥干,按25 g/150 mL量装入锥形瓶中,固液比25∶8(g∶mL),pH自然,灭菌后接种8%种子液,30 ℃发酵9 d。发酵物烘干、粉碎,过60目筛,待测。
1.4 MK发酵工艺研究
1.4.1 单因素试验
苦荞用蒸馏水浸泡8 h后沥干,按25 g/150 mL量装入锥形瓶,固液比25∶8(g∶mL),pH 5,灭菌。考察不同固液比(25∶6、25∶10、25∶14、25∶18,g∶mL)、初始pH值(2、3、4、5)、接种量(4%、8%、12%、16%,以苦荞质量计)、温度(24、26、28、30 ℃)对MK产量的影响。
1.4.2 正交试验设计
以MK产量为指标,设计L9(34)正交试验(表1)。各因素对MK产量的影响占比按公式(1)计算:
占比![]()
(1)
表1 发酵工艺优化正交实验的因素和水平
Table 1 Factors and levels of orthogonal experiments for fermentation process optimization
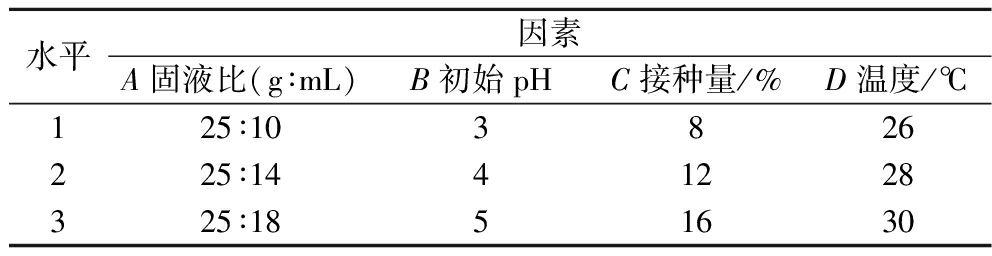
水平因素A固液比(g∶mL)B初始pHC接种量/%D温度/℃125∶103826225∶1441228325∶1851630
1.5 理化分析、微生物检验
理化指标、真菌毒素与微生物检验方法如表2所示。
表2 理化指标和微生物检测方法
Table 2 Physicochemical indexes and microbiological detection methods

指标方法感官评定T/ZZB 1452—2019《功能性红曲米(粉)》中感官要求色差使用手持式便携色差仪检测水分GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中直接干燥法淀粉GB 5009.9—2023《食品安全国家标准 食品中淀粉的测定》中酸水解法总糖GB 5009.8—2023《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》中HPLC法粗蛋白GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中分光光度法桔青霉素QB/T 2847—2023《功能性红曲米(粉)》黄曲霉毒素B1GB 5009.22—2016《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》中的薄层色谱法大肠菌群GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》霉菌GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》沙门氏菌GB 4789.4—2024《食品安全国家标准 食品微生物学检验 沙门氏菌检验》金黄色葡萄球菌GB 4789.10—2016《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》
1.6 生物量检测
红曲菌于相同条件下摇床培养3 d后,用预先称重的0.8 μm混合纤维素酯膜真空过滤,收集菌丝,蒸馏水洗涤3次,60 ℃干燥至恒重称量[16]。
1.7 红曲色价检测
色价测定参考GB 1886.19—2015《食品安全国家标准 食品添加剂 红曲米》:将样品溶解于乙醇(70%),60 ℃水浴1 h,过滤。将滤液稀释一定倍数后,于505 nm处测量稀释液的吸光度。色价计算如公式(2)所示:
色价![]()
(2)
式中:A,稀释吸光度;V,乙醇提取体积,mL;n,稀释倍数;m1,样品的质量,g;V,吸取乙醇提取液的体积,mL。
1.8 MK检测
将样品溶解于乙醇(体积分数为75%),室温下超声浸提30 min,离心取上清液,过0.22 μm微孔滤膜后,利用高效液相色谱仪(Agilent 1260)检测酸式和内酯式MK[8]。HPLC检测条件为:色谱柱AgilentTC-C18(5 μm,4.6 mm×250 mm),流动相V(甲醇)∶V(0.1%磷酸水溶液,体积分数)=80∶20,流速1 mL/min,柱温30 ℃,进样量10 μL,紫外检测波长237 nm。样品中MK总含量计算如公式(3)所示:
MK含量/(mg/kg)=AMK+LMK
(3)
式中:AMK,酸式MK含量,mg/kg;LMK,内酯式MK含量,mg/kg。
1.9 总酚、总黄酮及黄酮类化合物含量检测
使用Folin-Ciocalteu 比色法测定总酚含量(total phenolic content,TPC)[17],稍有修改。将1.0 g样品溶于20 mL甲醇溶液(80%,体积分数),40 ℃超声提取40 min,离心取上清液,重复操作一次,合并上清液,定容,待测。将1 mg没食子酸标准品溶解于1 mL甲醇溶液(70%,体积分数),先后加入1 mL Folin-Ciocalteu试剂和1 mL Na2CO3溶液(0.83 mol/L),摇匀,避光反应90 min,待测。在760 nm波长下测定标准液和待测液的吸光度。TPC计算为每100 g样品(DW)中没食子酸毫克数。
使用HPLC法测定总黄酮含量(total flavone content,TFC)[8]。将芦丁、山奈酚、槲皮素标准品用无水乙醇配制成1.0 mg /mL标准品储备液。将标准品储备液和待测液分别稀释一定倍数,过0.22 μm微孔滤膜。HPLC检测条件为:高效液相色谱仪Agilent 1260,色谱柱AgilentTC-C18(5 μm,4.6 mm×250 mm),流动相A、B分别为乙腈和1%冰乙酸,流速1 mL/min,柱温30 ℃,进样量20 μL,紫外检测波长280 nm。TFC使用标准芦丁曲线计算,并表示为每100 g样品(DW)的芦丁毫克数。
1.10 生物胺检测
按照张殿伟等[18]测定样品生物胺含量,稍作修改。
标准液制备与衍生:分别称取8种生物胺标准品,用0.4 mol/L的高氯酸溶解并定容10 mL,取适量标准液配成1.0、2.5、5.0、10、20、50 mg/L的标准混合溶液。准确吸取1 mL生物胺标准混合液,依次加入200 μL NaOH溶液(2 mol/L)、300 μL饱和NaHCO3溶液、2 mL丹磺酰氯衍生剂,60 ℃恒温水浴下避光反应45 min后,加入100 μL的氨水终止反应。用乙腈定容到5 mL,过0.22 μm微孔滤膜,备用。
样品制备:分别准确称取5 g未发酵苦荞和红曲苦荞,加入20 mL高氯酸溶液(0.4 mol/L),超声30 min,离心并转移上清液至50 mL容量瓶中,残渣重复操作一次,合并上清液,定容。样品的衍生与生物胺混合标准溶液处理的方法一样。
HPLC检测条件为:高效液相色谱仪Agilent 1260,色谱柱AgilentTC-C18色谱柱(5 μm,4.6 mm×250 mm),流动相A、B分别为水和乙腈,柱温30 ℃,流速1 mL/min,进样量20 μL,紫外检测波长254 nm。
1.11 数据统计与分析
所有试验均重复3次,结果以“平均值±标准差”表示。应用SPSS 25.0和Origin 2021进行统计分析。
2 结果与分析
2.1 高生物量红曲菌株筛选
MK是一种胞内产物,其产量通常与菌体生物量成正比关系[19]。3株红曲菌在相同条件下培养3 d后,M.purpureus 3.4629的菌体生物量最高(P<0.05),达6.23 g/L(图1)。PDA平板上,M.purpureus 3.4629的颜色更红,菌落更大,菌丝生长更密集,表明该菌生长旺盛,菌体活力高。毛继龙等[20]的研究也表明紫红曲M4于米粉液体培养基上菌体生物量最高,其相应MK的产量也最高。因此,选择菌株M.purpureus 3.4629作为后续发酵的优势红曲菌株。
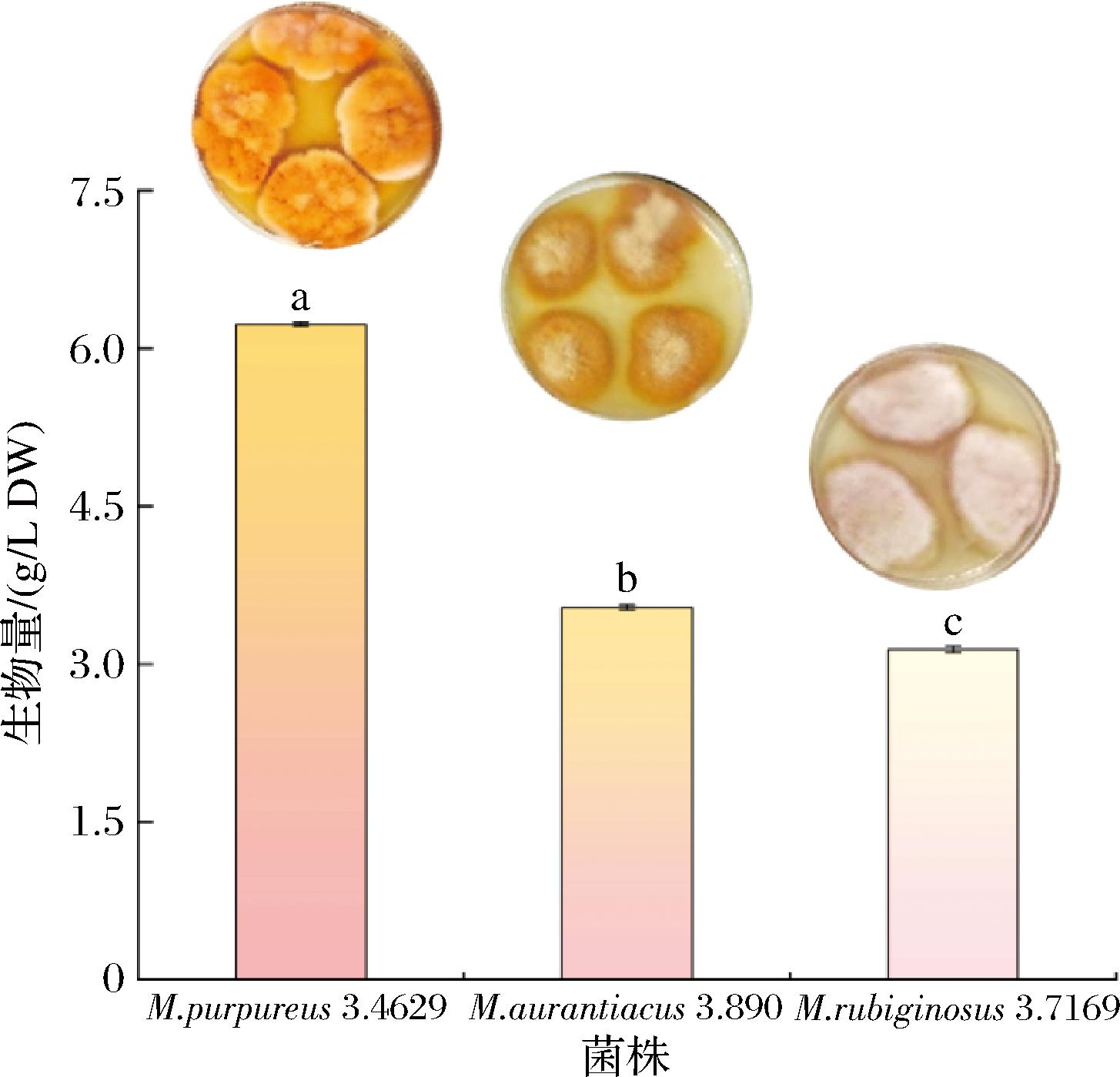
图1 不同红曲菌株的生物量比较
Fig.1 Comparison of biomass of different Monascus strains
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 高产MK的杂粮基质筛选
以大米为对照,探究不同杂粮基质对MK产量的影响(图2)。4种杂粮发酵后,苦荞产MK和红曲色素的量最高(P<0.05),分别达到80.10 mg/kg和299.20 U/g。ZHANG等[11]的研究发现,谷物的粒径、吸水能力、黏性和营养组成等均会影响MK的产量。苦荞粒径适中、吸水性良好,蒸煮后质地松散、黏性较小,能为红曲菌生长和代谢提供足够的空间、水分和氧气[12-13]。而小米粒径较小,蒸煮后黏性大易结块,氧气难以流通,抑制紫红曲菌生长,从而导致小米MK的产量最低。虽然杂粮基质MK生成量整体略低于大米,但它们丰富的营养功效组分,也成为开发复合型具多重生理活性组分功能产品的良好载体。因此,选择苦荞作为后续发酵优良基质。
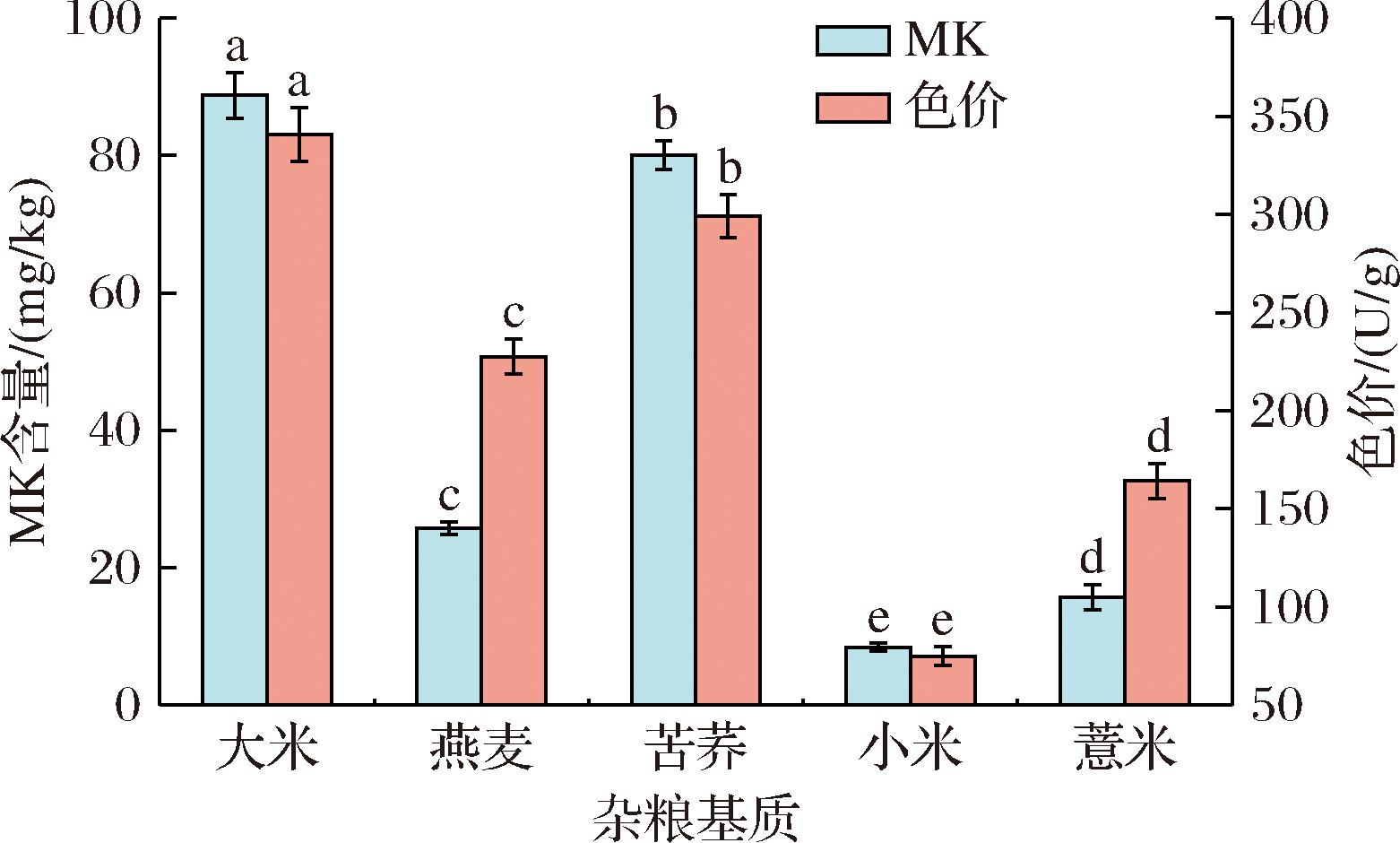
图2 杂粮基质对MK和色价的影响
Fig.2 Effect of coarse cereals substrates on MK content and color value
2.3 发酵条件对MK合成的影响
发酵条件对苦荞红曲中MK产量的影响显著(图3)。固液比为25∶18时,MK产量最高,达133.56 mg/kg(P<0.05)。红曲色素的产量在固液比25∶6时最高。MK和红曲色素均通过聚酮途径合成,固液比的变化显示紫红曲菌在高含水量下更倾向合成MK。当基质初始pH值为5.0时,其MK产量最高(P<0.05),达143.31 mg/kg,这与黄群等[21]的研究一致。当pH适宜时,可增加紫红曲菌细胞膜通透性,提高酶促反应,促进菌体对苦荞基质的转化[22]。接种量在12%时,所得红曲中MK和色素含量最高(P<0.05),分别达145.10 mg/kg和469.01 U/g。此时紫红曲菌繁殖旺盛,有利于提高菌体生物量,促进MK富集。但随着接种量增大,菌体密集度过高,生长竞争机制反而会影响MK的产量[11]。温度也是影响MK合成的重要因素。当温度为28 ℃时,MK的产量最高(P<0.05),达138.90 mg/kg,这与魏巍[23]的研究结论一致。
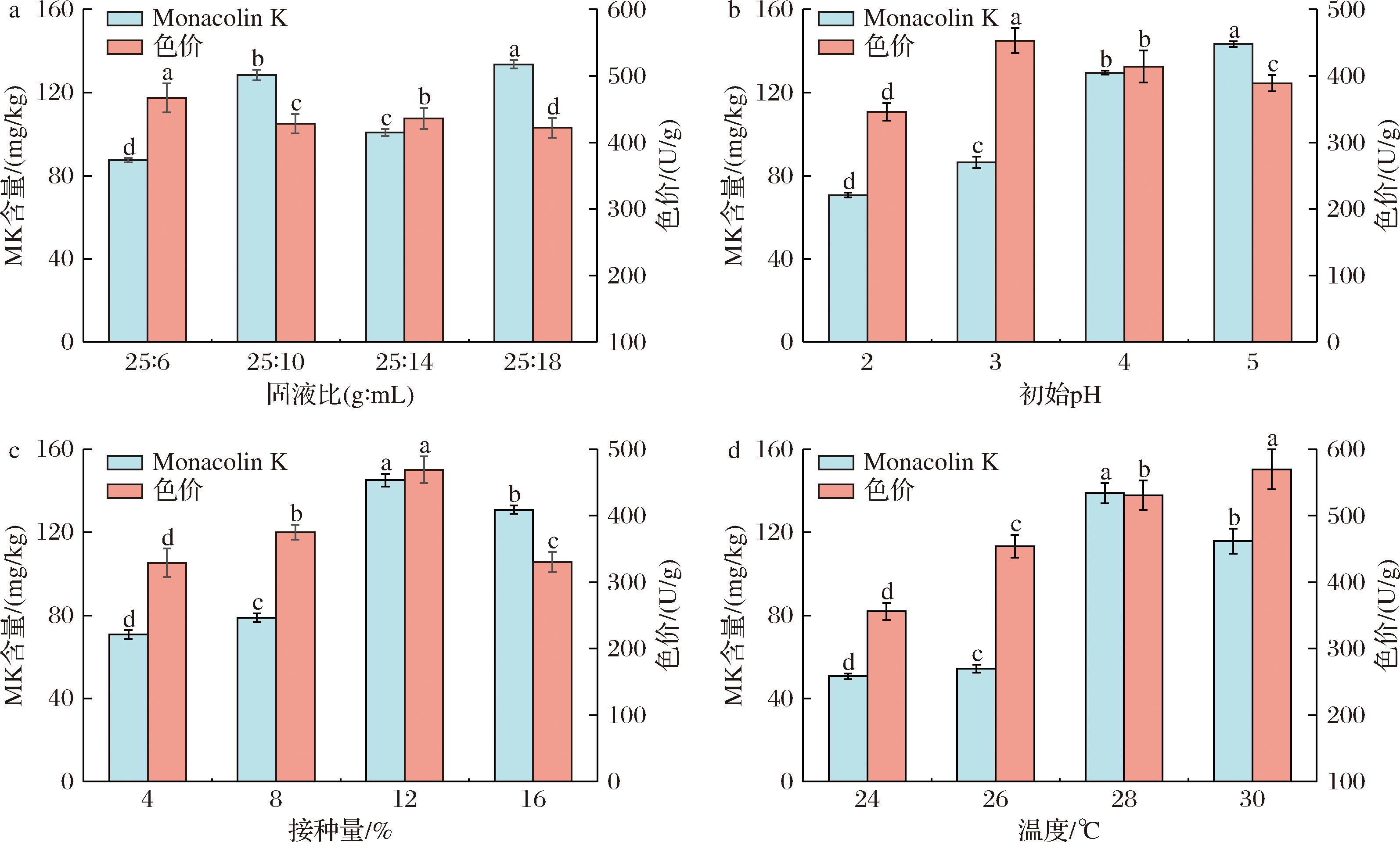
a-固液比;b-初始pH;c-接种量;d-温度
图3 不同发酵条件对MK和色价的影响
Fig.3 Effect of difference fermentation conditions on MK content and color value
2.4 高产MK的发酵工艺优化
通过正交优化试验表明,固液比、初始pH、接种量、温度对MK产量影响存在显著差异(表3)。发酵条件对MK产量的影响顺序为:C>A>D>B,即接种量>固液比>温度>初始pH(图4)。紫红曲固态发酵苦荞高产MK的最优工艺为C1A1D3B4,即固液比25∶10(g∶mL)、初始pH 4、接种量8%、温度30 ℃,在此优化条件下发酵9 d后,苦荞红曲中MK总含量可达200.00 mg/kg,较优化前提高150%(P<0.05)。
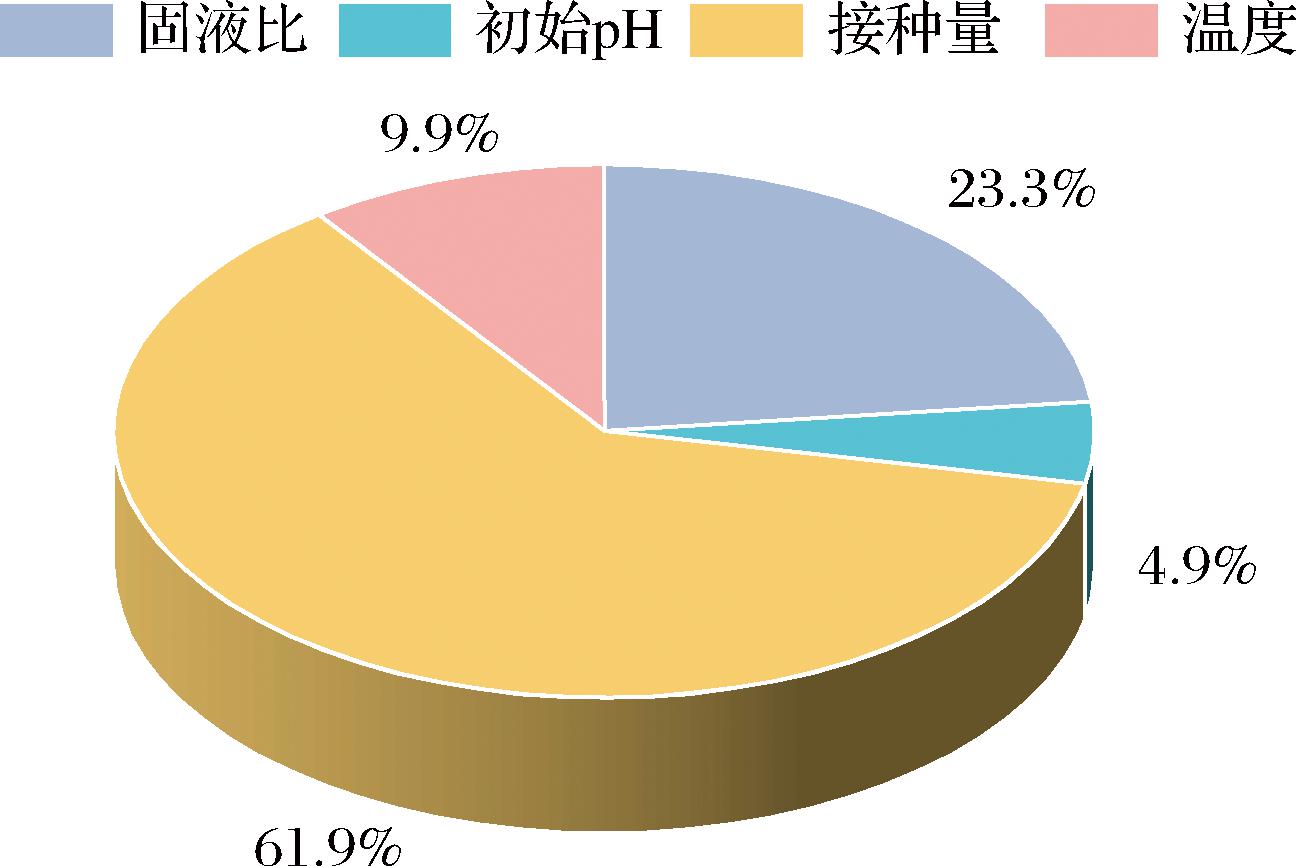
图4 发酵条件对MK产量的影响占比
Fig.4 Effect of fermentation conditions on MK yield
表3 MK发酵工艺优化的正交试验结果和分析
Table 3 Results and analysis of orthogonal experiments for MK fermentation process optimization
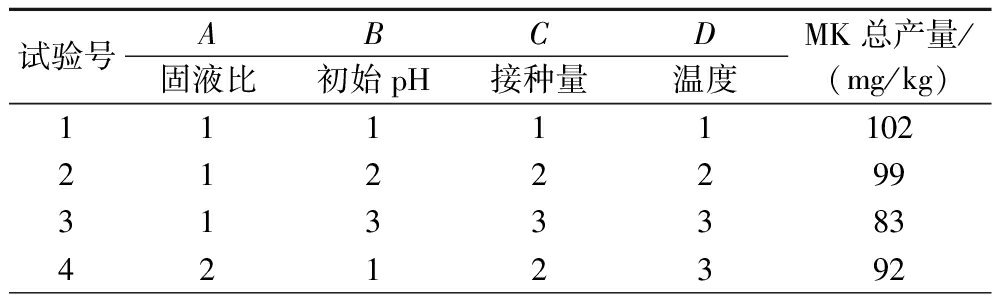
试验号ABCD固液比初始pH接种量温度MK总产量/(mg/kg)11111102212229931333834212392
续表3
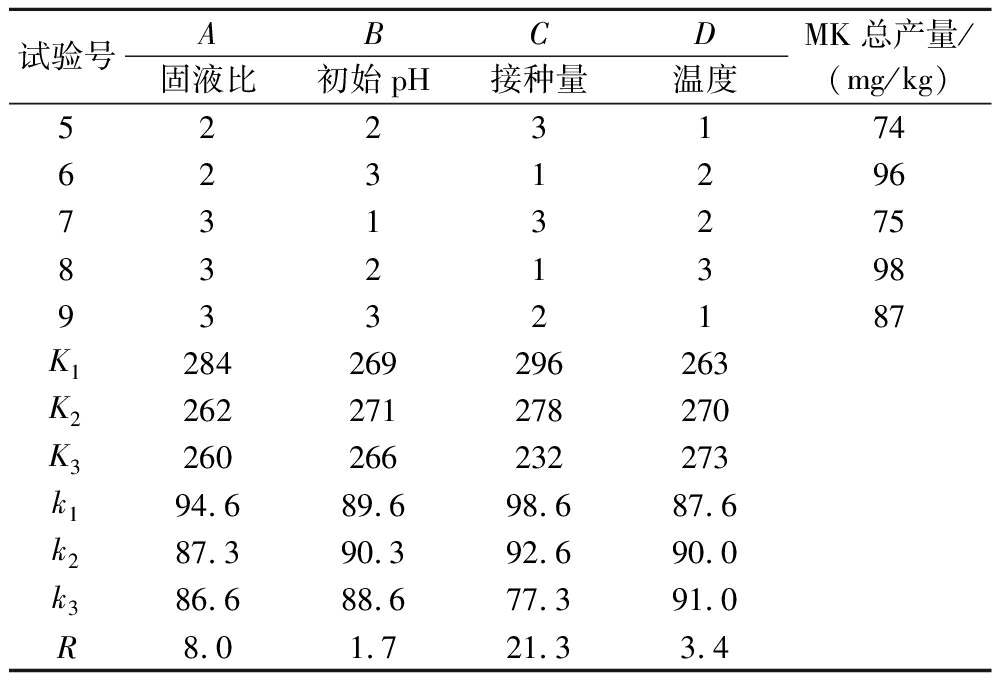
试验号ABCD固液比初始pH接种量温度MK总产量/(mg/kg)52231746231296731327583213989332187K1284269296263K2262271278270K3260266232273k194.689.698.687.6k287.390.392.690.0k386.688.677.391.0R8.01.721.33.4
2.5 高MK的苦荞红曲粉理化品质分析
在发酵过程中,随着紫红曲菌的生长繁殖,不断分泌并累积色素,苦荞从土黄色逐渐变成深红色(图5)。苦荞红曲散发浓郁红曲香并伴有微荞香,粉末质地细腻无结块、无杂质。较未发酵苦荞,苦荞红曲中的水分、蛋白、淀粉和总糖含量均有下降(表4),表明在富集MK时,紫红曲菌能充分利用基质的蛋白、淀粉等氮、碳源进行良好生长与代谢[8]。

a-未发酵苦荞;b-苦荞红曲
图5 发酵前后的苦荞粉
Fig.5 Tartary buckwheat flour before and after fermentation by M.purpureus 3.4629
表4 苦荞发酵前后的色差、感官评定和理化指标
Table 4 Color, sensory assessment, and nutritional composition before and after tartary buckwheat fermentation by M.purpureus 3.4629
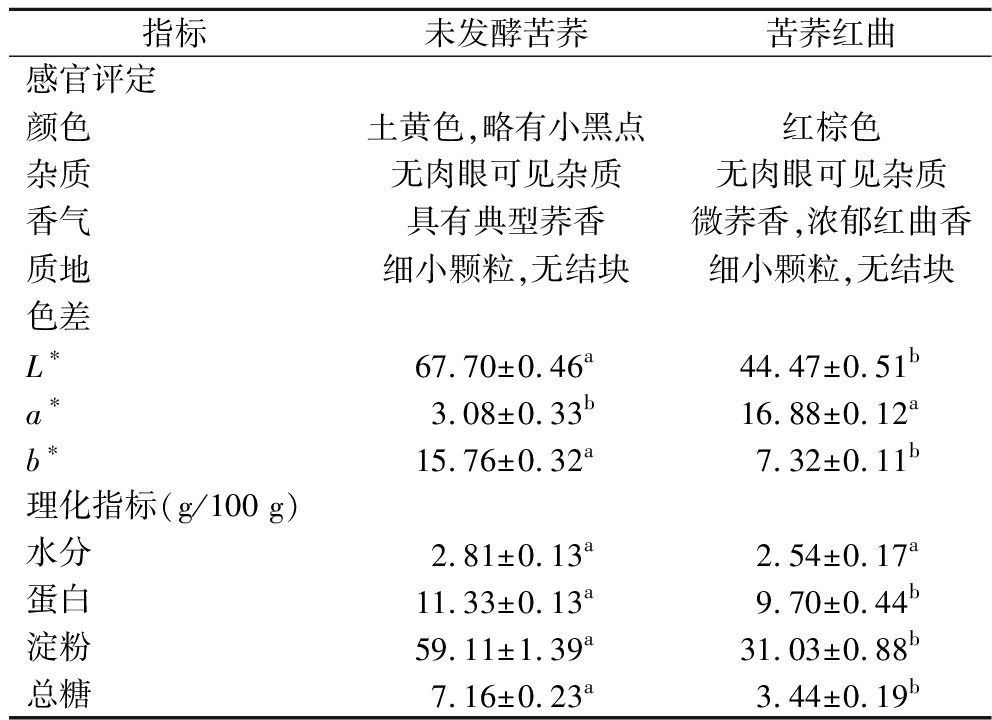
指标未发酵苦荞苦荞红曲感官评定颜色土黄色,略有小黑点红棕色杂质无肉眼可见杂质无肉眼可见杂质香气具有典型荞香微荞香,浓郁红曲香质地细小颗粒,无结块细小颗粒,无结块色差L∗67.70±0.46a44.47±0.51ba∗3.08±0.33b16.88±0.12ab∗15.76±0.32a7.32±0.11b理化指标(g/100 g)水分2.81±0.13a2.54±0.17a蛋白11.33±0.13a9.70±0.44b淀粉59.11±1.39a31.03±0.88b总糖7.16±0.23a3.44±0.19b
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.6 高MK的苦荞红曲功能成分分析
苦荞是一种药食两用杂粮,富含酚酸、类黄酮等多种功能活性物质,具有抗高血压、抗糖尿病等作用[24]。高产MK的发酵工艺下,苦荞红曲的总酚和总黄酮含量显著增高(P<0.05),分别达1.50和4.66 g/100 g,较未发酵苦荞(0.68、2.63 g/100 g)分别提高了121%和77%(图6-a)。通过发酵,紫红曲菌能产生较高浓度的碳水化合物水解酶,破坏酚类物质等与细胞壁之间的结合,从而促进酚类物质的释放与提取[25]。芦丁、槲皮素和山奈酚是苦荞主要黄酮类化合物,具有强抗氧化、抗炎等特性[24]。苦荞红曲中芦丁、槲皮素含量较未发酵苦荞(0.73、0.07 g/100 g)分别增高了66%和100%(P<0.05),其含量分别达1.21和0.14 g/100 g(图6-b),但山奈酚未检出。上述结果表明紫红曲菌发酵苦荞,不仅能新增MK,还能促进结合态的酚酸、黄酮类功能活性物质释放,一定程度上提高苦荞功效物,实现功效物质的多重富集。
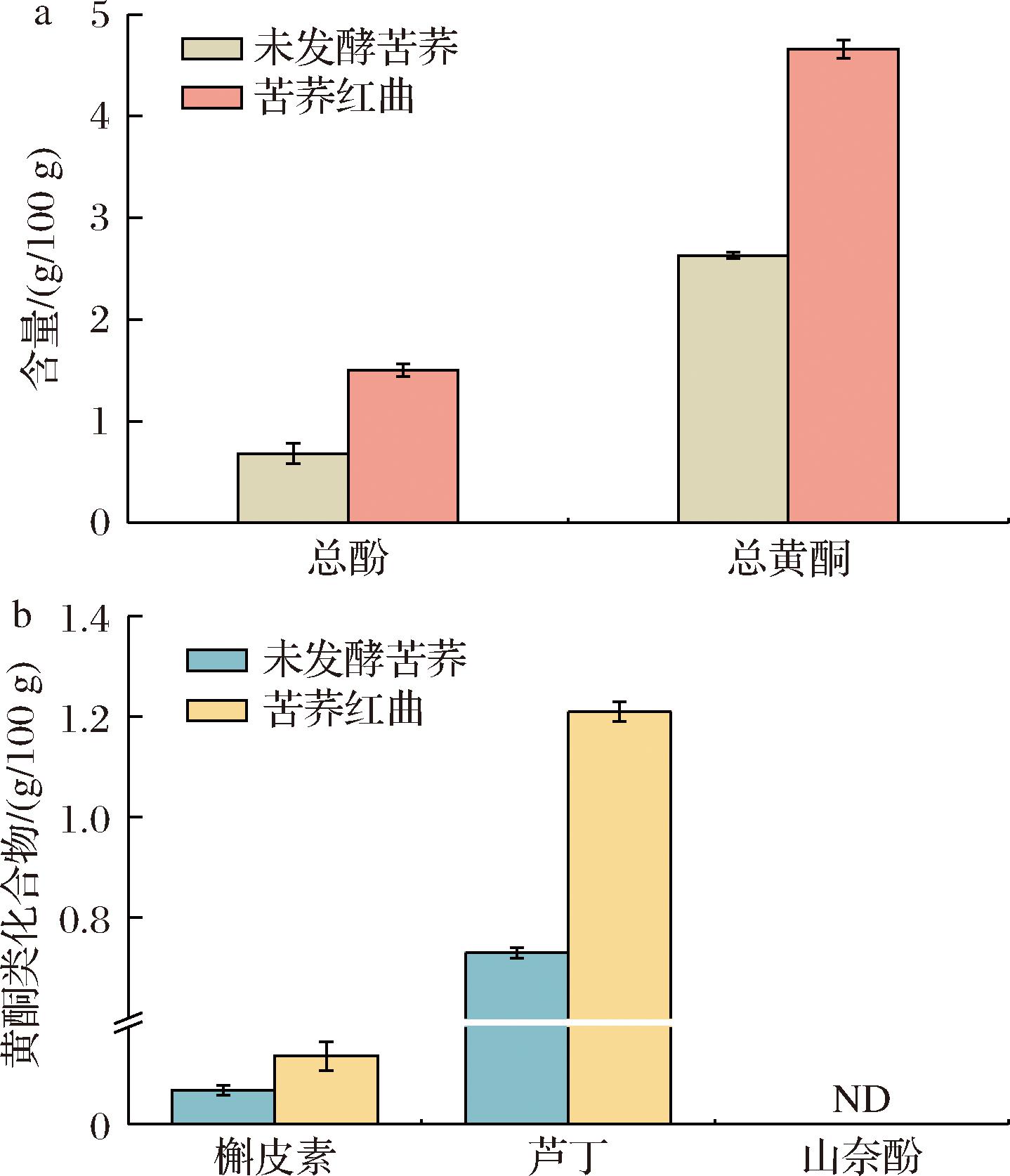
a-总酚和总黄酮;b-黄酮类化合物
图6 苦荞发酵前后酚类物质的含量变化
Fig.6 Changes in phenolic content before and after fermentation of Tartary buckwheat
注:ND表示未检出。
2.7 高MK的苦荞红曲安全特性
生物胺是一类具有生物活性的低分子质量碱性含氮化合物,可通过氨基酸脱羧产生,过量摄入会导致中毒和代谢紊乱[26]。当产氨基酸脱羧酶的微生物大量繁殖时,会导致发酵食品中生物胺超标[27]。因此,为保证食用安全,必须严格控制发酵食品中的生物胺含量。8种所检生物胺中,发酵苦荞红曲仅检出腐胺、尸胺、亚精胺和精胺(图7)。苦荞红曲的总生物胺为146.38 mg/kg(表5),较发酵前有增长,但远低于食品中生物胺的安全限量1 000 mg/kg[28]。尸胺是苦荞红曲中主要存在的生物胺,但含量仅为68.99 mg/kg,远低于尸胺安全限量510.89 mg/kg[29]。苦荞红曲中未检测出桔青霉素和黄曲霉毒素B1,符合T/ZZB 1452—2019《功能性红曲米(粉)》对红曲粉安全性的要求。苦荞红曲中未检出致病菌,大肠菌群MPN值<3.0,符合QB/T 2847—2023《功能性红曲米(粉)》对红曲粉的要求。
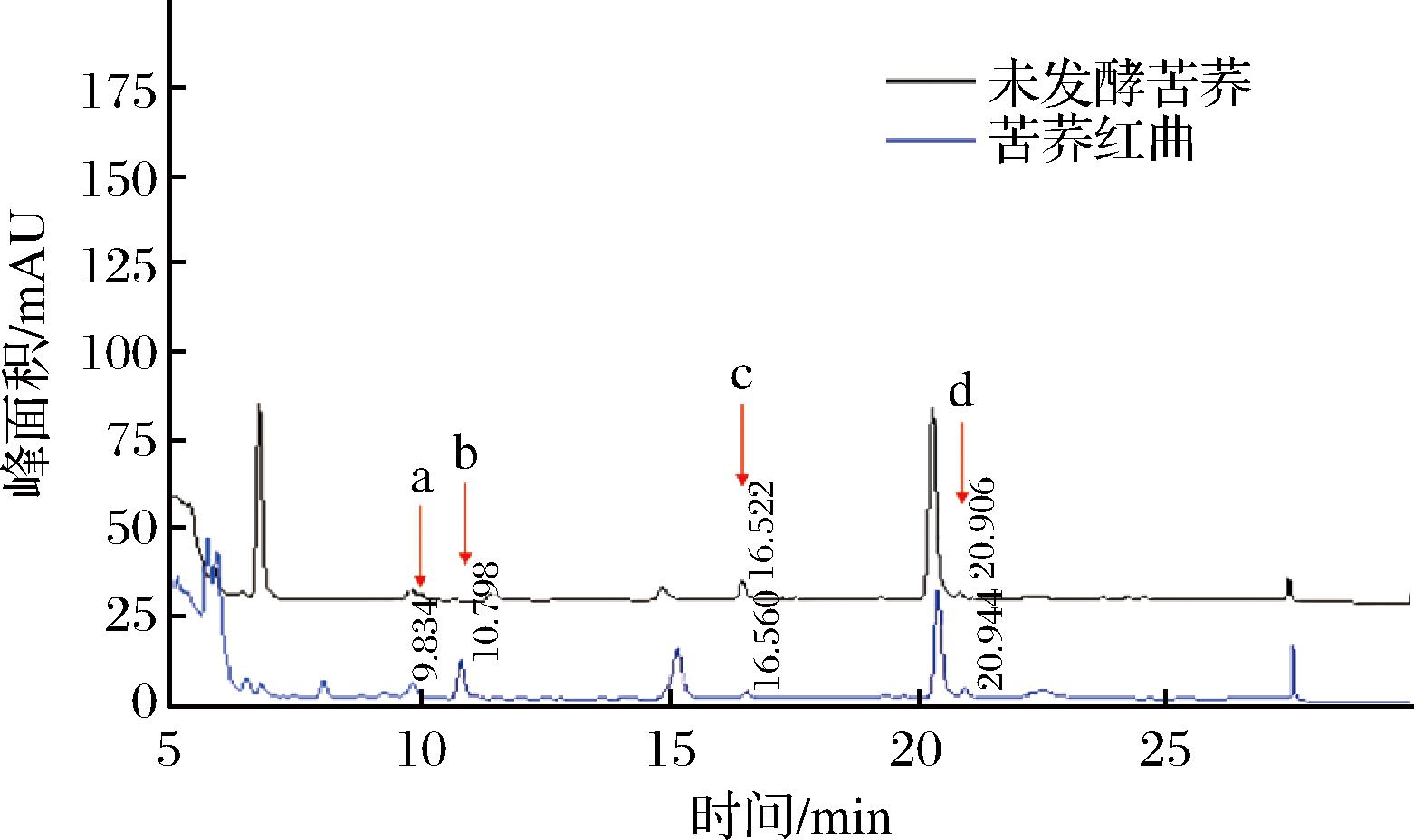
a-腐胺;b-尸胺;c-亚精胺;d-精胺
图7 苦荞发酵前后生物胺HPLC检测
Fig.7 Detection of biogenic amine HPLC before and after Tartary buckwheat fermentation
表5 苦荞发酵前后安全指标检测
Table 5 Safety indicators testing of Tartary buckwheat before and after fermentation

指标未发酵苦荞苦荞红曲参考值生物胺/(mg/kg)色胺——苯乙胺——腐胺—6.91±0.32尸胺—68.99±0.44<510.89[29]组胺——酪胺——
续表5
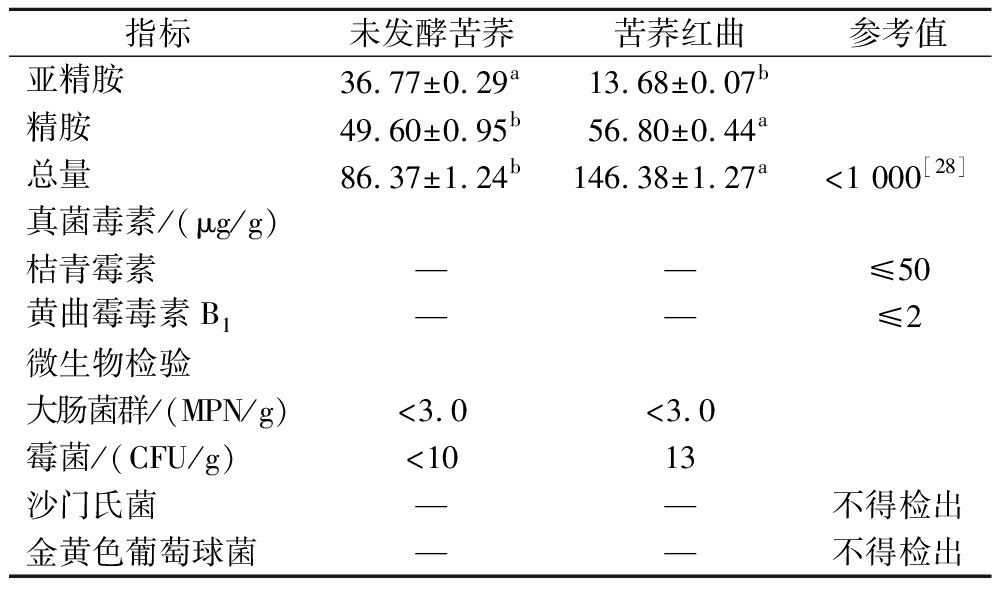
指标未发酵苦荞苦荞红曲参考值亚精胺36.77±0.29a13.68±0.07b精胺49.60±0.95b56.80±0.44a总量86.37±1.24b146.38±1.27a<1 000[28]真菌毒素/(μg/g)桔青霉素——≤50黄曲霉毒素B1——≤2微生物检验大肠菌群/(MPN/g)<3.0<3.0霉菌/(CFU/g)<1013沙门氏菌——不得检出金黄色葡萄球菌——不得检出
注:—表示未检出或低于检出限。
3 结论
研究筛选出M.purpureus 3.4629为高生物量优势菌株,苦荞为高产MK的杂粮基质。通过单因素试验和正交试验,获得高产MK的苦荞红曲工艺:固液比25∶10(g∶mL)、初始pH 4、接种量8%、温度30 ℃,发酵9 d后,MK产量达200.00 mg/kg,较优化前提高150%。该苦荞红曲品质良好,具有浓郁红曲香;总酚和总黄酮含量分别达1.50和4.66 g/100 g,较发酵前分别提高121%和77%,其中芦丁、槲皮素的含量分别增长66%和100%;同时,苦荞红曲中未检测出桔青霉素和黄曲霉毒素B1,其总生物胺含量和微生物指标都符合国家标准的安全限量要求。本研究通过对菌株、基质、发酵工艺的筛选及优化,实现MK高产,且产品品质、活性成分、安全特性等均显著提升,这为多重活性组分杂粮红曲的开发、特膳食疗产品的研制,提供理论基础与实验菌株。
[1] XIONG Z X, CAO X H, WEN Q Y, et al.An overview of the bioactivity of monacolin K/lovastatin[J].Food and Chemical Toxicology, 2019, 131:110585.
[2] MONU M, SEHRAWAT K D, SINGH A, et al.An overview on the therapeutic potential and anticancer mechanism of Monacolin K/Lovastatin[J].Pharmacological Research - Modern Chinese Medicine, 2022, 5:100187.
[3] SUN Y H, GAN Y, ZHANG L, et al.Isolation and identification of Monascus and evaluation of its selenium accumulation[J].LWT, 2022, 154:112887.
[4] CHEN C H, YANG J C, UANG Y S, et al.Improved dissolution rate and oral bioavailability of lovastatin in red yeast rice products[J].International Journal of Pharmaceutics, 2013, 444(1-2):18-24.
[5] HONG M Y, SEERAM N P, ZHANG Y J, et al.Anticancer effects of Chinese red yeast rice versus monacolin K alone on colon cancer cells[J].The Journal of Nutritional Biochemistry, 2008, 19(7):448-458.
[6] 郑文伟, 林军, 林风, 等.功能红曲与洛伐他汀降脂功效比较研究[J].中国酿造, 2022, 41(4):116-119.ZHENG W W, LIN J, LIN F, et al.Comparison of lipid-lowering efficacy of functional Monascus and lovastatin[J].China Brewing, 2022, 41(4):116-119.
[7] ZHANG Y R, CHEN Z T, WEN Q Y, et al.An overview on the biosynthesis and metabolic regulation of monacolin K/lovastatin[J].Food &Function, 2020, 11(7):5738-5748.
[8] REN R, ZENG H Y, MEI Q, et al.Effects of Monascus purpureus-fermented Tartary buckwheat extract on the blood lipid profile, glucose tolerance and antioxidant enzyme activities in KM mice[J].Journal of Cereal Science, 2022, 105:103465.
[9] YANG X, ZHU A R, LI X C, et al.Effects of extracted oil of fermented Tartary buckwheat on lipid-lowering, inflammation modulation, and gut microbial regulation in mice[J].Food &Function, 2023, 14(24):10814-10828.
[10] ZENG H Y, ZHU A R, HE S L, et al.Anti-lipid-oxidation effects and edible safety evaluation of the oil extracted by a supercritical CO2 process from Coix seed fermented by Monascus purpureus[J].Food Science and Human Wellness, 2023, 12(4):1119-1127.
[11] ZHANG B B, XING H B, JIANG B J, et al.Using millet as substrate for efficient production of monacolin K by solid-state fermentation of Monascus ruber[J].Journal of Bioscience and Bioengineering, 2018, 125(3):333-338.
[12] 林琳, 李贞景, 陈勉华, 等.4种培养基对红曲霉M1莫纳可林K产量影响及基因差异表达分析[J].食品科学技术学报, 2016, 34(5):43-47.LIN L, LI Z J, CHEN M H, et al.Effect of four kind of medium on Monascus M1 with monacolin K production and real-time quantitative analysis[J].Journal of Food Science and Technology, 2016, 34(5):43-47.
[13] 杨玉洁, 曾海英, 顾其丽, 等.高产γ-谷维素的杂粮基质筛选及工艺优化[J].中国酿造, 2019, 38(5):80-85.YANG Y J, ZENG H Y, GU Q L, et al.Selection and process optimization of high yield γ-oryzanol coarse cereals matrix[J].China Brewing, 2019, 38(5):80-85.
[14] 宋增光, 曾海英, 秦礼康, 等.紫红曲菌发酵薏米促α-生育酚富集及其发酵动力学模型构建[J].中国粮油学报, 2020, 35(12):23-29.SONG Z G, ZENG H Y, QIN L K, et al.Coix seed fermented by Monascus purpureus promoted enrichment of α-tocopherol and construction of dynamic models[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(12):23-29.
[15] MEI Q, XU Z N, WU Q Y, et al.Analysis of metabolites of coix seed fermented by Monascus purpureus[J].Food Bioscience, 2022, 50:102054.
[16] HUANG Z F, HU T T, LIU H Q, et al.Biosynthesis and polyketide oxidation of Monascus red pigments in an integrated fermentation system with microparticles and surfactants[J].Food Chemistry, 2022, 394:133545.
[17] WANG L F, CHEN C, SU A X, et al.Structural characterization of phenolic compounds and antioxidant activity of the phenolic-rich fraction from defatted adlay (Coix lachryma-jobi L.var.ma-yuen Stapf) seed meal[J].Food Chemistry, 2016, 196:509-517.
[18] 张殿伟, 高月宇, 王金菊, 等.高效液相色谱法分析发酵肉制品中生物胺[J].食品与发酵工业, 2019, 45(9):256-261.ZHANG D W, GAO Y Y, WANG J J, et al.Determination of biogenic amines in fermented meats by HPLC[J].Food and Fermentation Industries, 2019, 45(9):256-261.
[19] WEI P L, XU Z N, CEN P L.Lovastatin production by Aspergillus terreus in solid-state fermentation[J].Journal of Zhejiang University:Science A, 2007, 8(9):1521-1526.
[20] 毛继龙, 张建辉, 王璨, 等.一株高产洛伐他汀红曲霉的筛选与液态发酵条件优化[J].微生物学通报, 2022, 49(6):2221-2232.MAO J L, ZHANG J H, WANG C, et al.Screening and liquid fermentation condition optimization of a high lovastatin producing Monascus[J].Microbiology China, 2022, 49(6):2221-2232.
[21] 黄群, 麻成金, 余佶, 等.产Monacolin K红曲霉筛选及响应面法优化发酵条件[J].食品科学, 2011, 32(21):177-182.HUANG Q, MA C J, YU J, et al.Screening of monacolin K-producing Monascus and fermentation condition optimization by response surface methodology[J].Food Science, 2011, 32(21):177-182.
[22] ELMAHDI I, BAGANZ F, DIXON K, et al.PH control in microwell fermentations of S.erythraea CA340:Influence on biomass growth kinetics and erythromycin biosynthesis[J].Biochemical Engineering Journal, 2003, 16(3):299-310.
[23] 魏巍. 红曲霉发酵合成洛伐他汀的研究[D].武汉:华中科技大学, 2013.WEI W.Study on synthesis of lovastatin by monascus fermentation[D].Wuhan:Huazhong University of Science and Technology, 2013.
[24] ZHU F.Chemical composition and health effects of Tartary buckwheat[J].Food Chemistry, 2016, 203:231-245.
[25] BEI Q, CHEN G, LU F J, et al.Enzymatic action mechanism of phenolic mobilization in oats (Avena sativa L.) during solid-state fermentation with Monascus anka[J].Food Chemistry, 2018, 245:297-304.
[26] ZHANG Y J, ZHANG Y, ZHOU Y, et al.A review of pretreatment and analytical methods of biogenic amines in food and biological samples since 2010[J].Journal of Chromatography A, 2019, 1605:360361.
[27] GAO X L, LI C, HE R H, et al.Research advances on biogenic amines in traditional fermented foods:Emphasis on formation mechanism, detection and control methods[J].Food Chemistry, 2023, 405:134911.
[28] LIU Z Y, LI Z H, ZHANG M L, et al.Effect of fermentation with mixed starter cultures on biogenic amines in bighead carp surimi[J].International Journal of Food Science &Technology, 2010, 45(5):930-936.
[29] DEL RIO B, REDRUELLO B, LINARES D M, et al.The biogenic amines putrescine and cadaverine show in vitro cytotoxicity at concentrations that can be found in foods[J].Scientific Reports, 2019, 9(1):120.