余甘子(Phyllanthus emblica L.)大戟科叶下珠属植物,又名余甘果、油甘子、滇橄榄及庵摩勒等,在我国主要分布在广东、广西、云南、海南等省份[1]。余甘子果实营养丰富,富含多酚、黄酮、抗坏血酸等生物活性物质[2],具有消食健胃[3]、抗氧化[4]、抗癌[5]、抗炎[6]、保肝护肝[7]等功效,是一种药食同源水果,营养价值和经济价值极高,但因其鲜食酸涩味较重,很难被消费者所接受,所以大部分余甘子果实都加工成果汁、果粉、蜜饯等产品[8]。随着新茶饮行业的快速兴起,余甘子汁因其独特的回甘风味深受消费者喜爱,市场对余甘子汁的需求量逐渐增加。然而,市售的余甘子汁多为冷冻原汁和巴氏杀菌果汁,需在低温环境下贮藏,且体积大,贮藏成本高。因此,对余甘子汁进行浓缩,可减小体积,降低运输成本;余甘子汁糖度的提高,可抑制有害微生物生长,延长余甘子汁货架期。
传统的果汁浓缩多采用加热蒸发浓缩,容易破坏一些热敏性的风味及营养成分,降低品质。由此产生的非热技术(如膜浓缩、冷冻浓缩、冻融浓缩)代替了传统的热浓缩[9]。非热浓缩技术可以更好的保持果汁的风味、色泽和营养成分,因此对余甘子汁非热浓缩的研究与开发具有广阔的前景。本文采用膜浓缩、冻融浓缩和真空加热浓缩3种方式对余甘子汁进行处理,对其理化指标、抗氧化活性及挥发性香气成分进行探究,为余甘子汁浓缩的实际应用提供理论依据。
1 材料与方法
1.1 实验材料和仪器
1.1.1 材料和试剂
材料:选择成熟度一致、无病虫害且无机械损伤的“丙甜”余甘子果实作为试验材料。原料在最佳食用成熟期进行采集,并于4 ℃冷库贮藏。
试剂:抗坏血酸(维生素C)、ABTS、DPPH,上海源叶生物科技有限公司;无水乙醇、95%乙醇、无水甲醇、NaNO2、Al(NO3)3、NaOH、福林酚、Na2CO3、偏磷酸、苯酚、浓硫酸,均为分析纯,国药集团化学试剂有限公司。
1.1.2 仪器与设备
XBLL-S01型破壁机,中国西贝乐公司;LC-20A高效液相色谱仪、UV-1780紫外分光光度计,日本岛津公司;DK-98-1型电热恒温水浴锅,上海精密仪器仪表公司;FA1104型电子天平,上海乐平科学仪器有限公司;Milli-Q_Synthesis超纯水系统,美国Milipore公司;01-2型电热鼓风干燥箱,天津市泰斯特仪器有限公司;890A-5975C气相色谱质谱联用仪、ZORBAX SB-C18(4.6×250 mm)色谱柱,美国Agilent公司。
1.2 试验方法
1.2.1 余甘子汁制备
将新鲜余甘子用清水冲洗干净,去核,放入榨汁机榨汁,反复榨取3次,用5 μm过滤袋过滤得到澄清余甘子汁,用1 L的塑料瓶装好,于-20 ℃的冰箱中冷冻储存备用。
1.2.2 出汁率的测定
余甘子果实清洗后去核,果肉用破壁机破碎,用一层100目纱布滤出果汁,称取果汁质量,出汁率计算如公式(1)所示:
(1)
式中:W,出汁率,%;m1,果汁的质量,g;m2,果实的质量,g。
1.2.3 浓缩方法
1.2.3.1 真空浓缩
旋转蒸发仪的温度分别设置为50、60、70 ℃,压强0.005 MPa,转速60 r/min,将余甘子汁分别浓缩至60 °Brix,制得3种浓缩汁。分别向3种浓缩汁中加蒸馏水,还原至原汁浓度(6.97 °Brix),以色差、浓缩效率为指标,确定最佳浓缩温度。按照最佳浓缩温度,压强0.005 MPa,转速50 r/min,将余甘子汁浓缩至浓缩终点,得到真空浓缩汁。
1.2.3.2 膜浓缩
膜浓缩法为超滤和反渗透过程的结合,将8 L余甘子汁倒入膜浓缩装置,进入膜浓缩系统后,首先经过超滤膜预过滤,再经过反渗透膜过滤,最后进入收集罐,得到浓缩液。
1.2.3.3 冻融浓缩
将装有500 mL余甘子汁的塑料瓶置于-25 ℃冰箱中,用热电偶记录余甘子汁中心温度,等温度降至0 ℃以下并趋于稳定,确定为完全冻结温度。分别将装有500 mL余甘子汁的塑料瓶置于温度为-20、-18、-15、-12、-9、-6 ℃的冰箱中,记录余甘子汁完全冻结的时间。将完全冻结的余甘子汁取出,置于25 ℃环境解冻,每隔5 min取一次融化液并测定可溶性固形物(total soluble solids,TSS)。
1.2.4 pH值、TSS和总酸(total acid,TA)的测定
pH值采用pH计测定;TSS采用数字阿贝折射仪测定;TA采用GB/T 12456—2021《食品安全国家标准 食品中总酸的测定》的方法测定[10],结果以柠檬酸计。
1.2.5 总糖含量的测定
采用苯酚硫酸法[11]。取1 g样品加4 mL蒸馏水于离心管中,水浴50 ℃、30 min提取总糖,转移离心管至超声机超声波辅助提取30 min,4 000 r/min离心20 min取上清液。反复提取2次,合并定容至10 mL。取1 mL样品稀释液+1 mL 5%(体积分数)苯酚+5 mL浓硫酸,反应20 min待试管冷却后于紫外分光光度计490 nm检测其吸光值。
1.2.6 维生素C含量的测定
采用HPLC分析法[12]。柱温30 ℃;检测器为二极管阵列检测器;流动相0.1 mol/L(NH4)2HPO4(磷酸调节pH=2.70);流速1.0 mL/min;检测波长254 nm;进样量10 μL。
1.2.7 总酚含量的测定
参照曹艳萍等[13]的方法。样品溶液的制备:精确称取待测余甘子样品1.0 g于10 mL离心管中,加入5 mL 70%(体积分数)甲醇,35 ℃超声波振荡提取30 min,10 000 r/min离心10 min,取上清液,反复提取3次,合并提取液于25 mL的容量瓶中,用体积分数70%的甲醇定容至刻度。样品的测定:取适当稀释的液体样品1 mL,加入2 mL福林酚试剂,振荡混合,再加入2 mL 10%(质量分数,下同)Na2CO3溶液,避光放置1 h,测定760 nm处的吸光值。
1.2.8 总黄酮含量的测定
参照莫开菊等[14]的方法。样品溶液的制备同总酚的方法。样品的测定:准确吸取适当稀释的液体样品5 mL于试管中,加10% NaNO2溶液0.5 mL,摇匀放置6 min后加10% Al(NO3)3溶液0.5 mL,摇匀放置6 min,加4% NaOH溶液4 mL,摇匀放置15 min,同时作试剂空白,以试剂空白作对照于510 nm波长处测定吸光度。
1.2.9 抗氧化能力的测定
1.2.9.1 DPPH自由基清除能力
参考SOK
 -
-
![]() TOWSKA等[15]的方法,稍作修改。分别取1 mL样品稀释液(0.5、1.0、1.5、2.0、2.5、3.0 mg/mL),加入5 mL 0.13 mmol/L的DPPH溶液,混匀后置于室温环境下避光反应20 min,以无水乙醇为空白在517 nm处测得吸光度Ai,以1 mL无水乙醇和5 mL DPPH在517 nm处测得吸光度Aj。DPPH自由基清除率的计算如公式(2)所示:
TOWSKA等[15]的方法,稍作修改。分别取1 mL样品稀释液(0.5、1.0、1.5、2.0、2.5、3.0 mg/mL),加入5 mL 0.13 mmol/L的DPPH溶液,混匀后置于室温环境下避光反应20 min,以无水乙醇为空白在517 nm处测得吸光度Ai,以1 mL无水乙醇和5 mL DPPH在517 nm处测得吸光度Aj。DPPH自由基清除率的计算如公式(2)所示:
(2)
式中:M,清除率,%;Ai,样品组吸光度;Aj,同体积无水乙醇代替样品溶液的吸光度。
1.2.9.2 ABTS阳离子自由基清除能力
参考余元善等[16]的方法,稍作修改。分别取0.25 mL样品稀释液(0.5、1.0、1.5、2.0、2.5、3.0 mg/mL),加入5 mL ABTS溶液,混匀后置于室温条件下避光反应6 min,以无水乙醇为空白在734 nm处测的吸光度A0,以0.25 mL无水乙醇和5 mL ABTS溶液在734 nm处测得吸光度A1,ABTS阳离子自由基清除率的计算如公式(3)所示:
(3)
式中:M,清除率,%;A0,样品组吸光度;A1,同体积无水乙醇代替样品溶液的吸光度。
1.2.10 挥发性成分的测定
参考刘昊澄等[17]的方法。称取5 g样品置于萃取瓶中,加入100 μL 2-辛醇(0.05 mg/mL)作为内标物,密封,置于60 ℃水浴中,磁力搅拌速度500 r/min,平衡20 min后,插入萃取针萃取30 min。
GC条件:进样口温度250 ℃,气质接口温度280 ℃,载气流速1.5 mL/min,分流比4∶1 (体积比)。
MS条件:离子源温度230 ℃,四极杆温度150 ℃,电喷雾离子源(electron spray ionization, ESI)电离70 eV,全扫描35~550 Da。
1.2.10.1 挥发性成分的定性及定量
参考CHEN等[18]报道的方法。定性:根据C5~C20正构烷烃混合物在同一升温程序中谱图结果,计算样品各色谱峰保留指数,利用NIST 20.L谱库检索结果对挥发性物质进行定性。定量:采用内标法定量。在5 mL余甘子汁中加入100 μg/mL的2-辛醇溶液2 μL作为内标,然后进行固相萃取。通过比较各化合物的峰面积与内标物的峰面积,计算余甘子汁中各物质的浓度。
1.2.10.2 挥发性成分香气活度值(odor active values,OAV)的计算
OAV计算如公式(4)所示:
(4)
式中:Ci,化合物在水中的含量,μg/kg;Ti,化合物在水中的阈值,μg/kg。
1.2.11 感官评价
以外观与色泽、风味、口感、外观、总体可接受性5个指标为评价标准,评价标准见表1,邀请30名专业人员组成感官评定小组对不同品种余甘子汁进行感官评定。
表1 余甘子汁感官评价标准
Table 1 Sensory evaluation criteria of P.emblica juice

分数色泽风味口感外观总体可接受性987色泽均匀一致具有强烈的余甘子香气,香气浓郁好的滋味,适度的糖酸比及回甘良好的流动性和一致性,没有絮凝优秀654色泽较均匀一致具有余甘子汁香气,香气不够浓郁滋味一般一般的流动性和一致性,轻微絮凝一般321色泽不均匀一致不具有余甘子香气,并且有异味滋味不好差的流动性和一致性,明显的絮凝不合格
1.3 数据处理
所有试验重复3次,取平均值,数据处理及作图采用Origin 2019、SPSS 22软件,结果为“平均值±标准差”,采用Duncan验证法分析显著性差异,P<0.05为差异性显著。
2 结果与分析
2.1 浓缩方法的确定
2.1.1 浓缩终点的确定
如图1所示,余甘子浓缩汁的黏度随着糖度的增大而增大。糖度由10.0 °Brix上升为50.0 °Brix时,黏度由2.52×10-3 Pa·s上升至7.04×10-3 Pa·s,黏度上升幅度较小;糖度由50.0 °Brix上升为60.0 °Brix时,黏度由7.04×10-3 Pa·s上升至2.42×10-2 Pa·s,黏度上升幅度有所增大;糖度由60.0 °Brix上升为70.0 °Brix时,黏度由2.42×10-2 Pa·s上升至1.26×10-1 Pa·s,黏度上升幅度骤增。判断出60 °Brix的糖度值为余甘子浓缩汁黏度突然有较大变化的节点。黏度突然增大对泵、灌装机等设备的参数要求会提高,给生产造成困难。因此,余甘子浓缩汁的浓缩终点应低于60.0 °Brix。
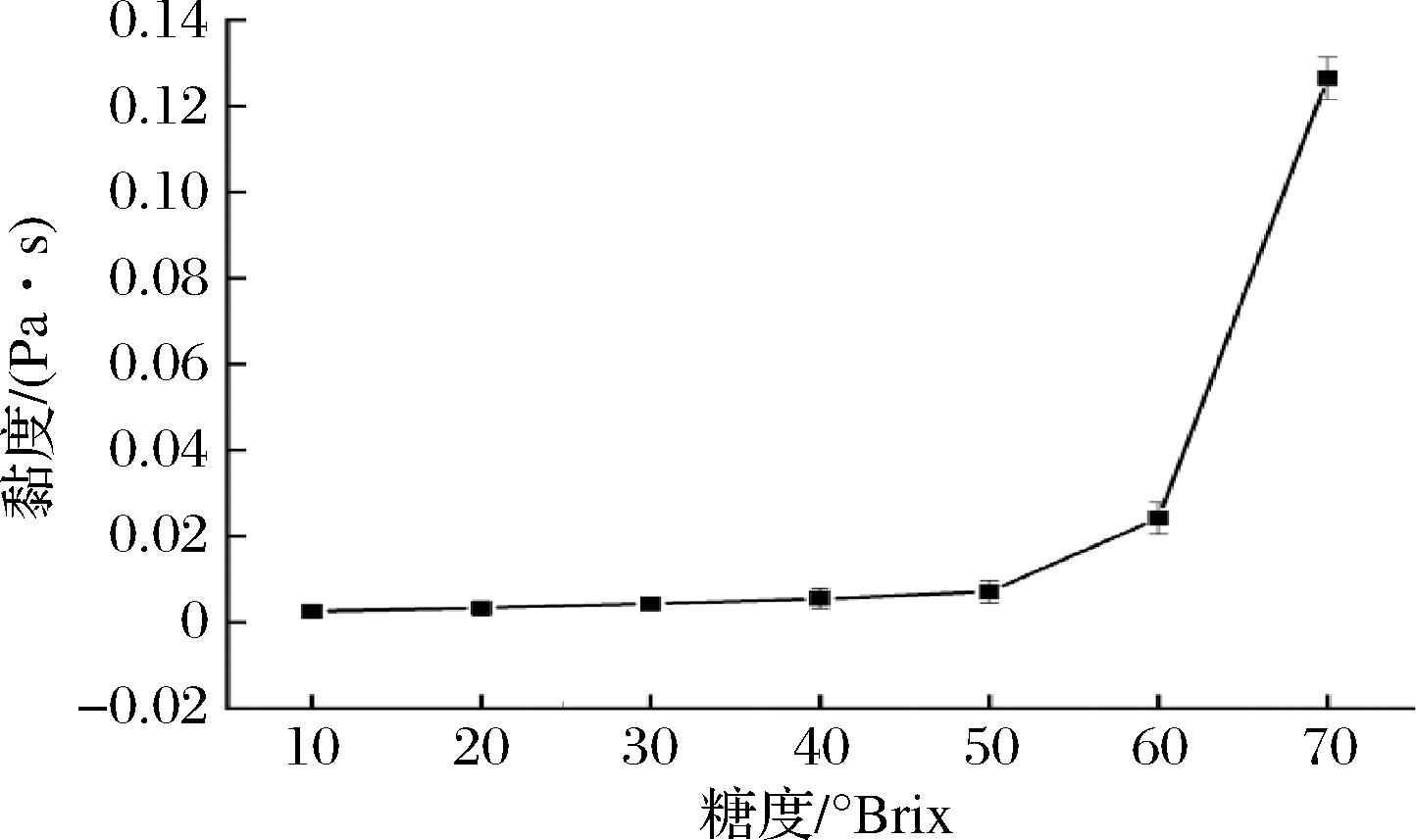
图1 黏度随糖度的变化曲线
Fig.1 Viscosity curve with sugar content
2.1.2 真空浓缩法
由表2可知,温度越高,浓缩效率越高,浓缩效率由高到低为70 ℃>60 ℃>50 ℃,浓缩温度为70 ℃时的浓缩效率比60 ℃和50 ℃分别快0.40 h/L、1.2 h/L。温度越高,色差越大,对色泽的保护效果为50 ℃>60 ℃>70 ℃,浓缩温度为50 ℃时的色差分别比60 ℃和70 ℃小0.17、1.49。综合浓缩效率和色差,以浓缩效率较高,色差较小为标准,确定60 ℃为真空浓缩的最佳温度。
表2 温度对色差和浓缩效率的影响
Table 2 Influence of temperature on color difference and concentration efficiency
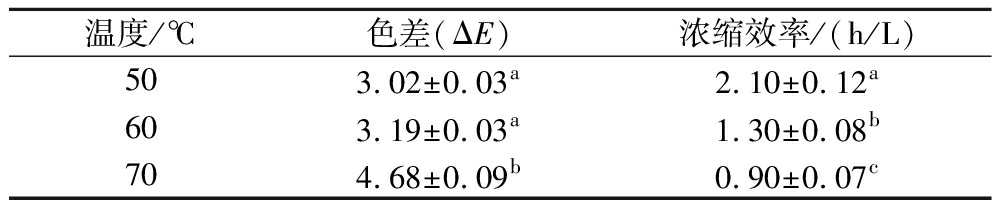
温度/℃色差(ΔE)浓缩效率/(h/L)503.02±0.03a2.10±0.12a603.19±0.03a1.30±0.08b704.68±0.09b0.90±0.07c
注:不同小写字母表示组间差异显著(P<0.05)(下同)。
2.1.3 膜浓缩法
由图2-a可知,一级膜浓缩中,余甘子汁在1 MPa压强下的浓缩效率明显低于2 MPa和3 MPa,在2 MPa 和3 MPa压强下,余甘子汁糖度由6.97 °Brix上升至15 °Brix以上,在0~150 min浓缩效率较快,150 min之后浓缩效率明显下降。二级膜浓缩中(图2-b),余甘子汁在3 MPa和4 MPa压强下所达到的浓缩效果明显优于2 MPa,在0~100 min浓缩效率较快,100 min之后浓缩效率明显下降。压强过大和时间过长会产生高温,影响浓缩汁的品质。因此,一级膜浓缩和二级膜浓缩的最佳条件分别为2 MPa、150 min 和3 MPa、100 min,最终浓缩糖度为25.58 °Brix。
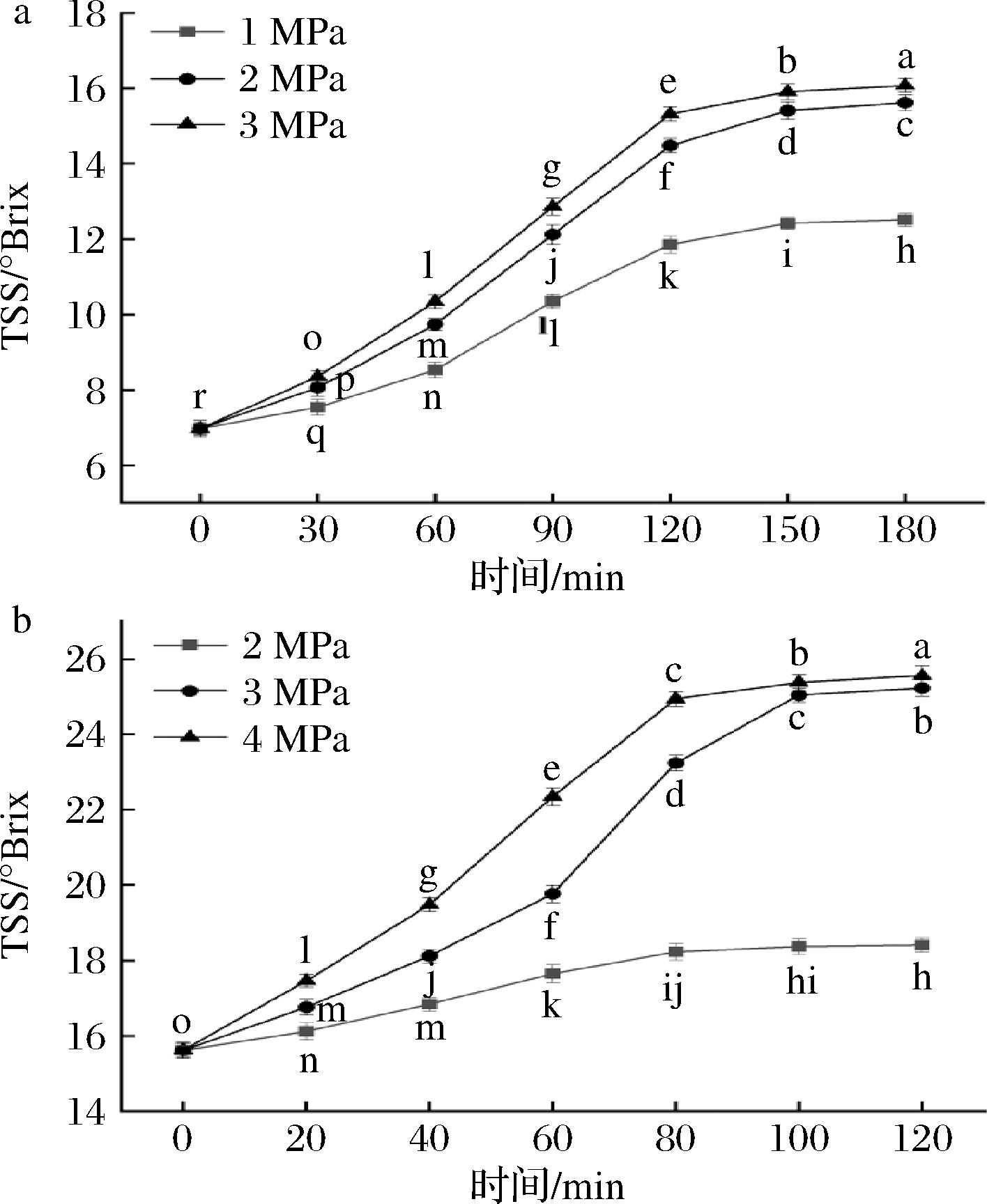
a-一级膜浓缩;b-二级膜浓缩
图2 膜浓缩后TSS的含量
Fig.2 Content of TSS after membrane concentration
2.1.4 冻融浓缩法
由图3可知,在-20 ℃环境下,随着冷冻时间的延长,余甘子汁的中心温度逐渐下降,当温度降至-1 ℃时,温度基本处于平稳状态,因此,确定-1 ℃为余甘子汁完全冻结温度。由表3可知,随着冷冻温度的降低,余甘子汁完全冻结的时间越来越短,完全冻结时间从-6 ℃的24 h降至-18 ℃的8 h,低于-18 ℃时,随着温度的下降完全冻结的时间不再缩短,-18 ℃ 和-20 ℃的冻结时间都是8 h,综合考虑能耗和冻结效率,选择-18 ℃为最佳冷冻温度。
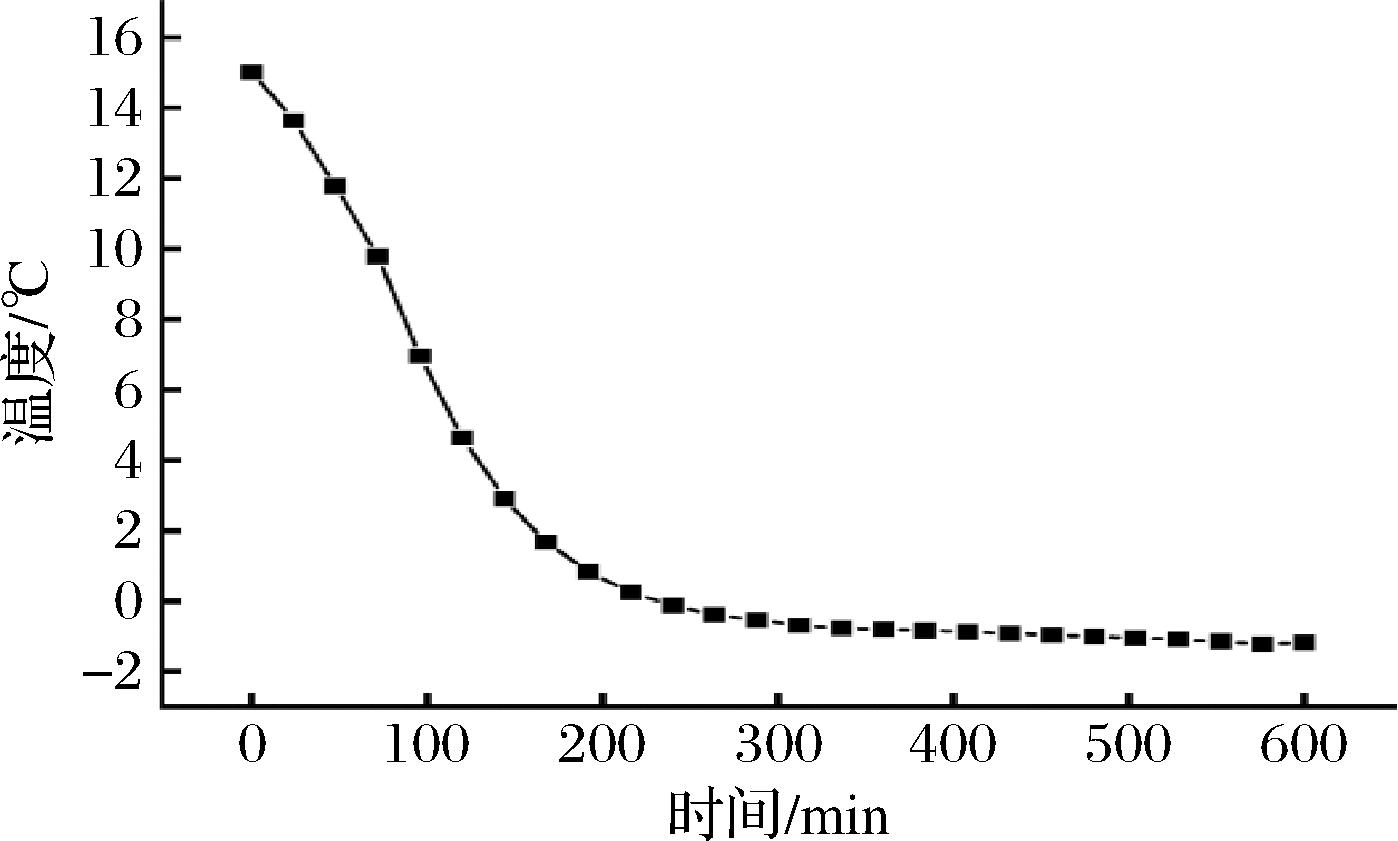
图3 -20 ℃环境下冻结时间对温度的影响
Fig.3 Effect of freezing time on temperature at -20 ℃
表3 温度对完全冻结时间的影响
Table 3 Influence of temperature on complete freezing time
温度/℃-6-9-12-15-18-20时间/h2420151288
由图4-a可知,融化20 min收集的浓缩液糖度最高为35 °Brix左右,随着融化时间的增加,融化液的糖度逐渐降低,为了尽可能得到高糖度的浓缩汁,确定前20 min为最佳收集时间。由图4-b可知,余甘子汁糖度由1 °Brix上升到6.97 °Brix,浓缩终点由3.56 °Brix上升至35.02 °Brix,上升幅度大;糖度由6.97 °Brix上升到25 °Brix,浓缩终点由35.02 °Brix上升至41.23 °Brix,上升幅度趋于平缓,确定最终浓缩糖度为35.02 °Brix。余甘子汁糖度为6.97 °Brix时的浓缩倍数最高为5.02倍,因此确定6.97 °Brix为余甘子汁最佳浓缩糖度。
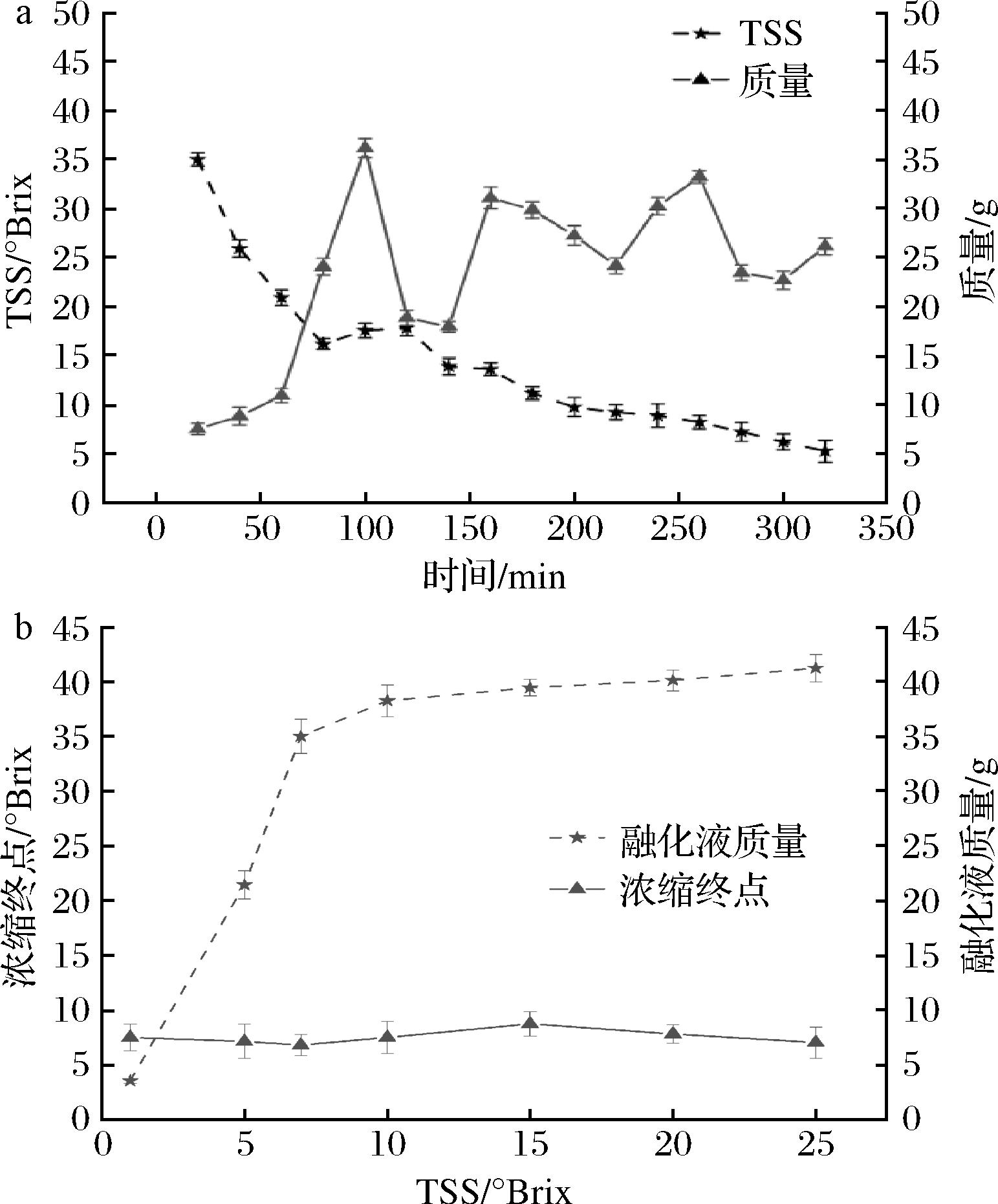
a-融化液的糖度和质量;b-浓缩终点
图4 时间对融化液糖度和质量的影响、糖度对浓缩终点的影响
Fig.4 Influence of time on the sugar content and quality of the melt solution,influence of sugar content on the concentration end point
2.2 不同浓缩方式对余甘子汁理化指标的影响
将真空浓缩汁、膜浓缩汁和冻融浓缩汁复原至原汁浓度(6.97 °Brix),与原汁进行比较,分析理化指标的变化。
2.2.1 不同浓缩方式对余甘子汁理化指标的影响
由表4可知,膜浓缩、冻融浓缩和真空浓缩汁的浓缩倍数分别为3.67倍、5.19倍和8.61倍,与余甘子原汁相比,3种浓缩复原汁pH值变化不大。膜浓缩复原汁的浊度和褐变度显著下降(P<0.05),透光率显著上升(P<0.05),说明经过膜浓缩处理后,余甘子汁许多大分子物质和一部分色素被过滤掉,浓缩汁色泽变清澈透明。真空浓缩复原汁的褐变度显著上升(P<0.05),透光率和浊度也有所下降,色泽明显变暗,说明高温对余甘子浓缩汁色泽的影响较大,且褐变度随着温度的上升而增加[19]。冻融浓缩复原汁的浊度、透光率和褐变度变化较小,色泽保持的较好。
表4 不同浓缩方式对余甘子汁理化指标的影响
Table 4 Effects of different concentration methods on physicochemical indexes of P. emblica juice
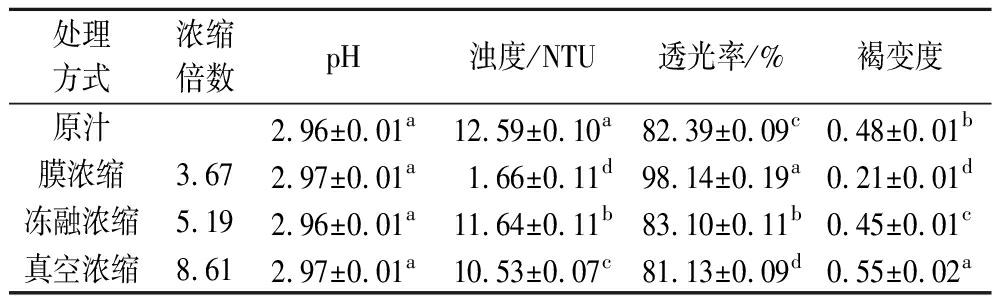
处理方式浓缩倍数pH浊度/NTU透光率/%褐变度原汁2.96±0.01a12.59±0.10a82.39±0.09c0.48±0.01b膜浓缩3.672.97±0.01a1.66±0.11d98.14±0.19a0.21±0.01d冻融浓缩5.192.96±0.01a11.64±0.11b83.10±0.11b0.45±0.01c真空浓缩8.612.97±0.01a10.53±0.07c81.13±0.09d0.55±0.02a
2.2.2 不同浓缩方式对余甘子汁色差的影响
由表5可知,与对照组相比,3种浓缩复原汁的L*值均显著性下降(P<0.05),表明经过浓缩处理余甘子汁的色泽变暗,真空浓缩L*值下降幅度最大,这是由于高温破坏了果汁中维生素C等活性物质,导致果汁的褐变。3种浓缩复原汁与原汁相比,a*、b*值均显著性上升(P<0.05),证明经过浓缩处理的余甘子汁色泽变红、变黄。真空浓缩复原汁的ΔE*最大,其次是膜浓缩复原汁,冻融浓缩复原汁的ΔE*最小,证明真空浓缩对浓缩汁色泽的影响最大,这种色泽变化可能与加热浓缩过程中美拉德反应产生的糖-蛋白质/氨基酸物质有关[20]。冻融浓缩能更好的保持余甘子汁的色泽。
表5 不同浓缩方式对余甘子汁色差的影响
Table 5 Influence of different concentration methods on color difference of P. emblica juice

处理方式L∗a∗b∗ΔE∗原汁32.75±0.37a-1.65±0.02d2.01±0.05a-膜浓缩31.35±0.05c0.20±0.02a3.43±0.03b2.72±0.02b冻融浓缩31.77±0.09b-0.64±0.01c2.65±0.06c1.54±0.03c真空浓缩30.70±0.17d-0.05±0.02b3.85±0.15a3.19±0.03a
2.2.3 不同浓缩方式对余甘子汁总酚和维生素C含量的影响
由图5可知,与余甘子原汁相比,膜浓缩复原汁和真空浓缩复原汁中总酚、维生素C的含量显著性下降(P<0.05),冻融浓缩复原汁中总酚、维生素C的含量没有显著性变化(P>0.05)。膜浓缩、冻融浓缩和真空浓缩复原汁中维生素C的含量分别是原汁的86.21%、94.88%、71.69%,总酚的含量分别是原汁的70.64%、91.51%、49.61%。真空浓缩复原汁中总酚和维生素C的损失最大,冻融浓缩复原汁中总酚和维生素C保持的最好,这是由于酚类和维生素C属于热敏性物质,高温环境下会破坏其结构,使其降解。马晓玉[21]比较了冷冻浓缩和真空浓缩对甜瓜浓缩汁品质的影响,发现冷冻浓缩甜瓜汁中总酚和维生素C含量的损失率较小;董雪君等[22]研究发现,梨汁经过真空浓缩后总酚的含量显著下降,较高的温度会破坏浓缩汁中的活性成分;刘霭莎等[23]研究发现,冷冻浓缩处理的芒果果酱中维生素C的含量远高于真空浓缩处理的芒果果酱,与本研究结果一致。
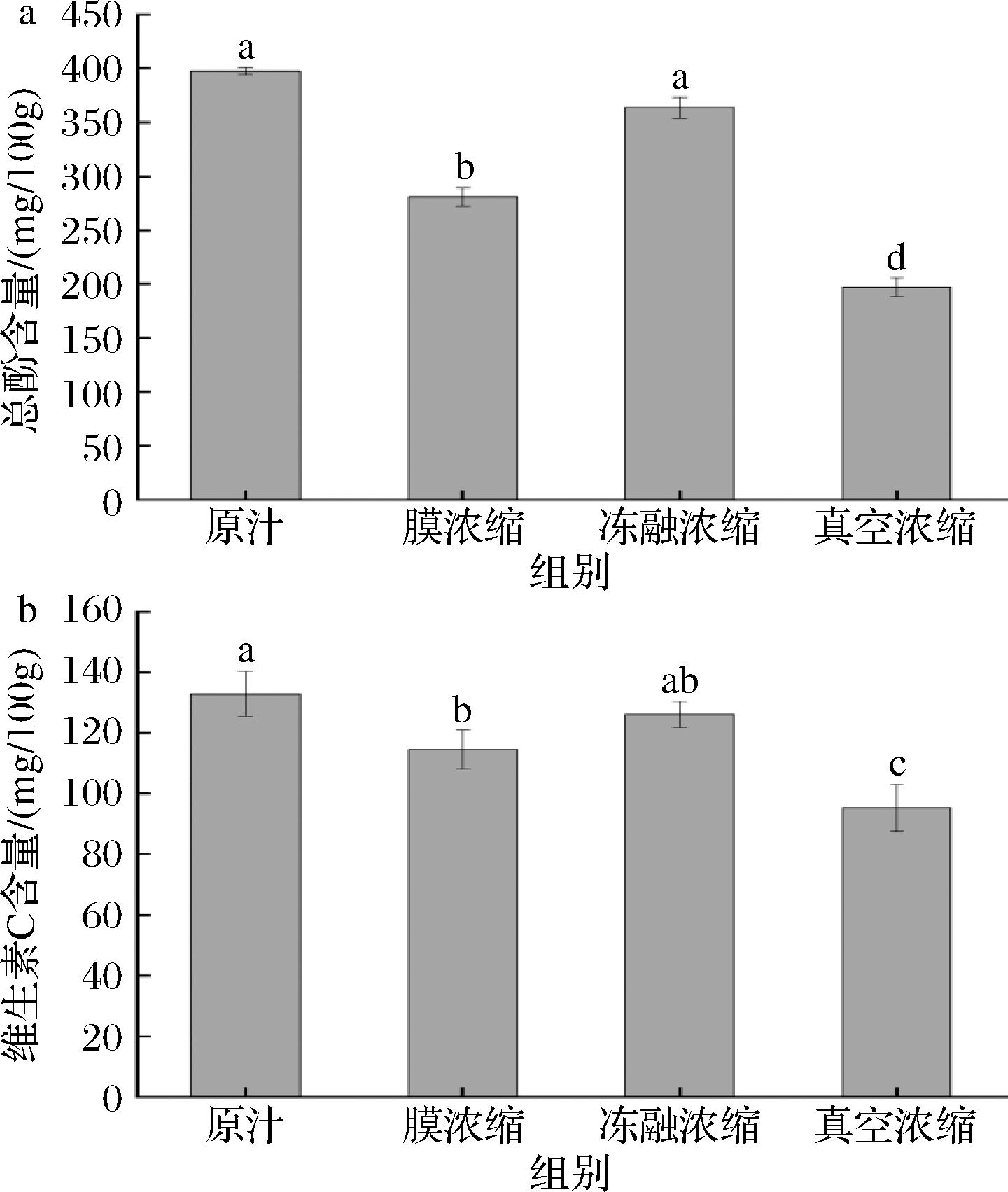
a-总酚含量;b-维生素C含量
图5 浓缩方式对余甘子汁总酚和维生素C含量的影响
Fig.5 Effects of concentration methods on the content of total phenol and vitamin C in P. emblica juice
2.2.4 不同浓缩方式对余甘子汁粒径、多分散指数(polydispersity index,PDI)和电位的影响
乳液体系的粒径和电位能反映其稳定性[24],粒径、PDI值越小、电位绝对值越大,说明乳液体系越稳定[25]。由图6可知,与原汁相比,膜浓缩复原汁粒径和PDI值显著上升(P<0.05),电位绝对值显著下降(P<0.05),说明经过膜浓缩处理,余甘子汁稳定性降低。真空浓缩复原汁粒径变化不大,PDI值上升,电位绝对值下降,说明高温会破坏余甘子汁的结构,使其稳定性变差。冻融浓缩复原汁粒径降低,电位绝对值显著上升(P<0.05),果汁体系较稳定,利于保存。
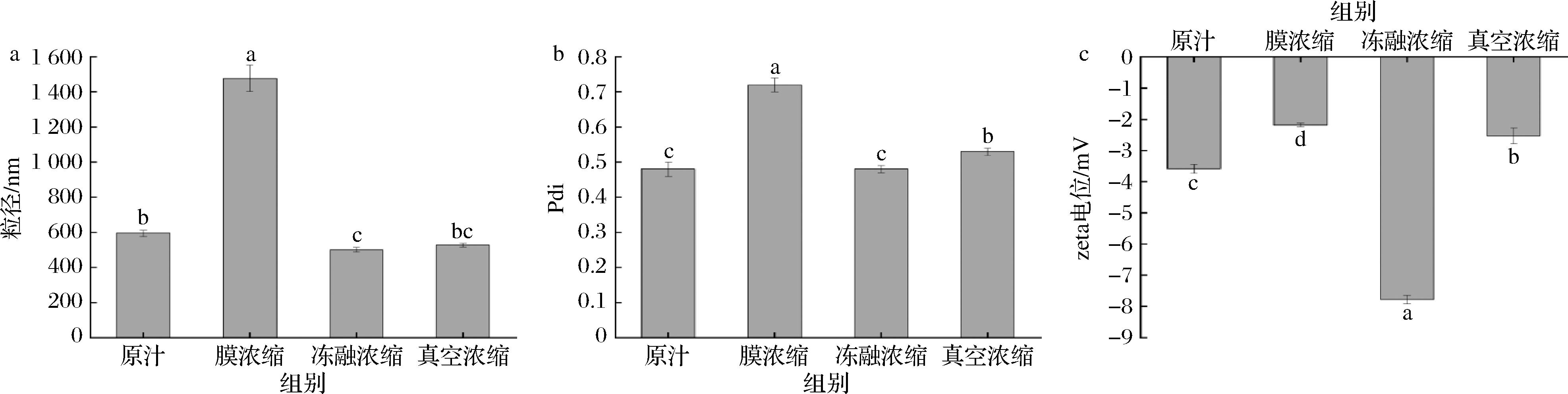
a-粒径值;b-PDI值;c-电位值
图6 不同浓缩方式对余甘子汁粒径、PDI和电位的影响
Fig.6 Effects of different concentration methods on particle size, PDI, and potential of P. emblica L. juice
2.3 抗氧化活性的变化
如图7所示,不同浓缩方式制得的余甘子汁具有不同的抗氧化活性,有明显差异(P<0.05)。半抑制浓度(half inhibitory concentration,IC50)值越低,抗氧化能力越强。膜浓缩复原汁、冻融浓缩复原汁和真空浓缩复原汁清除DPPH自由基的IC50值分别为3.19、2.37 mg/mL和3.83 mg/mL,是原汁的1.63倍、1.21倍和1.95倍。膜浓缩复原汁、冻融浓缩复原汁和真空浓缩复原汁清除ABTS阳离子自由基的IC50值分别为4.68、4.19 mg/mL和5.39 mg/mL,是原汁的1.19倍、1.07倍和1.38倍。因此,冻融浓缩能更好地保护余甘子汁的抗氧化活性,其次为膜浓缩法,真空浓缩法对抗氧化活性的影响最大。余甘子汁中含有丰富的抗氧化活性物质,但其抗氧化能力在加工过程中容易受加工条件的影响而发生改变,这是由于余甘子汁中的维生素C、黄酮、多酚等生物活性成分在真空浓缩中会因温度的升高而发生结构改变,从而降低果汁的抗氧化活性[26]。
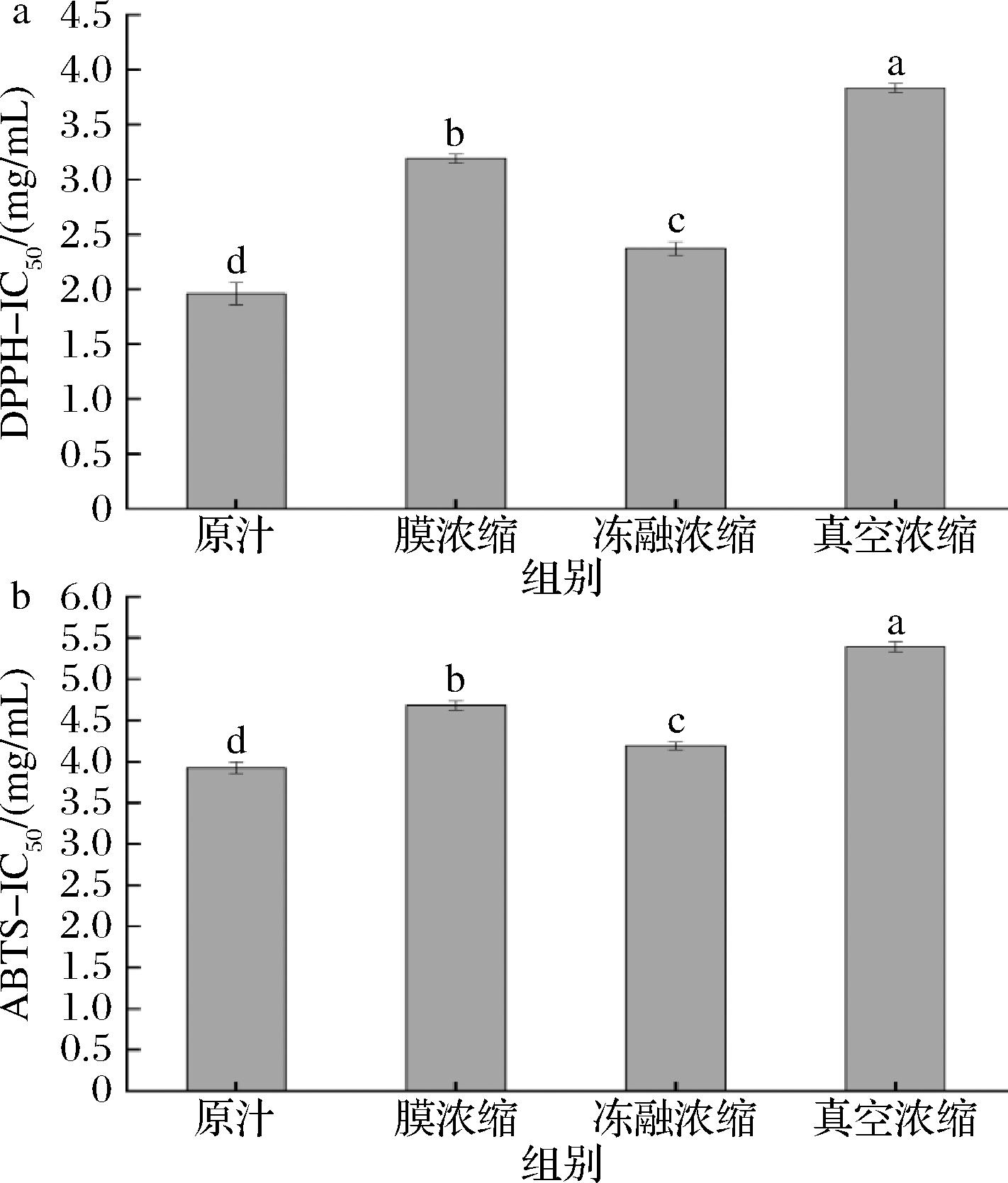
a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力
图7 不同浓缩方式对余甘子汁对抗氧化活性的影响
Fig.7 Effect of different concentration methods on antioxidant capacity of P. emblica juice
2.4 浓缩余甘子汁挥发性成分的GC-MS分析
余甘子原汁、膜浓缩复原汁、冻融浓缩复原汁和真空浓缩复原汁中共鉴定出51种化合物,包括酯类12种、醛类8种、醇类7种、烷烃类11种、酮类2种、烯烃类7种、酚类2种、芳烃类2种,其中共同鉴定出的化合物有7种,酯类1种、醛类2种、醇类1种、烷烃类3种。4个处理组分别鉴定出的化合物种类有32、22、29、19种,真空浓缩复原汁鉴定出的化合物种类最少,其次是膜浓缩复原汁,说明较高的温度和膜处理对余甘子汁挥发性物质的损失较大,冻融浓缩复原汁对挥发性物质的保持最好。余甘子原汁挥发性成分以醇类、酚类和酯类为主,含量较高的化合物有2,5-二叔丁基酚、反式-2-己烯醇和正己醇,其含量分别为48.44、46.22 μg/100 mL和25.54 μg/100 mL,为余甘子汁提供果香、青草香气。膜浓缩复原汁挥发性成分以酚类、烷烃类和醇类为主,2,4-二叔丁基苯酚含量最高,为54.31 μg/100 mL。冻融浓缩复原汁挥发性成分以醇类、酚类和酯类为主,其中2,4-二叔丁基苯酚、正己醇含量较高,分别为45.68、18.22 μg/100 mL。真空浓缩复原汁挥发性成分以酚类、醛类和烷烃类为主,主要化合物为2,4-二叔丁基苯酚、3,4-二甲基苯甲醛,其含量分别为44.22、8.32 μg/100 mL。具体见电子增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.039561)。
4个处理组共检测到51种挥发性化合物,并不是所有的挥发性物质都对香气具有贡献,贡献的大小取决于果汁中化合物的浓度及其气味阈值。OAV是常见的评价挥发性成分香气贡献大小的一种方法,当挥发性物质的OAV≥1时,该物质才能被人体感知,并对样品的香气具有贡献[27]。
对16种挥发性化合物的OAV进行分析,4个处理组的OAV≥1的化合物分别有4、4、5种和6种,共同的化合物有2种。正己醛和芳樟醇是共有的香气成分,且OAV≥1,对香气的贡献较大,为余甘子汁提供青草、果香、铃兰香、木香等香气。酯类阈值较高,所以其OAV较小,对余甘子汁的特征气味贡献不大,如膜浓缩复原汁中仅有棕榈酸甲酯OAV≥1,余甘子原汁、冻融浓缩复原汁、真空浓缩复原汁中酯类物质的OAV均小于1。醛类化合物中,冻融浓缩复原汁鉴定到2种OAV≥1的挥发性成分,为正己醛和壬醛,其OAV分别为9.29、19.00,其他3个处理组中OAV≥1的挥发性成分均只有正己醛,其OAV分别为11.91、1.73、12.31。醇类化合物中,余甘子原汁和冻融浓缩复原汁均鉴定到2种OAV≥1的挥发性成分,均为反式-2-己烯醇和芳樟醇,膜浓缩复原汁和真空浓缩复原汁均只鉴定到1种挥发性成分,为芳樟醇,其OAV分别为9.38、10.85。除了膜浓缩复原汁,其他3种处理方式均检测到大马士酮,大马士酮阈值极低,其OAV分别为30 700、17 400、16 550,对香气的贡献很大,为余甘子汁提供强烈的花香和苹果香气。除了余甘子原汁没有检测到OAV≥1的酚类物质外,其他3个处理组均检测到1种OAV≥1的酚类物质,为2,4-二叔丁基苯酚,其OAV分别为2.72、2.28、2.21。具体见电子增强出版附表2。
综上分析,余甘子汁的特征气味主要由酯类、醛类、醇类和酮类等物质构成,鉴定出对余甘子汁整体香气具有较大贡献的化合物7种。其中,酯类和酮类均有1种,分别为乙酸乙酯、大马士酮;醛类有2种,分别是正己醛、壬醛;醇类类物质有2种,分别是反式-2-己烯醇、芳樟醇;此外,2,4-二叔丁基苯酚对余甘子汁也有香气贡献。冻融浓缩复原汁挥发性成分的保留效果最好,其次是膜浓缩复原汁,真空浓缩复原汁挥发性成分的保留效果最差。
2.5 不同浓缩方式余甘子汁感官评价的影响
由图8可知,余甘子汁经过浓缩处理后,感官评价的得分有所下降。以色泽、风味、口感、外观、总体可接受性5项指标对余甘子汁做感官评价,每个指标评分标准为1~9分,综合得分排名为余甘子原汁>冻融浓缩复原汁>膜浓缩复原汁>真空浓缩复原汁。冻融浓缩能更好的保持余甘子汁本身的风味、口感和色泽,是较为理想的浓缩方式。真空浓缩复原汁由于加工过程中温度较高,余甘子汁发生褐变,色泽变暗淡,同时对风味和口感的影响较大。膜浓缩过滤了一部分有机物和色素,对余甘子汁的感官也造成一定的影响。
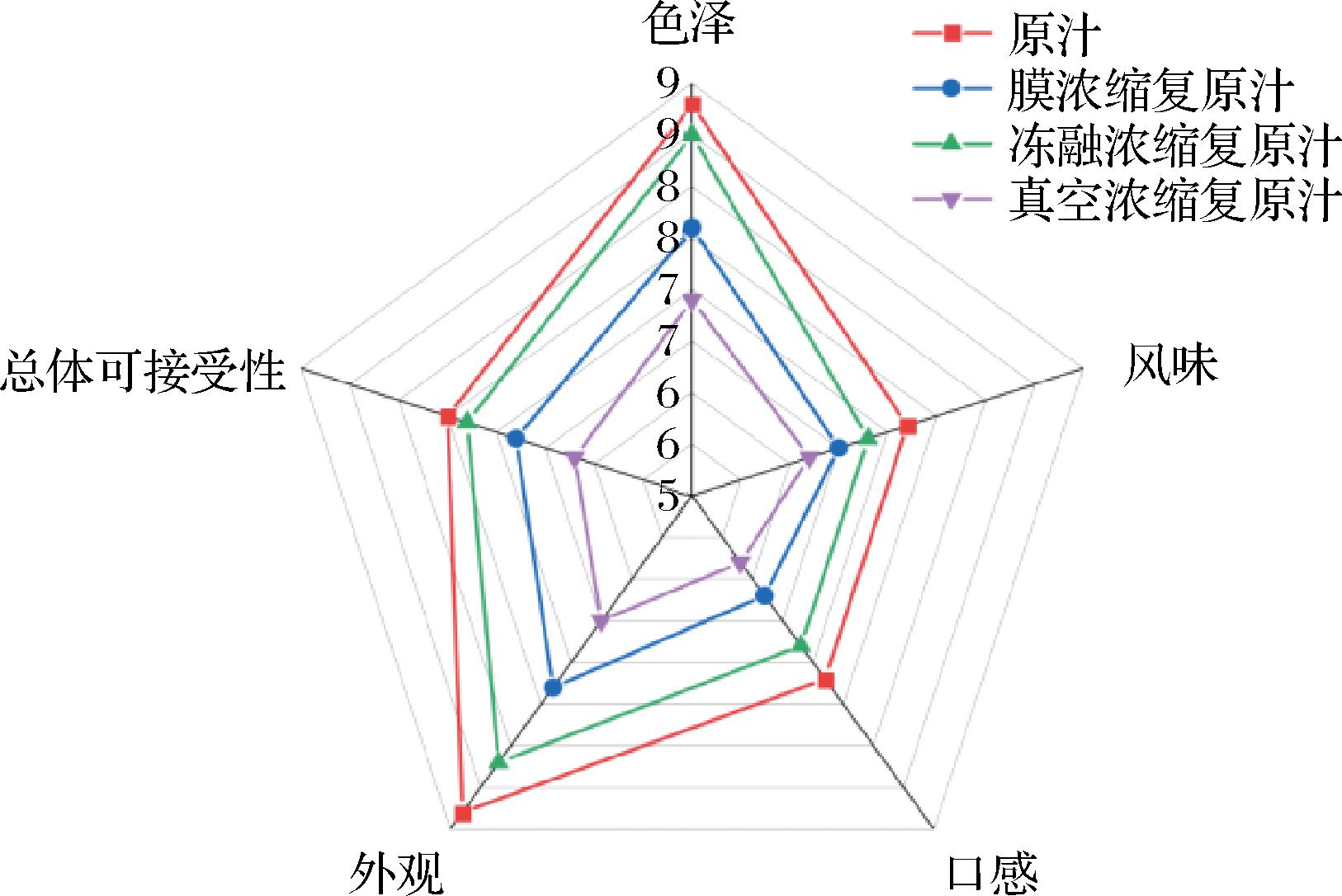
图8 不同浓缩方式对余甘子汁感官评价的影响
Fig.8 Influence of different concentration methods on sensory evaluation of P. emblica juice
3 结论
本文研究了3种浓缩方式(膜浓缩、冻融浓缩、真空浓缩)对余甘子汁的理化特性、抗氧化活性及挥发性成分的影响。膜浓缩、冻融浓缩、真空浓缩3种浓缩方式的浓缩倍数分别为3.67倍、5.19倍和8.61倍。膜浓缩复原汁、冻融浓缩复原汁、真空浓缩复原汁中维生素C的含量分别是原汁的86.21%、94.88%、71.69%,总酚的含量分别是原汁的70.64%、91.51%、49.61%。与余甘子原汁相比,冻融浓缩复原汁的色泽、抗氧化活性无显著差异,真空浓缩复原汁色泽明显变暗,抗氧化能力也明显下降。原汁与3种浓缩复原汁挥发性成分的种类分别为32、22、29种和19种,主要以酯类、醛类和醇类为主,真空浓缩复原汁和膜浓缩复原汁挥发性成分损失较大,冻融浓缩复原汁挥发性成分保持的较好。冻融浓缩复原汁电位绝对值最大,粒径、PDI值最小,果汁体系最稳定,有利于贮藏。综合浓缩倍数、营养成分、香气成分的损失情况及其稳定性考虑,冻融浓缩法是浓缩余甘子汁较为理想的浓缩方式。
[1] 张雯雯, 李坤, 徐涓, 等.新品种余甘子盈玉和糯种的果实性状及果实品质的差异性分析[J].食品科学, 2019, 40(2):180-185.ZHANG W W, LI K, XU J, et al.Comparative analysis of fruit characters and quality of new Phyllanthus emblica L.varieties Yingyu and Nuozhong[J].Food Science, 2019, 40(2):180-185.
[2] GUL M, LIU Z W, IAHTISHAM-UL-HAQ, et al.Functional and nutraceutical significance of amla (Phyllanthus emblica L.):A review[J].Antioxidants, 2022, 11(5):816.
[3] 孟晓, 唐鸣跃, 袁昌益, 等.响应面法优化余甘子果渣没食子酸的提取工艺[J].食品工业, 2022, 43(11):24-28.MENG X, TANG M Y, YUAN C Y, et al.Optimization of extraction technology of Gallic acid from Phyllanthus emblica L.pomace by response surface methodology[J].The Food Industry, 2022, 43(11):24-28.
[4] ROSE K N, WAN C P, THOMAS A, et al.Phenolic compounds isolated and identified from amla (Phyllanthus emblica) juice powder and their antioxidant and neuroprotective activities[J].Natural Product Communications, 2018, 13(10):1309-1311.
[5] KUMAR G, MADKA V, PATHURI G, et al.Molecular mechanisms of cancer prevention by gooseberry (Phyllanthus emblica)[J].Nutrition and Cancer, 2022, 74(7):2291-2302.
[6] LI W, ZHU H W, CHEN Y J, et al.Bioactivity-guided isolation of anti-inflammatory components from Phyllanthus emblica[J].Food Science &Nutrition, 2020, 8(6):2670-2679.
[7] WANG Y P, WU Y, XU M G, et al.Protective effects of Emblica officinalis polysaccharide against lead induced liver injury in mice model[J].International Journal of Biological Macromolecules, 2023, 251:126312.
[8] 陈军, 陈洪彬, 蒋璇靓, 等.余甘子贮藏与加工研究进展[J].食品工业科技, 2021, 42(11):342-347.CHEN J, CHEN H B, JIANG X J, et al.Research progress on storage and processing of Phyllanthus emblica[J].Science and Technology of Food Industry, 2021, 42(11):342-347.
[9] 高欣月, 万金庆, 厉建国, 等.两种浓缩工艺对苹果浊汁贮藏期品质及抗氧化活性的影响[J].食品与发酵工业, 2020, 46(14):114-120;135.GAO X Y, WAN J Q, LI J G, et al.Effect of different concentration processes on quality and antioxidant activity of apple turbid juice[J].Food and Fermentation Industries, 2020, 46(14):114-120;135.
[10] 中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 12456—2021 食品安全国家标准 食品中总酸的测定[S].北京:中国标准出版社, 2021.National Health Commission of the People’s Republic of China, State Administration for Market Regulation.GB 12456—2021 National Standard for Food Safety Determination of total acids in food[S].Beijing:Standards Press of China, 2021.
[11] DUBOIS M, GILLES K A, HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[12] 林羡, 李博哲, 徐玉娟, 等.二甲基二碳酸盐对百香果汁的杀菌效果及品质影响[J].保鲜与加工, 2022, 22(9):38-44.LIN X, LI B Z, XU Y J, et al.Sterilization efficacy and quality influence of dimethyl dicarbonate on passion fruit juice[J].Storage and Process, 2022, 22(9):38-44.
[13] 曹艳萍, 代宏哲, 曹炜, 等.Folin-Ciocaileu比色法测定红枣总酚[J].安徽农业科学, 2008, 36(4):1299; 1302.CAO Y P, DAI H Z, CAO W, et al.Determination of total phenols in Zizyphus jujuba Mill.by folin-ciocaileu colorimetry[J].Journal of Anhui Agricultural Sciences, 2008, 36(4):1299; 1302.
[14] 莫开菊, 柳圣, 程超.生姜黄酮的抗氧化活性研究[J].食品科学, 2006, 27(9):110-115.MO K J, LIU S, CHENG C.Study on antioxidant activity of the ginger flavonoid[J].Food Science, 2006, 27(9):110-115.
[15] SOK
 -
-
![]() TOWSKA A, KUCHARSKA A Z, WI
TOWSKA A, KUCHARSKA A Z, WI SKA K, et al.Composition and antioxidant activity of red fruit liqueurs[J].Food Chemistry, 2014, 157:533-539.
SKA K, et al.Composition and antioxidant activity of red fruit liqueurs[J].Food Chemistry, 2014, 157:533-539.
[16] 余元善, 郑自奋, 张桐, 等.贡柑籽油的提取及理化性质研究[J].食品安全质量检测学报, 2022, 13(22):7431-7437.YU Y S, ZHENG Z F, ZHANG T, et al.Extraction and physicochemical properties of Tribute citru seed oil[J].Journal of Food Safety &Quality, 2022, 13(22):7431-7437.
[17] 刘昊澄, 安可婧, 傅曼琴, 等.三种方法制备的柚皮精油的分子蒸馏及GC-MS挥发性成分测定[J].食品工业科技, 2020, 41(8):217-223.LIU H C, AN K J, FU M Q, et al.Molecular distillation separation and GC-MS analysis of pomelo peel oil prepared by three methods[J].Science and Technology of Food Industry, 2020, 41(8):217-223.
[18] CHEN X H, CHEN D J, JIANG H, et al.Aroma characterization of Hanzhong black tea (Camellia sinensis) using solid phase extraction coupled with gas chromatography-mass spectrometry and olfactometry and sensory analysis[J].Food Chemistry, 2019, 274:130-136.
[19] 陈树俊, 赵辛, 康俊杰, 等.不同梨品种品质评价及温度对梨浓缩汁指标影响研究[J].食品工业科技, 2015, 36(17):326-329.CHEN S J, ZHAO X, KANG J J, et al.Evaluation of the quality of different varieties of pears and effect of temperature on pear concentrated juice[J].Science and Technology of Food Industry, 2015, 36(17):326-329.
[20] 张子希, 苗俨龙, 萧奕童, 等.不同浓缩工艺对龙眼浓缩汁的色泽及挥发性成分的影响[J].食品与发酵工业, 2022, 48(6):84-89.ZHANG Z X, MIAO Y L, XIAO Y T, et al.Effects of different concentration techniques on color and volatile components of Longan concentrated juice[J].Food and Fermentation Industries, 2022, 48(6):84-89.
[21] 马晓玉. 加工方式对甜瓜浓缩汁品质的影响[D].乌鲁木齐:新疆农业大学, 2014.MA X Y.Effect of processing methods on the quality of concentrated melon juice[D].Urumqi:Xinjiang Agricultural University, 2014.
[22] 董雪君, 陈义伦.加工过程对莱阳梨清膏总酚及抗氧化能力的影响[J].食品科技, 2019, 44(1):115-119.DONG X J, CHEN Y L.Effect of working process on total polyphenol and antioxidant capacity of Laiyang pear clear syrup[J].Food Science and Technology, 2019, 44(1):115-119.
[23] 刘霭莎, 吴俏槿, 胡志高, 等.不同浓缩方式对发酵芒果果酱品质的影响[J].食品科技, 2019, 44(9):98-102.LIU A S, WU Q J, HU Z G, et al.Effects of different concentration methods on the quality of fermented mango jam[J].Food Science and Technology, 2019, 44(9):98-102.
[24] MA P H, ZENG Q H, TAI K D, et al.Preparation of curcumin-loaded emulsion using high pressure homogenization:Impact of oil phase and concentration on physicochemical stability[J].LWT, 2017, 84:34-46.
[25] 王小媛, 牛涵, 靳学远, 等.杜仲籽油苹果汁饮料低温等离子体和热杀菌的比较分析[J].现代食品科技, 2022, 38(9):206-214.WANG X Y, NIU H, JIN X Y, et al.Comparative analysis of cold plasma and thermal sterilization of Eucommia ulmoides seed oil-apple juice beverage[J].Modern Food Science and Technology, 2022, 38(9):206-214.
[26] KLIMCZAK I, MA ECKA M, SZLACHTA M, et al.Effect of storage on the content of polyphenols, vitamin C and the antioxidant activity of orange juices[J].Journal of Food Composition and Analysis, 2007, 20(3-4):313-322.
ECKA M, SZLACHTA M, et al.Effect of storage on the content of polyphenols, vitamin C and the antioxidant activity of orange juices[J].Journal of Food Composition and Analysis, 2007, 20(3-4):313-322.
[27] 谢克林, 冯涛, 庄海宁, 等.外源可发酵糖对葡萄酒挥发性化合物的影响[J].食品科学, 2016, 37(18):113-119.XIE K L, FENG T, ZHUANG H N, et al.Influence of different exogenous fermentable sugars on volatile compounds of wine[J].Food Science, 2016, 37(18):113-119.