糯米香(Strobilanthes tonkinensis Lindau),爵床科(Acanthaceae)马蓝属(Strobilanthes)多年生草本植物,原产于中国云南省,现广泛分布于我国云南、广西等省份及越南、泰国等地[1]。因其叶片晒干后具有糯米香气而得名,长期以来作为傣族人的传统茶饮料,叶片中富含多种芳香成分[2-3]及生物活性物质[4-5],可作为天然香料和药用植物,亦可作为茶叶[6-7]、酒曲、冰淇凌等的调味添加剂。新鲜的糯米香叶含有大量水分,不利于运输和储藏,干燥是糯米香叶生产过程的关键步骤,对于保留糯米香叶的香气、营养成分至关重要。自然晾干是糯米香叶较为传统的干燥方式[8],但干燥效率较低,可能导致叶片污染或变质。目前对于糯米香叶的研究多集中于挥发性香气成分[9-11],而对于糯米香叶的干燥加工鲜有报道,因此开展不同干燥方式对糯米香叶品质影响的研究十分必要。
与传统的自然晾干相比,热风干燥(hot air drying,HAD)、微波真空(microwave vacuum drying,MVD)、真空冷冻(vacuum freeze drying,VFD)等干燥方式也逐渐广泛应用于茶叶[12-13]、果蔬[14-15]等方面。JIAO等[16]研究表明,相比于日光干燥,40~50 ℃低温热风干燥的橙红黑茶的甜果香气更浓郁,香气协调性更好,综合品质更高;叶秋萍等[17]对茉莉花茶的研究结果表明,冷冻干燥能够较好地保留茶坯中烯烃类和醇类等热敏性成分,热泵干燥能较好地保留茉莉花茶的特征香气;陈苏森等[18]发现微波干燥是高品质斑兰叶最适宜的加工方式。本研究以云南糯米香叶为研究对象,采用HAD 40 ℃、HAD 50 ℃、HAD 60 ℃、MVD、VFD、自然晾干等6种干燥方式对糯米香叶进行处理,探究不同干燥方式处理糯米香叶的干燥特性,通过电子鼻及顶空固相微萃取-气相色谱-质谱联用(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)技术,分析研究其挥发性成分的差异,并结合感官评价,以期筛选出最适用于糯米香叶的干燥方式,为糯米香叶的干燥加工提供理论支撑和实用指导。
1 材料与方法
1.1 材料、试剂与仪器
新鲜糯米香叶,收集于云南省昆明市茶叶市场;C7~C40正构烷烃(色谱纯)、癸酸乙酯(内标物,≥99%),上海麦克林生化科技股份有限公司。
7890A-5977B型气相色谱-质谱联用仪、50/30 μm型手动SPME萃取头(DVB/CAR/PDMS),美国Agilent公司;FD-1-50型真空冷冻干燥机,北京博医康实验仪器有限公司;RWBA-08S型微波真空干燥箱,南京苏恩瑞干燥设备有限公司;PEN3.5型便携式电子鼻传感器,德国Airsense公司。
1.2 实验方法
1.2.1 含水率的测定
参照GB/T 5009.3—2016《食品安全国家标准 食品中水分的测定》,采用直接干燥法测定。
1.2.2 干燥方式
将新鲜糯米香叶清洗干净后,用吸水纸吸干叶片表面水分,分别进行40 ℃ HAD、50 ℃ HAD、60 ℃ HAD、MVD、VFD、自然晾干处理。
HAD:将叶片平铺于干燥箱中,分别以40、50、60 ℃进行热风干燥,设置风速为1 m/s。
MVD:在温度60 ℃,功率180 W,真空度1 MPa条件下干燥。
VFD:将叶片放置于-25 ℃冰箱中预冻12 h,后将物料盘置于冷冻干燥机中进行干燥,冷阱温度为-50 ℃,真空度为4 MPa。
自然晾干:置于室内通风处自然晾干。
各种干燥方式均将新鲜糯米香叶干燥至湿基含水率5%以下,使用研磨机研磨后过60目筛,密封于顶空瓶中,置于-20 ℃冰箱中保存备用。
1.2.3 干燥参数计算
干基含水量的计算如公式(1)所示:
(1)
式中:M,样品干基含水量,g/g;mt,样品t时刻的质量,g;md,样品干燥至湿基含水量5%以下时样品的质量,g;m,样品的干基质量,g。
水分比的计算如公式(2)所示:
(2)
式中:MR,水分比;M0、Mt分别为物料的初始干基含水量、t时刻的干基含水量,g/g。
干燥速率的计算如公式(3)所示:
(3)
式中:rd,样品干燥速率,g/(g·h);ht,样品在t时刻的干基含水量,g/g;ht+Δt,样品在t+Δt时刻的干基含水量,g/g;Δt,干燥间隔时间,h。
1.2.4 电子鼻传感器检测
称取1.0 g不同干燥方式得到的糯米香叶粉,置于15 mL顶空瓶中,参考文献[3,19]的方法,70 ℃下水浴5 min后静置平衡10 min,记录电子鼻10个传感器在120 s内的响应值。电子鼻10个传感器敏感物质见电子增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.040461)。
表1 不同干燥处理的糯米香叶挥发性成分HS-SPME-GC-MS分析结果
Table 1 Results of HS-SPME-GC-MS analysis of volatile constituents of S. tonkinensis leaves with different drying treatments
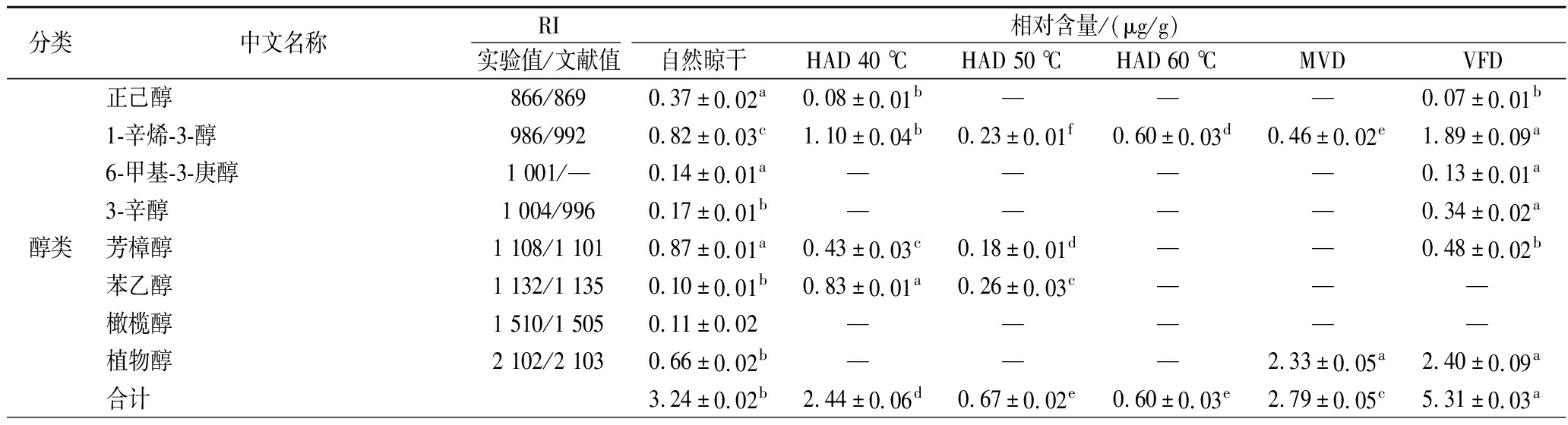
分类中文名称RI相对含量/(μg/g)实验值/文献值自然晾干HAD 40 ℃HAD 50 ℃HAD 60 ℃MVDVFD醇类正己醇866/8690.37±0.02a0.08±0.01b———0.07±0.01b1-辛烯-3-醇986/9920.82±0.03c1.10±0.04b0.23±0.01f0.60±0.03d0.46±0.02e1.89±0.09a6-甲基-3-庚醇1 001/—0.14±0.01a————0.13±0.01a3-辛醇1 004/9960.17±0.01b————0.34±0.02a芳樟醇1 108/1 1010.87±0.01a0.43±0.03c0.18±0.01d——0.48±0.02b苯乙醇1 132/1 1350.10±0.01b0.83±0.01a0.26±0.03c———橄榄醇1 510/1 5050.11±0.02—————植物醇2 102/2 1030.66±0.02b———2.33±0.05a2.40±0.09a合计3.24±0.02b2.44±0.06d0.67±0.02e0.60±0.03e2.79±0.05c5.31±0.03a
续表1

分类中文名称RI相对含量/(μg/g)实验值/文献值自然晾干HAD 40 ℃HAD 50 ℃HAD 60 ℃MVDVFD酮类1-辛烯-3-酮982/9800.60±0.02d1.75±0.11a1.46±0.03b0.37±0.01e—0.72±0.02c3-辛酮985/988—0.72±0.03————4,5,6,7-四氢-1H-吲哚-3(2H)-酮1 404/1 4180.20±0.02b0.25±0.01a—0.17±0.01c—0.17±0.01cα-紫罗兰酮1 425/—1.45±0.03a0.85±0.03b0.12±0.01c0.12±0.01c—0.13±0.01c香叶基丙酮1 443/—0.22±0.02b0.14±0.01c0.09±0.01d0.10±0.03d0.13±0.02c0.49±0.02aβ-紫罗兰酮1 452/1 4521.03±0.03b0.81±0.02c0.18±0.01d0.13±0.01d0.13±0.02d3.09±0.07a5,6-环氧紫罗兰酮1 487/1 4860.16±0.02—————植酮1 846/1 8470.43±0.03a————0.30±0.02b2-(乙氨基)-2-(3-甲氧基苯基)环己酮1 996/—4.62±0.28a——0.22±0.01c—4.14±0.07b合计8.71±0.35b4.52±0.13c1.85±0.01d1.10±0.03e0.27±0.01f9.04±0.11a醛类正己醛776/7770.12±0.01b————0.51±0.23a反式-2-己烯醛853/8530.26±0.01c0.30±0.03b———1.24±0.02aβ-环柠檬醛1 241/1 2340.07±0.01a————0.07±0.01a十一醛1 313/1 310—0.72±0.01————十三醛1 501/——0.87±0.01————正十四醛1 605/——0.97±0.06a——0.16±0.01b—十五醛1 721/1 713—0.88±0.03a——0.11±0.00b—合计0.46±0.03c3.73±0.07a——0.27±0.01d1.82±0.24b酯类水杨酸甲酯1 206/1 1994.32±0.06a4.13±0.07b3.24±0.02c4.10±0.04b3.41±0.02c4.32±0.01a6-甲基-2-吡啶羧酸乙酯1 302/—0.37±0.01c0.07±0.01d0.51±0.01b0.76±0.04a—0.74±0.03a二氢猕猴桃内酯1 529/—0.12±0.01a0.11±0.01a———0.13±0.02a水杨酸-2-乙基己基酯1 813/1 8070.34±0.02b0.44±0.02a—0.25±0.01c0.42±0.01a0.26±0.01c胡莫柳酯1 900/1 9030.23±0.03d0.67±0.00a—0.24±0.01d0.42±0.02b0.27±0.01c棕榈酸甲酯1 927/1 9271.10±0.01a1.12±0.02a1.07±0.00a1.11±0.02a1.07±0.01a1.08±0.02a棕榈酸乙酯1 993/1 9921.32±0.01b1.48±0.02a1.28±0.02b1.29±0.01b1.28±0.00b1.31±0.02b油酸乙酯2 173/2 180—1.39±0.02————合计8.80±0.04c9.41±0.09a5.10±0.02e6.76±0.08c6.61±0.04d7.10±0.03b杂环类2-乙酰基-3,4,5,6-四氢吡啶914/——0.16±0.01————2-丙基吡啶999/—0.47±0.02e1.14±0.04a0.75±0.03c0.63±0.02d0.95±0.03b0.28±0.01f2-乙酰基吡啶1 042/1 0462.61±0.04d7.29±0.56a3.34±0.07c3.17±0.01c3.30±0.09c4.29±0.05b2,3-环戊烯并吡啶1 080/——0.37±0.04a0.23±0.02b—0.12±0.02c—2-丙酰基吡啶1 100/1 1076.29±0.05c15.76±0.69a9.90±0.51b10.24±0.29b15.20±0.15a9.65±0.32b2-丙酰基-3,4,5,6-四氢吡啶1 149/—53.41±5.63e105.19±3.29a64.09±2.42d70.93±0.67c83.41±2.39b76.05±1.05c2-丙酰基-1,4,5,6-四氢吡啶1 188/—26.85±1.14c49.10±1.71a24.22±0.62d33.47±1.36b21.49±2.42d22.04±0.62d1,2,3,4-四氢-2-甲基喹啉1 326/—0.05±0.01b0.07±0.01a0.03±0.01c0.02±0.01d0.03±0.00c0.02±0.01d1-吡咯烷-1-环己烯1 442/—0.35±0.03a—0.14±0.01c0.17±0.01b—0.17±0.01b2-(5-甲氧基-2-甲基-1H-吲哚-3-基)乙胺1 626/—0.17±0.01—————8-甲氧基-2,3-二甲基喹喔啉-5-胺1 759/—2.34±0.03—————9-羟基-4-甲氧基吖啶2 031/—0.73±0.04c1.85±0.04a1.19±0.06b0.49±0.01d0.04±0.01e—4-乙酰-5-甲基-1-苯基吡唑2 050/——1.61±0.03a0.75±0.01c1.07±0.03b——合计93.27±3.18e182.54±1.78a104.64±2.46d120.19±1.75b124.54±3.22b112.5±1.19c烃类1-苯基-1-丁烯1 092/——————0.11±0.02十四烷1 400/1 4000.16±0.01a———0.16±0.01a—正十五烷1 491/1 4880.52±0.02a0.52±0.01a0.13±0.01d0.25±0.02c0.13±0.01d0.32±0.03b正十七烷1 698/1 7000.17±0.01a0.18±0.01a0.16±0.01a0.17±0.02a0.17±0.00a0.17±0.01a合计0.82±0.02a0.75±0.02b0.30±0.01e0.42±0.01d0.46±0.01c0.49±0.03c酸类丙酸724/7180.22±0.02c0.29±0.03b0.29±0.02b—0.42±0.01a—4,4-二甲基庚二酸1 431/1 4270.20±0.02—————月桂酸1 573/——0.66±0.01————肉豆蔻酸1 780/1 770—1.49±0.03————棕榈酸1 980/1 9722.53±0.04c4.73±0.08a2.57±0.02c2.55±0.03c2.71±0.02b2.72±0.04b合计3.05±0.00b7.18±0.07a2.86±0.02c2.55±0.03e3.13±0.01b2.72±0.04d含硫化合物苯并噻唑1 263/1 2580.78±0.03a————0.77±0.01a2,3-二氢-3-甲基-苯并[b]噻吩-3-甲醇1 329/—0.15±0.01d0.56±0.01a0.29±0.01b0.21±0.01c0.22±0.01c0.11±0.01e4,5,6,7-四甲基-苯并[1,2,5]噻二唑1 548/1 5480.12±0.02—————二苯硫醚1 579/1 5670.87±0.01a0.58±0.02c—0.07±0.00d—0.67±0.01b合计1.93±0.02a1.14±0.03c0.29±0.01d0.29±0.01d0.22±0.01e1.53±0.04b
续表1
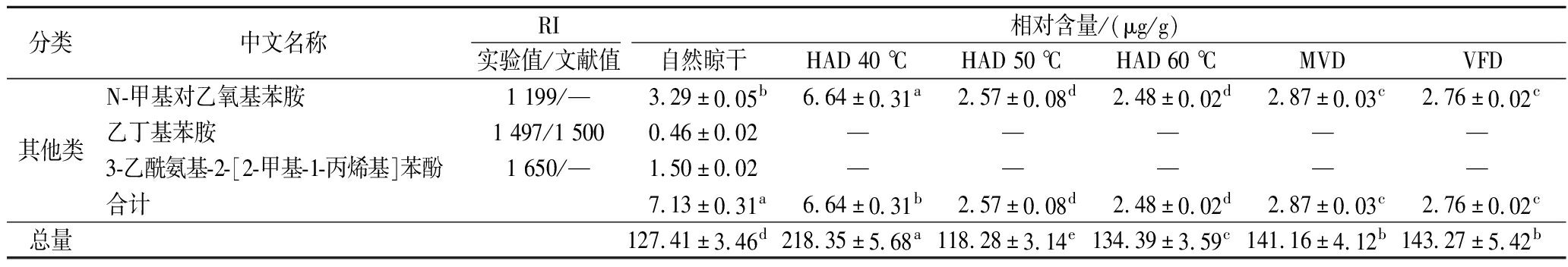
分类中文名称RI相对含量/(μg/g)实验值/文献值自然晾干HAD 40 ℃HAD 50 ℃HAD 60 ℃MVDVFD其他类N-甲基对乙氧基苯胺1 199/—3.29±0.05b6.64±0.31a2.57±0.08d2.48±0.02d2.87±0.03c2.76±0.02c乙丁基苯胺1 497/1 5000.46±0.02—————3-乙酰氨基-2-[2-甲基-1-丙烯基]苯酚1 650/—1.50±0.02—————合计7.13±0.31a6.64±0.31b2.57±0.08d2.48±0.02d2.87±0.03c2.76±0.02c总量127.41±3.46d218.35±5.68a118.28±3.14e134.39±3.59c141.16±4.12b143.27±5.42b
注:不同小写字母代表差异显著(P<0.05),“—”表示该数据没有被检测到。
1.2.5 HS-SPME条件
参照文献[20]的方法,取1 g不同干燥方式处理的糯米香叶粉置于20 mL顶空瓶中,加入2 g NaCl,5 mL纯净水,50 μL 132.30 μg/mL的癸酸乙酯内标溶液,混合均匀,平衡30 min,萃取温度70 ℃,萃取时间30 min,在230 ℃进样口解析5 min。
1.2.6 GC-MS分析条件
参照文献[3]检测糯米香叶挥发性成分。GC条件:Agilent 7890A-5977B型气相色谱-质谱联用仪,122-5562 DB-5 MS毛细管柱(60 m×250 μm×0.25 μm);进样口温度280 ℃;载气99.999%高纯度He,流速1.0 mL/min;不分流模式,进样量1.0 μL。升温程序:初始温度40 ℃,保持3 min,以3 ℃/min升至180 ℃,保持5 min,以10 ℃/min升至250 ℃,保持5 min。
MS条件:采用SCAN模式,传输线温度280 ℃;离子源温度230 ℃;四极杆温度150 ℃;离子源为XTR-EI源,电子能量70 eV;扫描范围10~550 amu。
定性方法:基于NIST20数据库,匹配度≥85%,并结合保留指数(retention index,RI)对挥发性成分进行定性分析。
定量方法:挥发性成分含量按公式(4)计算:
![]()
(4)
式中:w,挥发性物质含量,μg/g;S0,挥发性物质峰面积,%;w1,内标含量,μg/g;S1,内标峰面积,%。
1.2.7 感官评定方式
按照GB/T 23776—2018《茶叶感官评审方法》对糯米香叶进行感官评定。
1.3 数据统计分析
使用Excel等软件对实验数据进行处理分析,使用Origin对干燥数学模型进行拟合和验证;利用WinMuster软件对电子鼻数据进行分析、绘图;SIMCA 14.1软件进行偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA);使用TBtools绘制聚类热图,上述实验数据均平行测定3次以上。
2 结果与讨论
2.1 糯米香叶干燥特性及干燥动力学分析
2.1.1 糯米香叶干燥特性
如图1所示,不同干燥方式处理下,水分比随干燥时间均呈现急速下降后趋于稳定的变化趋势,自然晾干、VFD、HAD 40 ℃、HAD 50 ℃、HAD 60 ℃、MVD达到水分比0.01所需时间分别为25、18、10、2.7、2、0.8 h,其中自然晾干的干燥效率最低,MVD效率最高,HAD 60 ℃的干燥效率是HAD 40 ℃的5倍。此外,干燥速率随干燥时间呈现波动性变化,干燥速率见电子增强出版附图1,干燥前期,大部分的自由水可通过热和质量传递从糯米香叶中蒸发[21],HAD可通过热空气对流,加速叶片中的水分蒸发,从而干燥速率较高,VFD通过降低气压使水分在较低温度下蒸发,从而保护热敏感成分;干燥中期,叶片水分流失会进一步加剧,干燥速率会出现波动性增大,细胞间孔隙变大,叶片整体变脆;干燥后期,叶片大部分水分已经散失,叶片表面结构紧致,降低了材料内部水蒸气传递速率[22],干燥速率逐渐缓慢。
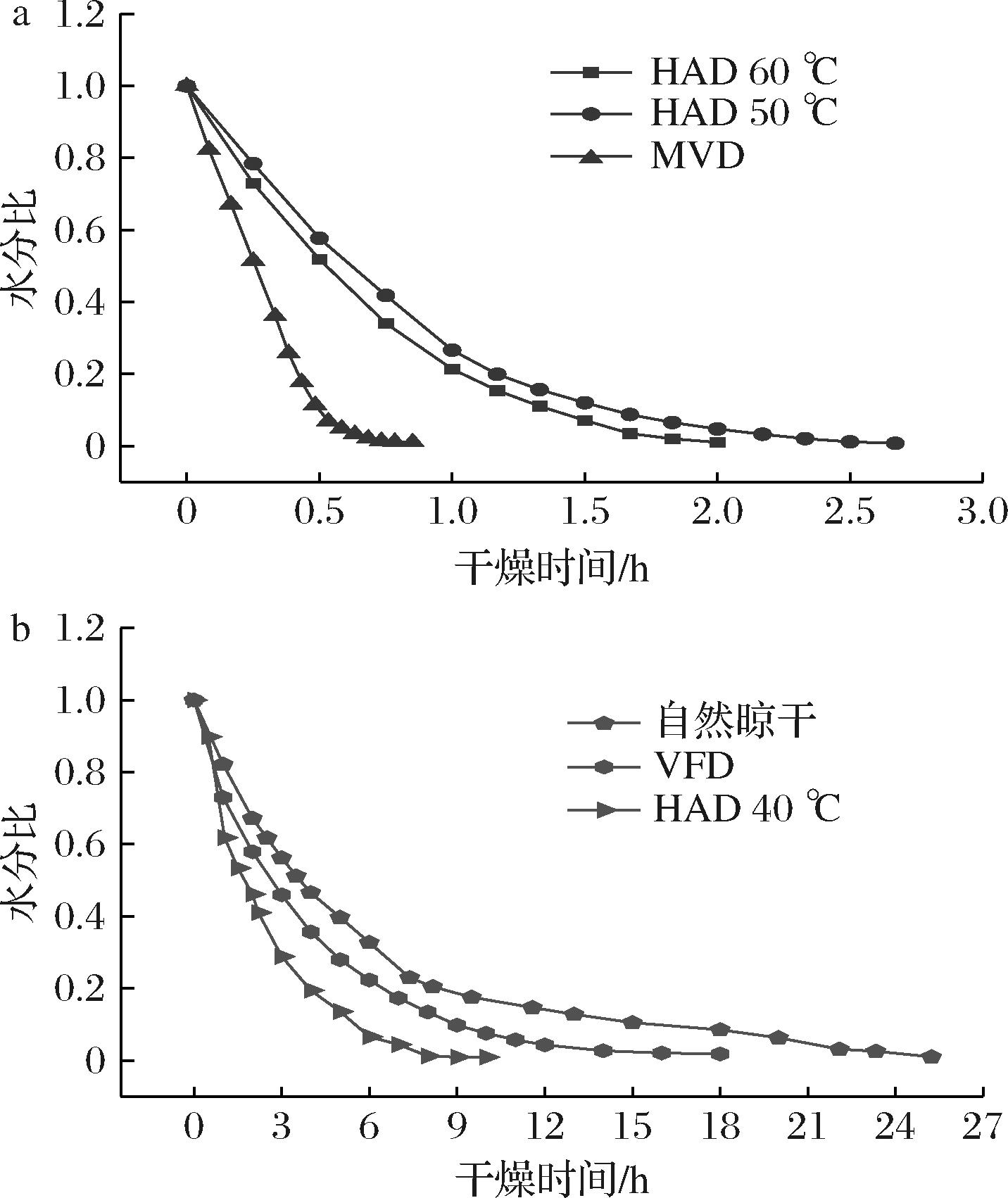
a-HAD 50℃、HAD 60℃、MVD;b-自然晾干、VFD、HAD 40℃
图1 水分比随干燥时间的变化
Fig.1 The variation of moisture ratio with drying time
2.1.2 糯米香叶干燥数学模型的构建及验证
根据文献[21,23],选用5种常用的薄层干燥数学模型,对糯米香叶干燥过程进行拟合,模型参数见电子增强出版附表2。R2(决定系数)是选择最佳模型的重要参数之一,R2越接近1,说明拟合效果越好。当多个模型的R2相同时,则要求,χ2(卡方)、均方根误差(root mean square error,RMSE)越接近于0.00。实验得出,Page模型对糯米香叶HAD、MVD、VFD、自然晾干过程的拟合效果最好,R2均>0.990 0,x2、RMSE均<0.009,其次是Logarithmic模型,Wang and Singh模型拟合效果最差,因此,Page模型是模拟和预测糯米香叶干燥过程的最优模型。
为验证所选模型的准确性,对糯米香叶6种干燥过程的实验值与Page模型的预测值进行对比,结果如图2所示,实验值与Page模型的预测值高度重合,说明Page模型有较高的预测性和可靠性,可以准确反映糯米香叶干燥过程的水分变化规律,模拟糯米香叶干燥过程。
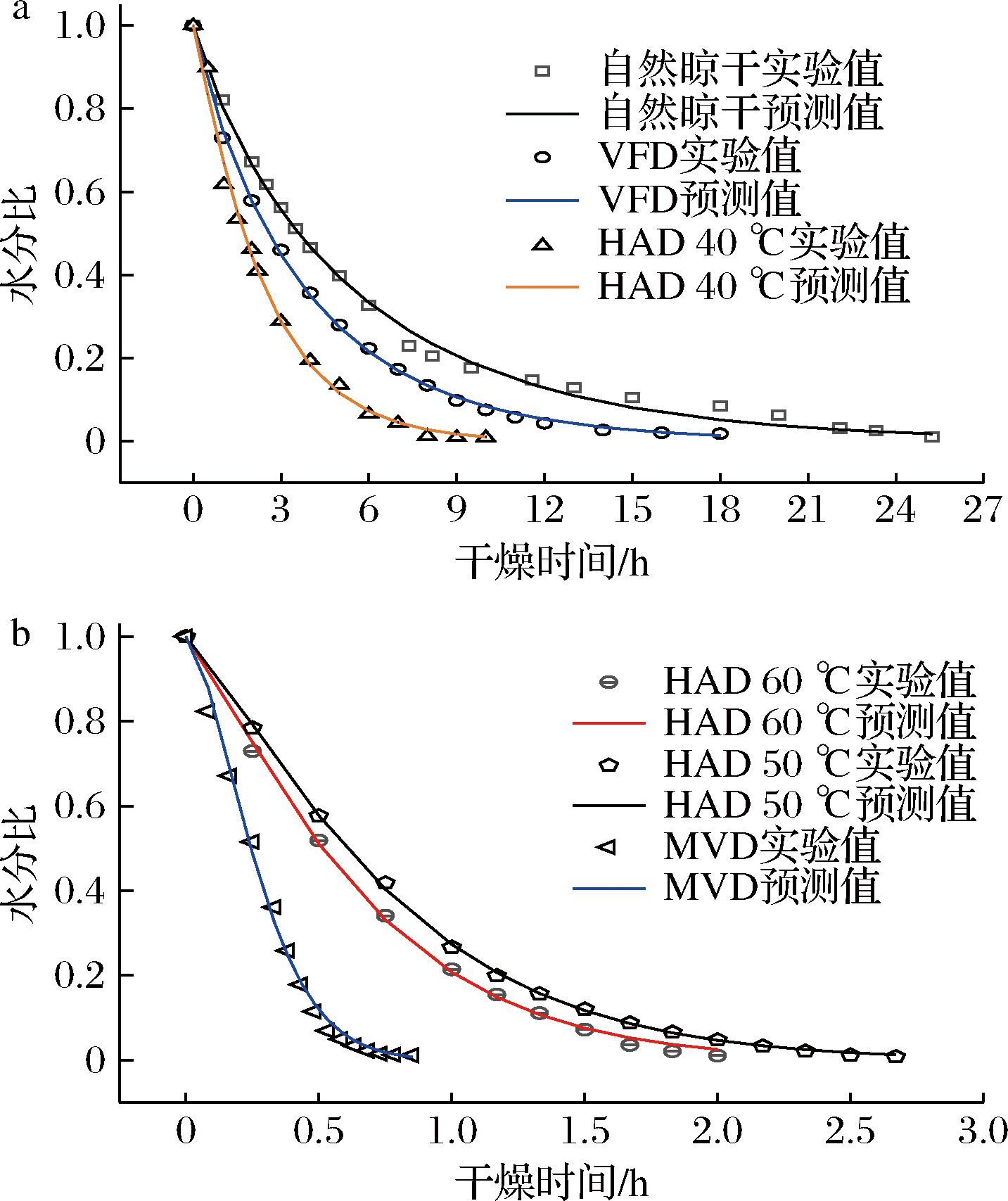
a-自然晾干、VFD、HAD 40 ℃;b-HAD 50 ℃、HAD 60 ℃、MVD
图2 六种干燥方式的水分比实验值和Page模型预测值
Fig.2 Experimental values and Page model predicted values of moisture ratio for 6 drying methods
2.2 电子鼻传感器检测结果分析
如图3所示,电子鼻不同传感器上的响应值有明显差异,其中W1W(对萜类和含硫化物化合物敏感)、W1S(对烷烃类敏感)、W2W(对芳香族化合物和有机硫化物敏感)、W5S(对氮氧化合物敏感)等4个传感器响应值相对较高、且不同干燥方式间存在明显差异。在6种干燥方式中,自然晾干、VFD、HAD 40 ℃电子鼻响应值在上述4个维度上显著高于其余3种干燥方式(P<0.05),能够较好的保留糯米香叶的香气,HAD 50 ℃、HAD 60 ℃和MVD电子鼻响应值较为相似,但其各维度响应值均较低,HAD 50 ℃、HAD 60 ℃及MVD的糯米香叶烷烃类、芳香族及氮氧化物可能有一定损失。
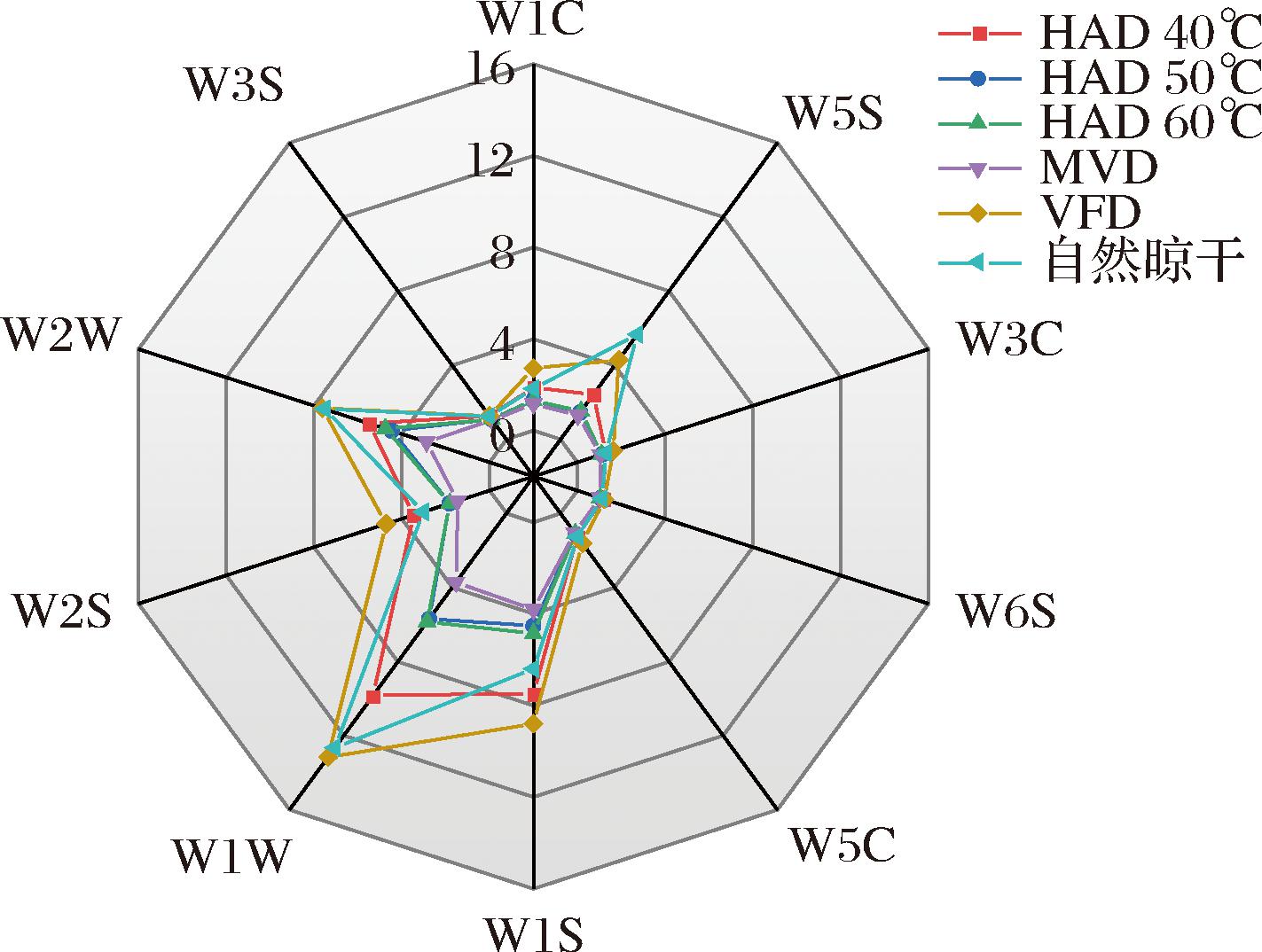
图3 六种干燥方式电子鼻响应值雷达图
Fig.3 Radar plot of electronic nose response values for 6 drying methods
对不同干燥方式的糯米香叶电子鼻117~119 s的响应值进行主成分分析(principal component analysis, PCA),其PCA及载荷图如图4所示,第一、第二主成分贡献率之和为92.4%,能够有效代表干燥后糯米香叶的气味信息。在结果分析中,气味相似度较高的组分会重叠在一起或距离相近[24]。由图4-a可知,HAD 50 ℃、HAD 60 ℃和MVD重叠在一起,其气味较为相近,而与VFD、HAD 40 ℃、自然晾干有效区分,本研究与刘红等[25]研究结果一致。
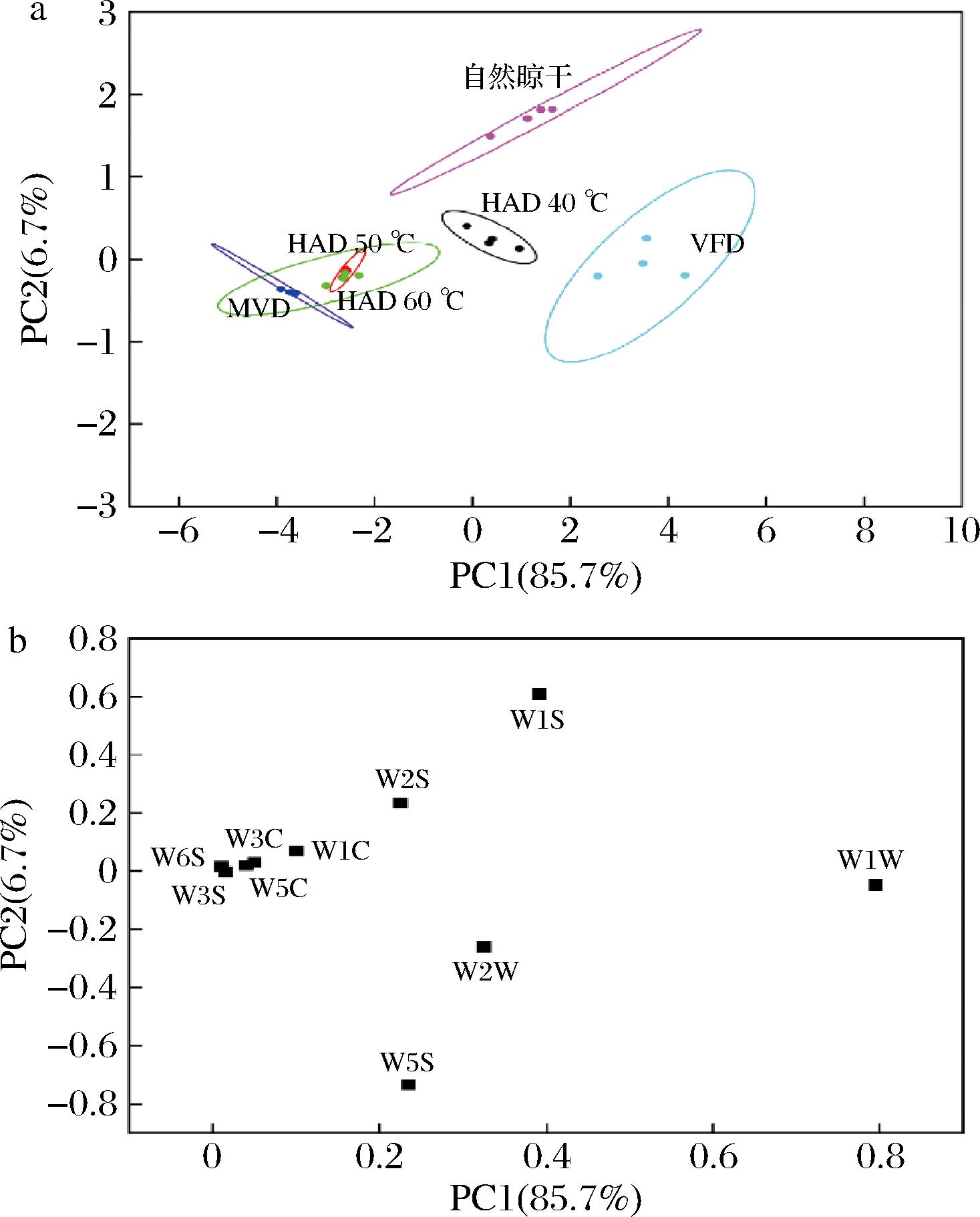
a-PCA图;b-载荷图
图4 不同干燥方式糯米香叶电子鼻PCA图和载荷图
Fig.4 E-nose PCA plots and loadings for different drying methods of S. tonkinensis leaves
由载荷图可知,在第1主成分中,W1W贡献度最高,在第2主成分中,W1S和W5S贡献度较高,W2W在第1、第2主成分均有较高的贡献度,说明不同干燥方式得到的糯米香叶萜类和含硫化物化合物、烷烃类化合物、氮氧化物及芳香族化合物可能具有显著差异。
2.3 干燥方式对糯米香叶挥发性成分的影响
如表1所示,不同干燥方式处理后的糯米香叶挥发性成分的种类和含量存在显著差异,HAD 40 ℃、自然晾干、分别检出42种、49种,远高于其他4种干燥工艺(HAD 50 ℃ 27种、HAD 60 ℃ 28种、MVD 26种、VFD 38种),6种干燥方式共检出61种挥发性物质,包括醇类(8种)、酮类(9种)、醛类(7种)、酯类(8种)、杂环类(13种)、烃类(4种)、酸类(5种)、含硫化合物(4种)、其他类(3种)。
杂环类化合物是糯米香叶主要的挥发性成分,不同温度HAD处理,杂环类化合物含量差异显著,可知干燥温度是影响杂环化合物含量的重要因素之一。其中含量较高的2-丙酰基-3,4,5,6-四氢吡啶和2-丙酰基-1,4,5,6-四氢吡啶,约占总含量的44%、22%,呈现出“爆米花样、糯米”香气,是糯米香叶主要的呈香物质[20],这一结果与张彦军等[3]研究结果一致。不同干燥方式处理后的2-丙酰基-3,4,5,6-四氢吡啶和2-丙酰基-1,4,5,6-四氢吡啶存在显著差异,其中HAD 40 ℃的总含量最高(154.29 μg/g),自然晾干的最低(80.26 μg/g)。此外,具有烘焙香、烟草香的2-乙酰基吡啶和2-丙酰基吡啶,在糯米香叶独特的香气中发挥重要的作用,HAD 40 ℃含量均最高。这可能是由于不同干燥温度引起的美拉德反应和氧化反应所导致的,干燥条件较为温和时,更易于保留这类香味物质。综上,HAD 40 ℃处理能够较大程度激发并保留糯米香叶的关键气息。
酮醇类化合物同样是糯米香叶中重要的呈香物质,能使糯米香叶的香气更加丰富饱满。亚油酸自动氧化产物1-辛烯-3-醇[26]及3-辛醇,能够赋予糯米香叶典型的蘑菇香,VFD和自然晾干中1-辛烯-3-醇含量显著高于其他干燥方式,且HAD 40 ℃、HAD 50 ℃、HAD 60 ℃和MVD中未能检测到3-辛醇,说明HAD和MVD会造成糯米香叶中部分蘑菇香气的散失。糯米香叶中的芳香化合物,如苯乙醇、芳樟醇、α-紫罗酮、β-紫罗兰酮、香叶基丙酮,具有宜人的清香和花果香,虽以较低的含量存在,但大多数阈值较高,能够增强糯米香叶的香气,其中芳樟醇、β-紫罗兰酮为糯米香叶的重要香气成分,起到协调香气的作用[20],VFD和自然晾干2种干燥方式中的芳樟醇、β-紫罗兰酮的含量是其他干燥方式的2~3倍,说明VFD和自然晾晒的糯米香叶气息更为丰富。
酯类及醛类化合物主要来源于氨基酸及脂肪酸的代谢[27],干燥后糯米香叶中的酯类化合物主要以水杨酸甲酯为主,水杨酸甲酯具有薄荷和冬青的混合气息[28],同时是乌龙茶[29]、红茶[30]等茶叶的主要呈香物质,在以往糯米香叶挥发性成分的研究中未见关于该物质的报道,可能是产地或品种引起的差异。不同干燥方式中,自然晾干和VFD的水杨酸甲酯的含量最高,HAD 50 ℃最低。干燥后的醛类化合物含量相对较低,十一醛、十三醛是HAD 40 ℃特有的醛类物质。此外,HAD 50 ℃、HAD 60 ℃、MVD会导致糯米香叶中青草气息样的正己醛、反式-2-己烯醛散失。
不同干燥方式的糯米香叶中酸类化合物含量相对较低,HAD 40 ℃酸类化合物的含量显著高于其他干燥方式,特有的酸类物质是月桂酸、肉豆蔻酸,其中月桂酸具有月桂油的温暖气息。含硫化合物主要来自糯米香叶中含硫氨基酸的分解,具有硫样气息,可能赋予糯米香叶独特的花香、果香或者烟熏香气,自然晾干、VFD、HAD 40 ℃中含硫化合物高于其他干燥方式,与电子鼻分析结果一致。
2.3.2 PLS-DA及聚类分析
以不同干燥方式为自变量,61种挥发性成分为因变量构建PLS-DA模型,结果如图5-a所示,模型中自变量拟合指数R2x、因变量拟合指数R2y、模型预测指数Q2分别为0.958、0.845、0.806,均大于0.5,R2x与R2y差值小于0.3,说明模型可靠。由图5-a可知,HAD 50 ℃、HAD 60 ℃及MVD距离相近,代表3种干燥方式的挥发性成分的种类与含量接近,与电子鼻PCA结果一致。自然晾干、VFD、HAD 40 ℃之间差异明显。
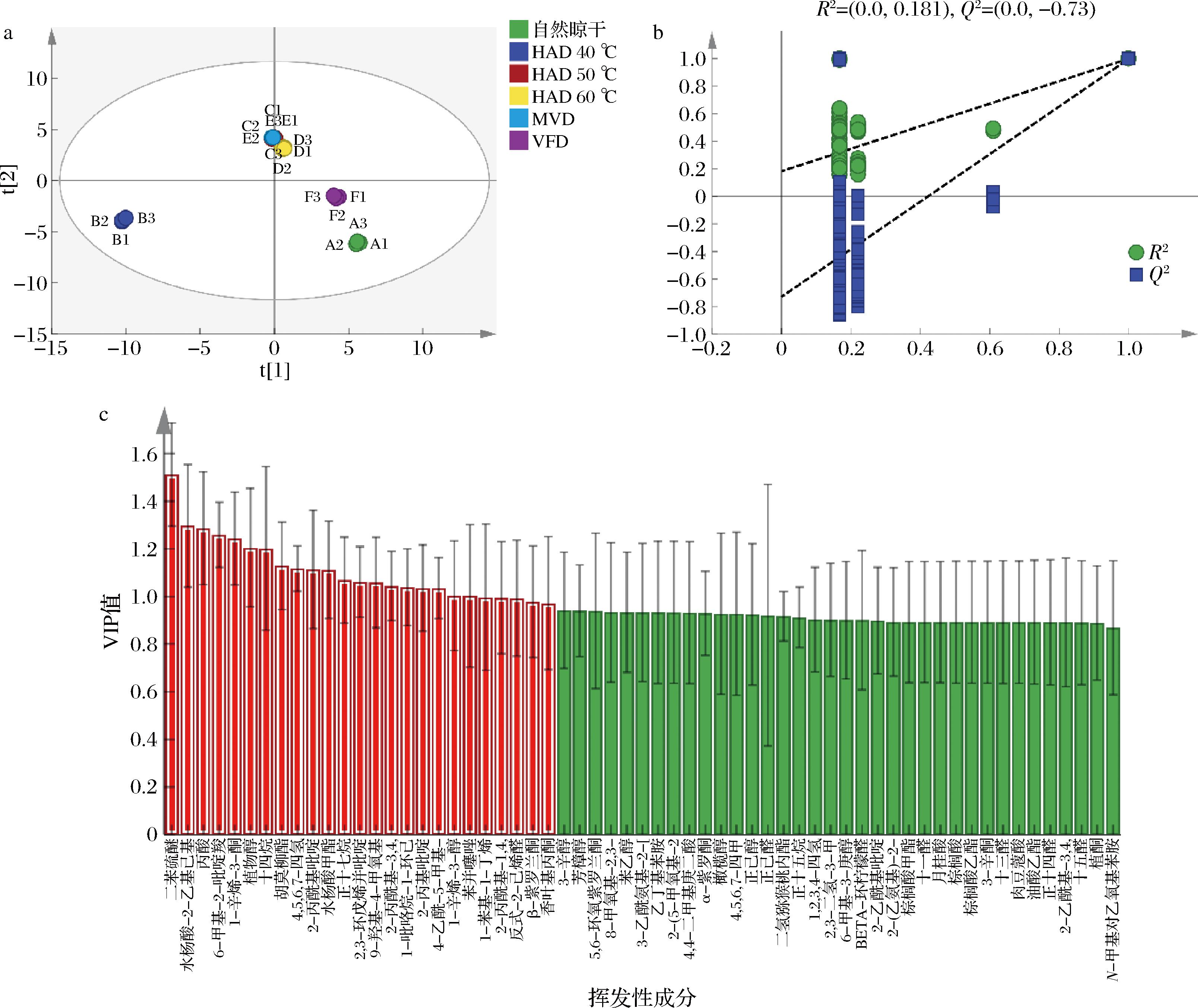
a-PLS-DA图;b-置换检验图;c-VIP值图
图5 糯米香叶挥发性成分PLS-DA图、置换检验图、VIP值图
Fig.5 PLS-DA result of volatile component of S. tonkinensis leaves, replacement test, and VIP values
为避免模型出现过拟合现象,对模型进行200次置换检验,结果如图5-b所示,R2,Q2分别为0.181、-0.73,Q2<0,表明模型不存在过拟合现象,有较好的预测能力,可认为PLS-DA模型可用来区分不同干燥方式糯米香叶挥发性成分。图5-c为挥发性成分变量投影重要性(variable importance in the projection,VIP)值分布图,一般认为VIP>1,在模型判别分类过程中起重要作用,由图5-c可知,VIP>1的挥发性化合物有25种,包括杂环类8种、酯类4种、酮类4种、醇类2种、醛类1种,含硫化合物2种,酸类1种、烃类3种。
根据PLS-DA模型,在VIP>1的25种挥发性化合物中,筛选出具有显著差异(P<0.05)的20种物质进行聚类分析,结果如图6所示,色块颜色由红到蓝代表挥发性成分含量由高到低。以20种挥发性成分含量可以明显区分糯米香的不同干燥方式,HAD 40 ℃中杂环化合物含量相对较高,VFD、自然晾干中的醇酮类、醛类、酯类含量相对较高。

图6 差异成分热图
Fig.6 Heat map of differential composition
2.4 感官评定分析
对不同干燥处理的糯米香叶进行感官评价,HAD 40 ℃、自然晾干、VFD、MVD、HAD 60 ℃、HAD 50 ℃、感官评价总得分分别为86.50、86.05、85.55、84.40、84.00、83.85,其雷达图如图7所示。HAD 40 ℃的感官总评分最高,其茶汤呈现明亮的黄绿色,香气纯正,糯米香浓厚,无明显杂气,口感较醇厚,余味较强,但略有苦涩味。自然晾干与VFD感官总评分略低于HAD 40 ℃,其茶汤香气飘逸,在糯米香的基础上,香气更为清新,口感醇厚、更有层次,但涩味明显。HAD 50 ℃、HAD 60 ℃、MVD的茶汤成色相近,茶汤明亮度略差于HAD 40 ℃,糯米香气稍弱,口感稍平淡。感官评定结果与挥发性成分测定结果基本一致。
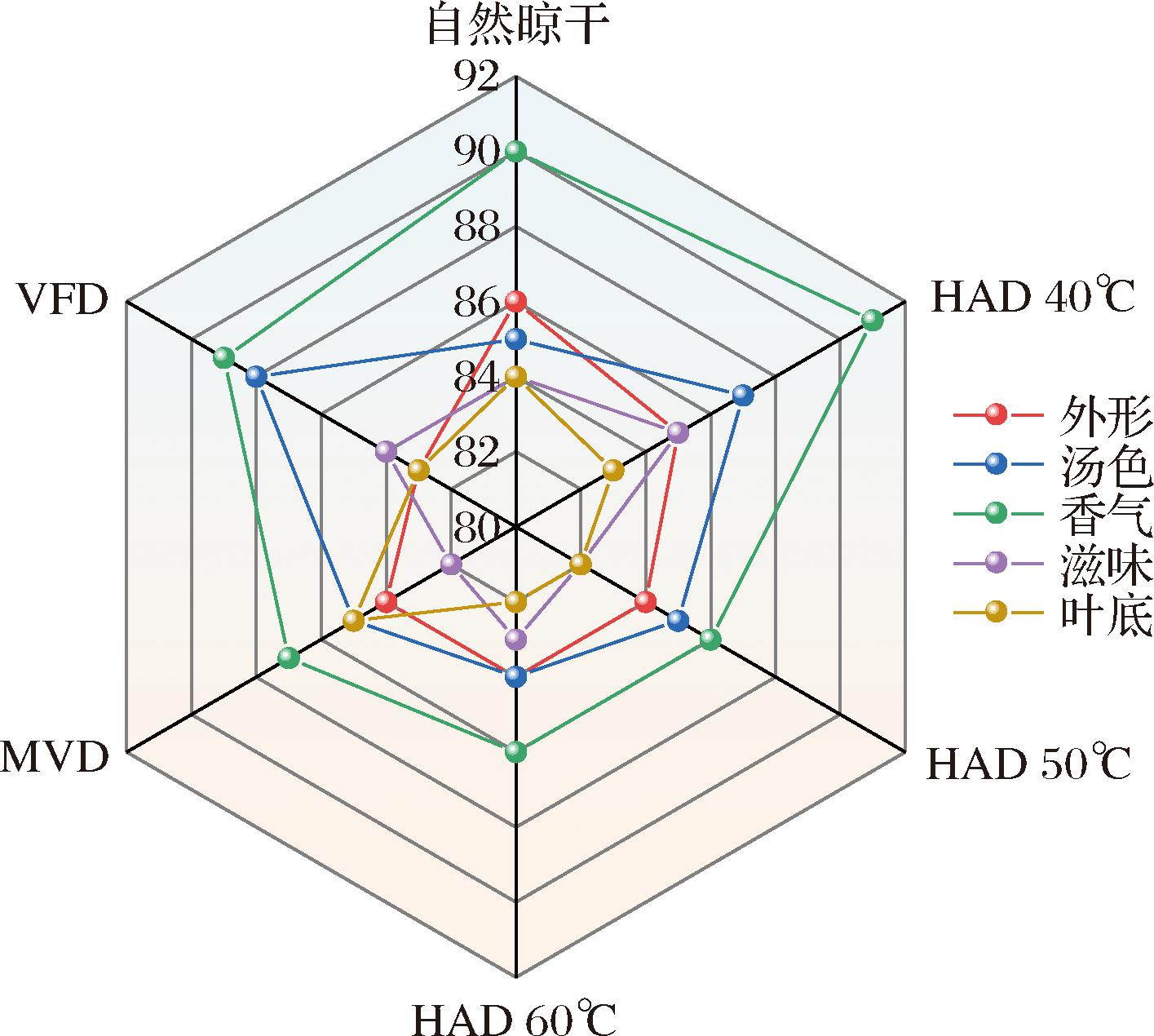
图7 不同干燥方式糯香茶感官雷达图
Fig.7 Sensory radar map of different proportions ofS. tonkinensis leaves with different drying treatments
3 结论
本研究对不同干燥方式处理的糯米香叶的干燥特性及挥发性成分进行测定,结果表明,6种干燥方式的干燥速率差异显著,Page模型是模拟6种不同干燥方式糯米香叶水分比随时间变化规律的最优模型。电子鼻结果表明,不同干燥方式糯米香叶具有不同的风味特征,MVD、HAD 60 ℃、HAD 50 ℃的风味特征较为相似,而与HAD 40 ℃、VFD、自然晾干得到有效区分。此外,不同干燥方式之间挥发性成分差异显著,HAD 40 ℃的杂环化合物含量最高,能够保留糯米样的关键气息,且其他香味散失程度较小,香气更为饱满,感官评定总得分最高。HAD 50 ℃、HAD 60 ℃、MVD虽然干燥效率较高,但会导致糯米香叶中蘑菇样、青草样香气散失,其茶汤香气及口感均较平淡。VFD与自然晾干能较好地保留糯米香叶中醇酮类热敏性香味物质,整体香气更加丰富,但两者杂环化合物含量较低,干燥时间较长,能耗较高,感官评定得分均略低于HAD 40 ℃。
综上可知,在考虑能耗和品质的情况下,HAD 40 ℃是糯米香叶最适宜的干燥方式。此外,糯米香叶作为云南本土的多功能型植物,单独作为茶饮料时,口感略苦涩,接下来可从茶叶混配、特征香富集提取、加香应用等方面入手研究,其应用前景十分广泛。
[1] Flora of China Editorial Committee.Flora of China.Vol.19[M].Beijing:Science Press, Beijing and Missouri Botanical Garden Press, St.Louis, 2011:381-429.
[2] 谭乐和, 尹桂豪, 章程辉, 等.超临界CO2萃取/气相色谱—质谱联用分析糯米香茶中的挥发油[J].热带作物学报, 2008, 29(4):530-534.TAN L H, YIN G H, ZHANG C H, et al.Supercritical CO2 extraction and GC-MS analysis of leaf volatile constituents in Teucrium manghuaense[J].Chinese Journal of Tropical Crops, 2008, 29(4):530-534.
[3] 张彦军, 徐飞, 谭乐和, 等.HS-SPME-GC/MS分析海南产糯米香叶的挥发性成分[J].热带作物学报, 2015, 36(3):603-610.ZHANG Y J, XU F, TAN L H, et al.GC/MS analysis of volatiles in Strobilanthes tonkinensis leaf extracted by headspace solid-phase microextraction[J].Chinese Journal of Tropical Crops, 2015, 36(3):603-610.
[4] SRIKUN N.In vitro propagation of the aromatic herb Strobilanthes tonkinensis Lindau[J].Agriculture and Natural Resources, 2017, 51(1):15-19.
[5] YU H, LI T N, RAN Q, et al.Strobilanthes cusia (Nees) Kuntze, a multifunctional traditional Chinese medicinal plant, and its herbal medicines:A comprehensive review[J].Journal of Ethnopharmacology, 2021, 265:113325.
[6] HUA J J, LI J, OUYANG W, et al.Effect of Strobilanthes tonkinensis Lindau addition on black tea flavor quality and volatile metabolite content[J].Foods, 2022, 11(12):1678.
[7] 吕金潇, 秦艳婷, 马笑宇, 等.不同配比糯香茯茶的品质分析[J].食品与发酵工业, 2025, 51(2):168-175.LYU J X, QIN Y T, MA X Y, et al.Quality analysis of different ratios of Semnostachya menglaensis Tsui Fu-brick tea[J].Food and Fermentation Industries, 2025, 51(2):168-175.
[8] 徐秀娟, 薛云, 胡军, 等.糯米香净油的制备及其热裂解产物[J].烟草科技, 2023, 56(10):70-81.XU X J, XUE Y, HU J, et al.Preparation of absolute oil from Strobilanthes tonkinensis Lindau and its pyrolysis products[J].Tobacco Science &Technology, 2023, 56(10):70-81.
[9] NAEF R, VELLUZ A, MAYENZET F, et al.Volatile constituents of Semnostachya menglaensis Tsui[J].Journal of Agricultural and Food Chemistry, 2005, 53(23):9161-9164.
[10] YIN G H, ZENG H C, HE M J, et al.Extraction of Teucrium manghuaense and evaluation of the bioactivity of its extract[J].International Journal of Molecular Sciences, 2009, 10(10):4330-4341.
[11] 李维莉, 马银海, 张亚平, 等.糯米香茶香气化合物的组分研究[J].西南大学学报(自然科学版), 2009, 31(11):53-56.LI W L, MA Y H, ZHANG Y P, et al.Study on the constituents of volatile oils of Nuomi-scented tea[J].Journal of Southwest University (Natural Science Edition), 2009, 31(11):53-56.
[12] HAN X, SONG Z Q, LIU J W, et al.Effects of different drying methods on the quality of Bletilla striata scented tea[J].Molecules, 2023, 28(6):2438.
[13] 李官丽, 吴秋月, 陈锡霞, 等.干燥方式对油茶粉品质及挥发性风味物质的影响[J].食品与机械, 2024, 40(3):210-216.LI G L, WU Q Y, CHEN X X, et al.Effects of drying methods on the quality and volatile flavor compounds of oil tea powder[J].Food &Machinery, 2024, 40(3):210-216.
[14] 金鑫, 段续, 任广跃, 等.不同干燥方式对无花果干燥特性及品质的影响[J].食品与发酵工业, 2024, 50(10):69-75.JIN X, DUAN X, REN G Y, et al.Effects of different drying methods on drying characteristics and quality of figs[J].Food and Fermentation Industries, 2024, 50(10):69-75.
[15] 赵愉涵, 袁丽雪, 王敏, 等.不同干燥方式对芹菜叶品质的影响[J].食品与发酵工业, 2022, 48(8):205-211.ZHAO Y H, YUAN L X, WANG M, et al.Effects of different drying methods on quality attributes of celery leaves[J].Food and Fermentation Industries, 2022, 48(8):205-211.
[16] JIAO Y F, TANG H Y, YAN Z, et al.Effect of different drying methods on quality of orange dark tea[J].Journal of Food Measurement and Characterization, 2024, 18(5):3244-3254.
[17] 叶秋萍, 余雯, 谢基雄, 等.不同干燥方式对茉莉花茶挥发性成分的影响[J].食品工业科技, 2024, 45(18):210-218.YE Q P, YU W, XIE J X, et al.Effects of different drying methods on volatile components of jasmine tea[J].Science and Technology of Food Industry, 2024, 45(18):210-218.
[18] 陈苏森, 吉训志, 张映萍, 等. 不同干燥方式对斑兰叶挥发性成分的影响[J]. 中国热带农业, 2024(2): 53-60.CHEN S S, JI X Z, ZHANG Y P, et al. The effect of different drying methods on the volatile components of Pandanus amaryllifolius Roxb. leaves[J]. China Tropical Agriculture, 2024(2): 53-60.
[19] 易宇文, 何莲, 邓静, 等.基于电子鼻和气质联用识别不同工艺的俄色茶[J].食品工业科技, 2023, 44(18):361-370.YI Y W, HE L, DENG J, et al.Identification of Malus toringoides(Rehd.) Hughes teas with different processes based on E-nose and GC-MS[J].Science and Technology of Food Industry, 2023, 44(18):361-370.
[20] HE C J, LI Z Y, LIU H X, et al.Characterization of the key aroma compounds in Semnostachya menglaensis Tsui by gas chromatography-olfactometry, odor activity values, aroma recombination, and omission analysis[J].Food Research International, 2020, 131:108948.
[21] 古能平. 红茶加工过程中干燥工艺对其主要挥发性物质的影响[J].食品工业, 2018, 39(10):78-81.GU N P.The effect of drying process on the main volatile substances in black tea processing[J].The Food Industry, 2018, 39(10):78-81.
[22] 周子丹, 彭文君, 倪家宝, 等.不同干燥方式对油菜蜂花粉色泽、酚酸含量和抗氧化活性的影响[J].食品科学, 2021, 42(17):76-83.ZHOU Z D, PENG W J, NI J B, et al.Effects of different drying methods on color, phenolic acids contents and antioxidant activity of rape bee pollen[J].Food Science, 2021, 42(17):76-83.
[23] YUE Y M, ZHANG Q, WAN F X, et al.Effects of different drying methods on the drying characteristics and quality of Codonopsis pilosulae slices[J].Foods, 2023, 12(6):1323.
[24] 易宇文, 刘阳, 彭毅秦, 等.东坡肘子风味电子鼻分析与感官评价相关性探究[J].食品与发酵工业, 2018, 44(1):238-244.YI Y W, LIU Y, PENG Y Q, et al.Research on the correlation between electronic nose analysis and sensory evaluation of Dongpo pork[J].Food and Fermentation Industries, 2018, 44(1):238-244.
[25] 刘红, 朱红英.基于电子鼻技术分析糯米香茶风味的研究[J].热带农业科学, 2011, 31(11):73-76.LIU H, ZHU H Y.Classification of Teucrium manghuaense by using an electronic tongue[J].Chinese Journal of Tropical Agriculture, 2011, 31(11):73-76.
[26] 朱庆珍, 随新平, 王羽桐, 等.焙烤对核桃乳关键性香气成分的影响分析[J].精细化工, 2020, 37(12):2562-2570.ZHU Q Z, SUI X P, WANG Y T, et al.Analysis of the effect of roasting on the key aroma compounds of walnut milk[J].Fine Chemicals, 2020, 37(12):2562-2570.
[27] 尹洪旭, 杨艳芹, 姚月凤, 等.基于气相色谱-质谱技术与多元统计分析对不同栗香特征绿茶判别分析[J].食品科学, 2019, 40(4):192-198.YIN H X, YANG Y Q, YAO Y F, et al.Discrimination of different characteristics of chestnut-like green tea based on gas chromatography-mass spectrometry and multivariate statistical data analysis[J].Food Science, 2019, 40(4):192-198.
[28] XU J Y, ZHANG Y, YAN F, et al.Monitoring changes in the volatile compounds of tea made from summer tea leaves by GC-IMS and HS-SPME-GC-MS[J].Foods, 2022, 12(1):146.
[29] HE C, LI Y C, ZHOU J T, et al.Study on the suitability of tea cultivars for processing oolong tea from the perspective of aroma based on olfactory sensory, electronic nose, and GC-MS data correlation analysis[J].Foods, 2022, 11(18):2880.
[30] OUYANG J, JIANG R G, CHEN H Y, et al.Characterization of key odorants in ‘Baimaocha’ black teas from different regions[J].Food Chemistry:X, 2024, 22:101303.