西藏牦牛酸奶是西藏地区藏族人民采用传统而古老的自然发酵方法制作的一种发酵乳制品,集鲜明的地域和民族特色为一体,是西藏高原传统特色发酵食品的代表[1]。西藏牦牛酸奶口感细腻柔顺、质地浓稠丝滑、风味独特、奶味浓郁,让人回味无穷。牦牛酸奶在发酵过程中会形成游离脂肪酸、氨基酸等小分子物质,并富含B族维生素、多种矿物质、乳糖、蛋白质等营养成分,而且牦牛酸奶中的微量元素(如铬、乳铁蛋白和溶菌酶)极其丰富,Ca浓度也较普通酸奶高[2]。在西藏地区强紫外线、低压缺氧、昼夜温差大的特殊气候条件下,自然发酵的牦牛酸奶中微生物以及风味成分也较为特殊,其中的微生物及代谢风味逐渐成为研究热点。由于受到地理地貌、制作方法、发酵参数、牧民生活习惯以及奶源等各种因素的影响,牦牛酸奶中微生物菌群十分复杂[3]。其中,不仅具有遗传多样性的乳酸菌,而且酵母菌的分离率也很高,乳酸菌和酵母菌优势互补、协同作用,使得诸味协调,赋予了牦牛酸奶独特的风味[4]。在西藏牦牛酸奶发酵过程中,微生物会产生有机酸(如乳酸、丁酸等)代谢产物,还会产生香气物质和活性物质等[5],这些代谢产物赋予了牦牛酸奶独特的风味和营养特点。传统发酵牦牛酸奶的微生物群主要由乳酸菌和酵母菌组成,这2类微生物间的相互作用对乳制品的发酵影响显著[6]。高通量测序技术因具有测序质量高、对微生物结构理解更全面及客观等优点,已被广泛应用于发酵乳制品中微生物多样性的测定[7]。牦牛酸奶中存在乳酸菌属、链球菌属、乳球菌属和明串珠菌属等细菌属和克鲁维酵母属、毕赤酵母属等真菌属,它们天然存在于容器、原料和周围环境中并积极参与了发酵过程[8]。挥发性风味成分来源于酸奶中蛋白质、乳糖和脂肪酸的微生物分解代谢。ZHANG等[9]通过GC-MS在酸奶中发现了56种挥发性化合物,YU等[10]使用固相微萃取(solid-phase microextraction,SPME)和气相色谱-嗅闻/气质联用(gas chromatography-olfactometry/mass spectrometry,GC-O-MS)检测发现了发酵乳中的2,3-丁二酮、1-己醇和2-戊基呋喃等24种气味活性化合物。
西藏牦牛酸奶属于自然菌群发酵乳制品,其菌群结构复杂、风味独特,还需对其优势发酵菌群以及特征挥发性风味成分深入研究。因此,为更好地了解西藏地区传统发酵牦牛酸奶的核心微生物群落结构及其在风味形成中的作用,本研究利用顶空固相微萃取-气相色谱质谱联用技术(headspace solid-phase microextraction and gas chromatography-mass spectrometry,HS-SPME-GC-MS)和Illumina MiSeq高通量测序方法,对西藏不同地区牦牛酸奶样本中的微生物群落结构以及挥发性风味成分进行了分析,并探究了其潜在相关关系,并通过功能预测解析微生物的代谢作用,以期为牦牛酸奶风味改善和品质提升提供科学依据和理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 样本
共采集西藏牧民依传统方式自然发酵的牦牛酸奶样本9个,样本信息见表1。在采样过程中,样本收集在50 mL无菌离心管中,用-20 ℃车载冰箱运回实验室后,保存于-20 ℃冰箱备用。
表1 西藏牦牛酸奶样本信息表
Table 1 Xizang yak yoghurt sample information sheet
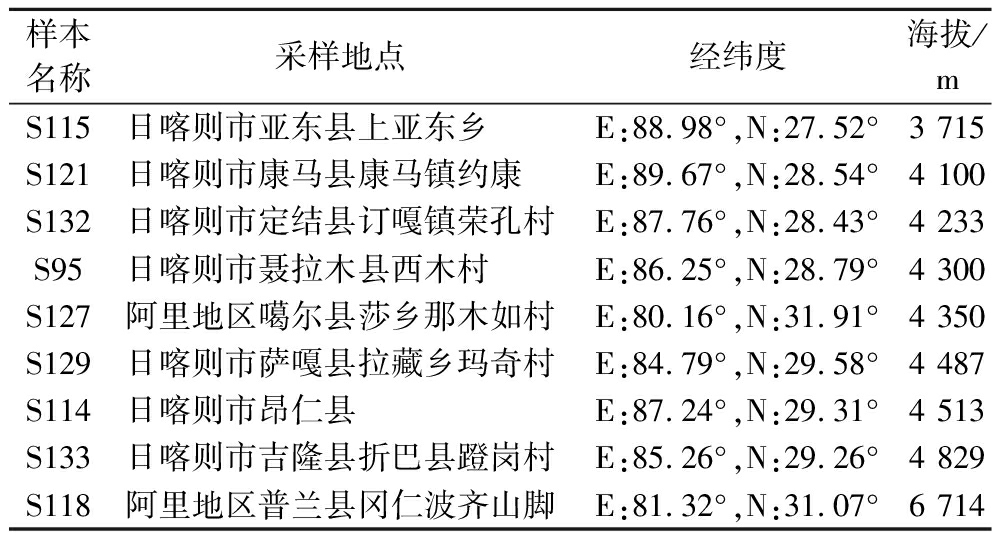
样本名称采样地点经纬度海拔/mS115日喀则市亚东县上亚东乡E:88.98°,N:27.52°3 715S121日喀则市康马县康马镇约康E:89.67°,N:28.54°4 100S132日喀则市定结县订嘎镇荣孔村E:87.76°,N:28.43°4 233S95日喀则市聂拉木县西木村E:86.25°,N:28.79°4 300S127阿里地区噶尔县莎乡那木如村E:80.16°,N:31.91°4 350S129日喀则市萨嘎县拉藏乡玛奇村E:84.79°,N:29.58°4 487S114日喀则市昂仁县E:87.24°,N:29.31°4 513S133日喀则市吉隆县折巴县蹬岗村E:85.26°,N:29.26°4 829S118阿里地区普兰县冈仁波齐山脚E:81.32°,N:31.07°6 714
1.1.2 试剂
实验所用的标准品(纯度>95%),美国Sigma-Aldrich公司;E.Z.N.A.®Soil DNA kit,美国OMEGA公司;琼脂糖,西班牙 BIOWESTE 公司;DNA 凝胶回收试剂盒,南京诺唯赞生物科技股份有限公司;PCR 所用试剂,大连 TaKaRa公司;细菌基因组DNA提取试剂盒,天根生化科技有限公司。
1.1.3 仪器
E-WAX ETR色谱柱(30 m×0.25 mm,0.50 μm),美国 PerkinElmer公司;HGC-12A型氮吹仪,武汉爱斯佩科学仪器有限公司;5977B型气相色谱-质谱联用仪,美国Agilent公司;MiSeq PE300高通量测序仪,美国 Illumina 公司;2-16N型高速微量离心机,湖南恒诺仪器设备有限公司;T20型 PCR 仪,杭州朗基科学仪器有限公司;Tanon 1600型凝胶成像系统,上海天能科技公司;1300 SERIES A2型超净工作台,美国 Thermo 公司。
1.2 实验方法
1.2.1 挥发性风味成分测定
1.2.1.1 固相微萃取
参考胡海敏等[11]的方法略有修改。准确称取酸奶样本3.50 g、NaCl 2 g、超纯水3.5 mL置于20 mL顶空瓶中进行固相微萃取,添加15 μL 0.040 9 mg/mL 的2-辛醇作为内标,55 ℃萃取45 min,250 ℃解析2 min。
1.2.1.2 GC-MS分析
GC条件:柱箱温度40 ℃保持2 min,以3 ℃/min的速率升至180 ℃,再以6 ℃/min的速率升至240 ℃保持5 min。进样口温度为250 ℃,载气(高纯氦气)流速1.5 mL/min。MS条件:EI源电离,离子源温度220 ℃,70 eV电子能量,质量扫描,扫描方式为全扫描。
1.2.1.3 GC-MS数据分析
定性分析:在NIST20数据库中,通过对各色谱峰的保留时间进行匹配,选择匹配度>85的化合物为有效风味物质物质。定量分析:各物质峰面积比等于物质浓度比。采用半定量的方法,选择各化合物的保留峰面积,再对比2-辛醇的出峰面积计算各化合物的相对浓度,取2次平行试样平均值[12]。
1.2.2 DNA提取、PCR扩增及高通量测序
参照试剂盒说明进行样本DNA提取。提取成功后用1%的琼脂糖凝胶电泳检测DNA的提取质量并测定其浓度和纯度。PCR扩增体系:10×PCR buffer(Mg2+plus)2.5 μL,dNTP Mixture 2.0 μL,上游引物1.0 μL,下游引物1.0 μL,DNA模板1.0 μL,rTaq DNA聚合酶(5 U/μL)0.3 μL,ddH2O补足至25 μL。
细菌16S rRNA基因V3~V4可变区:上游引物27F:5′-AGAGTTTGATCMTGGCTCAG-3′,下游引物1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR扩增条件:95 ℃预变性3 min,35个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,72 ℃稳定延伸10 min,最后4 ℃保存。真菌ITS区域的通用引物为ITS1F。上游引物:ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′),下游引物:ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)。PCR扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,扩增30个循环;72 ℃再延伸10 min,4 ℃保存。PCR产物用2%琼脂糖凝胶电泳检测,将符合要求的PCR产物切胶回收后进行纯化,经文库构建后寄至上海美吉生物医药科技有限公司通过Illumina MiSeqPE300平台进行高通量测序[13]。
在美吉生物公司的云平台上进行数据处理,使用Trimmomatic软件对原始序列进行质控与过滤,舍去质量较低的序列。以相似性97%对各样本有效数据进行操作单元(operational taxonomic units,OTU)划分,基于生成的OTU表格进行微生物群落多样性分析,利用PICRUSt2软件进行微生物功能预测[14-15]。
1.3 数据统计分析
利用SPSS 26、Origin 2021对所有数据进行整理和作图分析,Cytoscape 3.10.2对微生物与挥发性风味数据的相关性进行可视化分析。
2 结果与分析
2.1 西藏牦牛酸奶挥发性风味成分分析
9个牦牛酸奶样本中挥发性风味成分检测结果见表2,牦牛酸奶中挥发性风味成分种类复杂。在样本中共检测出37种主要的挥发性风味成分,其中酯类13种、挥发性脂肪酸10种、醇类7种、酮类3种、醛类2种、其他化合物2种。牦牛酸奶中的酯类化合物以乙酯类居多,其中相对含量较高的有辛酸乙酯、己酸乙酯、L-乳酸乙酯、癸酸乙酯和乙酸苯乙酯,乙基酯通常可以赋予酸奶水果味和奶油香味。辛酸乙酯、庚酸乙酯、丁酸乙酯是常见的中碳链和短碳链脂肪酸乙酯,具有较低的阈值,通常具有水果香和乳脂香等令人愉快的气味,可中和过量酸性引起的刺激味,同时还能让酸奶的口味变得柔和,整体口味也更均衡[16]。研究表明,酯类物质的形成与发酵牦牛酸奶的菌群结构密切相关,不同菌群对风味物质生成的贡献差异显著,且特定真菌群落也会对酯类物质的积累产生影响[17]。
表2 西藏牦牛酸奶挥发性风味成分 单位:μg/kg Table 2 Volatile flavour components of Xizang yak yoghurt
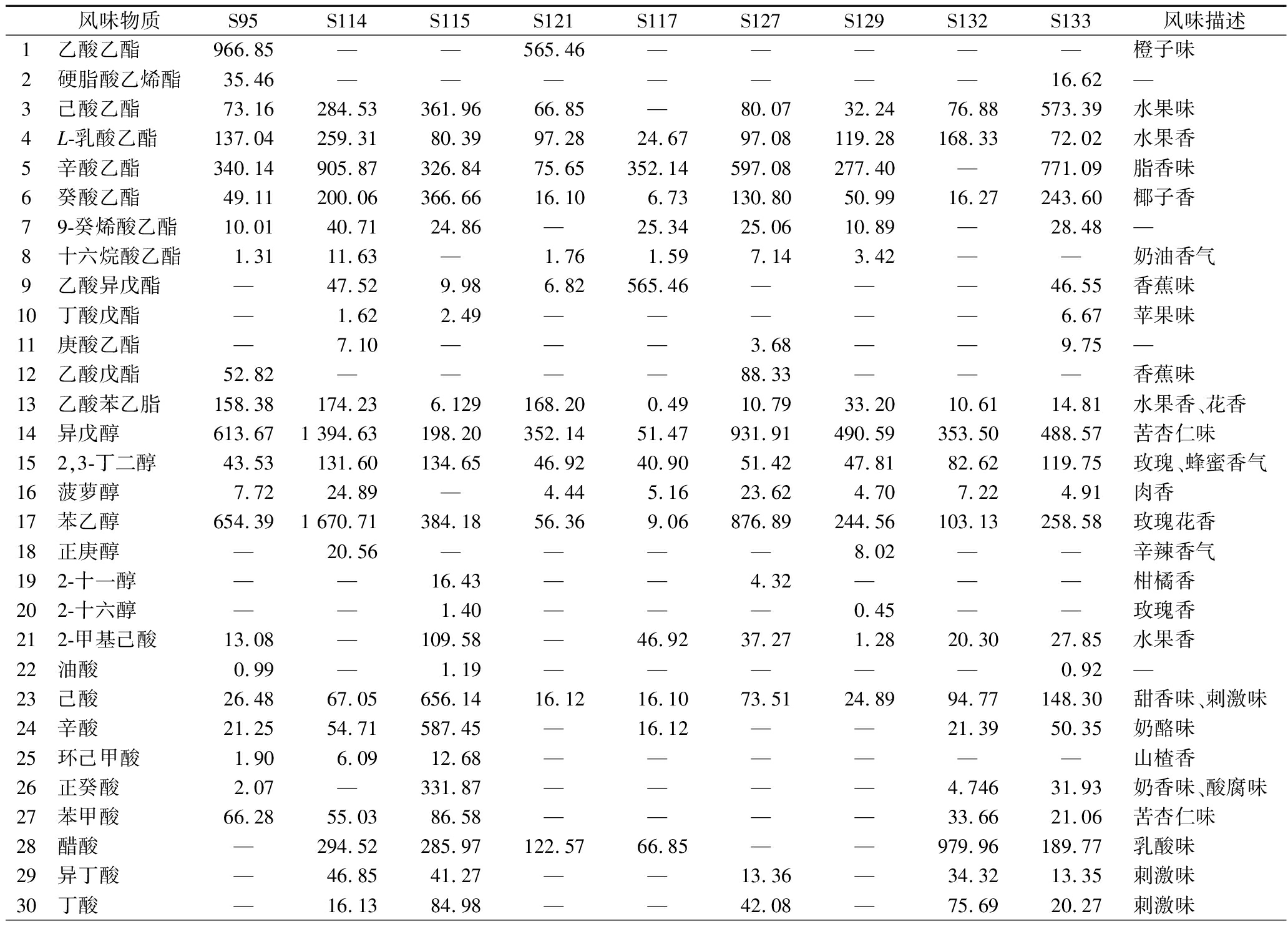
风味物质S95S114S115S121S117S127S129S132S133风味描述1乙酸乙酯966.85— — 565.46— — — — — 橙子味2硬脂酸乙烯酯35.46— — — — — — — 16.62— 3己酸乙酯73.16284.53361.9666.85— 80.0732.2476.88573.39水果味4L-乳酸乙酯137.04259.3180.3997.2824.6797.08119.28168.3372.02水果香5辛酸乙酯340.14905.87326.8475.65352.14597.08277.40— 771.09脂香味6癸酸乙酯49.11200.06366.6616.106.73130.8050.9916.27243.60椰子香79-癸烯酸乙酯10.0140.7124.86— 25.3425.0610.89— 28.48— 8十六烷酸乙酯1.3111.63— 1.761.597.143.42— — 奶油香气9乙酸异戊酯— 47.529.986.82565.46— — — 46.55香蕉味10丁酸戊酯— 1.622.49— — — — — 6.67苹果味11庚酸乙酯— 7.10— — — 3.68— — 9.75— 12乙酸戊酯52.82— — — — 88.33— — — 香蕉味13乙酸苯乙脂158.38174.236.129168.200.4910.7933.2010.6114.81水果香、花香14异戊醇613.671 394.63198.20352.1451.47931.91490.59353.50488.57苦杏仁味152,3-丁二醇43.53131.60134.6546.9240.9051.4247.8182.62119.75玫瑰、蜂蜜香气16菠萝醇7.7224.89— 4.445.1623.624.707.224.91肉香17苯乙醇654.391 670.71384.1856.369.06876.89244.56103.13258.58玫瑰花香18正庚醇— 20.56— — — — 8.02— — 辛辣香气192-十一醇— — 16.43— — 4.32— — — 柑橘香202-十六醇— — 1.40— — — 0.45— — 玫瑰香212-甲基己酸13.08— 109.58— 46.9237.271.2820.3027.85水果香22油酸0.99— 1.19— — — — — 0.92— 23己酸26.4867.05656.1416.1216.1073.5124.8994.77148.30甜香味、刺激味24辛酸21.2554.71587.45— 16.12— — 21.3950.35奶酪味25环己甲酸1.906.0912.68— — — — — — 山楂香26正癸酸2.07— 331.87— — — — 4.74631.93奶香味、酸腐味27苯甲酸66.2855.0386.58— — — — 33.6621.06苦杏仁味28醋酸— 294.52285.97122.5766.85— — 979.96189.77乳酸味29异丁酸— 46.8541.27— — 13.36— 34.3213.35刺激味30丁酸— 16.1384.98— — 42.08— 75.6920.27刺激味
续表2
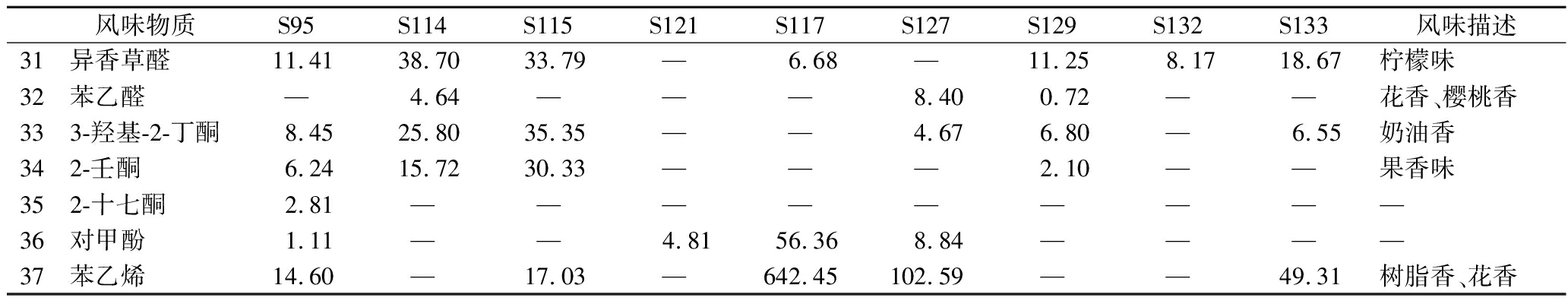
风味物质S95S114S115S121S117S127S129S132S133风味描述31异香草醛11.4138.7033.79— 6.68— 11.258.1718.67柠檬味32苯乙醛— 4.64— — — 8.400.72— — 花香、樱桃香333-羟基-2-丁酮8.4525.8035.35— — 4.676.80— 6.55奶油香342-壬酮6.2415.7230.33— — — 2.10— — 果香味352-十七酮2.81— — — — — — — — — 36对甲酚1.11— — 4.8156.368.84— — — — 37苯乙烯14.60— 17.03— 642.45102.59— — 49.31树脂香、花香
注:“—”表示未检出。
挥发性脂肪酸主要通过牦牛酸奶发酵菌群的脂肪酸代谢产生,并可通过进一步的生化代谢合成甲基酮、酯类等风味化合物,对酸奶风味具有较大贡献[18]。牦牛酸奶样本中检测到的挥发性脂肪酸的种类较多,含量较高,其中己酸、辛酸、异丁酸、2-甲基己酸、醋酸为酸奶中主要酸类物质,S132组的挥发性脂肪酸含量明显高于其他组。辛酸赋予酸奶奶香气味,其含量越高对奶香味的贡献越大[19]。
醇类是酸奶中必不可少的风味物质,由乳糖和氨基酸等代谢途径产生,具有花香、油脂香等香气,但因其阈值较高,对酸奶的作用有限,主要起修饰作用[20]。不同样本中含量较高且共有的醇类物质有异戊醇、2,3-丁二醇、苯乙醇,正庚醇是S114组样本中特有的醇类物质。
酮类物质是乳制品中重要的风味化合物[21],3-羟基-2-丁酮是发酵乳制品中独特的风味物质,在S95、S114、S115、S127、S129、S133组样本中均有检出,在其他组样本中检出的酮类物质还有2-壬酮、2-十七酮。2-壬酮具有奶香味,S115组样本中2-壬酮含量明显高于其他组样本。除上述几类含量较高的风味化合物之外,还检测出异香草醛、苯乙醛等醛类物质和苯乙烯等烯类物质,对酸奶风味提升具有重要作用[22]。
2.2 风味物质聚类分析
基于每个样品中挥发性风味物质相对含量的聚类热图(图1)所示,挥发性脂肪酸类和酮类等物质聚为一大类,酯类和酚类等其他物质聚为另一类。在S114组样本中,苯乙醇、2,3丁二醇、L-乳酸乙酯等醇类物质含量较高,是该样本中的特征挥发性风味物质,通常表现出水果香气。辛酸乙酯、癸酸乙酯、己酸等挥发性脂肪酸类是S115组样本中的特征挥发性化合物,以上物质可能会形成该样本中浓郁的酸味与脂肪气味。乙酸戊酯、苯乙醛、菠萝醇是S127组样本中特征挥发性化合物,除上述物质外其他样本中检测到少量醛类和酚类物质,可能与青草香有一定关系[23]。在S133组样本中,2,3-丁二醇、丁酸戊酯、微生物菌群与牦牛酸奶风味形成紧密相关,乳酸菌和酵母菌发酵产生的酶通过生化反应将原料转化为酮类、醇类、酯类等风味物质,从而直接作用于牦牛酸奶风味轮廓的塑造[24]。
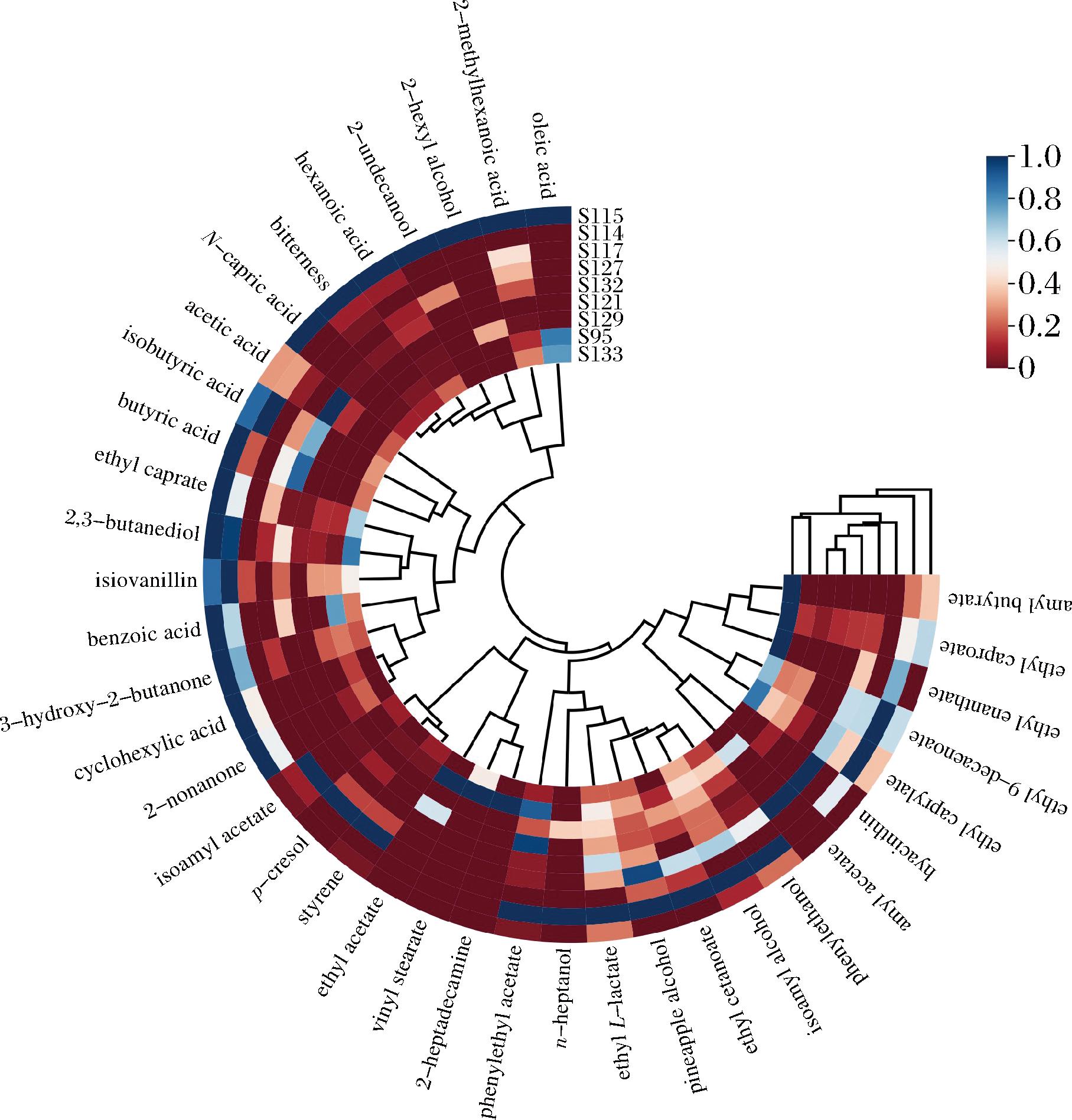
图1 西藏牦牛酸奶风味物质热图
Fig.1 Thermogram of Xizang yak yogurt flavor substances
2.3 牦牛酸奶中微生物多样性分析
2.3.1 α多样性分析
为了分析不同样本中微生物群落的α多样性,采用Shannon指数来反映微生物的丰富度和均匀度。细菌多样性如图2-a所示,S132组的样本有较高的Shannon指数,表示该组样本的微生物多样性均较高,所含微生物种类多于其他样本;S95组Shannon指数最低,表明在该样本中某种微生物占据很大优势,其他微生物占比较低;其余各样本Shannon指数差异较小。真菌多样性如图2-b所示,S95组、S121组、S117组样本的Shannon指数较大,其中S95组最大,表明该样本中真菌群落结构复杂,微生物多样性较高;S115的Shannon指数最小,只有0.01,表明该样本的真菌群落结构极为简单,某种真菌占有绝对性优势。使用基于Bray-Curtis距离算法的主坐标分析(principal co-ordinates analysis, PCoA)不同样本之间细菌和真菌的β多样性,如图2-c所示,S95、S114、S115组样品在第一象限,距离结构较近,表明这几组样本的细菌群落结构相似度较高。S121、S132组样本在第四象限,表明与其他样本中的细菌群落结构存在较大差异。如图2-d所示,S115、S132、S133组样本在第一象限,表明这几组样本的真菌群落相似度较高,S117、S127组样本与其他几组样本距离较远,菌群差异性较大。综上所述,各样本的Alpha多样性指数有所差异,西藏各地区的牦牛酸奶微生物多样性有所不同。
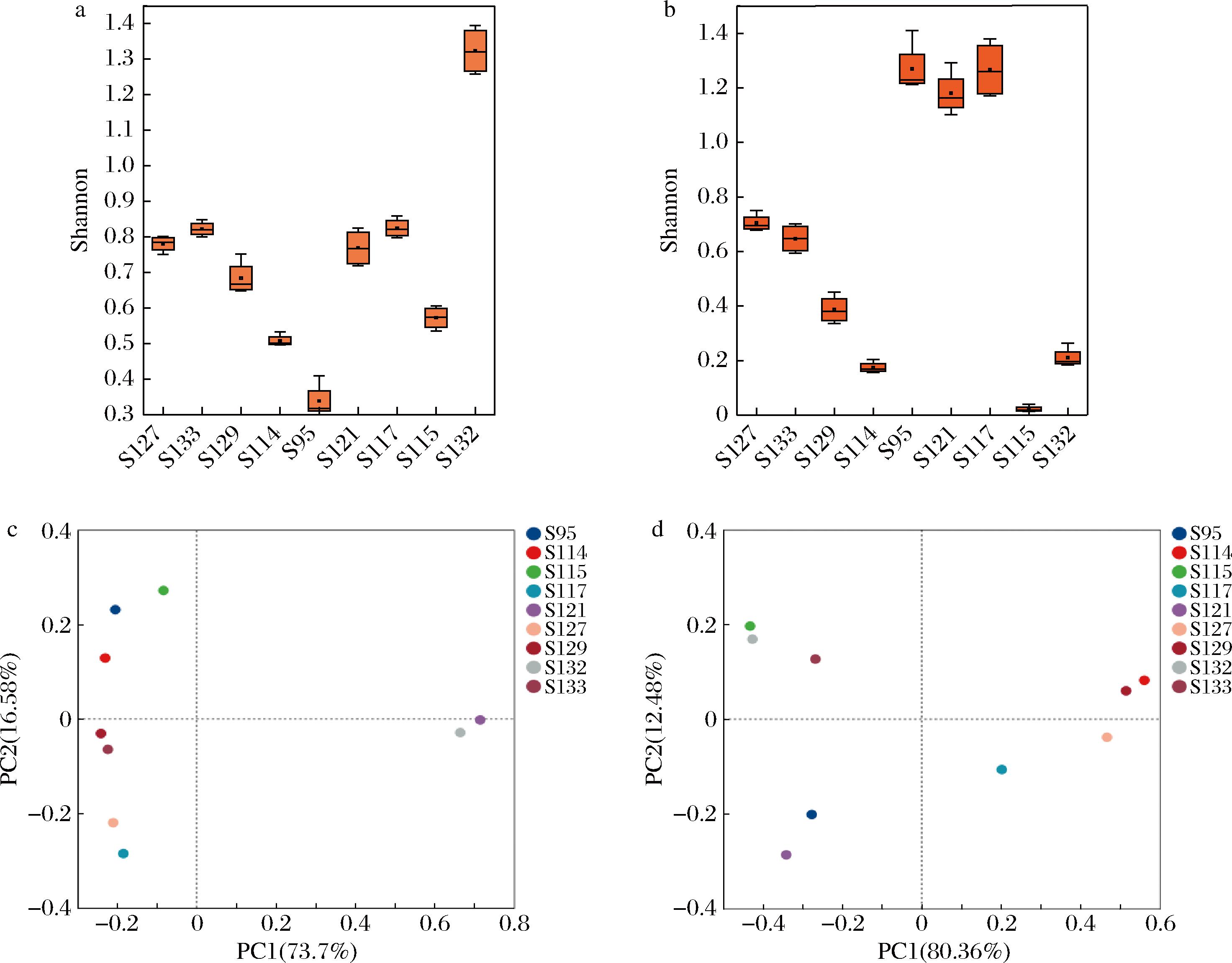
a-细菌Shannon指数;b-真菌Shannon指数;c-细菌PCoA;d-真菌PCoA
图2 不同样本的Alpha多样性分析
Fig.2 Alpha variation analysis of samples
2.3.2 属水平菌群结构分析
在细菌属水平上(图3-a),相对丰度较高的菌属为乳杆菌属(Lactobacillus)、链球菌属(Streptococcus)、肠球菌属(Enterococcus)、乳球菌属(Lactococcus)、醋杆菌属(Acetobacter)、明串珠菌属(Leuconostoc)。牦牛酸奶的优势细菌属为乳杆菌属(Lactobacillus),平均相对丰度42.19%,其次为链球菌属(Streptococcus),平均相对丰度23.41%,2个细菌属总计占整个酸奶样本的65.60%。Lactobacillus和Streptococcus通常与天然发酵乳制品相关,在其生产和发酵过程中发挥重要作用。据报道,乳杆菌比链球菌和乳球菌表现出更高的耐酸性,在牦牛酸奶发酵过程中,随着酸度的增加,一部分乳杆菌被保留和富集,导致其在细菌种类中占据优势地位[25]。Lactobacillus可产生α-半乳糖苷酶,对酸奶发酵过程中风味形成相关碳水化合物的代谢起重要作用,从而对酸奶风味有很大影响[26]。其余肠球菌属(Enterococcus)、乳球菌属(Lactococcus)的相对丰度分别在S115组和S132组样本中所占比例较高,均在55%以上。稳定的微生物菌群是保障牦牛酸奶发酵品质和安全的基础,乳酸杆菌、乳球菌及链球菌为天然发酵乳中的核心微生物群,乳球菌、明串珠菌等通过消耗乳糖、氨基酸和碳水化合物等,可促进发酵乳制品的凝乳和营养及风味的形成[27]。
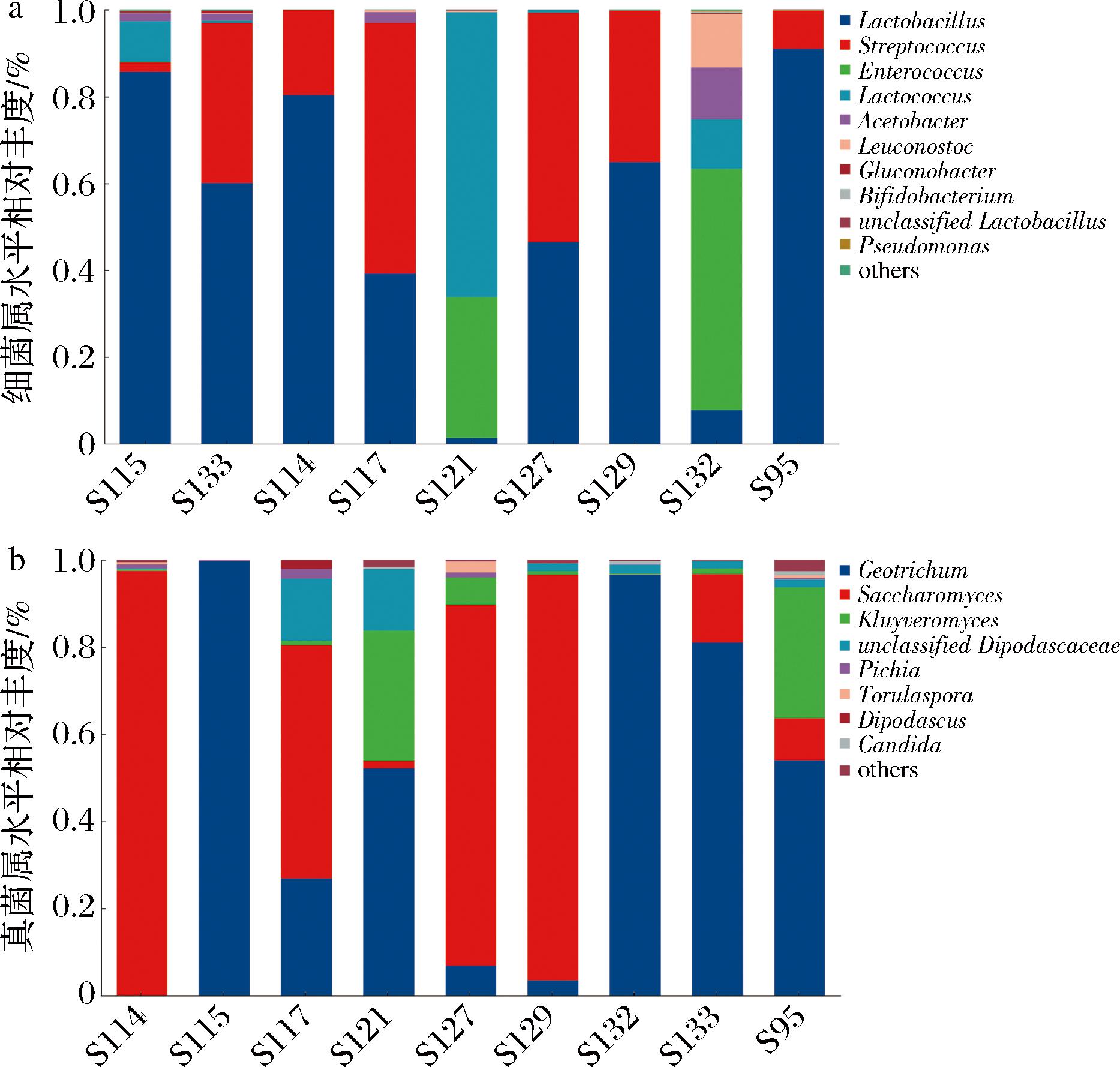
a-细菌属水平群落结构;b-真菌属水平群落结构
图3 牦牛酸奶样本属水平相对丰度柱状图
Fig.3 Histogram of relative abundance at genus level for yak yogurt samples
在真菌属水平上(图3-b),所有样本共检出21个相对丰度大于1%的菌属,相对丰度较高的菌属有地霉属(Geotrichum)、克鲁维酵母属(Kluyveromyces)、毕赤酵母属(Pichia)、孢圆酵母属(Torulaspora)等。地霉属(Geotrichum)为样本的优势菌属,平均相对丰度为52.59%。其次为酵母菌属(Saccharomyces),相对丰度为50.58%,地霉属存在于牛乳制品中,如生产干酪时需要依靠霉菌。在S114组、S117组、S121组样本中,克鲁维酵母属(Kluyveromyces)也有较高的丰度,其他真菌属种类及含量存在一定差异。脂肪酸可在酵母的酶促作用下发生酯化反应从而得到酯类物质,可以与乳酸菌共同分解蛋白质产生大量的氨基酸等,克鲁维酵母对酸奶的风味形成也起到了积极作用[28]。S127组、S129组中优势菌属为酵母菌属(Saccharomyces),克鲁维酵母属(Kluyveromyces)、孢圆酵母属(Torulaspora)。所有样本的真菌群落结构各不相同,即使是同一地区的样本间差异性也较大,证明西藏酸奶有丰富的真菌多样性。
2.4 西藏牦牛酸奶微生物与挥发性风味相关性分析
为探究西藏牦牛酸奶中微生物与挥发性风味的关系,找出对风味物质有影响的关键微生物,对优势微生物和挥发性风味成分数据进行相关性分析如图4所示。红色代表正相关,蓝色代表负相关,网格颜色越深代表相关性越强;1~24代表不同类型的挥发性风味物质,微生物与挥发性风味间的实线越粗表示相关性越强,虚线表示二者相关性越弱,结果表明优势微生物与20多种挥发性风味成分存在较强的正相关性。细菌属与挥发性风味的相关性如图4-a所示,与牦牛酸奶风味物质相关性较高的细菌菌属是Lactobacillus、Streptococcus,其中Lactobacillus与9-癸烯酸乙酯、正癸酸、苯甲酸、异香草醛、3-羟基-2-丁酮、2-壬酮等挥发性风味成分存在较强的正相关,表明对牦牛酸奶中香气的形成具有较大贡献,与己酸乙酯、L-乳酸乙酯、异戊醇呈负相关,于佳琦[29]通过对酸马奶发酵过程中微生物群落结构与风味物质的相关性研究分析,也发现Lactobacillus对酸马奶风味物质的形成具有很大贡献。Streptococcus与乙酸异戊酯、苯乙烯存在较强的正相关性,与己酸乙酯、癸酸乙酯、2,3-丁二醇存在负相关性。真菌属与挥发性风味的相关性如图4-b所示,与牦牛酸奶风味物质相关性较高的真菌菌属是Geotrichum、Pichia,其中Geotrichum与己酸、辛酸、正癸酸、异丁酸等酸类物质呈较强的正相关,与乙酸乙酯、乙酸苯乙酯、苯乙烯等物质存在负相关,这与高代微等[30]研究的Geotrichum可以有效改善奶酪风味和口感,对奶酪香味的形成起主要作用的结果相似。Pichia与乙酸异戊酯、异戊醇、苯乙烯呈正相关,与大部分酯类和酸类物质呈负相关,与卢灏泽等[16]研究的Pichia是与西藏牦牛奶酪中风味物质相关性较高的真菌菌属结果一致。微生物与挥发性风味物质相关性分析结果表明,这些存在正相关性的菌属可能对西藏牦牛酸奶的挥发性风味物质产生重要影响,最终影响牦牛酸奶的口感与品质。

1-乙酸乙酯;2-己酸乙酯;3-L-乳酸乙酯;4-辛酸乙酯;5-癸酸乙酯;6-9-癸烯酸乙酯;7-乙酸异戊酯;8-乙酸苯乙脂;9-异戊醇;10-2,3-丁二醇;11-菠萝醇;12-苯乙醇;13-2-甲基己酸;14-己酸;15-辛酸;16-正癸酸;17-苯甲酸;18-醋酸;19-异丁酸;20-丁酸;21-异香草醛;22-3-羟基-2-丁酮;23-2-壬酮;24-苯乙烯。a-细菌属与挥发性风味相关性;b-真菌属与挥发性风味相关性
图4 微生物与挥发性风味物质相关性网络图
Fig.4 Correlation network diagram of microorganisms and aroma substances
2.5 功能预测分析
牦牛酸奶的风味和品质受到不同代谢物质的共同调控,还需要对细菌属的代谢功能进行分析。利用PICRUSt2软件对平均相对丰度>1%的 KEGG代谢途径进行分类,如图5-a所示,牦牛酸奶中细菌属主要参与新陈代谢58.52%(metabolism)、环境信息处理18.70%(environmental information processing)、遗传信息处理17.75%(genetic information processing)、人类疾病2.15%(human diseases)四大一级代谢途径。初步分析结果显示,共富集到17条属于以上4大类且相对丰度>0.1%的二级代谢途径,这些功能为微生物群落的稳定性提供了一定保障。碳水化合物代谢(carbohydrate metabolism)和膜转运(membrane transport)等代谢途径表明,在酸奶发酵过程中微生物群落代谢活跃,并具有与周围资源环境交换的能力。氨基酸代谢(amino acid metabolism)、能量代谢(energy metabolism)、翻译(translation)、复制和修复(replication and repair)等功能可促进微生物群落中细胞的繁殖、生长和死亡。在牦牛酸奶发酵过程中,微生物的富集和扩增导致菌群结构的密度和活性较高,这些微生物的生长、增殖和遗传稳定性由DNA的复制、重组、修复和转录决定,最终导致大量相关功能基因的存在。为进一步了解牦牛酸奶中与细菌属相关的潜在功能,研究了细菌属与二级代谢功能的相关性(图5-b),其中Streptococcus与萜类化合物和多酮类化合物代谢、翻译、膜运输等8种代谢功能存在显著的正相关性,Acetobacter与信号传导、膜的转录、复制和修复等代谢功能存在正相关性,在牦牛酸奶菌群代谢途径中占绝对优势地位[31]。Lactobacillus与次级代谢物的合成、能量运输等途径存在负相关性,LI等[25]研究发现,Lactobacillus和Streptococcus与多条KEGG通路显著相关并参与谷氨酸等不同化合物的代谢,强调了其在风味形成中的重要性。本研究中与代谢产物存在相关性较显著的Lactobacillus和Streptococcus属于同质发酵,使用EMP途径产生乳酸作为主要副产物,这种途径的代谢副产物包括多种醛类和醇类等风味化合物[32]。牦牛酸奶中菌群结构的多样性促进了其优势微生物与风味物质的生成[33-34]。

a-PICRUSt2 预测随时间变化的微生物潜在功能;b-细菌属与代谢的相关性分析
图5 PICRUSt2预测牦牛酸奶微生物功能和细菌属与代谢相关性分析
Fig.5 PICRUSt2 for predicting yak yoghurt functionality of microbial and correlative analyses of bacterial genera with the metabolism pathway
3 结论
牦牛酸奶发酵是一个高度复杂的微生态系统,由于受多种因素的影响,微生物群落组成及发酵代谢产物也有较大的差异。本研究以西藏不同地区牦牛酸奶样本为对象,通过HS-SPME-GC-MS、高通量测序技术对其挥发性风味成分和微生物多样性及代谢功能进行了检测和分析。结果显示,共检测到37种风味物质,其中己酸乙酯、L-乳酸乙酯、辛酸乙酯、癸酸乙酯、乙酸苯乙脂是主要酯类物质,异戊醇、2,3-丁二醇、苯乙醇、菠萝醇是主要醇类物质,乙酸、辛酸、2-甲基己酸的相对含量也较高,还有少量异香草醛、3-羟基-2-丁酮和苯乙烯等化合物。微生物菌群结构分析表明,牦牛酸奶中优势细菌菌属为乳杆菌属、链球菌属、肠球菌属、乳球菌属、明串珠菌属等,优势真菌菌属为地霉属、克鲁维酵母属、毕赤酵母属、孢圆酵母属等。通过微生物与挥发性风味成分间的Pearson相关系数可见,乳杆菌属、链球菌属是与挥发性风味成分相关性较高的细菌菌属,地霉属、毕赤酵母属是与挥发性风味成分相关性较高的真菌菌属,可能对西藏牦牛酸奶风味的形成做出了很大的贡献。通过PICRUSt2预测牦牛酸奶微生物群落的潜在功能及其与微生物之间的联系,Lactobacillus、Streptococcus、Acetobacter与代谢途径存在很大相关性,研究结果为更好地调控西藏牦牛酸奶产品的品质提供了一定的理论基础。
[1] 周雨, 文华英.青藏高原地区牦牛酸奶的研究现状[J].中国乳品工业, 2019, 47(10):34-36.ZHOU Y, WEN H Y.Research status of yak yoghurt in Qinghai-Tibetan Plateau[J].China Dairy Industry, 2019, 47(10):34-36.
[2] 李双娇, 代安娜, 王慧, 等.牦牛酸奶营养价值与健康功能的研究进展[J].中国奶牛, 2021(6):47-50.LI S J, DAI A N, WANG H, et al.Research progress on the nutritional value and health function of yak yogurt[J].China Dairy Cattle, 2021(6):47-50.
[3] 南志强. 西藏自然发酵牛乳的微生物区系分析[J].安徽农学通报, 2019, 25(17):26-27;121.NAN Z Q.Microflora analysis of natural fermented milk in Tibet[J].Anhui Agricultural Science Bulletin, 2019, 25(17):26-27;121.
[4] JIANG Y, LI N, WANG Q, et al.Microbial diversity and volatile profile of traditional fermented yak milk[J].Journal of Dairy Science, 2020, 103(1):87-97.
[5] HUANG Z P, HABIB A, DING X M, et al.Physiochemical and microbial analysis of Tibetan yak milk yogurt in comparison to locally available yogurt[J].Molecules, 2023, 28(13):5242.
[6] 刘文俊, 张和平.发酵乳中的主要风味物质及其代谢合成途径和关键功能基因[J].中国科技论文, 2016, 11(12):1391-1397.LIU W J, ZHANG H P.Production and metabolic pathways of key flavor compounds in fermented milk as well as functional genes[J].China Sciencepaper, 2016, 11(12):1391-1397.
[7] 刘怡萱, 许国琪, 曹鹏熙, 等.基于16S rRNA高通量测序的西藏农、牧区牦牛酸奶菌群多样性分析[J].食品科学, 2020, 41(18):92-97.LIU Y X, XU G Q, CAO P X, et al.Microbial diversity of yak yogurt in agricultural and pastoral areas of Tibet analyzed based on high-throughput 16S rRNA gene sequencing[J].Food Science, 2020, 41(18):92-97.
[8] LIU W J, XI X X, SUDU Q, et al.High-throughput sequencing reveals microbial community diversity of Tibetan naturally fermented yak milk[J].Annals of Microbiology, 2015, 65(3):1741-1751.
[9] ZHANG L, MI S, LIU R B, et al.Evaluation of volatile compounds during the fermentation process of yogurts by Streptococcus thermophilus based on odor activity value and heat map analysis[J].International Journal of Analytical Chemistry, 2020, 2020(1):3242854.
[10] YU M G, WANG B S, WANG Y, et al.Odor profile characterization and variety identification of brown Lactobacillus beverage based on untargeted metabolomics[J].Journal of Food Composition and Analysis, 2023, 120:105293.
[11] 胡海敏, 田佳乐, 孙思霖, 等.固相微萃取-气相色谱-质谱结合电子鼻技术分析发酵乳中挥发性风味物质[J].微生物学通报, 2023, 50(1):273-288.HU H M, TIAN J L, SUN S L, et al.Analysis of volatile flavor compounds in fermented milk by solid phase microextraction-gas chromatography-mass spectrometry and electronic nose[J].Microbiology China, 2023, 50(1):273-288.
[12] 薛蓓, 卢灏泽, 杨帆, 等.高通量测序技术分析西藏不同海拔地区曲拉微生物多样性[J].食品科学, 2022, 43(14):176-182.XUE B, LU H Z, YANG F, et al.High-throughput sequencing technology to analyze microbial community diversity in qula at different altitudes in Tibet[J].Food Science, 2022, 43(14):176-182.
[13] WU S F, YANG X L, GAO H N, et al.Research on bacterial community characteristics of traditional fermented yak milk in the Tibetan Plateau based on high-throughput sequencing[J].PeerJ, 2023, 11:e14733.
[14] YANG G W, ZHANG J X, DAI R F, et al.Comparative study on nutritional characteristics and volatile flavor substances of yak milk in different regions of Gannan[J].Foods, 2023, 12(11):2172.
[15] 李孟珍. 常见市售发酵乳挥发性风味物质代谢指纹图谱分析及其品质评价[D].呼和浩特:内蒙古农业大学,2022.LI M Z.Metabolic fingerprint analysis and quality evaluation of volatile flavor substances in common fermented milk[D].Hohhot:Inner Mongolia Agricultural University, 2022.
[16] 卢灏泽, 吕嘉伟, 杨帆, 等.西藏牦牛奶酪的微生物群落结构与风味物质分析[J].食品与发酵工业, 2023, 49(6):179-186.LU H Z, LYU J W, YANG F, et al.Microbial community structure and flavor analysis of Tibetan yak cheese[J].Food and Fermentation Industries, 2023, 49(6):179-186.
[17] 高薇. 西藏开菲尔粒乳间菌群结构差异及乳中关键风味物质解析[D].哈尔滨:哈尔滨工业大学,2021.GAO W.Difference of flora structure between kefir grains and milk in Tibet and analysis of key flavor substances in milk[D].Harbin:Harbin Institute of Technology, 2021.
[18] MOISEENKO K V, SHABAEV A V, GLAZUNOVA O A, et al.Changes in fatty acid profiles and the formation of volatile organic compounds during fermentation of cow’s milk with probiotic Lacticaseibacillus paracasei strains[J].Applied Biochemistry and Microbiology, 2023, 59(5):636-645.
[19] PAN D D, WU Z, PENG T, et al.Volatile organic compounds profile during milk fermentation by Lactobacillus pentosus and correlations between volatiles flavor and carbohydrate metabolism[J].Journal of Dairy Science, 2014, 97(2):624-631.
[20] WALSH A M, CRISPIE F, KILCAWLEY K, et al.Microbial succession and flavor production in the fermented dairy beverage kefir[J].mSystems, 2016, 1(5):e00052-16.
[21] 葛武鹏, 李元瑞, 陈瑛, 等.牛羊奶酸奶挥发性风味物质固相微萃取GC/MS分析[J].农业机械学报, 2008, 39(11):64-69;75.GE W P, LI Y R, CHEN Y, et al.Analysis of volatile aromatic compounds from cow’s and goat’s milk yoghurt by SPME-GC/MS[J].Transactions of the Chinese Society for Agricultural Machinery, 2008, 39(11):64-69;75.
[22] FANG X, GUO L W, CHEN H, et al.Characteristics of volatile flavor components in traditional fermented yak milk produced in different ecoregions of the Qinghai-Tibetan Plateau[J].Journal of Dairy Science, 2020, 103(1):191-200.
[23] 梁晓琳, 张哲川, 王宇豪, 等.传统发酵牦牛乳制品中微生物群落及其与代谢产物相关性[J].食品科学, 2024, 45(9):84-92.LIANG X L, ZHANG Z C, WANG Y H, et al.Microbial community structure and correlation with metabolites in traditional fermented yak milk products[J].Food Science, 2024, 45(9):84-92.
[24] WANG J D, FENG Z R, YANG Q L, et al.The correlation between the succession of microflora and volatile flavor compounds in kefir vegetable juice fermentation[J].Food Bioscience, 2024, 57:103477.
[25] LI H Q, YANG X L, TANG D F, et al.Exploring the link between microbial community structure and flavour compounds of traditional fermented yak milk in Gannan region[J].Food Chemistry, 2024, 435:137553.
[26] TANG Y, YU M G, LIU C, et al.Sensory-directed characterization of key odor-active compounds in fermented milk[J].Journal of Food Composition and Analysis, 2024, 126:105904.
[27] 仝静雯. 传统发酵食品中优良可食用乳酸菌的筛选及其在发酵乳中的应用研究[D].杭州:浙江工商大学,2023.TONG J W.Screening of excellent edible lactic acid bacteria from traditional fermented foods and its application in fermented milk [D].Hangzhou:Zhejiang Gongshang University, 2023.
[28] XUE B, LI G, XUN X J, et al.Multi-omics revealed the formation mechanism of characteristic volatiles in Tibetan yak cheese induced by different altitudes[J].Food Chemistry, 2024, 21:101120.
[29] 于佳琦. 酸马奶发酵过程中微生物群落结构与风味物质的相关性研究[D].呼和浩特:内蒙古农业大学,2021.YU J Q.Study on the correlation between microbial community structure and flavor substances during the fermentation of yogurt [D].Hohhot:Inner Mongolia Agricultural University, 2021.
[30] 高代微, 陈炼红, 王琳琳, 等.相对湿度对牦牛毛霉霉菌奶酪成熟过程中品质的影响[J].食品工业科技, 2020, 41(5):23-30.GAO D W, CHEN L H, WANG L L, et al.Effects of relative humidity on the quality of yak mold cheese during ripening[J].Science and Technology of Food Industry, 2020, 41(5):23-30.
[31] 于佳琦, 夏亚男, 乔晓宏, 等.锡林郭勒牧区酸马奶天然发酵剂中风味物质及微生物多样性[J].食品工业科技, 2021, 42(10):112-121.YU J Q, XIA Y N, QIAO X H, et al.Analysis of flavor substances and microbial diversity in nautral starter of koumiss in Xilin gol pastoral area[J].Science and Technology of Food Industry, 2021, 42(10):112-121.
[32] KRASTANOV A, YEBOAH P J, WIJEMANNA N D, et al.Volatile aromatic flavor compounds in yogurt:A review[J].Current Issues and Advances in the Dairy Industry, 2023.DOI: 10.5772/intechopen.109034.
[33] CHA K H, LEE E H, YOON H S, et al.Effects of fermented milk treatment on microbial population and metabolomic outcomes in a three-stage semi-continuous culture system[J].Food Chemistry, 2018, 263:216-224.
[34] PENG J Y, MA L Q, KWOK L Y, et al.Untargeted metabolic footprinting reveals key differences between fermented brown milk and fermented milk metabolomes[J].Journal of Dairy Science, 2022, 105(4):2771-2790.