莫能菌素(monensin)是一种由肉桂链霉菌(Streptomyces cinnamonensis)产生的聚醚类离子载体抗生素,具有显著的抗球虫和抗肿瘤活性,广泛应用于畜牧业和医药领域[1-3]。然而,天然莫能菌素的生产效率受限于肉桂链霉菌的代谢能力和发酵条件,因此提高其产量对于满足市场需求和降低生产成本具有重要意义。针对这一问题,如何提高生产菌株肉桂链霉菌的发酵能力,成为降低莫能菌素生产成本的一大挑战。选育莫能菌素高产菌种已成为广泛采用的研究手段。郭慧君等[4]采用紫外线—LiCl复合诱变,并建立了抑菌圈初筛法,显著提高了筛选效率,诱变菌株的罐上生产能力较出发菌提高了18.3%。在此基础上,李子勇等[5]采用同样的诱变方法结合上述快速筛选技术获得了3株高产突变菌株,其摇瓶相对效价较对照平均提高了30%以上。任勇等[6]将紫外诱变、亚硝基胍诱变和原生质体融合技术相结合,在摇瓶水平获得效价提高28%的突变株。可见,传统的诱变育种手段可以有效提升菌株莫能菌素生产能力,但长期重复使用相同的诱变源,往往会导致突变率低、突变谱窄和诱变疲劳[7]。常压室温等离子体(atmospheric room temperature plasma,ARTP)诱变技术是近年来发展起来的一种新型诱变方法,具有安全性高、操作简便、突变率高等特点,是微生物育种领域的一种新兴且有效的诱变手段[8]。吕苗苗等[9]利用ARTP诱变阿维链霉菌筛选出诱变菌株效RW-51,阿维菌素产量比原始菌株提高8.9%。郑明坤等[10]采用ARTP诱变和抗生素抗性筛选的组合策略使西索米星效价提高近40%。李艳青等[11]利用ARTP和紫外复合诱变的方式,使新硫肽类抗生素166A产量提高了7.47倍。可见,ARTP诱变在抗生素产生菌种选育方面极具应用前景。
优化培养基配方使微生物良好生长繁殖和合理生理代谢是提升抗生素产量的关键技术手段,通过调整培养基中碳源、氮源和前体物质等组分,能够显著提升莫能菌素的发酵效率和产量。DAY等[12]通过在肉桂链霉菌发酵时添加1 g/L丙酸钠溶液作为合成前体,使莫能菌素效价提高117%。张洁[13]开展了一株肉桂链霉菌发酵培养基改良的研究,发现通过优化葡萄糖、低温黄豆粉与微量元素等营养元素添加量,并且增添猪油作为碳源和消泡剂,有助于使发酵液pH稳定在利于莫能菌素合成的范围内,从而呈现出对提升发酵效价的积极作用。这些研究资料表明通过系统优化培养基主要组成成分有望进一步提高莫能菌素生产菌株的发酵水平。
论文旨在通过ARTP诱变选育菌种并结合发酵培养基优化提升肉桂链霉菌产生莫能菌素的发酵能力。实验首先利用ARTP诱变技术筛选出莫能菌素高产菌株,随后对培养基中的关键组分进行单因素和响应面分析,以确定最佳的培养基配方,最终在5 L发酵罐中验证了高产菌株和优化培养基的有效性。本研究期望为莫能菌素的工业化生产提供有价值的参考,并为生物制造领域提供创新的策略和方法。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
肉桂链霉菌(S.cinnamonensis)2110,本实验室保藏。
1.1.2 培养基
高氏培养基用于培养肉桂链霉菌单菌和斜面。种子培养基和初始发酵培养基用于培养肉桂链霉菌种子和发酵,培养基配方参照文献[14]配制。
1.1.3 主要试剂
葡萄糖、可溶性淀粉、KNO3、K2HPO4、MgSO4·7H2O、FeSO4·7H2O、NaCl、丙酸钠、缬氨酸、亮氨酸、异亮氨酸,国药集团化学试剂有限公司;PBS,生工生物工程(上海)股份有限公司;酵母粉、胰蛋白胨,美国赛默飞世尔科技公司;硫酸链霉素,上海阿拉丁生化科技股份有限公司;香草醛,上海泰坦科技股份有限公司。
1.2 仪器与设备
ARTP-3常压室温等离子体诱变仪,北京思清源生物科技有限公司;Synergy H4多功能酶标仪,美国伯腾仪器有限公司;1260 Infinity II高效液相色谱仪,美国安捷伦科技公司;HYL-C组合式摇床,太仓强乐实验设备有限公司;立式自动压力蒸汽灭菌器,致微(厦门)仪器有限公司;SW-CI-ID单人超净工作台,苏州净化设备有限公司;5 L发酵罐,上海百伦生物科技有限公司。
1.3 实验方法
1.3.1 链霉菌菌株的发酵培养
24孔深孔板发酵:将单菌接种至24孔深孔板种子培养基(装液量1 mL)中,33.0 ℃、350 r/min培养24 h。然后,按照接种量10%转入发酵孔板(装液量2.0 mL)中,33.0 ℃、350 r/min发酵10 d。
摇瓶发酵:将单菌接种至摇瓶种子中(100 mL/500 mL)中,33.0 ℃、180 r/min培养24 h。然后,按照接种量10%转入发酵培养基中(50 mL/500 mL),33.0 ℃、200 r/min发酵10 d。
5 L罐发酵:装液量为3.0 L,接种量 10%。培养温度33.0 ℃,转速 500 r/min,通气量 3.0 L/min,溶氧控制在30%左右。
1.3.2 S.cinnamonensis的ARTP诱变及筛选
1.3.2.1 ARTP诱变
在培养10 d后长满孢子的新鲜斜面上添加10 mL无菌PBS,用无菌接种环将孢子全部刮下至PBS中,稍混匀后即成孢子悬液;将其转移至装有直径4~6 mm玻璃珠的小锥形瓶中,于30 ℃恒温摇床中200 r/min振荡1 h以打散聚集的孢子链,用玻璃漏斗经四层无菌擦镜纸过滤后即成单孢子悬液。将金属载片在酒精灯火焰上灭菌,冷却至室温后,用移液枪吸取10 μL单孢子悬液,均匀涂布于金属载片表面,将载片置于ARTP诱变育种仪的载台上,以入射功率100 W、He流量10 L/min的诱变条件处理合适的时长(0、30、60、90、120、150 s)。处理后载片自动落入下方装有490 μL PBS的2 mL离心管中,盖紧盖子后用涡旋振荡仪充分振荡重悬3 min,将附着在载片上的孢子充分洗脱,即制成诱变后孢子悬液,稀释一定浓度后均匀涂布于平板。同时将未经诱变处理的菌液进行相同浓度稀释后涂布,于33 ℃恒温培养箱中倒置培养5 d,统计各平板菌落个数,致死率按公式(1)计算:
(1)
式中:C,致死率,%;A,未经诱变的单菌落数;B,诱变处理后的单菌落数。
1.3.2.2 诱变菌株筛选
实验对出发菌进行ARTP诱变处理90 s后,将诱变后孢子液涂布于20 μg/mL硫酸链霉素抗性平板上进行初筛,从中挑取长势良好的单菌落进行24孔深孔板发酵和保藏,发酵结束后对效价进行检测以筛选出莫能菌素高产菌。将初筛得到高产菌株,刮下孢子至200 μL的无菌水中,均匀涂布于试管斜面上,培养10 d后用10 mL无菌20%(体积分数)甘油溶液全部洗下,分装至10个冻存管中于-80 ℃冰箱保藏,进行后续摇瓶发酵验证。取1 mL保藏孢子悬液按照摇瓶培养的方法发酵并进行效价评价,得到的高产菌再进行下一轮ARTP诱变,共计进行5轮。本研究建立的基于ARTP的肉桂链霉菌高通量筛选方法如图1所示。
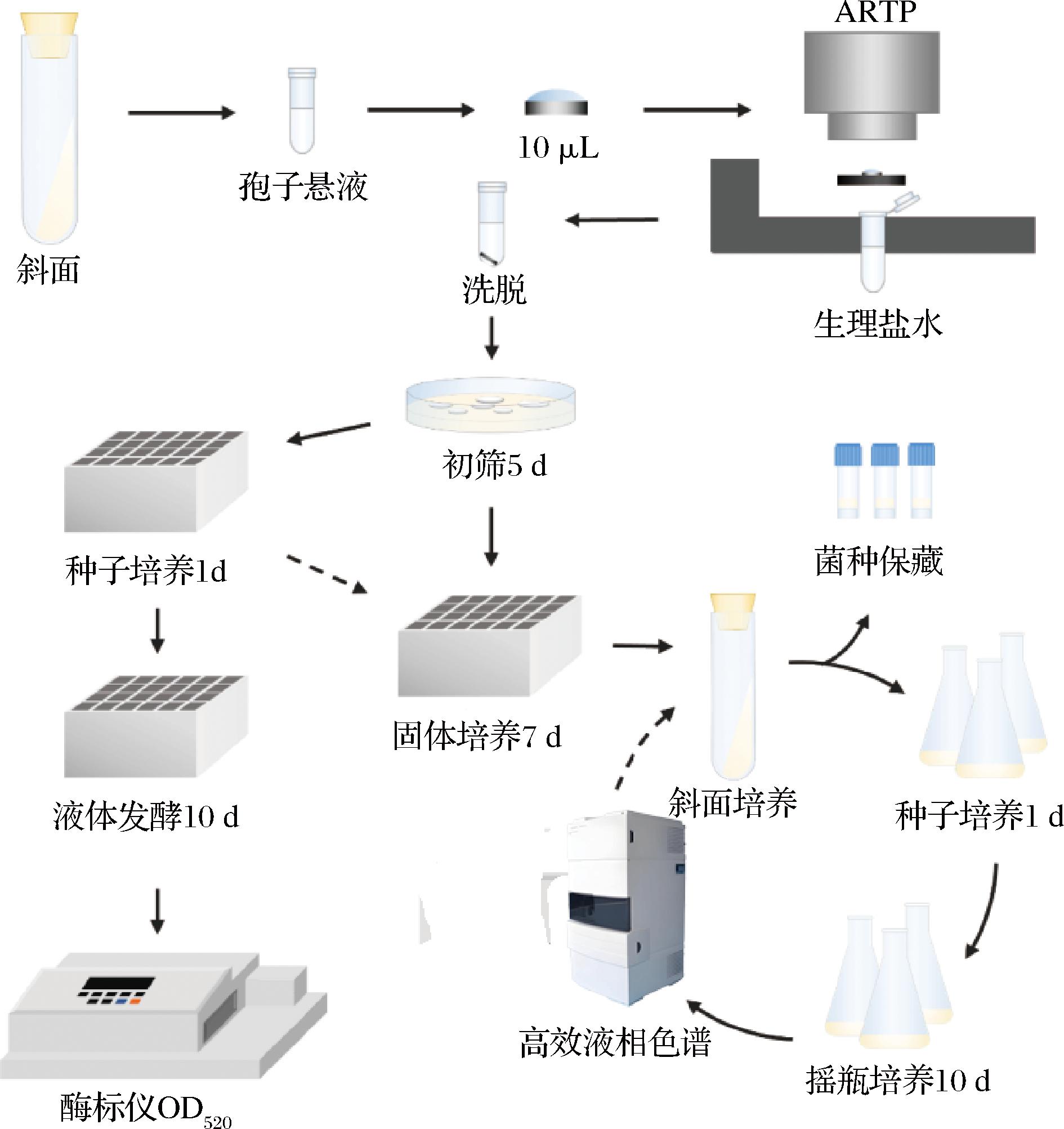
图1 基于ARTP的肉桂链霉菌高通量筛选策略
Fig.1 High throughput screening strategy forS.cinnamonensis based on ARTP
1.3.3 遗传稳定性验证
将诱变得到的莫能菌素较高的菌株接种至斜面培养基,于33 ℃恒温培养箱培养5 d,连续传代5代,每次传代后的菌株按照摇瓶复筛流程进行,并测定莫能菌素效价,选取遗传稳定性较好的菌株进行下一步实验并保藏。
1.3.4 发酵培养基的单因素优化
实验分别以碳源(葡萄糖、豆油)、氮源(黄豆饼粉)和前体物质(丙酸钠、分支氨基酸)的添加量为单因素条件考察其对莫能菌素效价的影响,每次以一种成分的添加量为考察对象,其他成分质量浓度保持不变。实验设计考察质量浓度葡萄糖分别为20.0、25.0、30.0、35.0、40.0、45.0 g/L,豆油分别为30.0、35.0、40.0、45.0、50.0、55.0 g/L,黄豆饼粉分别为20.0、25.0、30.0、35.0、40.0 g/L,丙酸钠分别为0.5、1.0、1.5、2.0、2.5 g/L,缬氨酸为0、0.1、0.2、0.3、0.4 g/L,异亮氨酸为0、0.1、0.2、0.3、0.4 g/L,亮氨酸为0、0.25、0.5、0.75、1.0 g/L。
1.3.5 发酵培养基的响应面法优化
根据单因素实验结果,选择对莫能菌素合成有正向作用的葡萄糖(A)、黄豆饼粉(B)、豆油(C)、丙酸钠(D)、缬氨酸(E)、亮氨酸(F)和异亮氨酸(G)7种因素进行Plackett-Burman实验,每个因素设置-1和+1两个水平,以发酵10 d的莫能菌素效价为响应值Y设计Plackett-Burman实验,生成12组实验方案,基于实验结果,对影响莫能菌素效价的3个显著因素(A、B、C)采用Box-Behnken实验设计进行响应面分析。实验以发酵10 d的莫能菌素效价为因变量Y,以3个显著因素为自变量,设计3因素3水平Box-Behnken组合矩阵对发酵效价进行优化,并对Box-Behnken实验结果进行回归分析,以获得二次多项式效价模型。
1.3.6 分析检测方法
莫能菌素的检测方法分为两种:a)利用多孔板进行菌种初筛的时候采用香草醛显色法。取发酵液1 mL,加入5.0 mL 30 g/L香草醛溶液进行衍生(将3.0 g香兰素溶于体积比95∶2的甲醇和硫酸混合物中,制备衍生化试剂),并设置空白对照,充分混匀后于45.0 ℃水浴20 min,冷却至室温后于520 nm处测吸光度,依据标准曲线计算莫能菌素含量。b)摇瓶复筛时采用高效液相色谱法。取1.0 g发酵液与50 mL甲醇混合充分混匀。然后对混合物实施30 min超声波处理。随后,粗提物通过0.45 μm的有机滤膜过滤,并转移到液相小瓶中。采用高效液相色谱法,色谱柱为C18柱(250 mm×4.6 mm, 5 μm),流动相为甲醇-水-冰醋酸混合液(94∶6∶0.1,体积比)。将流量设定为0.7 mL/min。检测波长520 nm,进样量20.0 μL。衍生温度98 ℃。稀释剂由甲醇水溶液(90∶10,体积比)。菌体浓度测定方法采用体积法[15]。
1.4 数据处理
每组实验均设置3个平行重复,实验数据采用响应面分析法(Design-Expert 13软件)进行建模分析,运用Origin 2022完成可视化处理。
2 结果与分析
2.1 S.cinnamonensis 的诱变选育
2.1.1 诱变致死率选择
对出发菌进行ARTP诱变处理,绘制出的致死率曲线如图2所示。结果表明,肉桂链霉菌的孢子对等离子体照射较为敏感,致死率随着诱变时间延长而不断上升,在0~60 s的处理时间内致死率快速攀升,处理150 s后达100%致死率。因此,选择90 s作为ARTP诱变的处理时间,此时致死率约为90%。
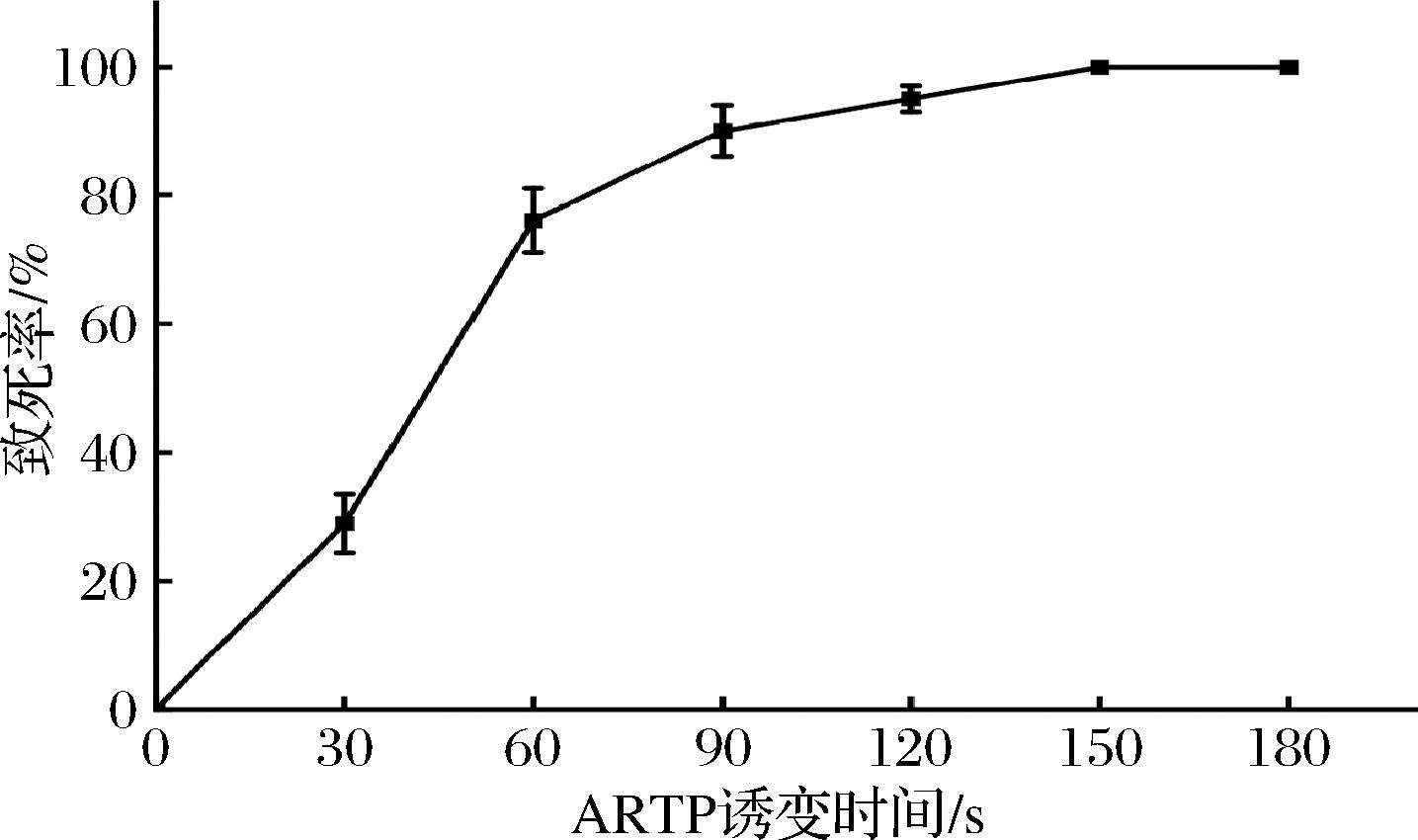
图2 出发菌2110经ARTP诱变的致死率曲线
Fig.2 Lethality curve of strain 2110 treated by ARTP mutagenesis
2.1.2 诱变菌株筛选
硫酸链霉素抗性突变是应用最广泛的一种核糖体工程技术。在发酵稳定期,核糖体决定了次级代谢产物合成相关基因的表达量,而核糖体突变所引起的蛋白合成能力的改变直接影响到次级代谢产物的合成分泌。因此链霉菌的抗生素生产能力与其自身对链霉素的抗性能力息息相关[16-17]。所以,实验选择硫酸链霉素作为初步筛选因子,对出发菌进行ARTP诱变处理90 s后将诱变后孢子液涂布于含有20 μg/mL硫酸链霉素的抗性平板上进行初筛,从中挑取长势良好的单菌落进行24孔深孔板发酵,发酵结束后对效价进行检测。最终第5轮诱变结果如图3所示,经诱变后60%以上菌株的效价仍保持在0.95~1.10 g/L,只有少数菌株效价会发生较大变化,总体上负突变率较高。为减少实验误差,实验挑取每块多孔板中效价最高的2株菌进行下一步摇瓶发酵验证。
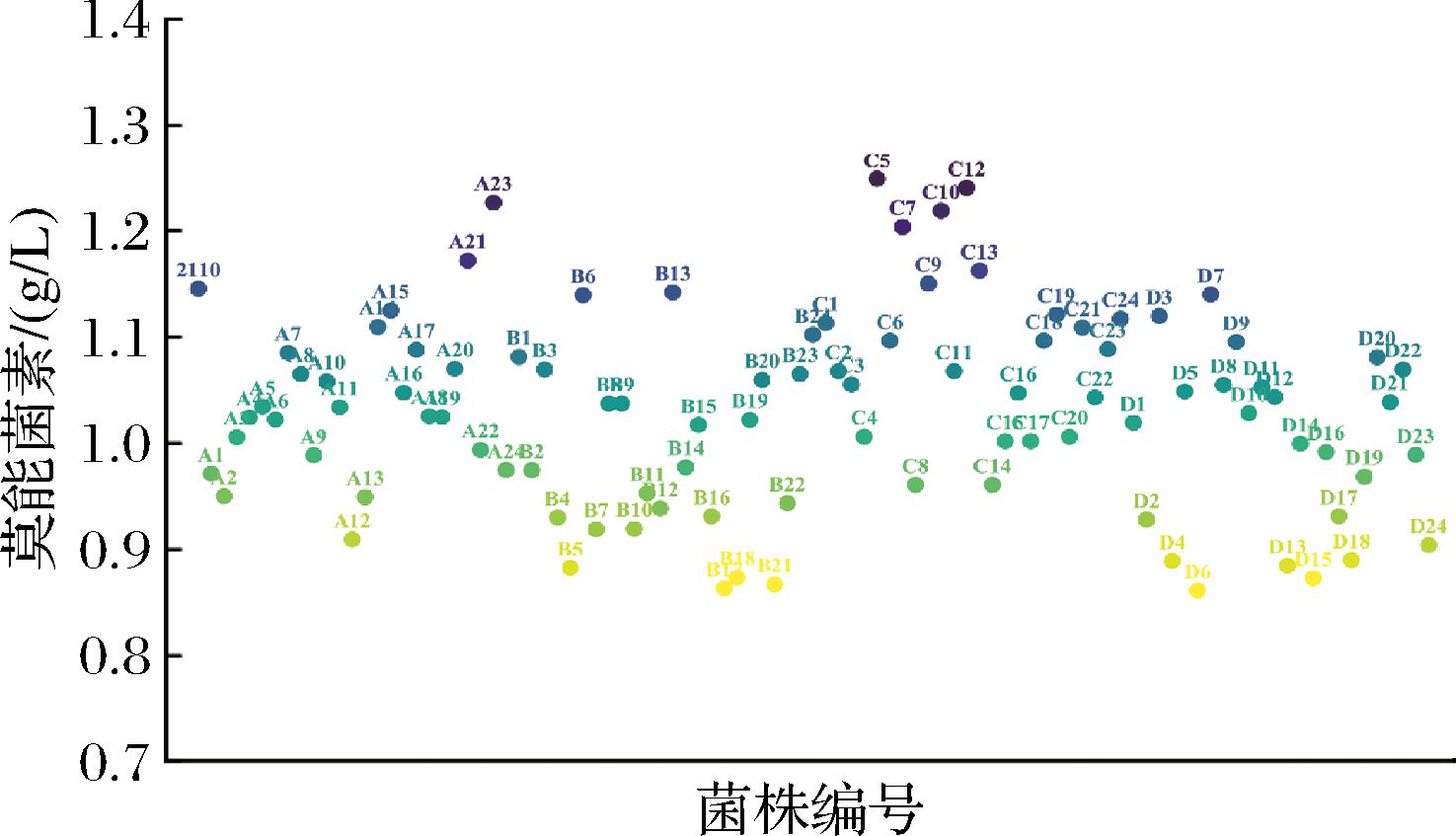
A、B、C和D表示多孔板的编号;数字表示该多孔板中孔的编号。
图3 第5轮诱变菌株的24孔深孔板筛选结果
Fig.3 Results of 24-well plate screening of the fifth round of mutagenic strains
2.2 突变菌株的摇瓶发酵
接着对24孔深孔板筛选得到的潜在高产菌株进行摇瓶发酵验证,结果如图4-a所示,所有菌株在发酵结束后的pH值变化不大,有7株菌效价高于原始菌株。特别地,菌株S.cinnamonensis 5C5的生物量显著高于其他菌株,与出发菌株相比提高了11.75%。此外,菌株5C5的发酵效价提升也相当显著,10 d发酵后效价可达7.56 g/L,相较于原始菌株S.cinnamonensis 2110(效价为6.90 g/L)提升了9.57%。这些结果表明,该突变体的生物量与效价之间存在正相关关系,推测这种提升可能是由于ARTP诱变增强了菌株的初级代谢过程,从而促进了菌株的快速生长,并提高了次级代谢产物的产量。鉴于原始菌株S.cinnamonensis 2110本身就是一个工业菌株,其性能提升的难度相对较大,因此,通过ARTP诱变实现的这一提升幅度在工业化应用中具有重要价值。
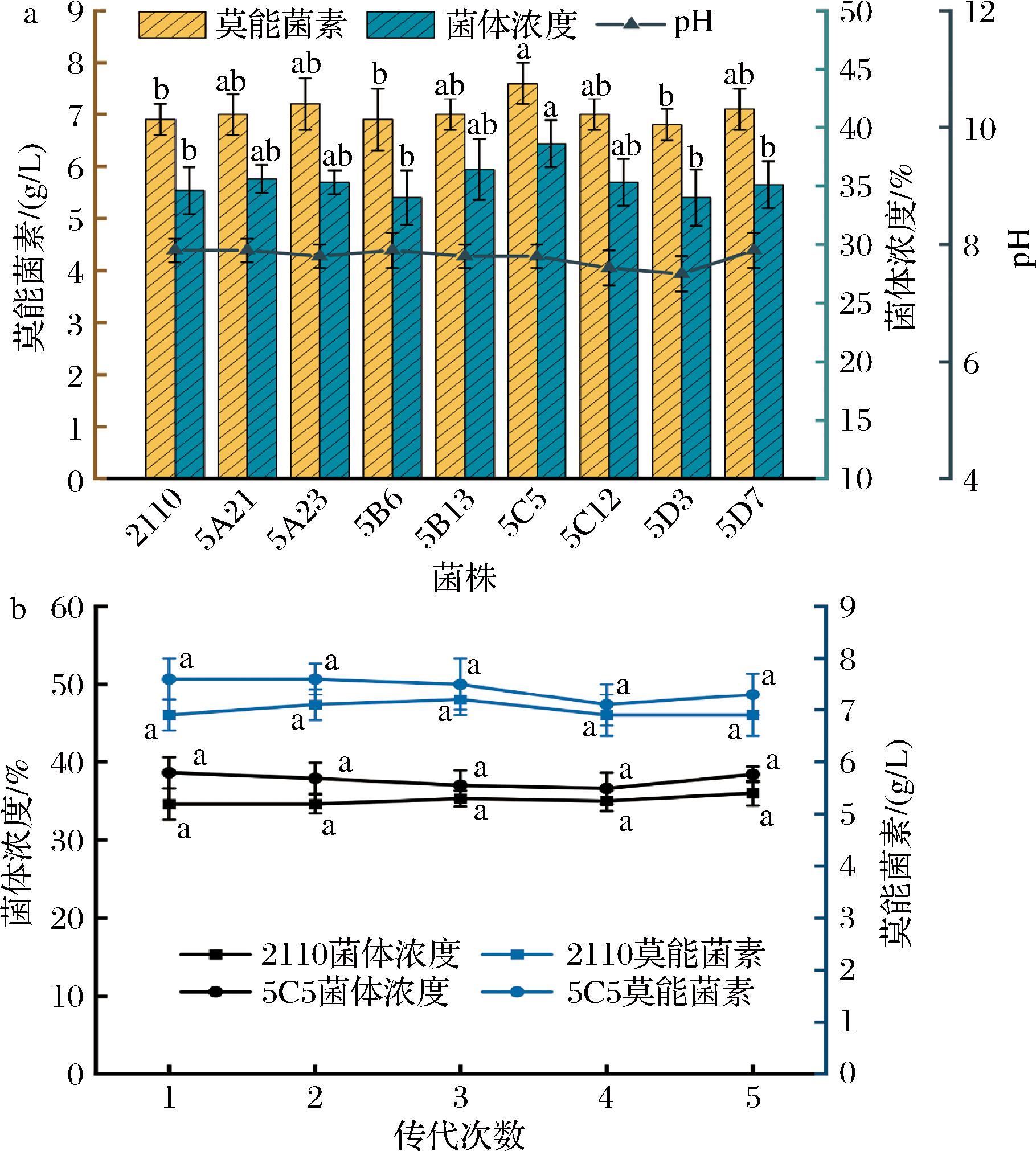
a-摇瓶验证;b-稳定性验证
图4 诱变菌株的摇瓶验证结果及稳定性验证
Fig.4 Shake flask verification results and stability verification of mutagenic strains
注:不同小写字母表示差异显著(P<0.05)(下同)。
为验证突变体的莫能菌素高产性状是否能稳定遗传,对S.cinnamonensis 5C5进行了5次连续传代培养。如图4-b所示,菌株5C5的生物量和菌体浓度在传代过程中略有波动,传至第5代时生物量提升6.19%,与第1代相比减少了约5.6个百分点;发酵效价比对照提升为6.23%,与第1代相比仅减少约3个百分点。对高产菌株5C5第1代至第5代的效价和菌体浓度进行显著性分析,发现它们没有显著差异。可见,肉桂链霉菌S.cinnamonensis 2110经诱变后得到的S.cinnamonensis 5C5基本保持了其高效价性状,具有实际应用价值。
2.3 发酵培养基的单因素优化
2.3.1 碳源添加量的优化
葡萄糖和豆油在微生物发酵中作为碳源,不仅提供了微生物生长和代谢所需的碳和能源,还可能影响发酵过程的pH和泡沫控制[18-19]。正确管理和平衡这2种碳源的使用对于优化发酵过程和提高产物产量至关重要[20]。因此,以初始发酵培养基为基础,其他成分质量浓度保持不变,对不同质量浓度的葡萄糖或者豆油进行优化,结果如图5所示。当葡萄糖添加量<35 g/L时效价随添加量增加而升高,原因可能在于碳源的缺乏导致初级代谢过程菌体生长较缓慢,影响了次级代谢产物莫能菌素的生成。葡萄糖添加量为35.0 g/L时效价达到最大值,为7.89 g/L,而当葡萄糖添加量>35.0 g/L时效价反而下降,可能是由于过量碳源导致菌体生长过快,提前进入衰退期而缩短了产物合成期。同理,莫能菌素效价随豆油质量浓度的增加呈先增加后减少的趋势,在添加量为40.0 g/L时达到最大值,为7.88 g/L。而当豆油添加量>40.0 g/L时效价反而下降,原因可能在于过多的豆油显著加大了发酵液黏度,菌体生长环境被破坏[21]。因此,本实验选择最适葡萄糖和豆油的添加量分别为35.0 g/L和40.0 g/L。
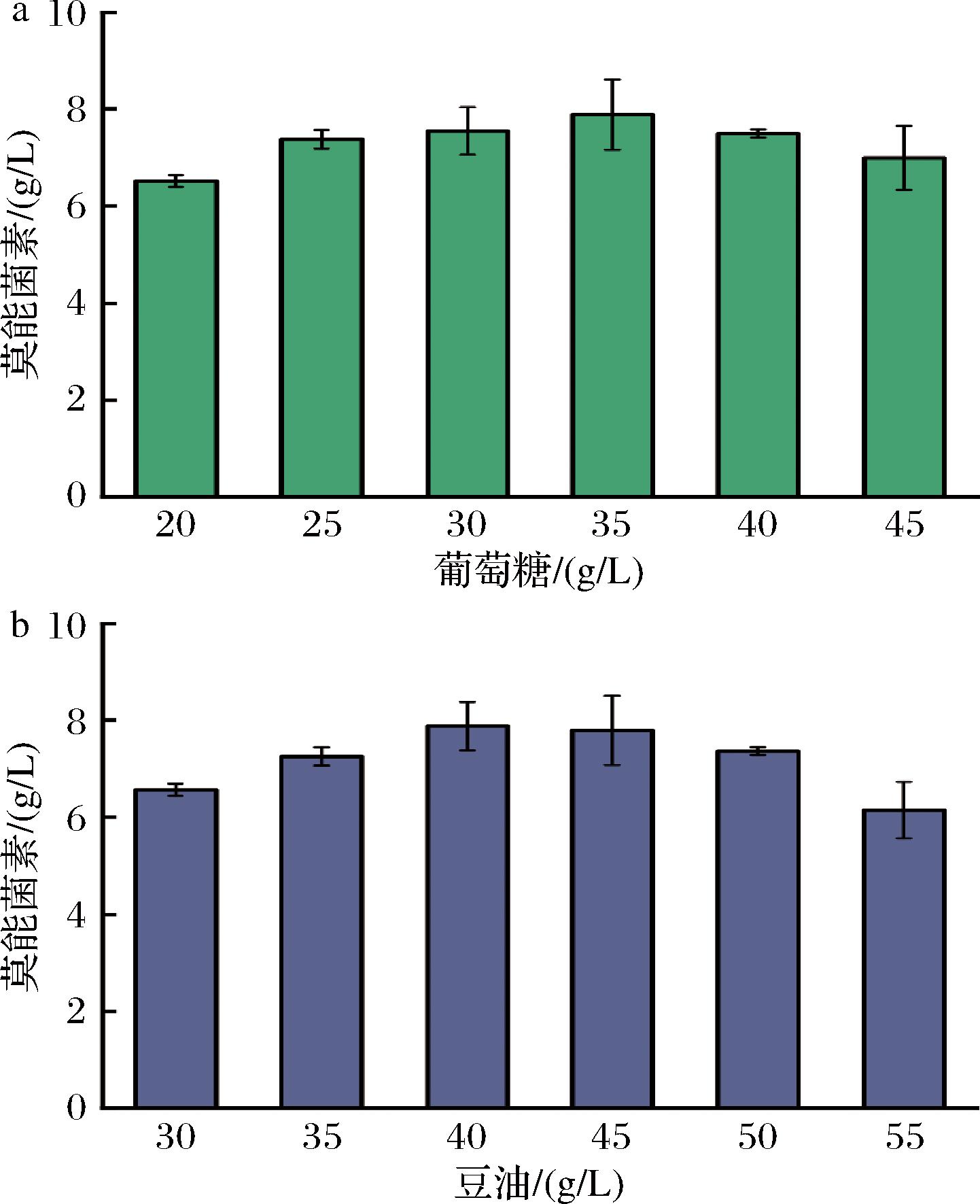
a-葡萄糖;b-豆油
图5 碳源添加量对莫能菌素效价的影响
Fig.5 Effect of addition of carbon source on monensin titer
2.3.2 氮源添加量的优化
在抗生素发酵的实际生产中,黄豆饼粉是首选的有机迟效氮源,其价格低廉,易于获得,含有丰富的蛋白质、多肽以及游离氨基酸等营养物质,还可以保持生长过程中培养基pH的相对稳定,对菌体的生长和产物的合成非常有利[22]。以初始发酵培养基为基础,考察了不同黄豆饼粉添加量对莫能菌素效价的影响,实验结果如图6所示。结果表明,添加黄豆饼粉的质量浓度较低时莫能菌素的效价明显偏低,原因可能是低质量浓度的黄豆饼粉导致氮源不足。在黄豆饼粉添加质量浓度为30.0 g/L时,莫能菌素效价最高,达到7.83 g/L,继续添加黄豆饼粉效价降低,原因可能在于高质量浓度的黄豆饼粉影响了培养基中的溶解氧含量,而肉桂链霉菌属于好氧菌,其呼吸作用受到限制后扰乱了初级代谢和次级代谢过程,进而影响莫能菌素的合成[23]。因此,本实验选择最适黄豆饼粉添加量为30.0 g/L。
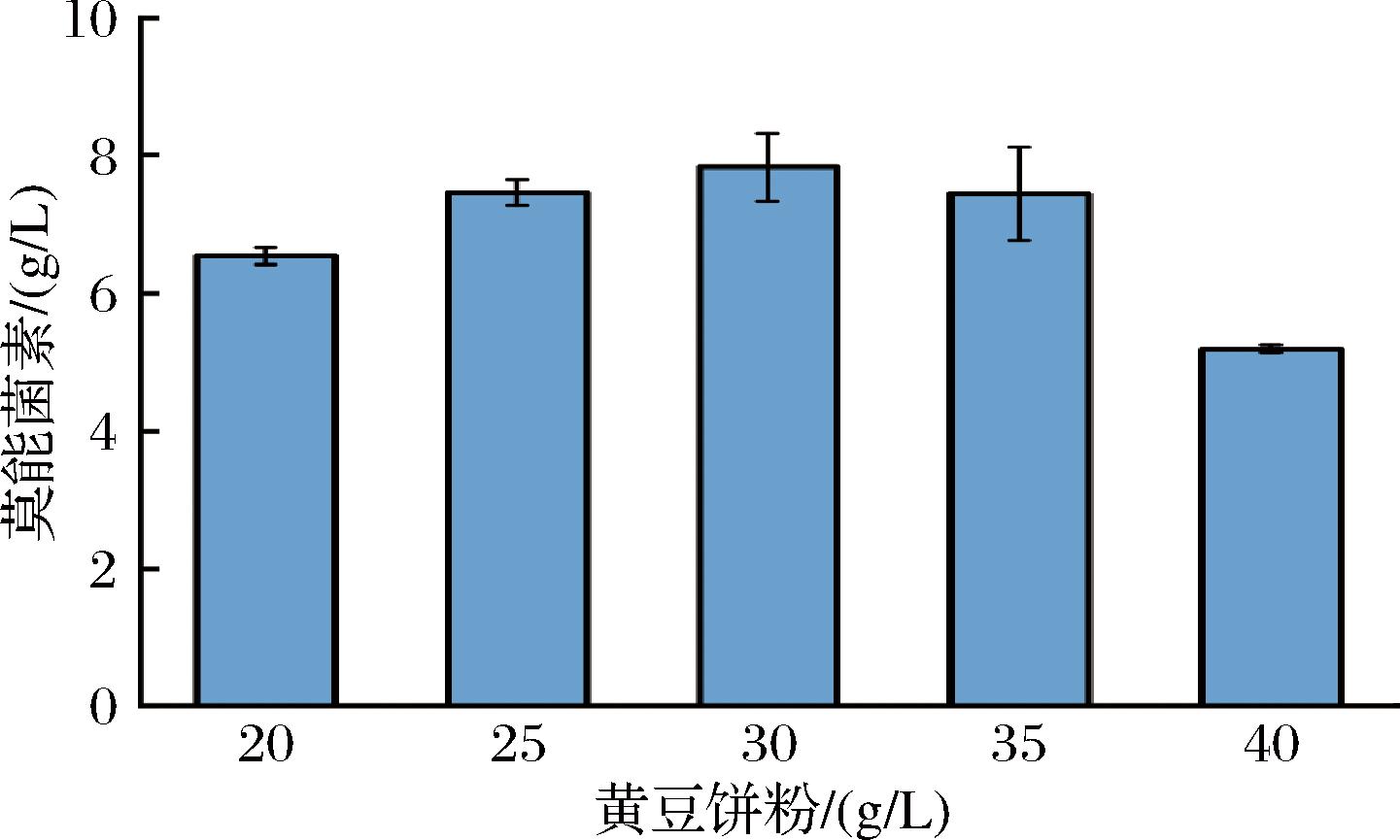
图6 黄豆饼粉添加质量浓度对莫能菌素效价的影响
Fig.6 Effect of soybean cake powder concentration on monensin titer
2.3.3 前体物质添加量的优化
莫能菌素的合成前体包括丙二酰辅酶A、甲基丙二酰辅酶A和乙基丙二酰辅酶A,丙酸盐和分支氨基酸(缬氨酸、亮氨酸和异亮氨酸)是前体来源的重要物质[12]。添加适当质量浓度的前体物质很有可能缩短莫能菌素的生物合成周期,提高发酵效价。本实验在发酵初始分别添加丙酸盐和3种分支氨基酸,考察其对莫能菌素效价的影响,结果如图7所示。莫能菌素效价随丙酸钠质量浓度的增加呈先增加后减少的趋势(图7-a),在添加量为1.0 g/L时达到最大值,为7.99 g/L;当添加量达到1.5 g/L以上,莫能菌素效价逐渐降低,莫能菌素合成被抑制,这与文献[24]报道的现象相符。如图7-b所示,缬氨酸在添加质量浓度为0.10 g/L时对效价的提升最大,达到8.43 g/L,与未添加缬氨酸的效价相比提高了11.6%;随着添加质量浓度的继续增大,效价逐渐降低,可能较高质量浓度的缬氨酸会对发酵效价产生抑制。亮氨酸在添加质量浓度为0.25 g/L时效价达到最高(图7-c)。异亮氨酸在添加质量浓度为0.2 g/L时效价达到最高,达到8.58 g/L,与未添加相比提高了13.4%,同样随着添加质量浓度的继续增大,效价逐渐降低(图7-d)。因此,本实验选择1.0、0.1、0.25和0.2 g/L作为丙氨酸、缬氨酸、亮氨酸和异亮氨酸的最适添加质量浓度。
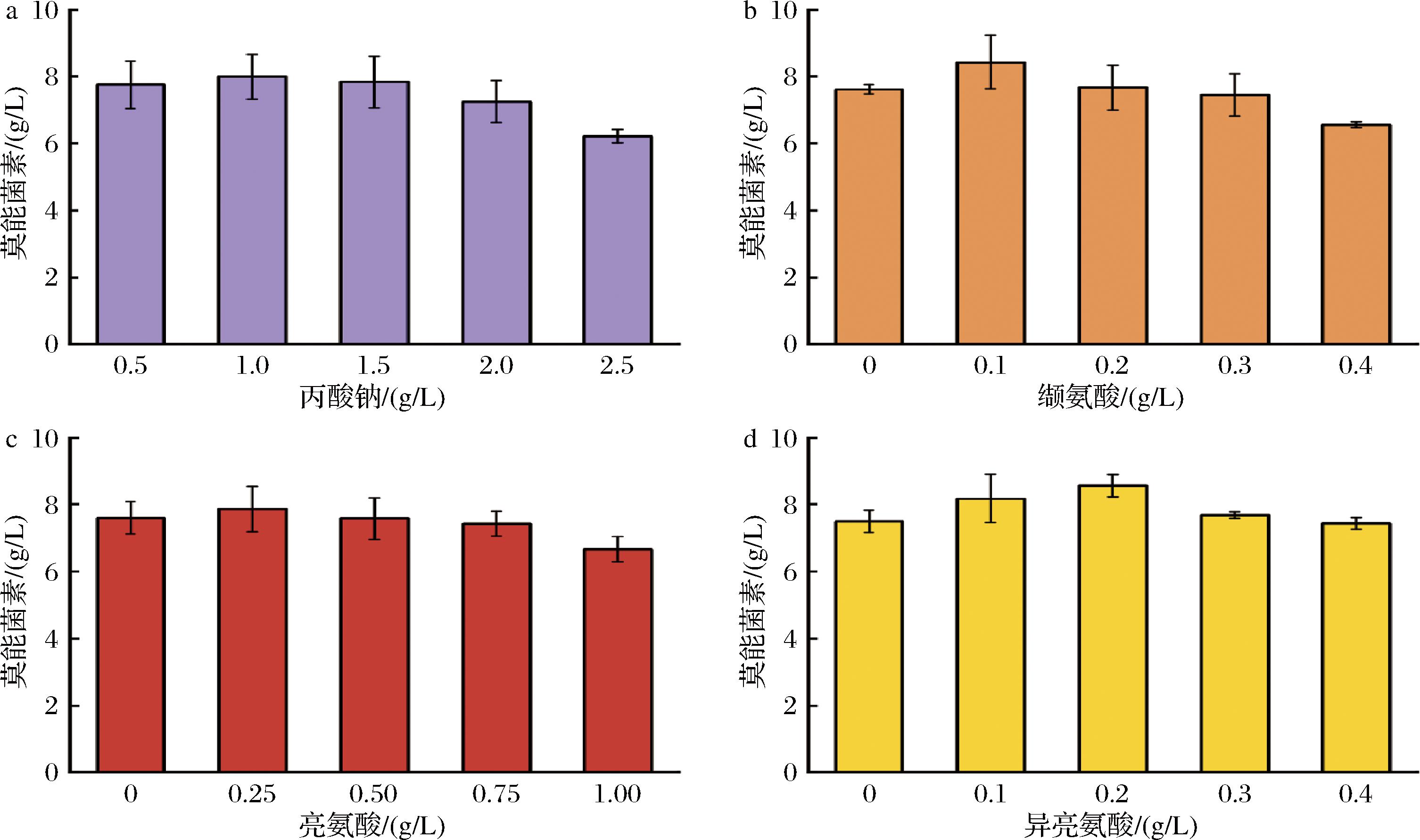
a-丙酸钠;b-缬氨酸;c-亮氨酸;d-异亮氨酸
图7 前体物质添加质量浓度对莫能菌素效价的影响
Fig.7 Effect of precursor substance concentration on monensin titer
2.4 响应面法优化发酵培养基
2.4.1 Plackett-Burman实验
Plackett-Burman实验设计基于完全平衡块原理,能够以最少的实验次数估计出各因素对响应项的影响效应,在考察因素较多时能够体现出快速高效的优势。根据单因素实验结果,设计实验,生成12组实验方案,结果见表1。
表1 Plackett-Burman实验的因素水平、实验设计及结果
Table 1 Experimental variables levels, design and results in Plackett-Burman design
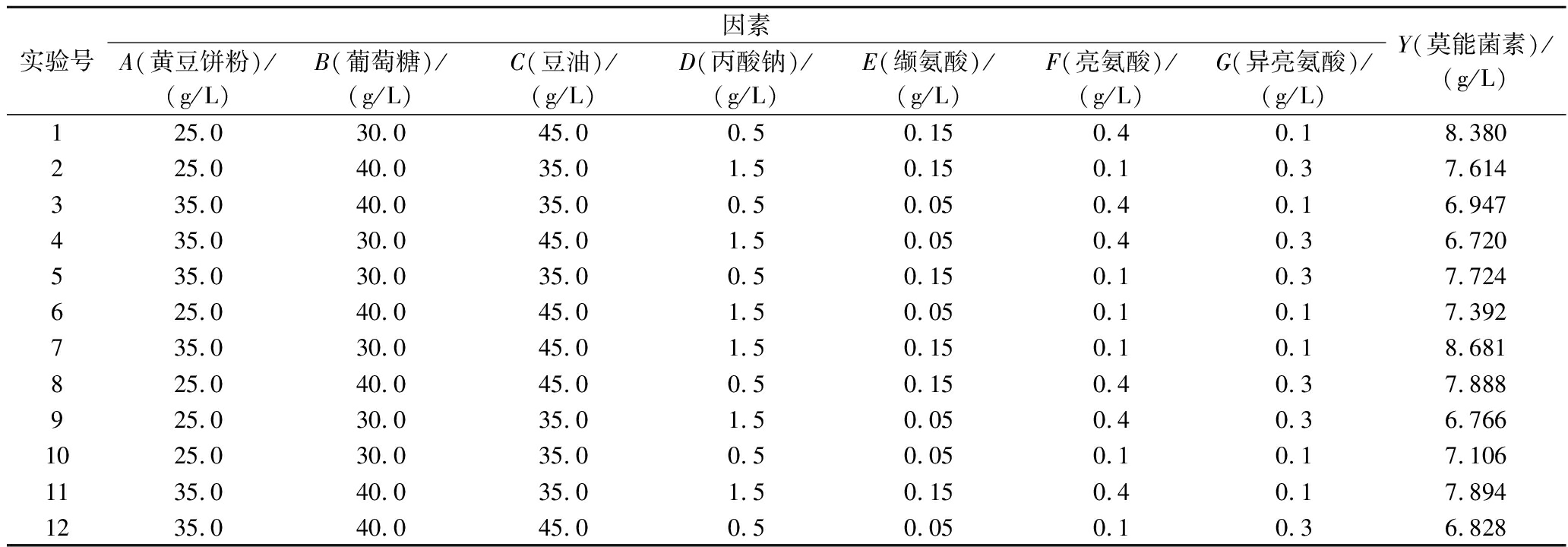
实验号因素A(黄豆饼粉)/(g/L)B(葡萄糖)/(g/L)C(豆油)/(g/L)D(丙酸钠)/(g/L)E(缬氨酸)/(g/L)F(亮氨酸)/(g/L)G(异亮氨酸)/(g/L)Y(莫能菌素)/(g/L)125.030.045.00.50.150.40.18.380225.040.035.01.50.150.10.37.614335.040.035.00.50.050.40.16.947435.030.045.01.50.050.40.36.720535.030.035.00.50.150.10.37.724625.040.045.01.50.050.10.17.392735.030.045.01.50.150.10.18.681825.040.045.00.50.150.40.37.888925.030.035.01.50.050.40.36.7661025.030.035.00.50.050.10.17.1061135.040.035.01.50.150.40.17.8941235.040.045.00.50.050.10.36.828
对表1进行显著性分析,结果见表2,7个因素对响应值Y的影响显著顺序为缬氨酸(E)>异亮氨酸(G)>豆油(C)>葡萄糖(B)>亮氨酸(F)>黄豆饼粉(A)>丙酸钠(D),且豆油(C)、缬氨酸(E)以及异亮氨酸(G)的水平显著(P<0.05)。在此基础上,以豆油、缬氨酸和异亮氨酸为变量进行Box-Behnken实验设计,进一步考察这3个因素的相互作用及对莫能菌素效价的影响。
表2 Plackett-Burman实验设计中各因素的主效应分析
Table 2 Analysis of the main effect of the variables in Plackett-Burman design
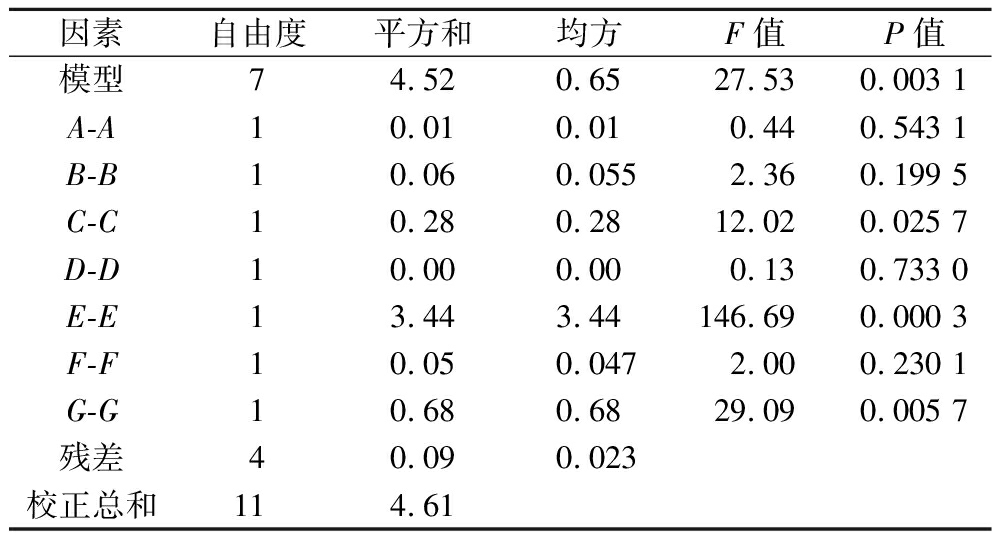
因素自由度平方和均方F值P值模型74.520.6527.530.003 1A-A10.010.010.440.543 1B-B10.060.0552.360.199 5C-C10.280.2812.020.025 7D-D10.000.000.130.733 0E-E13.443.44146.690.000 3F-F10.050.0472.000.230 1G-G10.680.6829.090.005 7残差40.090.023校正总和114.61
2.4.2 Box-Behnken实验设计
基于Plackett-Burman实验结果,对影响莫能菌素效价的3个显著因素采用Box-Behnken实验设计进行响应面分析。实验以发酵10 d的莫能菌素效价为因变量Y,以豆油(A)、缬氨酸(B)和异亮氨酸(C)为自变量,设计3因素3水平Box-Behnken组合矩阵对发酵效价进行优化。以发酵10 d的莫能菌素效价为响应值Y设计Box-Behnken实验,生成17组实验方案,实验结果见表3。
表3 Box-Behnken实验的因素水平、实验设计及结果
Table 3 Experimental variables levels, design and results in Box-Behnken design
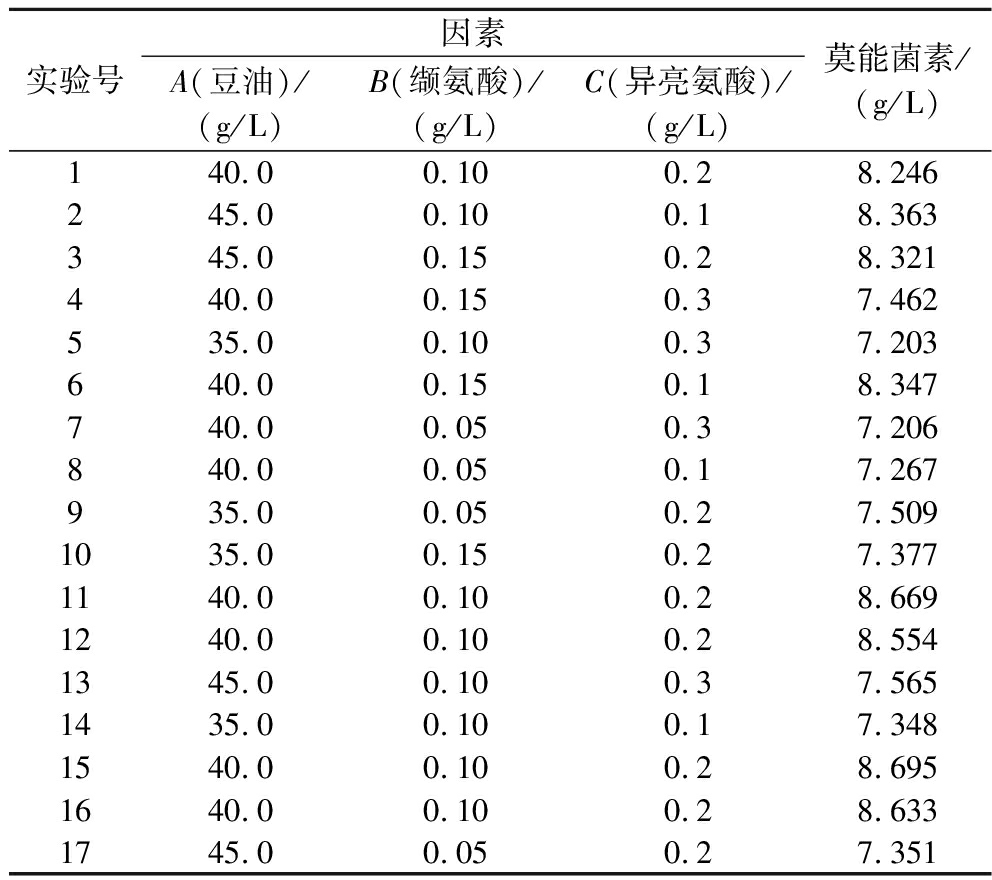
实验号因素A(豆油)/(g/L)B(缬氨酸)/(g/L)C(异亮氨酸)/(g/L)莫能菌素/(g/L)140.00.100.28.246245.00.100.18.363345.00.150.28.321440.00.150.37.462535.00.100.37.203640.00.150.18.347740.00.050.37.206840.00.050.17.267935.00.050.27.5091035.00.150.27.3771140.00.100.28.6691240.00.100.28.5541345.00.100.37.5651435.00.100.17.3481540.00.100.28.6951640.00.100.28.6331745.00.050.27.351
对表3中实验结果进行响应面回归和方差分析,结果见表4。模型F值极显著(P<0.001),表示拟合的预测值与实测值的相关性好,预测结果准确;失拟项0.58,表示相对于纯误差失拟项不显著,拟合结果可用于实验结果分析;模型相关系数R2=0.962 7,表明各显著因素与发酵结果之间响应关系良好,该模型与实验的拟合程度好。表中A、B、C、A2、B2和C2的影响极显著(P<0.01),AB、BC具有显著影响(P<0.05),AC的影响不显著。对Box-Behnken实验结果进行回归分析,可以得到二次多项式效价模型:效价=8.56+0.27A+0.27B-0.24C+0.28AB-0.16AC-0.21BC-0.44A2-0.48B2-0.5C2。
表4 Box-Behnken实验设计中各因素的主效应分析
Table 4 Analysis of the main effect of the variables in Box-Behnken design
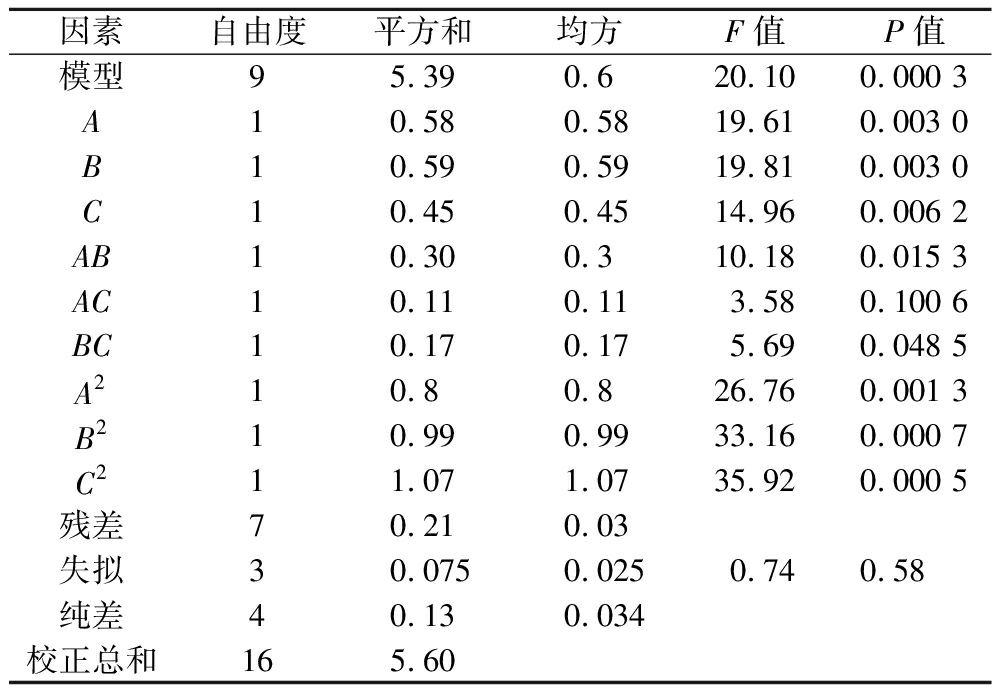
因素自由度平方和均方F值P值模型95.390.620.100.000 3A10.580.5819.610.003 0B10.590.5919.810.003 0C10.450.4514.960.006 2AB10.300.310.180.015 3AC10.110.113.580.100 6BC10.170.175.690.048 5A210.80.826.760.001 3B210.990.9933.160.000 7C211.071.0735.920.000 5残差70.210.03失拟30.0750.0250.740.58纯差40.130.034校正总和165.60
2.4.3 响应面分析
根据模型作响应面图,如图8所示,反映了豆油(A)、缬氨酸(B)和异亮氨酸(C)3个因素的两两交互作用对莫能菌素效价(Y)的影响。等高线越接近椭圆,说明两因素之间的交互作用越显著;等高线越接近圆形,说明两因素之间的交互作用越不显著。从图中可以看出,豆油与缬氨酸(AB)以及缬氨酸与异亮氨酸(BC)的交互作用显著,豆油与异亮氨酸(AC)的交互作用不显著。经响应面优化分析,实验最终确定豆油、缬氨酸和异亮氨酸的最佳添加质量浓度分别为41.81、0.12和0.16 g/L,在该组合下模型预测的效价为8.74 g/L。为了验证模型的准确性,根据该组合确定优化后的发酵培养基,在500 mL的摇瓶上进行3组平行发酵实验,得到的效价结果平均值8.73 g/L,实际效价接近预测值,说明响应面设计的该模型能够较好地预测莫能菌素效价。高产菌株C5C优化后的效价较原始培养基提高了15.50%,较原始菌株提高了24.8%。

a-豆油与缬氨酸的交互作用;b-豆油与异亮氨酸的交互作用;c-缬氨酸与异亮氨酸的交互作用
图8 三个显著因素交互影响莫能菌素效价的响应面曲面图
Fig.8 Response surface plot of three significant factors interacting on monensin titer
2.5 5 L发酵罐发酵验证
为进一步评估高产菌株S.cinnamonensis 5C5和优化的培养基的发酵效果,本实验以S.cinnamonensis 5C5和S.cinnamonensis 2110分别在原始培养基和优化后的培养基进行5 L罐发酵(图9)。首先,在菌体生长方面(图9-a),4组实验均表现出一致的趋势。均呈现先快速增加(发酵前期),增长缓慢(发酵中期),而后缓慢下降的趋势。其中在发酵前期2株菌在优化的培养基中增长速度高于原始培养基,表明优化后的培养基更适于S.cinnamonensis的生长。S.cinnamonensis 5C5在2种培养基中均第6或者7天达到最高值,比S.cinnamonensis 2110推后1 d,并且在优化后的培养基中最高达到44.1%, 比原工艺下S.cinnamonensis 2110的菌体浓度提高6.09%。说明高产菌株S.cinnamonensis 5C5的代谢能力更强。

a-菌体浓度;b-效价
图9 高产菌株S.cinnamonensis 5C5在不同发酵培养基中5 L罐上的发酵情况
Fig.9 Fermentation of the high-producing strain S.cinnamonensis5C5 on 5 L tanks in different fermentation media
如图9-b所示,在产物积累方面,在发酵前5 d,优化培养基实验组的莫能菌素效价一直高于原始培养基组,说明在发酵前中期,在优化后的培养基更加利于莫能菌素的合成。随着发酵的延长,培养基的优势逐渐消失,菌种的优势显现出来。S.cinnamonensis 5C5在2种培养基中继续合成莫能菌素,但是S.cinnamonensis 2110的产物合成能力逐渐减弱。值得注意的是,S.cinnamonensis 5C5在2种培养基中第7天是最大值,比原始菌株S.cinnamonensis 2110推后1 d,这与菌体浓度是一致的。表明高产菌株S.cinnamonensis 5C5合成莫能菌素的能力较强。因此,高产菌株S.cinnamonensis 5C5在原始培养基中莫能菌素效价最高达到10.66 g/L,比S.cinnamonensis 2110提高36.39%,在优化后的培养基中莫能菌素效价最高达到12.23 g/L,比原来提高56.56%。表明ARTP诱变和培养基优化在莫能菌素提高方面均发挥了重要的作用。
3 结论与讨论
论文利用ARTP技术诱变选育莫能菌素生产菌,成功筛选出1株具有高产潜力的突变株S.cinnamonensis 5C5。该突变株在系统优化的发酵培养基(葡萄糖35.0 g/L、豆油41.81 g/L、黄豆饼粉30.0 g/L、丙酸钠1.0 g/L、亮氨酸0.25 g/L、缬氨酸0.12 g/L和异亮氨酸0.16 g/L)上发酵能力显著提升,摇瓶发酵效价较优化前和出发菌分别提高15%和25%以上,其中豆油、缬氨酸和异亮氨酸对莫能菌素效价影响尤为显著。在优化条件下,突变菌株C5C在5 L发酵罐中分批发酵莫能菌素产量达到12.2 g/L,相较于原始菌株提高了50%以上。在莫能菌素指标方面,大部分的报道菌为肉桂链霉菌野生菌,报道工业菌株的较少。TANG等[25]通过过表达莫能菌素合成簇内的关键基因monRI和monRII,将莫能菌素效价提高到1.13 g/L。随后,ZHANG等[26]通过串联过表达dasR和monH,使莫能菌素效价显著提高至1.33 g/L。LIN等[27]通过过表达环腺苷酸受体蛋白(Crp)将莫能菌素的产量提高到0.84 g/L。此外,LIU等[28]通过异源表达聚醚特异性转运蛋白SLNHY_0929,使莫能菌素效价达到至1.29 g/L。这些报道的莫能菌素效价均比较低,而本实验的高产菌株5C5在莫能菌素产量方面展现出显著优势,具备良好的工业应用潜力。该研究显示出ARTP物理诱变技术在提高链霉菌生产抗生素方面的适用性以及发酵培养营养优化的必要性,为其他抗生素类生产菌菌株选育和发酵过程优化提供借鉴。
[1] GURUKKALOT K, RAJENDRAN V.Repurposing polyether ionophores as a new-class of anti-SARS-cov-2 agents as adjunct therapy[J].Current Microbiology, 2023, 80(8):273.
[2] LI Y L, SUN Q S, CHEN S S, et al.Monensin inhibits anaplastic thyroid cancer via disrupting mitochondrial respiration and AMPK/mTOR signaling[J].Anti-Cancer Agents in Medicinal Chemistry, 2022, 22(14):2539-2547.
[3] FREDERIKSEN R F, SLETTEMEÅS J S, GRANSTAD S, et al.Polyether ionophore resistance in a one health perspective[J].Frontiers in Microbiology, 2024, 15:1347490.
[4] 郭慧君, 张翠芬, 刘秋红, 等.莫能菌素的诱变育种与高通量筛选[J].中国动物保健, 2013, 15(10):12-15.GUO H J, ZHANG C F, LIU Q H, et al.Mutation breeding and high throughput screenings for monensin[J].China Animal Health, 2013, 15(10):12-15.
[5] 李子勇, 李云飞, 曾晓宁, 等.莫能菌素高产菌株的选育[J].中国动物保健, 2021, 23(5):116-117;119.LI Z Y, LI Y F, ZENG X N, et al.Selection of high monensin producing strains [J].China Animal Health, 2021, 23(5):116-117;119.
[6] 任勇, 王义.一种肉桂地链霉菌发酵生产莫能菌素的新型培养基和培养方法:中国,CN103937848A[P].2014-07-23.REN Y, WANG Y. A novel culture medium and method for the fermentation production of monensin by Streptomyces cinnamomi: China, CN103937848A[P]. 2014-07-23.
[7] 汪杏莉, 李宗伟, 陈林海, 等.工业微生物物理诱变育种技术的新进展[J].生物技术通报, 2007, 23(2):114-118.WANG X L, LI Z W, CHEN L H, et al.The development of physical mutation techniques in industrial microbe breeding[J].Biotechnology Bulletin, 2007, 23(2):114-118.
[8] 吴亦楠, 邢新会, 张翀, 等.ARTP生物育种技术与装备研发及其产业化发展[J].生物产业技术, 2017(1):37-45.WU Y N, XING X H, ZHANG C, et al.Recent progress on atmospheric and room temperature plasma(ARTP) biobreeding technology, instrumentation and its industrialization[J].Biotechnology &Business, 2017(1):37-45.
[9] 吕苗苗, 牛春, 石彦鹏, 等.阿维链霉菌高产菌株的复合筛选[J].国外医药(抗生素分册), 2024, 45(2):94-99.LV M M, NIU C, SHI Y P, et al.Compound screening of high-yield strain of Streptomyces avermitilis[J].World Notes on Antibiotics, 2024, 45(2):94-99.
[10] 郑明坤, 黄家滨, 李友明, 等.ARTP诱变结合抗性筛选选育西索米星高产菌株[J].中国抗生素杂志, 2021, 46(1):42-48.ZHENG M K, HUANG J B, LI Y M, et al.Breeding of high-yield sisomicin strain through the combination of ARTP mutagenesis and resistance screening[J].Chinese Journal of Antibiotics, 2021, 46(1):42-48.
[11] 李艳青, 戴剑漉, 蒋忠科, 等.常压室温等离子体-紫外复合诱变选育新硫肽类抗生素166A高产菌株[J].中国抗生素杂志, 2022, 47(5):514-520.LI Y Q, DAI J L, JIANG Z K, et al.Breeding of new thiopeptide antibiotic 166A high-yield producing strain by MPMS composite mutagenesis with plasma and UV[J].Chinese Journal of Antibiotics, 2022, 47(5):514-520.
[12] DAY L E, CHAMBERLIN J W, GORDEE E Z, et al.Biosynthesis of monensin[J].Antimicrobial Agents and Chemotherapy, 1973, 4(4):410-414.
[13] 张洁. 莫能菌素生物合成调控基因的敲除[D].天津:天津大学, 2015.ZHANG J.Deletion of regulatory genes in monensin biosynthetic cluster[D].Tianjin:Tianjin University,2015.
[14] 李欣颖, 张善飞, 刘旻炜, 等.高产莫能菌素肉桂地链霉菌的透明颤菌vgb基因异源表达[J].食品与发酵工业, 2024, 50(10):1-9.LI X Y, ZHANG S F, LIU M W, et al.Heterologous integrated expression of Vitreoscilla vgb in highly monensin producing Streptomyces cinnamonensis[J].Food and Fermentation Industries, 2024, 50(10):1-9.
[15] OCHI K.Insights into microbial cryptic gene activation and strain improvement:Principle, application and technical aspects[J].The Journal of Antibiotics, 2017, 70(1):25-40.
[16] LIU Z, ZHAO X Q, BAI F W.Production of xylanase by an alkaline-tolerant marine-derived Streptomyces viridochromogenes strain and improvement by ribosome engineering[J].Applied Microbiology and Biotechnology, 2013, 97(10):4361-4368.
[17] CAI X L, XU W L, ZHENG Y, et al.Coupled strategy based on regulator manipulation and medium optimization empowers the biosynthetic overproduction of lincomycin[J].Synthetic and Systems Biotechnology, 2024, 9(1):134-143.
[18] WANG X, ZHONG J J.Improvement of bacterial cellulose fermentation by metabolic perturbation with mixed carbon sources[J].Process Biochemistry, 2022, 122:95-102.
[19] WANG W S, LI S S, LI Z L, et al.Harnessing the intracellular triacylglycerols for titer improvement of polyketides in Streptomyces[J].Nature Biotechnology, 2020, 38(1):76-83.
[20] YE H K, HE Y D, XIE Y X, et al.Fed-batch fermentation of mixed carbon source significantly enhances the production of docosahexaenoic acid in Thraustochytriidae sp.PKU#Mn16 by differentially regulating fatty acids biosynthetic pathways[J].Bioresource Technology, 2020, 297:122402.
[21] GUO Y, LIU Y Y, YANG Z J, et al.Enhanced production of poly-γ-glutamic acid by Bacillus subtilis using stage-controlled fermentation and viscosity reduction strategy[J].Applied Biochemistry and Biotechnology, 2024, 196(3):1527-1543.
[22] 张鹏伟. 盐霉素发酵过程优化与放大研究[D].上海:华东理工大学, 2010.ZHANG P W.Optimization and scale-up of bioprocess for salinomycicn production by Streptomyces albus[D].Shanghai:East China University of Science and Technology, 2010.
[23] WEI P, HARINGA C, PORTELA L M, et al.Metabolic-fluid dynamics model construction and scale-down design for an industrial penicillin chrysogenum fermentation with combined dissolved oxygen and glucose concentration dynamics[J].Chemical Engineering Science, 2023, 276:118770.
[24] POSP
 IL S, KOPECK
IL S, KOPECK J, P
J, P IKRYLOV
IKRYLOV V, et al.Overproduction of 2-ketoisovalerate and monensin production by regulatory mutants of Streptomyces cinnamonensis resistant to 2-ketobutyrate and amino acids[J].FEMS Microbiology Letters, 1999, 172(2):197-204.
V, et al.Overproduction of 2-ketoisovalerate and monensin production by regulatory mutants of Streptomyces cinnamonensis resistant to 2-ketobutyrate and amino acids[J].FEMS Microbiology Letters, 1999, 172(2):197-204.
[25] TANG Z K, LI X M, PANG A P, et al.Characterization of three pathway-specific regulators for high production of monensin in Streptomyces cinnamonensis[J].Applied Microbiology and Biotechnology, 2017, 101(15):6083-6097.
[26] ZHANG Y, LIN C Y, LI X M, et al.DasR positively controls monensin production at two-level regulation in Streptomyces cinnamonensis[J].Journal of Industrial Microbiology &Biotechnology, 2016, 43(12):1681-1692.
[27] LIN C Y, ZHANG Y, WU J H, et al.Regulatory patterns of crp on monensin biosynthesis in Streptomyces cinnamonensis[J].Microorganisms, 2020, 8(2):271.
[28] LIU X, WU Y T, ZHANG X J, et al.Comparative transcriptome-based mining of genes involved in the export of polyether antibiotics for titer improvement[J].Antibiotics, 2022, 11(5):600.