高温大曲是典型的酱香型大曲,以软质小麦为原料,一般经人工堆积自然发酵而成,常用作酿造酱香型白酒的糖化发酵剂[1]。高温大曲的发酵温度高,最高可达60~65 ℃[2],但成品曲糖化力低,用曲量为所有酒类之最,与酿酒原料之比可达1∶1[3]。成品曲的香气是酱香风味的主要来源之一,大曲的品质对白酒的产量、质量和酒体风格有着直接而深远的影响。在传统固态酿造大曲酒的生产过程中,大曲被视为至关重要的物质保障,因此有“曲乃酒之骨”之称[4]。
由于曲块堆积位置的不同以及曲室温度等因素的影响,高温大曲通常根据其颜色分为黑色、黄色和白色3种[5-6]。当大曲在理想发酵条件(如温度、湿度等)下达到最佳发酵状态时,会形成黄曲,其收率最高,约占总收率的80%;当发酵时间较短或温度较低等条件未达到最佳状态时,会形成白曲,其收率约占10%;而当发酵时间过长或温度过高等条件导致发酵偏离最佳状态时,会形成黑曲,其收率约占10%[7]。目前,在酱香型白酒生产的过程中,对于3种颜色大曲的投入比例并没有明确要求,主要依靠工人的生产经验,以黄曲为主,搭配白曲和黑曲使用。黑、黄、白高温大曲的使用比例直接关系到酱香型白酒的品质,然而目前还没有关于黑、黄、白高温大曲形成机理的系统总结。因此,本文综述了影响黑、黄、白3种颜色高温大曲形成的因素及其品质差异,以期充分了解高温大曲的潜在功能,为酱香型白酒的生产标准化和质量稳定性提供科学依据。
1 影响高温大曲不同颜色形成因素分析
1.1 环境因素
高温大曲制作过程采用自然固态发酵,由于堆存过程中的空间异质性,曲坯不同位置的发酵温度、湿度和环境含氧量等因素均存在一定的波动[8]。在制曲过程中,曲坯的位置对高温大曲的颜色形成具有显著影响。位于曲房中层的曲坯,由于前期温度适宜且后期干燥良好,溶氧条件较好,通常形成黄曲。位于曲房中下层的曲坯,由于前期温度较低且后期干燥不足,溶氧量少、湿气重、水分含量高,热曲时间较长,易形成黑曲。相反,位于曲房上层的曲坯,由于门窗未完全密封,前期温度迅速上升且后期干燥不足,导致曲坯中的水分快速挥发,热曲时间较短,易形成白曲[9]。其中,发酵温度是影响大曲微生物群落聚集和代谢功能的关键因素,对高温大曲微生物群落空间异质性的形成起到重要作用[10-11]。与此同时,多水高湿的环境不仅有助于维持高温,也促进了微生物的正常生长繁殖以及酶的活性发挥,加速了褐变反应。此外,在高温大曲发酵的过程中,在微氧或缺氧条件下可以有效地控制发酵过程中好氧产酸微生物的活动,防止曲坯酸度过高,从而保证发酵产品的品质和褐变反应的顺利进行[12-13]。
1.2 生产工艺
高温大曲生产工艺的不同会直接影响大曲的发酵效果和最终酒类产品的品质特性。如图1所示,制曲工艺包括制曲原料处理、拌料、压曲、安曲(入仓发酵)、翻曲、贮存和出库,每一个环节都会影响大曲的品质。在压曲环节中,与传统人工踩曲方法相比,机械压制工艺制作的大曲在水分含量和温度控制上存在显著差异,这些差异导致了大曲微生态环境的分化,进而可能影响其颜色的变化[14-15]。入仓发酵是大曲生产过程中最重要也最关键的环节。蒋英丽等[16]发现传统的“横三竖三”模式表面以黄褐色和黑色为主,创新的“叠层反向倾斜排列”模式以黄褐色为主,后者在维持曲坯形状和促进水分挥发方面表现出优势,这可能有助于提高大曲的整体质量和发酵效率。李大鹏等[17]研究发现,通过在曲堆间插入木拍和四周覆盖麻袋的发酵工艺,能够生产出更符合酱香型白酒生产需求的大曲。这种工艺的优势主要体现能够提升黄曲比例、促进菌丝均匀生长、增强酱香特征等方面。在制曲过程中,翻曲时间和翻曲后曲坯的水分也是非常重要的因素。翻曲的时机不仅影响曲坯的成色,也影响最终成品曲的质量。如果翻曲时间过早,曲坯的温度较低,则导致成品曲中含有较多的白曲[18]。如果翻曲时间过晚,曲坯中黑色曲的含量会增加,这会影响成品曲的颜色和风味,使曲的品质下降。因此,在适当的时间进行翻曲,含有黄曲的比例最多,可以使成品曲的品质最佳[18-19]。

图1 高温大曲生产流程
Fig.1 High-temperature Daqu production procedure
1.3 非酶促褐变
非酶促褐变反应也被称为美拉德反应,是游离氨基酸和还原糖在高温条件下,经过复杂的聚合、缩合等反应过程,生成终产物类黑素,HASHIBA[20]通过对比不同糖类与特定氨基酸反应的实验发现,糖类的还原能力以及氨基酸的消耗量对褐变现象的形成具有显著影响。RIZZI[21]也证明多种颜色物质的形成,主要是由于糖类、蛋白质以及其他含氨基的氮源通过逆缩醛反应或是脱水聚合作用所生成的。大曲颜色的形成可能归因于美拉德反应终产物类黑素的积累[22]。在白曲中,由于温度和湿度较低,美拉德反应较弱;而在黑曲中,温度和湿度均较高,美拉德反应则很剧烈。有研究报道,黑曲中氨基酸的含量明显高于黄曲和白曲[23]。ZHU等[1]研究了不同色泽高温大曲中类黑精的差异,研究表现,类黑精的平均浓度黑曲>黄曲>白曲,表明黑曲的美拉德反应程度最高,黄曲次中,白曲最低,并推测,黑曲原料中淀粉、蛋白质等大分子物质的降解程度最高,这些大分子物质相较于黄曲和白曲产生更多的前体物质,使得黑曲中的美拉德反应更为活跃,从而促进了类黑素的形成,呈现出颜色更深和更为浓郁的风味[12]。此外,在大曲生产中添加淀粉酶和蛋白酶,大曲颜色明显比未添加酶的更黑,可能与酶催化小麦释放更多美拉德反应底物,从而产生更多的类黑素[22]有关。这与NAMLI等[24]的研究一致,通过控制还原糖的使用和反应条件,能够调节美拉德反应的程度。
1.4 酶促褐变
酶促褐变是在有氧条件下多酚氧化酶催化酚类化合物形成醌及其聚合物(黑色素)的反应。它需要3个条件:适当的酚类底物、多酚氧化酶和氧气[25-27]。它们相互作用会导致大曲中的颜色反应。在高温大曲发酵过程中,酶的作用使褐变反应可以在较低的温度下发生,而不需要像美拉德反应和焦糖化反应在高温条件下才能进行。罗帅[22]发现酪氨酸在大曲中富集的酪氨酸代谢途径被显著上调。酪氨酸酶是酪氨酸代谢途径的限速酶,也是一种多酚氧化酶,酪氨酸酶通过催化底物,促进酪氨酸代谢途径,导致更多的黑色素产生,从而促进了褐变及黑曲的形成。在高温大曲发酵过程中,微生物产生的酶类扮演着至关重要的角色。这些酶类不仅影响着大曲的品质,还会影响到曲种的形成。酪氨酸磷酸酶可以催化酪氨酸的合成,酪氨酸是酪氨酸代谢的关键前体,它进一步参与酪氨酸代谢,可以产生黑色素。阿魏酸酯酶可以催化阿魏酸酯水解生成阿魏酸,阿魏酸可以进一步生成香草醛、愈创木酚等多种酚类物质[22]。高产胞外蛋白酶的微生物,其强大的水解酶系统可以将原料中的蛋白质分解成小分子的氨基酸,供其他微生物利用,同样能在大曲中产生的酚类化合物,如4-乙基愈创木酚、4-甲基愈创木酚等[28]。既是芳香物质,又是酶促褐变底物的酚类化合物的产生有助于促进酶促褐变,进而促进黑曲的形成。因此,大曲发酵过程中代谢产生的酶类以及相关产物在大曲的品质和曲种形成中扮演着重要的角色,通过调控这些酶类的活性和产物的生成,可以影响大曲的特性和发酵过程的效果。
1.5 功能微生物
在高温大曲发酵的初期,细菌起着至关重要的作用。细菌在这一阶段提供了酿造所需的酸性环境,同时产生了多种酶,如蛋白酶、脂肪酶、糖化酶和纤维素酶等,其影响酶促褐变反应和非酶促褐变反应,导致大曲颜色发生变化[29-32]。DENG等[23]研究表明,长时间的高温阶段导致嗜热真菌属(Thermomyces)和嗜热子囊菌属(Thermoascus)等嗜热菌属存活,这些耐热菌属在黑曲中的优势地位还增加了耐热酶的活性,加强了美拉德和焦糖化反应,形成了许多黑色或深棕色化合物。黑曲和黄曲中还存在许多耐高温细菌,有研究表明糖多孢菌属(Saccharopolyspora)与大曲温度呈正相关,随着发酵温度升高,美拉德反应越强烈[33],产生的类黑素越多,使得黄曲和黑曲的颜色逐渐加深。郑磊等[34]在模拟大曲褐变的过程中,研究了产酱香功能芽孢杆菌漆酶活性与曲料褐变之间的关系,漆酶活性与大曲褐变程度呈显著相关,大曲中的多酚类化合物在芽孢杆菌漆酶的作用下会发生氧化反应,同时能在小分子介体物质的存在下氧化酪氨酸产生褐色物质。虽然功能微生物并不直接参与大曲颜色的形成,但它们的代谢产物能够促进大分子物质的降解,为美拉德反应提供给更多的前体物质,促进美拉德反应的进行,产生更多的黑色物质,从而导致大曲颜色加深。张运祺等[35]成功从高温大曲中分离出一株产淀粉酶和蛋白酶的嗜热芽孢杆菌,并对其生长和产酶特性进行了详细研究,为深入探索微生物代谢产物在催化美拉德反应中的应用,以及生成不同颜色和风味的大曲提供了重要的科学依据和技术支持。
2 不同颜色高温大曲特性差异分析
2.1 理化性质和酶活性
高温大曲的酸度、水分、淀粉、还原糖、液化力、糖化力、酯化力、发酵力、蛋白酶活力和氨基酸态氮等理化指标是衡量大曲品质好坏的重要依据。酸度对微生物的生长具有双重影响,适当的酸度可以抑制一些杂菌的生长,因为这些杂菌可能对酸性环境较为敏感,但过高的酸度会对微生物的生长繁殖产生不利影响;过高的水分含量会使大曲容易生霉,这是因为霉菌在潮湿的环境中更容易生长和繁殖,会导致大曲质量的降低;还原糖的含量是评价大曲质量好坏的关键;淀粉的高消耗率能够促进微生物的繁殖和代谢活动,使代谢产物更加丰富多样,从而影响大曲的品质;糖化力衡量了淀粉在糖化酶作用下酶解生成葡萄糖的能力,反映大曲中微生物对酿酒原料淀粉的利用效率;液化力是指酶能够分解淀粉,并将其转化为可发酵糖类的能力[9];酯化力反映大曲的产酯能力;发酵力是指微生物(如酵母菌、细菌等)在发酵过程中将糖类物质转化为酒精、酸类、气体等产物的能力,这种能力是衡量微生物发酵性能的一个重要指标;蛋白酶活力反映了蛋白质的降解速率,进而关联着氨基酸的生成量[36];氨基酸态氮是指在生物体内以氨基酸形式存在的氮元素。这种形式的氮是蛋白质分解的直接产物,因此它与蛋白酶活力和产酸微生物的代谢密切相关。
唐佳代等[9]对贵州省仁怀市不同感官特性大曲理化性质的对比分析发现,黑曲酸度最高,黄曲酸度最低;黄曲在液化力、发酵力和酯化力方面表现最佳,白曲糖化力最强,黑曲液化力和糖化力最低。何猛超等[37]指出,茅台地区的白曲发酵力弱但酯化力和糖化力强,黄曲各理化指标适中,黑曲发酵力突出但其他指标最低。研究还发现黑、白、黄3种颜色高温大曲的理化性质和酶活性会随着地域的不同而有所变化。王颖等[38]发现,赤水河上游黑曲酸度高达3.75 mmol/10 g,但氨基酸态氮、中性蛋白酶活力、糖化酶活力、酯化力和糖化力最低。中下游黄曲的氨基酸态氮最高,上游白曲的氨基酸态氮最高。两个地区的白曲在中性蛋白酶活力、糖化酶活力、酯化力和糖化力方面表现最佳,中下游产区的大曲中性蛋白酶活力和酯化力、糖化力均高于上游产区。DENG等[23]等比较了不同颜色大曲8种理化特性的差异。其中,白曲的蛋白酶活力最高(168.06 U/g),酸度最低;黑曲的蛋白酶活力最低,酸度最高;除了酯化能力和氨基酸态氮较高外,黄曲的其他理化性质适中,这些结果间接反映了高温大曲微生物的丰度和代谢。从整体水平来看,白曲和黄曲的酶活性较高。其中,白曲中的糖化酶活力明显高于黑曲和黄曲,具有很强的糖化能力,有助于提高对大曲淀粉的利用率,促进葡萄糖的生成;白曲中的蛋白酶活力同样远高于其他酶,蛋白酶可以促进蛋白质利用,并进一步形成氨基酸[39]。白曲的高糖化力和一定耐酸性,以及与产酒酵母的协同作用,是提高酒类产品质量和产量的重要因素。通过合理使用白曲,可以优化酿酒工艺,提高经济效益。
2.2 微生物组成
高温大曲在开放式的环境中生产,受到发酵温度、贮存时间和贮存环境等因素的影响,大曲微生物的多样性和群落结构存在差异[40-43]。温度被认为是大曲发酵过程中驱动群落演替和组装的关键因素[44]。HUANG等[44]研究发现高温大曲的生物标志物为短杆菌属(Brevibacterium)、链霉菌属(Streptomyces)和小囊菌属(Microascus)。通过对大曲发酵过程中微生物群落结构和功能的深入解析,不仅可以揭示发酵机制,还可以通过合理调控微生物群落,优化发酵过程,控制黑、黄、白曲的生成,提升酱香型白酒的品质和风味。这一研究对于推动传统酿造工艺的现代化和产业升级具有重要意义[45-46]。
近年来,微生物群落研究主要依赖于先进的微生物组学技术,这些技术无需依赖传统的微生物培养方法,即可深入分析和理解复杂的微生物群落。主要研究方法包括宏基因组学、宏转录组学和宏蛋白质组学等。查阅近年来黑、黄、白色高温大曲微生物群落相关文献,我们将不同颜色大曲微生物相对丰度排名前5且丰度>1%列为优势微生物(真菌、细菌分别统计)[6-9,23,37,47-56],进一步统计了不同菌属在文献中作为优势微生物的出现频次(图2),并将其中出现频次>1的菌属用作韦恩图可视化分析(图3)。结果表明,在真菌水平上,黑曲、黄曲和白曲共有的微生物包括嗜热子囊菌属(Thermoascus)、曲霉菌属(Aspergillus)、嗜热真菌属(Thermomyces)、丝衣霉菌属(Byssochlamys)和罗萨氏菌属(Rasamsonia),它们均为具有耐热性或嗜热性的丝状真菌。此外,白曲中存在3种特有的真菌,分别为覆膜孢酵母属(Saccharomycopsis)、红曲霉属(Monascus)以及根毛霉属(Rhizomucor)。在细菌水平上,黑曲、黄曲和白曲共有的微生物包括芽孢杆菌属(Bacillus)、克罗彭斯特菌属(Kroppenstedtia)、葡萄球菌属(Staphylococcus)、枝芽孢杆菌属(Virgibacillus)、岩石芽孢杆菌属(Scopulibacillus)、糖多孢菌属(Saccharopolyspora)、慢生芽孢杆菌属(Lentibacillus)和高温放线菌属(Thermoactinomyces)。除糖多孢菌属(Saccharopolyspora)外,其余7种细菌均属于芽孢杆菌目(Bacillales),该类群通常表现出较高的耐热性。此外,白曲中存在2种特有的细菌,分别是乳杆菌属(Lactobacillus)和魏斯氏菌属(Weissella)。它们均属于乳酸菌,该类群通常表现出嗜温性。总的来说,3种颜色大曲在主要微生物种类上存在较多交叠,整体相似性较高,尤其在黑曲和黄曲中,优势菌属几乎一致。研究发现,黑曲和黄曲的微生物群落差异主要体现在不同类群的分布丰度上[6]。相比之下,白曲中含有更多特有菌属,其微生物群落组成与黑曲和黄曲相比存在明显分化。
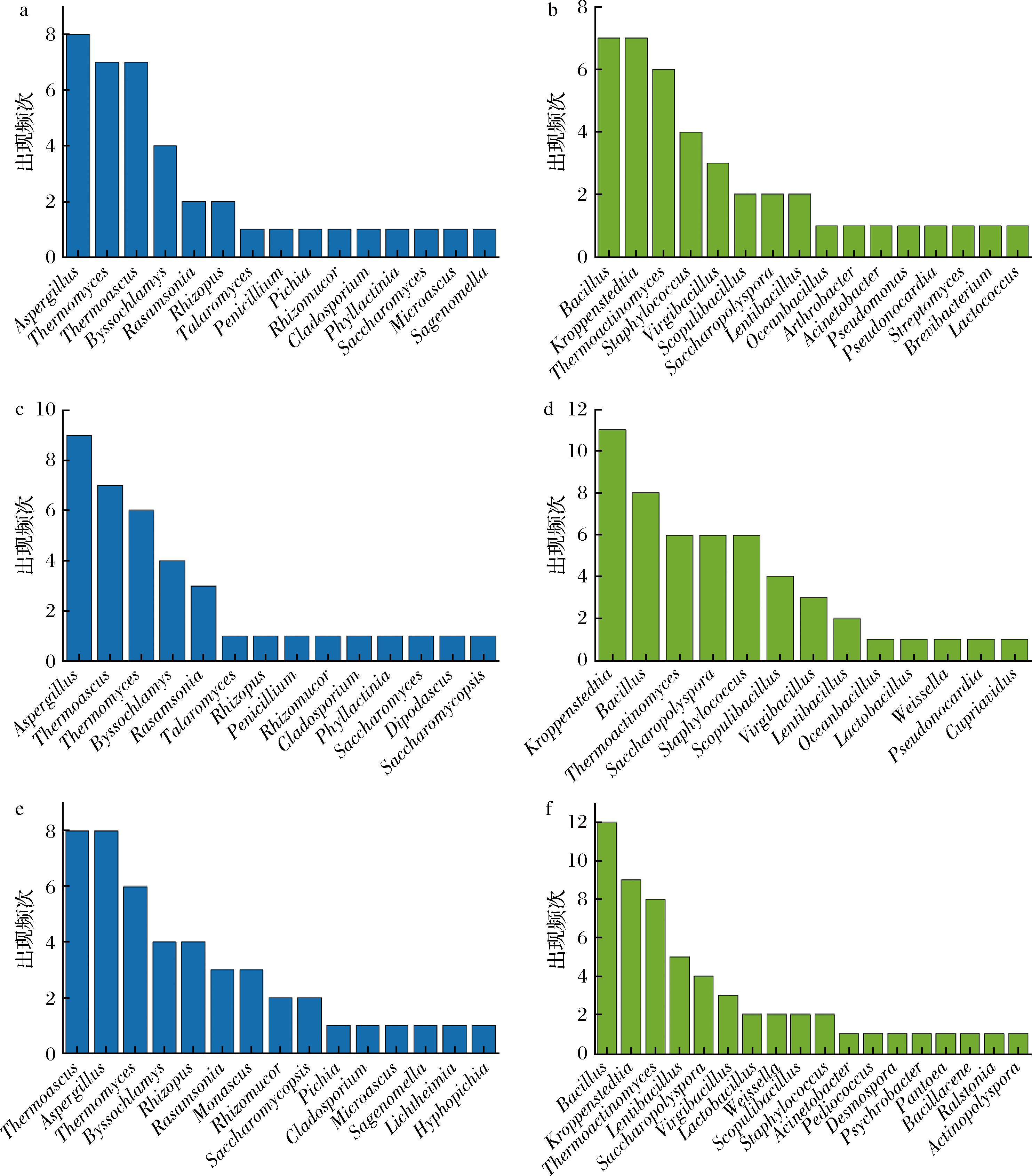
a-黑曲真菌群落;b-黑曲细菌群落;c-黄曲真菌群落;d-黄曲细菌群落;e-白曲真菌群落;f-白曲细菌群落
图2 不同颜色高温大曲的优势微生物
Fig.2 The dominant microbial genera in high-temperature Daqu of different colors
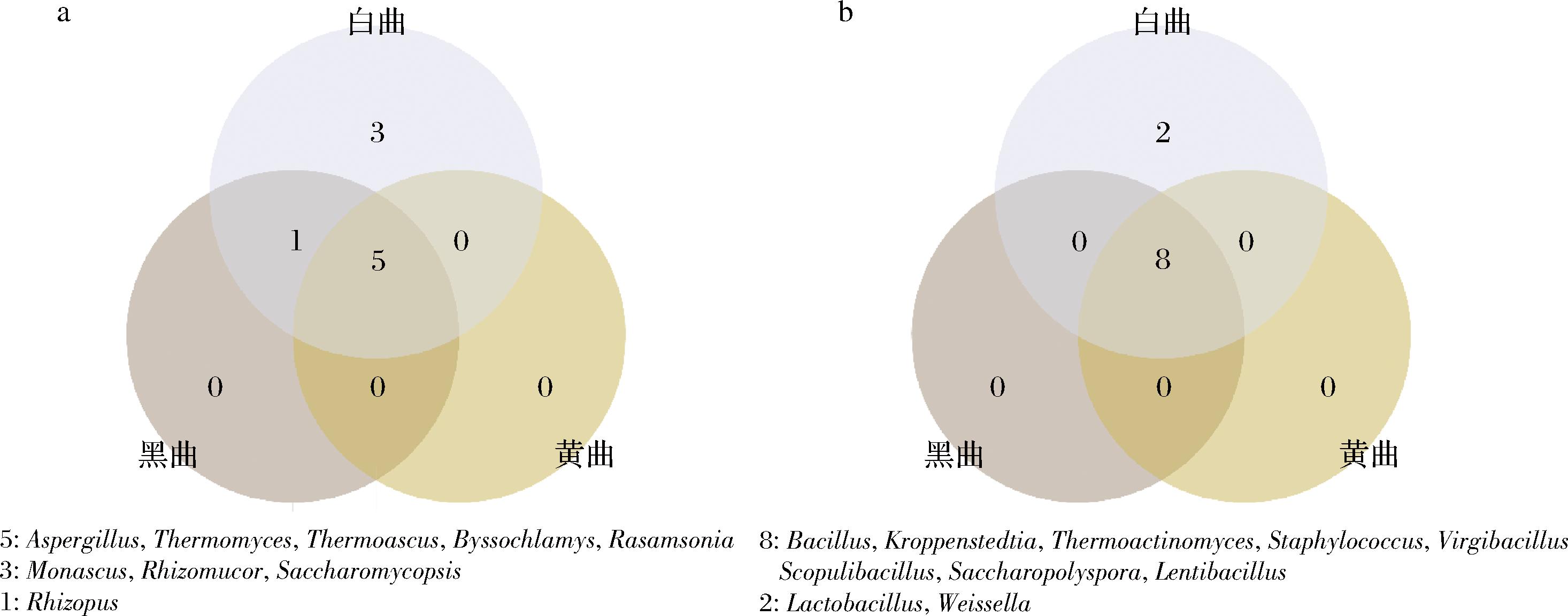
a-真菌;b-细菌
图3 不同颜色高温大曲优势菌属韦恩图
Fig.3 Venn diagram of dominant microbial genera in high temperature Daqu of different colors
YANG等[57]研究了异质环境对传统固态发酵过程中微生态建立的影响,揭示高温生产过程中微生态分化的机制,随着制曲过程的进行,曲房内不同地点的微生态差异日益明显。pH、温度、湿度和酸度与不同地点微生物群落的相互作用逐渐促进了高温大曲的微生态分化。这种变化最终导致了大曲表型的多样化,其显著特征是黑曲、黄曲和白曲的出现。SHI等[8]研究了发酵过程中由于车间不同位置的环境异质性导致的黑、白、黄曲微生物的差异。在细菌水平上,γ-变形菌纲(γ-Proteobacteria)、芽孢杆菌纲(Bacilli)和放线菌纲(Actinomycetia)分别显著富集于白曲、黄曲和黑曲。白曲在属水平上的生物标志物包括海洋芽孢杆菌属(Oceanobacillus)、泛菌属(Pantoea)、魏斯氏菌属(Weissella)和芽孢杆菌属(Bacillus)等;黄曲中的生物标志物是嗜热子囊菌属(Thermoascus)和岩石芽孢杆菌属(Scopulibacillus);黑曲中包括克罗彭斯特菌属(Kroppenstedtia)、葡萄球菌属(Staphylococcus)、棒状杆菌属(Corynebacterium)、短杆菌属(Brevibacterium)和小囊菌属(Microascus)。在基因层面上,不同颜色高温大曲也存在显著差异[6, 58]。研究发现,不同地区由于环境不同,不同颜色大曲的微生物群落组成也存在一定的差异[47]。PANG等[7]通过功能预测分析发现,白曲和黄曲富含编码细菌酶的基因,与克罗彭斯特菌属(Kroppenstedtia)相关,可能在淀粉和蛋白质的降解等方面发挥作用,黑曲富含编码真菌酶基因,与嗜热真菌属(Thermomyces)相关,嗜热真菌属(Thermomyces)具有良好的热稳定性和在各种恶劣环境下生存的高活力,并可以在60 ℃以上的温度下存活。此外,ZHAO等[59]利用定量宏蛋白质组学揭示了不同颜色大曲微生物群落组成随季节发生变化。春季和秋季的黄曲主要以克罗彭斯特菌属(Kroppenstedtia)、海洋芽孢杆菌属(Oceanobacillus)和曲霉菌属(Aspergillus)为主;夏季黄曲主要包含海洋芽孢杆菌属(Oceanobacillus)、曲霉菌属(Aspergillus)和高温放线菌属(Thermoactinomyces)。春季和夏季黑曲主要以克罗彭斯特菌属(Kroppenstedtia)、海洋芽孢杆菌属(Oceanobacillus)和曲霉菌属(Aspergillus)为主;秋季黑曲主要以克罗彭斯特菌属(Kroppenstedtia)、曲霉菌属(Aspergillus)和罗萨氏菌属(Rasamsonia)为主。
总的来说,不同颜色高温大曲中微生物群落的差异可能受地域、季节气候、温度、湿度等环境因素的影响,而不同的微生物群落结构和功能必然会影响到大曲的发酵效率和最终品质。
2.3 风味成分
大曲发酵是一个复杂的多阶段生物化学过程,原料的分解和多种微生物的代谢,产生了丰富多样的风味物质及其前体物,这些物质共同构成了大曲独特的风味和品质。不同类型的大曲中含有不同的化合物,这些化合物的含量和种类影响了大曲的风味特性。其中,酯类、醇类、酸类、醛类、酮类、呋喃类、吡嗪类和酚类是高温大曲中重要的风味成分。WU等[60]确定了8种物质,包括四甲基吡嗪、三甲基吡嗪、2,3-二甲基-5-乙基吡嗪、3-羟基-2-丁酮、2,3-二甲基吡嗪、苯甲醛、乙酸和异戊酸,均为高温下的特征化合物。高温大曲产生的风味物质会随着一同入窖,为酱香型白酒酒体风格的形成提供了物质基础。
酯类通常被认为是白酒花香和果香的主要贡献者。TANG等[61]研究明确了丙烯酸丁酯和(2E)-2-辛醛是产生花香和果香味的重要因素。PANG等[7]研究报道黄曲中酯的含量最高,白曲中酯的含量最低;黄曲和黑曲中乙酸乙酯的含量均显著高于白曲;此外,黄曲中苯乙酸乙酯和十六酸乙酯的含量也最高。醇类化合物在白酒中扮演着重要角色,它们对酒的口感和风味有着显著的贡献,多数具有甜味。黄曲和黑曲的乙醇含量显著高于白曲。其中,黄曲中的苯乙醇含量最高;白曲中的2,3-丁二醇、壬醇、十一烷醇和十六烷醇的含量最高;3-甲基-2-丁醇和丁二醇仅存在于黑曲;此外,醇类物质在贮存过程中逐渐降低,可能是醇类物质参与了酯化反应的原因[62]。酸类化合物,往往是由大曲发酵的过程中产酸细菌代谢而产生,带有一定的刺激性气味。乙酸和戊酸是黄曲的特征物质(P<0.05)。乙酸通过与醇类物质进行酯化反应,可以生成各种酯类化合物,其中乙酸乙酯是最常见的一种,对白酒的特殊风味有着极其重要的影响[39]。
吡嗪类化合物在大曲发酵中积累,为最终的产品提供了焦香味、烘焙味等复杂的风味特征。吡嗪类化合物为三种大曲的优势挥发性化合物,主要包括2,6-二甲基吡嗪、2,5-二甲基吡嗪和四甲基吡嗪。黑曲和黄曲的吡嗪类含量最多,白曲的吡嗪类含量最少。其中,又以四甲基吡嗪的含量最多,占总吡嗪的31%~46%[7]。但是,DONG等[63]研究发现白曲和黑曲吡嗪含量均高于黄曲中吡嗪的含量。3-苯基呋喃和2-呋喃醛是美拉德反应的产物,黑曲中呋喃的总浓度显著高于黄曲和白曲,而白曲中仅检测到2-戊基呋喃。2-糠醛具有杏仁香味,是大曲和白酒中常见的风味物质,它在黑曲中的浓度高于白曲和黄曲,是黑曲的标志物质[64]。吡嗪类和呋喃类是酱香型大曲美拉德反应的主要产物,黑曲由于其独特的微生物生态和代谢过程,能够产生更多种类和更复杂的杂环化合物和类黑素。这些化合物的多样性不仅增加了黑曲的风味层次,还可能赋予其更为浓郁、复杂的香气。同时,较高的类黑素含量使得黑曲在视觉上呈现出更深的颜色。ZHU等[1]采用Py-GC/MS分析了类黑素的热解化合物,类黑素在经过热解反应后,其分解产物主要由以下几类杂环化合物构成:呋喃类、吡嗪类、吡咯类、吲哚类、酚类和吡喃类等。在这些产物中,吡咯类、吡嗪类、呋喃类、酚类和吲哚类物质的含量尤为突出,但它们在3种不同颜色大曲中的含量分布却差异明显。
此外,CAI等[52]利用电子舌和电子鼻对3种颜色高温大曲的感官和风味特征进行了研究,白曲和黑曲感官特征以酸味、苦味、涩味、浓郁度为主,黄曲感官特征以咸味、鲜味为主,黑曲中富集甲烷脂肪族、氢和芳香族化合物,白曲和黄曲中富集甲烷、醇类、酮类、氮氧化物和含硫有机化合物。HOU等[65]通过电子鼻检测发现芳香族化合物在黄曲中含量较低,在黑曲中含量较高,含硫化合物、氮氧化物和甲烷脂肪族化合物在黄曲中含量较高,在黑曲含量较低。综上所述,不同颜色大曲中风味化合物在含量和种类上存在差异,反映了其风味的多样性。这些差异源于微生物种类、发酵条件以及储存时间等因素,是形成白酒独特风味和口感的关键因素。
3 结论和展望
本文对黑、白、黄3种颜色的高温大曲进行了详细阐述,并对可能影响黑、白、黄曲形成的因素进行了整理归纳。目前,许多研究认为美拉德反应是导致高温大曲外观色泽差异最重要的因素之一。高温大曲的制曲环境包括温度、湿度、通风等因素,为美拉德反应提供了有利条件,适宜的制曲环境能够促进原料中氨基酸和还原糖的反应,有利于美拉德反应产物的形成,从而影响最终大曲的风味和色泽。功能微生物在高温大曲中同样起着重要作用,它们通过间接影响美拉德反应的进行,促进高温大曲的发酵过程和大曲质量的提升。
目前已有研究验证了不同颜色大曲对酱香型白酒的影响,安凯园等[66]研究了黑、白、黄曲对不同轮次酱酒的影响,在第一轮次中,黑曲发酵酒样的正丙醇高于其他颜色大曲,可以减少黑曲的使用量以降低酒样中正丙醇含量,在最后一个轮次中,白曲发酵的酒样的风味物质含量最高,因此可以适当增加白曲的比例以提高酒的风味。未来应更进一步研究如何通过影响制曲环境、生产工艺、非酶促褐变、酶促褐变、和功能微生物来调控不同颜色高温大曲的形成。此外,随着白酒行业机械化、智能化时代的到来,当机械操作代替传统操作,其环境条件和生产工艺会发生变化,对于不同颜色高温大曲形成机理的解析,将有助于优化高温大曲的机械化生产工艺,并为保障和提高酱香型白酒的品质和口感、满足消费者对于酱香型白酒的需求提供思路。
[1] ZHU Q, CHEN L Q, PU X X, et al.The differences in the composition of Maillard components between three kinds of sauce-flavor Daqu[J].Fermentation, 2023, 9(9):860.
[2] 张春林. 泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学, 2012.ZHANG C L.The relationship between quality, microorganisms ang flavour componets of Luzhou Laojiao Daqu[D].Wuxi:Jiangnan University, 2012.
[3] 刘光钱. 母曲添加量对高温大曲微生物群落动态演变和风味物质的影响研究[D].重庆:重庆大学, 2021.LIU G Q.Study on effects of additional amounts of mature daqu on microbial community dynamics and flavor compounds during high-temperature Daqu fermentation[D].Chongqing:Chongqing University, 2021.
[4] 杜向军, 明红梅, 马浩, 等.机制与人工大曲曲块部位间微生物群落结构差异及其关键影响因素[J].食品与发酵工业, 2023, 49(3):83-91.DU X J, MING H M, MA H, et al.Microbial community structure differences and key influencing factors among different parts of mechanical and artificial Daqu[J].Food and Fermentation Industries, 2023, 49(3):83-91.
[5] GAN S H, YANG F, SAHU S K, et al.Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor starters[J].Frontiers in Microbiology, 2019, 10:1540.
[6] WANG Y R, CAI W C, WANG W P, et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Science &Nutrition, 2021, 9(2):1003-1016.
[7] PANG Z M, LI W W, HAO J, et al.Correlational analysis of the physicochemical indexes, volatile flavor components, and microbial communities of high-temperature Daqu in the northern region of China[J].Foods, 2023, 12(2):326.
[8] SHI W, CHAI L J, FANG G Y, et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Research International, 2022, 156:111298.
[9] 唐佳代, 刘力萍, 龙亚飞, 等.不同感官特性酱香大曲真菌群落结构与理化特性[J].食品科学, 2022, 43(14):193-198.TANG J D, LIU L P, LONG Y F, et al.Physicochemical characteristics and fungal community structure of different colored Jiang-flavor Daqu[J].Food Science, 2022, 43(14):193-198.
[10] XIAO C, LU Z M, ZHANG X J, et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J].Applied and Environmental Microbiology, 2017, 83(23):e01550-17.
[11] YI Z L, JIN Y L, XIAO Y, et al.Unraveling the contribution of high temperature stage to Jiang-flavor Daqu, a liquor starter for production of Chinese Jiang-flavor Baijiu, with special reference to metatranscriptomics[J].Frontiers in Microbiology, 2019, 10:472.
[12] 陈心雨, 刘念, 王超凯, 等.高温大曲中美拉德反应的研究进展[J].食品与发酵科技, 2023, 59(6):109-112.CHEN X Y, LIU N, WANG C K, et al.Research progress of Maillard reaction in high temperature Daqu[J].Food and Fermentation Science &Technology, 2023, 59(6):109-112.
[13] 崔利. 酱香型高温大曲的高温多水微氧或缺氧与曲药质量的关系[J].酿酒科技, 2007(4):76-79.CUI L.Correlations of high temperature, more water, minute oxygen and hypoxia of Maotai-flavor high temperature Daqu[J].Liquor-Making Science &Technology, 2007(4):76-79.
[14] MU Y, HUANG Y, LI D, et al.Revealing the comprehensive effect of mechanization on sauce-flavor Daqu through high-throughput sequencing and multi-dimensional metabolite profiling[J].Food Research International, 2024, 191:114645.
[15] SHI G L, FANG C, XING S, et al.Heterogenetic mechanism in high-temperature Daqu fermentation by traditional craft and mechanical craft:From microbial assembly patterns to metabolism phenotypes[J].Food Research International, 2024, 187:114327.
[16] 蒋英丽, 沈毅, 王西, 等.不同堆曲模式对酱香大曲质量的影响[J].中国酿造, 2023, 42(9):144-149.JIANG Y L, SHEN Y, WANG X, et al.Effect of different stacking patterns on the quality of Jiangxiang Daqu[J].China Brewing, 2023, 42(9):144-149.
[17] 李大鹏, 刘建华, 张晓山, 等.北大仓高温大曲不同培养方式的对比分析[J].酿酒, 2022, 49(4):109-112.LI D P, LIU J H, ZHANG X S, et al.Comparative analysis of different cultivation methods of high temperature Daqu[J].Liquor Making, 2022, 49(4):109-112.
[18] 胡宝东, 王晓丹, 王婧, 等.酱香型大曲生产工艺与大曲品质的关系研究[J].食品工业, 2016, 37(2):260-264.HU B D, WANG X D, WANG J, et al.Relationship between production technology of Maotai-flavor Daqu and its quality[J].The Food Industry, 2016, 37(2):260-264.
[19] 沈毅, 陈波, 张亚东, 等.影响高温大曲质量的关键控制点[J].酿酒科技, 2019(8):17-21.SHEN Y, CHEN B, ZHANG Y D, et al.Key control points to guarantee the quality of high-temperature Daqu[J].Liquor-Making Science &Technology, 2019(8):17-21.
[20] HASHIBA H.The browning reaction of amadori compounds derived from various sugars[J].Agricultural and Biological Chemistry, 1982, 46(2):547-548.
[21] RIZZI G P.Chemical structure of colored Maillard reaction products[J].Food Reviews International, 1997, 13(1):1-28.
[22] 罗帅. 酱香型大曲中黑曲形成机制及抑菌性能解析[D].无锡:江南大学, 2022, LUO S.Analysis of the formation and antibacterial properties of sauce-flavored Daqu-black Daqu[D].Wuxi:Jiangnan University, 2022.
[23] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Frontiers in Microbiology, 2020, 11:588117.
[24] NAMLI S, SUMNU S G, OZTOP M H.Microwave glycation of soy protein isolate with rare sugar (D-allulose), fructose and glucose[J].Food Bioscience, 2021, 40:100897.
[25] AND O L, WATSON M A.Effects of ascorbic acid on peroxidase and polyphenoloxidase activities in fresh-cut cantaloupe melon[J].Journal of Food Science, 2001, 66(9):1283-1286.
[26] MOON K M, KWON E B, LEE B, et al.Recent trends in controlling the enzymatic browning of fruit and vegetable products[J].Molecules, 2020, 25(12):2754.
[27] PARAVISINI L, PETERSON D G.Mechanisms non-enzymatic browning in orange juice during storage[J].Food Chemistry, 2019, 289:320-327.
[28] 刘青阳, 黄晓宁, 陆玮, 等.中高温大曲中芽孢杆菌多样性及代谢特征研究[J].中国酿造, 2022, 41(7):26-31.LIU Q Y, HUANG X N, LU W, et al.Diversity and metabolic characteristics of Bacillus strains isolated from medium-high temperature Daqu[J].China Brewing, 2022, 41(7):26-31.
[29] 任爱容, 黄永光.茅台镇不同主酿区域酱香型白酒酿造大曲中细菌菌群结构分析[J].食品科学, 2021, 42(4):167-174.REN A R, HUANG Y G.Analysis of bacterial community structure in daqu of Maotai-flavor liquor in different main brewing regions in Maotai Town[J].Food Science, 2021, 42(4):167-174.
[30] 王小平, 黄永光, 周文美.酱香型白酒大曲细菌菌群结构及功能研究进展[J].中国酿造, 2020, 39(2):19-25.WANG X P, HUANG Y G, ZHOU W M.Research progress on structure and function of bacterial community in Moutai-flavor Baijiu Daqu[J].China Brewing, 2020, 39(2):19-25.
[31] CAI H Y, ZHANG T, ZHANG Q, et al.Microbial diversity and chemical analysis of the starters used in traditional Chinese sweet rice wine[J].Food Microbiology, 2018, 73:319-326.
[32] LIU X, GUO K L, ZHANG H X.Determination of microbial diversity in Daqu, a fermentation starter culture of Maotai liquor, using nested PCR-denaturing gradient gel electrophoresis[J].World Journal of Microbiology &Biotechnology, 2012, 28(6):2375-2381.
[33] JIANG Q E, WU X Y, XU Y Q, et al.Microbial composition and dynamic succession during the Daqu production process of Northern Jiang-flavored liquor in China[J].3 Biotech, 2021, 11(5):224.
[34] 郑磊, 柴锟, 谢和.产酱香功能芽孢杆菌漆酶活性与曲料褐变的相关性[J].贵州农业科学, 2014, 42(11):170-175.ZHENG L, CHAI K, XIE H.Correlation between browning of fermented soybean and laccase activity of Bacillus strains with producing Maotai-flavor function[J].Guizhou Agricultural Sciences, 2014, 42(11):170-175.
[35] 张运祺, 郑自强, 邢浩博, 等.一株嗜热脂肪芽孢杆菌的筛选及其产酶特性研究[J].酿酒科技, 2023(5):78-84.ZHANG Y Q, ZHENG Z Q, XING H B, et al.Screening of a Geobacillus stearothermophilus strain and study on its enzyme-producing characteristics[J].Liquor-Making Science &Technology, 2023(5):78-84.
[36] 申孟林, 张超, 王玉霞, 等.白酒大曲微生物酶系研究进展[J].中国酿造, 2018, 37(4):7-11.SHEN M L, ZHANG C, WANG Y X, et al.Research progress on microbial enzyme system in Baijiu Daqu[J].China Brewing, 2018, 37(4):7-11.
[37] 何猛超, 任义平, 熊林, 等.茅台地区不同高温大曲微生物群落结构解析[J].中国酿造, 2022, 41(6):51-57.HE M C, REN Y P, XIONG L, et al.Microbial community structure of different high-temperature Daqu in Maotai area[J].China Brewing, 2022, 41(6):51-57.
[38] 王颖, 邱勇, 王隆, 等.不同产区酱香型高温大曲黑、白、黄曲的理化、挥发性成分差异性分析[J].中国调味品, 2022, 47(6):155-159.WANG Y, QIU Y, WANG L, et al.Analysis on the differences of physicochemical indexes and volatile components of black, white and yellow koji at high temperature with Maotai flavor in different production areas[J].China Condiment, 2022, 47(6):155-159.
[39] 柳习月, 朱琪, 杨帆, 等.多组学解析酱香型大曲风味物质的形成[J].食品与发酵工业, 2021, 47(22):35-41.LIU X Y, ZHU Q, YANG F, et al.Multi-omics reveal the formation of flavor compounds in sauce-flavor Daqu[J].Food and Fermentation Industries, 2021, 47(22):35-41.
[40] 赵驰, 苏伟, 母应春, 等.不同原料对酱香大曲微生物群落结构及多样性的影响[J].食品科学, 2022, 43(10):133-141.ZHAO C, SU W, MU Y C, et al.Effects of different raw materials on microbial community structure and diversity in Jiang-flavor Daqu[J].Food Science, 2022, 43(10):133-141.
[41] 朱治宇. 茅台镇酱香型白酒酿造区域霉菌多样性特征研究[D].贵阳:贵州大学, 2020.ZHU Z Y.Study on the characteristics of mold diversity in Maotai town sauce-flavor liquor brewing area[D].Guiyang:Guizhou University, 2020.
[42] FU G M, DENG M F, CHEN Y, et al.Analysis of microbial community, physiochemical indices, and volatile compounds of Chinese te-flavor Baijiu daqu produced in different seasons[J].Journal of the Science of Food and Agriculture, 2021, 101(15):6525-6532.
[43] LIU P H, ZHANG L H, DU X W, et al.Dynamic analysis of physicochemical and biochemical indices and microbial communities of light-flavor daqu during storage[J].Journal of the American Society of Brewing Chemists, 2019, 77(4):287-294.
[44] HUANG Y, LI D, MU Y, et al.Exploring the heterogeneity of community and function and correspondence of “species-enzymes” among three types of Daqu with different fermentation peak-temperature via high-throughput sequencing and metagenomics[J].Food Research International, 2024, 176:113805.
[45] HUANG Y H, YI Z L, JIN Y L, et al.New microbial resource:Microbial diversity, function and dynamics in Chinese liquor starter[J].Scientific Reports, 2017, 7(1):14577.
[46] JIN Y, LI D Y, AI M, et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Research International, 2019, 121:422-432.
[47] 侯强川, 王玉荣, 王文平, 等.茅台和尧治河高温大曲细菌群落结构差异及功能预测[J].食品与发酵工业, 2022, 48(1):36-44.HOU Q C, WANG Y R, WANG W P, et al.Difference of bacterial community structure and functional prediction in high-temperature Daqu of Maotai and Yaozhihe[J].Food and Fermentation Industries, 2022, 48(1):36-44.
[48] 黄魏, 李浪金, 谢丹, 等.3种高温大曲发酵过程中细菌群落结构演替规律[J].食品研究与开发, 2023, 44(22):155-162.HUANG W, LI L J, XIE D, et al.Investigation of bacterial community structure succession during the fermentation of three types of high-temperature Daqu[J].Food Research and Development, 2023, 44(22):155-162.
[49] 王玉荣, 侯强川, 田龙新, 等.高温大曲真菌群落结构及其感官特性解析[J].食品与发酵工业, 2024, 50(15):56-62.WANG Y R, HOU Q C, TIAN L X, et al.Analysis of the fungal communities and sensory characteristics of high-temperature Daqu[J].Food and Fermentation Industries, 2024, 50(15):56-62.
[50] 向凡舒, 蔡文超, 田龙新, 等.襄阳地区高温大曲真菌群落结构及其风味品质解析[J].食品科学, 2023, 44(24):211-219.XIANG F S, CAI W C, TIAN L X, et al.Analysis of fungal community structure and flavor quality of high-temperature Daqu from Xiangyang, China[J].Food Science, 2023, 44(24):211-219.
[51] 张芮, 刘文虎, 张立强, 等.基于宏基因组学解析高温大曲微生物群落与功能的异质性[J].酿酒科技, 2023(5):70-77.ZHANG R, LIU W H, ZHANG L Q, et al.Analysis of microbial community and functional heterogeneity of high-temperature Daqu based on metagenomics[J].Liquor-Making Science &Technology, 2023(5):70-77.
[52] CAI W C, XUE Y A, WANG Y R, et al.The fungal communities and flavor profiles in different types of high-temperature Daqu as revealed by high-throughput sequencing and electronic senses[J].Frontiers in Microbiology, 2021, 12:784651.
[53] GE D Y, CAI W C, GUO Z, et al.Comparative analysis of bacterial community structure and physicochemical quality in high-temperature Daqu of different colors in Qingzhou production area[J].Heliyon, 2024, 10(11):e31718.
[54] GUO Z, XIANG F S, HOU Q C, et al.Analysis of bacterial community structure and taste quality of different colored high-temperature Daqu in the Xiangyang region, China[J].LWT, 2023, 188:115411.
[55] WU X Y, JING R X, CHEN W H, et al.High-throughput sequencing of the microbial diversity of roasted-sesame-like flavored Daqu with different characteristics[J].3 Biotech, 2020, 10(11):502.
[56] 蒋倩儿, 陈文浩, 孙金沅, 等.酱香型白酒大曲微生物研究进展[J].中国酿造, 2021, 40(12):1-5.JIANG Q E, CHEN W H, SUN J Y, et al.Research progress on microorganism of sauce-flavor Baijiu Daqu[J].China Brewing, 2021, 40(12):1-5.
[57] YANG L, FAN W L, XU Y.Qu-omics elucidates the formation and spatio-temporal differentiation mechanism underlying the microecology of high temperature Daqu[J].Food Chemistry, 2024, 438:137988.
[58] 薄涛, 吕娜, 杨凯环, 等.白酒大曲发酵过程中微生物群落及功能研究进展[J].食品科学, 2023, 44(19):385-393.BO T, LÜ N, YANG K H, et al.Recent advances in understanding the composition and functions of microbial community in the fermentation of Baijiu Daqu[J].Food Science, 2023, 44(19):385-393.
[59] ZHAO J Z, YANG Y, CHEN L Q, et al.Quantitative metaproteomics reveals composition and metabolism characteristics of microbial communities in Chinese liquor fermentation starters[J].Frontiers in Microbiology, 2023, 13:1098268.
[60] WU S L, DU H, XU Y.Daqu microbiota adaptability to altered temperature determines the formation of characteristic compounds[J].International Journal of Food Microbiology, 2023, 385:109995.
[61] TANG P, WANG L Q, ZHAO Q, et al.Characterization of key aroma compounds and relationship between aroma compounds and sensory attributes in different quality of high temperature Daqu[J].LWT, 2024, 194:115801.
[62] 沈世明, 张娇娇, 张高瑜, 等.酱香型大曲贮存过程曲香风味物质变化的分析[J].中国酿造, 2022, 41(7):58-63.SHEN S M, ZHANG J J, ZHANG G Y, et al.Change of the flavor substances of sauce-flavor Daqu during the storage[J].China Brewing, 2022, 41(7):58-63.
[63] DONG W W, YU X, WANG L Y, et al.Unveiling the microbiota of sauce-flavor Daqu and its relationships with flavors and color during maturation[J].Frontiers in Microbiology, 2024, 15:1345772.
[64] LUO S, ZHANG Q L, YANG F, et al.Analysis of the formation of sauce-flavored Daqu using non-targeted metabolomics[J].Frontiers in Microbiology, 2022, 13:857966.
[65] HOU Q C, WANG Y R, QU D W, et al.Microbial communities, functional, and flavor differences among three different-colored high-temperature Daqu:A comprehensive metagenomic, physicochemical, and electronic sensory analysis[J].Food Research International, 2024, 184:114257.
[66] 安凯园, 王瑞鑫, 郭莹, 等.基于原位发酵探究不同颜色高温大曲对酱香型白酒发酵过程的影响[J].食品与发酵工业, 2025,51(9):160-168.AN K Y, WANG R X, GUO Y, et al.Exploring influence of different color Daqu on brewing process of Jiang-flavor liquor based on in-situ fermentation[J].Food and Fermentation Industries, 2025,51(9):160-168.