黑豆是一种药食同源[1]的豆科植物,含有多种人体所需营养物质和活性物质。黑豆分布范围广泛,在我国各地均有产区,黑豆的栽培最早可以追溯到秦汉至南北朝时期。黑豆营养价值丰富,广泛应用于营养保健食品、化工原料、饲料工业、化妆品、医药和其他方面。大量研究证实黑豆具有抗炎、抗氧化、抗肥胖等作用。
黑豆中的多酚和黄酮主要是花青素和异黄酮等。花青素属于类黄酮,是一种水溶性天然色素,主要存在于黑豆的种皮中。黑豆种皮中丰富的花色苷是黑豆区别于黄大豆的主要呈色物质。目前已经确定的天然花青素包括20多种,在食物中常见的有6种,即矢车菊色素、飞燕草色素、芍药色素、牵牛花色素、天竺葵色素和锦葵色素[2]。由于其稳定性差,自然界中通常很少存在游离的花青素,骨架上的3、5、7位与一个或多个糖(葡萄糖、鼠李糖、半乳糖、木糖、阿拉伯糖等)通过糖苷键结合形成花色苷,或与芳香酸或脂肪酸(香豆酸、阿魏酸、咖啡酸、对羟基苯甲酸等)形成酰化结构,例如羟基化、甲基化以及酰基化等修饰形成不同类型且结构复杂的花色苷。
糖基数量会影响花色苷的色调(蓝移),酰基化影响其明暗度,羟基化程度增加会破坏花色苷的稳定性(蓝移),甲氧基的取代破坏花色苷的稳定性[3]。不同食物来源花色苷的种类、含量、结构有所不同,见表1。推测其功能尤其是活性强弱也会有不同。
表1 不同食物来源花色苷的种类、含量及结构比较
Table 1 Comparison of types, contents, and structures of anthocyanins from different food sources
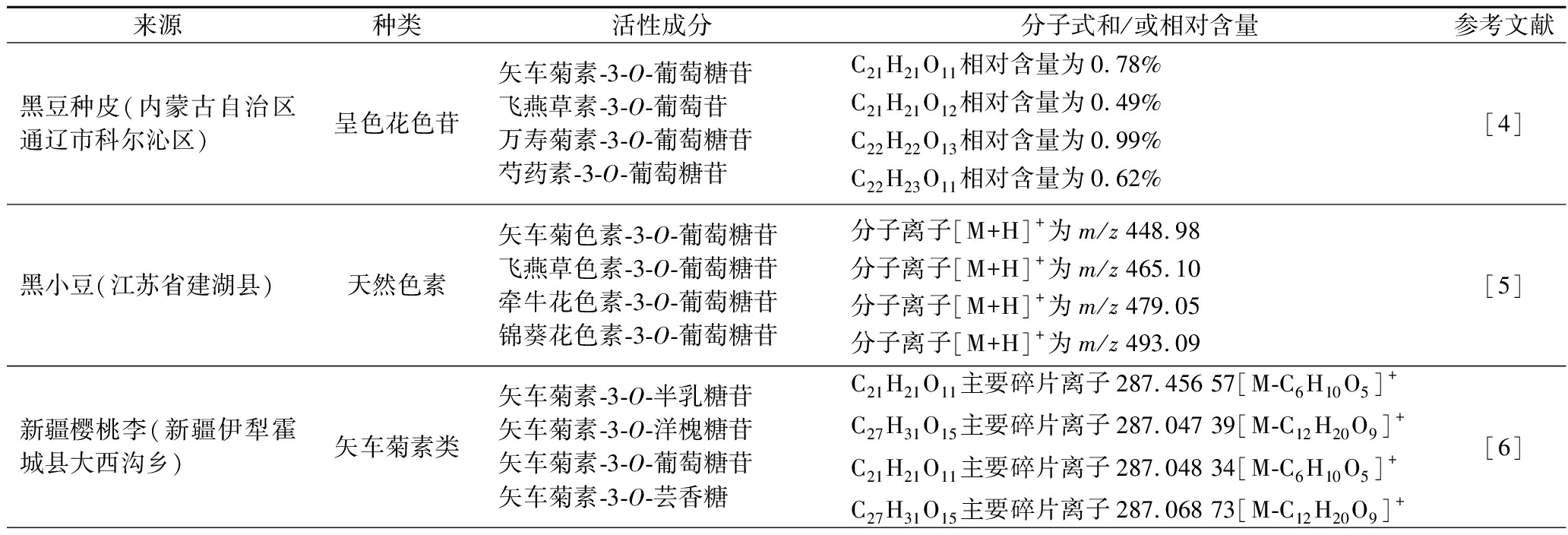
来源种类活性成分分子式和/或相对含量参考文献黑豆种皮(内蒙古自治区通辽市科尔沁区)呈色花色苷矢车菊素-3-O-葡萄糖苷飞燕草素-3-O-葡萄苷万寿菊素-3-O-葡萄糖苷芍药素-3-O-葡萄糖苷C21H21O11 相对含量为0.78%C21H21O12 相对含量为0.49%C22H22O13 相对含量为0.99%C22H23O11 相对含量为0.62%[4]黑小豆(江苏省建湖县)天然色素矢车菊色素-3-O-葡萄糖苷飞燕草色素-3-O-葡萄糖苷牵牛花色素-3-O-葡萄糖苷锦葵花色素-3-O-葡萄糖苷分子离子[M+H]+为m/z 448.98分子离子[M+H]+为m/z 465.10分子离子[M+H]+为m/z 479.05分子离子[M+H]+为m/z 493.09[5]新疆樱桃李(新疆伊犁霍城县大西沟乡)矢车菊素类矢车菊素-3-O-半乳糖苷矢车菊素-3-O-洋槐糖苷矢车菊素-3-O-葡萄糖苷矢车菊素-3-O-芸香糖C21H21O11 主要碎片离子287.456 57[M-C6H10O5]+C27H31O15 主要碎片离子287.047 39[M-C12H20O9]+C21H21O11 主要碎片离子287.048 34[M-C6H10O5]+C27H31O15 主要碎片离子287.068 73[M-C12H20O9]+[6]
续表1

来源种类活性成分分子式和/或相对含量参考文献黑果腺肋花楸新鲜果实(吉林省长春市双阳区)矢车菊素类天竺葵素类飞燕草素类芍药素类锦葵色素类矢车菊素-3-O-半乳糖苷矢车菊素-3-O-葡萄糖苷矢车菊素-3-O-木糖苷矢车菊素-3-O-阿拉伯糖苷(仅展示矢车菊素类)C21H21O11 分子离子[M]+449.103 8C21H21O11 分子离子[M]+449.103 8C20H19O10 分子离子[M]+419.098 7C20H19O10 分子离子[M]+419.098 7(仅展示矢车菊素类)[7]
炎症是有害刺激和条件下引发的反应,包括Ⅰ型炎症和Ⅱ型炎症。Ⅰ型炎症的特征是产生促炎细胞因子/趋化因子,Ⅱ型是产生Ⅰ型炎症消退趋化因子或抗炎细胞因子[8]。炎症可由多种原因引起或与一些疾病并发,如肥胖、神经系统疾病、糖尿病等。大量证据表明,许多植物[9]及其活性成分[10]具有抗炎治病作用。
目前为止,尽管已有大量关于黑豆种皮提取物治病抗炎作用的研究,但仍缺乏完整的归纳整理。本文综述黑豆种皮花色苷的提取及其在肥胖、糖尿病、脂肪肝、阿尔茨海默病(Alzheimer’s disease,AD)、炎性肠病、神经系统疾病等炎症性疾病中的应用,并展望未来热点和应用,为黑豆种皮花色苷的机制研究和应用提供参考依据。
1 花色苷提取
花色苷广泛存在于有色水果和蔬菜中,具有明显的抗肥胖、抗氧化、降糖、抗癌等功能。矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside chloride,C3G)和飞燕草素-3-O-葡萄糖苷(delphinidin-3-O-glucoside,D3G)是2种常见的花色苷,分别是矢车菊色素(Cy)和飞燕草色素(Dp)的矢糖基化形式,同时也是黑豆种皮中最常见的2种花色苷。
花色苷在自然条件下稳定性较差,易受pH值影响而发生降解[11]。为提高花色苷的稳定性,实验研究中常采用水、乙醇、甲醇、丙酮等作为提取溶剂,并通过调节溶剂体系的pH值来抑制花色苷的降解[12]。
目前已报道的黑豆种皮花色苷的提取方法包括超声法、微波法、酶提法、离子液体提取法,总结概括如下。
1.1 超声波提取法
超声波提取法通过超声波产生强烈的震动,使植物细胞壁破碎,从而达到提高花色素提取率的目的。采用超声波辅助提取可以缩短提取时间、减少溶剂消耗、提高得率,张利等[13]通过超声波辅助醇提法提取黑豆种皮花色苷提取率比普通醇提法高24.05%,在单因素试验基础上进行正交试验,最终花色苷提取率达到90.85%。
1.2 微波提取
微波提取法利用微波辐射破坏细胞,使有效成分在短时间内溶出。微波提取法设备简单、操作方便,李娟[14]采用微波辅助乙醇提取,用于探究不同浓度黑豆花青素提取对晶状体上皮细胞迁移的抑制作用。结果发现,抑制作用与浓度呈正相关,且随着作用时间延长,抑制效果越明显,证明黑豆花青素在抑制晶状体上皮细胞迁移方面具有潜在价值。
1.3 酶提取
酶提取法是酶解破坏植物细胞的纤维素、半纤维素、果胶等物质结构,使化合物更容易释放出来,从而提高提取率。张文莉等[15]采用超声波辅助纤维素酶法粗提黑豆种皮花色苷,D-101型大孔树脂纯化后花色苷含量为1.352 mg/g。
1.4 离子液体辅助提取
离子液体作为一种新型材料,是具有超强溶解性的绿色溶剂,被广泛应用于食品等领域[16]。离子液体易溶解于纤维素,能迅速破坏细胞壁,从而提高提取率。苏适等[17]和于德涵等[18]分别采用微波辅助离子液体1.0 mol/L 1-丁基-3-甲基咪唑氯和0.7 mol/L 1-己基-3-甲基咪唑溴盐提取黑豆皮花青素,响应曲面法优化得率分别为4.146和4.834 mg/g。通过超声辅助离子液体0.9 mol/L 1-己基-3-甲基咪唑溴盐[19]以及微波辅助离子液体1.0 mol/L 1-丁基-3-甲基咪唑氯盐[20]提取,黑豆皮花青素得率为4.12 mg/g和4.45%。
1.5 提取方法分析
花色苷提取方法各有优劣(表2)。采取多种方法相结合有望提高花色苷提取率和纯度。张芷瑜等[21]采用正交试验提取蓝莓果渣中花色苷,含量为1.294 mg/g,通过LK825型大孔树脂纯化,花色苷含量提高12.8倍。与传统提取法相比,张馨月等[22]以甜菜碱和柠檬酸制备酸性低共熔溶剂,使紫马铃薯花色苷含量提高56.92%。采用响应面法优化黑胡萝卜花色苷后,再通过AB-8型大孔树脂和葡聚糖凝胶纯化,含量由(4.048±0.12) mg/g达到359.694 mg/L,得到主要花色苷为:矢车菊素-3-木糖-葡萄糖苷和天竺葵素-3,5-二葡萄糖苷[23]。此外,还应控制提取过程中的pH值、光照和温度[3],以提高花色苷的稳定性。
表2 花色苷提取方法优劣分析
Table 2 Analysis of the advantages and disadvantages of anthocyanin extraction methods

提取方法优势劣势参考文献超声波辅助提取法提取时间短、消耗溶剂少、得率高,低提取温度有利于保护生物活性物质设备和工艺参数的研究不深入[24]酶提取法色素更容易释放出来,绿色、环保酶纯度、生产成本要求高[25]微波辅助提取法操作方便,提取时间短,耗能低,提取率更高条件不易获得[24]有机溶剂提取法提取率较高溶剂用量大,耗时长,成本高[26]离子液体提取法溶解性好,可选择性溶解目标物质,稳定性好,可调节黏度范围,易回收,环保等成本高,现有离子液体提取方法对于复杂物质的提取效率不高[27]
2 抗炎治病
细胞因子是炎症机制的关键参与者,由巨噬细胞和肥大细胞产生。炎性细胞因子激活内皮细胞和白细胞,诱导急性期反应。信号传感器和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是炎症重要的细胞内介质,核因子-κB(nuclear factor kappa B,NF-κB)是重要的炎症转录因子[28]。TNF-α、IL-6、单核细胞趋化蛋白-1[29](monocyte chemoattractant protein-1,MCP-1)等细胞因子,以及环氧合酶-2(cyclooxygenase,COX-2)、C反应蛋白、血管内皮生长因子[30](vasoactive endothelial growth factor,VEGF)等酶和蛋白质是易测量的炎症生物标志物。与其他炎症标志物相比,IL-6在血清、尿液和唾液中都可以检测到,是常用的炎症生物标志物。
临床试验与动物实验研究发现[31],黑豆醇提物有显著的抗炎[32]、抗氧化[33]、抑制甘油三酯的积累等作用。黑豆种皮提取物能改善肥胖[34]以及保护糖尿病导致的器官损伤[35]等炎症性疾病。
2.1 抗肥胖
肥胖伴有低度的慢性炎症,肥胖及伴生炎症会对许多器官功能产生影响。肥胖是2型糖尿病、脂肪肝、高血压等许多疾病的核心危险因素,且全球肥胖患病率持续增加。肥胖促使巨噬细胞数量增加,分泌炎性细胞因子和促炎激素,下调抗炎因子的表达,引发β细胞功能障碍[36]。脂肪细胞肥大导致游离脂肪酸(free fatty acid,FFA)的释放以及IL-6和MCP-1的分泌增加[37]。肥胖通过固醇调节元件结合蛋白1c(sterol regulatory element binding protein-1c,SREBP-1c)、过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors,PPAR-γ)等转录调节因子诱导肝脏甘油三酯(triglyceride,TG)的积累[38]。
黑豆种皮来源的多酚(富含花色苷,主要是C3G),能迅速降低促炎细胞因子基因的表达,减缓肥胖小鼠体重增加,改善由高脂饮食(high-fat diet,HFD)引起的异常喂养模式并预防肥胖[39]。KWON等[40]将0.037%黑豆种皮花色苷(black soybean anthocyanins,BSA)加入到高脂饲料中,发现,BSA阻止了HFD诱导的雄性SD大鼠的体重增加,一定程度上抑制了肝脏、附睾和肾周脂肪重量的增加,能有效改善脂肪分布。
WU等[41]将BSA和HFD给予C57雄性小鼠,与HFD组相比,BSA组小鼠体重明显下降,血清血脂三项、丙二醛(malondialdehyde,MDA)以及肝脏胆固醇(total cholestrol,TC)水平均显著降低,TNFα、IL-6、NF-κB和一氧化氮合酶(inducible nitric oxide synthase,iNOS)基因的表达显著下调,粪便丁酸含量显著升高。BSA可以减轻HFD诱导的肝脏炎症,加速脂肪酸的分解,通过减轻氧化应激和炎症改善了HFD诱导的肥胖。SATO等[42]将黑豆提取物(含有1.5 mg花色苷/150 mg黑豆提取物)灌胃给予HFD诱导的肥胖雄性Wistar大鼠,结果显示,与对照组相比,提取物组可降低大鼠皮下脂肪组织中饱和(14C、16C)、单不饱和(14C、18C)和n-6多不饱和(18C、20C和22C)各种脂肪酸的含量,但n-3多不饱和脂肪酸和内脏脂肪无明显变化,长链脂肪酸与炎症调节相关,黑豆提取物可能通过下调长链脂肪酸来抑制肥胖鼠炎症反应。
产热脂肪包括棕色脂肪和米色脂肪。棕色脂肪组织(brown adipose tissue,BAT)通过非战栗产热(non-shivering thermogenesis,NST)调节全身能量平衡,线粒体解偶联蛋白1(uncoupling protein 1,UCP1),又被称为热原蛋白,是BAT产热和全身能量稳态的中心,被认为是产热脂肪中唯一负责NST的产热蛋白[43],BAT和白色脂肪组织(white adipose tissue,WAT)中均表达UCP1并消耗葡萄糖和脂质,参与产热,米色脂肪需要外部刺激来诱导UCP1表达[44]。
LEE等[44]的体内外实验研究发现,黑豆种皮提取物花色苷(包括C3G和D3G)减少WAT和米色脂肪细胞(beige adipose tissue,BLA)中TG的积累,显著降低PPARγ和增强子结合蛋白α(CCAAT/enhancer binding protein α,C/EBPα)的表达,剂量依赖性地增加AMPKα/AMPKα、过氧化物酶体增殖物激活受体-γ辅激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)、脂肪TG脂肪酶(adipose triglyceride lipase,ATGL)的磷酸化以及UCP1和细胞色素C蛋白的表达,控制产热和脂解基因(recombinant cell death inducing DFFA like effector A,CIDEA)的mRNA表达水平增加,能调控脂质能量代谢。
KANAMOTO等[45]用不同剂量(0.2%、1.0%、2.0%)黑豆种皮提取物(BE,其中含有C3G 9.2%、原花青素39.8%)处理HFD诱导的肥胖小鼠,与对照组相比,BE使小鼠体重、血浆胆固醇水平和脂肪酸合酶(fatty acid synthase,FAS)表达水平显著降低,脂肪组织质量增加被抑制,胰岛素水平正常,以剂量依赖方式抑制HFD诱导的瘦素的表达,下调细胞因子TNF-α、MCP-1和IL-6的表达,高剂量BE组可显著增加肥胖小鼠中棕色脂肪组织中UCP1的基因表达,具有抗肥胖功效。KIM等[46]等研究Choengja3黑豆种皮花色苷(C3G 68.3%,D3G 25.2%,矮牵牛素-3-O-葡萄糖苷,petunidin-3-O-glucoside chloride,P3G 6.5%)在3T3-L1小鼠胚胎成纤维细胞诱导分化成脂肪细胞过程中对脂质积累的抑制,发现黑豆花色苷抑制处于分化过程中的前体脂肪细胞和成熟脂肪细胞增殖,各种脂肪细胞数目下降,抑制脂质积累和脂质合成转录因子PPARγ的表达。黑豆花色苷抑制脂肪细胞分化和脂质合成积累可能是其抗肥胖的机制所在。
肥胖不仅伴生炎症,而且增加患糖尿病、心血管疾病和某些类型癌症等慢性疾病的风险。以上动物实验研究发现,黑豆种皮花色苷可有效降低HFD实验动物体重,有望作为控制能量代谢和抗肥胖的良好功能材料。然而,直接证明黑豆种皮提取物在体重管理中有益作用的临床实验研究仍比较缺乏,在最终确定将其用于人类肥胖治疗前有必要进行包含活性成分、使用剂量、方式、时间、作用对象、预期效果等的全面细致的研究。
2.2 抗糖尿病
2型糖尿病主要特点是高血糖、胰腺β细胞胰岛素释放不足,和/或胰岛素抵抗[47],由2型糖尿病引起的炎症会导致细胞因子水平升高。
KUMAR等[47]采用3T3-L1脂肪细胞和RAW264.7巨噬细胞共培养体系研究黑豆花色苷提取物(black soybean anthocyanin extract,BSAn)对肥胖诱导的氧化应激、炎症反应和胰岛素抵抗的影响作用,发现BSAn能下调MCP-1、TNFα、IL-6的表达,抑制炎症介质前列腺素E2(prostinE,PGE2)和一氧化氮的升高,上调PPARγ基因表达、增加葡萄糖摄入,以响应胰岛素,以剂量依赖方式显著抑制非酯化脂肪酸(nonesterified fatty acid,NEFA)的释放,显著抑制共培养诱导的c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号的活化,抑制巨噬细胞向脂肪细胞的迁移,在共培养体系中减弱炎症反应和肥胖诱导的胰岛素抵抗。
将黑豆种皮提取物(black soybean seed coat extract,BE,富含原花青素和C3G)添加到雄性KK-Ay小鼠的饮食中,发现BE可使肝脏重量明显下降,显著增加骨骼肌AMPKα(Thr172)的磷酸化和磷酸化比例,下调糖异生酶磷酸烯醇式丙酮酸羧激酶(Phosphoenolpyruvate carboxykinase,PEPCK)和葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6 Pase)的表达,显著激活骨骼肌AMPK以及葡萄糖转运蛋白4(recombinant glucose transporter 4,GLUT4)的表达,降低2型糖尿病小鼠的血糖水平、改善胰岛素抵抗[48]。用黑豆种皮提取物花色苷(black soybean seed coat extract,BSSCE)灌胃糖尿病模型小鼠,抑制小鼠体重和白色脂肪增加,显著抑制食物摄入[49]。不同浓度C3G和BSSCE处理小鼠3T3-L1前脂肪细胞,不同浓度C3G处理C2C12细胞,发现C3G是BSSCE中诱导前脂肪细胞分化为较小脂肪细胞的主要活性化合物,可促进脂肪细胞的分化,减少脂肪细胞中脂联素、增加TNF-α、C3G可增强脂肪细胞胰岛素敏感性、增强PPARγ和增强子结合蛋白α(CCAAT/enhancer binding protein α,C/EBPα)的基因表达。C3G通过调节脂肪细胞分化和胰岛素敏感性达到预防或改善2型糖尿病的目的。
NIZAMUTDINOVA等[50]和CHEN等[35]分别将黑豆种皮花色苷提取物(分别简称ANT和BSSCE,BSSCE活性成分C3G)用于链脲佐菌素(streptozocin,STZ)诱导的糖尿病大、小鼠,发现ANT可提高STZ诱导的糖尿病大鼠胰岛素水平下降,降低血清TG,显著抑制MDA产生,恢复体重、恢复超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性,增强GLUT4表达,改善胰岛素抵抗、胰腺细胞凋亡,且效果优于临床药物格列苯脲;BSSCE可显著降低糖尿病小鼠的体重和血糖,显著改善SOD、CAT和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活性,显著降低TC、TG、NEFA,升高HDL-c,改善糖尿病小鼠动脉粥样硬化性血脂异常,保护糖尿病小鼠对抗肝、肾和胰腺损伤。ANT和BSSCE有望开发成为2型糖尿病治疗用功能食品和药品。
糖尿病是最常见的内分泌疾病,也是世界范围内的一个重要的健康问题。胰岛素抵抗是2型糖尿病的主要病因和症状。以上研究表明,黑豆种皮花色苷提取物可调节脂肪细胞分化,改善胰岛素抵抗,平衡糖脂代谢,降低氧化损伤,具有良好的抗糖尿病作用。C3G可能是主要功效成分。黑豆种皮花色苷有望用于预防糖尿病的发展,或进一步调节2型糖尿病及其并发症。因此,有必要深入研究人体对黑豆种皮花色苷的消化吸收、生物利用和代谢转化。
2.3 抗脂肪肝
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)发展到晚期,即非酒精性脂性肝炎(nonalcoholic steatohepatitis,NASH),肝脏脂肪变性,还伴有持续的炎症和组织损伤。
YAMAMOTO等[51]将1.0%、2.0%的黑豆种皮提取物(富含花色苷)加入到日粮中,探究BE对3种模型小鼠NAFLD的预防作用,3种模型分别为胆碱缺乏和L -氨基酸定义的高脂饮食(CDAHFD)诱导、西方饮食诱导、西方饮食和CCl4结合诱导,发现,BE显著降低模型鼠血浆TC,显著降低西方饮食诱导的肝脏SREBP-1和PPARα水平,剂量依赖性显著抑制谷丙转氨酶(alanine transaminase,ALT)和天冬氨酸氨基转移酶(aspartate transaminase,AST)活性;BE和EC(BE中的成分)均抑制西方饮食诱导的附睾白色脂肪组织中SREBP-1和PPARγ水平,降低肝脏MDA水平,抑制炎症细胞因子表达水平,并显著抑制α-平滑肌肌动蛋白(α-smooth muscle action,α-SMA)表达;EC使核因子e2相关因子2(nuclear factor erythroid 2-related factor,Nrf2)及其下游血红素加氧酶1 (heme oxygenase-1,HO-1)蛋白表达增加;BE显著阻止CCl4注射组中α-SMA表达的增加。BE能改善WD引起的脂肪累积,改善肝脏和白色脂肪组织脂质代谢。有研究也发现补充黑豆可以抑制高胆固醇高脂饮食诱导的NALFD小鼠肝脏胆固醇积累[52]。
近些年,NAFLD(NASH)发病率持续增加。NAFLD(NASH)的重要标志是肝脏炎症,长期慢性炎症导致向肝纤维化、肝硬化发展。目前,并没有治疗NAFLD的特效药。黑豆种皮花色苷提取物对肝脏功能的保护、对脂质代谢的调节、对脂质级联氧化产物MDA和炎症因子的抑制等,为NAFLD(NASH)新型治疗药物的开发提供了一种选择。
2.4 抗AD
AD是最常见的神经退行性痴呆疾病,表现为认知障碍及持续下降。AD的主要病理特征是淀粉样蛋白-β(amyloid β-protein,Aβ)在大脑中的沉积、神经元内神经原纤维缠结的存在和突触的逐渐丢失,以及微管相关蛋白(tau蛋白)的过度磷酸化[53]。
黑豆花色苷在淀粉样蛋白Aβ1-42神经退行性模型中可显著提高细胞活力,阻止Aβ诱导的胞浆Ca2+水平升高,可逆转线粒体内膜跨膜电位(mitochondrial transmembrane potentia,ΔΨm)[54]。逆转Aβ诱导的细胞色素C水平,下调Aβ诱导的BCL2关联X蛋白(BCL2-Associated X,Bax)的表达,显著降低胱天蛋白酶-9(caspase-9,CASP9)和胱天蛋白酶3(caspase-3,CASP3)表达水平,以及Aβ诱导的tau蛋白过度磷酸化。显著降低雄性SD成年大鼠海马神经元凋亡标志物BACE-1蛋白的表达水平以及Aβ和β-淀粉样蛋白前体蛋白[myloid beta (A4) precursor protein,APP]水平。随着人口老龄化日益加剧,AD发病率逐年上升。黑豆种皮花色苷能有效抑制Aβ的神经毒性并维持正常的细胞功能,可以将其应用到临床试验中来更好地治疗AD。
2.5 抗炎性肠病
溃疡性结肠炎不同程度引起从直肠延伸到更近端结肠的持续性黏膜炎症。KIM等[55]研究发现增补10%黑豆种皮花色苷可抑制致癌剂处理大鼠结肠COX-2 mRNA表达,降低血浆PGE2水平。在组织型纤溶酶原激活因子(tissue plasminogen activator,TPA)诱导人结肠腺癌细胞系HT-29中,黑豆花色苷Cy和Dp均能抑制COX-2 mRNA的表达,天竺葵色素(pelargonidin chloride,Pg)仅在高浓度时表现出明显的抑制作用。活性氧(reactive oxygen species,ROS)[56]诱导核转录因子激活,使 COX-2表达增加,COX-2 将花生四烯酸(arachidonic acid, AA) 转化为PGE2,介导结肠癌炎症反应的发生。将黑豆种皮提取物花色苷(anthocyanidins and anthocyanin-rich extract,AE)添加到ApcMin/+小鼠的日粮中,发现胞质β-连环蛋白水平显著降低,高浓度AE饮食小鼠的肠道肿瘤数量显著减少,肠黏膜细胞质磷脂酶A2(cytoplasmic phospholipase A2,cPLA2)以及肠道COX-2的mRNA表达水平显著降低[57]。
结直肠癌是消化道最常见的恶性肿瘤之一,近些年在我国发病率与死亡率明显上升,且高于世界水平,许多结肠癌病人表现出COX-2表达。黑豆花色苷能抑制结肠癌癌症细胞生长而无细胞毒性,且减少氧化应激,降低COX-2和PGE2的表达。深入研究黑豆花色苷对炎性肠病信号通路的调控、明确其体内抗癌活性及有效摄入剂量,有望加速其临床应用、提高治疗效果。
2.6 神经保护
研究发现黑豆种皮提取物花色苷预处理通过抑制iNOS和COX-2蛋白的表达浓度依赖式,显著抑制脂多糖(lipopolysaccharides,LPS)刺激的BV2小胶质细胞NO和PGE2的产生,降低TNF-α和IL-1β的表达,消除NF-κB p65的易位,显著阻断LPS诱导的苏氨酸激酶磷酸化[58]。黑豆花色苷通过抑制LPS诱导的NF-κB活性抑制促炎细胞因子的表达,在治疗伴有小胶质细胞活化的炎症和神经退行性疾病上提供帮助。黑豆种皮提取物花色苷还可显著降低LPS诱导的成年小鼠ROS和MDA水平,小鼠大脑皮层8-氧鸟嘌呤(8-oxoguanine,8-OxoG)和活化的p-JNK、星形胶质细胞胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、离子化钙结合适配分子1(recombinant Ionized calcium-binding adapter molecule 1,IBA1)、TNF-α、IL-1β和COX-2的表达均显著降低[59]。黑豆花色苷通过降低LPS诱导的成年小鼠大脑皮层NF-kB活化,抑制线粒体凋亡,达到预防中枢神经系统损伤性疾病的作用。
用黑豆花色苷提取物(含有68.3% C3G,25.2% D3G,6.5% P3G)预处理暴露于糖氧剥夺(oxygen and glucose deprivation,OGD)应激下的胶质瘤细胞(U87),ROS水平降低10倍多;单独使用花色苷处理或 OGD 应激均增加自噬诱导,OGD应激前用花色苷预处理,自噬诱导成倍增加[60]。Cheongja3黑豆种皮提取物花色苷预处理,ASK1-JNK/p38信号通路被抑制,HO-1和Neu1唾液酸酶基因表达增强,H2O2诱导的人神经节细胞死亡剂量依赖式减少,细胞ROS水平显著降低[61]。花色苷有望用于预防氧化损伤如中风引起的脑功能障碍。
黑豆花色苷可通过γ-氨基丁酸B1受体(γ-aminobutyric acid B1 receptor,GABAB1R)对乙醇诱导的SD大鼠胎儿海马神经元凋亡起保护作用。黑豆花色苷和维生素C共处理暴露于10%(体积分数)乙醇中的成年大鼠[62],发现Bax/Bcl-2比率、GABAB1R的表达、聚腺苷二磷酸核糖聚合酶-1(poly(ADP-ribose)polymerase-1,PARP-1)裂解水平、大鼠大脑皮层以及海马CASP3和CASP9水平均下降,GABAB1R下游分子p-CREB表达增加。黑豆花色苷或花色苷联合维生素C可能成为酒精滥用者一种新的脑神经保护制剂。
小胶质细胞在先天中枢神经系统免疫应答中起关键作用。小胶质细胞的慢性活化和促炎细胞因子的过量产生是各种神经系统疾病的组织病理学标志,过度活化的小胶质细胞使促炎成分过量产生,可能是通过许多细胞信号通路启动神经退行性发作的危险因素[58]。黑豆花色苷可通过失活PI3/Akt信号通路抑制LPS诱导的NF-κB活化,可直接或间接激活GABAB1R防止产前大鼠海马神经元的乙醇诱导变性。但黑豆种皮花色苷提取物对人脑的神经保护作用尚未得到广泛研究,所涉及的体内外潜在机制尚不完全清楚。
2.7 其他活性
研究发现黑豆花色苷除以上功能活性外,还有很多其他生理调节功能或防病治病功能活性,在很多疾病预防和治疗方面有开发利用价值,总结如下表3。
表3 黑豆花色苷其他功能活性及作用机制
Table 3 Other functional activities and mechanisms of action of black bean anthocyanins

受试物受试对象作用效果作用途径可能用途参考文献黑豆花色苷LPS处理的RAW 264.7 细胞炎症反应↓ROS↓,NO↓,TNF-α↓,IL-6↓,MAPKsP↓抗炎[63]黑豆花色苷和原花青素(BE)HPO处理的HepG2细胞HPO导致的细胞死亡↓PP↑,ERK↓抗氧化[64]
续表3

受试物受试对象作用效果作用途径可能用途参考文献黑豆花色苷(ATCs)U2OS细胞细胞凋亡↓细胞自噬↑,AMPK-FOXO3a通路↑肿瘤治疗[65]黑豆花色苷MNU诱导RD大鼠保护视网膜神经元免受MNU损伤ERG响应↑,保护视网膜外层光感受器视网膜变性调节[66]黑豆皮提取物(BSHE)PCA小鼠,大鼠嗜碱性白细胞瘤RBL-2H3细胞小鼠PCA↓RBL-2H3细胞β-Hex↓、组胺↓抗I型过敏[67]A63品种黑豆花色苷OXA诱导小鼠表皮厚度和炎性细胞浸润↓IL-4↓,IL-5↓,STAT3/6↓,MAPK信号通路↓,细胞功能↑抗AD样皮炎[68]黑豆花色苷UVB辐照无毛小鼠,人源角化细胞 HaCaTCOX-2↓,PGE 2 ↓NF-kB通路↓,PI3 /Akt 通路↓抗UVB损伤[69]黑豆花色苷CBP大鼠模型炎症水平↓前列腺组织和尿液中的细菌数量↓、炎症细胞浸润水平↓,腺泡破坏程度↓、间质纤维化↓抗CBP[70]黑豆Seoritae提取物(SE,含花色苷)BPH模型大鼠前列腺重量↓氧化压力↓,细胞凋亡↓,5-α还原酶活性↓抗前列腺增生[71]黑豆花色苷无胸腺肿瘤异种移植小鼠,荷尔蒙难治型前列腺癌DU-145 细胞肿瘤生长↓细胞凋亡↑,Bax↑,p53↓,Bcl-2↓,PSA↓,AR↓抗前列腺癌[72]黑豆花色苷有伤口SD大鼠伤口愈合快VEGF↑,CD31↑, TSP1↓,NF-kB(p65)易位↓,IκBαP↓促进伤口愈合[73]黑豆种皮提取花色苷(AEBS)骨胶原诱导关节炎模型小鼠关节炎发作↓,组织炎症↓促炎因子↓,NF-kB信号↓,Th17细胞数量↓抗关节炎[74]
注:↓下降、下调、降低或被抑制;↑增加、增高、增强、促进、提升或上调;P,磷酸化(phosphorylation);HPO,过氧化氢(hydrogen peroxide);ERK,细胞外信号调节激酶(extracellular signal-regulated kinase);PP,蛋白磷酸酶(protein phosphatase);ATCs,花色苷(anthocyanins);MNU,N-甲基-N-亚硝脲(N-methyl-N-nitrosourea);RD,视网膜变性(retinal degeneration);ERG,视网膜电图(electroretinographic);BSHE,黑豆皮提取物(black soybean hull extract);PCA,被动皮肤过敏(passive cutaneous anaphylaxis);β-Hex,β氨基己糖苷酶(β-hexosaminidase);OXA,恶唑酮(oxazolone);STAT3/6,信号传导和转录激活因子3/6(signal transducer and activator of transcription);AD,异位性皮炎(atopic dermatitis);CBP,慢性细菌性前列腺炎(chronic bacterial prostatitis);SE,一种黑豆Seoritae提取物(seoritae extract);BPH,慢性前列腺增生(benign prostatic hyperplasia);PSA,前列腺特异抗原(prostate specific antigen);AR,雄激素受体(androgen receptor);VEGF,血管内皮生长因子(vscular endothelial growth factor);TSP1,血小板反应蛋白(thrombospondin 1);AEBS,黑豆种皮提取花色苷(anthocyanin extracted from black soybean seed coats);CIA,骨胶原诱导关节炎(collagen-induced arthritis)。
3 展望
花色苷广泛存在于植物中,具有多种活性作用。研究发现,彩色马铃薯花色苷(多为矮牵牛素和芍药色素)[75]、黑果枸杞花色苷(矢车菊素-3-O-葡萄糖苷)[76]、樱桃李(4种主要活性成分均为矢车菊素类花色苷)[6]等其他来源的花色苷均具有和黑豆花色苷相同的健康效应,例如抗氧化、抗糖、调控脂质代谢等。但是,花色苷相关代谢物有上百种,不同果蔬或植物中的花色苷提取物的活性成分有所不同,花色苷在果实中通常含有1个或2个苷元碱基衍生的花青素,在花卉中大多以色素颗粒形式存在,因此,针对不同食物来源的活性成分,研究者需要分开进行研究,而非局限于1种或1类食物或植物。在明确其花色苷种类、结构特性基础上,通过网络药理学等生信技术预测作用靶点得到信号通路,再进行深入研究。
黑豆不仅含有丰富的花色苷,还含有多种营养物质和活性成分,近些年被国内外研究者广泛应用于各种领域。随着黑豆品种选育和种植技术的提高,黑豆产量增加,不仅促进经济的发展,还帮助农民增加收入。黑豆有多种吃法,不仅可充饥果腹、强健身体,中医认为黑豆还可治疗多种疾病。与其他有色水果或蔬菜相比,黑豆具有更广泛的健康优势。
花色苷的大多数功能都归因于C3G或花色苷的混合物。尽管已有关于黑豆花色苷抗炎和抗癌等各种潜在健康益处的研究许多,但不同遗传基因型或不同品种以及不同环境因素的影响,使黑豆花色苷的组成和结构具有多样性[2],而且,花色苷抗炎治病功能成分、作用方式、作用剂量、信号途径、治疗周期以及可能毒性剂量等也需进一步明确。
有研究报道黑豆花色苷(多含C3G)具有降脂功效[40-42,44-46],主要通过抗炎、降低氧化应激、调控脂质能量代谢、抑制脂肪细胞成熟等途径发挥作用,但目前对活性单体-作用靶点关系及相关途径之间的关联(协同或抑制)了解甚少,从而限制了黑豆和/或花色苷特殊定制类食品的精准开发。
巨噬细胞可以分化为M1型巨噬细胞和M2型巨噬细胞。M1型可分泌炎症因子,介导局部组织发生炎症,被认为是促炎性巨噬细胞;M2型分泌抗炎因子,被认为是抗炎性巨噬细胞。然而,尽管花色苷对巨噬细胞的免疫调节作用明确,但尚未见到关于黑豆花色苷对M1、M2型巨噬细胞极化的研究。疫情之后机体免疫力问题备受关注,免疫调节可能会成为黑豆和/或花色苷功能活性研究的一个热点。
黑豆花色苷具有炎症性疾病治疗剂的潜力和应用价值,为有效和精准利用黑豆花色苷的健康效益,需深入研究单体成分及不同单体成分不同配比下的作用效果和作用机制,并加速对临床患者和慢病人群的研究。黑豆自古就是食药兼用者,具有很好的食用安全性和依从性。但目前黑豆的食用产品形式还比较少,依然局限于少数几种传统品类和形式,加大对黑豆新型食品形态的研发,既保证其营养和活性成分不被破坏又保证其口感和美味,促使黑豆成为老百姓喜爱和常用的食材,无疑对广泛发挥黑豆的健康效益、推动健康中国建设具有较大的现实意义。
[1] 胡懿化, 王星滟, 张武霞, 等.黑豆糖蛋白的结构分析及抗氧化和免疫活性[J].食品科学, 2021, 42(17):19-26.HU Y H, WANG X Y, ZHANG W X, et al.Structural characterization and antioxidant and immunoregulatory activity of glycoproteins from black soybeans[J].Food Science, 2021, 42(17):19-26.
[2] 魏心源, 陈虹印, 程道梅.黑豆种皮花青素生理功能、分离纯化及应用研究进展[J].食品与机械, 2021, 37(3):221-227.WEI X Y, CHEN H Y, CHENG D M.Research progress in physiological function, extraction and application of anthocyanidin from black soybean coat[J].Food &Machinery, 2021, 37(3):221-227.
[3] 梁璐, 隋勇, 黄师荣, 等.花色苷结构与呈色稳定性研究进展[J].现代食品科技, 2024, 40(6):336-346.LIANG L, SUI Y, HUANG S R, et al.Research progress on the structures and coloration stability of anthocyanins[J].Modern Food Science and Technology, 2024, 40(6):336-346.
[4] 吴志华, 马丽, 陈剑, 等.基于UPLC-ESI-MS/MS技术黑豆种皮的化学成分分析[J].植物资源与环境学报, 2024, 33(1):111-113.WU Z H, MA L, CHEN J, et al.Analysis on chemical components in seed coat of black soybean based on UPLC-ESI-MS/MS technology[J].Journal of Plant Resources and Environment, 2024, 33(1):111-113.
[5] 江甜, 何毅, 祝振洲, 等.黑豆蛋白的分级提取及黑豆花色苷的成分鉴定[J].食品科学, 2017, 38(4):217-222.JIANG T, HE Y, ZHU Z Z, et al.Fractional extraction of protein and characterization of anthocyanins from black soybean seeds[J].Food Science, 2017, 38(4):217-222.
[6] 张裴, 张歆, 李珍, 等.液相色谱-质谱结合网络药理学及实验验证新疆樱桃李花色苷改善动脉粥样硬化的作用机制[J].世界中医药, 2024, 19(12):1720-1729.ZHANG P, ZHANG X, LI Z, et al.LC-MS combined with network pharmacology and experimental validation reveals mechanism of anthocyanins from Prunus cerasifera in Xinjiang in treating atherosclerosis[J].World Chinese Medicine, 2024, 19(12):1720-1729.
[7] 王雷, 董金旭, 王一凯, 等.基于UPLC-Orbitrap-MS/MS技术联合GNPS分子网络快速分析黑果腺肋花楸果实成分[J].质谱学报, 2024, 45(6):874-883.WANG L, DONG J X, WANG Y K, et al.Rapid identification of constituents of Aronia melanocarpa(michx.) Elliott fruit by UPLC-qrbitrap-MS/MS and GNPS molecular network[J].Journal of Chinese Mass Spectrometry Society, 2024, 45(6):874-883.
[8] MANJILI S H, ISBELL M, GHOCHAGHI N, et al.Multifaceted functions of chronic inflammation in regulating tumor dormancy and relapse[J].Seminars in Cancer Biology, 2022, 78:17-22.
[9] S NCHEZ M, GONZ
NCHEZ M, GONZ LEZ-BURGOS E, IGLESIAS I, et al.Pharmacological update properties of Aloe vera and its major active constituents[J].Molecules, 2020, 25(6):1324.
LEZ-BURGOS E, IGLESIAS I, et al.Pharmacological update properties of Aloe vera and its major active constituents[J].Molecules, 2020, 25(6):1324.
[10] LI W, YANG H J.Phenolic constituents from Platycodon grandiflorum root and their anti-inflammatory activity[J].Molecules, 2021, 26(15):4530.
[11] 夏玲, 陈小兰, 王自超, 等. 酰基化花色苷的结构、稳定性及降血糖作用研究进展[J/OL]. 食品与发酵工业, 2024:1-12. (2024-12-30). https://link.cnki.net/doi/10.13995/j.cnki.11-1802/ts.041195.XIA L, CHEN X L, WANG Z C, et al. Research progress on structure, stability and hypoglycemic effect of acylated anthocyanins[J/OL]. Food and Fermentation Industries, 2024:1-12. (2024-12-30). https://link.cnki.net/doi/10.13995/j.cnki.11-1802/ts.041195.
[12] 宋毓晔, 王渝, 朱千林, 等.植物中花色苷来源及提取方法研究进展[J].食品研究与开发, 2022, 43(16):199-208.SONG Y Y, WANG Y, ZHU Q L, et al.Research progress on sources and extraction methods of plant-based anthocyanin[J].Food Research and Development, 2022, 43(16):199-208.
[13] 张利, 高金, 李秀花. 黑豆花色苷提取工艺的优化[J]. 吉林农业, 2018(19):72-73.ZHANG L, GAO J, LI X H. Optimization of extraction technology of anthocyanins from black beans[J]. Agriculture of Jilin, 2018(19):72-73.
[14] 李娟. 黑豆提取物花青素对大鼠晶状体上皮细胞抑制作用的实验研究[D].延吉:延边大学, 2018.LI J.Inhibitory effect of black soybean extract anthocyanin on rat lens epithelial cells[D].Yanji:Yanbian University, 2018.
[15] 张文莉, 张建萍, 巫永华, 等.大孔树脂纯化黑豆皮花色苷的工艺优化[J].粮食与油脂, 2021, 34(1):110-113;122.ZHANG W L, ZHANG J P, WU Y H, et al.Optimization of purification process of anthocyanins from black soybean peel by macroprous resin[J].Cereals &Oils, 2021, 34(1):110-113;122.
[16] 张书鸣, 钟梓文, 向小凤, 等.磁性离子液体在食品化学污染物预处理应用的研究进展[J].食品科学, 2024, 45(18):342-349.ZHANG S M, ZHONG Z W, XIANG X F, et al.Progress in the application of magnetic ionic liquids in sample pretreatment for determination of chemical pollutants in foods[J].Food Science, 2024, 45(18):342-349.
[17] 苏适, 马瑞, 董立强, 等.微波辅助离子液体提取黑豆皮花青素的研究[J].哈尔滨商业大学学报(自然科学版), 2020, 36(2):204-209.SU S, MA R, DONG L Q, et al.Study of microwave-assisted extraction of anthocyanin by ionic liquids[J].Journal of Harbin University of Commerce (Natural Sciences Edition), 2020, 36(2):204-209.
[18] 于德涵, 苏适, 王喜庆, 等.响应曲面优化离子液体-微波辅助提取黑豆皮中花青素的工艺研究[J].食品研究与开发, 2020, 41(16):120-125.YU D H, SU S, WANG X Q, et al.Response surface methodology for optimizing the extraction of anthocyanins from black soybean peel by ionic liquids-microwave-assisted extraction[J].Food Research and Development, 2020, 41(16):120-125.
[19] 苏适, 赵东江, 柴宝丽, 等.离子液体超声辅助提取黑豆皮花青素及其抗氧化活性研究[J].中国酿造, 2019, 38(6):171-175.SU S, ZHAO D J, CHAI B L, et al.Ionic liquid-based ultrasonic assisted extraction of anthocyanin from black soybean peel and its antioxidant activity[J].China Brewing, 2019, 38(6):171-175.
[20] 苏适, 李月, 董立强, 等.黑豆皮花青素的提取及体外抗菌活性研究[J].哈尔滨商业大学学报(自然科学版), 2020, 36(5):532-536.SU S, LI Y, DONG L Q, et al.Study on extraction and antibacterial activity of anthocyanin from black soybean peel[J].Journal of Harbin University of Commerce(Natural Sciences Edition), 2020, 36(5):532-536.
[21] 张芷瑜, 张天伟, 杨馥菡, 等.蓝莓果渣花色苷提取纯化工艺研究[J].中国调味品, 2024, 49(3):175-181.ZHANG Z Y, ZHANG T W, YANG F H, et al.Study on extraction and purification process of anthocyanins from blueberry residue[J].China Condiment, 2024, 49(3):175-181.
[22] 张馨月, 赵思毅, 吴明阳, 等.紫马铃薯花色苷提取工艺优化及稳定性、抗氧化活性分析[J].食品工业科技, 2024, 45(5):187-196.ZHANG X Y, ZHAO S Y, WU M Y, et al.Optimization of extraction process of anthocyanins from purple-fleshed potatoes and its stability and antioxidant activity[J].Science and Technology of Food Industry, 2024, 45(5):187-196.
[23] 宋毓晔. 黑胡萝卜花色苷提取纯化及稳态化研究[D].淮安:淮阴工学院, 2022.SONG Y Y.Steady-state preparation technology and application of anthocyanin from black carrot[D].Huai’an:Huaiyin Institute of Technology, 2022.
[24] 黄齐齐, 房韬文, 罗怡雯, 等.甘蔗多酚提取、纯化及生物活性研究进展[J].食品工业科技, 2024, 45(9):389-398.HUANG Q Q, FANG T W, LUO Y W, et al.Research progress on extraction, purification and biological activities of sugarcane polyphenols[J].Science and Technology of Food Industry, 2024, 45(9):389-398.
[25] 魏炳琦, 陈柳, 张新月, 等.三七皂苷的提取、结构、生物活性及其应用研究进展[J].食品工业科技, 2025,46(7):415-424.WEI B Q, CHEN L, ZHANG X Y, et al.Research Progress on Extraction, Structure, Biological Activity and Application of Panax Notoginseng Saponin[J].Science and Technology of Food Industry, 2025,46(7):415-424.
[26] 高叶, 陈晓艺, 郭盛, 等.中药糖肽的提取分离、结构鉴定及药理作用研究现状与展望[J].中国中药杂志, 2024, 49(17):4637-4649.GAO Y, CHEN X Y, GUO S, et al.Extraction, isolation, structural characterization and pharmacological effects of glycopeptides from traditional Chinese medicine:Current status and prospects[J].China Journal of Chinese Materia Medica, 2024, 49(17):4637-4649.
[27] 王艳珍. 植物活性成分提取技术研究进展[J].食品安全导刊, 2024(19):162-164.WANG Y Z.Research progress on extraction technology of plant active ingredients[J].China Food Safety Magazine, 2024(19):162-164.
[28] ROE K.An inflammation classification system using cytokine parameters[J].Scandinavian Journal of Immunology, 2021, 93(2):e12970.
[29] 于晓倩, 姜月华, 赵世腾, 等.肠道菌群失调与血管内皮损伤的相关机制研究概况[J].中国现代医学杂志, 2024, 34(5):37-43.YU X Q, JIANG Y H, ZHAO S T, et al.Survey of the research on the related mechanisms of intestinal microflora imbalance involved in vascular endothelial injury[J].China Journal of Modern Medicine, 2024, 34(5):37-43.
[30] 朱永豹, 张礼周.甘草酸二铵联合恩替卡韦治疗老年慢性乙型肝炎的效果及对炎症标志物、MCP-1、VEGF和sST2水平的影响[J].中国老年学杂志, 2023, 43(24):5924-5927.ZHU Y B, ZHANG L Z.Effect of diammonium glycyrrhizinate combined with entecavir on elderly patients with chronic hepatitis B and its influence on inflammatory markers, MCP-1, VEGF and sST2 levels[J].Chinese Journal of Gerontology, 2023, 43(24):5924-5927.
[31] 徐飞, 葛阳阳, 刘新春, 等.黑豆营养成分及生物活性的研究进展[J].中国食物与营养, 2019, 25(9):55-61.XU F, GE Y Y, LIU X C, et al.Research advancement of nutritional composition and biological activiey of black soybean[J].Food and Nutrition in China, 2019, 25(9):55-61.
[32] KIM J N, HAN S N, KIM H K.Anti-inflammatory and anti-diabetic effect of black soybean anthocyanins:Data from a dual cooperative cellular system[J].Molecules, 2021, 26(11):3363.
[33] 张宽朝, 汪炜姿, 余平, 等.黑豆种皮花色苷酶法辅助提取工艺优化及其抗氧化活性分析[J].天然产物研究与开发, 2022, 34(1):83-92.ZHANG K C, WANG W Z, YU P, et al.Optimization of enzyme assisted extraction and antioxidant activity of anthocyanins from black bean seed coat[J].Natural Product Research and Development, 2022, 34(1):83-92.
[34] LEE M, SORN S R, PARK Y, et al.Anthocyanin rich-black soybean testa improved visceral fat and plasma lipid profiles in overweight/obese Korean adults:A randomized controlled trial[J].Journal of Medicinal Food, 2016, 19(11):995-1003.
[35] CHEN Z Q, WANG C, PAN Y X, et al.Hypoglycemic and hypolipidemic effects of anthocyanins extract from black soybean seed coat in high fat diet and streptozotocin-induced diabetic mice[J].Food &Function, 2018, 9(1):426-439.
[36] EGUCHI K, NAGAI R.Islet inflammation in type 2 diabetes and physiology[J].The Journal of Clinical Investigation, 2017, 127(1):14-23.
[37] LEE J H, SEO E Y, LEE Y M.Comparative investigation on variations of nutritional components in whole seeds and seed Coats of Korean black soybeans for different crop years and screening of their antioxidant and anti-aging properties[J].Food Chemistry:X, 2023, 17:100572.
[38] 马晓婷. 健脾化浊降脂方对肥胖小鼠代谢稳态和慢性炎症的影响及机制研究[D].保定:河北大学, 2021.MA X T.Study on the effect and mechanism of Jianpi Huazhuo Jiangzhi decoction on metabolic homeostasis and chronic inflammation in obese mice[D].Baoding:Hebei University, 2021.
[39] HIRONAO K Y, ASHIDA H, YAMASHITA Y.Black soybean seed coat polyphenol ameliorates the abnormal feeding pattern induced by high-fat diet consumption[J].Frontiers in Nutrition, 2022, 9:1006132.
[40] KWON S H, AHN I S, KIM S O, et al.Anti-obesity and hypolipidemic effects of black soybean anthocyanins[J].Journal of Medicinal Food, 2007, 10(3):552-556.
[41] WU T, GUO X Q, ZHANG M, et al.Anthocyanins in black rice, soybean and purple corn increase fecal butyric acid and prevent liver inflammation in high fat diet-induced obese mice[J].Food &Function, 2017, 8(9):3178-3186.
[42] SATO D, KUSUNOKI M, SEINO N, et al.Black soybean extract reduces fatty acid contents in subcutaneous, but not in visceral adipose triglyceride in high-fat fed rats[J].International Journal of Food Sciences and Nutrition, 2015, 66(5):539-545.
[43] IKEDA K, YAMADA T.UCP1 dependent and independent thermogenesis in brown and beige adipocytes[J].Frontiers in Endocrinology, 2020, 11:498.
[44] LEE M, LEE M.The effects of C3G and D3G anthocyanin-rich black soybean on energy metabolism in beige-like adipocytes[J].Journal of Agricultural and Food Chemistry, 2020, 68(43):12011-12018.
[45] KANAMOTO Y, YAMASHITA Y, NANBA F, et al.A black soybean seed coat extract prevents obesity and glucose intolerance by up-regulating uncoupling proteins and down-regulating inflammatory cytokines in high-fat diet-fed mice[J].Journal of Agricultural and Food Chemistry, 2011, 59(16):8985-8993.
[46] KIM H K, KIM J N, HAN S N, et al.Black soybean anthocyanins inhibit adipocyte differentiation in 3T3-L1 cells[J].Nutrition Research, 2012, 32(10):770-777.
[47] KUMAR M, SUHAG R, HASAN M, et al.Black soybean (Glycine max (L.) merr.):Paving the way toward new nutraceutical[J].Critical Reviews in Food Science and Nutrition, 2023, 63(23):6208-6234.
[48] KURIMOTO Y, SHIBAYAMA Y, INOUE S, et al.Black soybean seed coat extract ameliorates hyperglycemia and insulin sensitivity via the activation of AMP-activated protein kinase in diabetic mice[J].Journal of Agricultural and Food Chemistry, 2013, 61(23):5558-5564.
[49] MATSUKAWA T, INAGUMA T, HAN J, et al.Cyanidin-3-glucoside derived from black soybeans ameliorate type 2 diabetes through the induction of differentiation of preadipocytes into smaller and insulin-sensitive adipocytes[J].The Journal of Nutritional Biochemistry, 2015, 26(8):860-867.
[50] NIZAMUTDINOVA I T, JIN Y C, CHUNG J I, et al.The anti-diabetic effect of anthocyanins in streptozotocin-induced diabetic rats through glucose transporter 4 regulation and prevention of insulin resistance and pancreatic apoptosis[J].Molecular Nutrition &Food Research, 2009, 53(11):1419-1429.
[51] YAMAMOTO M, YOSHIOKA Y, KITAKAZE T, et al.Preventive effects of black soybean polyphenols on non-alcoholic fatty liver disease in three different mouse models[J].Food &Function, 2022, 13(2):1000-1014.
[52] JUNG J H, KIM H S.The inhibitory effect of black soybean on hepatic cholesterol accumulation in high cholesterol and high fat diet-induced non-alcoholic fatty liver disease[J].Food and Chemical Toxicology, 2013, 60:404-412.
[53] MEDEIROS R, BAGLIETTO-VARGAS D, LAFERLA F M.The role of tau in Alzheimer’s disease and related disorders[J].CNS Neuroscience &Therapeutics, 2011, 17(5):514-524.
[54] BADSHAH H, KIM T H, KIM M O.Protective effects of Anthocyanins against amyloid beta-induced neurotoxicity in vivo and in vitro[J].Neurochemistry International, 2015, 80:51-59.
[55] KIM J M, KIM J S, YOO H, et al.Effects of black soybean[Glycine max (L.) Merr.]seed Coats and its anthocyanidins on colonic inflammation and cell proliferation in vitro and in vivo[J].Journal of Agricultural and Food Chemistry, 2008, 56(18):8427-8433.
[56] REUTER S, GUPTA S C, CHATURVEDI M M, et al.Oxidative stress, inflammation, and cancer:How are they linked?[J].Free Radical Biology and Medicine, 2010, 49(11):1603-1616.
[57] PARK M Y, KIM J M, KIM J S, et al.Chemopreventive action of anthocyanin-rich black soybean fraction in APC (Min/+) intestinal polyposis model[J].Journal of Cancer Prevention, 2015, 20(3):193-201.
[58] JEONG J W, LEE W S, SHIN S C, et al.Anthocyanins downregulate lipopolysaccharide-induced inflammatory responses in BV2 microglial cells by suppressing the NF-κB and Akt/MAPKs signaling pathways[J].International Journal of Molecular Sciences, 2013, 14(1):1502-1515.
[59] KHAN M S, ALI T, KIM M W, et al.Anthocyanins protect against LPS-induced oxidative stress-mediated neuroinflammation and neurodegeneration in the adult mouse cortex[J].Neurochemistry International, 2016, 100:1-10.
[60] KIM Y K, YOON H H, LEE Y D, et al.Anthocyanin extracts from black soybean (Glycine max L.) protect human glial cells against oxygen-glucose deprivation by promoting autophagy[J].Biomolecules &Therapeutics, 2012, 20(1):68-74.
[61] KIM S M, CHUNG M J, HA T J, et al.Neuroprotective effects of black soybean anthocyanins via inactivation of ASK1-JNK/p38 pathways and mobilization of cellular sialic acids[J].Life Sciences, 2012, 90(21-22):874-882.
[62] BADSHAH H, ALI T, AHMAD A, et al.Co-treatment with anthocyanins and vitamin C ameliorates ethanol- induced neurodegeneration via modulation of GABAB receptor signaling in the adult rat brain[J].CNS &Neurological Disorders Drug Targets, 2015, 14(6):791-803.
[63] KIM J N, HAN S N, HA T J, et al.Black soybean anthocyanins attenuate inflammatory responses by suppressing reactive oxygen species production and mitogen activated protein kinases signaling in lipopolysaccharide-stimulated macrophages[J].Nutrition Research and Practice, 2017, 11(5):357-364.
[64] HASHIMOTO N, OKI T, SASAKI K, et al.Black soybean seed coat extract prevents hydrogen peroxide-mediated cell death via extracellular signal-related kinase signalling in HepG2 cells[J].Journal of Nutritional Science and Vitaminology, 2015, 61(3):275-279.
[65] CHOE Y J, HA T J, KO K W, et al.Anthocyanins in the black soybean (Glycine max L.) protect U2OS cells from apoptosis by inducing autophagy via the activation of adenosyl monophosphate-dependent protein kinase[J].Oncology Reports, 2012, 28(6):2049-2056.
[66] PAIK S S, JEONG E, JUNG S W, et al.Anthocyanins from the seed coat of black soybean reduce retinal degeneration induced by N-methyl-N-nitrosourea[J].Experimental Eye Research, 2012, 97(1):55-62.
[67] HIEMORI-KONDO M, MORIKAWA E, FUJIKURA M, et al.Inhibitory effects of cyanidin-3-O-glucoside in black soybean hull extract on RBL-2H3 cells degranulation and passive cutaneous anaphylaxis reaction in mice[J].International Immunopharmacology, 2021, 94:107394.
[68] DORJSEMBE B, NHO C W, CHOI Y, et al.Extract from black soybean cultivar A63 extract ameliorates atopic dermatitis-like skin inflammation in an oxazolone-induced murine model[J].Molecules, 2022, 27(9):2751.
[69] TSOYI K, PARK H B, KIM Y M, et al.Anthocyanins from black soybean seed Coats inhibit UVB-induced inflammatory cylooxygenase-2 gene expression and PGE2 production through regulation of the nuclear factor-kappaB and phosphatidylinositol 3-kinase/Akt pathway[J].Journal of Agricultural and Food Chemistry, 2008, 56(19):8969-8974.
[70] YOON B I, BAE W J, CHOI Y S, et al.Anti-inflammatory and antimicrobial effects of anthocyanin extracted from black soybean on chronic bacterial prostatitis rat model[J].Chinese Journal of Integrative Medicine, 2018, 24(8):621-626.
[71] JANG H, BAE W J, YUK S M, et al.Seoritae extract reduces prostate weight and suppresses prostate cell proliferation in a rat model of benign prostate hyperplasia[J].Evidence-Based Complementary and Alternative Medicine, 2014, 2014(1):475876.
[72] HA U S, BAE W J, KIM S J, et al.Anthocyanin induces apoptosis of DU-145 cells in vitro and inhibits xenograft growth of prostate cancer[J].Yonsei Medical Journal, 2015, 56(1):16-23.
[73] XU L J, CHOI T H, KIM S, et al.Anthocyanins from black soybean seed coat enhance wound healing[J].Annals of Plastic Surgery, 2013, 71(4):415-420.
[74] MIN H K, KIM S M, BAEK S Y, et al.Anthocyanin extracted from black soybean seed Coats prevents autoimmune arthritis by suppressing the development of Th17 cells and synthesis of proinflammatory cytokines by such cells, via inhibition of NF-κB[J].PLoS One, 2015, 10(11):e0138201.
[75] 邢金月, 杨梦平, 翟玲侠, 等.彩色马铃薯花色苷及其生理活性的研究进展[J/OL].分子植物育种,1-10 [2024-09-26].XING J Y,YANG M P,ZHAI L X,et al.Research Progress on Colored Potato Anthocyanins and Their Physiological Activities[J/OL].Molecular Plant Breeding, 1-10 [2024-09-26].
[76] 张晓俭, 范丽霞.蓝莓花色苷抗疲劳功效及机制研究[J].食品科技, 2024, 49(7):231-236.ZHANG X J, FAN L X.Anti-fatigue effect and mechanism of blueberry anthocyanins[J].Food Science and Technology, 2024, 49(7):231-236.