食品安全事关全球公共健康,是一项重要的议题,直接影响人类的生存与发展。随着全球化贸易的推进,食品供应链变得愈加复杂,食品安全问题频繁显现。多起食品污染事件引发了公众对“舌尖上安全”问题的广泛关注。伴随食品生产和加工技术的不断进步,食品中可能含有的细菌、生物毒素、过敏原及转基因成分等安全隐患与日俱增。根据世界卫生组织的数据显示,食品安全问题导致的食源性疾病和死亡案例屡见不鲜,这使得食品安全的监管与检测显得尤为迫切。传统的食品检测方法,如培养基法、聚合酶链式反应和免疫分析法等,虽然应用广泛,但存在时间长、操作复杂、需要专业设备、灵敏度不高等局限性,难以满足快速检测、准确检测的需求。因此,急需开发更高效、灵敏且便携的检测技术,以确保食品的安全性和质量。核酸等温扩增技术是一种在特定恒定温度下进行的核酸扩增方法,通过特定的酶和引物设计,实现了在恒定温度下对目标核酸序列的快速扩增。与传统的聚合酶链式反应、免疫分析法相比,它不需要温度变化,因此简化了实验条件,减少了对专业设备的依赖,能够满足快速、简便、低成本的现场检测方法的需求。与此同时,核酸等温扩增技术还具有更高的灵敏度和特异性,能够检测到更低浓度的目标核酸,且不受抗体交叉反应的影响,在食品安全检测领域显示出巨大的潜力和优势。本文将探讨该技术的类型、应用现状、与相关技术的结合及其未来发展方向。
1 环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术
LAMP技术是一种具备“简洁、迅速、精准、经济”特性的基因扩增技术,自2000年首次发布就备受关注。如图1、图2所示,该技术针对目标DNA链上的6个位点设计4种或6种引物,再利用链置换型DNA合成酶在恒定温度下进行反应。其扩增效率极高,能实现对痕量核酸的大量扩增,且对抑制物的耐受程度较高,可以简化核酸提取过程。该技术可以通过检测扩增产物的生成情况快速判断靶基因序列的存在或缺失,其反应灵敏度<10拷贝/反应。

图1 哑铃状模板结构的形成过程
Fig.1 Formation process of dumbbell-like template structures

图2 LAMP扩增
Fig.2 LAMP amplification
LAMP技术因其高灵敏度和特异性,在食品安全检测领域得到了广泛应用。以下是LAMP技术在食品安全检测中的一些主要应用:
LAMP技术在检测食品中真菌、细菌等病原微生物污染的应用已经获得了广泛的关注与认可。XIONG等[1]开发了一种用于目视检测金黄色葡萄球菌的闭管LAMP测定法,选择甲酚红作为最佳视觉性能的最佳染料,显示出良好的灵敏度,对纯化 DNA 的检出限为5.4拷贝/μL。另一方面,吕观等[2]开发了一种结合免疫磁珠分离与LAMP技术的方法,旨在检测牛肉样本中金黄色葡萄球菌和鼠伤寒沙门氏菌。该方法通过生物素标记这2种细菌的特异性抗体,并借助链霉亲和素功能化磁珠的特性来实现对目标的富集与检测。
此外,LAMP技术在食品掺假检测中展现出了显著的应用潜力,能够有效识别多种肉类中的非法添加成分,确保食品标签的真实性。ZHANG等[3]通过应用特异于线粒体细胞色素b基因及细胞色素c氧化酶亚基的物种特异引物,对食品样本中的猪肉、牛肉、羊肉和鸭肉进行了同步检测。他们将不同的引物预先固定在实时荧光LAMP-微流控芯片的独立反应单元中,实现了在30 min内完成整个扩增过程。该实时荧光LAMP-微流控检测技术展现出了优异的特异性和灵敏度,对模拟的掺杂样本检测限低至0.1%。陈珍金等[4]开发了基于 LAMP快速检测鼠的线粒体基因(大鼠环氧化酶基因KP244683.1和小鼠的16S rRNA基因KY018919.1)的方法,以SYTO-9荧光染料作为DNA扩增指示剂,通过优化反应条件,大鼠、小鼠的鼠源性掺假成分检测限分别为0.1%、0.5%,实现对市售肉制品是否掺杂鼠源性成分的判定。
在霉菌毒素检测中,FERRARA等[5]开发了一种基于fum10基因设计引物的方法,能够对田间粗提取的DNA样本进行直接且可视化的评估,从而为霉菌毒素的检测提供了一种高效的现场快速检测方案。与传统的比色法相比,该方法在快速检测产伏马菌素B2的黑曲霉和卫氏曲霉方面展现出明显的优势。这种新颖的检测方法不仅展现出卓越的特异性,同时也适合用于玉米食品链的现场监测。
LAMP技术还可用于转基因食品的检测中。近年来,转基因作物的商业化在全球范围内不断增加,其种植面积从1996年的170万hm2增加到2017年的1.898 亿hm2。虽然转基因作物的种植面积和种类不断扩大,但其安全性一直备受争议,因此食品中转基因成分的检测也颇受社会重视。YU等[6]提出了一种创新的LAMP与TaqMan实时荧光定量聚合酶链反应技术结合的方法,旨在对携带 NOS 终止子的转基因生物进行快速的定性筛查。与传统的 TaqMan PCR 方法相比,该方法在特异性和检测灵敏度方面表现出与 TaqMan PCR 方法相当的水平,但其在等温扩增过程中荧光信号出现更快,整体反应时间明显缩短。TAKABATAKE等[7]则开发了一套靶向花椰菜花叶病毒35S启动子(P35S)LAMP介导的转基因木瓜筛选检测方法,专门用于检测番木瓜内源参考序列木瓜凝乳蛋白酶,同时为提高成本效益,结合测流层析技术,成功实现P35S 和木瓜凝乳蛋白酶的双重检测。该技术简便高效,可用于筛查转基因番木瓜,从而在防范未经授权的转基因作物对生态环境可能带来的潜在污染方面发挥重要作用。
LAMP技术凭借其高灵敏度和特异性,在食品过敏原检测中展现出巨大潜力,特别是在花生和虾类过敏原的快速识别方面。SHEU等[8]开发了用于检测虾DNA的LAMP法,该方法检测虾 DNA 的灵敏度是常规 PCR 的100倍,且仅需30 min就能排除其他甲壳类动物DNA的干扰,准确识别加工食品中的虾成分。这一技术的进步有望在食品安全和过敏原管理中发挥重要作用。
LAMP技术在食品新鲜度检测中也扮演着越来越重要的角色。张晋豪等[9]建立了一种基于LAMP技术快速检测假单胞菌数量的方法,以实现对冷鲜鸡新鲜度检测。该方法以假单胞菌16S rDNA为靶标设计引物,通过裸眼观察羟基萘酚蓝的颜色变化(蓝—紫)以及在646 nm波长处的吸光度值来判断反应结果。经过反应条件的优化,LAMP技术的检测结果与传统感官评定结果相一致,这表明该方法有望成为传统检测方法的替代品,具有广泛的应用前景。
此外,LAMP技术与其他检测技术的结合开辟了食品检测的新途径,进一步提升了其在食品检测中的应用效果。
LAMP技术与生物传感器联用为快速诊断食品安全问题提供了强有力的工具。CHEN 等[10]创新性地将LAMP技术与横向流动生物传感器相结合,开发了一种用于快速且准确地检测疟原虫的新方法。该生物传感器设计有2个特定的结合区域:控制线和检测线。在LAMP扩增产物两端添加了荧光素和生物素标签,当这些标记的产物与传感器的线条结合时,能够吸引纳米金粒子,从而在传感器上形成可见的红色条带。NAWATTANAPAIBOON等[11]基于LAMP 技术研发了一种用于检测耐甲氧西林金黄色葡萄球菌中femB和mecA基因的光学生物传感器。金黄色葡萄球菌可产生7种不同的毒素,这些毒素常常引起食物中毒。该生物传感器通过将每个基因特异性的生物素化捕获探针固定在链霉亲和素修饰的芯片上,并利用表面等离子体共振技术监测与 LAMP 扩增子杂交。此外,为了提升检测灵敏度,该生物传感器采用了带有金纳米颗粒标记的报告探针进行夹心测定,用以放大信号。结果显示,这种金纳米颗粒标记的报告探针能将生物传感器的灵敏度提高一个数量级,达到10 拷贝/μL的检测限。
如图3、图4所示,结合LAMP技术和微流控芯片,研究人员开发出了一种高效、高特异性的食品过敏原检测方法,极大地提高了检测的效率和准确性。SHARMA等[12]基于LAMP方法开发了一种全自动的微流控实验平台,该平台能够精确操控磁珠的运动,确保目标核苷酸片段在磁珠表面的有效捕获和扩增。利用白晶体紫染料的比色特性,通过观察扩增室中的颜色变化即可判断结果是否为阳性。这种全自动的检测方法不仅性能卓越,而且在样品处理到结果判读的整个过程中无需人工干预,大大减少了操作误差对检测结果的影响。
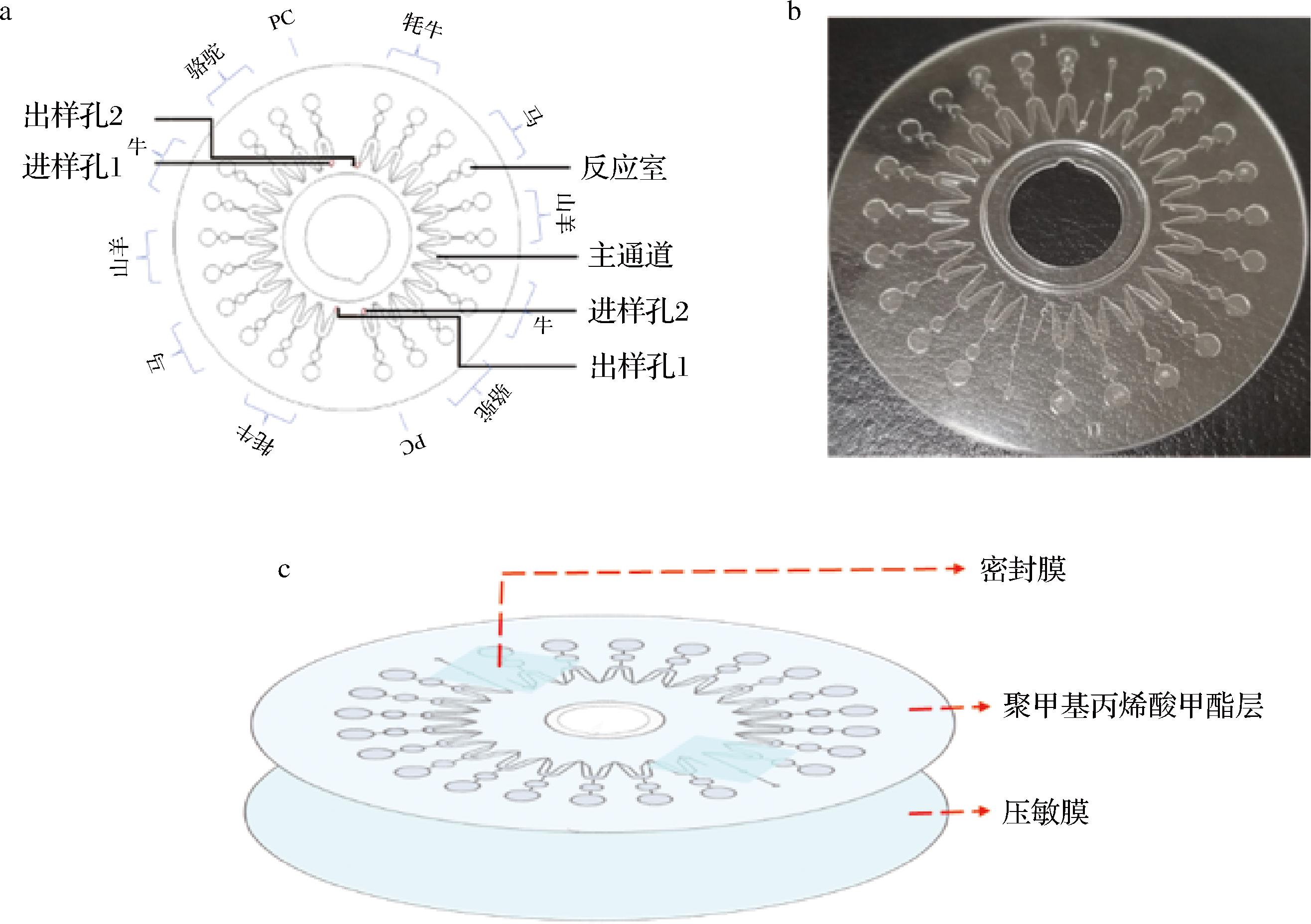
a-结构示意图;b-实物照片;c-分层结构分解图
图3 微流控芯片设计示意图
Fig.3 Schematic diagram of microfluidic chip design
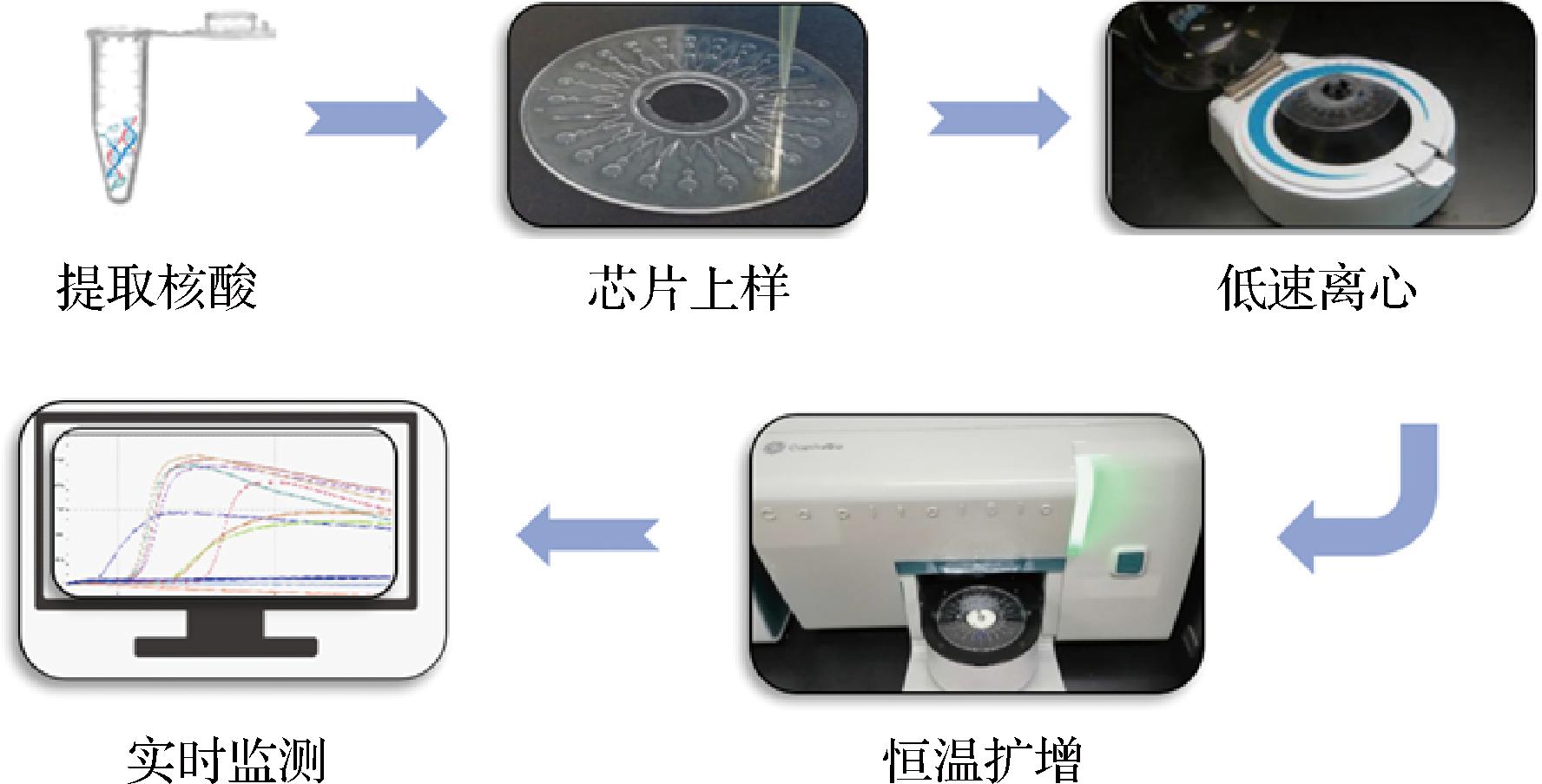
图4 微流体装置检测流程
Fig.4 Detection process of the microfluidic device
LAMP技术与横向流动试纸条的结合简化了检测流程,为过敏原基因检测提供了一种既快速又简便的方法。ALLGÖWER等[13]利用LAMP技术,开发了一种针对过敏原大豆的基因检测方法,其基本原理在于对LAMP引物进行荧光标记,并在横向流动试纸条上实现显色,主要适用于食品生产过程中的现场应用或现场分析筛选大豆过敏原,显著降低了样本污染的风险。
LAMP技术与便携式荧光仪的结合,为现场快速检测提供了一种有效的技术手段。SUL等[14]提出了一种直接的LAMP技术用于现场检测肉制品中的鸡肉。这一方法基于线粒体16S rRNA基因,利用便携式荧光仪进行检测,并在24种动物物种的样本中实现了对目标物种的特异性识别,为现场快速检测技术的应用奠定了基础。
LAMP技术与分子信标相结合,为食品安全检测带来了新的精确度。分子信标是一种具有约15~30个碱基对的DNA茎环结构,荧光团与猝灭剂分别位于其5′和3′末端。在缺乏目标DNA的情况下,荧光团因与猝灭剂的接近而发生荧光淬灭,这一过程通过荧光共振能量转移机制实现。LIU等[15]探索了将LAMP技术与分子信标技术相结合的新方法。研究发现,分子信标仅在与目标DNA序列特异性结合后才会发出荧光信号,从而直接指示扩增反应的结果,并且这种结果可以通过肉眼直接观察。此外,该技术有效避免了传统LAMP检测中可能出现的非特异性扩增导致的假阳性问题,提高了检测结果的准确性。因此,这种结合技术在食品安全检测领域展现出更高的可靠性和效率。
LAMP技术与智能手机结合。JIA等[16]开发了一种创新的荧光检测方法,用于检测鼠伤寒沙门氏菌,该方法巧妙地将LAMP技术与智能手机技术相结合。他们利用三维打印技术制造了一款便携式设备,集成了LAMP反应区、荧光激发区和观察区,并配套开发了一款手机应用程序来分析荧光图像。这款应用程序能够检测到人眼难以识别的荧光信号,检出限可达5.5 CFU/mL。该便携式装置使得鼠伤寒沙门氏菌能够在现场快速被检测出来。这一技术的进步显著缩短了食源性致病菌检测的时间,同时,便携式设备的设计也提高了执法部门在处理食品安全案件时的效率。
2 滚环扩增(rolling circle amplification,RCA)技术
RCA技术是一种基于循环模板的等温核酸扩增方法。该技术于20世纪90年代中期由美国卡内基研究所的FIRE团队和斯坦福大学的Kool团队相继提出。RCA技术的核心机制在于运用一种特殊的DNA或RNA聚合酶,该酶具备在环形DNA或RNA模板上进行持续性合成的能力,从而生成延长的单链DNA或RNA分子。这一过程始于聚合酶对环状模板上的特定引物区域的识别与结合,随后沿着模板链进行连续的合成反应。在每次合成周期中,新合成的链会取代前一周期的链,形成新的单链产物。这些单链产物随后能够与荧光标记物或其他检测试剂相结合,实现信号放大,进而对目标分子进行高效检测。通过这种机制,RCA技术能够以高灵敏度和特异性识别特定的核酸序列。连接滚环扩增技术(ligation-rolling circle amplification, LRCA)是基于滚环扩增原理的核酸扩增技术,如图5所示,其通过引入连接反应,提高了扩增的特异性和信号放大能力,更适合用于复杂样本中低丰度核酸分子的检测。
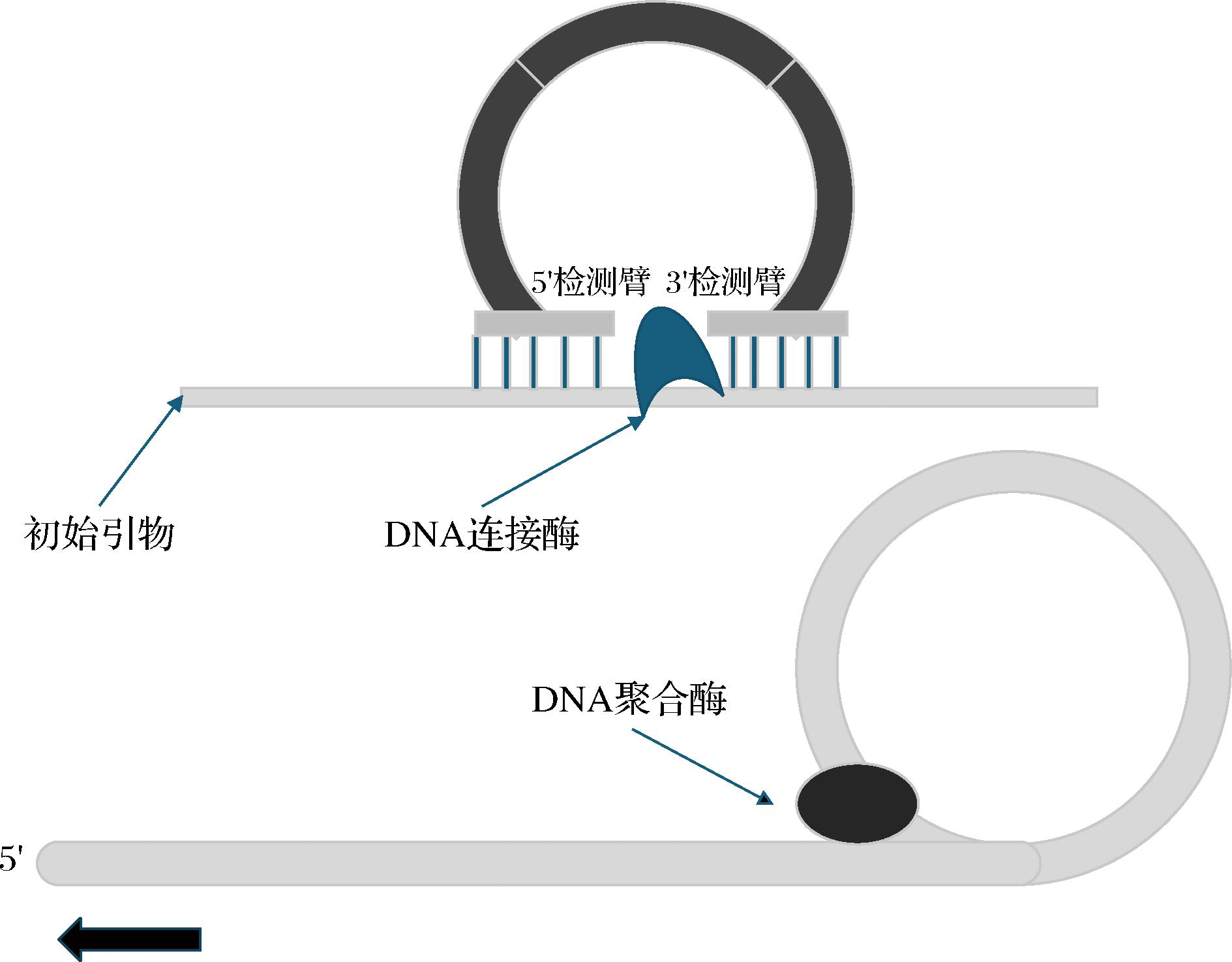
图5 锁式探针的成环步骤与 LRCA 的扩增步骤
Fig.5 Circularization steps of the padlock probe and amplification steps of LRCA
RCA技术在食品安全检测中能够快速、灵敏且特异性地放大目标核酸序列,实现对食品中微量污染物的检测。
RCA技术在食源性细菌检测中扮演了至关重要的角色。在微生物的定量分析领域,RCA技术通过针对特定核酸标志物的量化来完成检测分析。GUO等[17]研究者基于RCA技术开发了一种简单、低成本的电化学生物传感器。该技术开创性地将RCA扩增的DNA模拟酶与电化学检测相结合,在对大肠杆菌的检测中,表现出了极高的灵敏度和特异性,其检测下限可达8 CFU/mL。WANG等[18]和ZHANG等[19]先后开发了基于跨越式滚环扩增(saltatory rolling circle amplification, SRCA)的技术平台,并将其成功应用于检测蔬菜沙拉中的志贺氏菌和婴儿配方奶粉中的克罗诺杆菌。与常规PCR技术相比,SRCA技术无需使用昂贵的热循环设备,并且避免了电泳步骤。在荧光信号检测的灵敏度上提高了逾百倍,进一步凸显了其在食品安全检测领域的应用潜力。
在食品真实性检测方面,RCA技术也展现出极高检测准确性和灵敏度。XU等[20]开发了一种 T-三聚氰胺-T 碱基错配介导的RCA信号增强方法,用于对牛奶中的三聚氰胺进行高敏感和无标记的荧光检测。该技术利用T-三聚氰胺-T碱基错配原理,实现了2.5 nmol/L的检测限,展示了RCA技术在食品掺假监控中的潜在应用价值。胡学佳等[21]基于RCA技术针对肉制品中掺假鼠肉的情况开发了一种可视化跨越式滚环等温扩增检测方法。该方法以鼠线粒体DNA作为靶标,并设计筛选出一对特异性引物。实验结果表明,该法对鼠肉DNA的检测灵敏度高达7.3 fg/μL,并且在模拟掺假实验中,能够检测到含量低至0.01%的鼠肉。
在生物毒素检测方面,RCA技术为食品中毒素的准确测定提供了有效手段。PANG等[22]采用RCA技术构建了灵敏、高通量的电化学酶联免疫吸附测定平台,实现了对乳制品中黄曲霉毒素M1的肉眼量化检测,其检测下限为0.15 ng/mL。此外,GU等[23]针对蛤蜊肉中的大田软海绵酸毒素,研发了一种基于RCA技术的直接竞争核酸适配体荧光分析手段,该方法的检测下限为1 pg/mL,并在1 pg/mL~100 ng/mL的质量浓度范围内展现了高度的灵敏度。
RCA技术在转基因食品检测中展现了高效性和成本效益。WANG等[24]开发的多重不对称 PCR与超分支RCA技术联用的反向点杂交系统来检测转基因农作物, 该系统在检测转基因大豆DNA时,其检出限可达0.5 ng/L。研究进一步表明,RCA技术在检测转基因作物方面具有多重优势,不仅有效提高了检测效率,还降低了检测成本。这一技术为转基因农作物的快速筛查和精准监管提供了创新性的解决方案,推动了相关检测方法的优化与应用。
RCA技术提高了对于食物过敏源检测的效率和准确性。YANG等[25]首次将羟基萘酚蓝染料与跨越式滚环等温扩增技术相结合,应用于花生过敏源的检测。该方法通过封闭管系统实现直观检测,有效避免了交叉污染的风险,在二元混合物中,该技术相对检测限为0.01%。凭借成本低廉、特异性强及灵敏度高等优势,该技术为食品过敏原的现场快速检测提供了极具潜力的解决方案。
RCA技术在农、兽药残留检测中发挥了重要作用。近年来,随着市场对农产品中农兽药残留快速检测需求的激增,RCA信号放大技术的运用显著增强了检测的灵敏度。LIU等[26]将乙酰胆碱酯酶催化的DNA结构变化与RCA信号放大技术相结合,检测食品中的有机磷和氨基甲酸酯类农药,其检测的线性范围为10~10000 μg/L,检测限可达2.1 μg/L。HE等[27]针对牛奶和鱼肉中的卡那霉素,开发了一种结合搅拌棒辅助吸附提取与RCA信号放大的微流控芯片技术,大幅降低了基质干扰,检测下限可达0.3 pg/mL。这些研究成果通过多样化手段实现了农兽药残留的高效检测。
重金属作为环境中的持久性污染物,对公共卫生和食品安全构成严重威胁。由于Pb2+的污染可沿食物链积累,对公众健康造成严重威胁,因此人们投入了大量研究工作来开发用于监测Pb2+的快速、灵敏和选择性生物传感器。CAI 等[28]巧妙设计了一种双DNA模拟酶反馈扩增结合双重RCA信号放大的电化学Pb2+检测系统。其构建的基于碳纤维微电极的小型电化学器件用以记录电化学信号的降低,对水中的Pb2+展现出高选择性和高灵敏度的检测能力,检出限达到0.048 pmol/L,且样品用量可减少至10 μL。该电化学检测系统不仅提高了Pb2+检测的选择性和灵敏度,还减少了样品用量,为重金属污染的快速检测提供了创新解决方案。
此外,RCA技术搭载如分子信标、生物传感器和微流控芯片等技术,可以显著提升检测的灵敏度和特异性,实现对食品中微量有害物质的快速检测;同时,这种技术组合能够简化操作流程,减少样品前处理步骤,提高检测效率,并使检测结果更加稳定可靠,从而在食品安全检测领域展现出广阔的应用前景。
RCA技术与分子信标的结合为食品中微生物检测提供了一种高灵敏度的新方法。GAO等[29]开发了一种基于核酸外切酶Ⅲ辅助靶标回收和RCA技术结合的新型双扩增策略,用于 DNA的超灵敏电化学检测。该方法使用金电极固定带有3′突出端的分子信标作为识别探针并执行双信号放大程序,同时避免了标准电化学检测中的脱氧程序,在食品微生物检测中具有广阔的应用前景。
随着快速检测技术的不断发展,检测的芯片化与高通量化已成为一种主要的研究趋势。RCA技术在微流控芯片平台的应用显著提升了检测信号的强度,从而大幅增强了检测的灵敏度。JIANG等[30]成功研发了一种针对大肠杆菌O157∶H7的RCA放大微流控芯片系统。与未经过RCA处理的对照组相比,该系统的信号强度提升超过50倍,有效提升了食品安全检测的精确性和工作效率,为快速、可靠的食品检测提供了有力支持。
RCA技术与生物传感器的结合为食品中有害物质的检测提供了高灵敏度和特异性的新方法。XIE等[31]基于RCA技术开发了一种夹心型阻抗生物传感器,用于检测大肠杆菌中的脂多糖。该生物传感器将RCA引物修饰的金纳米颗粒作为信号探针,经过RCA后,产生了长单链DNA重复序列,显著增强了抗性信号。另一方面,XU 等[32]首次在核酸适配体传感器中采用双步放大策略, 使切口酶扩增反应和RCA技术相结合, 可检测到低至5 CFU/mL的金黄色葡萄球菌,该传感器对活体金黄色葡萄球菌具有良好的检测能力,可用于食品工业中金黄色葡萄球菌的检测。这些基于RCA技术的创新生物传感器技术为食品安全检测提供了多样化的工具,增强了检测的准确性和便捷性。
3 重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术
RPA技术在食品安全检测中有快速、灵敏、特异且无需热循环的核酸扩增能力,能够在接近体温的条件下进行,适合现场快速检测,在寄生虫和转基因食品等方面检测展现出优势。如图6所示,重组酶与引物结合形成的蛋白-核酸复合体可以在双链DNA中精准识别并定位至目标同源序列。当引物成功结合到同源区域后,会触发链交换反应,从而启动DNA的合成过程,最终实现对模板特定区域的指数级扩增。在此过程中,被置换的DNA链与单链DNA结合蛋白发生相互作用,从而有效防止再次出现链交换现象。整个扩增流程迅速高效,通常在短短10 min之内,就能达到可检测的扩增产物水平。

图6 RPA反应原理图
Fig.6 Schematic diagrams of RPA
RPA技术的运用提高了食源性细菌检测的灵敏度和速度,还简化了检测流程,为食品安全检测领域提供了高效、便捷的新方法。LIU等[33]通过融合簇状规律间隔短回文重复序列及其相关蛋白(CRISPR/Cas12a)与RPA技术,开发了一种用于快速现场检测蛋类中沙门氏菌的新方法。该检测过程耗时仅4 h,灵敏度与荧光定量PCR 技术的灵敏度相当,但该方法的操作比荧光定量PCR 更简单、更快捷。周广彪等[34]开发了一种针对拟态弧菌特异VmhA基因的RPA检测技术,该方法无需任何仪器支持,仅需在人体正常体温下反应40 min,便能特异性地扩增出拟态弧菌的目标DNA片段。该技术具有反应时间短、对设备依赖性低的特点,适合现场检测应用,其灵敏度与传统的PCR方法相当,达到0.1 ng/μL。
RPA技术的扩增特异性以及灵敏度为食品真实性检测提供了有效工具。郭燕华等[35]研发了一种针对牛源线粒体细胞色素B基因的RPA检测技术,其检测灵敏度高达0.1 ng/μL,适用于对市售生鲜及加工肉品中牛源成分的准确鉴定。林霖等[36]则基于细胞色素C氧化酶亚型I中的猪特异性DNA序列,结合快速核酸提取技术,建立了一种RT-RPA快速检测方法,该方法能够检测出牛肉中低至1%(质量分数)的猪肉掺假,有效区分牛肉与猪肉的混合情况。
RPA技术在寄生虫检测中提供的新方法,有助于提高寄生虫感染的防控效率。近期,人类因摄入含有寄生虫原虫的动物源性食品而引发的传染病事件屡见不鲜,这一现象已逐步演变成一项重大的公共卫生挑战。食用未完全煮熟或生的、含有寄生虫的食品可能会引起多种寄生虫疾病,某些寄生虫在人体内的潜伏期甚至可能长达数十年。鉴于此,开发快速且高效的寄生虫早期筛查手段,对于寄生虫感染的预防和控制至关重要。JARVI等[37]采利用RPA及RPA-侧流层析法技术,针对蛞蝓等宿主中广州管圆线虫的快速检测进行了研究。这些方法展现出了较高的灵敏度,其中RPA技术的最低检测限为25 拷贝/μL,而RPA-侧流层析法技术的最低检测限则为50 拷贝/μL,这些方法可作为qPCR检测的有效替代。张惠媛[38]建立外切酶辅助的RPA反应体系,并对反应条件进行了优化,使得在39 ℃的温度下,仅需20 min即可完成对华支睾吸虫成虫、囊蚴及虫卵的快速检测。该体系对华支睾吸虫基因组DNA的检测灵敏度达到10 fg/μL,对于含有目标片段的重组质粒,其检测下限为102 拷贝/μL。
目前,RPA技术已成功应用于检测转基因食品方面,并展现出巨大潜力。LI等[39]构建了一种基于通用引物的多重RPA侧向流动生物传感器,用以实现对转基因玉米的多重分析。这项技术凭借高灵敏度、强特异性、快速检测和低成本等显著优势,为转基因玉米的高效筛查提供了全新的解决方案。该传感器能够灵活检测包括MON810、MON863和MON89034在内的3种转基因玉米品种,最低检出限可达50拷贝/reaction。
此外,RPA技术搭载其他技术,如纳米材料或生物传感器以及上文中提高的CRISPR/Cas系统、实时荧光PCR技术,可以显著提升检测的灵敏度和特异性,这种技术组合能够简化检测流程,减少对复杂仪器设备的依赖,增强现场快速检测的能力,并拓宽检测的应用范围,从而在食品安全监测领域提供了一种高效、低成本的解决方案。
如图7所示,融合RPA技术与侧流试纸条技术,兰全学等[40]成功开发出了一种针对大肠杆菌O157∶H7的高灵敏度检测新方法。该检测技术能够检测到浓度低至1.2×104 CFU/mL的大肠杆菌O157菌液,不仅能够迅速且准确地识别食品中的大肠杆菌O157,而且操作简便,无需依赖专业设备,具有成本效益,为现场快速诊断提供了一种更为灵敏的解决方案。
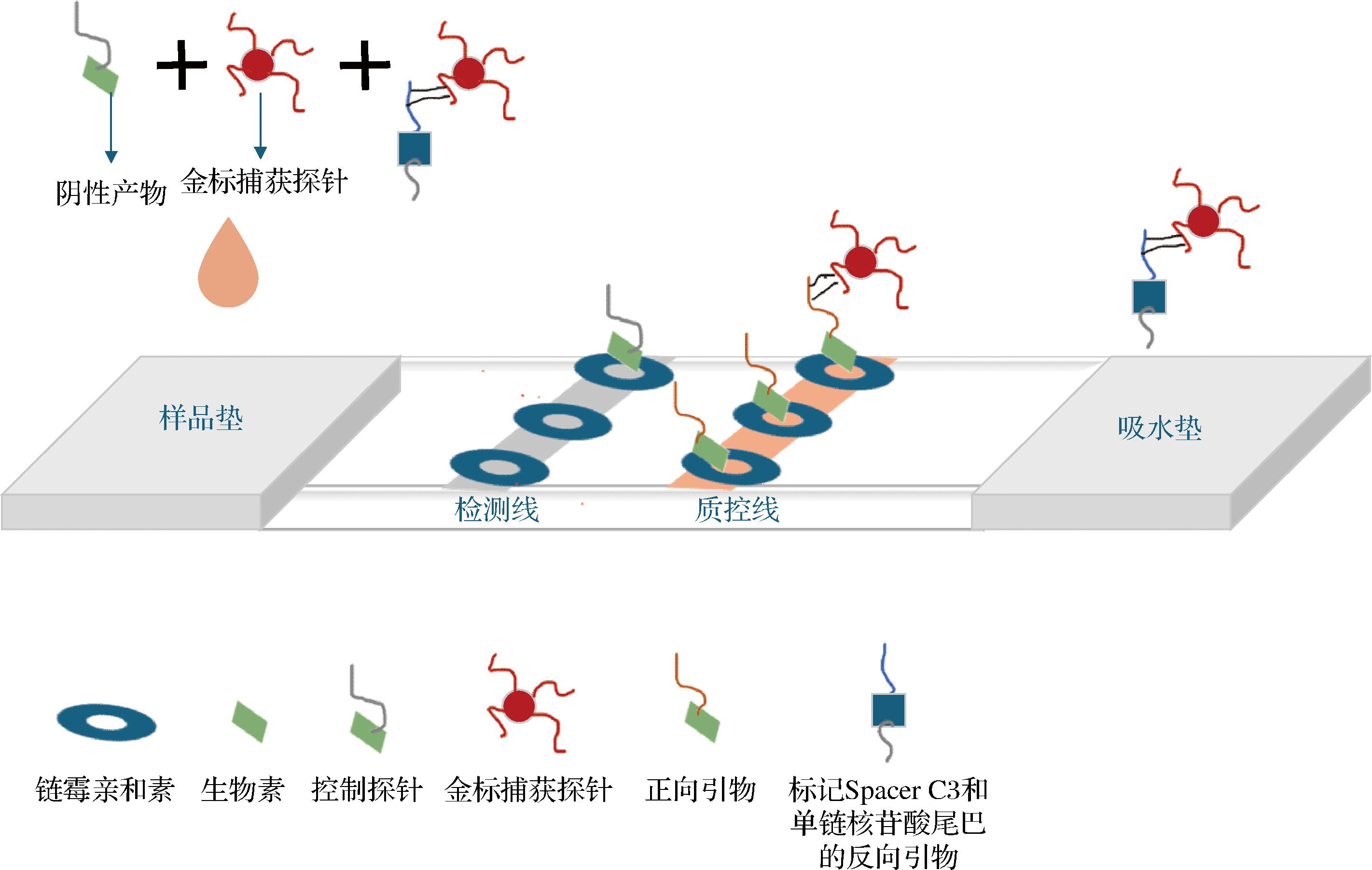
图7 RPA试纸条原理示意图
Fig.7 Schematic diagram of RPA test strip
结合RPA技术与基因芯片,能够显著提高检测的通量。YIN等[41]开创性地将数字PCR的理念融入RPA反应中,研发出了数字RPA技术。数字RPA技术将荧光检测功能集成于芯片平台,开发出一种快速检测方法,能够同时精准识别大肠杆菌O157∶H7、单核细胞增生李斯特菌和肠炎沙门氏菌,为多目标致病菌的高效筛查提供了创新手段。此方法仅需45 min即可在牛奶中完成对这3种主要致病菌的检测,其检测下限达到10个细胞/芯片,充分展示了其在快速诊断领域的应用前景。
RPA技术与生物传感器相结合。DEL R O 等[42]基于RPA技术开发了一种电化学生物传感器,用于检测鲑鱼中的Piscirickettsia salmonis,这是一种导致鲑鱼立克次体病的细菌。通过添加链霉亲和素-辣根过氧化物酶偶联物对随后的表面栓系双链扩增子的形成进行电化学监测,固相 RPA方法将DNA扩增、杂交和检测整合到一个平台上,从而减少分析时间和污染,并为现场检测铺平道路。
O 等[42]基于RPA技术开发了一种电化学生物传感器,用于检测鲑鱼中的Piscirickettsia salmonis,这是一种导致鲑鱼立克次体病的细菌。通过添加链霉亲和素-辣根过氧化物酶偶联物对随后的表面栓系双链扩增子的形成进行电化学监测,固相 RPA方法将DNA扩增、杂交和检测整合到一个平台上,从而减少分析时间和污染,并为现场检测铺平道路。
结合RPA技术与CRISPR技术,研究者们开发出了一系列高灵敏度和高特异性的检测方法,这些方法在食品安全和病原体检测领域显示出显著的应用潜力。李焓笑[43]、TIAN等[44]通过将RPA与CRISPR技术相结合,建立了一种针对单核细胞增生李斯特菌的检测方法,其灵敏度高达1.5×10-3 ng/μL[43],WANG 等[45] 等开发了一种基于CRISPR/Cas12a的准确超敏感鉴别平台,能够在50 min内完成从基因组DNA提取到一锅法反应的过程,实现对牛奶等复杂基质食品中大肠杆菌O157∶H7和金黄色葡萄球菌的快速鉴别,检测限低至1 CFU/mL。2017年,GOOTENBERG等[46]的创新突破,即特异性高灵敏度酶促解锁(specific high sensitivity enzymatic reporter unLOCKing,SHERLOCK)的开发,进一步提升了检测的特异性和灵敏度。该方法能够识别单个碱基差异,并对多种病原体进行快速检测。SHERLOCK v2技术的升级,实现了多重荧光定量检测,该研究团队还开发了简便的检测试纸条,减少了对外部设备的依赖,极大提升了现场检测的便捷性。
4 酶促重组等温扩增(enzymatic recombinase amplification,ERA)技术
ERA技术是一种新兴的分子生物学技术,如图8所示,其基本原理是通过特定的酶在恒定温度下进行反应,从而实现对目标DNA或RNA序列的扩增。该技术通常使用重组DNA酶和特异性引物,在无须复杂的热循环设备的情况下,能够有效地将目标序列在短时间内扩增到足够的量以供后续分析。这种技术的优点在于其高效性、灵敏度和特异性,能够在复杂的样本中快速检测出目标核酸序列,从而为疾病的诊断和食品安全检测提供了有力的工具。
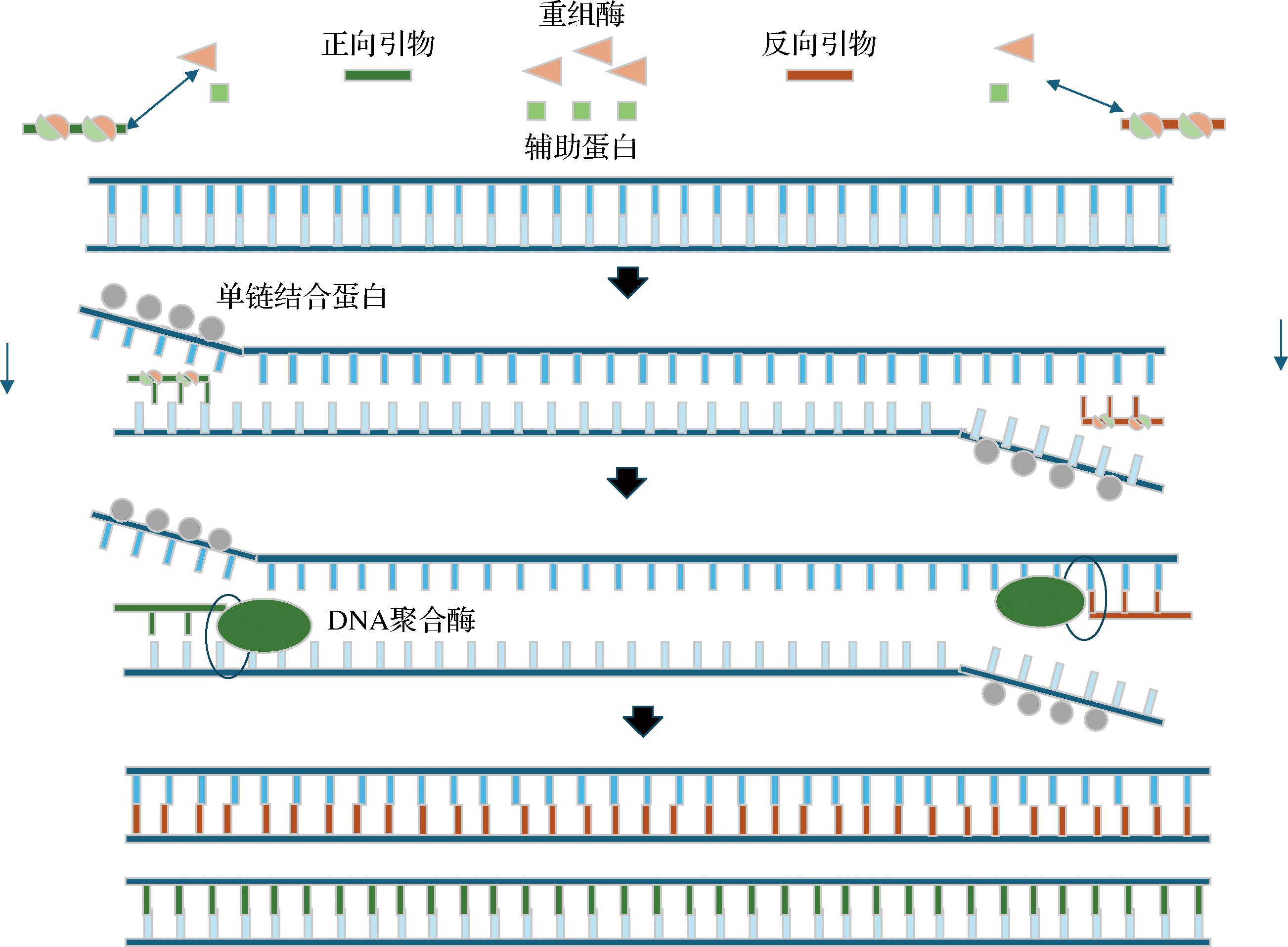
图8 ERA反应原理图
Fig.8 Schematic diagrams of ERA
ERA技术作为一种国内自主研发的核酸等温扩增方法,尽管相关研究报道不多,但其应用潜力在食品安全和领域已初现端倪。MENG等[47]利用ERA-CRISPR技术对食品中的腐败微生物进行了探究,并成功开发出一种简便的检测啤酒腐败菌的方法,该方法的检测灵敏度可达10拷贝DNA。ZHANG等[48]开发的ERA-CRISPR/Cas12a检测技术,适用于猪圆环病毒3型的检测,能够识别低至7拷贝的DNA片段,其检测效率与实时荧光定量检测技术相媲美。
ERA技术在食品安全检测中与其他检测技术联用的报道较少,但从该技术在医学领域的应用可知,ERA技术与高通量测序组合不仅提高了检测的灵敏度,还能有效降低假阳性和假阴性的发生率。此外,ERA技术还可以与机器视觉系统结合,利用图像分析技术对食品进行自动化检测,从而提升检测的效率和准确性。期待未来在实际应用中,ERA技术能为食品行业的健康发展提供强有力的支持。
5 等温链置换技术(isothermal strand displacement polymerization reaction, ISDPR)
ISDPR技术是等温扩增技术家族的新成员,于2009年首次引入,在模板引物和聚合酶的作用下,可以通过链置换产生大量扩增产物以进行信号放大。如图9所示,ISDPR反应通常在37 ℃下运行约120 min,但需先经过95 ℃的初始变性步骤,以形成能够与发夹探针杂交的单链DNA,为后续信号放大提供基础。
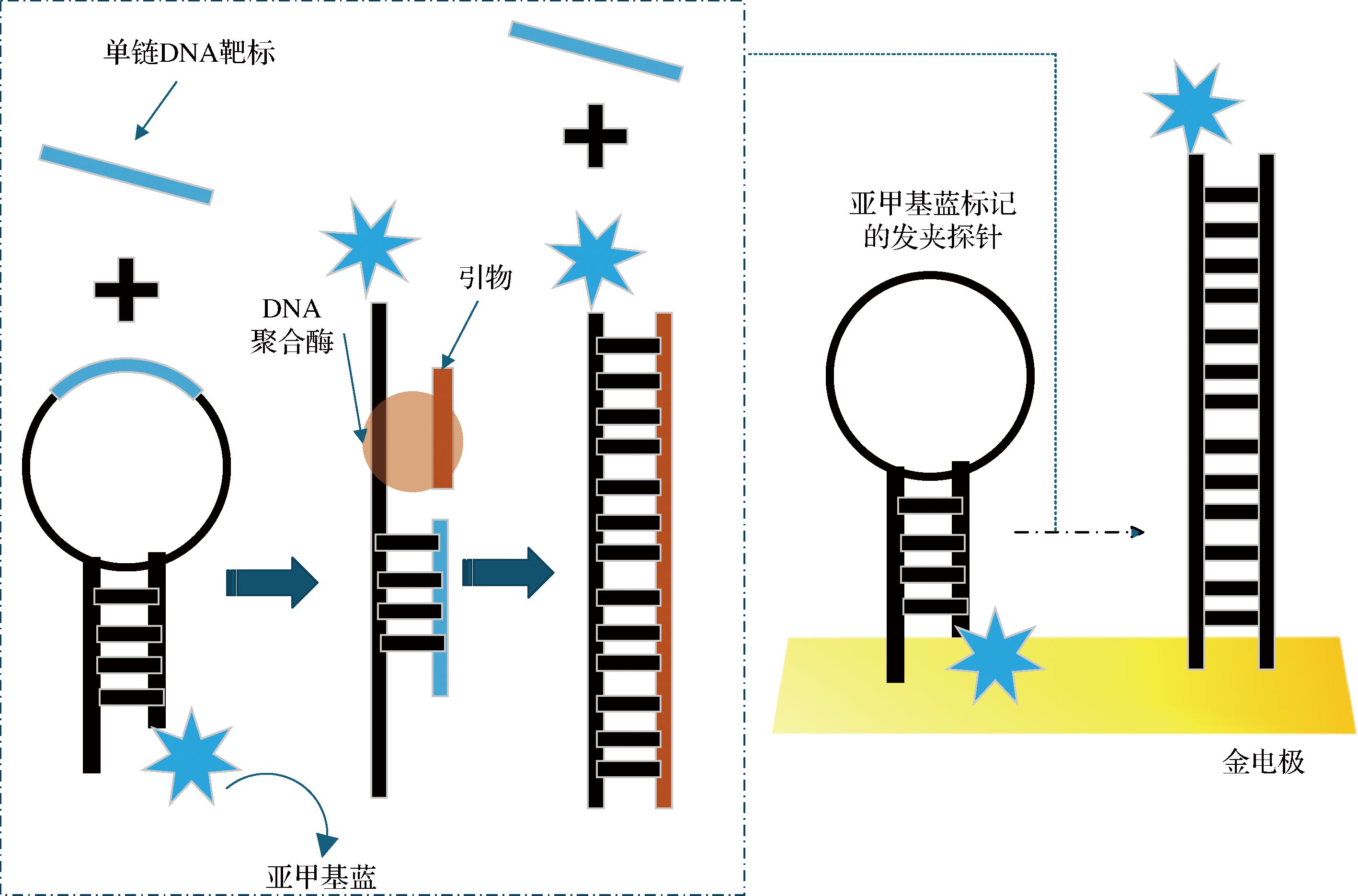
图9 ISDPR反应原理图和基于 ISDPR 的电化学生物传感器的示例
Fig.9 Schematic diagrams of ISDPR and example of electrochemical biosensor based on ISDPR
ISDPR技术与其他技术联用应用于检测食品中致病菌显示了无标记、超灵敏、快速、分离效果好等优点。WANG等[45]基于ISDPR技术开发了一种电化学生物传感器用于检测细菌,该传感器使用在金电极上自组装的亚甲基蓝标记发夹探针检测金黄色葡萄球菌的mecA基因。在没有靶标的情况下,氧化还原部分靠近电极表面,从而产生有效的电子转移。mecA基因与发夹探针的杂交发生了构象变化,使亚甲基蓝分子远离电极表面,导致电流响应降低。当靶链被扩增链取代并与另一个发夹探针杂交时,电流降低增加,实现了63 fmol/L合成DNA的检测限和0.075~200 pmol/L 的宽线性范围。鹿宇麒[49]开发了一种将微流控电泳技术与等温链取代聚合酶反应相结合的检测手段。在最优条件下,该方法能够检测到低至12.3 pmol/L的DNA目标序列(信噪比S/N=3),并已成功应用于耐甲氧西林金黄色葡萄球菌的检测。
6 核酸多臂引物和环优化(amplifying DNA with multiarm priming and looping optimization of nucleic acid,AMPLON)技术
2024年7月,美国凯斯西储大学医学院的研究团队在Advanced Materials期刊上发表了一篇题为“AMPLON:Amplifying DNA with Multiarm Priming and Looping Optimization of Nucleic Acid”的文章[50],介绍了一种名为AMPLON的新型DNA扩增方法。如图10所示,AMPLON技术利用了含有多臂聚乙二醇的DNA引物和一种新型聚合物材料,在恒定温度下实现高效扩增。AMPLON技术展现出极高的灵敏度,能够探测到低至100拷贝/mL的DNA靶标。与高灵敏度引物的实时定量PCR技术相比,AMPLON技术在血浆样本中检测HIV-1 RNA的准确性达到了95%的一致性。该技术能在30 min内完成对靶标的特异性和灵敏扩增,预示着它在核酸研究、医学诊断、生物技术以及食品安全检测等领域具有广泛的应用前景。

图10 AMPLON反应设计和原理
Fig.10 AMPLON reaction design and mechanism
核酸等温扩增技术通过在恒定温度下实现核酸的高效扩增,为快速、灵敏地检测病原微生物、食品真实性以及生物毒素等提供了有力工具。表1对几种常见的核酸等温扩增技术进行了概述,包括环介导等温扩增技术(LAMP)、滚环扩增技术(RCA)、重组酶聚合酶扩增技术(RPA)、酶促重组等温扩增技术(ERA)、等温链置换技术(ISDPR)以及核酸多臂引物和环优化技术(AMPLON)。每种技术都有其独特的原理、优势和局限性,且在食品安全检测中的应用范围也各有侧重。通过对比这些技术的性能和应用实例,我们可以更好地理解它们在实际检测中的潜力和挑战,为选择合适的检测方法提供参考依据。
表1 基于核酸等温扩增技术研究概述表
Table 1 Overview of research based on isothermal nucleic acid amplification technology

核酸等温扩增技术原理优势缺点食品安全中应用范围参考文献环介导等温扩增技术(LAMP)利用链置换型DNA合成酶在恒定温度下进行反应,针对目标DNA链上的6个区段设计4(或6)条不同的引物出色的特异性和扩增速率(15~60 min内实现109~1 010倍的扩增)靶DNA长度的限制和扩增子的复杂结构食品安全检测中的真菌、细菌等病原微生物污染检测[1-3,5-6]滚环扩增技术(RCA)利用特定的DNA或RNA聚合酶在环状的DNA或RNA模板上进行持续的合成反应快速、灵敏、特异性地放大目标核酸序列非特异性扩增和引物设计的复杂问题食源性细菌检测、食品真实性检测、生物毒素检测等[18,20,22,24]重组酶聚合酶扩增技术(RPA)重组酶与引物结合形成的蛋白-DNA复合物,在双链DNA中寻找同源序列,启动DNA合成体系较为简单,快速、灵敏、特异且无需热循环设计引物难度高,目标序列选择限制食源性细菌检测、食品真实性检测、寄生虫检测等[33-34,36-37]酶促重组等温扩增技术(ERA)通过特定的酶在恒定温度下进行反应,实现对目标DNA或RNA序列的扩增高效性、灵敏度和特异性研究报道较少,应用潜力待进一步开发人畜病原体和食品中腐败微生物检测[47]等温链置换技术(IS-DPR)在模板、引物和聚合酶作用下,通过链置换产生大量扩增产物以进行信号放大新技术,具有潜在的高灵敏度和特异性需要特定的DNA聚合酶和引物检测食品中致病菌[45,49]核酸多臂引物和环优化技术(AMPLON)使用一种新型聚合物材料多臂聚乙二醇-DNA引物,在等温条件下进行高效的DNA扩增高灵敏度,可检测低至100拷贝/mL的靶标浓度新技术,应用范围待进一步研究暂无[50]
7 结论与展望
核酸等温扩增技术作为一种高效、快速且操作简便的分子诊断工具,在食品安全检测领域展现出巨大的应用潜力。展望未来,随着深度学习技术的融合和创新,该技术有望实现更加精准和智能化的食品安全监控。首先,核酸等温扩增技术与深度学习算法的结合,将极大地提升检测的灵敏度和特异性。通过深度学习对扩增过程中产生的数据进行实时分析,可以快速识别和区分目标病原体的微小差异,从而实现对食品中微生物的精确检测。此外,通过对大量食品安全相关数据的学习,深度学习模型能够识别多种食源性细菌的特征,实现一次检测多个目标的能力。这将极大地提高检测的效率,降低成本,尤其是在大规模食品安全筛查中。这种技术的进步将使得食品安全检测更加依赖于智能化系统,减少人为误差,提高检测结果的可靠性。随着物联网技术的发展,核酸等温扩增技术有望实现现场快速检测。通过将检测设备与云端数据库连接,检测结果可以即时上传和分析,实现对食品供应链中潜在风险的实时监控。这种即时反馈机制将极大地提高食品安全管理的效率,降低疾病传播的风险。未来,核酸等温扩增技术有望与更多新型生物传感器相结合,开发出更加灵敏和特异的检测方法。这些方法将能够检测到食品中极低浓度的有害物质,为食品安全提供更强有力的保障。
现阶段,有多种新型核算等温扩增技术,如无需核酸提取即可对粗样品裂解物进行直接等温核酸扩增检测、下一代测序、等应用于医学分子诊断领域,取得了显著效果,未来期待这些技术将更多应用于食品掺假检测、食品溯源等方面。
综上所述,核酸等温扩增技术在食品安全检测方面的未来展望是充满希望的。随着技术的不断进步和创新,未来有望实现一个更加安全、高效和智能化的食品安全检测体系,为全球食品安全提供坚实的科学支撑。
[1] XIONG J, HUANG B, XU J S, et al.A closed-tube loop-mediated isothermal amplification assay for the visual detection of Staphylococcus aureus[J].Applied Biochemistry and Biotechnology, 2020, 191(1):201-211.
[2] 吕观, 常彦磊, 石磊.免疫磁珠-环介导等温扩增快速检测牛肉中的鼠伤寒沙门氏菌与金黄色葡萄球菌[J].肉类研究, 2019, 33(7):42-48.LYU G, CHANG Y L, SHI L.Rapid detection of Salmonella Typhimurium and Staphylococcus aureus in beef by immunomagnetic separation combined with loop-mediated IsothermaL amplification method[J].Meat Research, 2019, 33(7):42-48.
[3] ZHANG H, CAO W W, ZHANG Y L, et al.Identification for meat adulteration (pork, beef, sheep and duck) in foodstuff by microfluidic chip-based real-time fluorescent LAMP[J].Journal of Food Composition and Analysis, 2023, 119:105223.
[4] 陈珍金, 张璜, 石磊, 等.利用LAMP技术快速检测羊肉制品中的鼠源性成分[J].食品科学, 2021, 42(12):322-327.CHEN Z J, ZHANG H, SHI L, et al.Rapid detection of murine-derived ingredients in mutton products using loop-mediated isothermal amplification[J].Food Science, 2021, 42(12):322-327.
[5] FERRARA M, LOGRIECO A F, MORETTI A, et al.A loop-mediated isothermal amplification (LAMP) assay for rapid detection of fumonisin producing Aspergillus species[J].Food Microbiology, 2020, 90:103469.
[6] YU Y B, LI R, MA Z H, et al.Development and evaluation of a novel loop mediated isothermal amplification coupled with TaqMan probe assay for detection of genetically modified organism with NOS terminator[J].Food Chemistry, 2021, 356:129684.
[7] TAKABATAKE R, KAGIYA Y, FUTO S, et al.Rapid screening detection of genetically modified papaya by loop-mediated isothermal amplification[J].Biological &Pharmaceutical Bulletin, 2023, 46(5):713-717.
[8] SHEU S C, YU M T, LIEN Y Y, et al.Development of a specific isothermal nucleic acid amplification for the rapid and sensitive detection of shrimp allergens in processed food[J].Food Chemistry, 2020, 332:127389.
[9] 张晋豪, 王浩东, 刘欣悦, 等.基于LAMP技术快速检测冷鲜鸡新鲜度[J].食品科学, 2023, 44(6):351-359.ZHANG J H, WANG H D, LIU X Y, et al.Loop-mediated isothermal amplification for rapid evaluation of the freshness of chilled chicken[J].Food Science, 2023, 44(6):351-359.
[10] CHEN C, LU J, LONG B, et al.Detection of Mycobacterium kansasii using a combination of loop-mediated isothermal amplification (LAMP) and lateral flow biosensors[J].International Microbiology, 2021, 24(1):75-82.
[11] NAWATTANAPAIBOON K, KIATPATHOMCHAI W, SANTANIRAND P, et al.SPR-DNA array for detection of methicillin-resistant Staphylococcus aureus (MRSA) in combination with loop-mediated isothermal amplification[J].Biosensors and Bioelectronics, 2015, 74:335-340.
[12] SHARMA S, KABIR M A, ASGHAR W.Lab-on-a-chip zika detection with reverse transcription loop-mediated isothermal amplification-based assay for point-of-care settings[J].Archives of Pathology &Laboratory Medicine, 2020, 144(11):1335-1343.
[13] ALLGÖWER S M, HARTMANN C A, HOLZHAUSER T.The development of highly specific and sensitive primers for the detection of potentially allergenic soybean (Glycine max) using loop-mediated isothermal amplification combined with lateral flow dipstick (LAMP-LFD)[J].Foods, 2020, 9(4):423.
[14] SUL S, KIM M J, KIM H Y.Development of a direct loop-mediated isothermal amplification (LAMP) assay for rapid and simple on-site detection of chicken in processed meat products[J].Food Control, 2019, 98:194-199.
[15] LIU W, HUANG S M, LIU N W, et al.Establishment of an accurate and fast detection method using molecular beacons in loop-mediated isothermal amplification assay[J].Scientific Reports, 2017, 7:40125.
[16] JIA K Y, XIAO R H, LIN Q J, et al.RNase H2 triggered visual loop-mediated isothermal amplification combining smartphone assisted all-in-one aptamer magnetic enrichment device for ultrasensitive culture-independent detection of Salmonella Typhimurium in chicken meat[J].Sensors and Actuators B:Chemical, 2023, 380:133399.
[17] GUO Y N, WANG Y, LIU S, et al.Label-free and highly sensitive electrochemical detection of E.coli based on rolling circle amplifications coupled peroxidase-mimicking DNAzyme amplification[J].Biosensors &Bioelectronics, 2016, 75:315-319.
[18] WANG Z Y, YANG Q, ZHANG Y Z, et al.Saltatory rolling circle amplification (SRCA):A novel nucleic acid isothermal amplification technique applied for rapid detection of Shigella spp.in vegetable salad[J].Food Analytical Methods, 2018, 11(2):504-513.
[19] ZHANG Y Z, YANG Q, LI C, et al.Sensitive and visual detection of Cronobacter spp.in powdered infant formula by saltatory rolling circle amplification method[J].LWT, 2019, 107:41-48.
[20] XU L, LI D X, JIANG B Y, et al.Melamine-mediated base mismatch for label-free and amplified sensitive fluorescent detection of melamine in milk[J].Food Analytical Methods, 2019, 12(5):1255-1261.
[21] 胡学佳, 张蕴哲, 徐慧, 等.可视化-跨越式滚环等温扩增技术检测鼠肉掺假[J].食品安全质量检测学报, 2021, 12(2):466-471.HU X J, ZHANG Y Z, XU H, et al.Determination of rat meat adulteration by visualization-saltatory rolling circle isothermal amplification technology[J].Journal of Food Safety &Quality, 2021, 12(2):466-471.
[22] PANG Y H, GUO L L, SHEN X F, et al.Rolling circle amplified DNAzyme followed with covalent organic frameworks:Cascade signal amplification of electrochemical ELISA for alfatoxin M1 sensing[J].Electrochimica Acta, 2020, 341:136055.
[23] GU H J, HAO L L, DUAN N, et al.A competitive fluorescent aptasensor for okadaic acid detection assisted by rolling circle amplification[J].Microchimica Acta, 2017, 184(8):2893-2899.
[24] WANG X M, TENG D, GUAN Q F, et al.Detection of genetically modified crops using multiplex asymmetric polymerase chain reaction and asymmetric hyperbranched rolling circle amplification coupled with reverse dot blot[J].Food Chemistry, 2015, 173:1022-1029.
[25] YANG Q, YANG H Y, YUAN N, et al.Closed-tube saltatory rolling circle amplification with hydroxynaphthol blue for visual on-site detection of peanut as an allergenic food[J].Food Chemistry, 2022, 393:133408.
[26] LIU X J, SONG M M, HOU T, et al.Label-free homogeneous electroanalytical platform for pesticide detection based on acetylcholinesterase-mediated DNA conformational switch integrated with rolling circle amplification[J].ACS Sensors, 2017, 2(4):562-568.
[27] HE L Y, SHEN Z P, CAO Y T, et al.A microfluidic chip based ratiometric aptasensor for antibiotic detection in foods using stir bar assisted sorptive extraction and rolling circle amplification[J].Analyst, 2019, 144(8):2755-2764.
[28] CAI W, XIE S B, ZHANG J, et al.Immobilized-free miniaturized electrochemical sensing system for Pb2+ detection based on dual Pb2+-DNAzyme assistant feedback amplification strategy[J].Biosensors &Bioelectronics, 2018, 117:312-318.
[29] GAO F L, DU Y, YAO J W, et al.A novel electrochemical biosensor for DNA detection based on exonuclease Ⅲ-assisted target recycling and rolling circle amplification[J].RSC Advances, 2015, 5(12):9123-9129.
[30] JIANG Y Q, ZOU S, CAO X D.A simple dendrimer-aptamer based microfluidic platform for E.coli O157:H7 detection and signal intensification by rolling circle amplification[J].Sensors and Actuators B:Chemical, 2017, 251:976-984.
[31] XIE Y J, DU J, LIU Z F, et al.miR-6 875-3p promotes the proliferation, invasion and metastasis of hepatocellular carcinoma via BTG2/FAK/Akt pathway[J].Journal of Experimental &Clinical Cancer Research, 2019, 38(1):7.
[32] XU J G, GUO J, MAINA S W, et al.An aptasensor for Staphylococcus aureus based on nicking enzyme amplification reaction and rolling circle amplification[J].Analytical Biochemistry, 2018, 549:136-142.
[33] LIU L, ZHAO G, LI X M, et al.Development of rapid and easy detection of Salmonella in food matrics using RPA-CRISPR/Cas12a method[J].LWT, 2022, 162:113443.
[34] 周广彪, 段建发, 胡晓珊, 等.重组酶聚合酶扩增技术(RPA)检测拟态弧菌[J].检验检疫学刊, 2018, 28(5):1-4; 16.ZHOU G B, DUAN J F, HU X S, et al.Detection of Vibrio mimicus heat-labile hemolysin by recombinase polymerase amplification[J].Journal of Inspection and Quarantine, 2018, 28(5):1-4; 16.
[35] 郭燕华, 王德莲, 王强, 等.重组酶介导等温扩增技术快速检测牛肉及牛肉制品中的牛源性成分[J].食品安全质量检测学报, 2017, 8(5):1745-1749.GUO Y H, WANG D L, WANG Q, et al.Determination of bovine ingredient in beef and its derivates with recombinase polymerase mediated isothermal amplification[J].Journal of Food Safety &Quality, 2017, 8(5):1745-1749.
[36] 林霖, 冯荣虎, 王坤, 等.牛肉真伪鉴别荧光RPA现场快检方法建立[J].食品科技, 2018, 43(6):322-326.LIN L, FENG R H, WANG K, et al.Construct beef authentication on-site rapid detection method based on fluorescent RPA technology[J].Food Science and Technology, 2018, 43(6):322-326.
[37] JARVI S I, ATKINSON E S, KALUNA L M, et al.Development of a recombinase polymerase amplification (RPA-EXO) and lateral flow assay (RPA-LFA) based on the ITS1 gene for the detection of Angiostrongylus cantonensis in gastropod intermediate hosts[J].Parasitology, 2021, 148(2):251-258.
[38] 张惠媛. 华支睾吸虫RPA可视化检测方法的建立与初步应用[D].长春:吉林大学, 2024.ZHANG H Y.Establishment and preliminary application of a visual RPA detection method for Clonorchis sinensis[D].Changchun:Jilin University, 2024.
[39] LI K, LUO Y B, HUANG K L, et al.Single universal primer recombinase polymerase amplification-based lateral flow biosensor (SUP-RPA-LFB) for multiplex detection of genetically modified maize[J].Analytica Chimica Acta, 2020, 1127:217-224.
[40] 兰全学, 陈佳平, 杨慧, 等.侧向流动型重组酶聚合酶扩增技术检测食品中大肠埃希氏菌O157[J].食品科技, 2021, 46(1):302-307.LAN Q X, CHEN J P, YANG H, et al.The detection method for Escherichia coli O157 based on lateral flow-based recombinase polymerase amplification[J].Food Science and Technology, 2021, 46(1):302-307.
[41] YIN J X, ZOU Z Y, HU Z M, et al.A “sample-in-multiplex-digital-answer-out” chip for fast detection of pathogens[J].Lab on a Chip, 2020, 20(5):979-986.
[42] DEL R O J S, SVOBODOVA M, BUSTOS P, et al.Electrochemical detection of Piscirickettsia salmonis genomic DNA from salmon samples using solid-phase recombinase polymerase amplification[J].Analytical and Bioanalytical Chemistry, 2016, 408(30):8611-8620.
O J S, SVOBODOVA M, BUSTOS P, et al.Electrochemical detection of Piscirickettsia salmonis genomic DNA from salmon samples using solid-phase recombinase polymerase amplification[J].Analytical and Bioanalytical Chemistry, 2016, 408(30):8611-8620.
[43] 李焓笑. 基于CRISPR/Cas13a及RPA单增李斯特菌检测方法的建立和应用[D].长春:吉林大学, 2021:75.LI H X.Establishment and application of a CRISPR/Cas13a and RPA-based single amplification method for Listeria monocytogenes detection[D].Changchun:Jilin University, 2021:75.
[44] TIAN Y C, LIU T, LIU C, et al.An ultrasensitive and contamination-free on-site nucleic acid detection platform for Listeria monocytogenes based on the CRISPR-Cas12a system combined with recombinase polymerase amplification[J].LWT, 2021, 152:112166.
[45] WANG Y Q, KE Y Q, LIU W J, et al.A one-pot toolbox based on Cas12a/crRNA enables rapid foodborne pathogen detection at attomolar level[J].ACS Sensors, 2020, 5(5):1427-1435.
[46] GOOTENBERG J S, ABUDAYYEH O O, LEE J W, et al.Nucleic acid detection with CRISPR-Cas13a/C2c2[J].Science, 2017, 356(6336):438-442.
[47] MENG Q Z, YANG H M, ZHANG G Q, et al.CRISPR/Cas12a-assisted rapid identification of key beer spoilage bacteria[J].Innovative Food Science &Emerging Technologies, 2021, 74:102854.
[48] ZHANG W Y, XU L, LIU Q, et al.Enzymatic recombinase amplification coupled with CRISPR-Cas12a for ultrasensitive, rapid, and specific Porcine circovirus 3 detection[J].Molecular and Cellular Probes, 2021, 59:101763.
[49] 鹿宇麒. 基于链取代放大的细菌微流控芯片检测方法研究[D].上海:华东师范大学, 2021.LU Y Q.Research on bacterial microfluidic chip detection method based on strand displacement amplification[D].Shanghai:East China Normal University, 2021.
[50] DOGANAY M T, ROMAN E, HUJER A M, et al.AMPLON:Amplifying DNA with multiarm priming and looping optimization of nucleic acid[J].Advanced Materials, 2024, 36(28):2311634.