桑黄(Sanghuang porus)隶属担子菌门桑黄属,多糖、黄酮、多酚是其主要功能活性物质[1-2]。桑黄具有抗肿瘤[3],抗氧化[4]、抗炎症[5]等功效,是目前世界上公认的抗肿瘤效果最好的大型真菌[6],近年来引起了广泛的关注。由于自然界野生桑黄遭受掠夺式采摘,其数量急剧减少[7]。想要获得桑黄子实体,从试管母种转接到袋料栽培出菇,至少半年以上[8],相比于固体培养,液体发酵可以极大的缩短培养时间,菌丝体可在短时间内迅速繁殖,从而获得活性成分。但液体发酵桑黄菌丝体产量低,就目前的发酵技术,将其应用于大规模的生产还远远不够,迫切的市场需求与培养技术上的难题形成了较大的矛盾[9]。选育出培养周期短、菌丝体和活性物质含量高的桑黄新品种是解决该问题的有效途径。
航天育种,是指利用人造天体等将生物材料送入太空,在宇宙射线、高真空、微重力、辐射源和磁场环境下,生物材料发生变异,然后回归地面,采用现代生物技术选育具有优良性状的新品种[10]。主要步骤包括:从真实航天诱变处理菌株到平板培养,再到突变株的分离,诱变目标物初筛、复筛、终筛,最后扩大试验并推广示范。近年来大量学者通过航天诱变育种的方式试获得新型食用菌优良菌株[10-12],通过航天诱变可获得地面常规方法较难得到,甚至是罕见的突变种,致突变率是传统方式的5倍左右[13]。关于诱变菌株如何筛选,目前没有固定的标准,通常是基于某一物质或功能进行单一目的筛选,但以单一的活性物质为筛选指标的方法过于片面,无法从多维度衡量诱变菌株与出发菌株之间的差异。本试验优化液体发酵培养基配方后,采用航天诱变方法获得诱变桑黄,采用多维度综合评价方法,按照桑黄液体发酵主要活性成分含量及功能,赋予桑黄菌丝生物量、各项活性成分含量及抗氧化能力相应权重后,比较其综合得分。试图在液体发酵方面获得综合表现最好的桑黄诱变菌株。此类方法文章鲜有报道,可为后续大型真菌诱变育种的筛选方法提供新思路。
1 材料与方法
1.1 材料与试剂
桑黄菌种,华南农业大学食品学院应用真菌实验室分离保存;市售桑黄(SH-S),湖北随州桑黄;葡萄糖标准品(≥98%)、芦丁标准品(≥98%),上海源叶生物科技有限公司;没食子酸标准品(≥98%),南京源植生物科技有限公司;总抗氧化试剂盒,北京索莱宝公司;DPPH清除率试剂盒,北京雷根生物技术有限公司;琼脂粉、葡萄糖、酵母粉、KH2PO4、MgSO4、维生素B1,广州化学试剂厂;玉米粉,涞水县金谷粮油食品有限公司;土豆,湖北易巧福电子商务有限公司;黄豆面、麸皮,市售。
1.2 仪器与设备
XFH-30CA立式高压蒸汽灭菌锅,浙江新丰医疗器械有限公司;WK2102电磁炉,美的集团;101-00B电热鼓风干燥箱,上海锦屏仪器仪表有限公司;SW-CJ-1G单人超净工作台,苏州净化设备有限公司;JA103P电子天平,德国赛多利斯股份公司;SN-SPX-30B生化培养箱,上海一恒集团广东分公司;THZ-98AB恒温培养摇床,上海新苗医疗器械制造有限公司;GL-20G-C低温冷冻离心机,上海安亭科学仪器厂。
1.3 试验方法
1.3.1 培养基配方
桑枝综合固体培养基(g/L):马铃薯200,葡萄糖20,桑枝粉5、琼脂20,pH自然。
桑黄液体种子培养基(完全培养基,g/L):马铃薯200,葡萄糖20,KH2PO4 3,MgSO4 1.5,pH自然。
1.3.2 培养基制作方法
1.3.2.1 桑黄种子液培养基制作
选取250 mL锥形瓶,配制100 mL桑黄种子液培养基,灭菌处理后,无菌条件下,接种4片直径大小为1 cm的桑黄小圆片于锥形瓶,密封后置于28 ℃,160 r/min恒温旋转式摇床中培养10 d。
1.3.2.2 二级摇瓶发酵培养
将玉米粉、黄豆面和麸皮混合,沸水煮20 min,过滤,加入其他参试因子,装液量50 mL,分装于250 mL锥形瓶中,灭菌、冷却,在无菌操作台中接种5 mL种子液(即10%的接种量)于二级发酵培养基,后置于28 ℃,160 r/min旋转式摇床培养5 d。
1.3.3 均匀设计
在前期大量的单因素试验的基础上,如表1所示,选取玉米粉、葡萄糖、蛋白胨、黄豆面、KH2PO4、酵母浸出粉、麸皮、NaCl、维生素B1、MgSO4作为10个参试因子,采用均匀设计法U12(1210),按照表2进行试验设计。
表1 均匀设计水平因素
Table 1 Uniform design level factors
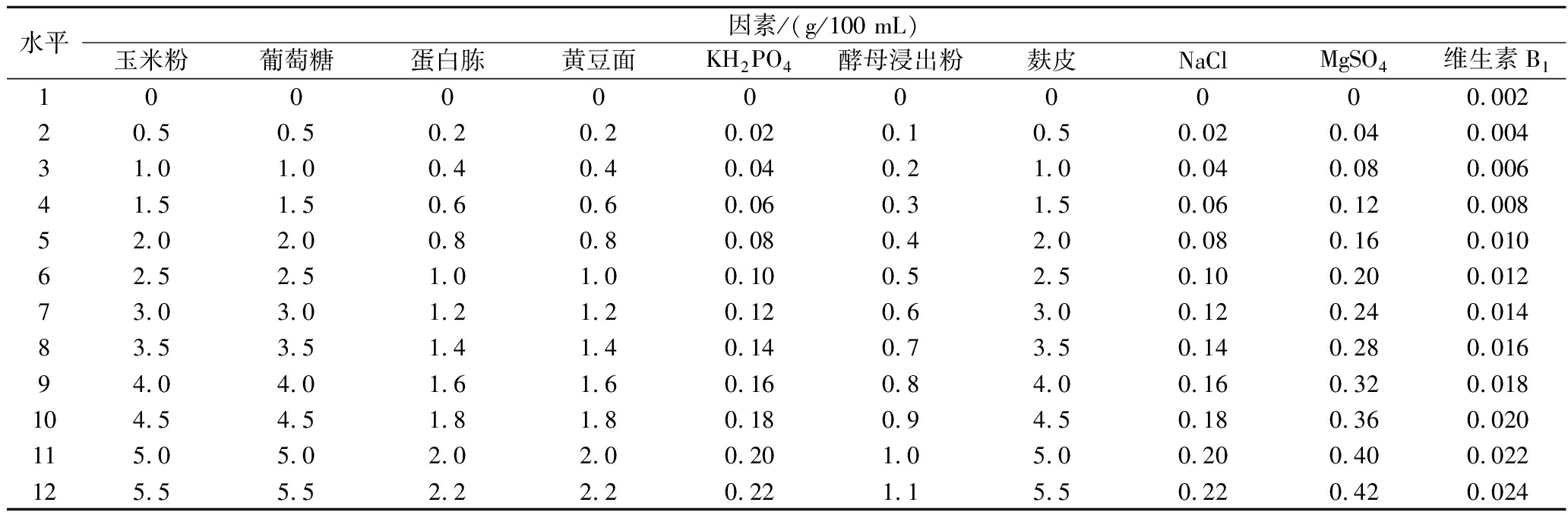
水平因素/(g/100 mL)玉米粉葡萄糖蛋白胨黄豆面KH2PO4酵母浸出粉麸皮NaClMgSO4维生素B110000000000.00220.50.50.20.20.020.10.50.020.040.00431.01.00.40.40.040.21.00.040.080.00641.51.50.60.60.060.31.50.060.120.00852.02.00.80.80.080.42.00.080.160.01062.52.51.01.00.100.52.50.100.200.01273.03.01.21.20.120.63.00.120.240.01483.53.51.41.40.140.73.50.140.280.01694.04.01.61.60.160.84.00.160.320.018104.54.51.81.80.180.94.50.180.360.020115.05.02.02.00.201.05.00.200.400.022125.55.52.22.20.221.15.50.220.420.024
表2 均匀设计表
Table 2 Uniform design table

配方号因素/(g/100 mL)玉米粉葡萄糖蛋白胨黄豆面KH2PO4酵母浸出粉麸皮NaClMgSO4维生素B111(0.0)2(0.5)3(0.4)4(0.6)5(0.08)6(0.5)8(3.5)9(0.16)10(0.36)12(0.024)22(0.5)4(1.5)6(1.0)8(1.4)10(0.18)12(1.1)3(1.0)5(0.08)7(0.24)11(0.022)33(1.0)6(2.5)9(1.6)12(2.2)2(0.02)5(0.4)11(5.0)1(0.00)4(0.12)10(0.020)44(1.5)8(3.5)12(2.2)3(0.4)7(0.12)11(1.0)6(2.5)10(0.18)1(0.00)9(0.018)55(2.0)10(4.5)2(0.2)7(1.2)12(0.22)4(0.3)1(0.0)6(0.10)11(0.40)8(0.016)66(2.5)12(5.5)5(0.8)11(2.0)4(0.06)10(0.9)9(4.0)2(0.02)8(0.28)7(0.014)77(3.0)1(0.0)8(1.4)2(0.2)9(0.16)3(0.2)4(1.5)11(0.20)5(0.16)6(0.012)88(3.5)3(1.0)11(2.0)6(1.0)1(0.00)9(0.8)12(5.5)7(0.12)2(0.04)5(0.010)99(4.0)5(2.0)1(0.0)10(1.8)6(0.10)2(0.1)7(3.0)3(0.04)12(0.42)4(0.008)1010(4.5)7(3.0)4(0.6)1(0.0)11(0.20)8(0.7)2(0.5)12(0.22)9(0.32)3(0.006)1111(5.0)9(4.0)7(1.2)5(0.8)3(0.04)1(0.0)10(4.5)8(0.14)6(0.20)2(0.004)1212(5.5)11(5.0)10(1.8)9(1.6)8(0.14)7(0.6)5(2.0)4(0.06)3(0.08)1(0.000)
1.3.4 分子生物学鉴定方法
采用T5 Direct PCR Kit(Plant)试剂盒对待测菌株的ITS序列进行PCR扩增。采用真菌rDNA 内转录间隔区通用引物ITS 1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS 4(5′-TCCTCCGCTTATTGATATGC-3′)进行扩增[13]。胶浓度1%,Marker上样量2 μL, 电压120 V,电泳时间20 min。
1.3.5 菌丝生物量测定方法
二级摇瓶发酵结束后,过滤菌丝,用蒸馏水反复冲洗后置于60 ℃干燥箱中,干燥至恒重,称量。菌丝生物量按公式(1)计算:
桑黄菌丝生物量![]()
(1)
式中:m,桑黄菌丝干燥后的质量,g;V,发酵液体积,L。
1.3.6 功能活性物质及抗氧化能力测定方法
粗多糖含量:参考SN/T 4260—2015 《出口植物源食品中粗多糖的测定 苯酚-硫酸法》测定,以葡萄糖质量浓度为横坐标(mg/mL),吸光度值为纵坐标,得到标准曲线回归方程为:Y=10.14x+0.001 619,R2=0.999 1。
总黄酮含量:采用NaNO2-Al (NO3)3-Na(OH)2比色法(硝酸铝-亚硝酸钠显色法)测定[14],以芦丁质量浓度为横坐标(mg/mL),吸光度值为纵坐标,得到标准曲线回归方程为:Y=1.522x-0.007 3,R2=0.999 2。
总多酚含量:参考T/NAIA 097—2021《枸杞中总酚含量的测定 分光光度法》,采用福林酚法测定,以没食子酸质量浓度 (μg/mL)为横坐标,吸光度值为纵坐标,得到标准曲线回归方程为:Y=0.005 6x+0.006,R2=0.999 3。
总抗氧化能力测定:采用试剂盒测定,以Fe2+浓度(μmol/mL)为横坐标,吸光度值为纵坐标,得到标准曲线回归方程为Y=9.607 3x-0.034 2,R2=0.999。
DPPH自由基清除率测定:采用试剂盒测定,以维生素C为阳性对照标准管,测定其DPPH自由基清除能力,以维生素C质量浓度(μg/mL)为横坐标,DPPH清除率为纵坐标,得到标准曲线回归方程为:Y=0.019x+0.078 1,R2=0.999 6。
1.3.7 桑黄航天诱变菌株液体发酵综合评价方法
采用对不同因子赋予权重后,比较各菌株间综合得分。主要从菌丝体干重、功能活性物质含量、体外抗氧化能力3个方面进行。
其中,菌丝体干重是衡量桑黄航天诱变菌株液体发酵生长状况的重要指标,在工厂化生产中,菌丝产量的高低直接影响企业的收益,因此赋予其25%的权重。桑黄相比于其他食用菌具有较强的药用价值,桑黄的药用功效与其所含的功能活性成分含量密切相关,因此赋予功能活性成分50%的权重,桑黄多糖为抗肿瘤、降血糖、抗炎症最主要的物质[15],桑黄总黄酮、总多酚是药用真菌桑黄重要的活性成分之一,因此赋予桑黄菌丝体总多糖20%、总黄酮15%、总酚15%的权重。桑黄菌株体外抗氧化能力中,总抗氧化能力可更全面地评估测定样品中所有抗氧化剂的累积活性效果,因此赋予其15%权重, DPPH清除率赋予10%权重。综合得分按公式(2)计算:
航天诱变桑黄液体发酵综合得分=25%A+20%B+15%C+15%D+15%E+10%F
(2)
式中:A,桑黄菌丝体干重,g/L;B,桑黄菌丝体总多糖含量,mg/g;C,桑黄菌丝体总黄酮含量,mg/g;D,桑黄菌丝体总多酚含量,mg/g;E,桑黄菌丝体总抗氧化能力,μmol/g;F,桑黄菌丝体DPPH自由基清除率,%。
1.3.8 数据的分析及处理
使用Excel 2010处理数据,SPSS 26.0软件进行显著性分析,DPSv 9.01数据处理系统进行均匀设计分析,利用Graphpad Prism 10作图。
2 结果与分析
2.1 桑黄种子液培养结果
图1是桑黄种子液培养10 d的结果,随着培养时间的加长,菌液颜色由透明色转变为黄褐色并逐渐加深,液体清澈,黏稠度高。菌丝球细小而均匀,呈放射状且大小基本一致,具有较好的悬浮能力,摇晃后静置菌球不易沉淀,此种现象的桑黄菌种具有较好的生长活力。

图1 桑黄液体种子
Fig.1 Liquid seed of Sanghuangporus
2.2 二级发酵均匀设计试验结果
按照1.3.2.2节二级摇瓶发酵流程,5 d后完成二次发酵,每组重复3次,以各组平均值输入表3,以菌丝球干重为目标函数的二次逐步回归方程为:
y=0.810+0.009X22+0.015X32-2.944X82-829.326X102+0.020X1X6-0.136X3X6
表3 均匀设计试验结果
Table 3 Uniform design test results
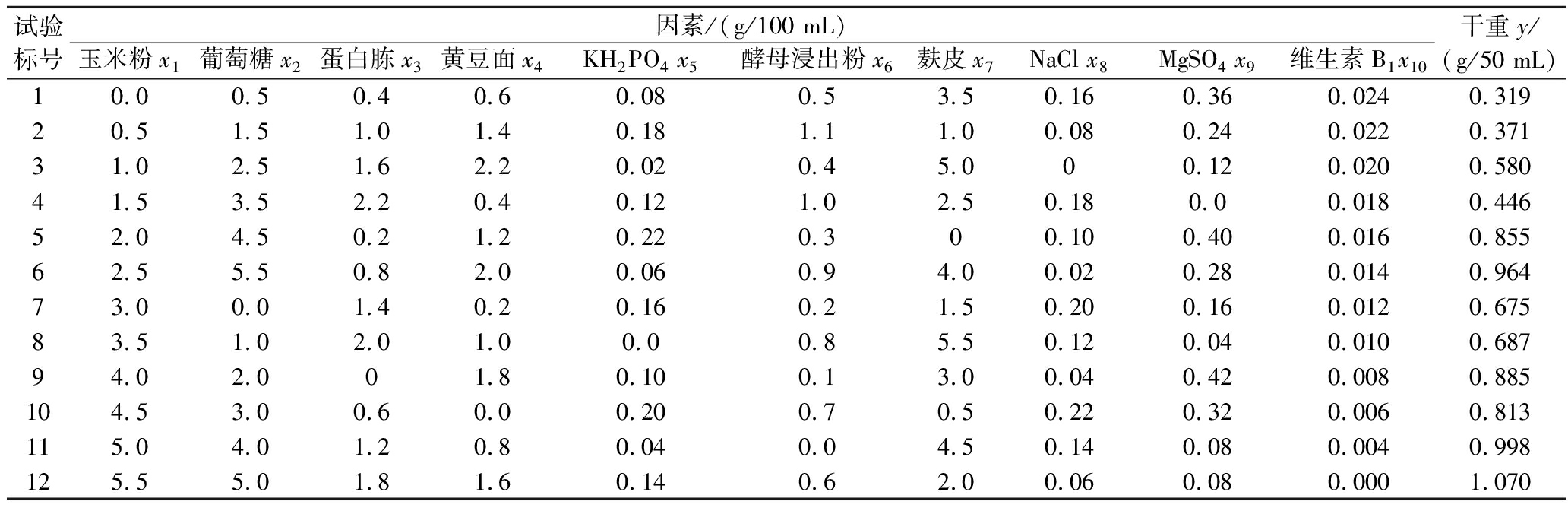
试验标号因素/(g/100 mL)玉米粉x1葡萄糖x2蛋白胨x3黄豆面x4KH2PO4 x5酵母浸出粉x6麸皮x7NaCl x8MgSO4 x9维生素B1x10干重y/(g/50 mL)10.00.50.40.60.080.53.50.160.360.0240.31920.51.51.01.40.181.11.00.080.240.0220.37131.02.51.62.20.020.45.000.120.0200.58041.53.52.20.40.121.02.50.180.00.0180.44652.04.50.21.20.220.300.100.400.0160.85562.55.50.82.00.060.94.00.020.280.0140.96473.00.01.40.20.160.21.50.200.160.0120.67583.51.02.01.00.00.85.50.120.040.0100.68794.02.001.80.100.13.00.040.420.0080.885104.53.00.60.00.200.70.50.220.320.0060.813115.04.01.20.80.040.04.50.140.080.0040.998125.55.01.81.60.140.62.00.060.080.0001.070
观察表4可知各项回归项的显著水平均小于0.05,说明方程中引入的各项对桑黄菌丝的干重具有显著性的影响。方程P值为0.000 1,相关系数R=0.999 6。理论最高值y=1.238,当y=1.238时,各因子的添加浓度为X1=4.647,X2=5.500,X3=2.200,X4=2.194,X5=0.007,X7=3.634,X8=0.001,X9=0.029,由表5可知,样本观察值与拟合值之间的相对误差小于2%,属于可接受范围,试验观测值和拟合值比较接近,说明了回归方程的准确性,通过数学模型分析,找出理论最优桑黄液体发酵配方(g/L):各因子的添加浓度为玉米粉46.47 g,葡萄糖55.00 g,蛋白胨22.00 g,黄豆面21.94 g,KH2PO4 0.07 g,麸皮36.34 g,NaCl 0.01 g,MgSO4 0.29 g。
表4 各项回归项的回归系数检验结果
Table 4 Regression coefficient test results of various regression terms
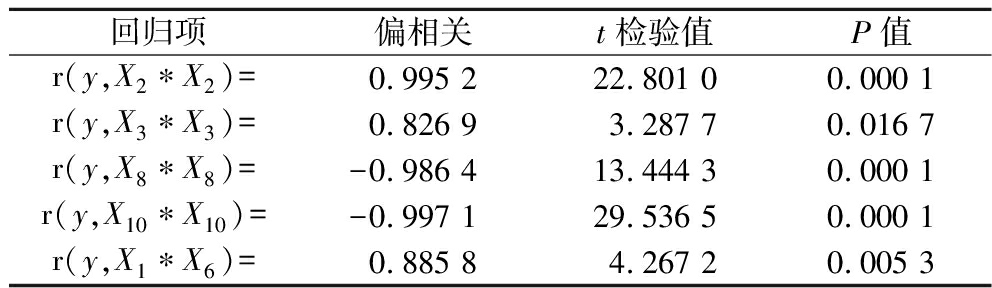
回归项偏相关t检验值P值r(y,X2∗X2)=0.995 222.801 00.000 1r(y,X3∗X3)=0.826 93.287 70.016 7r(y,X8∗X8)=-0.986 413.444 30.000 1r(y,X10∗X10)=-0.997 129.536 50.000 1r(y,X1∗X6)=0.885 84.267 20.005 3
表5 样本观察值、拟合值和拟合误差
Table 5 Sample observations, fit values, and fit errors
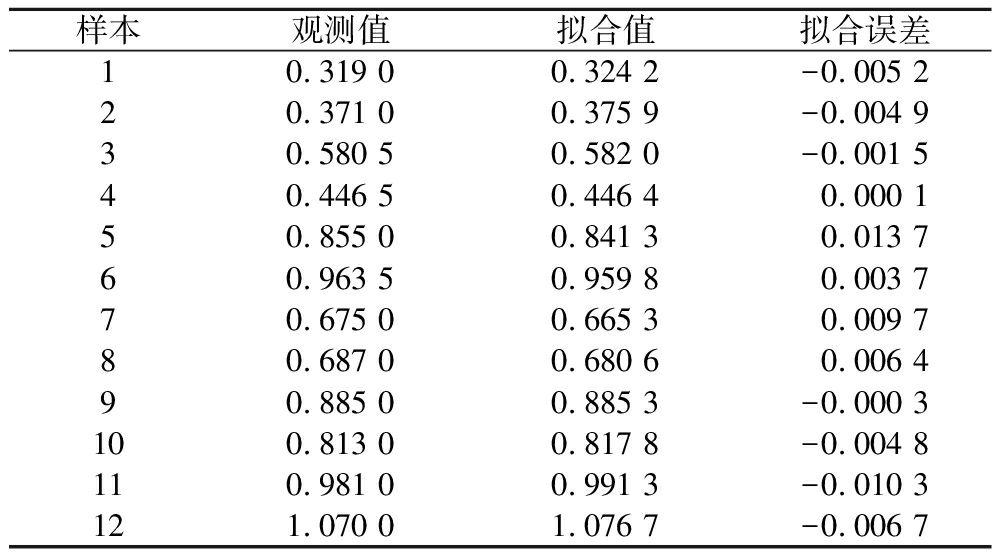
样本观测值拟合值拟合误差10.319 00.324 2-0.005 220.371 00.375 9-0.004 930.580 50.582 0-0.001 540.446 50.446 40.000 150.855 00.841 30.013 760.963 50.959 80.003 770.675 00.665 30.009 780.687 00.680 60.006 490.885 00.885 3-0.000 3100.813 00.817 8-0.004 8110.981 00.991 3-0.010 3121.070 01.076 7-0.006 7
2.3 均匀设计优化配方验证试验结果
桑黄菌丝干重最大的12号与11号间无显著性差异,因此后续将11号和12号同时与均匀设计理论最优配方进行比较。现将理论最优配方与直观最优配方11、配方12和完全培养基(按照1.3.1节种子液培养基进行配制)进行对比试验(表6),结果见表7和图2。桑黄菌丝体在理论最优配方中菌球最大,菌丝茂盛、生长活力好,与其他验证组均存在显著性差异。二级发酵在完全培养基中桑黄菌球最小,培养5 d后菌球未长满液体培养基,原因可能是培养时间过短,导致其未达到其指数增长期。

图2 验证试验结果图片
Fig.2 Pictures of validation experiment results
表6 验证试验方案
Table 6 Validation test plan
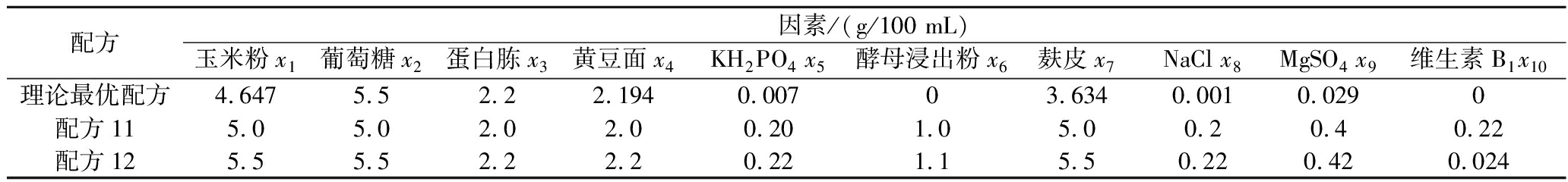
配方因素/(g/100 mL)玉米粉x1葡萄糖x2蛋白胨x3黄豆面x4KH2PO4 x5酵母浸出粉x6麸皮x7NaCl x8MgSO4 x9维生素B1x10理论最优配方4.6475.52.22.1940.00703.6340.0010.0290配方115.05.02.02.00.201.05.00.20.40.22配方125.55.52.22.20.221.15.50.220.420.024
表7 验证试验结果
Table 7 Validation test results

配方菌丝生物量/(g/L)理论最优配方23.72±0.019a配方1119.48±0.007b配方1219.78±0.010b完全培养基4.740±0.013c
注:不同小写字母表示P<0.05,具有显著性差异。
2.4 航天诱变桑黄分子生物学鉴定结果
SH-0和通过初筛的桑黄航天诱变菌株及市售菌株的凝胶电泳(共32株)。实验结果如图3所示,32株菌株均在750 bp处获得单一目的条带。
图3 初筛32株桑黄核酸电泳检测胶
Fig.3 Preliminary screening of 32 strains of Sanghuangporus nucleic acid electrophoresis detection gel
2.5 航天诱变菌株复筛及菌丝生物量比较结果
采用最优液体发酵培养基,培养上述32株桑黄菌株,以二级发酵菌丝生物量为指标进行航天诱变桑黄的复筛,对比出发菌株SH-0,其中有12株诱变菌株和1株市售桑黄(SH-S)菌丝体干重显著大于出发菌株。菌丝生物量的结果如图4所示,其中SH-33(27.78 g/L)>SH-10(26.56 g/L)>SH-69(24.80 g/L)>SH-68(24.40 g/L)菌丝体干重显著高于其他菌株。
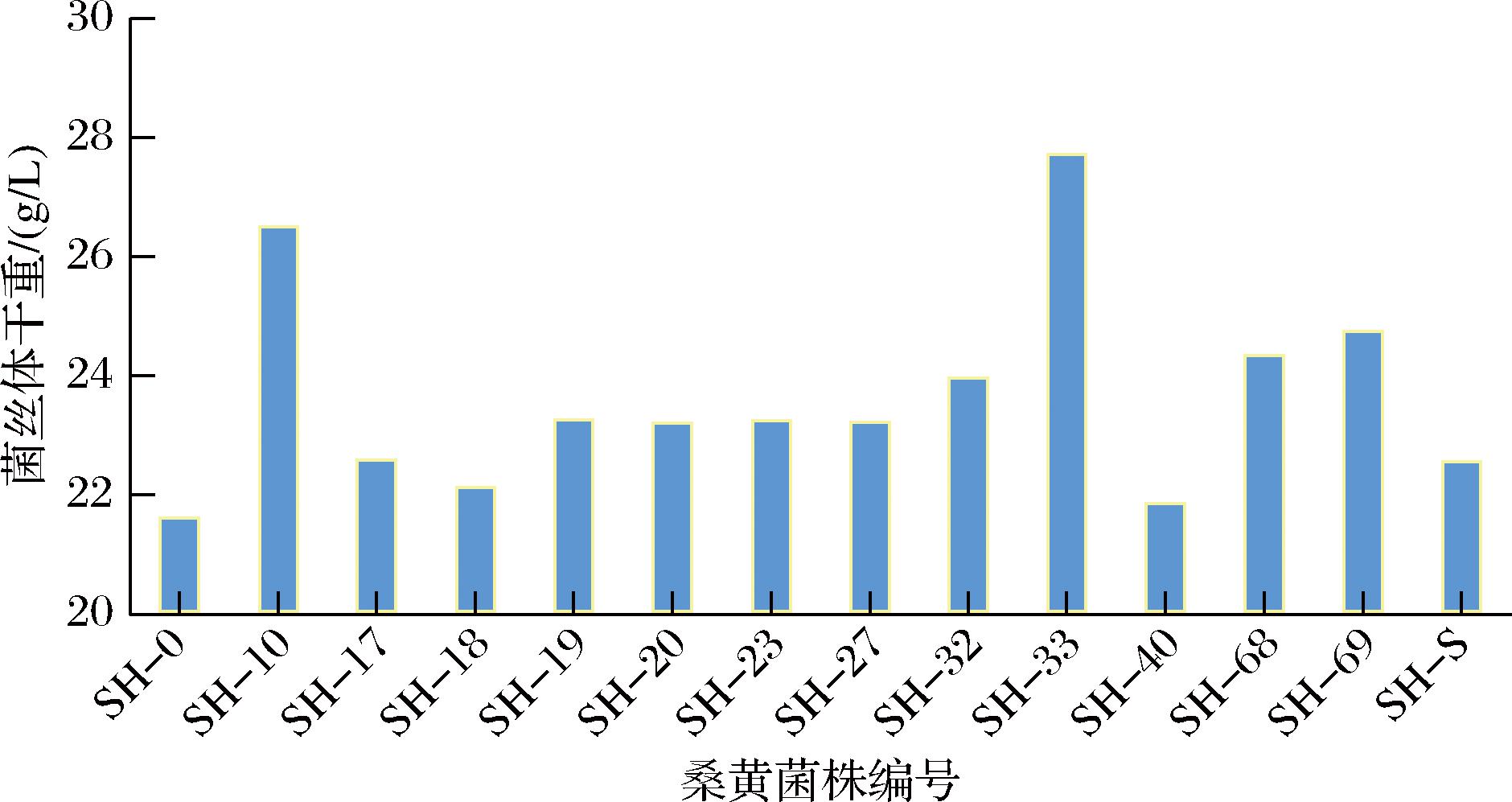
图4 14株桑黄菌株菌丝体干重比较
Fig.4 Comparison of mycelial dry weight of 14 strains of Sanghuangporus
将复筛菌株进行分子生物学鉴定后,序列上传至NCBI数据库,表8是包括SH-0在内的14株复筛桑黄菌株BLAST对比结果,经鉴定有两株卧孔菌属,其余均为桑黄孔菌属,且相似度较高,说明复筛的14株桑黄均可用于下一步的综合筛选试验。
表8 复筛结果桑黄BLAST对比结果
Table 8 Comparison results of Sanghuangporus BLAST in rescreening results
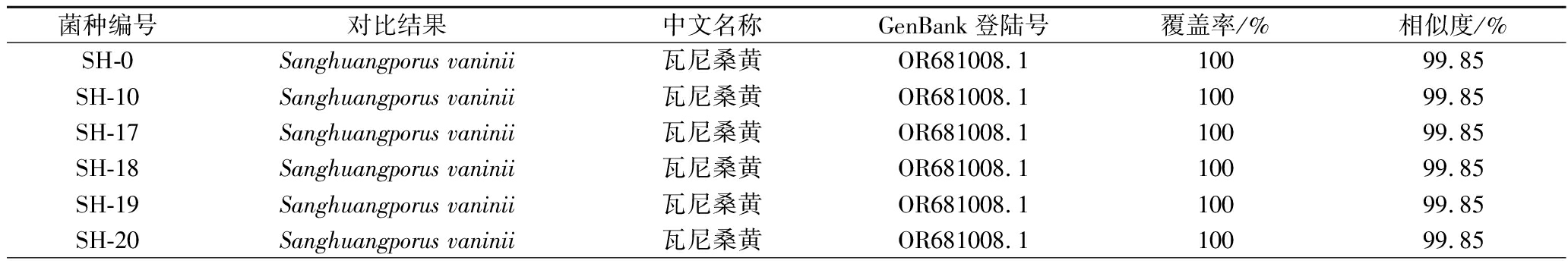
菌种编号对比结果中文名称GenBank登陆号覆盖率/%相似度/%SH-0Sanghuangporus vaninii瓦尼桑黄OR681008.110099.85SH-10Sanghuangporus vaninii瓦尼桑黄OR681008.110099.85SH-17Sanghuangporus vaninii瓦尼桑黄OR681008.110099.85SH-18Sanghuangporus vaninii瓦尼桑黄OR681008.110099.85SH-19Sanghuangporus vaninii瓦尼桑黄OR681008.110099.85SH-20Sanghuangporus vaninii瓦尼桑黄OR681008.110099.85
续表8

菌种编号对比结果中文名称GenBank登陆号覆盖率/%相似度/%SH-23Fuscoporia gilva淡黄褐卧孔菌HM584811.19985.29SH-27Fuscoporia gilva淡黄褐卧孔菌HM584811.19989.11SH-32Sanghuangporus baumii鲍氏桑黄KP974834.18887.19SH-33Sanghuangporus baumii鲍氏桑黄KP974834.19188.57SH-40Sanghuangporus vaninii瓦尼桑黄MT421906.110099.85SH-68Sanghuangporus vaninii瓦尼桑黄MN153566.1100100SH-69Sanghuangporus vaninii瓦尼桑黄OR681008.110099.85SH-SSanghuangporus baumii鲍氏桑黄MG062790.1100100
2.6 航天诱变菌株粗多糖含量测定结果
桑黄多糖是桑黄的主要活性成分之一,其具有抗肿瘤、免疫调节、降血糖、抗炎的作用[16]。如图5所示,14株桑黄菌株粗多糖含量最多的为:SH-40(48.1 mg/g)>SH-32(47.78 mg/g)>SH-69(47.5 mg/g)。
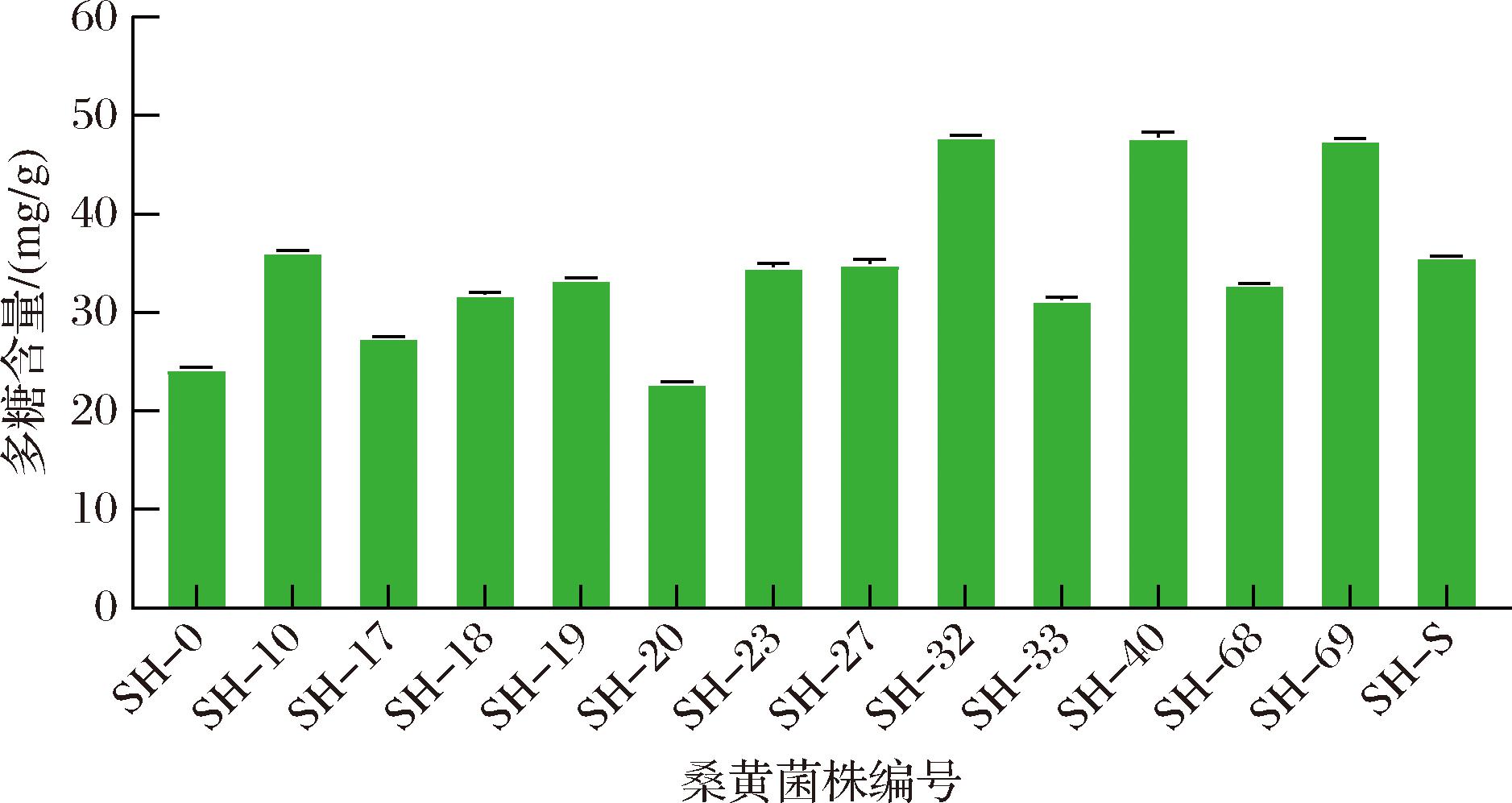
图5 14株桑黄菌株粗多糖含量
Fig.5 Crude polysaccharide content of 14 strains ofSanghuangporus
2.7 航天诱变菌株功能活性物质及抗氧化测定结果
桑黄属于食用菌中少有的含有黄酮类化合物的真菌,桑黄黄酮是在桑黄次级代谢产物中发现的重要的活性物质之一,其具有重要的药理学价值[17]。多酚是一类具有高抗氧化活性的化合物,研究表明,桑黄多酚类物质具有抗肿瘤作用[18]。如图6所示,14株桑黄菌株中总多酚含量最多的前3个为:SH-18(8.73 mg/g)>SH-S(8.03 mg/g)>SH-68(7.77 mg/g);总黄酮含量最多的为:SH-68(8.90 mg/g)>SH-20(6.32 mg/g)>SH-19(4.59 mg/g)。
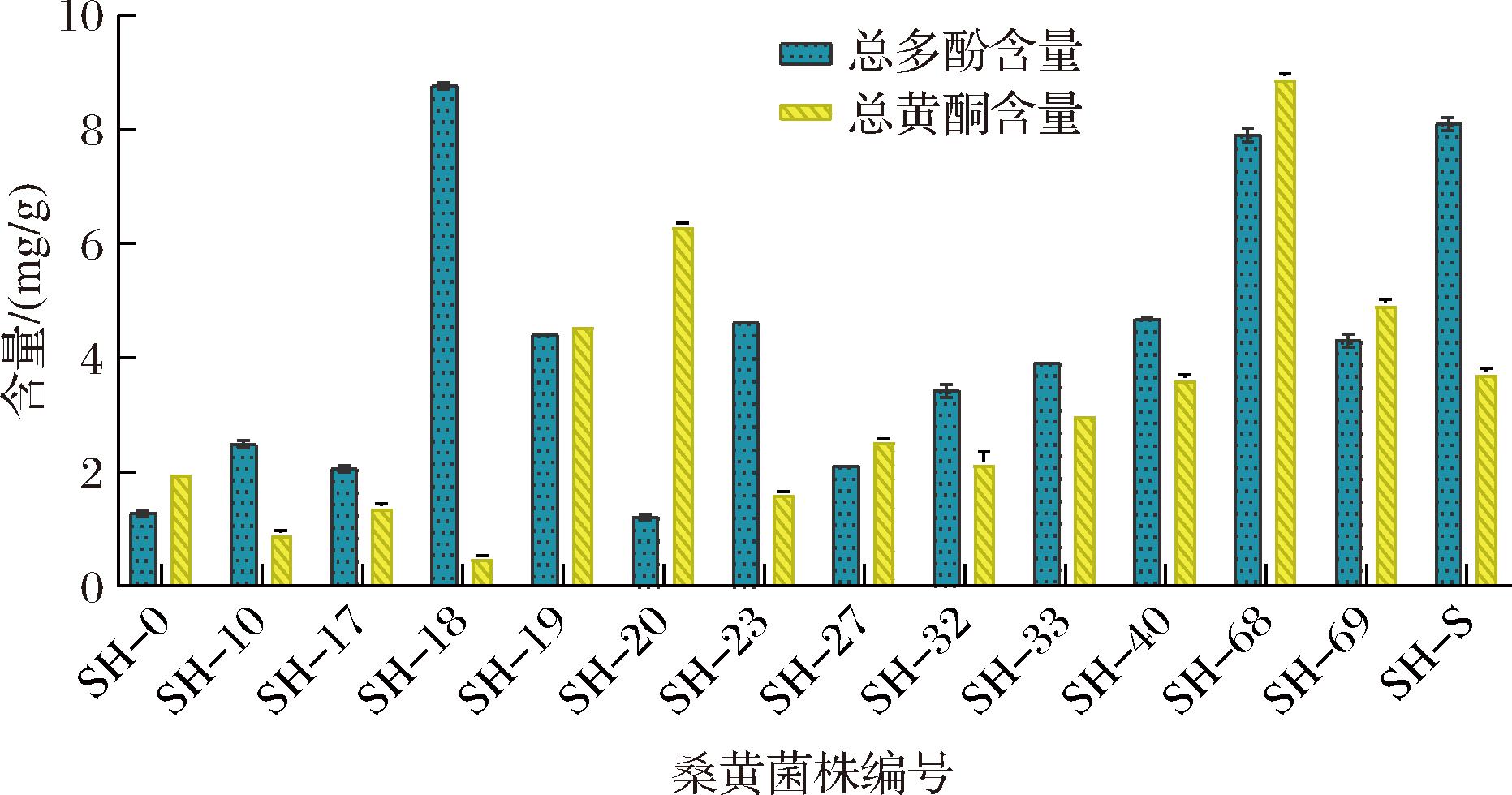
图6 14株桑黄菌株菌丝体多酚和黄酮含量
Fig.6 Polyphenol and flavone contents in mycelia of 14 Sanghuangporus strains
DPPH自由基清除率是评估化合物和草药提取物抗氧化能力最方便和最常见的自由基去除方法,如图7所示,DPPH自由基清除率最高的前3个桑黄菌株为SH-33(94%)>SH-68(91.8%)>SH-S(81.4%)。总抗氧化能力可以更加全面地评估测定样品中所有抗氧化剂的累积活性效果。总抗氧化能力中SH-40(72.20 μmol/g)>SH-23(71.63 μmol/g)>SH-32(45.87 μmol/g)表现最好。
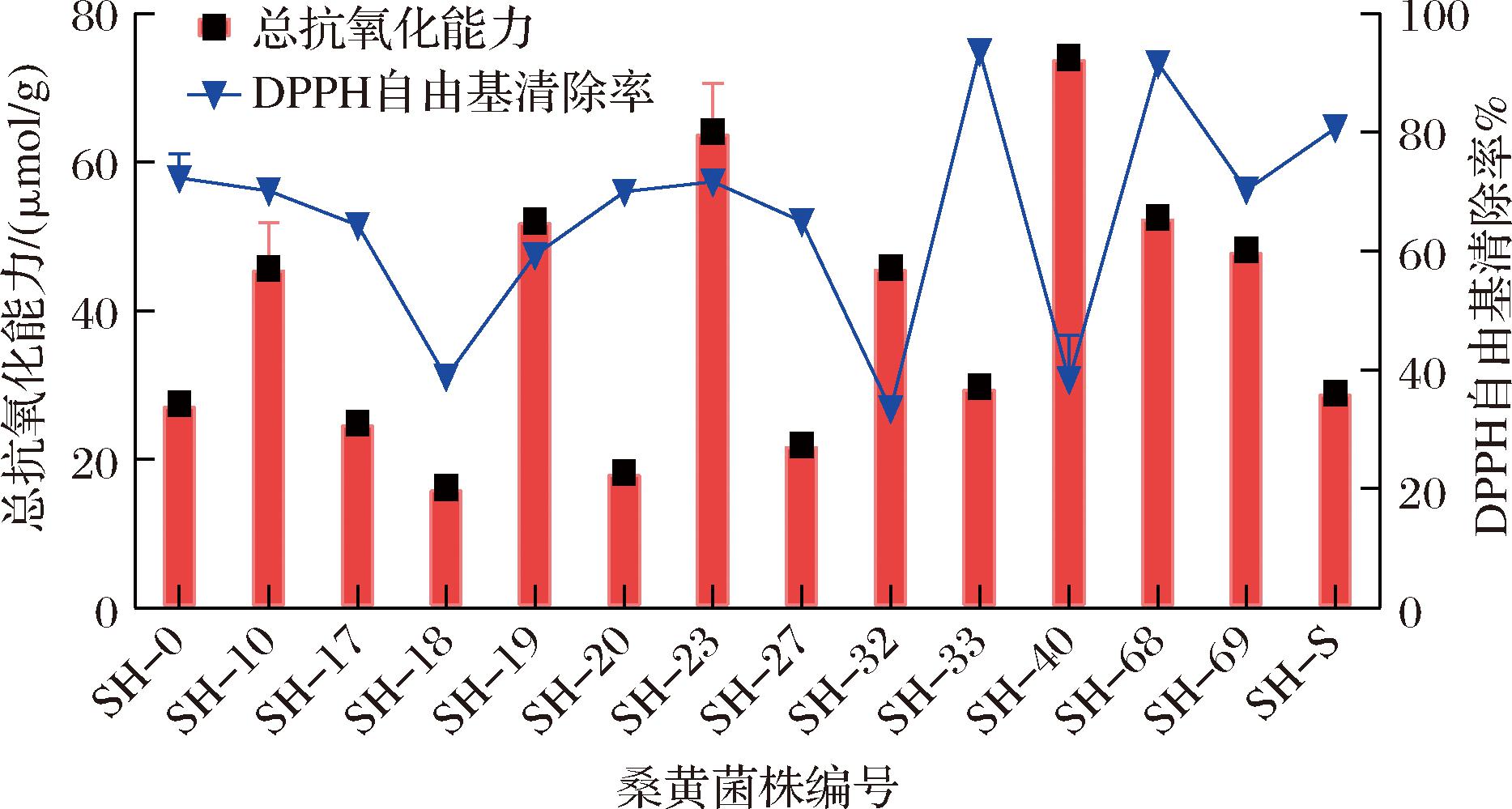
图7 14株桑黄菌株菌丝体抗氧化活性
Fig.7 Antioxidant capacity of mycelia of 14Sanghuangporus strains
2.8 航天诱变桑黄综合评价结果
航天诱变桑黄液体发酵综合评价结果如图8所示。其中综合表现最好的菌株为SH-68,综合得分为32.46,显著大于其他桑黄菌株,其中表现最差的为SH-18和SH-17,分别得分为19.53和21.91。
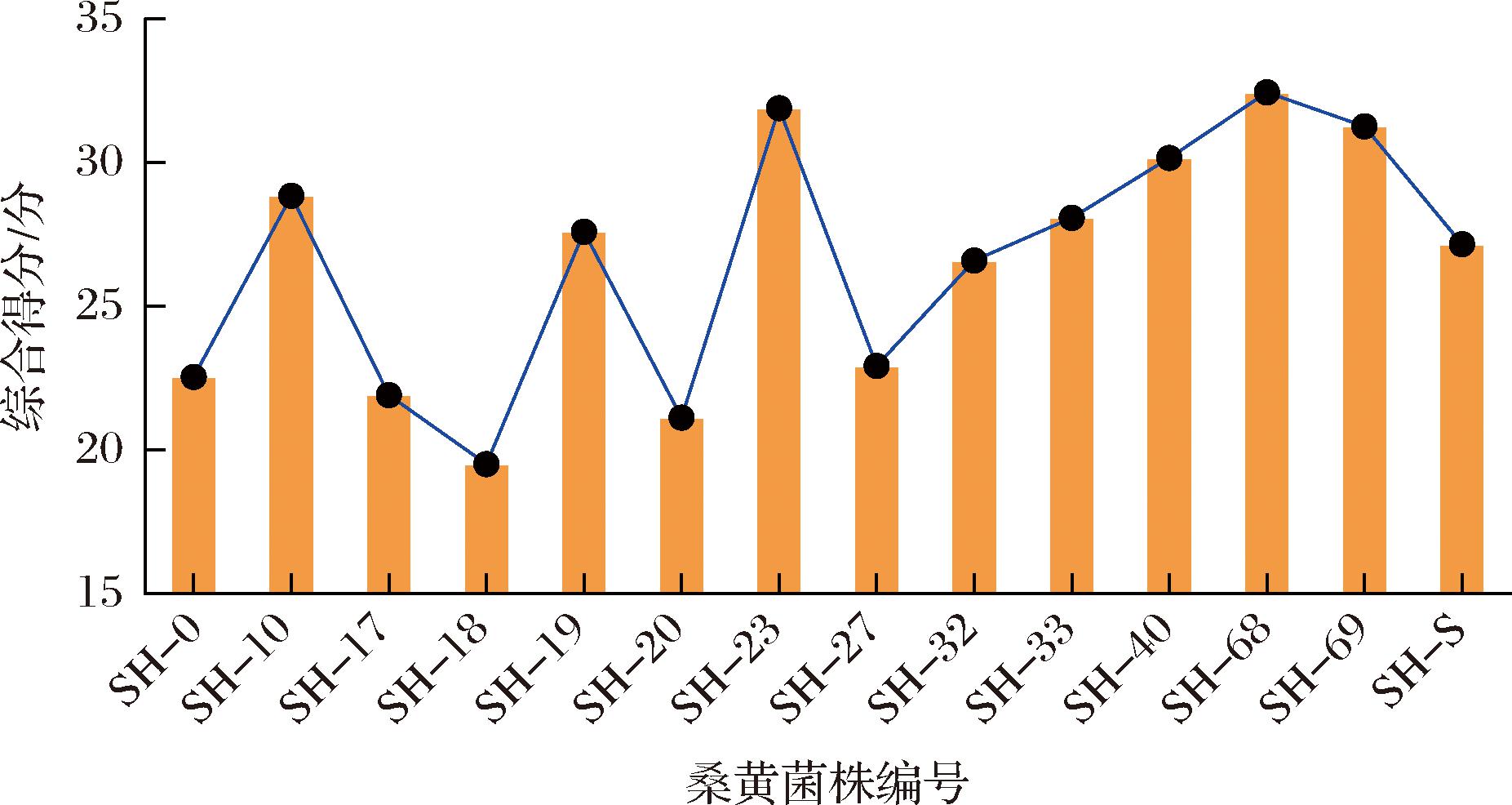
图8 14株桑黄菌株的综合得分
Fig.8 Comprehensive score of 14 Sanghuangporus strains
3 结论与讨论
本试验旨在优化桑黄液体发酵最优配方及筛选最佳桑黄航天诱变菌株用于液体发酵。以桑黄为出发菌株(SH-0),搭载“长征5号B”运载火箭进行真实太空环境诱变,通过分离纯化初筛后,获得30株液体发酵桑黄诱变菌株。以SH-0桑黄菌丝体干重为指标,采用U12(1210)均匀设计表设计试验,DPSv9.01软件对试验结果进行二次多项式逐步回归分析,得出理论最佳配方即:1 L培养基中,玉米粉46.47 g、葡萄糖55.00 g、蛋白胨22.00 g、黄豆面21.94 g、KH2PO4 0.07 g、麸皮36.34 g、NaCl 0.01 g、MgSO4 0.29 g。理论最优配方中的SH-0桑黄菌丝生物量为23.72 g/L,是相同时间内完全培养基的5倍。同时高于傅海庆等[19]研究的桑黄液体发酵培养基22.3 g/L,田雪梅等[20]通过响应面法优化后的菌丝干重18.33 g/L,祝明思等[21]优化的桑黄液体发酵培养基,得到菌丝体干重18.43 g/L。
采用优化后的桑黄液体发酵最优配方,培养上述初筛的30株诱变桑黄和购买的市售桑黄,复筛出菌丝生物量显著大于SH-0的12株航天诱变桑黄和1株市售桑黄(SH-S)。赋予桑黄菌丝生物量、菌丝体粗多糖含量、总黄酮含量、总多酚含量、总抗氧化能力和DPPH自由基清除率一定权重后,多指标综合筛选。最终筛选出最优桑黄航天诱变菌株SH-68,其菌丝生物量为24.4 g/L;菌丝粗多糖含量为32.99 mg/g;总黄酮8.90 mg/g;总多酚含量7.76 mg/g,总抗氧化能力为53.9 μmol/g;DPPH自由基清除率为91.8%,将各指标赋予相应权重后其综合得分32.46,在出发菌株22.56分的基础上显著提升。太空复杂的环境可有效提高桑黄基因突变率,航天诱变可以作为桑黄育种的优良途径,本试验可为今后大型真菌的诱变育种及筛选工作提供相应的理论依据,今后可从以下几个方面展开研究:一是进行相关诱变基因的挖掘及诱变后关键基因的功能研究;二是探究诱变菌株活性成分合成的调控机制,从而进一步了解其内在机理。
相比灵芝类药用真菌的研究与产品的开发,同样作为一种具有较大药用价值的桑黄,对其的开发利用,大多还停留在桑黄子实体的种植、栽培上。有研究表明[22],桑黄液体发酵菌丝所产生的功能活性物质与其子实体所产生的功能活性物质相近,因此更加论证了桑黄液体发酵存在巨大的潜在价值。随着新技术、新标准的进一步探索和公开,未来桑黄类药用真菌液体发酵产业的长期发展,可以是功能活性成分提取的保健类食品或者靶向性功能食品的开发,但桑黄液体发酵菌丝体在食品中的应用,目前没有权威文件进行科学的规范,新食品原料的安全性如何保障是今后相关食品开发者们需要面临的问题。
[1] THANH N T, TUAN N N, KUO P C, et al.Chemical constituents from the fruiting bodies of Phellinus igniarius[J].Natural Product Research, 2018, 32(20):2392-2397.
[2] WU X L, WANG S, LIU C, et al.A new 2H-benzindazole compound from Alternaria alternata Shm-1, an endophytic fungus isolated from the fresh wild fruit of Phellinus igniarius[J].Journal of Natural Medicines, 2019, 73(3):620-626.
[3] 侯玉浩, 马军成, 李宁.不同基原、栽培模式、栽培基质对桑黄药材主要成分含量和体外抗肿瘤活性的影响[J].中药材, 2022, 45(3):536-541.HOU Y H, MA J C, LI N.Effects of different substrates, cultivation modes and cultivation substrates on the content of main components and in vitro antitumor activity of Phellinus igniarius[J].Journal of Chinese Medicinal Materials, 2022, 45(3):536-541.
[4] 彭睿, 徐睿鹏, 辛芮, 等.桑黄中的酚类化合物研究进展[J].中草药, 2023, 54(9):2978-2992.PENG R, XU R P, XIN R, et al.Research progress on phenol compounds in Sanghuang[J].Chinese Traditional and Herbal Drugs, 2023, 54(9):2978-2992.
[5] 于艳杰, 王芳芳, 马红红, 等.桑黄生物活性成分及药理作用研究进展[J].特种经济动植物, 2022, 25(10):94-99.YU Y J, WANG F F, MA H H, et al.Research progress on bioactive components and pharmacological effects of Phellinus igniarius[J].Special Economic Animals and Plants, 2022, 25(10):94-99.
[6] 袁雪梅, 陈冠宇, 王华林.具有潜在抗癌作用的可食用真菌桑黄的研究进展[C].国际食品安全与营养健康高峰论坛组委会.第三届国际食品安全与营养健康高峰论坛论文集, 2021:44-54.YUAN X M, CHENG G Y, WANG H L.Research progress of edible fungus Phellinus igniarius with potential anticancer effect [C].Organizing Committee of the International Food Safety and Nutritional Health Summit Forum.Proceedings of the Third International Food Safety and Nutritional Health Summit Forum, 2021:44-54.
[7] OH K K, ADNAN M, CHO D H.Active ingredients and mechanisms of Phellinus linteus (grown on Rosa multiflora) for alleviation of Type 2 diabetes mellitus through network pharmacology[J].Gene, 2021, 768:145320.
[8] 殷九一. 桑树桑黄多糖的提取、纯化与体外抗肿瘤活性研究[D].石家庄:河北经贸大学, 2023.YIN J Y.Study on extraction, purification and in vitro antitumor activity of polysaccharide from mulberry and Phellinus igniarius[D].Shijiazhuang:Hebei University of Economics and Business, 2023.
[9] 田怡, 张振伟, 高锦运, 等.桑黄航天诱变菌株的筛选及黄酮提取工艺的优化[J].北方园艺, 2024(8):83-93.TIAN Y, ZHANG Z W, GAO J Y, et al.Screening of space mutagenic strains of Phellinus igniarius and optimization of flavonoid extraction process[J].Northern Horticulture, 2024(8):83-93.
[10] 尹琼, 陈超, 吴佳海, 等.航天诱变黔草1号高羊茅分子多样性研究[J].种子, 2023, 42(10):99-104.YIN Q, CHEN C, WU J H, et al.The study on the morphological diversity of Qiancao No.1 Festuca arundinacea with space mutation[J].Seed, 2023, 42(10):99-104.
[11] 薛建邦, 莫转林, 莫美华.灵芝航天诱变菌株的活性成分含量与体外抗氧化活性评价[J].食品科技, 2023, 48(12):1-8.XUE J B, MO Z L, MO M H.Evaluation of active ingredient content and in vitro antioxidant activity of Ganoderma lucidum aerospace mutagenic strains[J].Food Science and Technology, 2023, 48(12):1-8.
[12] 谷凤举, 赖亮民, 杜敏如, 等.航天诱变处理对草菇生物学特性的影响[J].北方园艺, 2022(17):112-120.GU F J, LAI L M, DU M R, et al.Effects of space mutagenesis on biological characteristics of Volvariella volvacea[J].Northern Horticulture, 2022(17):112-120.
[13] 郎红, 赵云昊, 姜明亮.航天诱变育种在园艺作物中的应用进展[J].北方园艺, 2024(14):135-141.LANG H, ZHAO Y H, JIANG M L.Research progress on space mutation breeding application of horticultural crops[J].Northern Horticulture, 2024(14):135-141.
[14] 王丽丽, 林清霞, 宋振硕, 等.分光光度法测定茶叶中总黄酮含量[J].茶叶学报, 2021, 62(1):1-6.WANG L L, LIN Q X, SONG Z S, et al.Spectrophotometric determination of total flavonoids in tea[J].Acta Tea Sinica, 2021, 62(1):1-6.
[15] 李德毓, 司豆豆, 彭浩, 等.桑树桑黄液体发酵及多糖提取工艺优化[J].黑龙江农业科学, 2024(6):64-70.LI D Y, SI D D, PENG H, et al.Optimization of liquid fermentation and polysaccharide extraction of Sanghuangporus sanghuang[J].Heilongjiang Agricultural Sciences, 2024(6):64-70.
[16] 石河, 梅景晨, 李荣雪, 等.桑黄多糖的提取分离及药理作用研究进展[J].药物评价研究, 2023, 46(6):1360-1368.SHI H, MEI J C, LI R X, et al.Research progress in extraction, separation and pharmacological action of Phellinus polysaccharides[J].Drug Evaluation Research, 2023, 46(6):1360-1368.
[17] 李雨鸿, 殷朝敏, 范秀芝, 等.桑黄提取物的体外抗氧化、降血糖及降尿酸活性[J].现代食品科技, 2022, 38(5):71-80.LI Y H, YIN C M, FAN X Z, et al.In vitro anti-oxidant, hypoglycemic, and hypouricemic activities of Sanghuangporus vaninii extracts[J].Modern Food Science and Technology, 2022, 38(5):71-80.
[18] 安欣, 李桐彤, 胡佳雪, 等.鼠李糖乳杆菌发酵枸杞汁营养与风味特性及其抗氧化活性和体外抑制黄嘌呤氧化酶活性的研究 [J].食品工业科技, 2025, 46(1):239-247.AN X, LI T T, HU J X, et al.A study on the nutritional and flavor characteristics, antioxidant activity, and in vitro inhibition of xanthine oxidase activity of goji berry juice fermented by Lactobacillus rhamnosus [J].Science and Technology of Food Industry, 2025, 46(1):239-247.
[19] 傅海庆, 周阳, 傅华英.药用真菌桑黄的液体发酵培养基的配方优化筛选研究[J].江西农业大学学报, 2012, 34(5):1039-1042; 1048.FU H Q, ZHOU Y, FU H Y.Optimal screening of medium formula for liquid fermentation culture of medicinal fungus Phellinus igniarius[J].Acta Agriculturae Universitatis Jiangxiensis, 2012, 34(5):1039-1042; 1048.
[20] 田雪梅, 戴玉成.响应面法优化桑黄液体发酵培养基[C].中国菌物学会2015年学术年会论文摘要集.上海, 2015:165.TIAN X M, DAI Y C.Optimization of liquid fermentation medium of Phellinus igniarius by response surface methodology [C].Proceedings of the 2015 academic annual meeting of the Chinese mycological society.Shanghai,2015:165.
[21] 祝明思, 王应男, 张公亮, 等.桑黄菌丝体液体发酵培养条件的研究[J].中国酿造, 2010, 29(11):88-91.ZHU M S, WANG Y N, ZHANG G L, et al.Liquid fermentation conditions for production of mycelium of Phellinus linteus[J].China Brewing, 2010, 29(11):88-91.
[22] 杨舒廷. 桦树桑黄菌丝体的液体发酵工艺优化及产品研发[D].长春:吉林大学, 2023.YANG S T.Optimization of liquid fermentation process and product development of Phellinus igniarius mycelium [D].Changchun:Jilin University, 2023.