百香果是西番莲属多年生常绿攀缘藤本植物,又名鸡蛋果、西番莲,主要种植在热带和亚热带地区[1],在我国广西、广东、海南、福建、贵州等地均有大量种植[2]。百香果因富含多种水果香气而得名,本身还含有丰富蛋白质、维生素等多种营养物质,被广泛认为是“果汁之王”[3]。广西作为全国最大的百香果生产基地,百香果种植总面积超过20 000 hm2,年产量超30万t[4],给广西带来巨大的经济效益。但百香果成熟采收于高温高湿季节,极易受到微生物的附着侵染,病原菌可直接从果实表皮侵入[5],导致百香果贮藏期间容易发生病害,病害程度难以控制,严重损害了百香果的经济价值[6]。
目前,对于采后百香果病害的控制方法主要倾向于化学防治,但因长期使用化学杀菌剂会产生药物残留、危害有益生物、破坏生态环境、也会使病原物产生抗药性,对人体健康和环境存在潜在的危害,生物防治因具有见效快、易降解、对环境友好和有害生物不易产生抗药性等诸多优点而备受关注[7]。LI等[8]对33种精油单体进行了体外抗菌试验,发现香芹酚能够影响葡萄座腔菌菌丝形态、细胞膜透性、线粒体活性及呼吸速率,导致葡萄座腔菌细胞死亡,表明香芹酚能够用于猕猴桃采后软腐病的防治。研究表明植物源抑菌剂在防控果蔬采后病害显示出良好的应用前景和发展潜力。植酸是一种天然植物化合物,生物毒性低,具有显著的抗氧化、防腐抑菌活性,能有效降低扩展青霉菌和棒曲霉素对苹果侵害[9]。谢晶等[10]研究了植酸对希瓦氏细菌的抑制作用,发现植酸可以造成菌体损伤、影响细菌的生长,具有较强的抑菌效果。柠檬醛具有广谱抑菌、无毒或低毒的特性,可通过破坏并穿透细菌细胞壁脂层,造成膜结构被破坏及蛋白质变性,导致细胞死亡而发挥抗菌活性,对青霉菌、曲霉菌、木霉菌等常见真菌具有抑制作用[11]。魏玲[12]研究发现,柠檬醛能够显著提高猕猴桃采后抗病性,其抑菌机制可能是通过增加与抗氧化相关酶的活力和上调相关基因的表达来实现的。苯乳酸能够抑制多种微生物的生长,如疣状青霉、桔青霉、单核细胞增生李斯特菌、曲霉属等,苯乳酸的天然抗菌特性使其被广泛应用于食品安全领域[13]。LIU等[14]将草莓浸泡在0.1 g/L苯乳酸和乳酸链球菌素的混合溶液中30 s,贮藏6 d时与对照组相比,处理组样品的腐烂率下降了约30%。这些结果均表明植酸、柠檬醛、苯乳酸这3种天然的抑菌剂对采后果蔬病害具有较强的抑菌效果,但在百香果中还鲜有研究。
因此本研究对自然发病的百香果进行病原菌的分离鉴定,确定主要的致病真菌,使用植酸、柠檬醛、苯乳酸来处理致病真菌,研究植酸、柠檬醛、苯乳酸对致病真菌生长的抑制作用,并进一步探讨其可能的抑菌机理,为深入研究百香果采后病害侵染机制及防治措施提供了理论基础。
1 材料与方法
1.1 材料与仪器
试验材料:“紫香”百香果,于贺州市农贸市场
试验药品:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基,北京索莱宝科技有限公司;植酸(70%)、柠檬醛(97%),上海麦克林生化科技有限公司;L-3-苯乳酸(98%),上海源叶生物科技有限公司;其他试剂均为分析纯级。
试验仪器:Olympus-BX53光学显微镜,上海普赫光电科技有限公司;BPC-150F生化培养箱,上海一恒科学仪器有限公司;ZQZY-CF8振荡培养箱,上海知楚仪器有限公司;SQ510C立式压力蒸汽灭菌锅,重庆雅马拓科技有限公司;DL-CJ-2 N超级洁净工作台,北京东联哈尔仪器制造有限公司;XW-80A涡旋振荡器,海门市其林贝尔仪器制造有限公司;PTX-FA110S电子分析天平,福州华志科学仪器有限公司;UV1780紫外分光光度计,岛津科技有限公司;TGL-16MS高速冷冻离心机,上海卢湘仪离心机仪器有限公司
1.2 实验方法
1.2.1 采后百香果病原菌的分离与鉴定
分离纯化:将百香果放置在28 ℃,相对湿度90%的环境中,让其自然发病,观察发现其在第3天时出现病害症状。采用组织分离法[15]对自然发病的百香果病原菌进行分离,即在百香果病健交界处切取约5 mm×5 mm大小的方形组织,使用体积分数(下同)75%的酒精和2%NaClO进行30 s表面消毒、无菌水漂洗3次,将组织块放入无菌吸水纸中,再将果皮外表面贴近PDA平板中心,置于28 ℃恒温培养箱内,每天观察菌落生长情况并及时进行平板划线分离,直至获取纯化的菌株。
形态学鉴定:将纯化后的菌株接种于PDA培养基中,28 ℃培养观察菌落形态及颜色,光学显微镜下观察菌丝和分生孢子特点,对病原菌进行形态学初步鉴定。
分子生物学鉴定:将菌株纯化好后由测序公司进行测序,利用BLAST程序将ITS(ITS1、ITS4)序列与NCBI数据库中的序列进行比对分析,筛选出亲缘关系较近的物种,采用MEGA软件构建系统发育树,并根据序列相似度判断物种归属。
1.2.2 孢子悬浮液及菌丝的制备
孢子悬浮液的制备:将培养7 d的真菌培养皿中加入少量的无菌水,用无菌涂布器重复刮取菌丝,通过8层无菌纱布过滤得到孢子悬浮液。通过血球计数法,将孢子悬浮液配制成浓度为1×106 CFU/mL,置于4 ℃条件下储存备用[16]。
菌丝的收集:取1 mL浓度为1×106 CFU/mL的孢子悬浮液加入到100 mL灭菌的PDB培养基中,28 ℃、120 r/min振荡培养48 h,过滤收集菌丝,用无菌水冲洗3次后抽滤收集菌丝体并混匀[16]。
1.2.3 致病性分析
参考文献[6]的方法稍作修改,将病原菌划线接种到PDA平板上培养至菌丝茂盛,制备浓度为1×106 CFU/mL的孢子悬浮液。挑选表面健康无菌斑的百香果,先用75%的酒精进行表面消毒,再用2%的NaClO进行百香果表面二次消毒,清水洗涤风干后在赤道处用消毒的手术刀划伤(2 cm×2 cm×4 mm),每个伤口接种20 μL的真菌孢子悬浮液,接种无菌水作为对照组,将接种后的百香果于温度28 ℃恒温培养10 d,观察并记录不同致病菌的发病情况。每种菌株接种10个百香果,实验重复3次。
1.2.4 不同抑菌剂对尖孢镰刀菌的抑制效果
采用菌丝生长速率法[15],将药剂与培养基混合配制成终浓度为1%植酸[17]、0.4 μL/mL柠檬醛[12]、5 g/L苯乳酸[18]的PDA培养基,以不加任何药剂的PDA培养基为空白对照,每个处理重复3次。待培养基凝固后,将10 d龄的尖孢镰刀菌菌饼(6.5 mm)反接到PDA平板中心,密封后在28 ℃条件下培养,每隔2 d观察菌落生长状况。
1.2.5 植酸、柠檬醛、苯乳酸室内抑菌毒力测定
采用菌丝生长抑制法[15],分别用不同浓度的植酸、柠檬醛、苯乳酸抑菌剂处理尖孢镰刀菌,研究其抑菌效果。将抑菌剂加入灭菌好的PDA培养基中,配制成终含量为0%、0.05%、0.1%、0.15%、0.2%(体积分数,下同)植酸;0、0.15、0.25、0.35、0.45 μL/mL柠檬醛;0、2、3、4、5 g/L苯乳酸的培养基。接种菌饼(6.5 mm)后置于28 ℃培养箱中,分别在培养的第2、4、6、8天观察菌落形态并通过游标卡尺十字交叉法测量菌落直径,得到相应抑菌率,对其抗菌能力进行回归分析,求出植酸、柠檬醛、苯乳酸毒力回归方程和半最大效应浓度(concentration for 50% of maximal effect,EC50)。抑菌率按公式(1)计算:
抑菌率![]()
(1)
式中:D1,对照菌落直径,mm;D0,菌饼直径,mm;D2,处理菌落直径,mm。
1.2.6 植酸、柠檬醛、苯乳酸处理对尖孢镰刀菌的孢子萌发率测定
参考王敏[16]的方法并稍作修改。配制20 mL含有植酸(终体积分数为0%、0.05%、0.1%、0.15%、0.2%)、柠檬醛(终含量为0、0.2、0.4、0.6、0.8 μL/mL)、苯乳酸(终质量浓度为0、2、3、4、5 g/L)的PDB培养基。取1 mL浓度为1×106 CFU/mL的尖孢镰刀菌孢子悬浮液加入到上述含药培养基中,28 ℃、180 r/min振荡培养。培养0、6、8、10、12、14 h后,用光学显微镜观察尖孢镰刀菌孢子的萌发情况(当孢子芽管长度大于孢子本身长度的一半时视为萌发),计算孢子萌发率,每个处理3个平行,每个平行随机选择孢子数量不少于200个进行观察。孢子萌发率的计算如公式(2)所示:
孢子萌发率![]()
(2)
1.2.7 尖孢镰刀菌细胞膜完整性的测定
细胞膜完整性测定采用染色法[19]。将1 mL尖孢镰刀菌孢子悬浮液(1×106 CFU/mL)置于2 mL无菌离心管中,4 ℃、8 000 r/min离心2 min(后同),在沉淀中加入1 mL植酸(0%、0.05%、0.1%、0.15%、0.2%)、柠檬醛(0、0.2、0.4、0.6、0.8 μL/mL)、苯乳酸(0、2、3、4、5 g/L)溶液,28 ℃下,植酸、柠檬醛抑菌剂处理2 h,苯乳酸抑菌剂处理1 h后离心,孢子沉淀中加入1 mL PBS(0.01 mol/L、pH 7.0,后同),室温下避光静置30 min,离心,弃去上清液后向孢子沉淀中加入1 mL PBS和10 μL/mL碘化丙啶(propidium iodide, PI)染色液(1 mg/mL),避光静置20 min后离心。最后加入1 mL PBS洗涤,重复洗涤3次,最后在荧光显微镜下统计PI染色菌数。染色率的计算如公式(3)所示:
PI染色率![]()
(3)
1.2.8 丙二醛(malondialdehyde, MDA)含量测定
尖孢镰刀菌菌丝体细胞膜MDA含量测定采用硫代巴比妥酸法[16],分别称取2.5 g(湿重)菌丝体加入不同含量的植酸(0%、0.05%、0.1%、0.15%、0.2%)、柠檬醛(0、0.2、0.4、0.6、0.8 μL/mL)、苯乳酸(0、2、3、4、5 g/L)溶液中,28 ℃、100 r/min培养12 h后,再次收集各组菌丝体。分别称取经过不同抑菌剂处理的菌丝体各1 g(湿重)置于研钵中,加入5 mL体积分数10%的三氯乙酸溶液将菌丝磨成匀浆状态,4 ℃、10 000 r/min离心20 min(后同),取2 mL上清液,加入等体积0.67%硫代巴比妥酸溶液,空白对照管中加入等体积10%三氯乙酸溶液。涡旋振荡将其混匀,沸水浴20 min,流水冷却后离心取上清液,分别于450、532、600 nm处测定其吸光度(A450nm、A532nm、A600nm)。每个浓度设置3个平行,每个平行包含3个重复。MDA浓度的计算如公式(4)所示:
MDA浓度/(μmol/L)=6.45×(A532nm-A600nm)-0.56×A450nm
(4)
1.2.9 核酸渗漏量的测定
分别测定植酸(0%、0.05%、0.1%、0.15%、0.2%)、柠檬醛(0、0.2、0.4、0.6、0.8 μL/mL)、苯乳酸(0、2、3、4、5 g/L)溶液在260 nm处的吸光度Ay;称取10 g菌丝于50 mL离心管中,分别加入30 mL上述不同浓度的抑菌剂溶液,28 ℃振荡培养0、1、2、3、4 h时取2 mL培养液,12 000 r/min离心5 min后收集上清液,测定260 nm处吸光度Ax[19]。核酸渗漏量的计算如公式(5)所示:
核酸渗漏量=Ax-Ay
(5)
1.2.10 蛋白质渗漏量测定
分别测定植酸(0%、0.05%、0.1%、0.15%、0.2%)、柠檬醛(0、0.2、0.4、0.6、0.8 μL/mL)、苯乳酸(0、2、3、4、5 g/L)溶液在280 nm处的吸光度Ay;称取10 g菌丝于50 mL离心管中,分别加入30 mL上述不同浓度的抑菌剂溶液,28 ℃振荡培养0、1、2、3、4 h时取2 mL培养液,12 000 r/min离心5 min后收集上清液,测定280 nm处吸光度Ax[19]。蛋白质渗漏量的计算如公式(6)所示:
蛋白质渗漏量=Ax-Ay
(6)
1.3 数据处理
使用Excel进行数据计算,采用MEGA软件构建系统发育树,使用Origin Pro 2019软件进行统计分析,结果为3次测定的“平均值±标准差”,采用SPSS 19.0对数据进行统计分析,显著水平P<0.05。
2 结果与分析
2.1 采后百香果病原菌的分离与鉴定
从自然发病的百香果样品中共分离纯化出4种不同形态的真菌,分别标记为B3~B6,其中B3呈淡紫色,菌丝致密呈棉花絮状,边缘稀疏呈放射状,在光学显微镜下菌丝有隔,分生孢子梗短,呈镰刀型或椭圆形;B4菌落形态呈白色及黄褐色绒状,显微镜下菌丝呈单一状或分支状,菌丝有隔呈竹节状,孢子为圆筒形;B5呈中间灰褐色周围白色,车轮状,菌丝生长较为迅速,菌丝分支多,菌丝及分生孢子梗褐绿色,具横隔,分生孢子倒棒状;B6菌落为白色光滑油状,不生长菌丝,孢子呈圆形,详见电子增强出版附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.040144)。
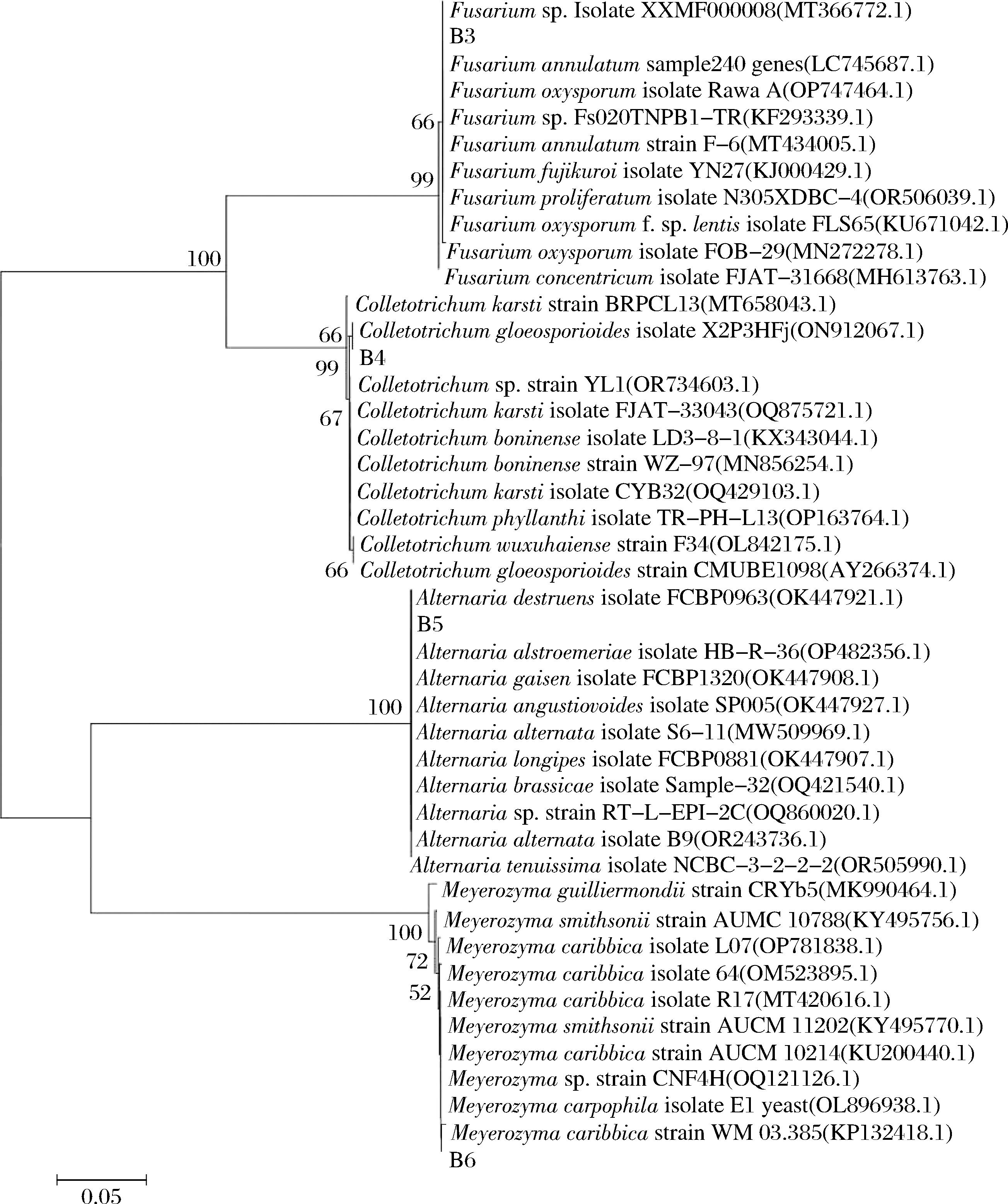
图1 基于ITS基因序列百香果病原真菌的系统发育树
Fig.1 Phylogenetic tree of passion fruit pathogenic fungi based on ITS sequences
将分离纯化的菌种进行试管斜面保存,送往广州有康生物有限公司进行测序。将病原菌的ITS序列测序结果利用BLAST程序与NCBI数据库中的序列进行比对,选择同源性相近的菌株ITS序列,利用MEGAX软件建立系统发育树(图1)。结果表明,B3菌株属于镰刀菌属,B4属于炭疽菌属,B5属于链铬孢属,B6属于Meyerozyma属。结合上述形态观察结果,鉴定B3病原菌为尖孢镰刀菌。
2.2 致病性分析
自然发病的百香果表皮长出白色绒毛,周围凹陷并出现水浸斑,通过组织分离法共分离鉴定到4种真菌,将这4种真菌反接到紫色百香果中,观察并记录百香果发病情况。在接种病原菌4 d后,除空白对照外,其他处理组的百香果均产生了明显的病变。其中划伤接菌B3处理组发病最早,第2天时可观察到白色菌丝,有明显病害症状,随贮藏时间的延长病斑面积逐渐增大,发病处逐渐形成水渍状腐烂病斑,腐烂速度较快,在第8天时完全腐烂,与自然发病的百香果病症相似。B4、B5、B6在第4天时出现病害症状,后病斑面积逐渐增大,第10天时完全腐烂(电子增强出版附图2)。表明B3为采后百香果病害的主要致病菌,故选择B3尖孢镰刀菌进行后续实验。
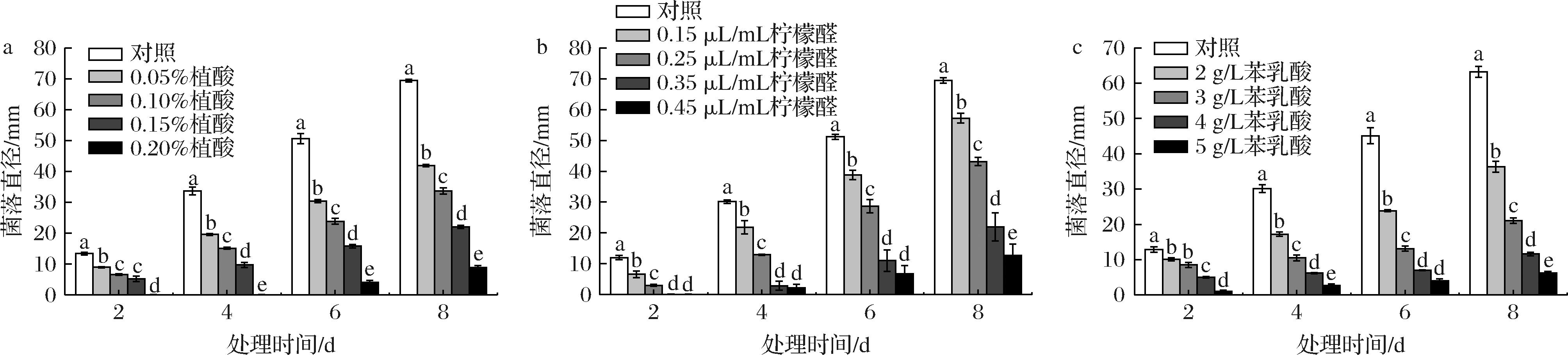
a-植酸;b-柠檬醛;c-苯乳酸
图2 不同含量植酸、柠檬醛、苯乳酸处理对尖孢镰刀菌菌落直径的影响
Fig.2 Effects of different concentrations of phytic acid, citral, and phenyl lactic acid treatments on the diameter of Fusarium oxysporum
注:不同小写字母表示相同时间组间差异显著(P<0.05)(下同)。
2.3 抑菌剂及其浓度的筛选
2.3.1 不同抑菌剂对尖孢镰刀菌的抑制效果
采用0.4 μL/mL柠檬醛处理,菌落直径在前6 d无明显变化,第8天时菌落些微有生长;1%植酸处理组菌落在整个观察期间几乎不生长;5 g/L苯乳酸处理组菌落直径在前4 d有微小的变化,直至观察期结束,菌落直径变化没有明显差异。与对照相比,0.4 μL/mL柠檬醛、1%植酸、5 g/L苯乳酸对尖孢镰刀菌的生长有明显抑制作用,尤其是1%植酸抑制效果显著(电子增强出版附图3)。
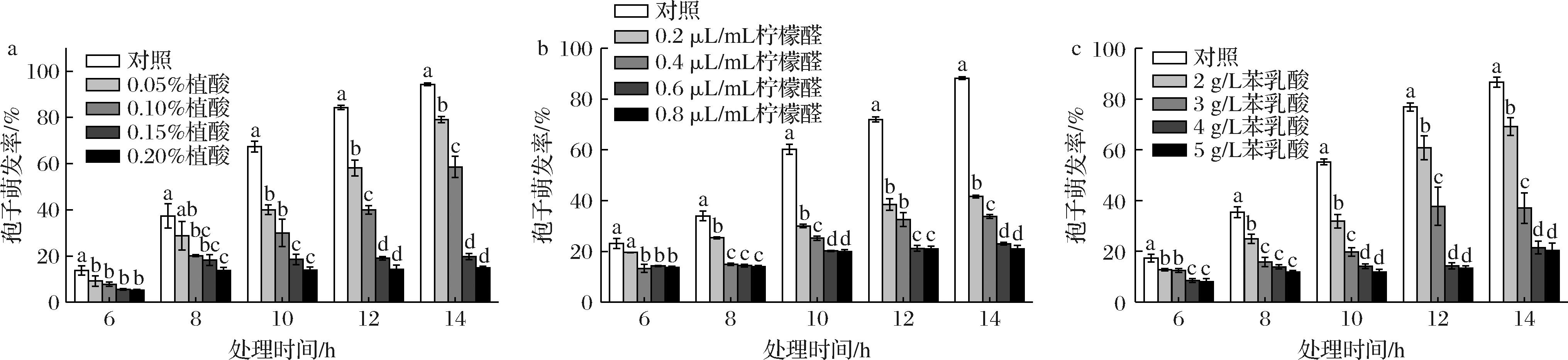
a-植酸;b-柠檬醛;c-苯乳酸
图3 不同含量植酸、柠檬醛、苯乳酸处理对尖孢镰刀菌孢子萌发率的影响
Fig.3 Effects of different concentrations of phytic acid, citral, and phenyl lactic acid treatments on the germination rate ofF. oxysporum spores
2.3.2 不同含量抑菌剂处理对尖孢镰刀菌菌落直径的影响
植酸、柠檬醛、苯乳酸处理均能显著抑制尖孢镰刀菌菌落直径(P<0.05),且随着浓度的增加菌落直径显著减小,即抑菌效果增强;同时发现苯乳酸处理加深了尖孢镰刀菌菌丝的颜色(电子增强出版附图4)。由图2所示,在培养8 d后,0.20%的植酸处理菌落直径仅为8.87 mm,为对照组的12.8%;当柠檬醛0.45 μL/mL时,其菌落直径仅为12.74 mm,是对照组的18.32%;而5 g/L的苯乳酸处理菌落直径为6.19 mm,仅为对照组的9.79%,这些结果表明5 g/L的苯乳酸处理能较好抑制尖孢镰刀菌菌落生长。通过测定植酸、柠檬醛、苯乳酸的抑菌率,以浓度对数为横坐标,抑菌率为纵坐标,拟合得出各抑菌剂毒力回归方程如表1所示:植酸y=79.173x+135.8,其EC50值为0.082 4%;柠檬醛y=139.11x+123.97,其EC50值为0.293 9 μL/mL;苯乳酸y=123.33x+5.9254,其EC50值为2.277 0 g/L。
表1 植酸、柠檬醛、苯乳酸处理尖孢镰刀菌的毒力方程
Table 1 Toxicity equations of phytic acid, citral, and phenyl lactic acid treatment on F. oxysporum

抑菌剂毒力方程相关系数/R2EC50植酸/%y=79.173x+135.80.914 80.082 4柠檬醛/(μL/mL)y=139.11x+123.970.974 20.293 9苯乳酸/(g/L)y=123.33x+5.925 40.993 72.277 0
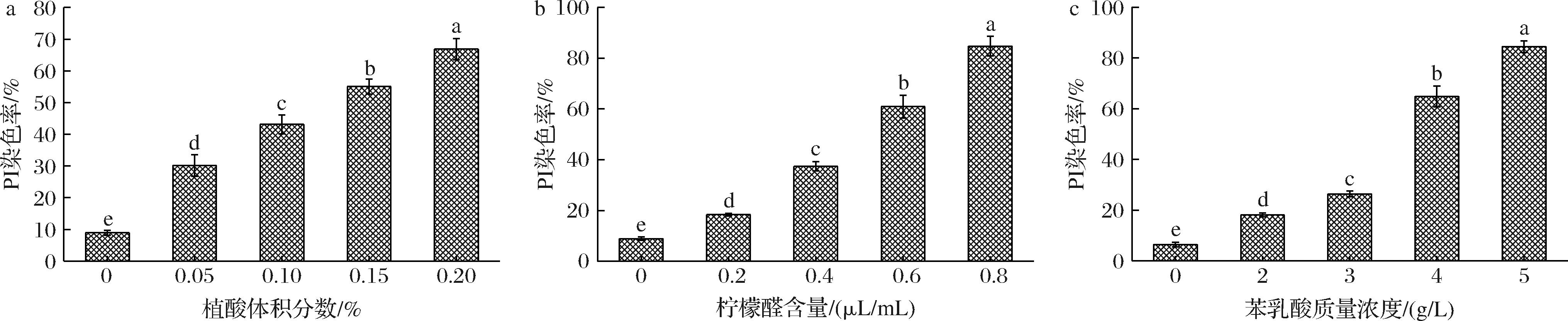
a-植酸;b-柠檬醛;c-苯乳酸
图4 不同浓度植酸、柠檬醛、苯乳酸处理对尖孢镰刀菌细胞PI染色率的影响
Fig.4 Effects of different concentrations of phytic acid, citral, and phenyl lactic acid treatments on PI staining rate of F. oxysporum cell
2.3.3 不同含量抑菌剂处理对尖孢镰刀菌孢子萌发率的影响
在观察期间尖孢镰刀菌孢子逐渐萌发,14 h后,植酸空白对照组的萌发率为94.31%,0.20%植酸处理组的萌发率仅为14.91%(图3-a);柠檬醛空白对照组的萌发率为88.25%,0.8 μL/mL柠檬醛处理组的萌发率仅为21.03%(图3-b);苯乳酸空白对照组的萌发率为86.62%,5 g/L苯乳酸处理组萌发率仅为20.32%(图3-c)。这些结果表明植酸、柠檬醛、苯乳酸对尖孢镰刀菌孢子的萌发均有显著抑制作用(P<0.05),且随着植酸、柠檬醛、苯乳酸浓度的增加,尖孢镰刀菌孢子的萌发率逐渐降低,抑制效果逐渐增强。
2.3.4 不同含量抑菌剂处理对尖孢镰刀菌细胞膜完整性的影响
根据PI染液来检测细胞膜的完整性,如图4所示,对照组中仅有个别孢子发出微弱红光,植酸处理组(2 h)在荧光显微镜的暗视野中可观察到大量被PI染红的孢子,且植酸含量越大被染红的孢子数量越多,红光也逐渐增强,经统计计算,0.20%植酸处理的孢子染色率为66.85%,是对照组的7.5倍(图4-a);对于柠檬醛处理组(2 h),可以在荧光显微镜中观察到大量被PI染红的孢子,且随柠檬醛含量的变大,发出红色荧光孢子的数量逐渐增多,根据计算可知,0.8 μL/mL柠檬醛处理的孢子染色率为84.73%,是对照组的9.53倍(图4-b);经过苯乳酸处理后(1 h),在荧光显微镜的暗视野中可显著观察到大量被PI染红的孢子,且苯乳酸浓度越大被染红的孢子数量越多,红光也逐渐增强,特别是5 g/L苯乳酸处理组有非常显著的变化,通过PI染色率也可以看出,5 g/L苯乳酸处理的孢子染色率为84.46%,是对照组的13.12倍(图4-c)。对于PI染色结果,植酸和柠檬醛处理孢子时间都是2 h才具有明显的红色荧光(即PI荧光率),而苯乳酸处理时间1 h便具有显著变化,且5 g/L苯乳酸处理组的荧光率均高于植酸和柠檬醛处理组(电子增强出版附图5),这表明尖孢镰刀菌孢子经植酸、柠檬醛、苯乳酸处理后,尖孢镰刀菌细胞膜完整性均遭到破坏,孢子发生凋亡,且苯乳酸的破坏性最大。
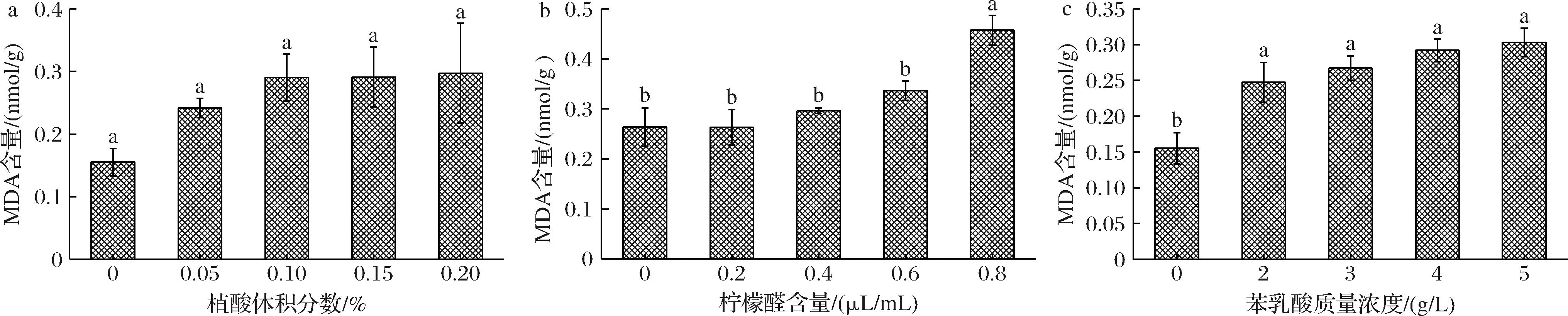
a-植酸;b-柠檬醛;c-苯乳酸
图5 不同含量植酸、柠檬醛、苯乳酸处理对尖孢镰刀菌MDA含量的影响
Fig.5 Effects of different concentrations of phytic acid, citral, and phenyl lactic acid treatments on the MDA content of F. oxysporum
2.3.5 不同含量抑菌剂处理对尖孢镰刀菌MDA含量的影响
如图5-a所示,植酸处理后尖孢镰刀菌的MDA含量有不同程度的增加,但各处理间无显著差异。柠檬醛处理同样促进尖孢镰刀菌MDA含量的增加,且随着柠檬醛含量的增加而增加;低浓度处理MDA含量无显著差异,当含量为0.8 μL/mL时,尖孢镰刀菌的MDA含量为0.46 nmol/g,是对照组的1.74倍,显著高于其他浓度处理(图5-b)。苯乳酸处理可以显著提高尖孢镰刀菌MDA含量(P<0.05),但各浓度间无显著差异(图5-c)。结果表明抑菌剂可以促进尖孢镰刀菌膜脂过氧化,进一步破坏膜的完整性。
2.3.6 不同含量抑菌剂处理对尖孢镰刀菌核酸泄漏量的影响
260 nm是核酸的特征波长,260 nm处吸光度值能够反映菌丝培养液中核酸物质的含量。如图6所示,植酸、柠檬醛、苯乳酸处理组尖孢镰刀菌菌丝核酸渗漏量显著高于对照组(P<0.05),且随着处理量增加以及处理时间的延长而增大。处理4 h时,0.20%植酸、0.8 μL/mL柠檬醛、5 g/L苯乳酸处理菌丝的核酸渗漏量分别为对照组的3.17、3.02、3.36倍。结果表明,植酸、柠檬醛、苯乳酸处理均能破坏尖孢镰刀菌细胞结构,导致核酸泄漏。
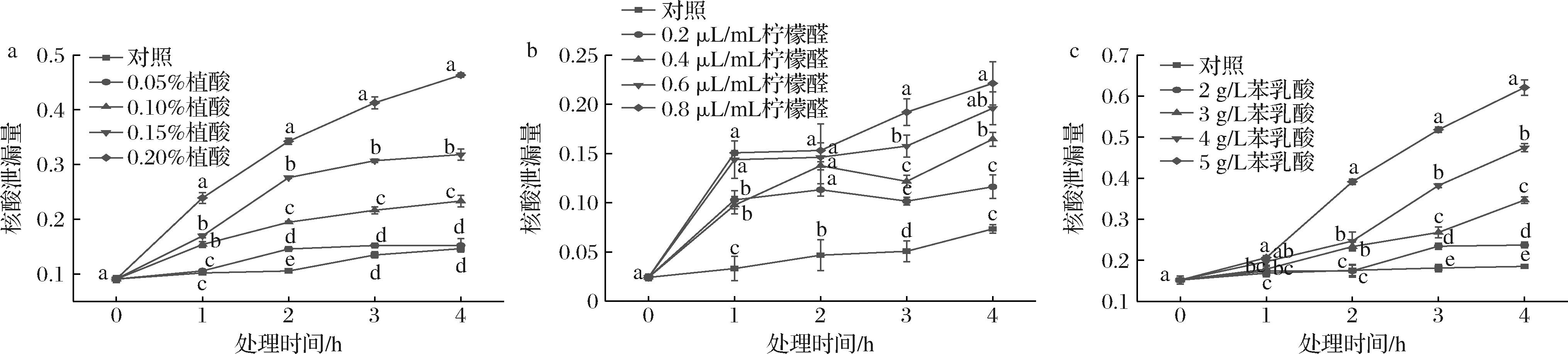
a-植酸;b-柠檬醛;c-苯乳酸
图6 不同含量植酸、柠檬醛、苯乳酸处理对尖孢镰刀菌核酸泄漏量的影响
Fig.6 Effects of different concentrations of phytic acid, citral, and phenyl lactic acid treatments on nucleic acid leakage of F. oxysporum
2.3.7 不同含量抑菌剂处理对尖孢镰刀菌蛋白质泄漏量的影响
如图7所示,植酸、柠檬醛、苯乳酸处理组尖孢镰刀菌菌丝蛋白质渗漏量显著高于对照组(P<0.05),且随着处理量增加以及处理时间的延长而增大。0.20%植酸、0.8 μL/mL柠檬醛、5 g/L苯乳酸处理4 h后菌丝的蛋白质渗漏量分别为对照组的2.61、1.89、2.87倍,说明植酸、柠檬醛、苯乳酸处理能够破坏尖孢镰刀菌细胞结构,造成蛋白质泄漏量增加。
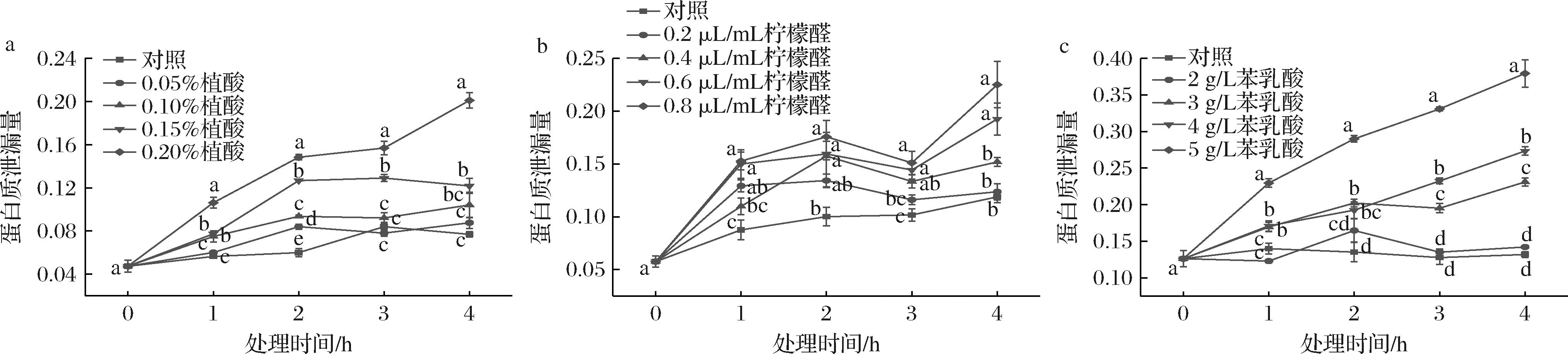
a-植酸;b-柠檬醛;c-苯乳酸
图7 不同含量植酸、柠檬醛、苯乳酸处理对尖孢镰刀菌蛋白质泄漏量的影响
Fig.7 Effects of different concentrations of phytic acid, citral, and phenyl lactic acid treatments on protein leakage of F. oxysporum
3 结论
目前已从多地栽培的百香果中分离鉴定到多种采后病原菌,主要为:藤仓镰刀菌(Fusarium fujikuroi)(贵州)[20]、轮纹镰刀菌(Fusarium concentricum)(广东)[21]、可可毛色二孢菌(Lasiodiplodia theobromae)(广西)[6]、链格孢菌(Alternaria alternata)(广西)[22]、巴西果胶杆菌(Colletotrichum brasiliense)(广西)[23]。本实验所用的实验材料为广西贺州本地种植的“紫香”百香果,从自然发病的果实中分离病原菌,通过形态学观察菌落颜色、分生孢子形状、菌丝生长情况,并结合分子生物学方法,初步确定造成百香果采后腐烂变质的病原菌为镰刀菌属、炭疽菌属、链格孢属、Meyerozyma属。对4种真菌的致病力进行测定,发现镰刀菌对采后百香果表现出较强的致病力。以上结果表明产地不同、气候不同、品种不同,引起百香果病害的致病菌可能不同,且镰刀菌可能是采后百香果主要的致病菌。
采后果蔬病害防治方法种类较多,如物理防治、化学防治以及生物防治,但由于前2种防治方法效果不稳定、对环境不友好且易使病原菌产生耐药性,因此目前更倾向于生物防治。植酸、柠檬醛和苯乳酸均为天然抑菌剂,对许多果蔬致病菌有较好地抑菌效果,在食品行业中应用广泛,但在百香果中还鲜有研究。本研究结果表明,植酸、柠檬醛、苯乳酸均能够明显抑制尖孢镰刀菌菌落直径的生长以及孢子的萌发。其中5 g/L苯乳酸处理能显著抑制菌落生长,而0.20%植酸处理能显著抑制尖孢镰刀菌孢子萌发,表明植酸和苯乳酸对尖孢镰刀菌可能存在着不同抑菌机制。目前关于抑菌剂的抑菌机制包括3种:一是通过破坏细胞壁、质膜等结构,造成营养成分渗出损失,导致细胞死亡;二是DNA、蛋白质结构被破坏,抑制了相关基因的表达,引起代谢过程的受阻;三是破坏细胞内线粒体等结构,干扰能量代谢过程,影响微生物的生长[24]。
谢晶等[10]研究发现植酸会导致菌体原生质、电解质渗出,破坏细胞壁、细胞膜结构,从而影响了微生物的正常生理代谢。郭都等[25]研究表明,柠檬醛能够引起副溶血性弧菌细胞膜电位变化,同时导致细胞皱缩变形,破坏了细胞膜的完整性。LIU等[14]在苯乳酸和乳酸链球菌素联合处理的样品中观察到塌陷、褶皱的细胞及细胞碎片,说明其对细菌生长的抑制作用可能是破坏了细胞膜的通透性,阻碍了细胞分裂,证实了苯乳酸对细胞壁、质膜等结构具有一定的破坏作用,有较强的抗菌活性。这些结果均表明细胞膜的完整性对菌体的正常生长和代谢至关重要,其完整性的受损将导致蛋白质、核酸、糖等重要成分的大量外流,进而影响到菌体的正常生长代谢[26]。本研究中尖孢镰刀菌的核酸泄漏量以及蛋白质泄漏量随着各抑菌剂浓度的增大而增多,这可能是由于抑菌剂破坏了细胞结构,导致细胞通透性增大,引起尖孢镰刀菌细胞内物质的外渗,这与柠檬醛能够通过改变菌丝形态,破坏菌丝细胞膜结构,导致核酸、蛋白等物质外泄的研究结果[27]相似。与对照组相比,苯乳酸对尖孢镰刀菌细胞膜通透性的影响比植酸和柠檬醛大。MDA是细胞膜脂质过氧化过程中的主要产物,其含量的增加表明细胞膜脂受氧化损伤加剧,严重破坏细胞膜结构[28]。本研究中,经不同剂量植酸、柠檬醛、苯乳酸处理后,尖孢镰刀菌菌丝体的MDA含量有明显提高,由此可以说明,植酸、柠檬醛、苯乳酸处理促使了尖孢镰刀菌细胞膜发生不同程度的过氧化反应,导致MDA含量的增加,引起细胞膜氧化损伤,且抑菌剂浓度越大,细胞膜系统的损伤程度越严重。这与欧阳秋丽等[28]研究柠檬醛处理指状青霉菌丝体导致其MDA含量明显增加的结果相似。杨阳阳等[19]研究吡啶-2,6-二羧酸对互隔交链孢的抑制作用时发现抑菌剂处理可以显著提高PI染色率,破坏细胞膜的完整性。本实验采用PI染液检测不同抑菌剂处理对尖孢镰刀菌细胞膜完整性的影响,发现抑菌剂处理后,尖孢镰刀菌的PI染色率明显升高,表明抑菌剂处理可能通过破坏病原菌细胞膜的完整性引起孢子凋亡,这与核酸、蛋白质泄漏量及MDA含量的测定结果一致。进一步证明植酸、柠檬醛、苯乳酸处理能破坏尖孢镰刀菌细胞膜结构,导致尖孢镰刀菌的抑制或死亡。
综上所述,植酸、柠檬醛、苯乳酸处理可以提高尖孢镰刀菌MDA含量、核酸和蛋白质的泄漏,有效抑制尖孢镰刀菌的菌落生长、孢子萌发。这些结果表明植酸、柠檬醛、苯乳酸可能通过引起病原菌细胞膜氧化损伤,破坏细胞膜完整性,提高细胞膜通透性,进而有效抑制病原菌的生长。因此,植酸、柠檬醛和苯乳酸可以作为防治尖孢镰刀菌侵染采后百香果的备选抑菌剂。
[1] LIANG J X, FANG Y Y, AN C, et al.Genome-wide identification and expression analysis of the bHLH gene family in passion fruit (Passiflora edulis) and its response to abiotic stress[J].International Journal of Biological Macromolecules, 2023, 225:389-403.
[2] 徐青, 安松, 李玉娇, 等.不同产地紫果百香果主要功能成分含量及抗氧化活性研究[J].中国果树, 2023(5):76-83.XU Q, AN S, LI Y J, et al.Contents of main functional components and antioxidant activity of purple passion fruit(Passiflora edulis f.edulis) from different habitats[J].China Fruits, 2023(5):76-83.
[3] HUANG D M, MA F N, WU B, et al.Genome-wide association and expression analysis of the lipoxygenase gene family in Passiflora edulis revealing PeLOX4 might be involved in fruit ripeness and ester formation[J].International Journal of Molecular Sciences, 2022, 23(20):12496.
[4] 邢相楠, 黄永才, 陈格, 等.广西百香果产业发展现状、存在问题及对策建议[J].南方农业学报, 2020, 51(5):1240-1246.XING X N, HUANG Y C, CHEN G, et al.Current status, existing problems and development suggestions of Guangxi passion fruit industry[J].Journal of Southern Agriculture, 2020, 51(5):1240-1246.
[5] 林育钊, 陈蕾伊, 陈佳怡, 等.ε-聚赖氨酸对西番莲果实采后病害与抗病物质代谢的影响[J].食品科学, 2024, 45(3):142-149.LIN Y Z, CHEN L Y, CHEN J Y, et al.Effect of ε-poly-L-lysine on postharvest diseases and disease-resistant substance metabolism in passion fruits[J].Food Science, 2024, 45(3):142-149.
[6] 杜婵娟, 杨迪, 叶云峰, 等.广西百香果采后果腐病病原的鉴定[J].植物病理学报, 2022, 52(1):109-113.DU C J, YANG D, YE Y F, et al.Identification of the pathogen causing postharvest fruit rot on passion fruit (Passiflora edulis) in Guangxi[J].Acta Phytopathologica Sinica, 2022, 52(1):109-113.
[7] 郭鸶怡, 马榕, 李思奇, 等.丁子香酚对人参黑斑病菌的抑制活性及其作用机制研究[J].农药学学报, 2024, 26(3):619-624.GUO S Y, MA R, LI S Q, et al.Antifungal effects and action mechanism of eugenol on Alternaria panax causing ginseng black spot[J].Chinese Journal of Pesticide Science, 2024, 26(3):619-624.
[8] LI J, FU S, FAN G, et al.Active compound identification by screening 33 essential oil monomers against Botryosphaeria dothidea from postharvest kiwifruit and its potential action mode[J].Pesticide Biochemistry and Physiology, 2021, 179:104957.
[9] YANG Q Y, ZHANG H Y, ZHANG X Y, et al.Phytic acid enhances biocontrol activity of Rhodotorula mucilaginosa against Penicillium expansum contamination and patulin production in apples[J].Frontiers in Microbiology, 2015, 6:1296.
[10] 谢晶, 侯伟峰, 汤毅, 等.植酸对腐败希瓦氏菌的抑菌机理[J].食品工业科技, 2011, 32(10):85-88.XIE J, HOU W F, TANG Y, et al.Antimicrobial mechanisms of phytic acid against Shewanella putrefacens[J].Science and Technology of Food Industry, 2011, 32(10):85-88.
[11] 张晶晶, 彭锐, 杜春贵, 等.柠檬醛抑制真菌作用的研究进展及其在食品防霉中的应用前景[J].中国调味品, 2020, 45(7):186-190, 200.ZHANG J J, PENG R, DU C G, et al.Research progress of antifungal action of citral and its application prospect in food mildew prevention[J].China Condiment, 2020, 45(7):186-190, 200.
[12] 魏玲. 柠檬醛对猕猴桃采后软腐病的防治机理及保鲜效果研究[D].南昌:江西农业大学, 2021.WEI L.Studies on mechanism of citral in preventing and controlling soft rot of kiwifruit and its effect on kiwifruit postharvest preservation[D].Nanchang:Jiangxi Agricultural University, 2021.
[13] WU H, GUANG C E, ZHANG W L, et al.Recent development of phenyllactic acid:Physicochemical properties, biotechnological production strategies and applications[J].Critical Reviews in Biotechnology, 2023, 43(2):293-308.
[14] LIU J H, HUANG R R, SONG Q Q, et al.Combinational antibacterial activity of nisin and 3-phenyllactic acid and their co-production by engineered Lactococcus lactis[J].Frontiers in Bioengineering and Biotechnology, 2021, 9:612105.
[15] 罗冬兰, 雷霁卿, 曹森, 等.火龙果采后病原菌的分离鉴定及丁香酚抑菌研究[J].中国果树, 2022(8):23-27, 2.LUO D L, LEI J Q, CAO S, et al.Isolation and identification of postharvest pathogens of pitaya fruit and antifungal effect of eugenol[J].China Fruits, 2022(8):23-27, 2.
[16] 王敏. ε-聚赖氨酸对链格孢菌致病力和毒素合成的影响及其机制研究[D].济南:齐鲁工业大学, 2023.WANG M.Effects of ε-polylysine on pathogenicity and toxin synthesis of Alternaria alternata and its mechanism[D].Jinan:Qilu University of Technology, 2023.
[17] 陈超. 壳聚糖、植酸复合涂膜对柑橘贮藏效果的影响[D].杭州:浙江农林大学, 2020.CHEN C.Study of natural film with chitosan combining phytic acids on storage of citrus[D].Hangzhou:Zhejiang A &F University, 2020.
[18] 郭宇逍, 洪阳, 邓丽莉, 等.乳酸菌产苯乳酸对指状青霉的抑菌活性及作用机理[J].食品科学, 2022, 43(15):21-27.GUO Y X, HONG Y, DENG L L, et al.Antifungal activity and possible mechanism of action of phenyllactic acid produced by lactic acid bacteria against Penicillium digitatum[J].Food Science, 2022, 43(15):21-27.
[19] 杨阳阳, 刘志恬, 李永才, 等.吡啶-2, 6-二羧酸处理对梨果采后黑斑病控制作用及其抑菌机理[J].食品科学, 2022, 43(11):163-170.YANG Y Y, LIU Z T, LI Y C, et al.Control effect of pyridine-2, 6-dipicolinic acid treatment on postharvest black spot of pear fruit and possible antifungal mechanism[J].Food Science, 2022, 43(11):163-170.
[20] 孙雁征, 帅良, 罗冬兰, 等.百香果果腐病病原菌的分离鉴定及防治药剂毒力测定[J].中国果树, 2023(4):73-77;143.SUN Y Z, SHUAI L, LUO D L, et al.Isolation and identification of pathogenic bacteria of passion fruit rot and toxicity of fungicides to the pathogen[J].China Fruits, 2023(4):73-77;143.
[21] 冯岩, 谢梓烁, 欧枝凯, 等.镰刀菌引致的百香果病害研究[J].仲恺农业工程学院学报, 2019, 32(4):13-18.FENG Y, XIE Z S, OU Z K, et al.Study on diseases of Passiflora Edulia caused by Fusarium[J].Journal of Zhongkai University of Agriculture and Engineering, 2019, 32(4):13-18.
[22] 史国英, 曾泉, 叶雪莲, 等.百香果疮痂病病原菌鉴定[J].植物病理学报, 2022, 52(6):1006-1008.SHI G Y, ZENG Q, YE X L, et al.Identification of the pathogen causing scab disease on passion fruit (Passiflora Linn.)[J].Acta Phytopathologica Sinica, 2022, 52(6):1006-1008.
[23] SHI G Y, ZENG Q, WEI Y W, et al.First report of anthracnose caused by Colletotrichum brasiliense on violet passion fruit in China[J].Plant Disease, 2022:PDIS11202485PDN.
[24] 老莹, 胡文忠, 冯可, 等.天然抑菌剂的抑菌机理及其在果蔬保鲜中的应用[J].食品与发酵工业, 2018, 44(9):288-293.LAO Y, HU W Z, FENG K, et al.Application of natural antimicrobial agents on fruits and vegetables preservation and its mechanism[J].Food and Fermentation Industries, 2018, 44(9):288-293.
[25] 郭都, 孙慧慧, 孙正, 等.柠檬醛对副溶血性弧菌的抑制作用[J].食品科学, 2019, 40(17):113-120.GUO D, SUN H H, SUN Z, et al.Antimicrobial activity of citral against Vibrio parahaemolyticus[J].Food Science, 2019, 40(17):113-120.
[26] PANTEV A, VALCHEVA R, DANOVA S, et al.Effect of enterococcin A 2000 on biological and synthetic phospholipid membranes[J].International Journal of Food Microbiology, 2003, 80(2):145-152.
[27] ZHANG J J, DU C G, LI Q, et al.Inhibition mechanism and antibacterial activity of natural antibacterial agent citral on bamboo mould and its anti-mildew effect on bamboo[J].Royal Society Open Science, 2021, 8(4):202244.
[28] 欧阳秋丽, 贾雷, 陶能国.柠檬醛对指状青霉菌丝体膜脂过氧化的影响[J].食品科学, 2016, 37(23):32-37.OUYANG Q L, JIA L, TAO N G.Citral inhibits mycelial growth of Penicillium digitatum involving membrane peroxidation[J].Food Science, 2016, 37(23):32-37.