铜绿假单胞菌(Pseudomonas aeruginosa)为革兰氏阴性菌,是一种常见的食源性致病菌,常存在于熟肉制品以及凉拌即食食品中[1]。目前,铜绿假单胞菌是医院常见的病原体之一,可引发呕吐、腹泻等不良症状[2],同时也是医院内引起感染和呼吸相关性肺炎的主要致病菌之一,也会增加免疫缺陷个体、囊性纤维化及严重烧伤等疾病的发病率和死亡率[3]。铜绿假单胞菌可以阻止抗生素治疗靶点的合成进而拥有多重耐药性,这主要取决于其拥有多种内生性、获得性和适应性的抗生素耐药机制[4]。并且,铜绿假单胞菌对高温、高压、紫外线照射等多种物理因素具有较强的抵抗力,所以铜绿假单胞菌的治理难度较大[5]。因此,探索可以有效抑制铜绿假单胞菌的生物活性成分、药物、方法至关重要。
苹果多酚,提取于蔷薇科苹果属落叶乔木植物中的苹果果实,其原料在我国种植历史悠久、种类多、产量大,属于我国重要的经济作物及药食两用水果[6-7]。苹果多酚含有多种植物活性成分,这使其在对人与动物的功能活性和对细菌的抑制作用上受到大量关注。苹果多酚的活性成分包含槲皮素、根皮素、儿茶素等,具有抗氧化、预防癌症,调节免疫水平等多种生理功能。在对人与动物的功能活性中,苹果多酚可降低体脂肪含量,减轻由脂肪囤积诱发的慢性炎症,也可减少由病原体诱导的趋化因子转录物的增加,起到对慢性肺病及相关呼吸道病原菌的抗菌抗炎作用,如一种苹果多酚对包括铜绿假单胞菌在内的可导致慢性阻塞性肺病病原菌的抑制及生物膜活性的影响[8-10]。在细菌的抑制作用上,苹果多酚可通过改变细菌的细胞壁和细胞膜接触、阻碍细菌核苷酸的正常合成与修复、抑制三羧酸循环等对细菌产生抑制作用[11]。
网络药理学,是通过建立数据库和网络,分析网络,并可进行体内外与计算机验证实验,阐述疾病的发展过程与药物分子作用机制的新兴学科[12-13]。网络药理学基于系统生物学理论、生物信息学、网络科学,从系统层次和生物网络的整体进行研究,分析多成分、多通路、多靶点间的复杂网状作用关系,具有多成分、多途径和多靶点协同作用的特点[14]。并且网络药理学还通过“药物-靶点-疾病”等网络图直观展示成分、靶点、通路间的关系,可以快速预测其潜在机制[15-16]。本研究主要探索苹果多酚在人体内对铜绿假单胞菌及其所引起疾病的抑制作用,基于文献整理与网络药理学分析预测了苹果多酚在人体内抑制铜绿假单胞菌与相应疾病的活性成分、靶点和通路,并对主要活性成分与核心蛋白进行分子对接的模拟验证,从而为苹果多酚抑制铜绿假单胞菌及其疾病提供理论依据。
1 材料与方法
1.1 苹果多酚活性成分和靶点的获取
通过查找文献搜集苹果多酚的活性成分[17-19]。利用TCMSP平台(https://old.tcmsp-e.com/tcmsp.php/)检索活性成分的化学名称获取相应的CAS号,并选择筛选条件为口服生物利用度(oral bioavailability,OB)≥30%、类药性指数(drug-likeness,DL)≥0.18的活性成分[20]。无法检索的活性成分使用PubChem(https://pubchem.ncbi.nlm.nih.gov/)检索CAS号获取相应的Canonical SMILES号,在SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)进行靶点预测,选择可能性不为0的靶点。或利用PubChem数据库获取活性成分相应的2D结构,在swiss ADME(http://www.swissadme.ch/)网站中,以GI absorption为high和druglikeness中存在不少于2个指标为“yes”的条件来进行筛选,再继续使用SwissTargetPrediction数据库进行靶点预测[21]。SwissTargetPrediction数据库最后仍无法预测的活性物质,使用TCMSP平台得到靶点,借助Uniprot数据库(https://www.uniprot.org/uploadlists/)获取相应的基因名称[20],将所得全部靶点进行汇总和去重,获得苹果多酚活性成分的关键作用靶点。
1.2 铜绿假单胞菌靶点的搜集
以“Pseudomonas aeruginosa”为关键词,在Genecards(https://www.genecards.org/)、OMIM(http://www.omim.org/)和TTD(https://db.idrblab.net/ttd/)数据库中检索,整合并去重后,得到铜绿假单胞菌及其疾病的相关作用靶点(以下表示为铜绿假单胞菌的靶点)。将苹果多酚活性成分的作用靶点和铜绿假单胞菌的靶点进行映射,获取交集靶点,并利用微生信网站(http://www.bioinformatics.com.cn/)制作韦恩图。
1.3 活性靶点网络图的绘制
利用微生信平台得到的交集靶点,借助Cytoscape 3.8.0软件绘制成“苹果多酚-活性成分-靶点”网络图,并根据度值(degree),筛选出苹果多酚核心成分。
1.4 蛋白-蛋白互作网络(protein-protein interaction networks,PPI)构建
使用STRING数据库(https://www.stringdb.org/),在Multiple proteins中输入靶点名称,选择生物体为“Homo sapiens”,设置最低互动要求为medium confidence(0.400),其他条件默认,构建交集靶点的蛋白互作网络。通过Cytoscape 3.8.0软件中的CytoNCA插件,选择“without weight”计算靶点的连接度(degree centrality,DC)、介度(betweenness,BC)和紧密度(closeness,CC),筛选关键靶点[22]得到核心蛋白。
1.5 GO和KEGG富集分析
将交集靶点导入DAVID平台(https://david.ncifcrf.gov/summary.jsp/),并设置Select Identifier和Select species分别为“OFFICIAL_GENE_SYMBOL”和“Homo sapiens”。进行GO和KEGG富集分析。结果利用微生信网站制作GO条形图和KEGG气泡图。利用Cytoscape 3.8.0软件,构建“苹果多酚-主要活性成分-靶点-通路-铜绿假单胞菌”网络图。
1.6 分子对接
在PubChem数据库中下载各活性成分3D结构的SDF文件并转化为.mol2格式,PDB数据库获取靶点蛋白的.pdb格式。使用Pymol软件进行去除水、配体和可视化的操作。使用AutoDockTools 4.2.6软件对活性成分和蛋白质进行加氢、分子对接和计算结合能[22],其中算法选择“Genetic Algorithm”。
2 结果与分析
2.1 苹果多酚活性成分和靶点
经文献查找和整理共获得74种苹果多酚活性成分。经筛选后得到8种符合要求的活性成分,如表1所示,编号分别为P1~P8。共获得作用靶点184个。
表1 苹果多酚活性成分
Table 1 The main active components of apple polyphenols

编号成分中文名成分英文名CAS号OBDL度值AP1金圣草酚chrysoeriol491-71-435.850.2732AP2槲皮素quercetin117-39-546.430.2830AP3木犀草素luteolin491-70-336.160.2530AP4圣草酚eriodictyol552-58-971.790.2425AP5(-)-表没食子儿茶素没食子酸酯(-)-epigallocatechin 3-gallate989-51-555.090.7716AP6原花青素B1procyanidin B120315-25-767.870.6616AP7鞣花酸ellagic acid476-66-443.060.4314AP8(+)儿茶素(+)catechin154-23-454.830.246
2.2 共同靶点筛选
从Genecards、OMIM和TTD数据库中,获取铜绿假单胞菌相应靶点1 103个。将苹果多酚活性成分的靶点与铜绿假单胞菌靶点通过微生信网站制作韦恩图,并获得交集靶点52个,如图1所示。
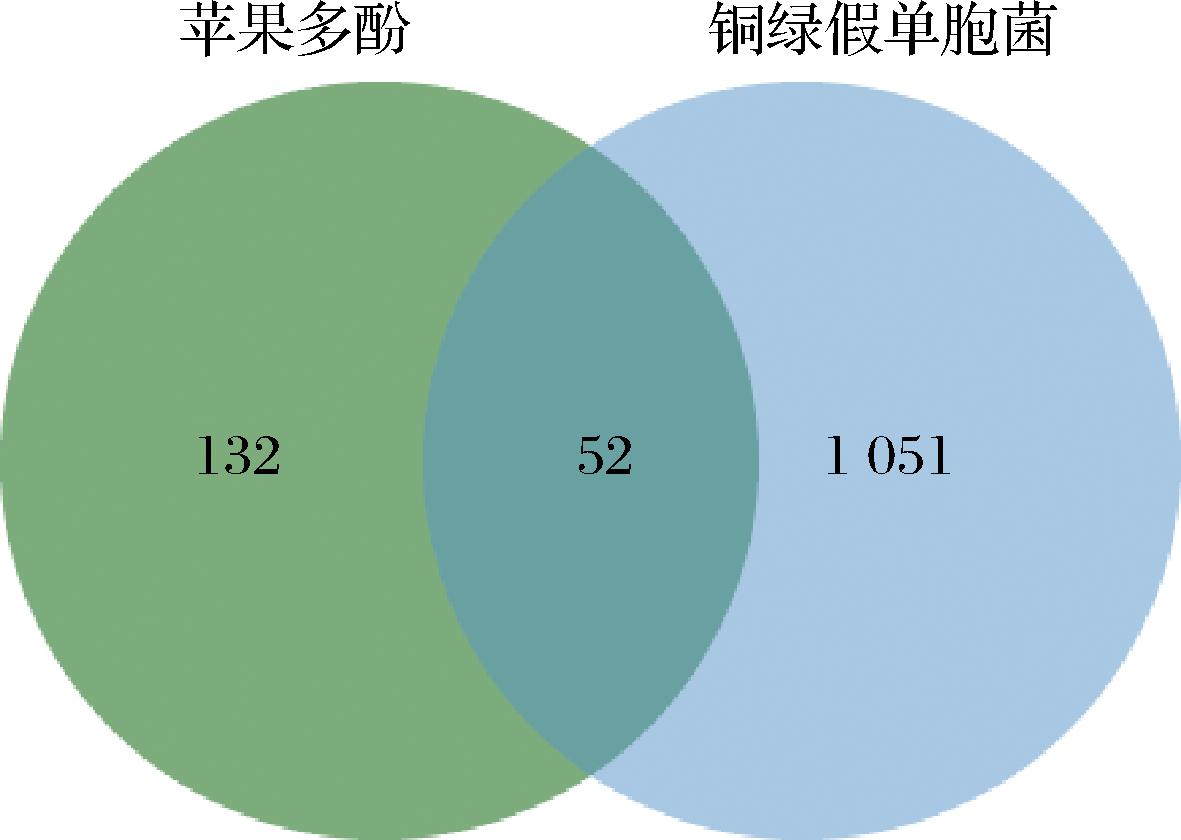
图1 苹果多酚与铜绿假单胞菌靶点韦恩图
Fig.1 Venn diagram of apple polyphenols andPseudomonas aeruginosa targets
2.3 “苹果多酚-活性成分-靶点网络图”的分析
将52个共有靶点使用Cytoscape 3.8.0构建“苹果多酚-活性成分-靶点”网络图,包含62个节点、169条边。并通过CytoNCA分析计算出每个节点的度值(degree),度值越大则表示该化合物发挥治疗作用的可能越大。如图2所示,其中红色三角形代表苹果多酚,黄色正方形代表不同的苹果多酚活性成分,绿色圆形代表靶点。每条边代表苹果多酚与活性成分、活性成分与靶点之间的相互作用关系。度值(degree)如表1所示。

图2 苹果多酚-活性成分-靶点网络图
Fig.2 The network of “apple polyphenols-active ingredient-target”
2.4 苹果多酚抑制铜绿假单胞菌的作用靶点-蛋白互作网络
对交集靶点进行蛋白-蛋白相互作用分析(图3)。其中,每个节点代表一个蛋白,每条边代表其具有不同的相互作用。除1个无连接节点外,共涉及51个节点、388条边。靶点之间的大量相互作用说明它们可能具有生物学上的相关性,并且苹果多酚活性成分对铜绿假单胞菌及疾病的抑制可能涉及多个靶点。经Cytoscape分析处理,获得选择条件分别为BC≥43.88、CC≥0.011、DC≥15.22,筛选后得到11个核心蛋白靶点,筛选结果如表2。筛选流程如图4所示,筛选顺序为BC、CC、DC,其中蓝色代表不符合筛选条件,不参与下一步的筛选,黄色代表符合筛选条件,可进行下一步筛选。

图3 蛋白与蛋白互相作用网络图
Fig.3 Network diagram of protein-protein interaction
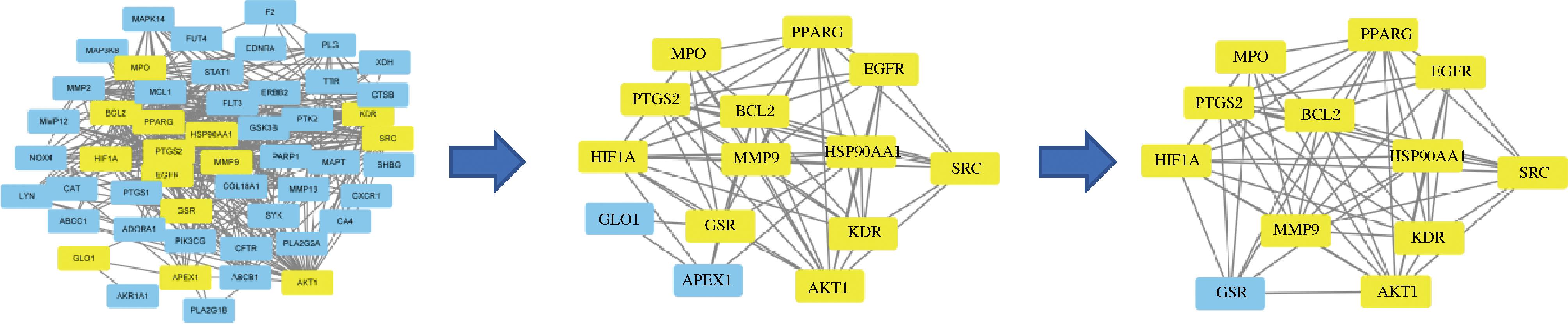
图4 CytoNCA筛选流程
Fig.4 Screening process of CytoNCA
表2 CytoNCA核心蛋白
Table 2 Core Protein of CytoNCA
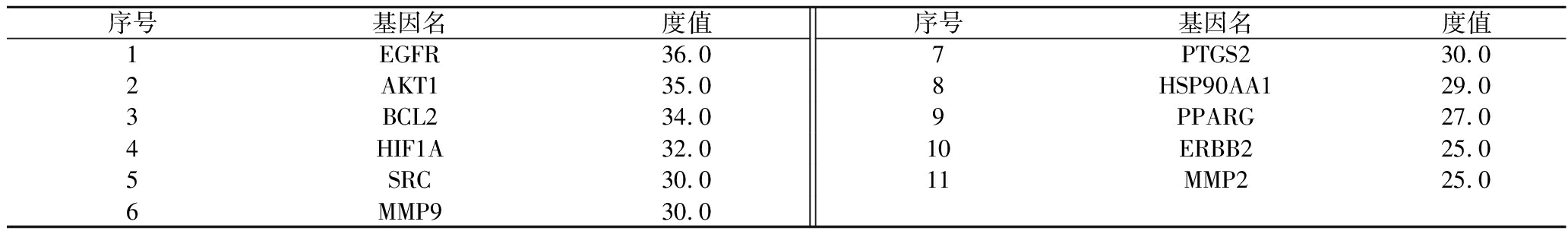
序号基因名度值序号基因名度值1EGFR36.07PTGS230.02AKT135.08HSP90AA129.03BCL234.09PPARG27.04HIF1A32.010ERBB225.05SRC30.011MMP225.06MMP930.0
2.5 GO和KEGG通路富集分析
对52个交集靶点进行GO功能富集分析,共获得条目387条。其中,274个条目为生物过程(biological process,BP)、69个条目为分子功能(molecular function,MF)、44个条目为细胞组成(cell component,CC)。条目的P值与富集程度呈负相关,根据P值将条目进行升序排列,分别选取BP、MF和CC前10的条目绘制条形图,如图5所示。
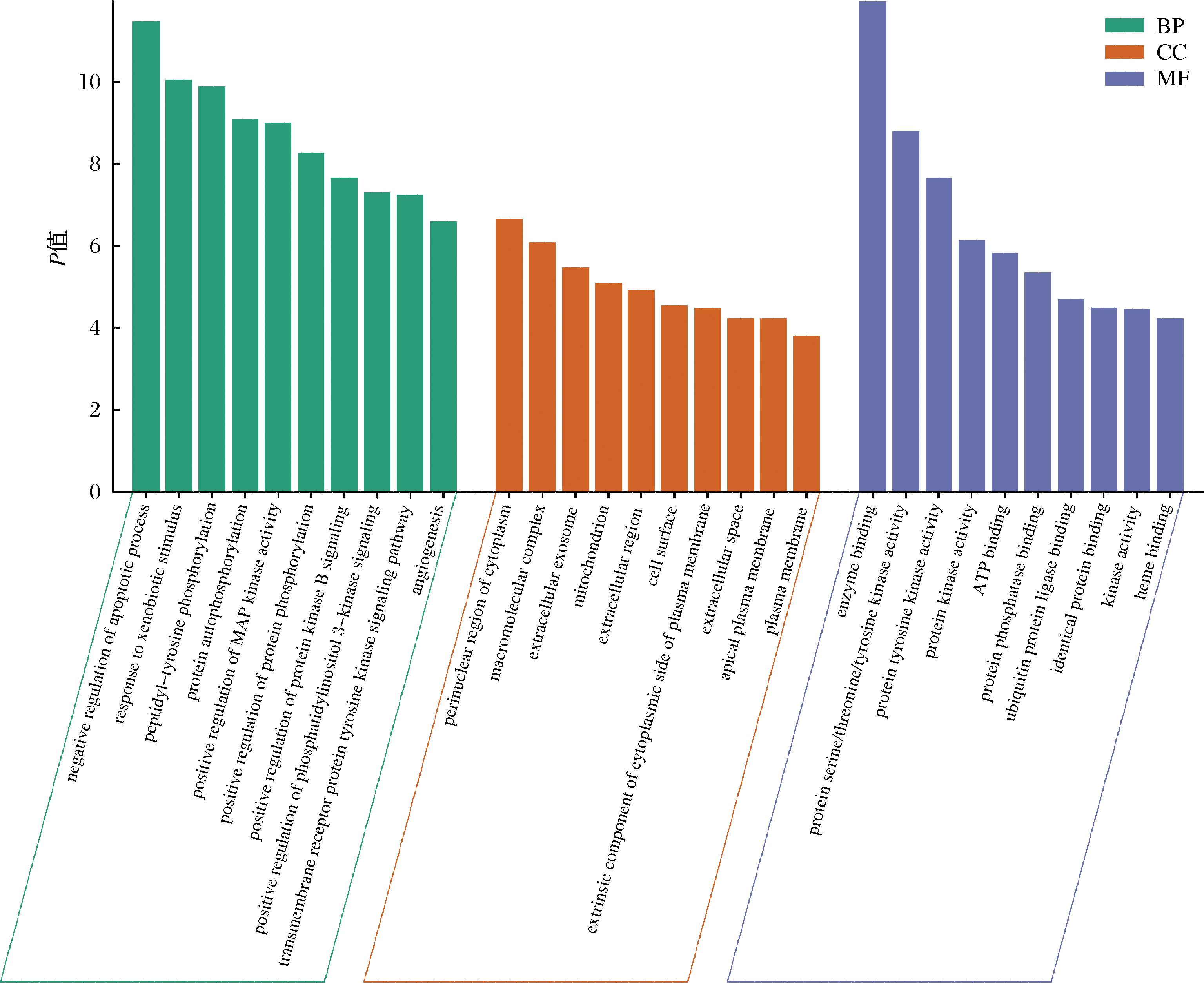
图5 GO富集分析图
Fig.5 GO function enrichment analysis
在生物过程方面,苹果多酚主要参与凋亡过程的负向调控、对异生素刺激的反应、肽基酪氨酸磷酸化、蛋白质自磷酸化、MAP激酶活性的正调控、蛋白质磷酸化的正调控、蛋白激酶B信号转导的正调控、磷脂酰肌醇3-激酶信号转导的正调控、跨膜受体蛋白酪氨酸激酶信号通路、血管生成等过程。在细胞组成方面,苹果多酚主要作用于细胞质核周区、大分子复合物、细胞外泌体、线粒体、细胞外区域、细胞表面、质膜细胞质侧的外在成分、细胞外空间、顶端质膜、质膜等。分子功能结果表明,苹果多酚的靶点主要富集于酶结合、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、蛋白酪氨酸激酶活性、蛋白激酶活性、ATP结合、蛋白磷酸酶结合、泛素蛋白连接酶结合、相同的蛋白质结合、激酶活性、血红素结合等。
KEGG通路富集分析显示,52个交集靶点富集于93条通路中。按照P值升序排列,选取前25个信号通路绘制为气泡图。如图6所示,其中气泡的大小与信号通路富集基因数目的多少成正相关、气泡的颜色越红表示此信号通路越显著、X轴表示错误发现率,且随着X轴向右而减小。结果显示,作用靶点主要富集在癌症的通路(17个靶点)、流体剪切应力与动脉粥样硬化(10个靶点)、内分泌抵抗(9个靶点)、卡波西肉瘤相关疱疹病毒感染(11个靶点)、蛋白聚糖在癌症中的应用(11个靶点)、EGFR酪氨酸激酶抑制剂耐药性(8个靶点)、PI3K-Akt信号通路(13个靶点)、VEGF信号通路(7个靶点)。

图6 KEGG通路富集分析图
Fig.6 KEGG pathway enrichment analysis
2.6 苹果多酚活性成分-靶点-通路关系网络
利用Cytoscape软件,构建“苹果多酚-主要活性成分-靶点-通路-铜绿假单胞菌”网络图,系统的阐述其作用机制。如图7所示,其中红色三角代表苹果多酚,黄色正方形代表不同的苹果多酚活性成分,绿色四边形代表铜绿假单胞菌,蓝色六边形代表通路,紫色八边形代表靶点。每条边代表苹果多酚活性成分与靶点、靶点与通路之间的相互作用关系。结果表明,度值较高的苹果多酚活性成分有金圣草酚、槲皮素、木犀草素、圣草酚等,与2.3节获取度值结果一致。靶点有AKT1、EGFR等,拥有较高的关联度。据图7可知,苹果多酚筛选获得的活性成分均作用于多个靶点,并且大部分靶点与多个组分相互作用,参与多条通路。这表明苹果多酚是通过多成分、多靶点、多通路对铜绿假单胞菌及其疾病进行抑制作用的。
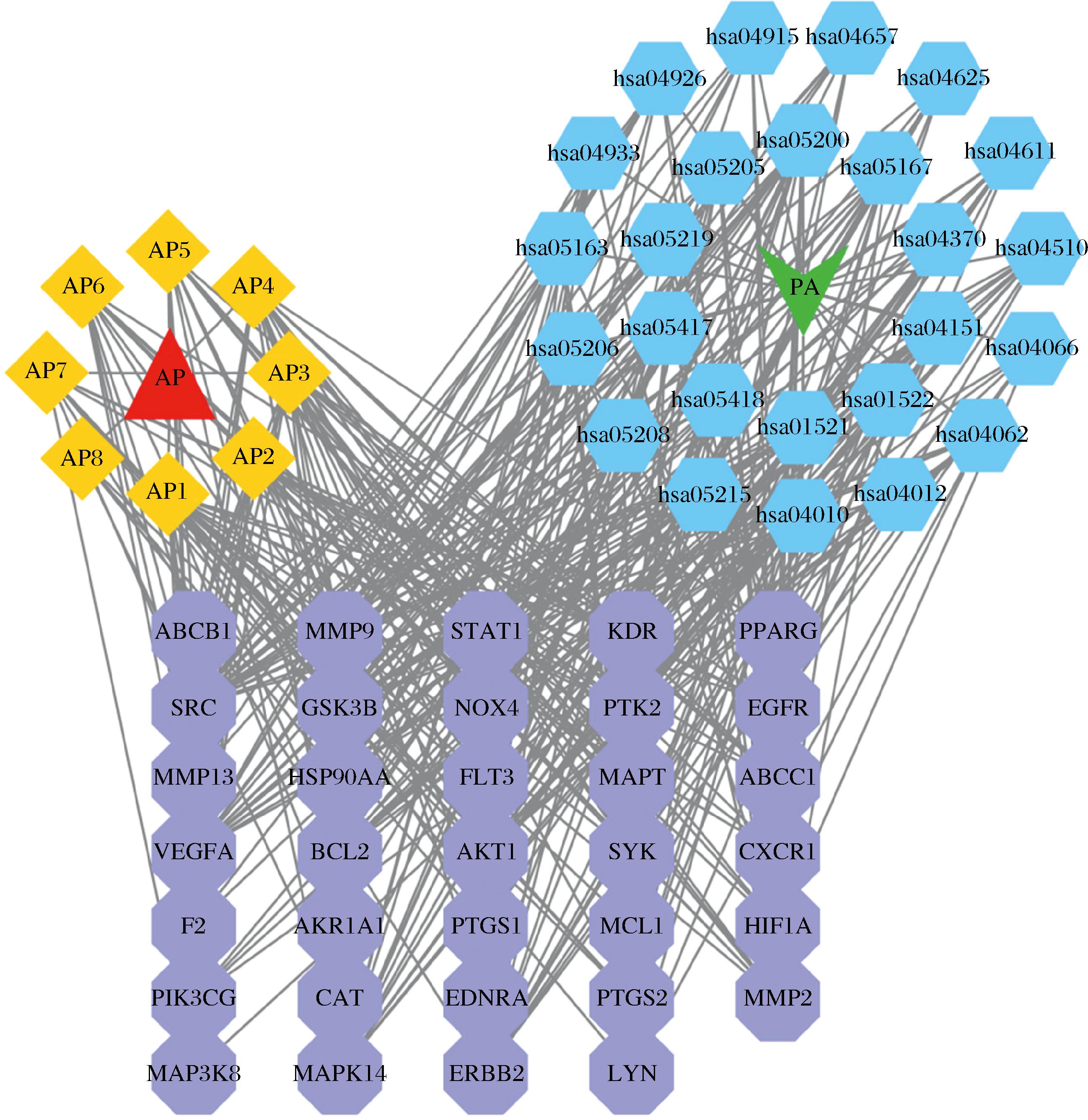
图7 苹果多酚-主要活性成分-靶点-通路-铜绿假单胞菌网络关联图
Fig.7 The network of apple polyphenols-main active ingredient-target-pathway-Pseudomonas aeruginosa
2.7 分子对接
为证明苹果多酚活性成分可以抑制铜绿假单胞菌及其疾病,使用活性成分与核心靶点的蛋白在计算机上进行对接,计算其结合效能,选取苹果多酚主要的4个活性成分与2.4节筛选的前4个核心靶点进行分子对接。活性成分为金圣草酚、槲皮素、木犀草素、圣草酚。核心靶点为EGFR、AKT1、BCL2、HIF1A。分子对接的结合能越低,两分子的结合活性越好。分子对接结合能<0时,说明两分子具有自发结合能力,分子对接结合能<-1.2 kcal/mol(-5.0 kJ/mol)时,表明两分子结合良好[23]。分子对接结果如表3所示。
表3 苹果多酚主要活性成分与核心靶点分子对接结合能 单位:kcal/mol Table 3 Binding energies of main active components of apple polyphenols and key targets
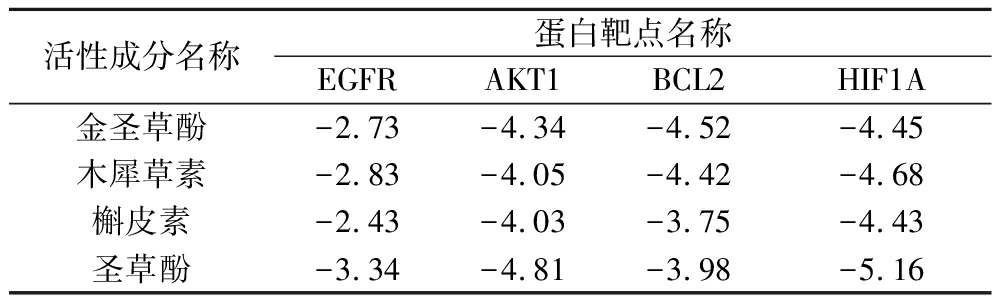
活性成分名称蛋白靶点名称EGFRAKT1BCL2HIF1A金圣草酚-2.73-4.34-4.52-4.45木犀草素-2.83-4.05-4.42-4.68槲皮素-2.43-4.03-3.75-4.43圣草酚-3.34-4.81-3.98-5.16
根据结果显示,筛选获得的苹果多酚活性成分与所选靶点均能良好的结合。并且,圣草酚与靶点HIF1A的结合能最低,可达到-5.16 kcal/mol。将苹果多酚活性成分和靶点对接的结果进行可视化,如图8所示。所选苹果多酚活性成分与靶点均可通过氢键结合,粉色代表活性成分,黄色代表氢键,如槲皮素与AKT1在GLU-85、ARG86、4IP-1117共形成9个氢键。

图8 苹果多酚活性成分和关键靶点的分子对接图
Fig.8 Molecular docking map of apple polyphenol active components and key targets
3 讨论
铜绿假单胞菌是食源性致病菌,也是一种耐药条件致病菌,可导致免疫功能低下的慢性阻塞性肺疾病、囊性纤维化、癌症、创伤、烧伤、败血症和呼吸机相关性肺炎患者发生急性或慢性感染,除此之外还可引起几乎任何器官的严重感染。铜绿假单胞菌外膜上具有的脂多糖,可诱导人体肺部的炎症反应,以及导致上皮细胞分泌细胞因子和趋化因子,从而过多激活免疫细胞,对组织造成严重的损伤,并加重细菌感染。铜绿假单胞菌的毒力、体内外的生存能力受群体感应、六类型的分泌系统、双组分系统以及网络调控等多个方面的影响[24]。
苹果多酚是由苹果提取的含有多种活性成分的混合物。具有抗氧化、抗癌、抑菌等多种活性功能。通过前期文献整理与网络药理学的分析,获得8种主要活性成分,均有抑菌能力。根据文献报道,在体外实验中,耿亚飞[25]获得了木犀草素通过抑制信号分子N-3-氧代十二酰基-L-高丝氨酸内酯的生成,并且与其和另一信号分子2-庚基-3-羟基-4-喹诺酮(2-heptyl-3-hydroxy-4-quinolone,PQS)的受体蛋白竞争结合,进而影响铜绿假单胞菌的群体感应,从而产生抑菌效果,木犀草素也通过抑制IκB-α蛋白的磷酸化、细胞质p65蛋白核移位,进而抑制核因子-κB炎症等信号通路,从而产生对铜绿假单胞菌侵染的抗炎效果。罗双燕[26]证明了槲皮素对铜绿假单胞菌的抗菌效果。ZHU等[27]证实了圣草酚可减缓由脂多糖诱导的肺损伤症状。金圣草酚也被证实可以通过对脂多糖诱导巨噬细胞产生NO过程的抑制,进而产生抗炎作用,并且金圣草酚对革兰氏阳性菌和革兰氏阴性菌都有抑菌效果[28]。廖春丽等[29]则研究证明了苹果多酚的混合物对大肠杆菌、金黄色葡萄球菌和枯草芽胞杆菌等有较好的抑制效果。因此,可知苹果多酚在体外对铜绿假单胞菌或革兰氏阴性菌有抑制作用。
根据PPI分析可知,苹果多酚抑制铜绿假单胞菌的核心靶点有EGFR、AKT1、BCL2、HIF1A、SRC、MMP9、PTGS2、HSP90AA1、PPARG、ERBB2、MMP2。其中,AKT1具有抑制肌动蛋白动力学过程、抑制吞噬小体与溶酶体融合的功能,使细菌的杀灭受到抑制,并促进细菌在细胞内生长。AKT1所参与的AKT1/mTOR通路也与细菌病原体入侵有关,当其通路受到抑制时,可使机体产生自噬体起到抵抗细菌病原体入侵的作用[30-31]。HIF1A靶点,一种免疫细胞功能的关键调节因子,可参与调节代谢、免疫基因的表达。但在机体被生物体侵染时,HIF1A对促炎细胞因子和趋化因子产生的影响,导致其具有致病以及加剧感染的作用[32-33]。EGFR属于受体酪氨酸激酶EGFR家族,其在疾病期间起到维持上皮屏障和防御以及保护宿主的作用。但当病毒和细菌入侵时,EGFR的功能会受到一定的影响,病毒和细菌便会利用EGFR的功能,以达到增强自身感染能力和增殖的效果[34]。B淋巴细胞瘤-2(B-cell lymphoma-2,BCL2)是一种抗凋亡蛋白,具有抑制促炎细胞因子干扰素-γ的表达,促进抗炎细胞因子IL-10和转化生长因子-β表达等功能。但有文献表明,细菌入侵人体时,BCL2的高表达促进T细胞抑制分子PD-L1的表达,进而减弱生产性T细胞的反应[35]。当BCL2受到抑制时,T细胞抑制分子PD-L1的水平显著降低,进而减少PD-L1与T细胞上的配体PD-1结合,阻止T细胞无反应性和T细胞凋亡,增强保护作用。MMP9参与细胞外基质的局部蛋白水解和白细胞迁移,可以通过影响非蛋白水解作用,阻止巨噬细胞迁移到感染部位,进而对细菌的感染具有一定的保护作用[36]。综上推测,苹果多酚可能通过影响这些靶点发挥对铜绿假单胞菌及其所引起疾病的抑制作用。
根据KEGG气泡图进行分析可知,对铜绿假单胞菌及其疾病的抑制包含癌症的相关通路、内分泌抵抗、流体剪切应力与动脉粥样硬化、EGFR酪氨酸激酶抑制剂耐药、PI3K/AKT和VEGF等多个通路。其中,PI3K/AKT信号通路,是参与细胞生长、分化、增殖等过程的重要节点[37]。有研究表明,PI3K/AKT信号通路可增加细菌病原菌的侵袭能力,如增强铜绿假单胞菌、肺炎链球菌以及克雷伯菌等[38]。EGFR酪氨酸激酶抑制剂耐药通路,其靶点蛋白通过PPI图可知是抑制铜绿假单胞菌及其疾病的核心靶点,并且有研究表明EGFR可以激活PI3K/AKT等多个下游信号的转导[39],进而影响细菌的侵袭能力。由此可知,苹果多酚对铜绿假单胞菌及其疾病的抑制涉及多方面生物学过程和包含EGFR酪氨酸激酶抑制剂耐药、PI3K/AKT、VEGF等在内的多条信号通路。
根据分子对接的结果显示,苹果多酚主要活性成分与核心靶点的蛋白均能够自发结合。并且结合能均小于-1.2 kcal/mol,表明苹果多酚中的活性成分可以通过以上筛选出来的靶点对铜绿假单胞菌及其疾病起到抑制作用。
综上所述,苹果多酚通过金圣草酚、槲皮素、木犀草素、圣草酚等活性成分调控EGFR、AKT1、BCL2、HIF1A等靶点,参与EGFR酪氨酸激酶抑制剂耐药性信号通路、PI3K/AKT信号通路和VEGF信号通路等来达到对铜绿假单胞菌及其疾病的抑制作用。本研究为进一步探讨苹果多酚对铜绿假单胞菌及其疾病的抑制机理提供理论基础。
[1] 蔡双福, 张琴, 黄耀雄.食品中铜绿假单胞菌的监测分析[J].中国卫生检验杂志, 2015, 25(6):875-876;905.CAI S F, ZHANG Q, HUANG Y X.Monitoring and analysis of Pseudomonas aeruginosa in food[J].Chinese Journal of Health Laboratory Technology, 2015, 25(6):875-876;905.
[2] 朱泽康, 王昭, 聂蓉, 等.Nisin与和厚朴酚联用对铜绿假单胞菌生物被膜的协同抑制作用[J].中国食品学报, 2023, 23(10):12-22.ZHU Z K, WANG Z, NIE R, et al.Synergistic inhibition of Pseudomonas aeruginosa biofilm by the combination of nisin and honokiol[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(10):12-22.
[3] GELLATLY S L, HANCOCK R E W.Pseudomonas aeruginosa:New insights into pathogenesis and host defenses[J].Pathogens and Disease, 2013, 67(3):159-173.
[4] 马书恒, 缪林坪, 陈荻秋, 等.隐丹参酮对铜绿假单胞菌的生长及生物膜形成的抑制作用[J].激光生物学报, 2024, 33(1):90-96.MA S H, MIAO L P, CHEN D Q, et al.Inhibitory effect of cryptotanshinone on biofilm formation of Pseudomonas aeruginosa[J].Acta Laser Biology Sinica, 2024, 33(1):90-96.
[5] VANDRISSE C M, LIPSH-SOKOLIK R, KHERSONSKY O, et al.Computationally designed pyocyanin demethylase acts synergistically with tobramycin to kill recalcitrant Pseudomonas aeruginosa biofilms[J].Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(12):e2022012118.
[6] 郭俊花, 许先猛, 马欣, 等.利用苹果皮渣发酵制备天然酵素工艺优化及其对苹果品质的影响[J].江苏农业科学, 2018, 46 (1):97-101.GUO J H, XU X M, MA X, et al.Optimization of natural enzyme production by apple pomace fermentation and its effect on apple quality[J].Jiangsu Agricultural Sciences, 2018, 46 (1):97-101.
[7] 徐椿慧. 苹果渣饲料的加工研究进展[J].畜禽业, 2009, 20(8):50-52.XU C H.Research progress on processing of apple pomace feed[J].Livestock and Poultry Industry, 2009, 20(8):50-52.
[8] 孟祥源.苹果多酚对肥胖小鼠骨质流失的预防效果研究[D].青岛:青岛大学, 2023.MENG X Y.Study on the preventive effect of apple polyphenols on bone loss in obese mice[D].Qingdao:Qingdao University, 2023.
[9] BIRRU R L, BEIN K, BONDARCHUK N, et al.Antimicrobial and anti-inflammatory activity of apple polyphenol phloretin on respiratory pathogens associated with chronic obstructive pulmonary disease[J].Frontiers in Cellular and Infection Microbiology, 2021, 11:652944.
[10] 李旋, 毕金峰, 刘璇, 等.苹果多酚的组成和功能特性研究现状与展望[J].中国食品学报, 2020, 20(11):328-340.LI X, BI J F, LIU X, et al.Research status and prospect on the composition and functional characteristics of apple polyphenols[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(11):328-340.
[11] 刘婷. 苹果幼果多酚对口腔致臭微生物的抑菌作用及机理[D].西安:陕西师范大学, 2022.LIU T.Antibacterial effect and mechanism of polyphenols from young apple fruit on oral malodorous microorganisms[D].Xi’an:Shaanxi Normal University, 2022.
[12] 袁甜, 崔琳琳, 王莹, 等.中药网络药理学最新进展[J].中医药学报, 2021, 49(1):101-106.YUAN T, CUI L L, WANG Y, et al.Latest development of TCM network pharmacology[J].Acta Chinese Medicine and Pharmacology, 2021, 49(1):101-106.
[13] 高丽娟, 季欢, 赖灵巧, 等.网络药理学在人兽共患病领域的应用研究进展[J].中国病原生物学杂志, 2023, 18(12):1487-1490.GAO L J, JI H, LAI L Q, et al.Application network pharmacology in the field of zoonosis research:A review[J].Journal of Pathogen Biology, 2023, 18(12):1487-1490.
[14] ZHAO L, ZHANG H, LI N, et al.Network pharmacology, a promising approach to reveal the pharmacology mechanism of Chinese medicine formula[J].Journal of Ethnopharmacology, 2023, 309:116306.
[15] HONG M, LI S, WANG N, et al.A biomedical investigation of the hepatoprotective effect of Radix salviae miltiorrhizae and network pharmacology-based prediction of the active compounds and molecular targets[J].International Journal of Molecular Sciences, 2017, 18(3):620.
[16] HONG M, LI S, TAN H Y, et al.A network-based pharmacology study of the herb-induced liver injury potential of traditional hepatoprotective Chinese herbal medicines[J].Molecules, 2017, 22(4):632.
[17] DA SILVA L C, VIGAN J, DE SOUZA MESQUITA L M, et al.Recent advances and trends in extraction techniques to recover polyphenols compounds from apple by-products[J].Food Chemistry:X, 2021, 12:100133.
J, DE SOUZA MESQUITA L M, et al.Recent advances and trends in extraction techniques to recover polyphenols compounds from apple by-products[J].Food Chemistry:X, 2021, 12:100133.
[18] FERNANDES P A R, LE BOURVELLEC C, RENARD C M G C, et al.Revisiting the chemistry of apple pomace polyphenols[J].Food Chemistry, 2019, 294:9-18.
[19] 冉军舰. 苹果多酚的组分鉴定及功能特性研究[D].杨凌:西北农林科技大学, 2013.RAN J J.Component identification and functional characteristics of apple polyphenols[D].Yangling:Northwest A&F University, 2013.
[20] 杨娟, 豆佳红, 孙悦龙, 等.基于网络药理学与分子对接和实验验证探讨费菜抗炎作用的分子机制[J].食品工业科技, 2023, 44(4):12-21.YANG J, DOU J H, SUN Y L, et al.Molecular mechanism of Phedimus aizoon(Linnaeus)’t hart.on antiinflammatory effect based on network pharmacology and molecular docking and experiment research[J].Science and Technology of Food Industry, 2023, 44(4):12-21.
[21] 李建良, 王朝鲁, 蔡淑珍, 等.基于网络药理学探讨全石榴“助胃火”治疗功能性胃肠病的作用机制[J].中成药, 2019, 41 (9):2240-2245.LI J L, WANG C L, CAI S Z, et al.Discussion on the mechanism of whole pomegranate “helping stomach fire” in treating functional gastrointestinal diseases based on network pharmacology[J].Chinese Traditional Patent Medicine, 2019, 41 (9):2240-2245.
[22] 王腾飞, 段瑞斌, 杨佳丽, 等.基于网络药理学和分子对接探讨毛建茶干预高脂血症的作用机制[J].食品科学, 2023, 44(9):7-14.WANG T F, DUAN R B, YANG J L, et al.Using network pharmacology and molecular docking to explore the mechanism by which Dracocephalum rupestre hance tea intervenes in hyperlipidemia[J].Food Science, 2023, 44(9):7-14.
[23] DUAN H, KHAN G J, SHANG L J, et al.Computational pharmacology and bioinformatics to explore the potential mechanism of Schisandra against atherosclerosis[J].Food and Chemical Toxicology, 2021, 150:112058.
[24] QIN S G, XIAO W, ZHOU C M, et al.Pseudomonas aeruginosa:Pathogenesis, virulence factors, antibiotic resistance, interaction with host, technology advances and emerging therapeutics[J].Signal Transduction and Targeted Therapy, 2022, 7(1):199.
[25] 耿亚飞. 木犀草素对铜绿假单胞菌的群体感应抑制及免疫调节机制研究[D].无锡:江南大学, 2021.GENG Y F.Study on quorum sensing inhibition and immune regulation mechanism of luteolin against Pseudomonas aeruginosa[D].Wuxi:Jiangnan University, 2021.
[26] 罗双燕. 奶牛乳房炎主要病原菌耐药性调查及槲皮素对铜绿假单胞菌生物被膜的抑制作用研究[D].银川:宁夏大学, 2023.LUO S Y.Investigation on drug resistance of main pathogenic bacteria of dairy cow mastitis and study on inhibitory effect of quercetin on Pseudomonas aeruginosa biofilm[D].Yinchuan:Ningxia University, 2023.
[27] ZHU G F, GUO H J, HUANG Y, et al.Eriodictyol, a plant flavonoid, attenuates LPS-induced acute lung injury through its antioxidative and anti-inflammatory activity[J].Experimental and Therapeutic Medicine, 2015, 10(6):2259-2266.
[28] ABOULAGHRAS S, SAHIB N, BAKRIM S, et al.Health benefits and pharmacological aspects of chrysoeriol[J].Pharmaceuticals, 2022, 15(8):973.
[29] 廖春丽, 汤缓缓, 杨闪闪.苹果多酚抑制油脂氧化与抑菌特性的研究[J].中国调味品, 2012, 37(6):31-34.LIAO C L, TANG H H, YANG S S.Study on Inhibiting oil oxidation and antibacterial characterization by apple polyphenol[J].China Condiment, 2012, 37(6):31-34.
[30] KUIJL C, SAVAGE N D L, MARSMAN M, et al.Intracellular bacterial growth is controlled by a kinase network around PKB/AKT1[J].Nature, 2007, 450(7170):725-730.
[31] LI R P, TAN S R, YU M, et al.Annexin A2 regulates autophagy in Pseudomonas aeruginosa infection through the Akt1-mTOR-ULK1/2 signaling pathway[J].Journal of Immunology, 2015, 195(8):3901-3911.
[32] MCGETTRICK A F, O’NEILL L A J.The role of HIF in immunity and inflammation[J].Cell Metabolism, 2020, 32(4):524-536.
[33] KNIGHT M, STANLEY S.HIF-1α as a central mediator of cellular resistance to intracellular pathogens[J].Current Opinion in Immunology, 2019, 60:111-116.
[34] HO J, YANG X X, NIKOU S A, et al.Candidalysin activates innate epithelial immune responses via epidermal growth factor receptor[J].Nature Communications, 2019, 10(1):2297.
[35] SINGH A, ANANG V, VERMA C, et al.Bcl2 negatively regulates protective immune responses during mycobacterial infection[J].Biomolecular Concepts, 2021, 12(1):94-109.
[36] SHAN Y, ZHANG Y K, ZHUO X H, et al.Matrix metalloproteinase-9 plays a role in protecting zebrafish from lethal infection with Listeria monocytogenes by enhancing macrophage migration[J].Fish &Shellfish Immunology, 2016, 54:179-187.
[37] SONG Z X, GUO Y F, ZHOU M, et al.The PI3K/p-Akt signaling pathway participates in calcitriol ameliorating podocyte injury in DN rats[J].Metabolism, 2014, 63(10):1324-1333.
[38] 周婧, 高阳阳, 刘佳玲, 等.基于网络药理学的穿心莲抗菌分子机制研究[J].中药与临床, 2021, 12(5):22-26;37.ZHOU J, GAO Y Y, LIU J L, et al.Molecular mechanism of Chuanxinlian against bacteria based on network pharmacology[J].Pharmacy and Clinics of Chinese Materia Medica, 2021, 12(5):22-26;37.
[39] 李琼雅, 刘亚.特布他林对老年AECOPD肺部感染患者肺功能及HIF1、γ-GCS水平的影响[J].华夏医学, 2021, 34(3):99-103.LI Q Y, LIU Y.Effects of terbutaline on lung function, HIF1 and γ-GCS levels in elderly AECOPD patients with lung infection[J].Acta Medicinae Sinica, 2021, 34(3):99-103.