沙门氏菌是常见的肠道致病菌,常引起人、食品和动物之间的循环感染,并呈现全球分布。近年来随着抑菌剂的泛用,沙门氏菌的耐药性和抗性问题日趋严重。群体感应(quorum sensing,QS)是细菌产生QS信号分子并释放至胞外环境中,当环境中的信号分子浓度达到一定阈值,就能与相应受体蛋白结合,激活靶基因表达,调控菌体的群体行为[1]。研究表明,沙门氏菌的QS系统可分为3类:酰基高丝氨酸内酯(acyl-homoserine lactone, AHL)介导的Ⅰ型系统、LuxS介导的Ⅱ型系统和AI-3/Epi/NE介导的Ⅲ型系统[2]。沙门氏菌通过SdiA(suppressor of celldivision inhibition A)受体蛋白识别外环境中其他细菌产生的AHL信号分子生成SdiA-AHL复合体激活rck操纵子基因座表达,而rck操纵子正是沙门氏菌菌毛合成,增强抵抗血清抗体和生物膜形成的基因座[3]。LuxS是一种小分子金属酶,其作用是催化细菌活化甲基化循环的最后一步S-核糖高半胱氨酸转化为4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentandione,DPD),DPD能与水反应生成QS信号分子AI-2的前体,环境中的AI-2进入沙门氏菌细胞后,会激活沙门氏菌的鞭毛基因和相关毒力基因的表达。AI-3由胃肠道菌群产生,尽管AI-3不直接依赖于LuxS合成,但是LuxS突变对AI-3的产生会造成影响。综上可知沙门氏菌的QS系统主要由LuxS蛋白调控,沙门氏菌毒力因子的表达受QS系统影响。因此研究基于QS系统的新型沙门氏菌抑菌剂,对缓解目前沙门氏菌耐药性和抗性严重的局面有积极作用。
群体感应抑制剂(quorum sensing inhibitor,QSI)是在不抑制细菌正常生长的条件下通过抑制QS系统调控细菌生理活动,从而降低细菌致病力和侵袭力的物质[4]。许多细菌的毒力因子(毒素、蛋白酶和免疫逃避因子)受QS系统的AHL信号分子调控,使得靶点QS开发新型抑菌剂有望成为破除沙门氏菌对越来越多抗生素耐药局面的方式。与细菌耐药性密切相关的生物膜形成过程与受QS系统调控的生物发光、毒力因子合成等过程具有进化上的相关性,靶向QS干扰旨在降低毒力并抑制生物膜,但并不杀死细菌,故而与传统抗生素相比,它不会施加选择性压力,因此不太可能使细菌产生耐药性。近年来,鉴于天然产物具有安全、低毒和来源广泛的特点,将天然产物作为QSI已成为研究热点[5]。研究证明植物来源的天然产物中发挥抗QS系统活性的物质多为黄酮类化合物[6],而主产于四川、云南、贵州等地的石斛正含有多种黄酮类单体[7]。铁皮石斛和叠鞘石斛是主要的川产石斛品种,大力发展石斛种植基地是夹江县重要的乡村振兴战略,对石斛提取物功能活性的研究为进一步探索铁皮石斛和叠鞘石斛的市场价值提供实验基础和理论支撑。
1 材料与设备
1.1 材料
受试菌株人肠道沙门氏菌,成都医学院公共卫生学院实验中心保存;铁皮石斛干茎和叠鞘石斛干茎,夹江县秧花石斛种植专业合作社。
1.2 试剂
琼脂、LB肉汤培养基,北京索莱宝科技有限公司;甲醇、乙腈、甲酸,均为LC-MS级,上海麦克林生化科技股份有限公司。
泳动培养基(g/L):胰蛋白胨10,NaCl 5,琼脂5,葡萄糖5。
1.3 仪器
SW-CJ-1FD-Ⅱ超净工作台,苏州安泰空气技术有限公司;BPH-9082恒温培养箱,致微(厦门)仪器有限公司;WMLL-125B干热灭菌箱,上海龙跃仪器设备有限公司;1510多功能酶标仪,德国PerkinElmer公司;5415R高速冷冻离心机,安徽中科中佳科学仪器有限公司;SR3000系列高效液相色谱仪,安徽皖仪科技股份有限公司;SXIENTZ-WSQ全自动生长分析仪,宁波新芝生物科技有限公司。
2 实验方法
2.1 石斛提取物制备
根据课题组前期建立的方法[8]。将石斛和水按照料液比1∶10(g∶mL)进行溶解,100 ℃沸水回流2 h。取上清液于离心管中,10 000 r/min高速离心15 min。取上清液,90 r/min、50 ℃旋转蒸发仪旋转蒸发1 h。将所得物于干燥箱60 ℃烘干过夜。取烘干后物质冷冻干燥12 h,将所得物质置于干燥箱备用。
2.2 最小抑菌浓度(minimum inhibitory concentration,MIC)确定
制备菌悬液。挑取单菌落溶于生理盐水中,倍比稀释后至0.5麦氏浓度对照,选择此稀释度的菌悬液参与实验。制备实验组培养基。将提取物溶解于LB肉汤培养基中,用倍比稀释法制的质量浓度梯度为32、16、8、4、2、1、0 mg/mL的含石斛提取物的液体培养基,37 ℃培养24 h,测定波长为600 nm的吸光度值,以吸光度值骤降的浓度作为提取物的MIC,后续实验均在亚抑菌浓度下进行[9]。实验重复3次。
2.3 石斛提取物对沙门氏菌生长状况的影响
取活化的沙门氏菌,制备0.5个比浊单位的菌悬液,以1∶100的体积比接种于LB肉汤培养基中,添加亚抑菌浓度梯度的石斛提取物,取等量灭菌生理盐水加于等浓度梯度的含石斛提取物培养基中,作为消除色差组。置于全自动生长仪中37 ℃、160 r/min培养48 h,每隔2 h测定波长为600 nm的吸光度值,用实验组吸光度减去消除色差组吸光度作为最终结果[10]。实验重复3次。
2.4 石斛提取物对沙门氏菌群体运动的影响
向泳动培养基中加入经0.22 μm滤膜除菌的石斛提取物,使其终浓度为亚抑菌浓度梯度。充分混匀后倾倒平板,待平板冷却后向平板中央滴加2 μL沙门氏菌菌液,无菌风吹干,置于37 ℃恒温培养箱中培养24 h,观察并用游标卡尺测量迁移圈直径。比较迁移直径的大小[11]。实验重复3次。
2.5 石斛提取物对沙门氏菌生物膜的影响
配制2种石斛提取物浓度梯度的液体培养基,在96孔板的A1~E1中每孔加入100 μL培养基,再向E1中加入100 μL 16 mg/mL的石斛提取物的培养基,混匀。在E1中吸取100 μL培养基加入D1中,混匀。梯度稀释至B1,混匀后弃去100 μL培养基。向F1中加入100 μL 16 mg/mL的石斛提取物的液体培养基。每个浓度横向重复3个复孔。在A5~F8孔重复该步骤。在A1~F4孔中每孔加入10 μL OD600=0.1的菌液,A5~F8孔设置加生理盐水作为对照组。将96孔板置于37 ℃恒温培养箱中培养12 h,取出,弃去培养基,无菌水清洗3遍,甲醇固定,置于超净工作台中吹干。用结晶紫染液染色,静置15 min,无菌水清洗3遍,吹干。加入乙酸溶液溶解10 min,并将液体转移至另一96孔板中,测波长为590 nm的吸光度值[12]。实验重复3次。
2.6 提取物的HPLC分析
采用HPLC技术对2种石斛提取物的成分进行分析[13]。色谱柱:Waters ACQUITYUPLCBEH C18色谱柱(4.6 mm×250 mm,1.8 μm),流动相:0.1%甲酸水(A)-0.1%甲酸乙腈(B)。梯度洗脱程序:0~6 min,5%~25% B;6~20 min,25%~40% B;20~25 min,40%~50% B,25~30 min;50%~5% B;流速0.60 mL/min;柱温40 ℃;进样量1.0 μL;紫外分光检测器条件360 nm。
2.7 分子对接模拟
通过分子对接验证活性单体与靶点的结合情况。本研究使用的分子对接程序AutoDock Vina (Vina 1.1.2)是一款采用半灵活对接方式运行的程序,对接精度高达78%。LuxS蛋白的晶体结构为5V2W,从RCSB(https://www.pdb.org/)获得。小分子的结构文件来源于PubChem (https://pubchem.ncbi.nlm.nih.gov/)。将活性单体成分(mol.2格式)作为配体,LuxS蛋白(pdb格式)为小分子蛋白对接的受体。Autodock Tools 用于加氢,电荷检查,分配原子类型为AD4类型,计算gasteiger电荷,构建蛋白质结构的对接网格,并在Autodock Tools中指定配体中的可旋转键,使用Discovery Studio 4.5软件进行作用力分析和可视化图处理[10]。
2.8 数据统计分析
实验数据采用Origin 2022进行统计分析,采用SPSS 22.0进行差异显著性分析,数据结果表示为“平均值±标准偏差”,组间差异比较采用单因素方差分析,采用t检验,P<0.05具有差异。
3 结论与讨论
3.1 石斛提取物对沙门氏菌的MIC
测定2种石斛提取物的MIC,确定后续实验浓度在亚抑菌浓度梯度下进行,确保沙门氏菌的QS抑制效果不是由抑菌效果导致。由图1可知,铁皮石斛提取物对沙门氏菌的MIC为8 mg/mL。叠鞘石斛提取物的MIC为4 mg/mL。
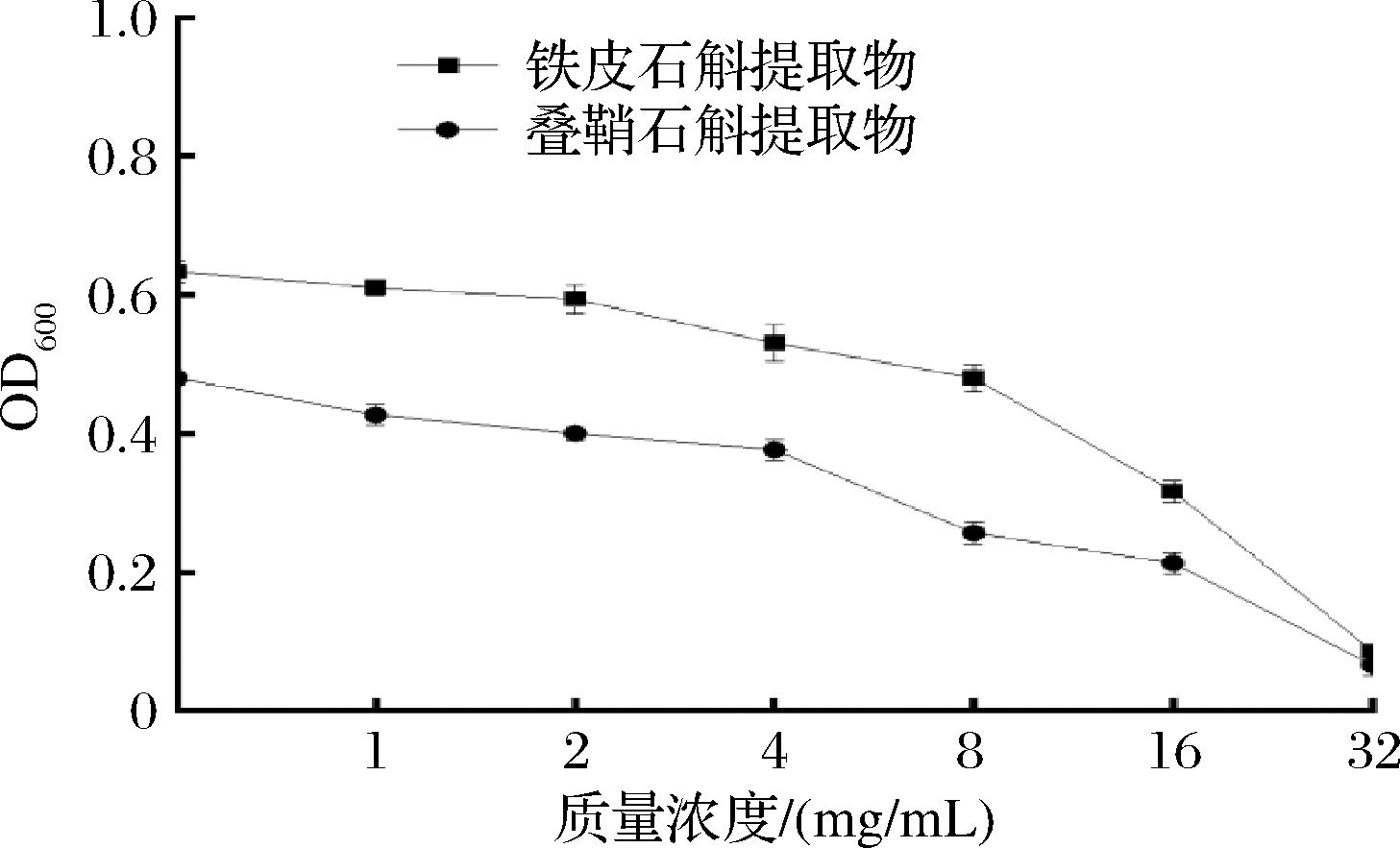
图1 两种石斛提取物对沙门氏菌的MIC
Fig.1 MIC of two Dendrobium extracts against Salmonella
3.2 石斛提取物对沙门氏菌生长状况的影响
生长曲线主要包括微生物生长的4个时期:迟缓期、对数期、稳定期和衰亡期。微生物在对数期的生长速度最大,在此期间内大量生长繁殖。通过对比添加组与未添加组的曲线一致情况,可得知添加物对沙门氏菌生长繁殖情况的影响程度。由图2可知,加入亚抑菌浓度的石斛提取物组和未加提取物组的生长曲线几乎完全重合,说明亚抑菌浓度下的石斛提取物对沙门氏菌的生长繁殖没有影响。
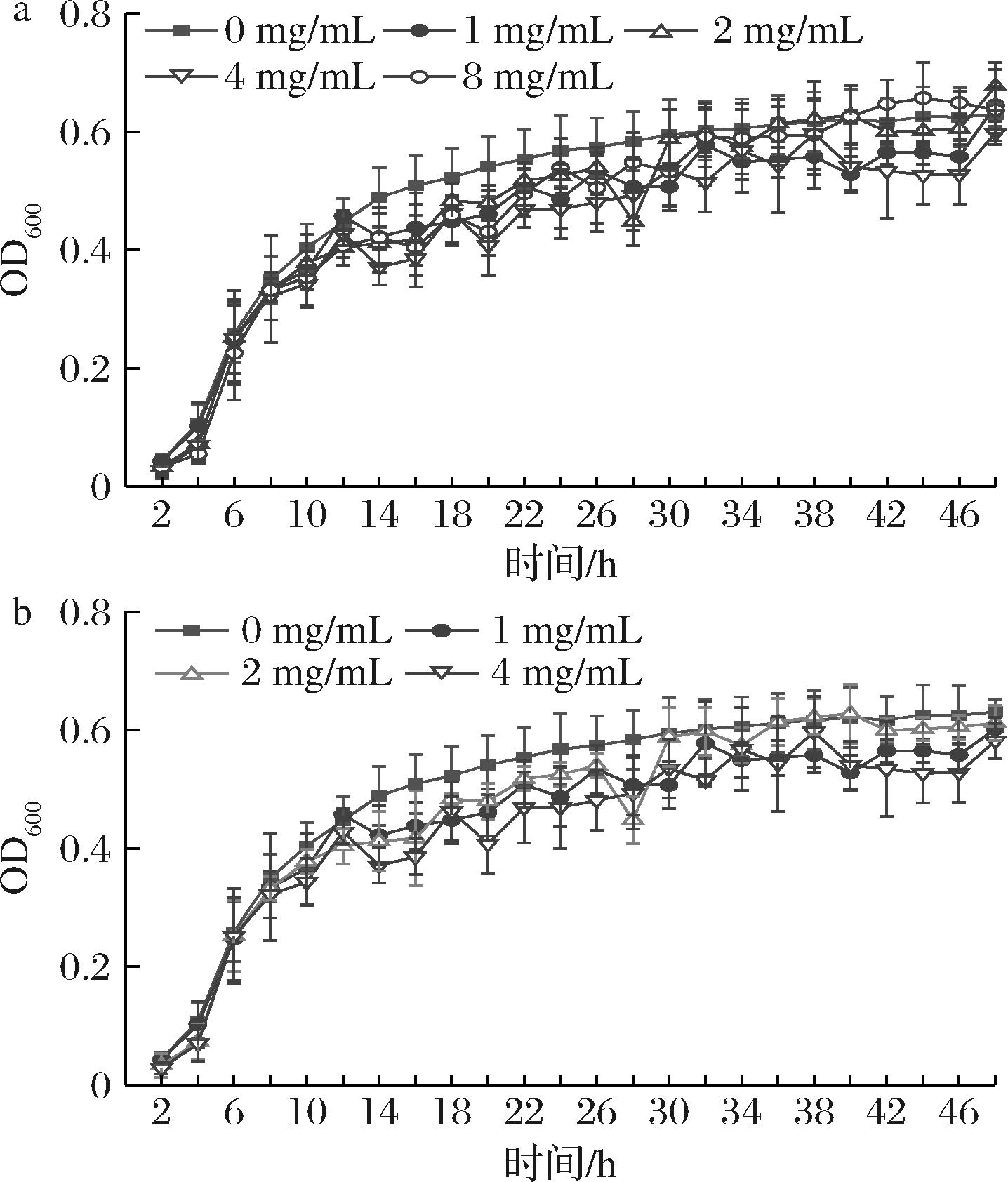
a-铁皮石斛提取物组;b-叠鞘石斛提取物组
图2 两种石斛提取物对沙门氏菌生长状况的影响
Fig.2 Effect of two Dendrobium extracts on the growth of Salmonella
3.3 石斛提取物对沙门氏菌运动能力的影响
泳动是细菌迁移的一种重要方式,是指细菌在琼脂含量<0.45%的培养基表面迁移。沙门氏菌的泳动能力可通过细菌在泳动平板上从接种点向四周扩散且迁移直径表征。细菌的泳动能力有利于细菌生物膜形成和细菌在宿主表面黏附聚集。如图3和图4所示,当加入石斛提取物后,细菌的迁移直径明显缩小,且呈现出剂量依赖性。由表1可知,当铁皮石斛提取物的质量浓度为8 mg/mL时,对沙门氏菌群集运动的抑制率为91.33%;当叠鞘石斛提取物的质量浓度为4 mg/mL时,对沙门氏菌群集运动的抑制能力达到了48.67%。实验过程中发现石斛提取物由于含有多糖,会随着浓度增高使培养基黏稠度变大,用0.22 μm滤膜过滤后可以消除多糖对实验结果的影响。
表1 两种石斛提取物对沙门氏菌群集运动的抑制能力
Table 1 Inhibition of the movement of Salmonella clusters by two Dendrobium extracts

项目铁皮石斛提取物质量浓度(mg/mL)叠鞘石斛提取物质量浓度(mg/mL)012480124直径/mm90.00±0.0089.33±1.1566.83±1.3316.20±0.367.80±0.3690.00±0.0090.00±0.0057.00±3.0046.20±0.79抑制率/%0.00 0.74 25.74 82.00 91.33 0.00 0.00 36.67 48.67
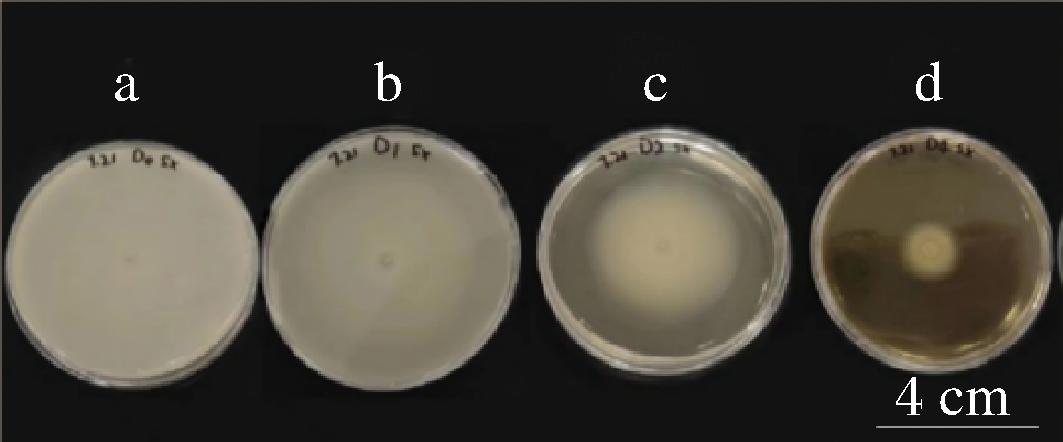
a-对照;b-1 mg/mL;c-2 mg/mL;d-4 mg/mL
图3 叠鞘石斛提取物对沙门氏菌群集运动的影响
Fig.3 Effect of Dendrobium denneanum Kerr extract onSalmonella cluster motility
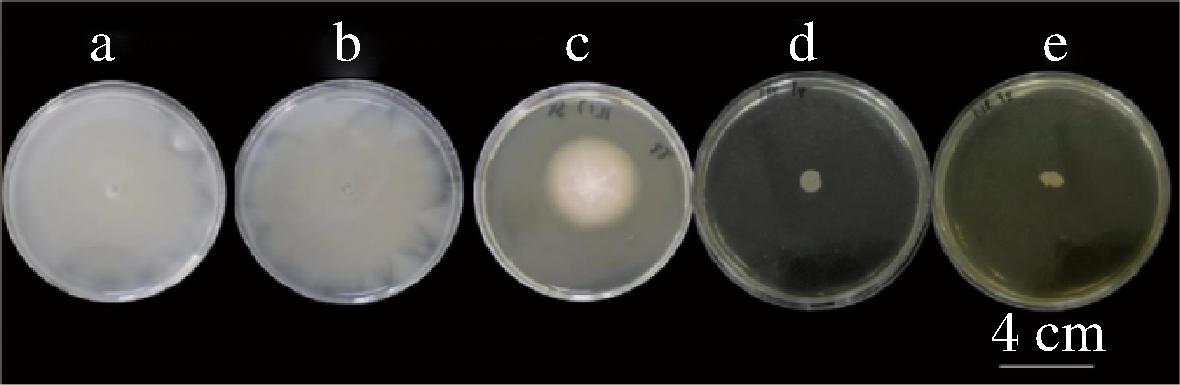
a-对照;b-1 mg/mL;c-2 mg/ mL;d-4 mg/mL;e-8 mg/mL
图4 铁皮石斛提取物对沙门氏菌群集运动的影响
Fig.4 Effect of Dendrobium officinale Kimura extract onSalmonella cluster motility
3.4 石斛提取物对沙门氏菌生物膜形成的影响
生物膜是细菌在生长过程中吸附于生长基质表面形成的一种包裹在细菌外面的生物被膜,由菌体和自身分泌的细胞外基质构成。生物膜形成有利于细菌生长及抗逆性产生。刘旭[14]的实验表明沙门氏菌生物膜的形成在该病原菌的传播和感染过程中发挥重要作用。由图5可知,2种石斛提取物均抑制沙门氏菌生物膜形成(P<0.01),并且生物膜生长率与石斛提取物浓度呈现负相关。
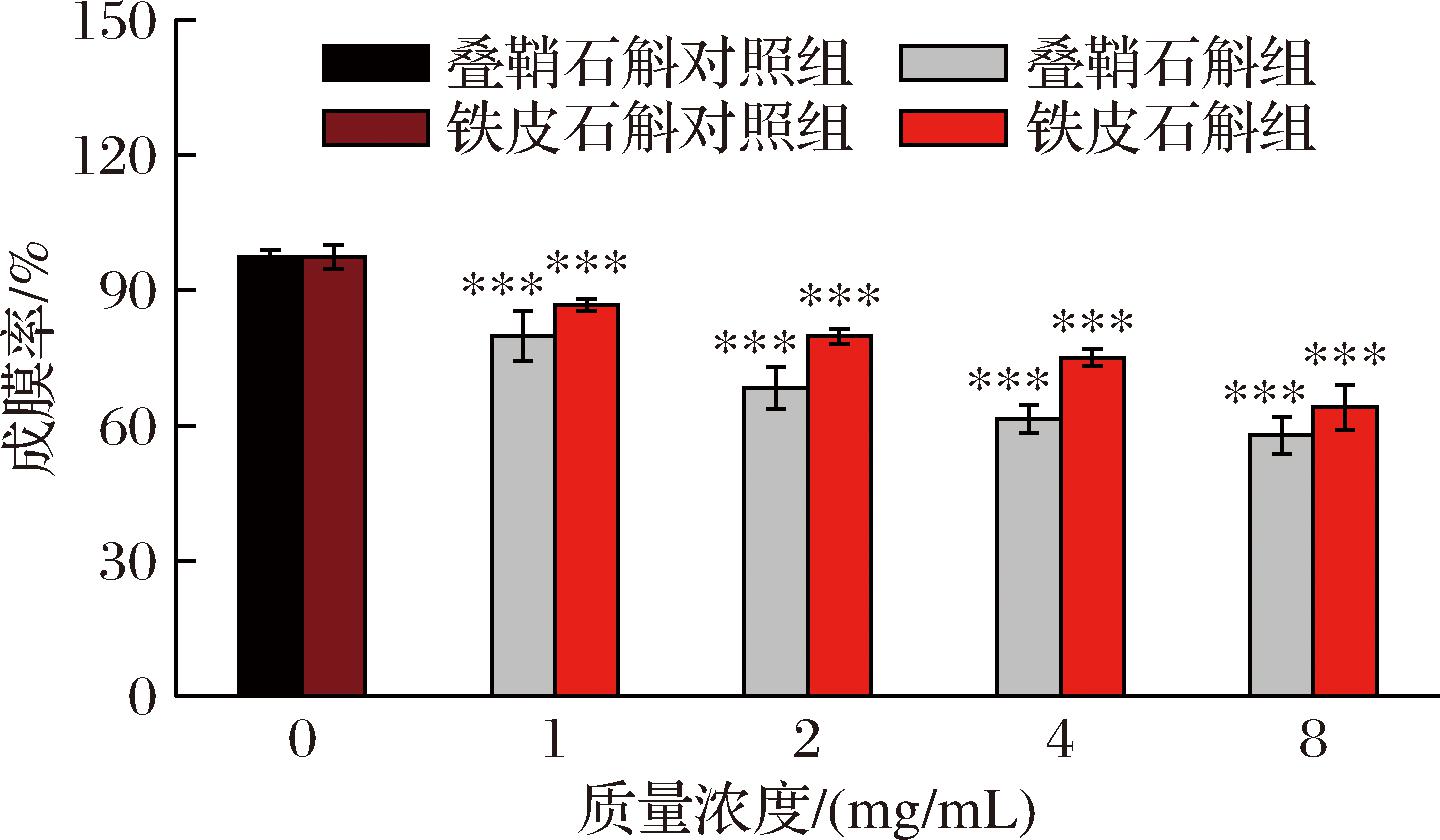
图5 两种石斛提取物对沙门氏菌生物膜生成率的影响
Fig.5 Effect of two Dendrobium extracts on the biofilm formation rate of Salmonella
注:与对照组相比,***表示P<0.01。
3.5 石斛提取物成分分析
植物提取物中的黄酮类[15]、多酚类、香豆素类、生物碱类等成分均存在抗菌活性[16],因其结构和组成差异发挥不同的QS抑制活性。图6和图7中结果表明,在石斛提取物中共鉴定出3种成分:异鼠李素,金丝桃苷,槲皮素。这些成分均具有抗菌、抗生物膜、抑制QS等多种作用[17]。
a-异鼠李素的出峰时间;b-金丝桃苷的出峰时间;c-槲皮素的出峰时间
图6 单体标准物质的出峰时间
Fig.6 Peak time of the monomer reference material
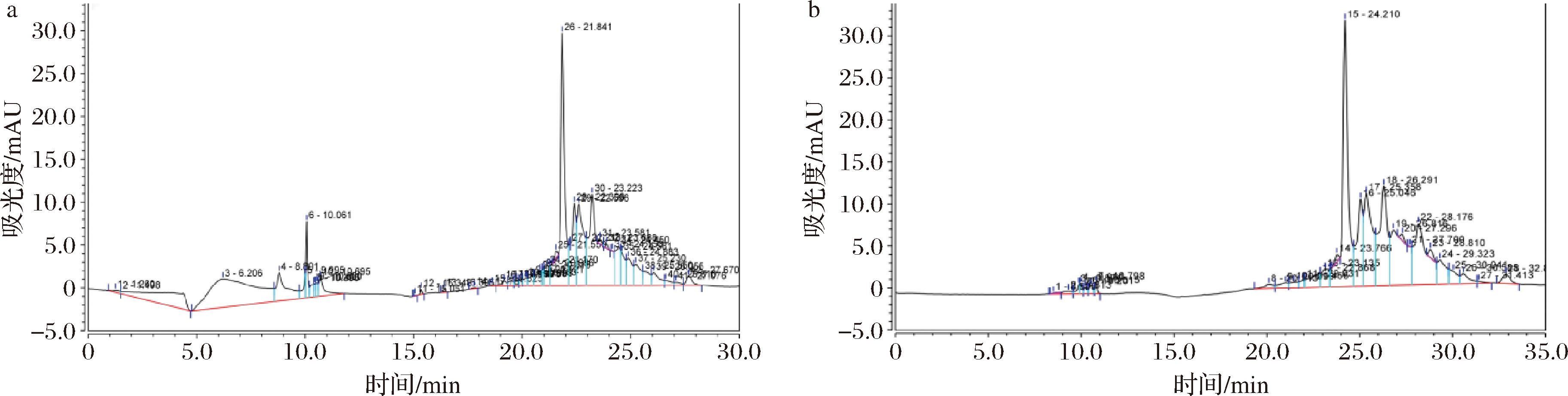
a-铁皮石斛提取物;b-叠鞘石斛提取物
图7 提取物的HPLC图
Fig.7 HPLC plot of two Dendrobium extracts
3.6 分子对接结果
据研究报道,异鼠李素、金丝桃苷、槲皮素等成分均具有QSI活性[18]。根据HPLC的结果,选择异鼠李素、金丝桃苷和槲皮素这3种成分进行分子模拟对接,分析石斛提取物发挥QSI活性的可能机制。结果显示,异鼠李素、金丝桃苷、槲皮素均能与LuxS受体蛋白结合,对接分数分别为-8、-9.1、-8,对应的结合能为-5.5、-2.57、-5.53 kJ/mol。结合能越小,说明对接能力越强[19]。异鼠李素与LuxS受体的Asn124之间形成氢键,金丝桃苷与Cys41、Ile142和Asp141之间形成了氢键,槲皮素与受体的Gln127和Leu123之间形成了氢键。分子对接结果如图8所示。

a-异鼠李素与LuxS蛋白对接;b-金丝桃苷与LuxS蛋白对接;c-槲皮素与LuxS蛋白对接
图8 分子对接结果
Fig.8 Molecular docking results
4 结论
通过生长曲线实验、泳动实验、生物膜实验可知石斛提取物具有明显抑制沙门氏菌群体行为的作用,且这种抑制作用具有统计学意义(P<0.05),说明石斛提取物可以对沙门氏菌的运动能力和耐药性造成明显影响。经HPLC分析表明,铁皮石斛提取物和叠鞘石斛提取物均含有异鼠李素、金丝桃苷和槲皮素这3种单体成分,分子对接结果表明,石斛提取物的活性单体成分均可与LuxS蛋白进行结合,提示石斛提取物可以通过与信号分子竞争沙门氏菌的QS系统受体蛋白来抑制沙门氏菌致病基因表达从而达到抑制细菌运动能力和抗性的作用。
通过以上实验,本研究发现石斛提取物对沙门氏菌的QS系统可以产生影响,其作用机制可能是通过抑制沙门氏菌的QS系统受体蛋白来抑制沙门氏菌致病基因表达,从而达到抑制沙门氏菌致病侵袭能力的效果。本研究可为铁皮石斛和叠鞘石斛的功效开发以及沙门氏菌的新型抑菌剂开发提供研究方向。
[1] SMITH D, WANG J H, SWATTON J E, et al.Variations on a theme:Diverse N-acyl homoserine lactone-mediated quorum sensing mechanisms in gram-negative bacteria[J].Science Progress, 2006, 89(Pt 3-4):167-211.
[2] 戴鹏, 杨溢, 赵亚荣, 等.沙门氏菌群体感应系统研究进展[J].生物加工过程, 2019, 17(3):257-263;323.DAI P, YANG Y, ZHAO Y R, et al.Research progress in quorum sensing system in Salmonella[J].Chinese Journal of Bioprocess Engineering, 2019, 17(3):257-263;323.
[3] FUQUA W C, WINANS S C, GREENBERG E P.Quorum sensing in bacteria:The LuxR-LuxI family of cell density-responsive transcriptional regulators[J].Journal of Bacteriology, 1994, 176(2):269-275.
[4] LADE H, PAUL D, KWEON J H.Quorum quenching mediated approaches for control of membrane biofouling[J].International Journal of Biological Sciences, 2014, 10(5):550-565.
[5] 孟凡颖, 杨敏, 顾雯, 等.天然产物中细菌群体感应抑制剂虚拟筛选研究进展[J].中国现代应用药学, 2022, 39(5):695-704.MENG F Y, YANG M, GU W, et al.Research progress on virtual screening of bacterial quorum sensing inhibitors in natural products[J].Chinese Journal of Modern Applied Pharmacy, 2022, 39(5):695-704.
[6] 曾利, 蔡杨, 凌保东.中药单体对细菌群体感应系统的影响[J].中国药理学与毒理学杂志, 2021, 35(10):754.ZENG L, CAI Y, LING B D.Effects of traditional Chinese medicine monomers on quorum sensing system of bacteria [J].Chinese Journal of Pharmacology and Toxicology, 2021, 35(10):754.
[7] 刘卉丹.铁皮石斛挥发性成分的提取与抑菌效果研究[D].长沙:湖南农业大学, 2017.LIU H D.Study on extracting and bacteriostatic effects of volatile composition of Dendrobium officinale [D].Changsha:Hunan Agricultural University, 2017.
[8] 张薇薇, 邓晓东, 张在强, 等.叠鞘石斛水提取物对小肠结肠炎耶尔森菌的抗菌活性及机制研究[J].现代预防医学, 2016, 43(10):1 852-1854;1883.ZHANG W W, DENG X D, ZHANG Z Q, et al.Studies on the antibacterial activity and mechanism of the water extracts from Dendrobium denneanum on Yersinia enterocolitica[J].Modern Preventive Medicine, 2016, 43(10):1 852-1854;1883.
[9] 黄靖.群体感应抑制剂筛选及冬凌草甲素对铜绿假单胞菌QSI活性研究[D].广州:广东药科大学, 2018.HUANG J.Screening of quorum sensing inhibitors and study on QSI activity of oridonin in Pseudomonas aeruginosa [D].Guangzhou:Guangdong Pharmaceutical University, 2018.
[10] 许腾腾, 赵慧娟, 刘尊英.连翘提取物对嗜水气单胞菌群体感应系统的影响[J].微生物学通报, 2022, 49(1):256-269.XU T T, ZHAO H J, LIU Z Y.Effect of Forsythia suspensa extract on quorum sensing system of Aeromonas hydrophila[J].Microbiology China, 2022, 49(1):256-269.
[11] GENG Y F, YANG C, ZHANG Y, et al.An innovative role for luteolin as a natural quorum sensing inhibitor in Pseudomonas aeruginosa[J].Life Sciences, 2021, 274:119325.
[12] TOPA S H, PALOMBO E A, KINGSHOTT P, et al.Activity of cinnamaldehyde on quorum sensing and biofilm susceptibility to antibiotics in Pseudomonas aeruginosa[J].Microorganisms, 2020, 8(3):455.
[13] 张巧月, 刘艳艳, 万昶宸, 等.HPLC-ESI-MS/MS法测定连翘心中的8种化学成分[J].中草药, 2017, 48(1):192-196.ZHANG Q Y, LIU Y Y, WAN C C, et al.Simultaneous quantification of eight constituents in the seed of Forsythia suspense(Thunb.) Vahl by HPLC-MS/MS method[J].Chinese Traditional and Herbal Drugs, 2017, 48(1):192-196.
[14] 刘旭.沙门氏菌毒力基因谱及生物膜形成能力研究[D].济南:齐鲁工业大学, 2023.LIU X.Studies on virulence gene profile and biofilm forming ability of Salmonella [D].Jinan:Qilu University of Technology, 2023.
[15] 吕朝耕, 杨健, 康传志, 等.铁皮石斛中10种黄酮类成分UPLC-MS/MS测定与多糖组成含量分析[J].中国实验方剂学杂志, 2017, 23(17):47-52.LYU C G, YANG J, KANG C Z, et al.Determination of 10 flavonoids by UPLC-MS/MS and analysis of polysaccharide contents and compositions in dendrobii officinalis caulis from different habitats[J].Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(17):47-52.
[16] 张雪琴, 赵庭梅, 刘静, 等.石斛化学成分及药理作用研究进展[J].中草药, 2018, 49(13):3174-3182.ZHANG X Q, ZHAO T M, LIU J, et al.Advances in chemical compounds and pharmacological effects of Dendrobii Caulis[J].Chinese Traditional and Herbal Drugs, 2018, 49(13):3174-3182.
[17] 王治丹, 代云飞, 罗尚娟, 等.铁皮石斛化学成分及药理作用的研究进展[J].华西药学杂志, 2022, 37(4):472-476.WANG Z D, DAI Y F, LUO S J, et al.Research progress on chemical constituents and pharmacological effects of Dendrobium officinale[J].West China Journal of Pharmaceutical Sciences, 2022, 37(4):472-476.
[18] 余展鹏, 彭亮.天然药物单体对肠杆菌科细菌的抗菌作用及其机制的研究进展[J].现代药物与临床, 2021, 36(2):403-407.YU Z P, PENG L.Research progress on antibacterial effect and its mechanism of natural drug active components against Enterobacteriaceae[J].Drugs &Clinic, 2021, 36(2):403-407.
[19] 徐子恒.基于LuxS/AI-2型QS系统的鸡白痢沙门氏菌多重耐药机制研究及QS抑制剂甘草酸的抗菌增敏作用[D].南宁:广西大学, 2022.XU Z H.Exploration of the amr mechanism of Salmonella pollorum based on qs system mediated by the LuxS/AI-2 and the antibacterial and sensitizing effects of the QS inhibitor glycyrrhizic acid[D].Nanning:Guangxi University, 2022.