交城骏枣(Ziziphus jujuba Mill.)是山西四大名枣之一,被誉为“枣后”,主要分布于黄土高原大陆性气候的山西省吕梁市交城县[1]。其形态独特,呈瓶形或上细下粗的圆柱形,色泽深红,皮薄肉厚,核小果大,脆甜味香,果肉质量占总质量的95%以上,味甜质脆,生食制干均优[2]。研究表明,交城骏枣中富含氨基酸、维生素、矿物质、多酚、黄酮等营养成分[3],具有极高的营养价值和药用价值[4],有大量文献报道其具有抗炎症、抗氧化[5]、抗肿瘤、提高免疫力[6]等功效。
现阶段对于发酵红枣的研究主要集中于发酵枣酒、枣醋等,卜智斌等[7]对骏枣果醋发酵过程中营养品质变化及风味成分进行分析,发现36~72 h为发酵产酸的主要时期。李智邦[8]对嗜酸乳杆菌发酵红枣饮料加工工艺及品质变化进行研究,找到了最佳加工工艺。邹波等[9]通过不同酿酒酵母对骏枣果酒发酵的特性进行分析,为骏枣果酒的研究提供了理论基础。徐铭阳等[10]对红枣汁发酵的植物乳植杆菌进行筛选及其发酵特性分析,找到了发酵枣汁的最佳植物乳植杆菌菌株。王彤等[11]对单一菌种嗜酸乳杆菌发酵枣汁进行了代谢组学研究。虽然研究人员对发酵红枣开展了一系列的研究,然而目前对不同菌种发酵枣汁中的差异代谢物的相关研究报道还较少。本研究主要以交城骏枣为原料,经过不同菌株发酵的骏枣汁为研究对象,通过植物乳植杆菌(Lactiplantibacillus plantarum)、嗜酸乳杆菌(Lactobacillus acidophilus)以及两种菌联用协同发酵骏枣汁,探究不同菌种发酵骏枣汁中主要差异代谢物,分析了主要差异代谢物富集代谢通路,以期为功能性红枣汁的开发和应用提供思路。
1 材料与方法
1.1 材料与仪器
红枣(Ziziphus jujuba Mill.),山西天滋实业有限公司提供的交城骏枣;植物乳植杆菌(1.5×1012 CFU/g)、嗜酸乳杆菌(1.5×1012 CFU/g),亿菌生物科技有限公司;2-氯-L-苯丙氨酸(分析纯),天津市凯通化学试剂有限公司;乙腈(色谱纯),美国Thermo Fisher Scientific公司;甲酸(色谱纯),日本TCI公司;甲酸铵(色谱纯),美国Sigma公司;BE-2600滤膜,天津津腾科技有限公司。
5305真空浓缩仪,德国Eppendorf公司;TGL-16GB高速台式离心机,金坛市大地自动化仪器厂;Vanquish液相色谱仪、Q Exactive Focus质谱仪,美国Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 不同菌种发酵骏枣汁的制备
称取清洗去核后的骏枣100 g,加入一定量水,持续熬煮,熬制过程检测糖度至20 °Brix,熬煮结束,过滤残渣,用糖度仪精确测得其可溶性固形物为20 °Brix,冷却得到骏枣原液[12]。取10 mL骏枣原液,分别接种植物乳植杆菌、嗜酸乳杆菌以及两菌协同联用发酵剂(植物乳植杆菌∶嗜酸乳杆菌=1∶1),接种量为0.5%(体积分数),置于37 ℃发酵罐中培养时间76 h[13],得到红枣发酵待测液。
1.2.2 骏枣汁代谢物提取
将实验样本在4 ℃条件下解冻,解冻后样本涡旋1 min,混合均匀后,经真空冷冻干燥;加入500 μL甲醇溶液(-20 ℃保存)到干燥后的样本管中,涡旋1 min;2 000 r/min 4 ℃离心10 min,取全部上清液转移至新的2 mL离心管中,浓缩干燥[14];准确加入150 μL 体积分数80%的甲醇水溶液配制的2-氯-L-苯丙氨酸(0.4 mg/mg)溶液(-20 ℃保存)复溶样品[15],提取表层液过0.22 μm膜,处理液加入到专用检测瓶,待测。
1.2.3 色谱条件
1.2.3.1 超高效液相色谱(ultra performance liquid chromatography,UPLC)条件
色谱柱:ACQUITY UPLC® HSS T3(2.1 mm× 150 mm, 1.8 μm);柱温40 ℃;流速0.25 mL/min;进样量2 μL;正离子模式:流动相为含0.1%甲酸的乙腈溶液(C)和含0.1%甲酸的水溶液(D),梯度洗脱程序为:0~1 min,2% C;1~9 min,2%~50% C;9~12 min,50%~98% C;12~13.5 min,98% C;13.5~14 min,98%~2% C;14~20 min,2% C;负离子模式:流动相为乙腈(A)和5 mmol/L 甲酸铵水(B),梯度洗脱程序:0~1 min,2% A;1~9 min,2%~50% A;9~12 min,50%~98% A;12~13.5 min,98% A;13.5~14 min,98%~2% A;14~17 min,2% A[16]。
1.2.3.2 MS条件
电喷雾离子源;正离子喷雾电压3.50 kV;负离子喷雾电压-2.50 kV;鞘气30 arb;辅助气10 arb;毛细管温度325 ℃;一级分辨率70 000;二级分辨率为17 500;扫描范围 m/z 81~1 000,并采用高能碰撞解离进行二级裂解;碰撞电压为30%[17]。
1.3 数据处理
通过Proteowizard软件包(V3.0.8789)中MSConvert工具将原始质谱下机文件转换为mzXML文件格式[18]。采用R XCMS软件包进行峰检测、峰过滤、峰对齐处理,得到物质定量列表,采用公共数据库及自建物质库进行物质的鉴定,基于质控QC样本(每个待测样本中取相同体积提取液协同联用而成)的本地散点平滑估计(locally estimated scatterplot smoothing, LOESS)信号校正方法实现数据矫正,消除系统误差。数据质控中过滤掉样本QC中相对标准偏差>30%的物质[19]。采用R软件包分别对样本数据进行正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)降维分析。根据统计检验计算P值、OPLS-DA降维方法计算变量投影重要度(variable importance in projection, VIP)、fold change计算组件差异倍数,衡量各代谢物组分含量对样本分类判别的影响强度和解释能力,辅助标志代谢物的筛选[20]。当P值<0.05和VIP值>1时,认为代谢物分子具有统计学意义,得出主要差异代谢物。采用MetaboAnalyst软件包对筛选差异代谢分子进行功能通路富集和拓扑学分析,富集得到的通路采用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)数据库进行差异代谢物与通路图的浏览。
2 结果与分析
2.1 植物乳植杆菌发酵骏枣汁与原汁的差异代谢物
经UPLC-MS检测,植物乳植杆菌发酵骏枣汁与原汁共有193种差异代谢物,植物乳植杆菌发酵骏枣汁中含量增加的差异代谢物144种,含量降低的差异代谢物49种。在193种差异代谢物成分中,差异倍数较大的是有机酸类、有机碱类、酚类、糖类4种类别,分别占比为37.31%、15.03%、11.40%、7.25%。
由图1可知,植物乳植杆菌发酵骏枣汁与骏枣原汁最显著的差异代谢物为4-香豆醇、D-木糖醇、马来酰胺酸、葡萄糖酸内酯、4-甲基氨基丁酸。香豆醇在植物中具有抗菌、抗炎和抗氧化作用[21]。马来酰胺酸起到抗氧化剂的作用[22],可清除自由基、抑制炎症反应和降低氧化应激水平[23],这些抗氧化作用对预防和治疗某些慢性疾病(如心血管疾病、糖尿病和癌症等)具有潜在益处[24]。香豆醇和马来酰胺酸在植物乳植杆菌发酵后的骏枣汁中相对含量显著高于骏枣原汁,说明经过植物乳植杆菌的发酵,骏枣汁中香豆醇和马来酰胺酸含量增加,植物乳植杆菌发酵的骏枣汁抗氧化活性有所增加,但具体的增加机制尚不清楚,仍需进一步研究探讨。木糖醇的甜度与蔗糖相当[25],其代谢不受胰岛素调节,在人体内代谢完全时热值仅为10.04 kJ/g[26]。葡萄糖酸内酯在食品工业中是一种多功能食品添加剂[27]。4-甲基氨基丁酸是一种抑制性神经递质,能够调节神经系统的兴奋性,缓解压力和焦虑等情绪[28]。D-木糖醇和4-甲基氨基丁酸的相对含量在植物乳植杆菌发酵枣汁后有所下降,主要由于植物乳植杆菌在发酵过程中产生的化学反应使这三种物质分解或转化成其他物质[29],D-木糖醇是天然的甜味剂[30],其含量降低可能会影响发酵枣汁的甜味和酸味,4-甲基氨基丁酸是一种重要的生物活性物质,其含量降低会影响发酵枣汁的功能。
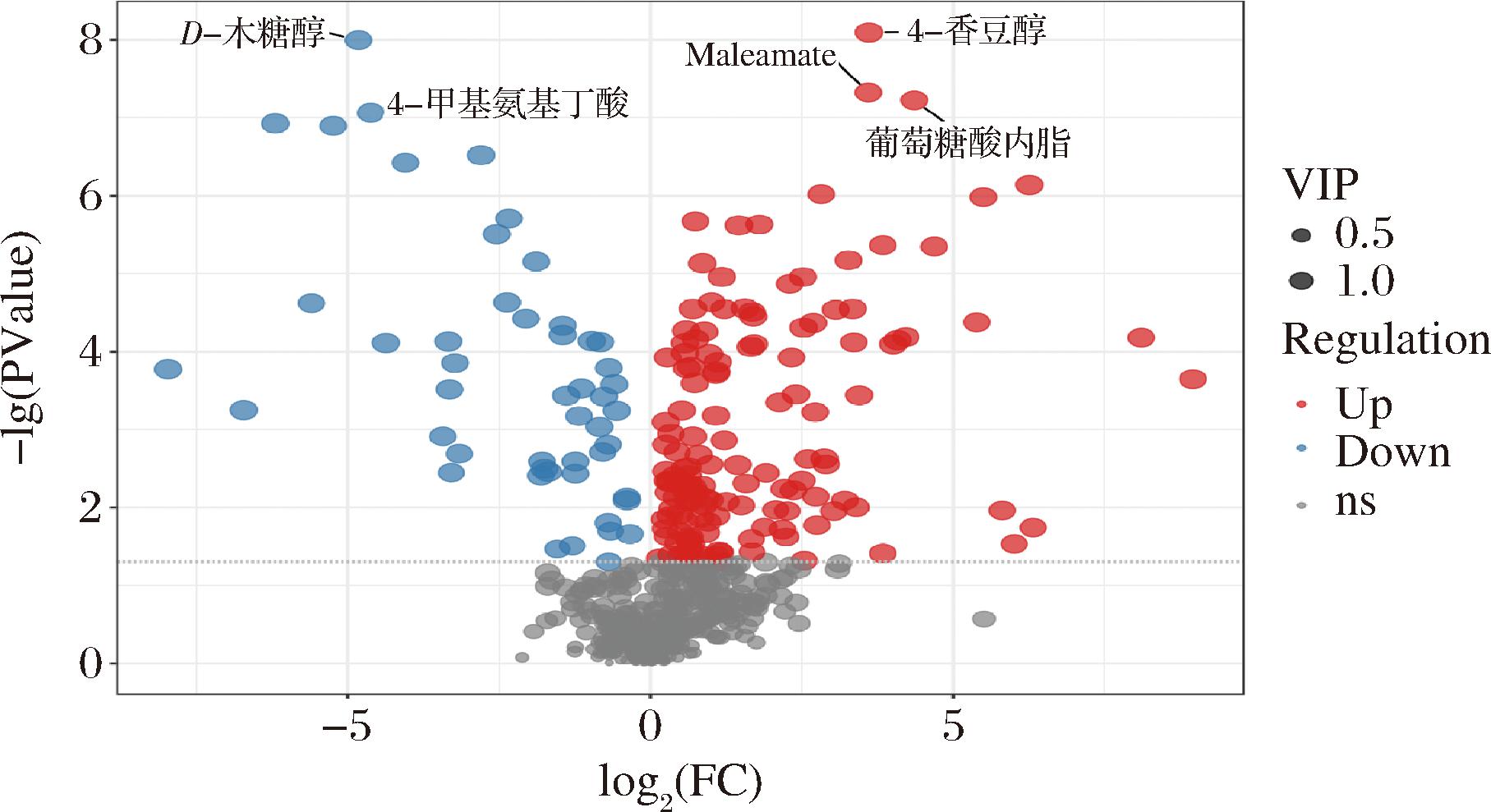
图1 植物乳植杆菌发酵骏枣汁和原汁差异代谢物火山图
Fig.1 Volcano plot of differential metabolites in fermented jujube juice by L. plantarum
注:Up表示在发酵骏枣汁中含量高,Down表示在原骏枣汁中含量高(下同)。
枣汁的发酵是复杂的代谢过程,由图2可知,植物乳植杆菌发酵骏枣汁和原汁的差异代谢物主要富集在20条代谢通路上,枣汁通过植物乳植杆菌发酵差异代谢物含量增加数目最多,且差异显著的代谢通路为酪氨酸代谢通路、苯丙素生物合成代谢通路、ABC转运蛋白代谢通路,大部分代谢物均会参与上述3种代谢途径。
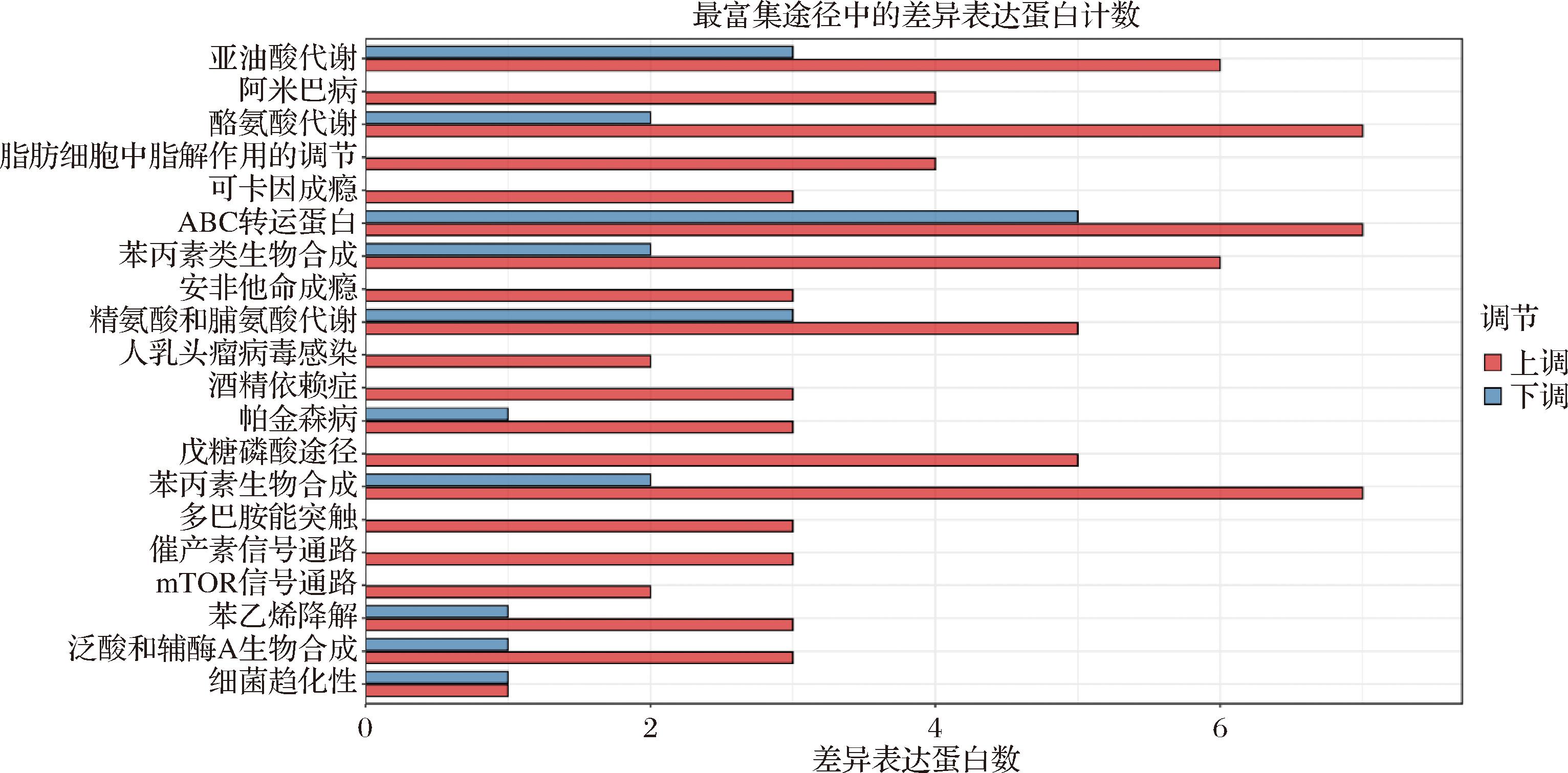
图2 植物乳植杆菌发酵骏枣汁和原汁差异代谢物富集代谢通路统计图
Fig.2 Differential metabolites enrichment metabolic pathways in fermented jujube juice by L. plantarum compared to jujube juice
酪氨酸代谢通路是生物体内的一种重要代谢过程,主要涉及到酪氨酸的分解与合成[31],酪氨酸首先通过酶的作用被氧化成多巴胺,然后再进一步被氧化成乙酰乙酸等物质[32]。在植物乳植杆菌发酵枣汁过程中,通过分泌酶类等物质,激活了酪氨酸酶参与酪氨酸代谢酶的活性[33],从而促进酪氨酸的分解与合成,导致枣汁中酪氨酸代谢产物的含量发生变化,进而影响枣汁的风味和营养价值。苯丙素生物合成代谢通路是植物体内的一类重要代谢途径[34],涉及到苯丙氨酸的合成及多种苯丙素化合物的生物合成。植物乳植杆菌发酵枣汁能够促进苯丙氨酸及苯丙素化合物的合成,导致枣汁中苯丙氨酸、香豆素含量增加[35],其中香豆素是一种具有抗菌、抗炎等生物活性的苯丙素化合物,影响枣汁的营养价值。ABC转运蛋白是一类跨膜运输蛋白[36],它们利用ATP水解所释放的能量来驱动各种底物,包括离子、氨基酸、核苷酸、多肽和较大的蛋白质,促使其从细胞的一侧移动到另一侧[37]。植物乳植杆菌发酵枣汁通过影响ABC转运蛋白的表达和活性,影响枣汁中多酚、黄酮等物质的运输和积累,同时植物乳植杆菌本身产生的一些代谢产物,如乳酸、乙酸等,也影响ABC转运蛋白的表达或活性,综合作用影响了枣汁的口感和营养价值。
2.2 嗜酸乳杆菌发酵骏枣汁与原汁的差异代谢物
嗜酸乳杆菌发酵骏枣汁与原汁的差异代谢物共206种,其中嗜酸乳杆菌发酵后含量增加的差异代谢物164种,含量降低的差异代谢物42种。在206种差异代谢物成分中,差异倍数较大的是有机酸类、氨基酸类、糖类、酚类、核苷类5种类别,分别占比为29.61%、11.17%、9.71%、8.74%、6.80%。
由图3可知,嗜酸乳杆菌发酵骏枣汁与骏枣原汁最显著的差异代谢物为壬烷、4-香豆醇、葡萄糖酸内酯、马来酰胺酸、核糖-1,5-二磷酸。其中,4-香豆醇、葡萄糖酸内酯和马来酰胺酸与植物乳植杆菌发酵骏枣汁和原汁最显著的差异代谢物一致,不同的是这5种差异代谢物均为嗜酸乳杆菌发酵后含量增加的代谢物。壬烷是生物体内脂肪酸代谢的产物之一,在人体内脂肪酸经过β-氧化产生能量时,会产生壬烷及其他多种酮体,这些酮体是重要的能量来源[38]。核糖-1,5-二磷酸光合作用中卡尔文循环的一个关键中间产物[39]。在发酵枣汁的过程中,嗜酸乳杆菌会利用枣汁中的糖分进行代谢,产生乳酸和其他有机酸[40],从而降低产品的pH值,赋予产品独特的酸味和风味。
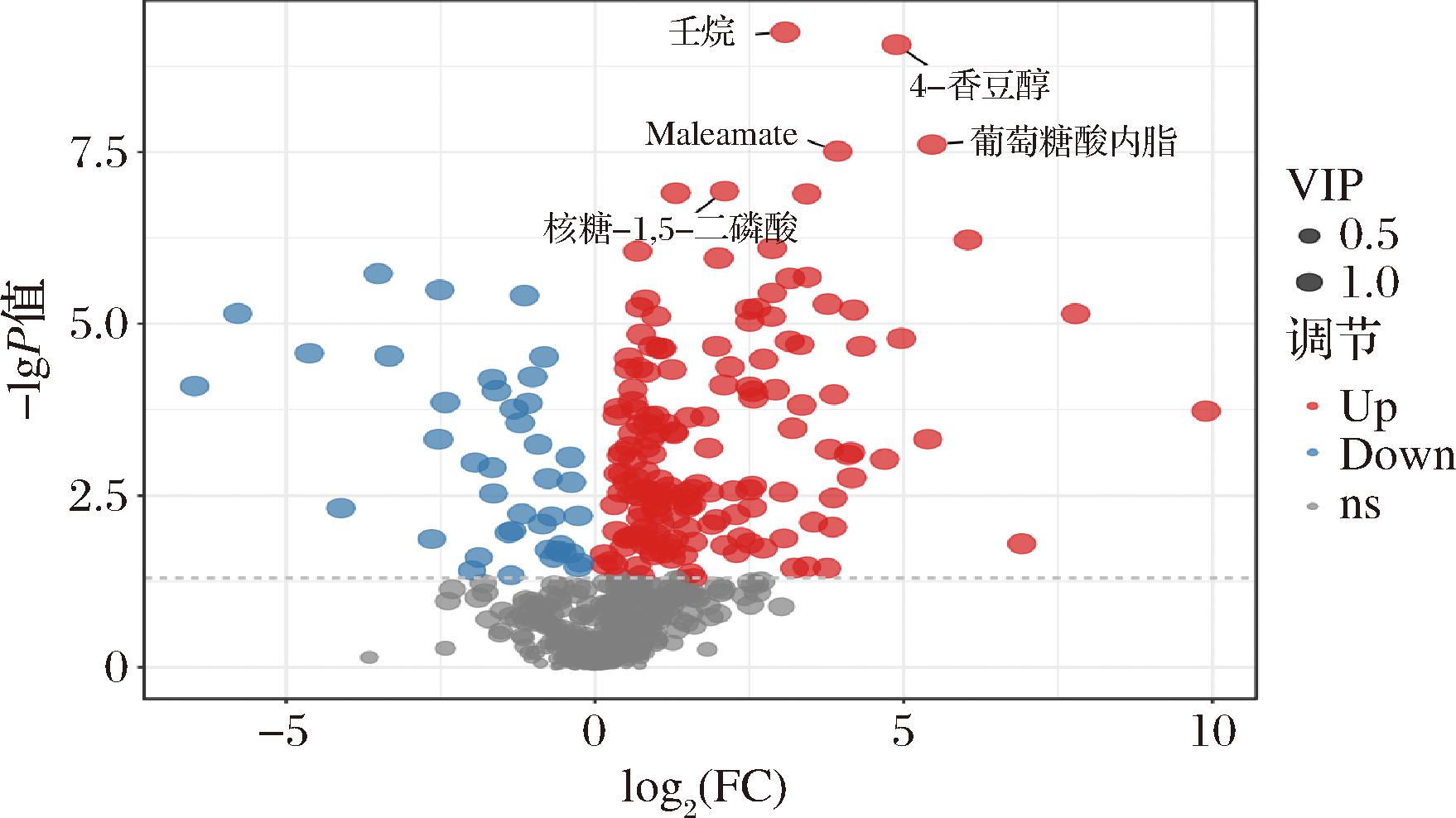
图3 嗜酸乳杆菌发酵骏枣汁和原汁差异代谢物火山图
Fig.3 Volcano plot of differential metabolites in fermented jujube juice by L. aciolophilus
由图4可知,嗜酸乳杆菌发酵骏枣汁和原汁的差异代谢物主要富集在20条代谢通路上,枣汁通过嗜酸乳杆菌发酵差异代谢物含量增加数目最多,且差异显著的代谢通路为ABC转运蛋白代谢通路、苯丙素生物合成代谢通路、苯丙素类生物合成代谢通路,大部分代谢物均会参与上述3种代谢途径。与植物乳植杆菌发酵枣汁相同的是,嗜酸乳杆菌发酵枣汁也可以通过影响ABC转运蛋白的表达或活性,影响枣汁中多酚、黄酮等酚类物质的运输和积累,影响枣汁的风味和营养价值。苯丙素生物合成代谢通路和苯丙素类生物合成代谢通路都是植物体内重要的次生代谢途径,这两条通路的主要产物是苯丙烷类化合物[41],如某些酚类化合物、香豆素等,这些苯丙烷类化合物具有抗氧化、抗炎、抗菌等活性[42],枣汁通过嗜酸乳杆菌的发酵,其生物活性得到了一定提升。
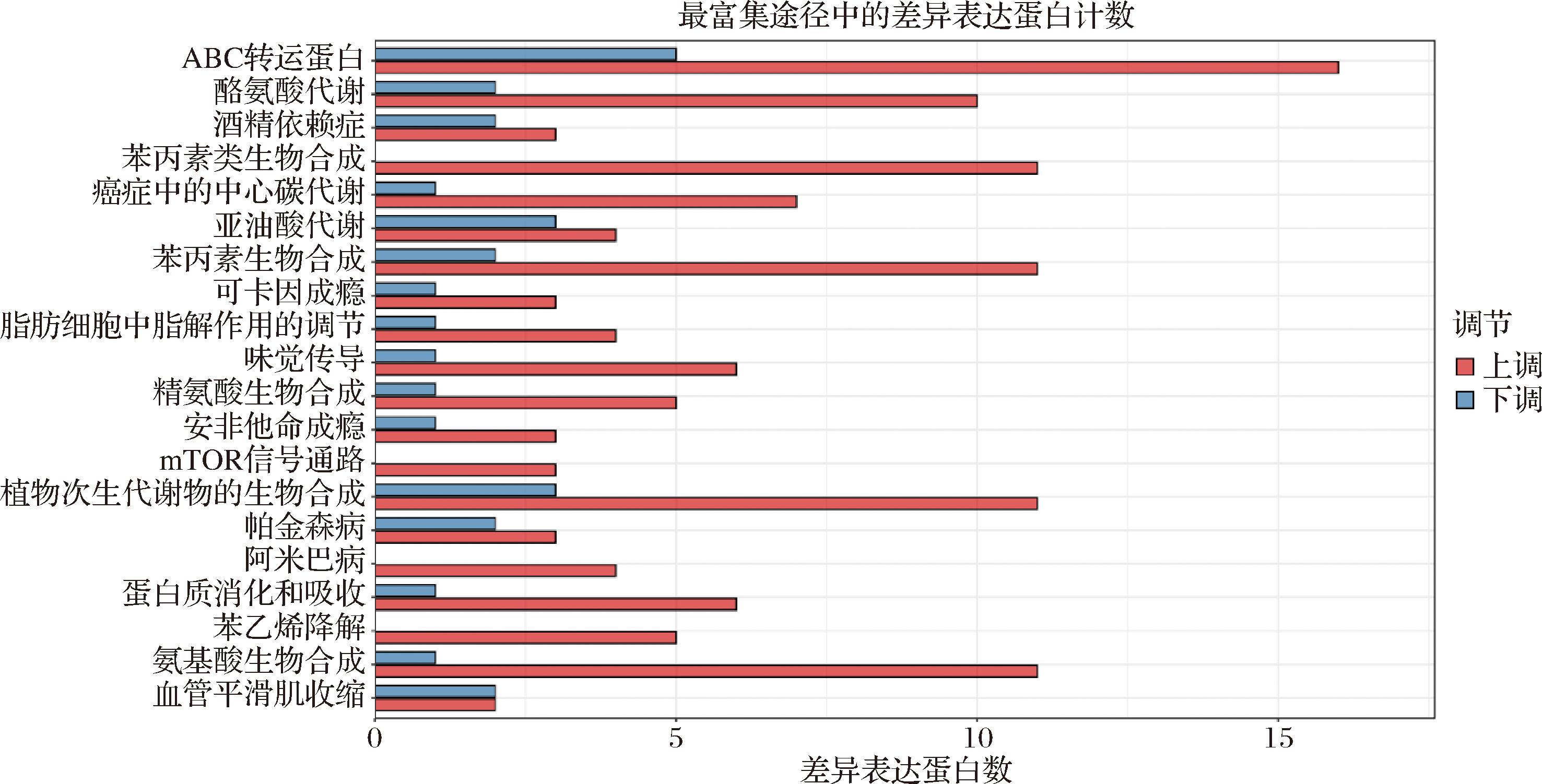
图4 嗜酸乳杆菌发酵骏枣汁和原汁差异代谢物富集代谢通路统计图
Fig.4 Differential metabolites enrichment metabolic pathways in fermented jujube juice by L. aciolophilus compared to jujube juice
2.3 协同联用菌株发酵骏枣汁的差异代谢物
协同联用菌株发酵骏枣汁与原汁的差异代谢物共有205种,其中协同联用菌株发酵后含量增加的差异代谢物152种,含量降低的差异代谢物53种。在205种差异代谢物成分中,差异倍数较大的是有机酸类、糖类、氨基酸类、酚类、有机碱类、核苷类6种类别,分别占比为33.17%、10.73%、9.76%、7.80%、6.34%、6.34%。
由图5可知,协同联用菌株发酵骏枣汁与骏枣原汁最显著的差异代谢物为D-木糖醇、葡萄糖酸内酯、壬烷、4-香豆醇、腺苷酸。其中,壬烷、4-香豆醇和葡萄糖酸内酯与两种单菌发酵枣汁和原汁最显著差异代谢物相同,D-木糖醇与植物乳植杆菌发酵骏枣汁和原汁的最显著差异代谢物相同,而且也是经过发酵后含量有所下降的差异代谢物,其余4种显著差异代谢物均为协同联用菌株发酵后与原汁相比含量增加的差异代谢物。壬烷是一种有机化合物,在生物体内可以被代谢和转化。长期接触高浓度的壬烷可能会对人体健康产生不利影响[38],协同联用菌株发酵骏枣汁与原汁中的壬烷相对含量均小于1×109,含量低于多数差异代谢物,对于人体来讲是健康安全的。
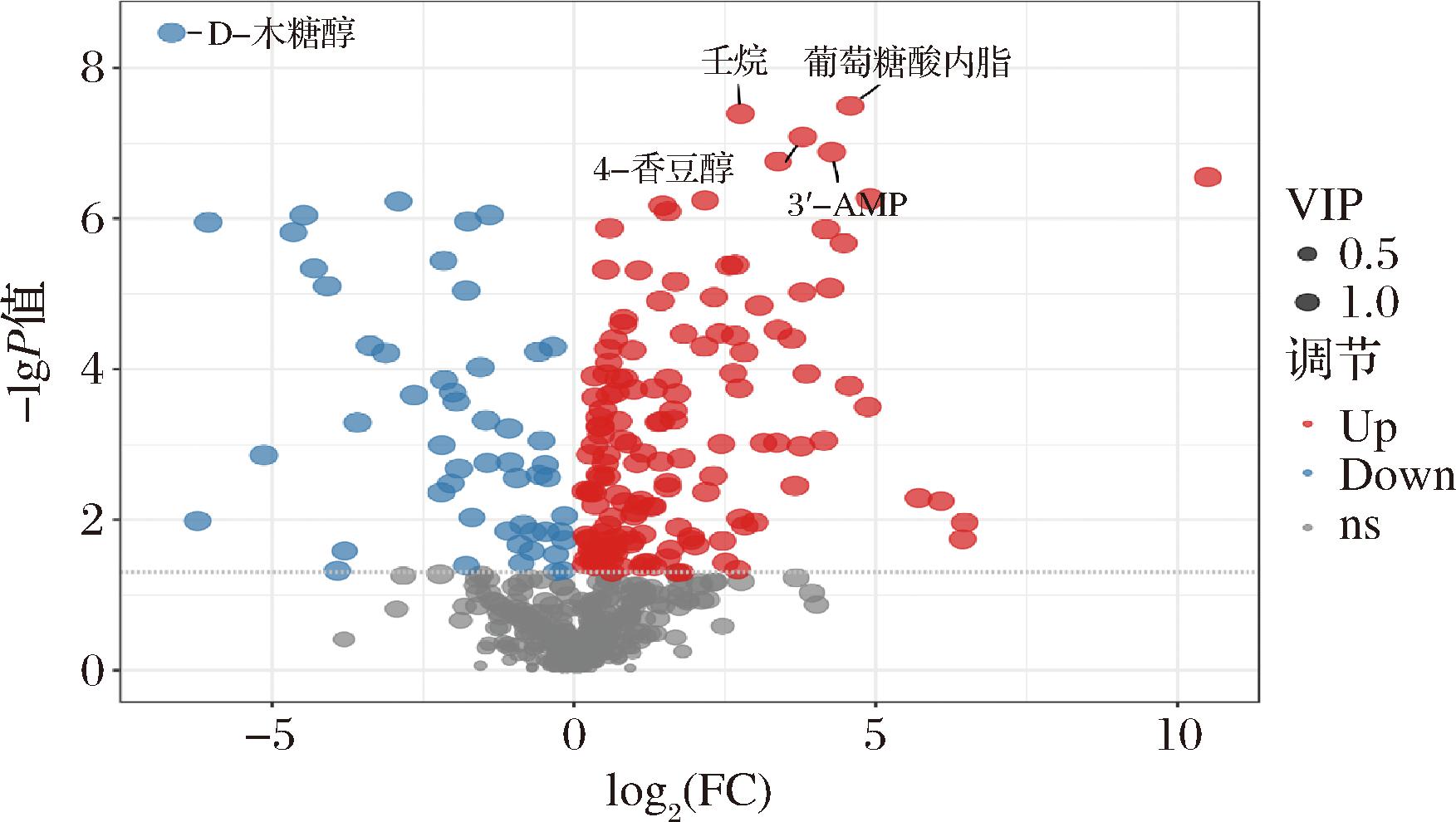
图5 协同联用菌种发酵骏枣汁差异代谢物火山图
Fig.5 Volcano plot of differential metabolites in jujube juice fermented by combined synergistic bacteria
由图6可知,协同联用菌株发酵骏枣汁和原汁的差异代谢物主要富集在20条代谢通路上,枣汁通过协同联用菌株发酵差异代谢物含量增加数目最多,且差异显著的代谢通路为ABC转运蛋白代谢通路、苯丙素生物合成代谢通路、苯丙素类生物合成代谢通路,大部分代谢物均会参与上述3种代谢途径。这3条主要代谢通路与嗜酸乳杆菌发酵枣汁和原汁差异代谢物主要的富集代谢通路相同,与植物乳植杆菌发酵枣汁和原汁差异代谢物主要富集代谢通路也有重合。说明虽然是不同的发酵菌种,但是差异代谢物参与的代谢通路基本一致,枣汁通过发酵都会提升枣汁的营养和生物活性。
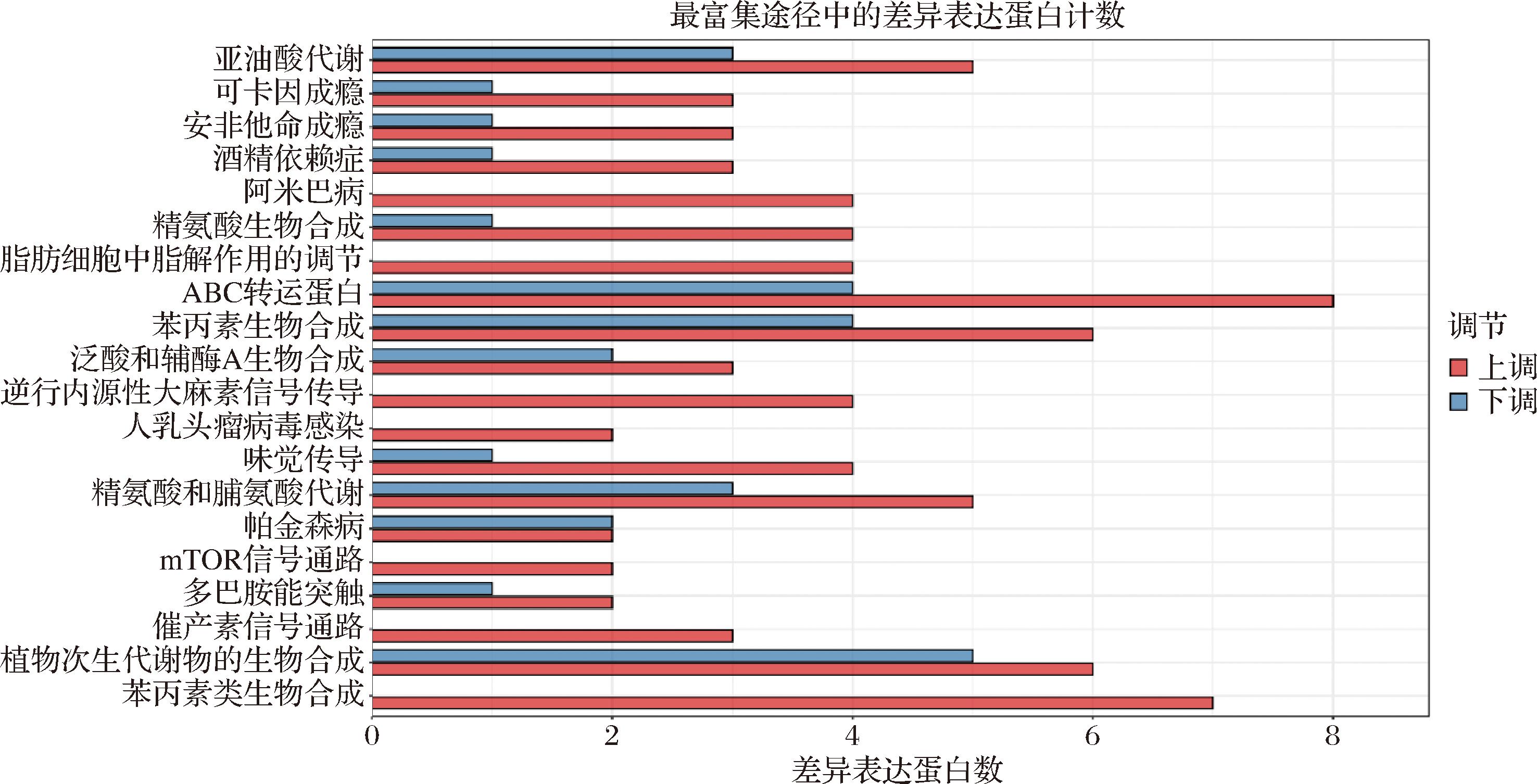
图6 协同联用菌种发酵骏枣汁和原汁差异代谢物富集代谢通路统计图
Fig.6 Differential metabolites enrichment metabolic pathways in combined synergistic fermented jujube juice and original juice
2.4 植物乳植杆菌、嗜酸乳杆菌及两者联用协同发酵骏枣汁之间的差异代谢物
植物乳植杆菌、嗜酸乳杆菌及两者联用协同发酵枣汁共有117种差异代谢物,差异最显著的是有机酸类、氨基酸类、有机碱类和酚类4种类别,分别占比为36.75%、12.82%、10.26%、5.98%。
由图7可知,单菌发酵与协同联用发酵骏枣汁最显著的差异代谢物为4-胍丁胺、苯乙酸、β-D-半乳糖酮糖、3,4-二羟基苯乙醛、N-乙酰L-天冬氨酸。这5种差异代谢物在协同联用发酵枣汁中的相对含量低于至少一种单菌发酵枣汁。4-胍丁胺是一种含有胍基和丁胺基团的化合物,代谢过程中会产生氰化物,对植物有杀伤作用[43]。苯乙酸是一种芳香族有机酸,在植物中起到调节激素的作用,可以抑制植物乳植杆菌和嗜酸乳杆菌的生长和繁殖[44]。由于两个菌种间的相互作用,为了尽可能地生长和繁殖,会减少产生不利于自身生长的代谢产物,所以4-胍丁胺、苯乙酸在协同联用发酵枣汁中相对含量较低[45]。β-D-半乳糖酮糖是一种单糖,其结构中包含酮基和半乳糖基,在植物中具有信号转导和防御作用。由于其特有的酮基和半乳糖结构,会产生苦味、涩味等不良口感,同时还具有一定的致敏性[46]。N-乙酰L-天冬氨酸是一种氨基酸的衍生物,含有乙酰基和天冬氨酸基团,在生物体内参与神经传导、蛋白质合成等代谢过程[47]。协同联用菌种可能产生特定的酶,能分解β-D-半乳糖酮糖和N-乙酰L-天冬氨酸,所以其相对含量较低,使得协同联用菌种发酵枣汁可以减少过敏人群的过敏反应,改善枣汁风味。4-二羟基苯乙醛是一种含有酚醛结构的化合物,在植物中具有抗氧化和抗炎作用,但是会产生不愉快的焦糖味或苦味[48],影响枣汁口感,其相对含量降低可以改善发酵枣汁的口感,使枣汁的风味更加自然、清新。
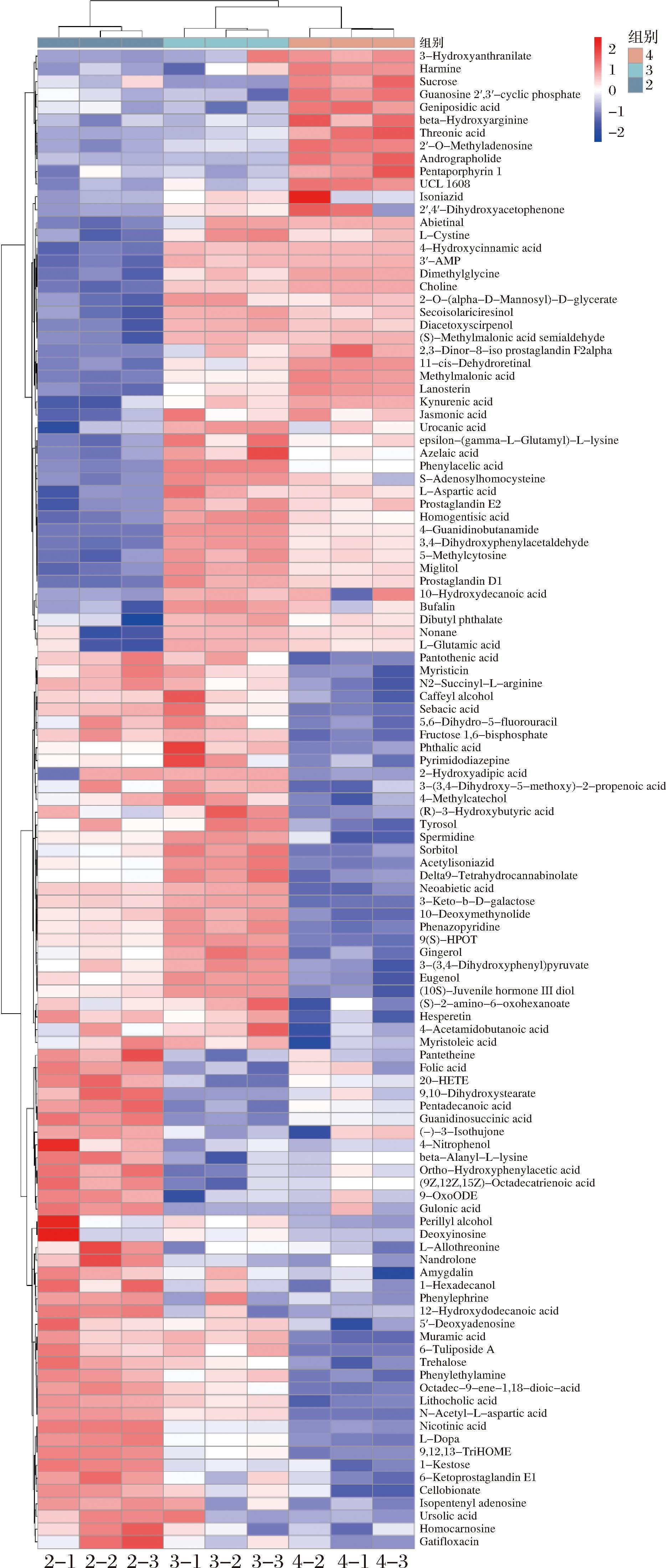
图7 单菌和协同联用菌发酵骏枣汁差异代谢物聚类热图
Fig.7 Cluster heatmap of differential metabolites between jujube juice fermented by single strain and that fermented by combined synergistic bacteria
注:2-植物乳杆菌发酵枣汁;3-嗜酸乳杆菌发酵枣汁;4-协同联用菌发酵枣汁。
由图8可知,通过代谢通路的富集分析和拓扑分析,单菌与协同联用发酵骏枣汁总体差异代谢物数量最多,且差异最显著的代谢通路分别为ABC转运蛋白代谢通路、植物次生代谢物的生物合成代谢通路、氨基酸代谢通路。与植物乳植杆菌、嗜酸乳杆菌及协同联用菌种发酵枣汁与原汁的代谢通路相比,新增的显著代谢通路为氨基酸代谢通路,尤其是精氨酸和脯氨酸代谢通路,精氨酸在生物体内不仅参与蛋白质的合成,还是多种生物活性物质的合成前体,如多胺和NO等[49]。脯氨酸是一种非必需氨基酸,是蛋白质合成的组成成分,参与转化为酪氨酸和酪醇参与黑色素的合成,转化为香草醛参与咖啡因生物的合成,以及转化为壬二酸和乙酰乙酸作为能量来源[50]。差异代谢物中氨基酸类物质占比较大,在协同联用发酵骏枣汁中含量较高的氨基酸代谢物有β-羟基精氨酸、N2-琥珀酰-L-精氨酸、3,4-二羟苯丙氨酸、L-天冬氨酸、L-谷氨酸,氨基酸与有机酸类代谢物之间存在协同作用,共同构成发酵骏枣汁的独特风味,其中L-天冬氨酸、L-谷氨酸为鲜味氨基酸,是协同联用发酵骏枣汁中特殊风味的来源。
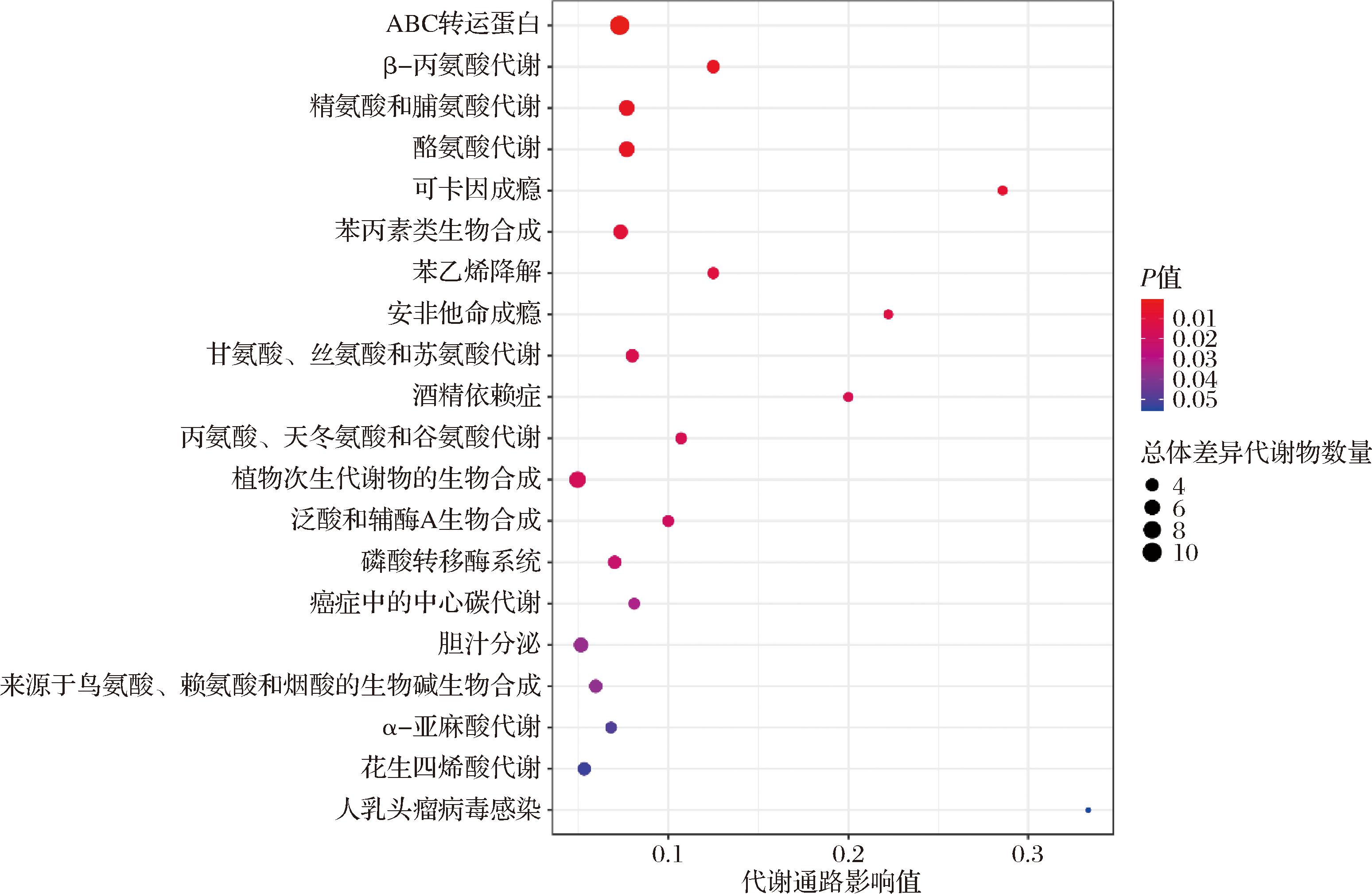
图8 单菌及协同联用发酵骏枣汁差异代谢物富集通路气泡图
Fig.8 Bubble chart of enriched pathways for differential metabolites in jujube juice fermented by single bacteria and combined synergistic fermentation
3 结论
通过UPLC-MS检测不同发酵菌种骏枣汁及原汁的差异代谢物,结合模型的VIP与非参数检验共筛选出最显著的差异代谢物有6类,分别为有机酸类、有机碱类、氨基酸类、糖类、酚类和核苷类,并发现3种不同发酵菌种骏枣汁与原汁的差异代谢物和不同菌种发酵骏枣汁之间的差异代谢物中占比最大的均为有机酸类。其中,4-香豆醇和葡萄糖酸内酯为3种发酵枣汁与原汁的共有差异代谢差异物,D-木糖醇是植物乳植杆菌发酵枣汁、协同联用菌种发酵枣汁分别与原汁的共有差异代谢物,马来酰胺酸是植物乳植杆菌发酵枣汁、嗜酸乳杆菌发酵枣汁分别与原汁的共有差异代谢物,单菌发酵与协同联用发酵骏枣汁的差异代谢物与不同菌种发酵骏枣汁和原汁之间的差异代谢物均不相同。KEGG代谢通路分析发现,不同菌种发酵骏枣汁与原汁的大多数差异代谢物主要富集在酪氨酸代谢通路、苯丙素生物合成代谢通路、ABC转运蛋白代谢通路、苯丙素类生物合成代谢通路。协同联用菌种发酵骏枣汁与原汁的差异代谢物参与的代谢通路与2种单菌发酵骏枣汁与原汁的代谢通路完全重合,单菌与协同联用发酵骏枣汁新增的显著代谢通路为氨基酸代谢通路。可见不同菌种发酵骏枣汁的品质均优于原汁,其中协同联用菌种发酵骏枣汁的效果最佳。
本研究建立了基于UPLC-MS技术的非靶向代谢组学方法,该模型可以定量分析不同菌种发酵骏枣汁之间以及同骏枣原汁之间的代谢产物差异性,该方法具有良好的重复性和精密度,所检测到的物质可为发酵骏枣汁的分析及相应生物学功能研究提供一定的数据支持。
[1] 王秋萍.交城骏枣名扬九州[J].果树实用技术与信息,2012(5):46.WANG Q P.Jiaocheng Junzao is famous in China[J].Fruit Tree Practical Technology and Information, 2012(5):46.
[2] 李强, 刘钧珂.吕梁木枣多糖与交城骏枣多糖的抗疲劳作用比较研究[J].中国调味品, 2023, 48(2):83-86.LI Q, LIU J K.Comparative study on anti-fatigue effect of polysaccharides from Lyuliang Zizyphus jujuba Mill.cv.Muzao and Jiaocheng Zizyphus jujuba Mill.cv.Junzao[J].China Condiment, 2023, 48(2):83-86.
[3] XUE X F, ZHAO A L, WANG Y K, et al.Composition and content of phenolic acids and flavonoids among the different varieties, development stages, and tissues of Chinese Jujube (Ziziphus jujuba Mill.)[J].PLoS One, 2021, 16(10):e0254058.
[4] WANG L N, FU H Y, WANG W Z, et al.Analysis of reducing sugars, organic acids and minerals in 15 cultivars of jujube (Ziziphus jujuba Mill.) fruits in China[J].Journal of Food Composition and Analysis, 2018, 73:10-16.
[5] 王成, 何伟忠, 庄宇, 等.新疆骏枣中15种成分的营养质量分析[J].食品工业科技, 2017, 38(22):291-295.WANG C, HE W Z, ZHUANG Y, et al.Study on the nutrition quality of 15 components in Jun jujube from Xinjiang[J].Science and Technology of Food Industry, 2017, 38(22):291-295.
[6] SHI Q Q, HAN G, LIU Y, et al.Nutrient composition and quality traits of dried jujube fruits in seven producing areas based on metabolomics analysis[J].Food Chemistry, 2022, 385:132627.
[7] 卜智斌, 徐玉娟, 温靖, 等.骏枣果醋发酵过程中营养品质变化及风味成分分析[J].中国酿造, 2020, 39(10):84-89.BU Z B, XU Y J, WEN J, et al.Analysis of change of nutritional quality and volatile components in fermentation process of Jun-jujube vinegar[J].China Brewing, 2020, 39(10):84-89.
[8] 李智邦. 酵母菌发酵红枣饮料加工工艺及品质变化研究[D].石河子:石河子大学,2022.LI Z B.Study on processing technology and quality change of jujube beverage fermented by yeast[D].Shihezi:Shihezi University, 2022.
[9] 邹波, 徐玉娟, 肖更生, 等.不同酿酒酵母对骏枣果酒发酵特性的影响[J].食品科学技术学报, 2019, 37(2):63-69.ZOU B, XU Y J, XIAO G S, et al.Effect of different Saccharomyces cerevisiae on Jun-jujube wine fermentation characteristics[J].Journal of Food Science and Technology, 2019, 37(2):63-69.
[10] 徐铭阳, 李崎, 郑飞云, 等.适于红枣汁发酵的乳酸菌的筛选及其发酵特性分析[J].食品与发酵工业, 2023, 49(21):66-74.XU M Y, LI Q, ZHENG F Y, et al.Screening and fermentation characteristics of lactic acid bacteria suitable for jujube juice fermentation[J].Food and Fermentation Industries, 2023, 49(21):66-74.
[11] 王彤, 刘慧燕, 潘琳, 等.嗜酸乳杆菌发酵枣汁的非靶向代谢组学研究[J].中国酿造, 2021, 40(8):174-179.WANG T, LIU H Y, PAN L, et al.Non-targeted metabolomics of fermented jujube juice by Lactobacillus acidophilus[J].China Brewing, 2021, 40(8):174-179.
[12] LIU G P, WU M Y, LI Y F, et al.The effect of different pretreatment methods on jujube juice and lactic acid bacteria-fermented jujube juice[J].LWT, 2023, 181:114692.
[13] 梁鑫, 陈思雨, 赵育, 等.乳酸菌和酵母菌发酵红枣汁工艺优化及成分分析[J].食品与发酵工业, 2021, 47(7):175-182.LIANG X, CHEN S Y, ZHAO Y, et al.Process optimization and composition analysis of jujube juice fermentation by lactic acid bacteria and yeast[J].Food and Fermentation Industries, 2021, 47(7):175-182.
[14] SHEN B Q, ZHANG Z, SHI Q Q, et al.Active compound analysis of Ziziphus jujuba cv.Jinsixiaozao in different developmental stages using metabolomic and transcriptomic approaches[J].Plant Physiology and Biochemistry, 2022, 189:14-23.
[15] ZHOU J, YI H, ZHAO Z X, et al.Simultaneous qualitative and quantitative evaluation of Ilex Kudingcha C.J.tseng by using UPLC and UHPLC-qTOF-MS/MS[J].Journal of Pharmaceutical and Biomedical Analysis, 2018, 155:15-26.
[16] ZELENA E, DUNN W B, BROADHURST D, et al.Development of a robust and repeatable UPLC-MS method for the long-term metabolomic study of human serum[J].Analytical Chemistry, 2009, 81(4):1357-1364.
[17] WANT E J, MASSON P, MICHOPOULOS F, et al.Global metabolic profiling of animal and human tissues via UPLC-MS[J].Nature Protocols, 2013, 8(1):17-32.
[18] DEMURTAS A, PESCINA S, NICOLI S, et al.Validation of a HPLC-UV method for the quantification of budesonide in skin layers[J].Journal of Chromatography.B, Analytical Technologies in the Biomedical and Life Sciences, 2021, 1164:122512.
[19] ABDELRAZIG S, SAFO L, RANCE G A, et al.Metabolic characterisation of Magnetospirillum gryphiswaldense MSR-1 using LC-MS-based metabolite profiling[J].RSC Advances, 2020, 10(54):32548-32560.
[20] GAGNEBIN Y, TONOLI D, LESCUYER P, et al.Metabolomic analysis of urine samples by UHPLC-QTOF-MS:Impact of normalization strategies[J].Analytica Chimica Acta, 2017, 955:27-35.
[21] JIN P F, YUAN X H, MA X M, et al.Epoxymicranthols A:N, 5, 9-epoxygrayanane diterpenoids as potent analgesics from Rhododendron micranthum[J].Chinese Journal of Chemistry, 2021, 39(7):1997-2008.
[22] SUN Y H, CHEN X X, XU F, et al.Quantum chemical calculations on the mechanism and kinetics of ozone-initiated removal of p-coumaryl alcohol in the atmosphere[J].Chemosphere, 2020, 253:126744.
[23] NOEL J W, SPITTLE N E, SNIDER M J.On the role of Cys150 in the mechanism of maleamate amidohydrolase (NicF)[J].The FASEB Journal,2012,26(S1).DOI:10.1096/fasebj.26.1_supplement.756.20.
[24] MU Y, ZHANG F Y, LI N, et al.Catabolic characterization of dipicolinic acid in Alcaligenes faecalis strain JQ135[J].International Biodeterioration &Biodegradation, 2021, 165:105312.
[25] CHEN X, JIANG Z H, CHEN S F, et al.Microbial and bioconversion production of D-xylitol and its detection and application[J].International Journal of Biological Sciences, 2010, 6(7):834-844.
[26] HUANG C B, CHEN Z X, GUI Y, et al.Crystal nucleation rates in glass-forming molecular liquids:D-sorbitol, D-arabitol, D-xylitol, and glycerol[J].The Journal of Chemical Physics, 2018, 149(5):054503.
[27] 杨雅婧, 张志衡, 琚魏波, 等.δ-葡萄糖酸内酯添加量对豆腐凝胶特性的影响[J].中国调味品, 2023, 48(2):183-187; 194.YANG Y J, ZHANG Z H, JU W B, et al.Effect of glucono-δ-lactone addition amount on the gel properties of tofu[J].China Condiment, 2023, 48(2):183-187; 194.
[28] MURIMWA J C, RUGARE J T, MABASA S, et al.Effect of Sorghum mulches on emergence and seedling growth of beggarticks, goose grass, and sesame[J].International Journal of Agronomy, 2022, 2022(1):2751106.
[29] SUN D Q, LI H F, SONG D W, et al.Genome, transcriptome and fermentation analyses of Lactobacillus plantarum LY-78 provide new insights into the mechanism of phenyllactate biosynthesis in lactic acid bacteria[J].Biochemical and Biophysical Research Communications, 2019, 519(2):351-357.
[30] 房媛, 王郑.葡萄糖醛酸内酯制备和表征研究[J].盐科学与化工, 2020, 49(9):28-31.FANG Y, WANG Z.Study on preparation and characterization of glucurolactone[J].Journal of Salt Science and Chemical Industry, 2020, 49(9):28-31.
[31] WANG B, WANG Y H, DENG Y J, et al.Effect of betanin synthesis on photosynthesis and tyrosine metabolism in transgenic carrot[J].BMC Plant Biology, 2023, 23(1):402.
[32] WANG Y, WAN C, LI L J, et al.Transcriptomic analysis of Yunwu tribute tea leaves under cold stress[J].Current Issues in Molecular Biology, 2023, 45(1):699-720.
[33] 张晓茹. 在发酵过程中,植物乳杆菌对酿酒酵母氧化代谢的调控[D].北京:北京化工大学,2020.ZHANG X R.Regulation of Lactobacillus plantarum on oxidative metabolism of Saccharomyces cerevisiae during fermentation[D].Beijing:Beijing University of Chemical Technology, 2020.
[34] ZHU S S, ZHANG X Y, REN C Q, et al.Chromosome-level reference genome of Tetrastigma hemsleyanum (Vitaceae) provides insights into genomic evolution and the biosynthesis of phenylpropanoids and flavonoids[J].The Plant Journal, 2023, 114(4):805-823.
[35] LONI A, SAADATMAND S, LARI YAZDI H, et al.Application of nano-β-cyclodextrin to induce biosynthesis of phenylpropanoids and antioxidant activity of basil[J].Iranian Journal of Science and Technology, Transactions A:Science, 2021, 45(6):1951-1962.
[36] T TH
TH  , JANASZKIEWICZ A, CRESPI V, et al.On the interplay between lipids and asymmetric dynamics of an NBS degenerate ABC transporter[J].Communications Biology, 2023, 6:149.
, JANASZKIEWICZ A, CRESPI V, et al.On the interplay between lipids and asymmetric dynamics of an NBS degenerate ABC transporter[J].Communications Biology, 2023, 6:149.
[37] ZHANG H H, ZENG N D, FENG Q R, et al.New mechanistic insights into PAHs transport across wheat root cell membrane:Evidence for ABC transporter mediation[J].Science of the Total Environment, 2023, 859:160251.
[38] DOLENSKY J, HINTEREGGER C, LEITNER A, et al.Antiprotozoal activity of azabicyclo-nonanes linked to tetrazole or sulfonamide cores[J].Molecules, 2022, 27(19):6217.
[39] 祁丹丹. 代谢组分析揭示了蜂王浆高产的代谢适应基础[D].北京:中国农业科学院,2021.QI D D.Metabonomic analysis revealed the metabolic adaptation basis of high yield of royal jelly[D].Beijing:Chinese Academy of Agricultural Sciences, 2021.
[40] PENG W Y, MENG D Q, YUE T L, et al.Effect of the apple cultivar on cloudy apple juice fermented by a mixture of Lactobacillus acidophilus, Lactobacillus plantarum, and Lactobacillus fermentum[J].Food Chemistry, 2021, 340:127922.
[41] WU Z Z, GAN Z W, ZHANG Y X, et al.Transcriptomic and metabolomic perspectives for the growth of alfalfa (Medicago sativa L.) seedlings with the effect of vanadium exposure[J].Chemosphere, 2023, 336:139222.
[42] WU T L, LIU K D, CHEN M, et al.Transcriptome and metabolome analyses of Shatian pomelo (Citrus grandis var.Shatinyu Hort) leaves provide insights into the overexpression of the gibberellin-induced gene CcGASA4[J].Frontiers in Plant Science, 2022, 13:1022961.
[43] SARAGADAM T, PUNEKAR N S.Novel route for agmatine catabolism in Aspergillus niger:4-guanidinobutyrase assay[J].Methods in Molecular Biology, 2018, 1694:163-172.
[44] PREM E M, MARKT R, LACKNER N, et al.Microbial and phenyl acid dynamics during the start-up phase of anaerobic straw degradation in meso- and thermophilic batch reactors[J].Microorganisms, 2019, 7(12):657.
[45] 杨宏.嗜酸乳杆菌和植物乳杆菌复合发酵合成共轭亚油酸的研究[D].大连:大连工业大学,2011.YANG H.Study on the synthesis of conjugated linoleic acid by Lactobacillus acidophilus and Lactobacillus plantarum[D].Dalian:Dalian Polytechnic University, 2011.
[46] TABERMAN H, ANDBERG M, PARKKINEN T, et al.Purification, crystallization and preliminary X-ray diffraction analysis of a novel keto-deoxy-D-galactarate (KDG) dehydratase from Agrobacterium tumefaciens[J].Acta Crystallographica.Section F, Structural Biology Communications, 2014, 70(Pt 1):49-52.
[47] KOTS E D, KHRENOVA M G, NEMUKHIN A V.Allosteric control of N-acetyl-aspartate hydrolysis by the Y231C and F295S mutants of human aspartoacylase[J].Journal of Chemical Information and Modeling, 2019, 59(5):2299-2308.
[48] JINSMAA Y, ISONAKA R, SHARABI Y, et al.3, 4-dihydroxyphenylacetaldehyde is more efficient than dopamine in oligomerizing and quinonizing α-synuclein[J].The Journal of Pharmacology and Experimental Therapeutics, 2020, 372(2):157-165.
[49] MAJUMDAR R, BARCHI B, TURLAPATI S A, et al.Glutamate, ornithine, arginine, proline, and polyamine metabolic interactions:The pathway is regulated at the post-transcriptional level[J].Frontiers in Plant Science, 2016, 7:78.
[50] XIE S B, JIANG S J, ZHANG H, et al.Prediction of sublingual immunotherapy efficacy in allergic rhinitis by serum metabolomics analysis[J].International Immunopharmacology, 2021, 90:107211.