根面龋是一种发生在牙根面的细菌感染性疾病,发生位置特殊且发病率高,彻底去除龋坏组织和干燥窝洞较困难,治疗难度相对较大,临床上以病因预防和早期治疗为主[1]。变异链球菌(Streptococcus mutans)作为主要致龋菌,具有产酸、耐酸和酵解有机物的特点,在根面龋发生发展中扮演着重要角色[2],因此,抑制变异链球菌生物膜的形成可有效预防根面龋的发生。目前国内外主要通过应用氟化物和氯己定等化学合成药物抑制变异链球菌的生长以达到防治龋病的目的,但因存在稳定性、耐药性、毒副作用等问题,致使寻找安全有效的抗菌药物成为龋病预防的当务之急。目前,已报道了一些植物提取物作为抗菌药抑制致龋菌的生长[2-5]。
姜黄精油是一种辛辣的橙黄色液体,主要由烯烃、烯酮以及芳香烃类等化学物质组成[6]。其成分复杂,有数十种至数百种组分,具有止咳[7]、抑菌[8-9]、抗炎镇痛、抗氧化[10]、降血脂和抗肿瘤[11]等作用。姜黄精油的抗菌活性已在很多研究中得到证实,公衍玲等[12]的研究表明姜黄挥发油对金黄色葡萄球菌、枯草杆菌和四联球菌有特别显著的抑菌效果,且对大肠埃希菌和产气杆菌也有较强的抑菌作用。蓝波妙[9]研究发现,姜黄挥发油对沙门氏菌的抑制效果最好。姜黄精油对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌等具有良好的抑制活性,主要抗菌活性成分是芳姜黄酮和姜黄酮[13]。NEGI等[14]的研究表明,芳姜黄酮、姜黄酮等是姜黄油的抑菌成分,但姜黄精油对变异链球菌的抑菌效果及抑菌机理的研究鲜有报道。
本研究首次选用微波预处理-超声波辅助提取腾冲姜黄精油,分析其活性成分,观察精油处理前后对变异链球菌抑菌生长曲线、抑菌圈大小、细胞形态、表面疏水性、表面电荷变化情况,探究姜黄精油对变异链球菌抗菌活性及其抑菌机理,以期为姜黄精油应用于抑制口腔中变异链球菌的生长提供理论依据。
1 材料与方法
1.1 材料与试剂
姜黄于2023年9月5日在云南省腾冲市购买所得。将采购回的新鲜姜黄洗净,切薄片晾晒,待晾干后粉碎,过100目筛,备用。变异链球菌冻干粉(ATCC 700610)、脑心浸出液培养基,北京保藏生物有限公司,2~8 ℃冰箱保存;甲醇、无水乙醇、蒸馏水、氯化钠、过硫酸钾、脑心浸液琼脂、脑心浸液肉汤、碘化丙啶,常德比克曼生物科技有限公司;磷酸缓冲盐溶液(0.02 mol/L pH 7.2),成都市科隆化学品有限公司。
1.2 仪器与设备
G70F20 N2L-DG(SO)微波炉,格兰仕微波炉电器有限公司;Finnigan Trace DSQ气质联用仪,日本岛津公司;BPH-9082恒温培养箱,上海一恒科技有限公司;DZTW调温电热套、XM-800UVF智能静音超声波清洗机、UV-5500PC紫外可见分光光度计、GI54DWS全自动高压灭菌锅,厦门致微仪器有限公司;AR8011电导率测试仪,苏州罗伯克测控技术有限公司;CSUOP0600荧光倒置显微镜,重庆重光实业有限公司;Zetasizer Nano ZS激光粒度仪,英国马尔文帕纳科公司。
1.3 实验方法
1.3.1 姜黄精油的提取方法
参照刘西岭等[15]的方法,采用微波预处理-超声波辅助水蒸气蒸馏法对腾冲姜黄精油进行提取。称取100目姜黄粉30 g,装入1 L的烧杯中,按料液比1∶24,加入10%的NaCl并搅拌,保鲜膜封口浸泡2 h,700 W微波预处理90 s,每30 s间隔处理,预处理结束后,560 W超声30 min,在水蒸气蒸馏装置中蒸馏2.5 h,将馏出物进行水油分离,得到的姜黄精油置于小棕瓶,贴上标签,密封保存于4 ℃冰箱中备用。
1.3.2 姜黄精油的提取方法
参照吴红洋[16]的方法,采用GC-MS技术对姜黄精油进行成分分析,利用面积归一法分析及NIST14谱库检索测定各成分的相对质量分数和定性分析。
1.3.3 样品的配制
姜黄精油的配制:用吐温20,将姜黄精油配制成32 mg/mL母液,4 ℃冰箱贮藏备用。
脑心浸出液(brian heart infusion,BHI)液体培养基的配制:脑心浸液肉汤7.40 g,蒸馏水1.0 L,pH自然,121 ℃,15 min灭菌。
变异链球菌的活化培养:将变异链球菌冻干粉甩至管底,然后用酒精消毒,将开口尖的一端打开,向菌种管中添加0.20 mL无菌水,轻摇至混匀,待充分溶解后,用无菌移液管吸出溶解液,接种在2支琼脂斜面上,然后将接种好的试管于37 ℃培养24~48 h,菌种长出后即可使用。
1.3.4 姜黄精油对变异链球菌的抑菌活性
1.3.4.1 姜黄精油对变异链球菌的抑菌圈及最低抑菌浓度(minimum inhibitory concentration,MIC)的测定
采用滤纸片法测定抑菌圈大小。吸取0.10 mL含菌量约为108 CFU/mL变异链球菌菌悬液,均匀涂布于BHI培养基表面,取5 μL以二倍稀释法将姜黄精油母液依次稀释质量浓度为16~0.25 mg/mL,并用无菌水作为对照一起浸于直径为6 mm滤纸片上。在恒温培养箱中分别放置含有菌液和不同稀释浓度的姜黄精油处理的平板,在37 ℃下培养24 h后,测定变异链球菌抑菌圈直径的大小,每个培养基中放置3片滤纸片,做3次重复,得到的数据取平均值。根据高海荣等[17]的研究成果,本试验姜黄精油抗菌性能参考的评估准则为:7 mm以下抑菌圈不敏感;7~10 mm抑菌圈低敏;10~15 mm抑菌圈中敏;15~20 mm抑菌圈高敏;大于20 mm抑菌圈极敏。
1.3.4.2 姜黄精油对变异链球菌的最小杀菌浓度(minimum bactericidal concentration,MBC)测定
参考孙月等[18]的方法,将姜黄精油用二倍稀释法配制成16~0.25 mg/mL,各区不同浓度精油2.5 mL,加入2.5 mL双倍浓度营养肉汤的试管中,再将0.1 mL含菌量约为108 CFU/mL的变异链球菌菌悬液接种于含不同稀释浓度的姜黄精油营养肉汤的试管中,吸取0.1 mL各浓度姜黄精油的菌悬液并涂布在脑心浸液固体培养基平板上,分别在37 ℃下孵育24 h后,观察相应的菌落数。
1.3.4.3 抑菌动力学的测定
分别配制含姜黄精油浓度为0(对照)、MIC、MBC的脑心浸液固体培养基,接种0.1 mL处于对数生长期的变异链球菌菌悬液于5 mL无菌脑心浸液体培养基中,分别置于恒温振荡培养箱中37 ℃培养,从0开始每2 h取样,样品用酶标仪在600 nm处测定OD值,记录数据。
1.3.5 姜黄精油对变异链球菌抑菌机理的研究
1.3.5.1 MIC和MBC处理的变异链球菌微观形态特征观察
将培养至对数生长期的变异链球菌用冷冻离心机6 000 r/min离心10 min,将BHI液体培养基中菌液浓度确定为1×107 CFU/mL,并将姜黄精油分别加入,使BHI液体培养基含精油浓度为0(对照)、MIC、MBC,置于37 ℃的摇床培养3 h,6 000 r/min 离心10 min,随后,将体积分数为2.50%的戊二醛溶液加入各浓度菌悬液中,进行固定处理3 h,离心10 min并用磷酸盐缓盐冲液洗涤3次,涂抹于载玻片上,用体积分数20%、40%、60%、80%、100%的乙醇溶液依次冲洗,完成脱水处理后,用体积分数为2.50%叔丁醇溶液置换乙醇,最后将处理好的样品平铺在灭菌的培养皿中,放置于超净台上自然风干,离子溅喷金后在扫描电镜下观察样品对细菌的损伤并拍照。
1.3.5.2 细胞膜完整性的测定
将处于对数期的变异链球菌加入含0(对照)、MIC、MBC质量浓度姜黄精油脑心浸液液体培养基中,37 ℃培养15 h后6 000 r/min冷冻离心机离心10 min,以磷酸缓冲盐溶液洗涤3次并重悬至菌悬液浓度为1×107 CFU/mL后,用激光粒度仪测细胞表面电荷。
1.3.5.3 表面电荷的测定
将0、MIC、MBC质量浓度的姜黄精油加入处于对数期的变异链球菌菌悬液中,37 ℃摇床培养4 h,混匀,取1 mL的培养液6 000 r/min离心10 min,用磷酸缓冲盐溶液洗涤3次并悬重,于96孔板中分别加入190 μL稀释100倍的菌悬液和10 μL按照体积比1∶3混合的SYBR Green Ⅰ和PI染料,25 ℃避光孵育25 min,在20×物镜及10×目镜荧光倒置显微镜下观察并拍照记录。
1.3.5.4 电导率的测定
参考DIAO等[19]的方法,将菌悬液浓度为1×107 CFU/mL的变异链球菌用冷冻离心机6 000 r/min离心10 min,将变异链球菌接种于液体培养基中,置于37 ℃的培养箱中培养12 h,6 000 r/min离心10 min,弃上清液,然后进行等渗处理,调整菌液的相对电导率,使其与5%葡萄糖溶液相匹配。在5%葡萄糖溶液中分别加入0(对照)、MIC、MBC浓度的姜黄精油,混合均匀,测量混合物的相对电导率,并将结果记录为L1。同样的方法,将在等渗处理后的菌液中分别加入0、MIC、MBC浓度的姜黄精油,混匀后在37 ℃的培养箱中培养12 h,每4 h取样并测量其相对电导率,数据记录为L2。最后,将悬浮在5%葡萄糖溶液中的菌液加热至沸腾状态持续5 min,然后迅速冷却。测量菌液的相对电导率,并将该值记录为L0。按照公式(1)计算菌种膜通透性的相对电导率:
相对电导率![]()
(1)
1.4 试验数据处理的方法
试验结果以“平均值±标准差”表示,Excel进行数据统计,Origin 2021软件作图,用SPSS 20.0显著性分析,以P≤0.05 表示差异有统计学意义。
2 结果与分析
2.1 姜黄精油成分分析
采用GC-MS对姜黄精油进行成分分析,其成分及保留时间如图1所示。用微波预处理-超声波辅助水蒸气蒸馏法提取的姜黄精油,其成分的保留时间集中在20~26 min,精油的出峰数占总峰数的比例为100%。
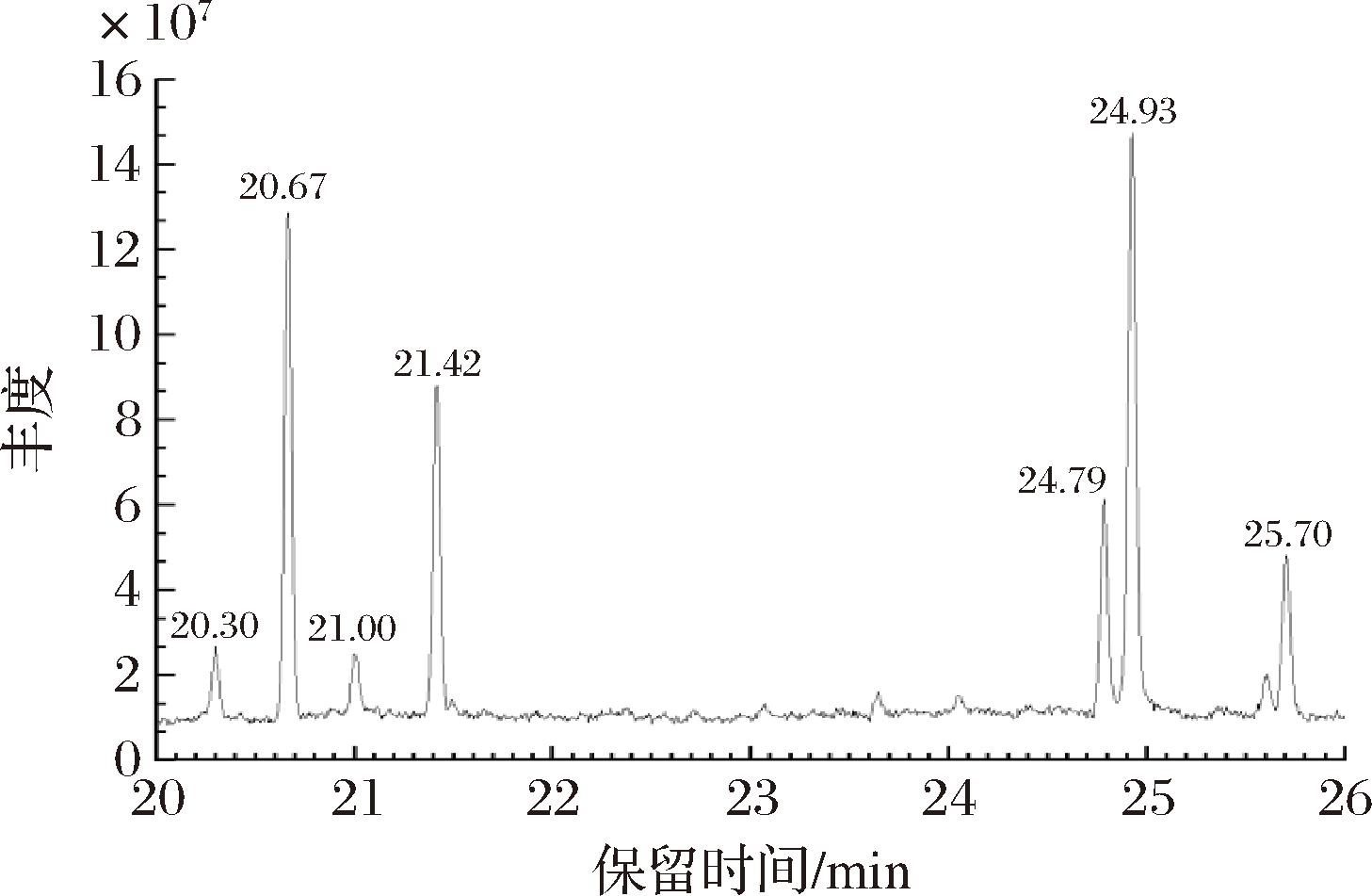
图1 姜黄精油的气相色谱总离子图
Fig.1 Gas chromatography total ion diagram of turmeric essential oil
采用面积归一化法分析得到各类成分的相对百分含量,如表1所示。姜黄精油的主要成分有5种。其中,单萜类为α-姜黄烯(3.25%)、α-姜烯(26.33%),倍半萜烯类为β-红没药烯(3.32%)、β- 倍半水芹烯(16.29%),萜烯类为芳姜黄酮(10.53%),苷类为姜黄酮(32.56%),酚类为β-姜黄素(7.73%)。
表1 姜黄精油主要成分及相对含量表
Table 1 Main components and relative content of turmeric essential oil
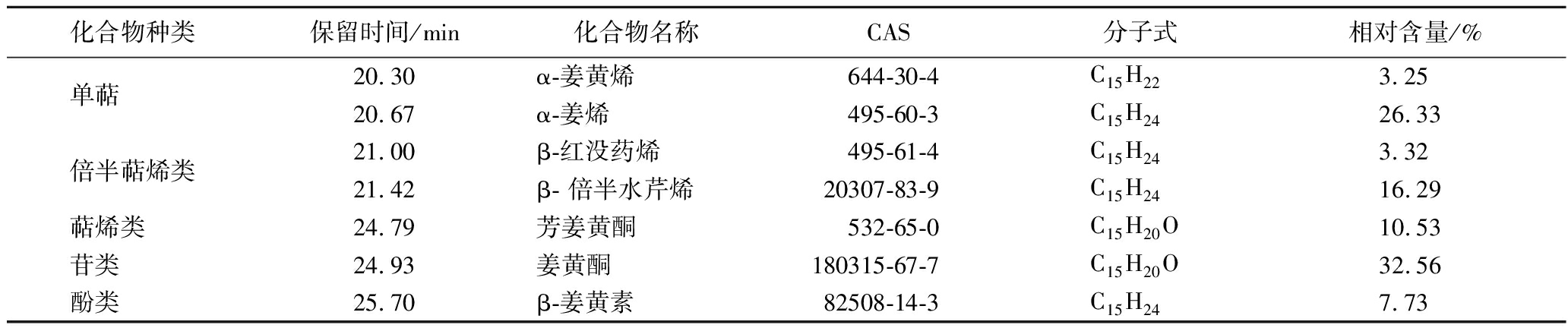
化合物种类保留时间/min化合物名称CAS分子式相对含量/%单萜 20.30α-姜黄烯644-30-4C15H223.2520.67α-姜烯495-60-3C15H2426.33倍半萜烯类21.00β-红没药烯495-61-4C15H243.3221.42β- 倍半水芹烯20307-83-9C15H2416.29萜烯类 24.79芳姜黄酮532-65-0C15H20O10.53苷类 24.93姜黄酮180315-67-7C15H20O32.56酚类 25.70β-姜黄素82508-14-3C15H247.73
2.2 姜黄精油对变异链球菌抑菌活性分析
2.2.1 抑菌圈直径及MIC的确定
如表2及图2所示,姜黄精油对变异链球菌表现出较好的抑菌能力。根据抑菌圈大小,当质量浓度为0.25、0.50 mg/mL时,抑菌圈为低敏,当质量浓度为1、2、4 mg/mL时,抑菌圈为中敏,当质量浓度为4、8、16 mg/mL时,抑菌圈为高敏。姜黄精油质量浓度为0 mg/mL的空白对照组无抑菌效果,质量浓度为0.25 mg/mL的平板对变异链球菌生长有抑菌效果,随精油浓度的增加,抑菌圈直径增大,抑菌效果增强,确定姜黄精油对变异链球菌的MIC为0.25 mg/mL。
表2 不同浓度的姜黄精油处理的变异链球菌的抑菌圈直径
Table 2 The diameter of the antibacterial zone of S.mutans treated with turmeric essential oil of different concentration
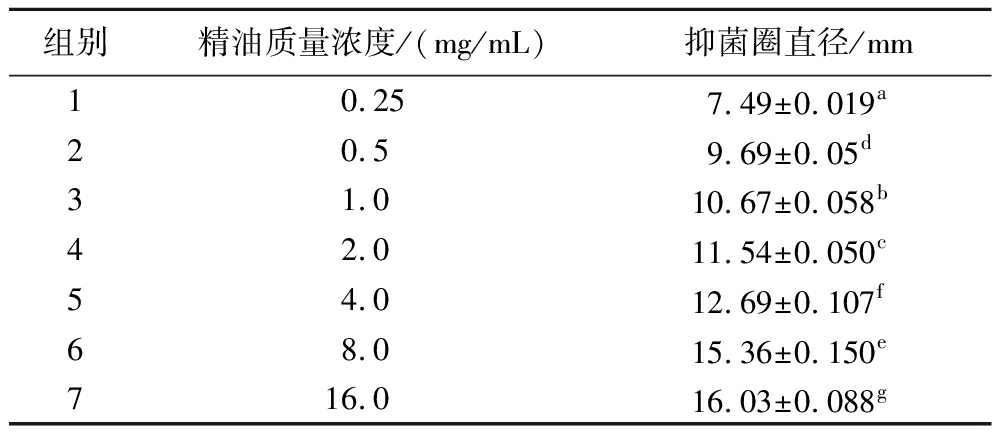
组别精油质量浓度/(mg/mL)抑菌圈直径/mm10.257.49±0.019a20.59.69±0.05d31.010.67±0.058b42.011.54±0.050c54.012.69±0.107f68.015.36±0.150e716.016.03±0.088g
注:不同字母表示梯度间差异显著(P<0.05),相同字母表示梯度间差异不显著。
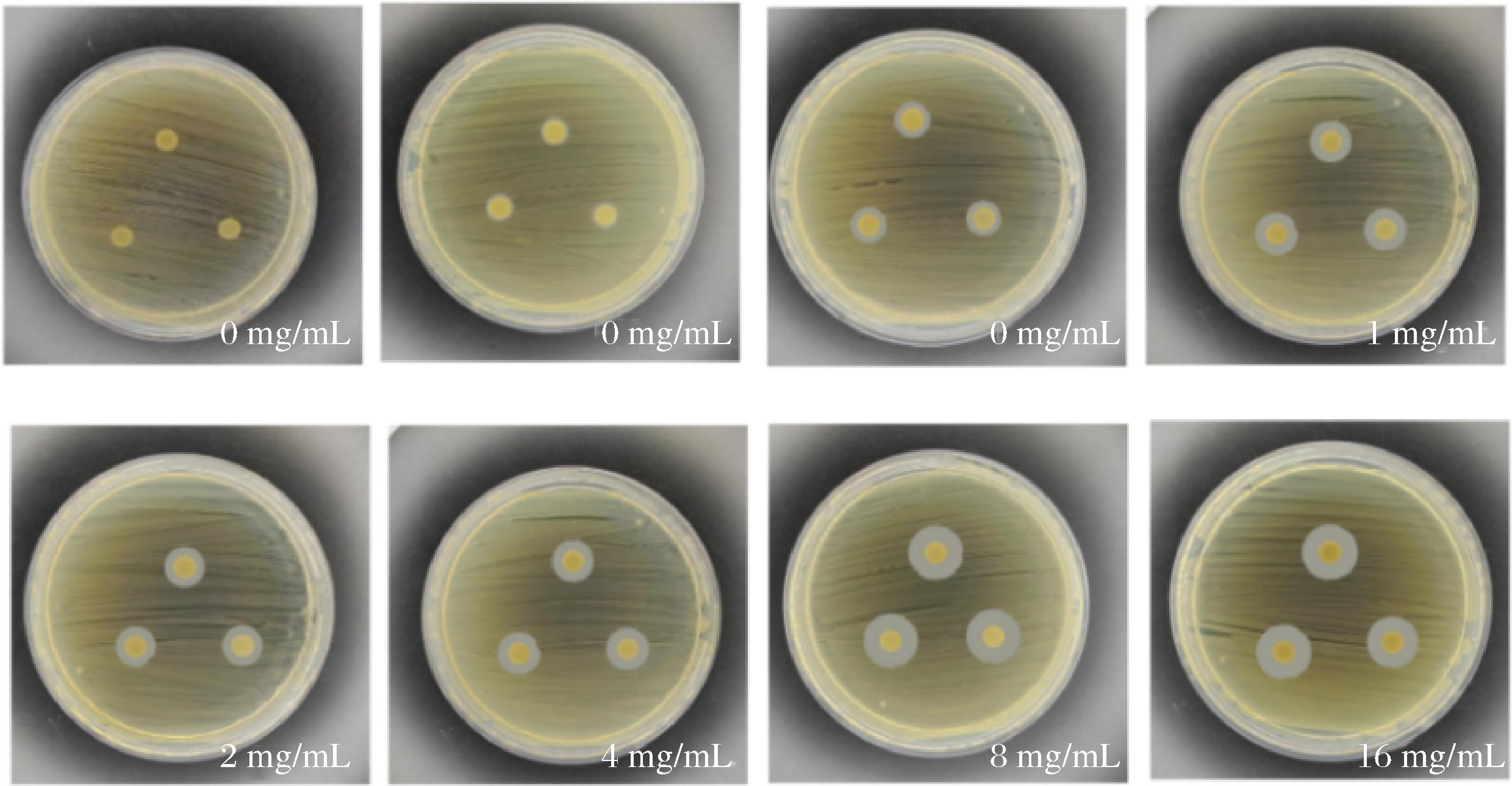
图2 不同浓度的姜黄精油处理的变异链球菌的抑菌圈大小
Fig.2 The size of the antibacterial zone of S.mutans treated with turmeric essential oil of different concentrations
2.2.2 姜黄精油对变异链球菌MBC
如图3所示,经0.25 mg/mL姜黄精油处理的平板仍有菌落生长,而0.50 mg/mL姜黄精油处理的平板已经无菌落生长。因此,本研究确定MBC为0.50 mg/mL。
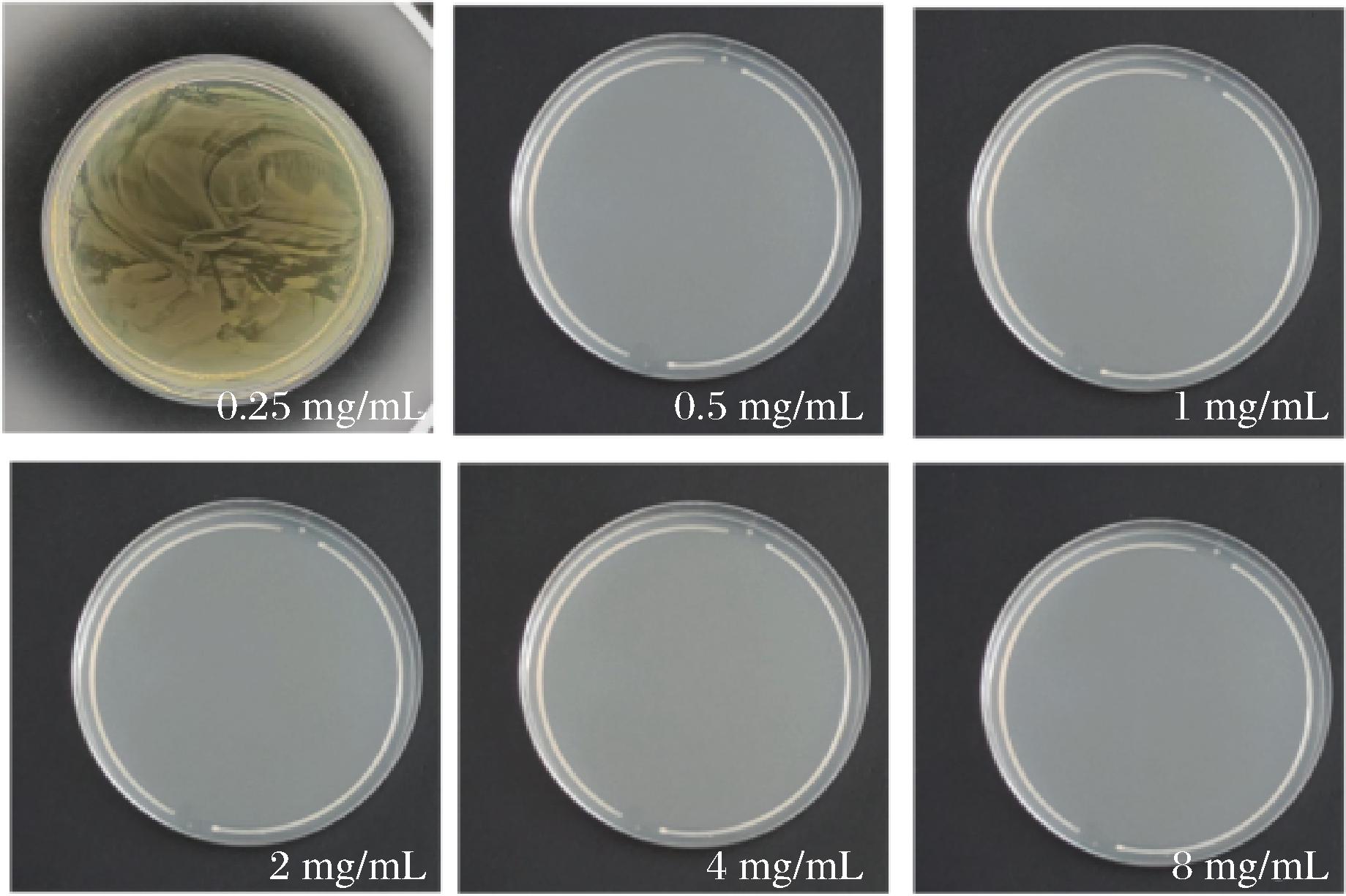
图3 不同浓度的姜黄精油对变异链球菌生长的影响
Fig.3 The effect of different concentrations of turmeric essential oil on the growth of S.mutans
2.2.3 姜黄精油对变异链球菌动力学分析
如图4所示,对照组的变异链球菌处在对数生长期,在0~30 h变异链球菌正常生长,状况良好,而相同时间范围内MIC、MBC姜黄精油处理的变异链球菌的生长明显受到抑制,且抑制作用与浓度成依赖关系。当姜黄精油质量浓度为MIC(0.25 mg/mL)和MBC(0.50 mg/mL)时,则变异链球菌的生长被完全抑制。其中,在姜黄精油质量浓度为0.50 mg/mL条件下处理2 h,变异链球菌生长已停滞,甚至灭活。由此说明姜黄精油能减弱变异链球菌的生长速度,延缓其生长期。
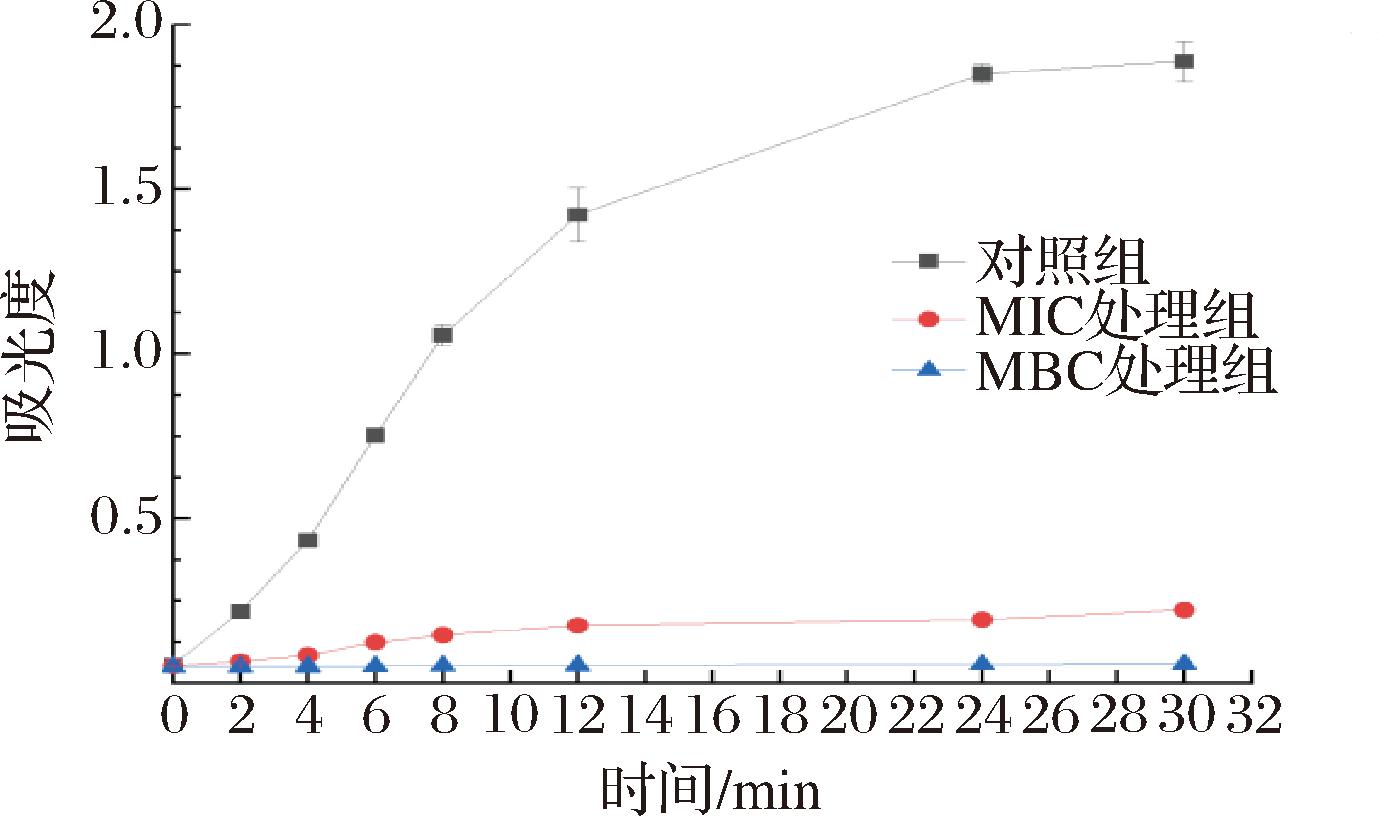
图4 姜黄精油对变异链球菌的抑菌生长曲线
Fig.4 The antibacterial growth curve of turmeric essential oil against S.mutans
2.3 姜黄精油对变异链球菌抑菌机理分析
2.3.1 精油作用前后变异链球菌菌体微观形态分析
从图5-a可以看出,在无姜黄精油处理的情况下,变异链球菌的细胞形态呈现出典型的短杆状,且形状规整,两端略显圆钝。此外,它们的表面并不平滑,而是呈现出卵圆形的特征,并且以短链的形式排列,显得饱满而圆润。值得注意的是,细胞表面的完整性得以维持,并未出现破损的情况,而且也没有在细胞内部发现有任何物质的流动。然而,由图5-b可知,当对变异链球菌进行MIC浓度的姜黄精油处理后,情况发生了明显的变化,部分菌体细胞膜破裂,细胞内物质流出。从图5-c可以明显看出,经过MBC浓度姜黄精油处理后的变异链球菌,细胞群粘连在一起,可能是由于姜黄精油引起了细胞膜溶解和转变。

a-无姜黄精油;b-MIC姜黄精油;c-MBC姜黄精油
图5 不同处理的变异链球菌扫描电镜图
Fig.5 Scanning electron microscopy images of S.mutans with different treatments
2.3.2 变异链球菌细胞表面特性研究
如图6所示,经MIC和MBC姜黄精油处理后的变异链球菌,其表面电荷绝对值降低,说明当变异链球菌暴露于一定量的姜黄精油后,其表面电荷会减少,表明变异链球菌菌体的稳定性变差,使菌体细胞更容易聚沉、成团,从而影响正常生长繁殖。
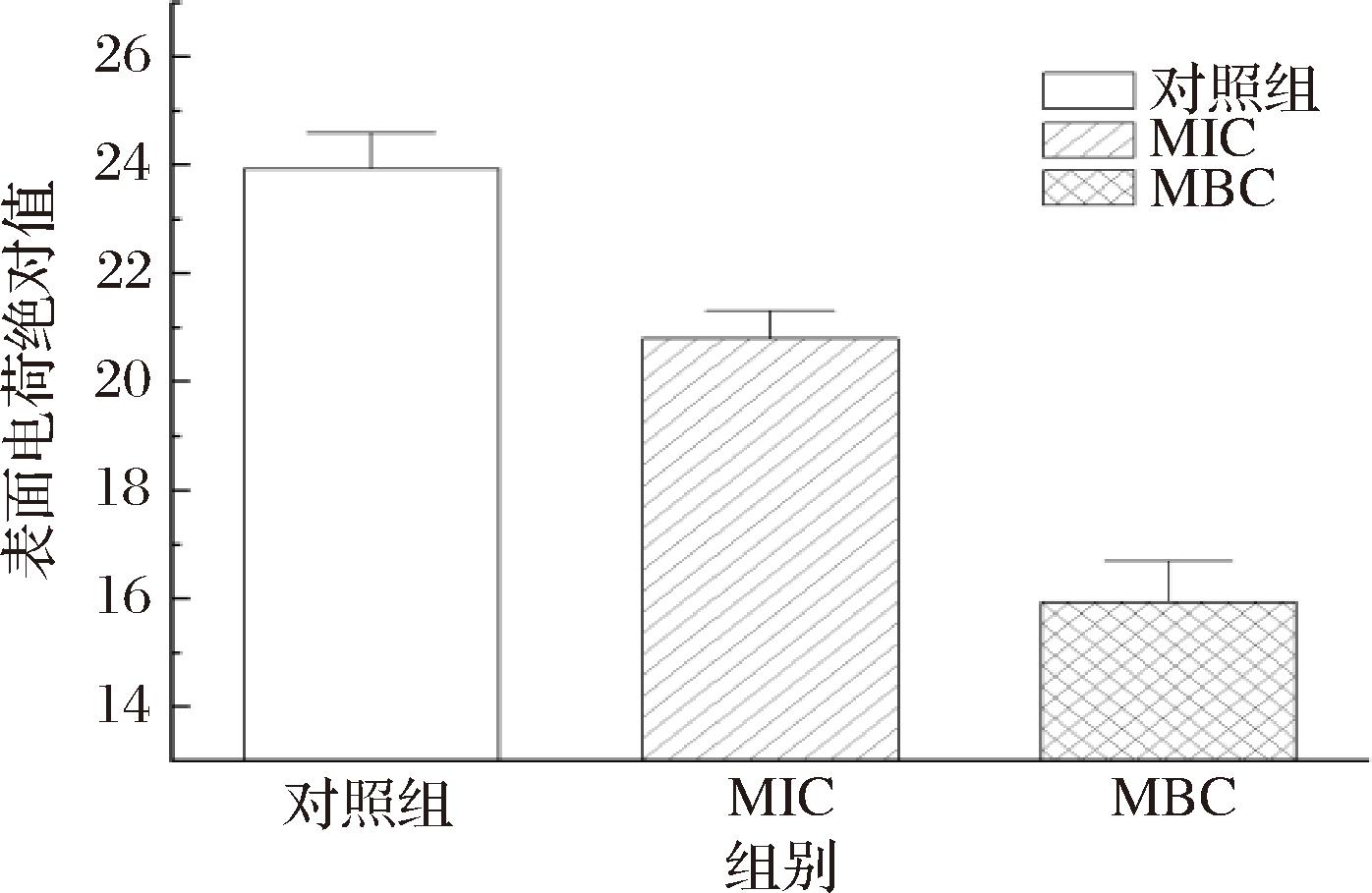
图6 姜黄精油对变异链球菌表面电荷的影响
Fig.6 The effect of turmeric essential oil on the surface charge of S.mutans
2.3.3 变异链球菌细胞膜完整性的影响
如图7-a所示,无姜黄精油处理的变异链球菌细胞发出明亮的绿色荧光,说明变异链球菌的细胞是活细胞,只有绿色荧光探针SYBR Green Ⅰ被水解的荧光素在细胞膜完整的活细胞中积累;经MIC姜黄精油处理的变异链球菌(图7-b),绿色荧光强度比无姜黄精油处理组明显减弱,而红色荧光强度增强,表明由于部分变异链球菌细胞遭受损伤所致,部分红色荧光染料PI进入细胞质膜受损的细胞。经MBC姜黄精油处理的变异链球菌(图7-c),几乎都是红色荧光,表明变异链球菌在MBC下,几乎所有菌体细胞膜都被破坏,致使细胞死亡。

a-无姜黄精油;b-MIC姜黄精油;c-MBC姜黄精油
图7 姜黄精油对变异链球菌细胞膜形态的影响
Fig.7 The effect of turmeric essential oil on the membrane morphology of S.mutans cells
2.3.4 电解质泄露情况的分析
由图8可知,没有被姜黄精油处理的变异链球菌的电导率无变化,MIC姜黄精油处理的变异链球菌的电导率在0~4 h电导率有较升高的趋势,4~8 h处于升高较缓慢。MBC姜黄精油处理的变异链球菌在0~8 h电导率均有特别明显的升高,说明在MBC下,姜黄精油使变异链球菌细胞膜破裂,导致细胞内部的离子被释放至菌体外部环境,引发了菌悬液电导率的显著提升。由于姜黄油能够攻击细胞膜,使其细胞受损,离子稳态失衡,影响菌体的代谢,最终导致菌体死亡[20]。
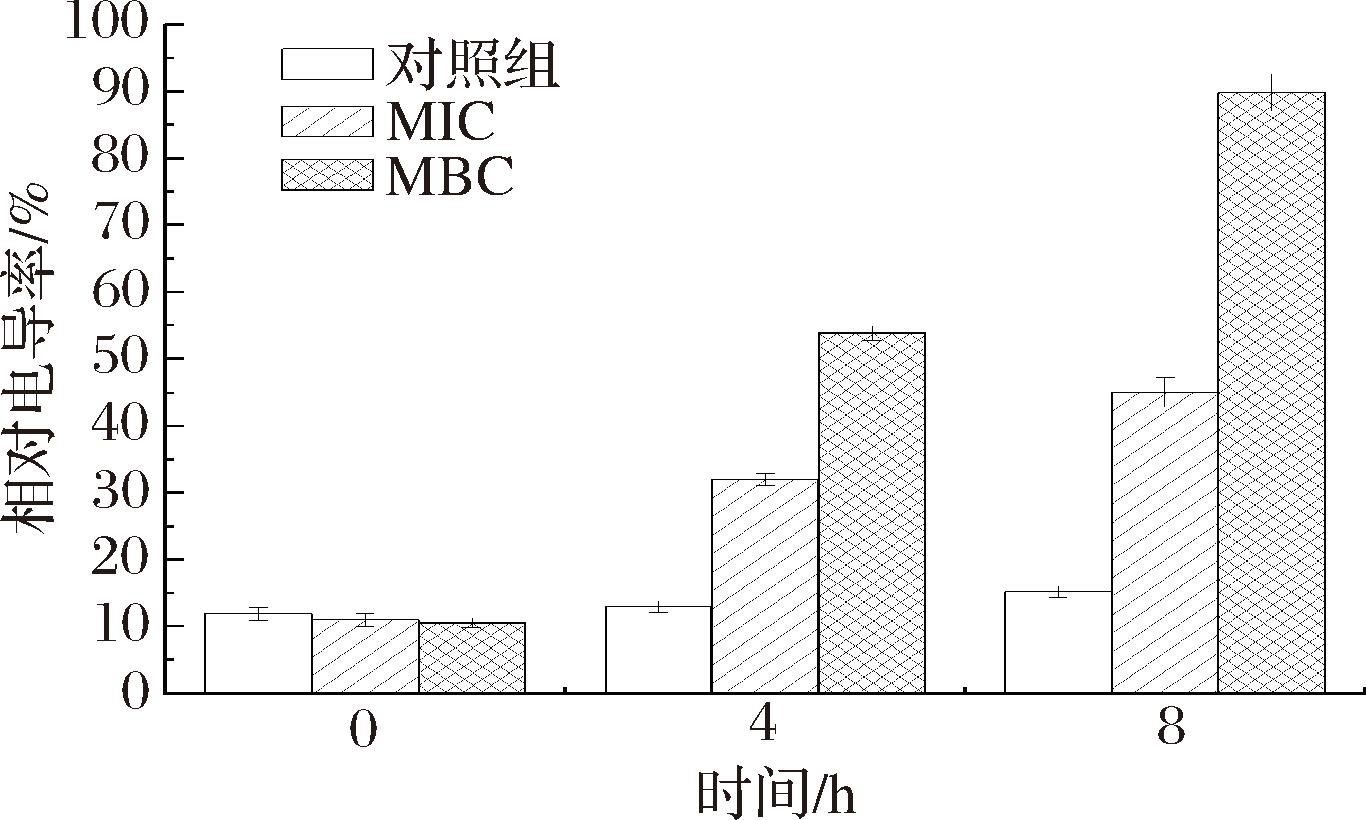
图8 姜黄精油对变异链球菌电导率的影响
Fig.8 The effect of turmeric essential oil on the conductivity of S.mutans
3 讨论与结论
3.1 姜黄精油成分
姜黄材料的产地、贮存条件、植物年龄、季节、采摘时间、成熟期以及气候等不同对姜黄精油的成分有一定的影响。此外,提取时间以及提取工艺条件的不同对精油的组分含量也有决定性作用。本实验采用微波预处理-超声波辅助水蒸气蒸馏法提取姜黄精油,共鉴定出7个化合物,按含量最高排列依次是姜黄酮(32.56%)、α-姜烯(26.33%)、β-倍半水芹烯(16.29%)、芳姜黄酮(10.53%)、β-姜黄素(7.73%)、β-红没药烯(3.32%)和α-姜黄烯(3.25%)。前人对姜黄精油的提取常采用水蒸气蒸馏法,化合物种类多,且主要化合物含量没有微波预处理-超声波辅助水蒸气蒸馏法提取的姜黄精油高。李洁[21]采用水蒸气蒸馏法,鉴定出不同时期和部位的姜黄挥发油有94种化合物。杨晓娜等[22]用水蒸气蒸馏法、微波辅助水蒸气蒸馏法和超声波辅助水蒸气蒸馏法提取了姜黄精油,分别鉴定出25、27和17个化合物。杨海艳等[23]采用水蒸气蒸馏法提取的姜黄精油鉴定出47种化合物。羊青等[24]的研究表明不同采收期姜黄精油的化学成分基本相同,但相对含量存在差异。黄惠芳等[25]研究表明,不同温度条件下获得的姜黄精油成分及其相对含量基本一致。
3.2 姜黄精油抑菌活性
姜黄精油对变异链球菌菌的MIC为0.25 mg/mL,MBC为0.50 mg/mL,抑菌圈大小分别为7.48、9.69 mm。已有研究表明,姜黄精油对大肠杆菌、黑曲霉[26]、酵母菌、青霉、枯草芽孢杆菌[27]、豇豆疫霉、禾谷丝核菌、稻瘟病菌、尖镰孢菌黄瓜专化型[28]。董雪容[29]的研究表明,姜黄精油对单核增生李斯特菌效果最明显,其抑菌圈为11.75 mm,MIC为6.25 mL/L,其次是伊氏李斯特菌、枯草芽孢杆菌和大肠杆菌。研究姜黄精油对变异链球菌的抑制作用暂未见报道。
3.3 姜黄精油抑菌机理
在培养基中加入MIC和MBC的姜黄精油后,变异链球菌的生长被完全抑制、生长停滞或死亡,部分菌体细胞膜破裂,菌体的稳定性变差,细胞内物质流出,表面电荷减少,电导率升高缓慢或显著升高,与对照组相比,姜黄精油具有抑制变异链球菌的作用。这与前人的研究结果相似[30-31]。董雪容[29]研究发现,姜黄油对单核増生李斯特菌的细胞结构破坏严重,细胞出现内陷、皱缩、破损甚至出现孔洞,内部组织明显被破坏,导致细胞内容物泄露。从而导致细胞无法正常繁殖,达到了抑菌效果。郭夏蕾等[32]的研究表明植物乳杆菌可通过破坏变异链球菌细胞膜的通透性抑制菌体的生长。本研究表明,姜黄精油通过破坏菌体细胞结构,使其细胞膜通透性紊乱,胞内物质渗漏,从而导致菌体细胞死亡。
综上分析可知,通过微波预处理-超声波辅助水蒸气蒸馏法提取的姜黄精油,其化合物组分少,且主要活性成分含量较高,对变异链球菌有较好的抑制活性,有利于姜黄的深加工及口腔产品的开发与利用,但还需要更多技术指标进行体内外评价,此方面的研究工作正在深入开展。
[1] 王素苹,方立新,陶地豪,等.精氨酸对变异链球菌生物膜及牙骨质再矿化作用的体外研究[J].郑州大学学报(医学版),2024,59 (1):67-71.
WANG S P,FANG L X,TAO D H,et al.Effects of arginine on Streptococcus mutans biofilm and remineralization of artificial cementum lesions:In vitro study[J].Journal of Zhengzhou University(Medical Sciences),2024,59(1):67-71.
[2] 宋玉梦,周红艳,黄鑫,等.茶树精油对变异链球菌抑菌浓度及效力的探究[J].实用口腔医学杂志, 2020, 36(5):701-705.
SONG Y M,ZHOU H Y,HUANG X,et al.A preliminary study on the effects of tea tree oil against Streptococcus mutans[J].Journal of Practical Stomatology, 2020, 36(5):701-705.
[3] 邢艳霞,祝贺,成双双,等.蒲公英叶提取物对龋齿菌的抑菌活性研究[J].中国果菜,2023,43(12):21-26.
XING Y X,ZHU H,CHENG S S,et al.Study on the bacteriostatic activity of dandelion leaf extract against caries bacteria[J].China Fruit &Vegetable,2023, 43(12):21-26.
[4] 秦苏佳,徐晚晴,张秋香,等.植物乳杆菌CCFM8724对致龋双菌生物膜的抑制作用[J].食品与发酵工业,2020,46(13):127-132.
QIN S J,XU W Q,ZHANG Q X,et al.Inhibitory effect of Lactobacillus plantarum CCFM8724 on caries-causing dual biofilms[J].Food and Fermentation Industries,2020,46(13):127-132.
[5] 邹文海,达春瑶,肖颖欣,等.桑酮G对变异链球菌生长和生物被膜形成的影响[J].微生物学通报,2025,52(1): 350-362.
ZHOU W H, DA C Y, XIAO Y X, et al.Effects of kuwanon G on the growth and biofilm formation of Streptococcus mutans[J].Microbiology China, 2025,52(1): 350-362.
[6] 闫翱翔,高苏亚,唐一梅,等.陕西姜黄挥发油的提取与GC-MS测定[J].化工科技,2021,29(1):7-10;15.
YAN A X,GAO S Y,TANG Y M,et al.Extraction of volatile oils in turmeric and determination by GC-MS[J].Science&Technology in Chemical Industry,2021,29(1):7-10;15.
[7] 陈梦奇,周鸣睿,韩娅红.姜黄素在食品中的应用研究进展[J].中国食品添加剂,2022,33(10):292-300.
CHEN M Q,ZHOU M R,HAN Y H.Research progress on the application of curcumin in food[J].China Food Additives,2022,33(10):292-300.
[8] 吴斌.姜黄油的提取、抑菌活性及姜黄色素的纯化研究[D].长沙:中南林业科技大学,2009.
WU B.Study on the extraction and antibacteria activity of turmeric oil and the purification of curcumin[D].Changsha:Central South University of Forestry and Technology,2009.
[9] 蓝波妙.泉州地区姜黄挥发油成分分析及抑菌效果研究[J].热带农业科学,2020,40(10):96-100.
LAN B M.Composition analysis and bacteriostatic effect of turmeric volatile oil in Quanzhou area[J].Chinese Journal of Tropical Agriculture,2020,40(10):96-100.
[10] 卢彩会,牟德华.姜黄油的抗炎镇痛及体外抗氧化活性[J].食品科学,2018,39(1):243-249.
LU C H, MOU D H.Antiinflammatory, analgesic and in vitro antioxidant activities of turmeric oil[J].Food Science, 2018,39(1):243-249.
[11] 雷慧.姜黄油降血脂与抗肿瘤活性研究[D].南京:南京中医药大学,2013.
LEI H.Studies on anti-hyperlipemia and anti-tumor activities of turmeric oil[D].Nanjing:Nanjing University of Chinese Medicine,2013.
[12] 公衍玲,王宏波,金宏.郁金挥发油提取工艺及其抑菌活性研究[J].医药导报,2009,28(2):170-172.
GONG Y L,WANG H B,JIN H.Study on extraction technology and antibacterial activity of volatile oil from Curcuma aromatica[J].Herald of Medicine,2009,28 (2):170-172.
[13] 张林会,邓楠,旷春桃.七种植物精油的抗菌活性及其抑菌成分分析[J].中国调味品,2023,48(2):31-34.
ZHANG L H,DENG N,KUANG C T.Antimicrobial activity of seven kinds of plant essential oils and analysis of their antimicrobial components[J].China Condiment,2023,48 (2):31-34.
[14] NEGI P S, JAYAPRAKASHA G K, RAO L M, et al.Sakariah, Antibacterial activity of turmeric oil:A byproduct from curcumin manufacture[J] Journal of Agricultural and Food Chemistry, 1999,47(10):4297-4300.
[15] 刘西岭,郭俊芳,程楠,等.超声-微波辅助提取柑橘皮精油工艺及抗氧化活性研究[J].贵州师范大学学报(自然科学版),2023,41(2):47-55.
LIU X L,GUO J F,CHENG N,et al.Study on ultrasonic-microwave assisted extraction of essential oil from Citrus peel and its antioxidant activity[J].Journal of Guizhou Normal University (Natural Sciences),2023,41(2):47-55.
[16] 吴红洋.气相色谱-质谱法测定药用复合膜中16种光引发剂的残留量[J].药物分析杂志,2024,44(5):851-858.
WU H Y.Determination of 16 photoinitiator residuces in medicinal composite membranes with gas chromatography-mass spectrometry[J].Chinese Journal of Pharmaceutical Analysis,2024,44(5):851-858.
[17] 高海荣,黄振旭,李霞,等.河南产白蒿精油的化学成分分析及抑菌活性研究[J].食品研究与开发,2020,41(7):69-74.
GAO H R,HUANG Z X,LI X,et al.Study on chemical composition and antibacterial activity of the essential oil of herba artimisiae sieversianae from Henan province in China[J].Food Research and Development,2020,41(7):69-74.
[18] 孙月,曾朝懿,李梓钰,等.山苍子精油对白假丝酵母菌细胞膜屏障影响的机理[J].食品科学,2023,44(17):29-35.
SUN Y,ZENG C Y,LI Z Y, et al.Mechanism for the effect of Litsea cubeba essential oil on Candida albicans cell membrane barrier[J].Food Science,2023,44(17):29-35.
[19] DIAO W R, HU Q P, ZHANG H, et al.Chemical composition, antibacterial activity and mechanism of action of essential oil from seeds of fennel (Foeniculum vulgare Mill.)[J].Food Control, 2014, 35(1):109-116.
[20] ZHANG Y B, LIU X Y, WANG Y F, et al.Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J].Food Control,2016,59:282-289.
[21] 李洁.姜黄油细胞发育及挥发油生物活性谱效关系研究[D].泉州:华侨大学,2021.
LI J.The oil cell development and the volatile oil spectrum-effect relationship of Curcuma longa L.[D].Quanzhou:HuaQiao University,2021.
[22] 杨晓娜,艾薇,李悦,等.基于三种方法提取的腾冲野生姜黄精油成分比较及抗氧化活性研究[J].中国食品添加剂,2024,35(5):84-92.
YANG X N,AI W,LI Y,et al.Comparison of components and antioxidative activities of turmeric essential oil from Chongteng Curcuma longa L.by three extraction methods[J].China Food Additives,2024,35(5):84-92.
[23] 杨海艳,赵天明,张显权,等.五种黔产药食同源植物精油抗氧化活性比较及成分分析[J].中国调味品,2021,46(3):127-135.
YANG H Y,ZHAO T M,ZHANG X Q,et al.Comparison of antioxidant activity and composition analysis of essential oils from five medicinal and edible plants in Guizhou[J].China Condiment,2021,46(3):127-135.
[24] 羊青,晏小霞,王茂媛,等.不同采收期海南姜黄挥发油的GC-MS分析[J].热带作物学报,2014,35(9):1866-1870.
YANG Q,YAN X X,WANG M Y,et al.Analysis of essential oils from Curcuma longa L.in Hainan with different harvest time by GC-MS[J].Chinese Journal of Tropical Crops, 2014,35(9):1866-1870.
[25] 黄惠芳,陈跃新,梁立娟,等.不同温度条件下分子蒸馏姜黄精油收率及其成分的GC-MS分析[J].食品工业科技,2012,33(1):265-267.
HUANG H F,CHEN Y X,LIANG L J,et al.Yield of molecular distillation turmeric oil under different temperature conditions and its components analysis by GC-MS[J].Science and Technology of Food Industry, 2012,33(1):265-267.
[26] 胡小军,李凤侠.姜黄油抑菌作用的研究[J].食品研究与开发,2006,27(5):30-31.
HU X J,LI F X.Study on the Antibacterial effect of Curcuma loonga Oils[J].Food Research and Development,2006,27(5):30-31.
[27] 齐莉莉,王进波.姜黄提取物的抗氧化及抗菌活性研究[J].中国调味品,2008, 33(2):72-73;83.
QI L L,WANG J B.Studies on the antioxidant and antibacterial activities of Curcuma longa L.extracts[J].China Condiment, 2008, 33(2):72-73;83.
[28] 高富涛,孙淑君,游秀峰,等.肉桂精油和姜黄油对四种植物病原菌的抑制作用[J].湖北农业科学,2023,62(9):74-77.
GAO F T,SUN S J,YOU X F,et al.Inhibitory effects of cinnamon essential oil and turmeric oil against four plant pathogens[J].Hu Bei Argricultural Sciences,2023,62(9):74-77.
[29] 董雪容. 姜黄油的抑菌机理及脂质体制备与性能研究[D].长沙:中南林业科技大学,2023.
DONG X R.Study on antibacterial mechanism,loposome pre paration and of pro perties of turmericoilby[D].Changsha:Central South University of Forestry and Technology,2023.
[30] ZHANG X R, JIANG Z Y, YUAN H, et al.Influence of surface zeta potential on adhesion of Chlorella sp.to substratum surfaces[J].Advanced Materials Research, 2013, 690693:1431-1434.
[31] LIU X, CAI J X, CHEN H M, et al.Antibacterial activity and mechanism of linalool against Pseudomonas aeruginosa[J].Microbial Pathogenesis, 2020, 141:103980.
[32] 郭夏蕾,张健,杨贞耐.抑制口腔变异链球菌的乳酸菌筛选及其抑菌机理[J].食品科学,2016,37(19):117-122.
GUO X L,ZHANG J,YANG Z N.Screening of lactic acid bacteria for inhibiting oral Streptococcus mutans and preliminary study of antibacterial mechanism[J].Food Science,2016,37(19):117-122.