单宁(tannin)是植物中的一类多酚聚合物,可与蛋白质络合,还会产生收敛感觉和苦涩味道,造成食品、饮料品质不佳[1-2]。近年来通过化学结构鉴定,发现不同来源的单宁结构存在差异,例如五倍子单宁结构以一个葡萄糖为核心,利用分子内的酯键将葡萄糖与多个没食子酰基相连接,而塔拉单宁是没食子酰及聚没食子酰的奎尼酸酯的混合物,两者均可作为原料分解制备没食子酸,被广泛用于食品添加剂、医药中间体和化工原料[3-4]。因此,单宁的高效降解不仅可以改善食品的品质,而且有利于扩展在其他领域的高值利用。
单宁酶(tannase,EC 3.1.1.20)能够催化单宁酸中的多羟基醇和没食子酸之间的酯键以及2个没食子酸间的缩酚酸键的水解,产生葡萄糖和没食子酸,从而用于降解单宁物质和制备没食子酸[5-6]。目前,单宁酶的生产主要采用微生物发酵法[7-8],生产该酶主要的菌属为曲霉属和青霉属,优势产酶菌株集中于黑曲霉(Aspergillus niger),例如黑曲霉N5-5固体发酵所产单宁酶在提取、纯化、浓缩后,酶活力能达到258.53 U/mL,可水解100~500 g/L的单宁酸[9]。与固态发酵相比,液态发酵所得单宁酶的酶活力偏低,但其发酵参数易控制,是最常用的产单宁酶方式。近年来,采用传统诱变和基因工程育种的方法,已有效提高了单宁酶的酶活力,例如青霉EZ-ZH190在经过热处理诱变后,单宁酶活力提升了约2倍左右[10]。使用毕赤酵母表达系统,烟曲霉中的单宁酶得到了有效表达,发酵上清液中活力达到8.93 U/mL[11]。常温常压等离子体(atmospheric room temperature plasma,ARTP)诱变具有安全性高、操作简便、突变率高等特点,是微生物育种领域的一种常用且有效的诱变手段[12-13],但在选育高产单宁酶的黑曲霉菌株方面鲜有报道。优化培养基配方和控制发酵条件是提升酶产量的关键技术手段,例如WU等[14]对塔宾曲霉培养基中碳源、氮源的组成和浓度进行调整,使其发酵产单宁酶能力提升3倍左右。此外,不同菌株的单宁酶在分子质量大小和催化特性方面呈现出差异,多数在30~60 ℃热稳定性好,在pH 3.0~8.0条件下稳定[15-17]。综上,使用黑曲霉进行液体发酵产单宁酶的过程中,菌种的产酶性能、发酵工艺与单宁酶性质仍需要进一步探索,以提高产酶水平,进而降低酶解反应成本。
为提升黑曲霉在液体发酵水平上产单宁酶的能力,本研究将对实验室保藏的黑曲霉LH菌株进行ARTP诱变筛选,得到遗传性状稳定的产单宁酶的优势菌株,并通过优化发酵条件提升优势菌株的产酶性能。在此基础上,对发酵所得酶液的酶学性质进一步开展评价,为实现单宁酶的商业化生产以及没食子酸等高值产品的酶法制备提供研究基础,研究路线见图1。
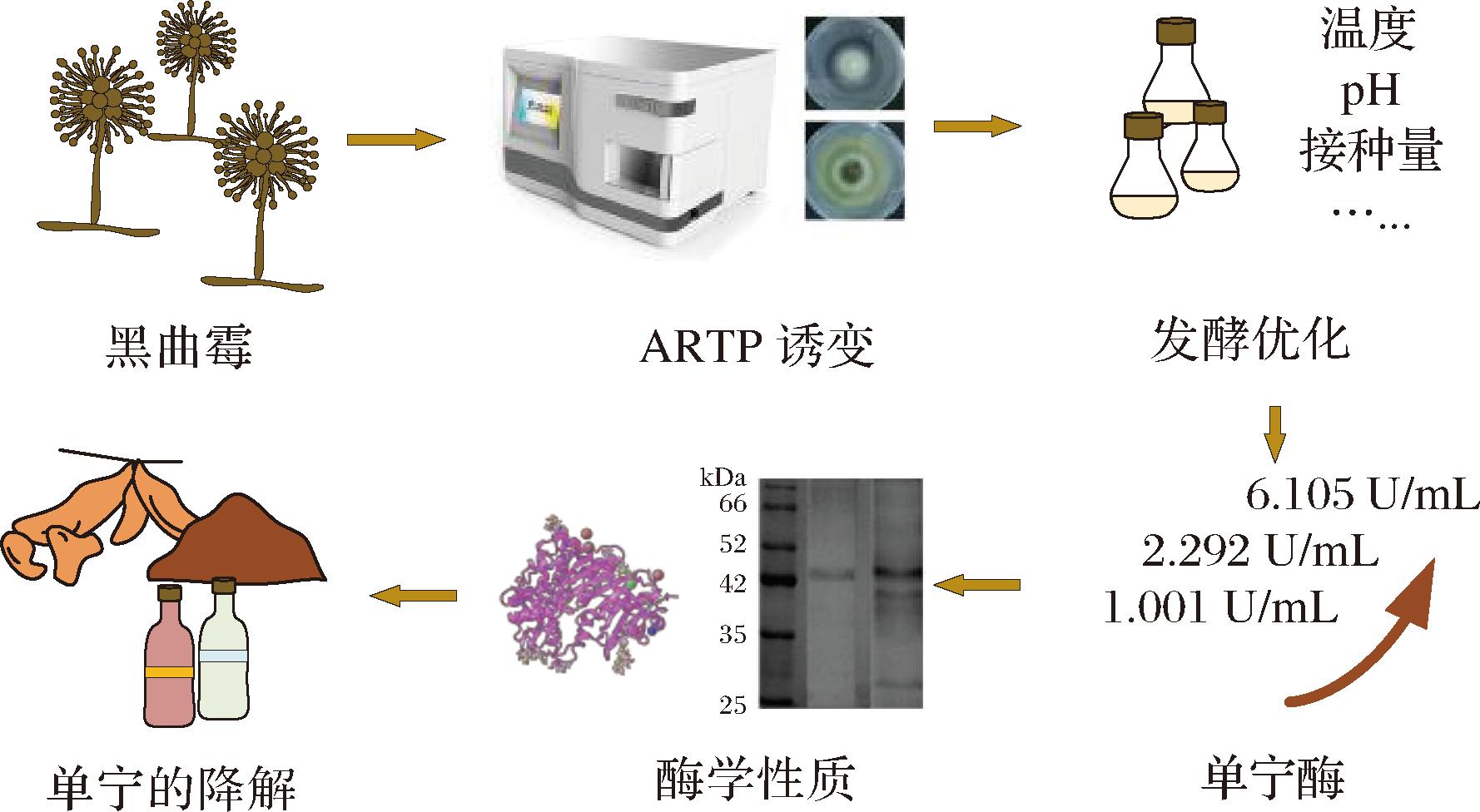
图1 黑曲霉LH的诱变选育、发酵优化及酶学性质考察
Fig.1 Mutation breeding, fermentation optimization, and enzymatic properties of tannase in Aspergillus niger LH
1 材料与方法
1.1 材料
1.1.1 菌种
黑曲霉LH,保藏于本实验室-80 ℃冰箱。
1.1.2 试剂
单宁酸、没食子酸、绕丹宁,上海麦克林生化科技有限公司;没食子酸丙酯,上海迈瑞尔生化科技有限公司;溴酚蓝,上海展云化工有限公司;硝酸钠,天津恒兴化工试剂制造有限公司;甲醇和培养基其他组分,国药集团化学试剂有限公司。
1.1.3 培养基
PDA固体培养基(g/L):马铃薯200,葡萄糖20,琼脂粉20。
固体初筛培养基(g/L):单宁酸20,蔗糖20,硝酸钠3,磷酸氢二钾1,七水硫酸镁0.5,氯化钾0.5,硫酸亚铁0.01,琼脂粉20,溴酚蓝0.04。
液态发酵复筛培养基(g/L):单宁酸10,葡萄糖20,硝酸钠3,磷酸氢二钾1,七水硫酸镁0.5,氯化钾0.5,硫酸亚铁0.01。
基础液态发酵培养基(g/L):葡萄糖10,酵母浸粉20,硫酸铵5,七水硫酸镁0.5,磷酸氢二钾 0.01,氯化钾0.005,七水硫酸亚铁 0.000 1,吐温-80两滴/100 mL,单宁酸10。
以上培养基于115 ℃下灭菌25 min。
1.2 仪器与设备
ARTP-M型常温常压等离子体诱变仪,无锡源清天木生物科技有限公司;SQ510C型立式压力蒸汽灭菌器,重庆雅马拓科技有限公司;LRH-250A型生化培养箱,泰宏医疗器械有限公司;ZQZY-78BV型恒温培养摇床,上海知楚仪器有限公司;GL21M型高速冷冻离心机,湖南湘立科学仪器有限公司;UV1800型紫外可见分光光度计,日本岛津有限公司;PHS-3C型精密pH计,上海图新电子科技有限公司;EX3I型光学显微镜,宁波舜宇仪器有限公司。
1.3 实验方法
1.3.1 高产单宁酶菌株ARTP诱变选育条件研究
于PDA培养基斜面上活化黑曲霉LH,使用生理盐水制作孢子悬液,使用显微镜下进行计数,并调整浓度为1×107CFU/mL作为孢子原液。在诱变功率100 W、氦气气量10 L/min、间距2 mm的条件下,分别设置不同浓度的孢子悬液(1×107、7×106、5×106、3×106、1×106 CFU/mL)和不同诱变照射时间(0、80、160、240、320、400、500 s)进行诱变处理。样品处理结束后,用无菌镊子将载片移至装有生理盐水的无菌离心管中,于振荡器上振荡5 min,使附着在金属载片上的孢子均匀洗脱到液体中,形成新的孢子悬液,并稀释涂布在含有单宁酸的固体初筛平板上进行培养。
1.3.2 正突变菌株的筛选及遗传稳定性考察
初筛平板于28 ℃下培养4~5 d,用直尺测量菌落的直径(D)与变色圈直径(H),以H/D比值衡量菌株产单宁酶的能力,挑选比值较大的菌株进行复筛。初筛得到的黑曲霉突变菌株接种于PDA斜面培养6 d,制备108 CFU/mL孢子悬液,以2%的接种量接种至液态发酵培养基中,在28 ℃、200 r/min的条件下发酵2 d后测定酶活力。高产单宁酶正突变株接种于PDA斜面培养基上进行传代培养,每传一代进行发酵,测定培养液单宁酶活力,共传代7次以考察突变株的遗传稳定性。
1.3.3 液态发酵的发酵工艺优化
分别设置不同的单宁酸浓度(5、10、20、40、60 g/L)、葡萄糖浓度(10、20、40、60、80 g/L)、酵母浸粉浓度(3.5、7、14、21、28 g/L)、接种量(0.5%、1%、2%、4%、6%)、pH(3、4、5、5.5、6)、发酵温度(20、28、36、44、51 ℃)进行单因素试验,选择影响因素和水平,开展正交设计,实验设计见表1,进行5因素4水平的发酵工艺优化。
表1 正交试验的因素水平表
Table 1 Factor level for orthogonal experiments
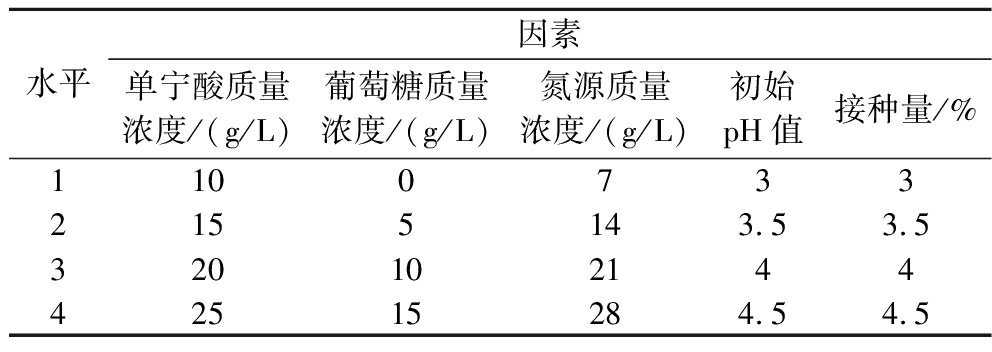
水平因素单宁酸质量浓度/(g/L)葡萄糖质量浓度/(g/L)氮源质量浓度/(g/L)初始pH值接种量/%11007332155143.53.532010214442515284.54.5
1.3.4 单宁酶的酶活力测定
用pH 5.0的磷酸氢二钠-柠檬酸缓冲液配制不同浓度的没食子酸标准溶液,取0.5 mL的没食子酸标准溶液与0.3 mL甲醇绕丹宁溶液(6.67 g/L),加入到试管中混合均匀,30 ℃水浴5 min,再加入4.2 mL的KOH溶液,30 ℃保温10 min。以缓冲液代替标准溶液作空白对照,于520 nm处测定吸光值。以浓度为横坐标,A520吸光度为纵坐标绘制标准曲线。在测定单宁酶的酶活力时,以0.25 mL 0.01 mol/L没食子酸丙酯作为底物,加入0.25 mL的待测酶液后,于 30 ℃水浴中保温5 min后,测定没食子酸含量,以每分钟生成1 μmol没食子酸所需的酶量为1个酶活力单位[18]。
1.3.5 生长曲线、产酶曲线与残糖的测定
将突变株LH2301接种于正交优化后的液态发酵培养基中,于28 ℃下进行培养,每隔6 h取出一瓶,过滤收集菌丝体和发酵液。菌体用清水反复洗涤,先置于玻璃培养皿于恒温干燥箱80 ℃干燥1 h,然后进行冷冻干燥至恒重,测定菌体干重。发酵液定容至100 mL,测定发酵液粗酶酶活力。另取发酵液样品液适当稀释,使糖质量浓度为0.1~1.0 mg/mL,采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定发酵液中的还原糖浓度[19]。
1.3.6 单宁酶液的纯化
采用硫酸铵对发酵液进行分级沉淀,将沉淀物溶解于pH 5.0、0.1 mol/L的磷酸氢二钠-柠檬酸缓冲液,并用10 kDa的超滤离心管进行浓缩,得到单宁酶初步纯化液,并采用SDS-PAGE和Native-PAGE分别确定单宁酶单亚基和多聚体的分子质量。
1.3.7 单宁酶的酶学性质考察
取酶液分别于20、30、40、50、60、70、80 ℃下水浴30 min预热,加入底物溶液继续置于该温度下反应,测定反应后没食子酸的增加量来计算出不同温度下单宁酶的活力,将酶活力的最高值定为100%,计算各温度下的相对活力,考察不同温度对黑曲霉LH2301所产单宁酶的酶学性质影响。
制备pH值为3.0、4.0、5.0、6.0、7.0的没食子酸丙酯溶液,将酶液与相应的缓冲液进行混合稀释至对应的pH,测定不同pH条件的单宁酶的酶活力,将酶活力的最高值定为100%,计算各pH条件下的相对活力,考察不同pH对黑曲霉LH2301产单宁酶的酶学性质影响。
由于绕单宁可能与金属离子发生作用而影响酶活力测定,在此参考王喆丽[20]的测定方法,向反应体系中加入1 mmol/L的Mg2+、Na+、Ca2+、Cu2+、Ba2+、Mn2+、Al3+、Zn2+、K+、Co2+溶液,测定相对酶活力,考察不同金属离子对单宁酶活力的影响。将Ca2+、K+、Al3+的浓度调整为2、4、6、8 mmol/L,测定相对酶活力,考察金属离子的不同浓度对单宁酶活力的影响。
2 结果与分析
2.1 黑曲霉ARTP诱变条件的确定
ARTP诱变利用离子体射流中丰富的活性粒子,实现对微生物的高强度遗传物质损伤和高效突变,能满足不同类型微生物诱变育种的需求[12-13],本研究将此技术用于诱变黑曲霉,以进一步提升菌株的产酶能力。虽然丝状真菌多采用孢子悬液进行诱变处理[21],但是仍缺少孢子悬液浓度对突变效果影响的探究。本研究发现在ARTP诱变处理黑曲霉LH时,随着孢子浓度的递增,菌体的正突变率呈现出先上升后降低的趋势,在3×106 CFU/mL正突变率接近于15%(图2-a),主要是由于当孢子悬液浓度较高时,ARTP诱变产生的化学活性离子作用的孢子数过多,部分孢子诱变效果较差,当孢子悬液浓度过低时,诱变后存活的菌落总数较少,导致正突变率降低。因此,选择3×106 CFU/mL作为诱变实验黑曲霉孢子悬液浓度。
不同丝状真菌在诱变时处理样品的时间会有所差异,黑曲霉c-gahB-17需要诱变处理150 s能够获得较多高表达谷氨酰胺酶的正突变株[22],然而黑曲霉xj仅需处理120 s便能够提升抗菌能力[23]。本研究发现,随着诱变时间延长,黑曲霉LH菌体的致死率在前160 s内急剧上升,处理160 s后致死率相对缓慢上升,处理400~500 s时,致死率到达100%,当诱变时间为240 s时,正突变率达到最高值为22%(图2-b),相对于以上其他黑曲霉的诱变时间要明显延长。上述研究结果表明,最佳的诱变条件为诱变功率100 W、气量10 L/min、间距2 mm、孢子浓度3×106 CFU/mL、诱变时间为240 s。
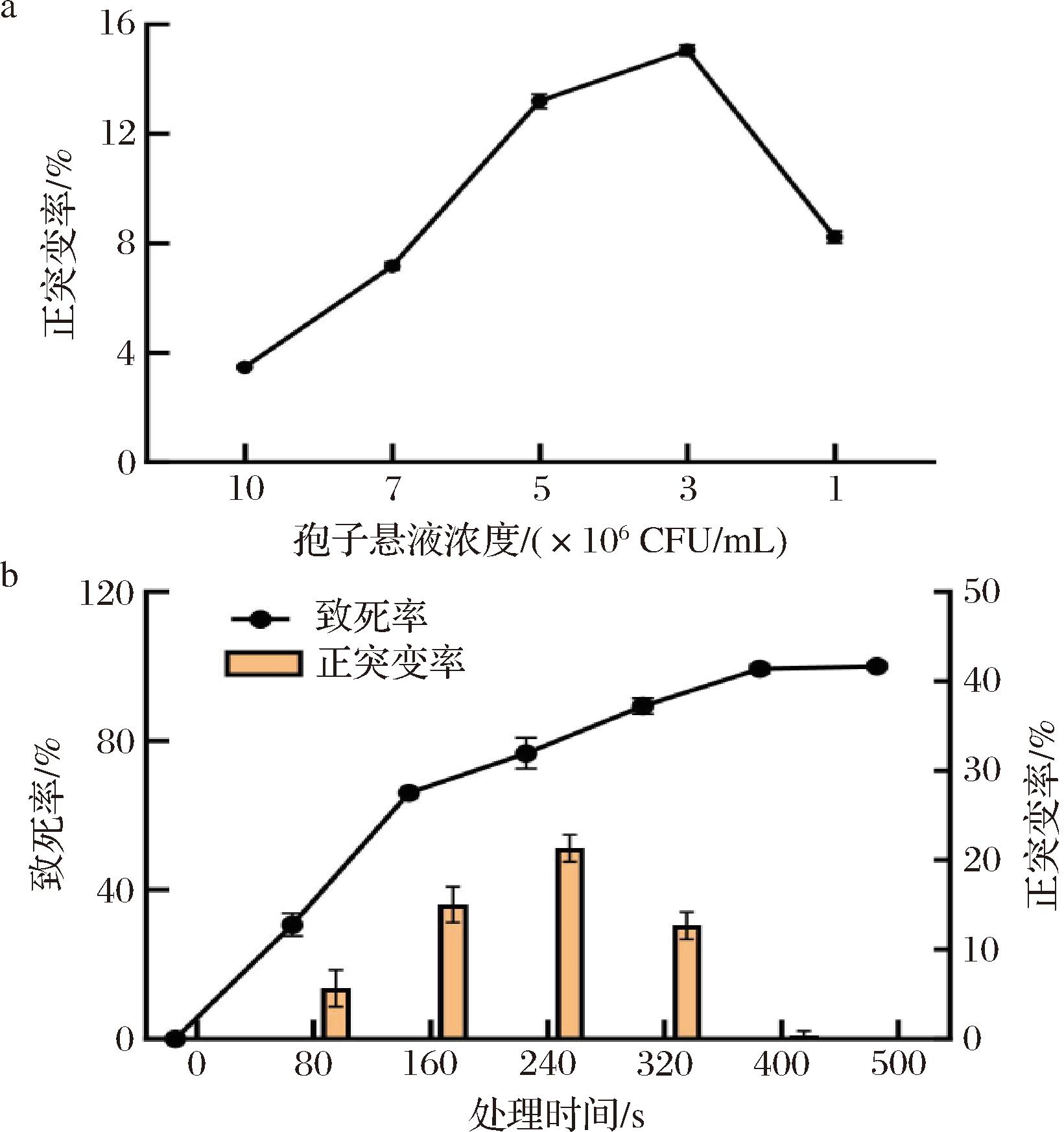
a-不同浓度的孢子悬液;b-不同的处理时间
图2 不同方式的ARTP处理对黑曲霉LH诱变率的影响
Fig.2 Effect of different ARTP treatments on the mutagenic rate of A.niger LH
2.2 高产单宁酶菌株的诱变选育及遗传稳定性考察
在含有单宁酸的培养基中,黑曲霉被诱导产生单宁酶,该酶水解单宁酸生成没食子酸,降低了培养基的pH使溴酚蓝指示剂变色,培养基的颜色会由紫色变为黄色,由此根据H/D,来初步判断菌株的产酶能力(图3-a)。根据以上的平板显色法,挑选出H/D比值相对较大的49株菌株进行摇瓶复筛(图3-b)。结果显示,其中12株诱变菌的产酶能力较好(图3-c)。进一步地,将复筛得到的12株优势菌株接种于PDA斜面培养基上,连续传代7次培养,结果发现突变菌株No.1(命名为LH2301)的遗传稳定性较好,平均酶活力2.292 U/mL,是原始出发菌株酶活力的2.27倍(图3-d)。董弦弦等[24]对炭黑曲霉进行ARTP诱变,所选育出的单宁酶高产菌株的酶活力仅有0.208 U/mL,相比之下,本研究所获得的突变株LH2301将更具有产酶优势。上述结果表明,ARTP诱变筛选能够用于高产单宁酶黑曲霉的菌种选育,但仍需要进一步提升诱变菌株的产酶能力。
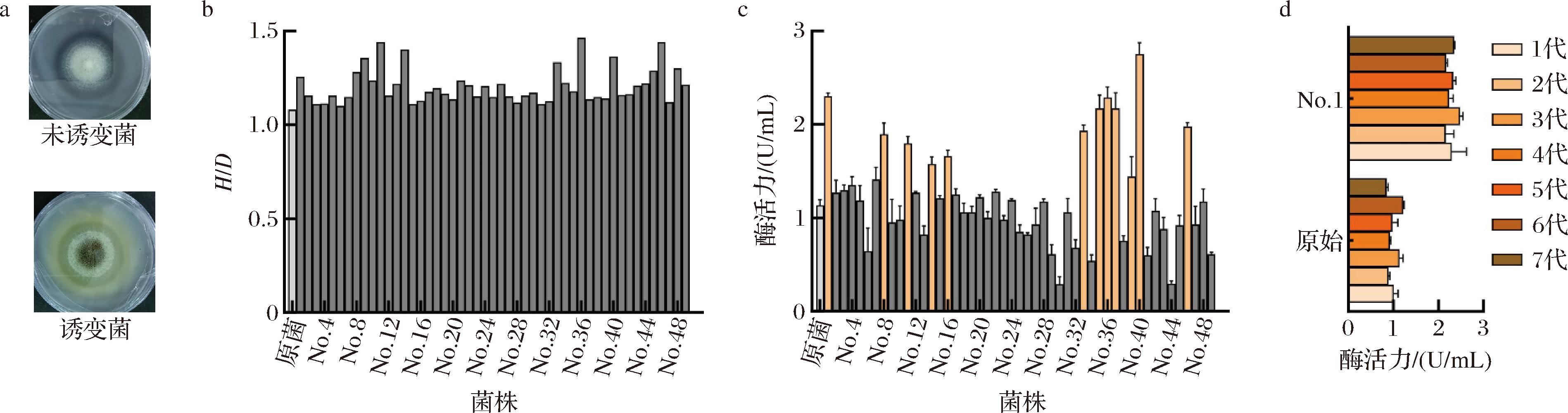
a-产酶菌株的平板显色;b-诱变菌株的显色初筛;c-诱变菌株的摇瓶复筛;d-诱变菌株的稳定性
图3 ARTP诱变菌株的初筛、复筛以及稳定性考察
Fig.3 Screening and stability investigation of ARTP mutant strains
2.3 黑曲霉LH2301产单宁酶的发酵工艺优化
诱变菌株用于生长和产酶的最佳工艺条件可能与出发菌株有较大差异,另外,发酵优化是用于提升菌株发酵性能的常用手段之一,因此,本文先通过单因素试验,确定了20 g/L单宁酸、10 g/L葡萄糖、21 g/L氮源酵母浸粉、28 ℃、pH 4.0和4%接种量,有利于诱变菌株产单宁酶(图4)。
其中单宁酸是作为单宁酶产生的诱导物,诱导过程的实质是黑曲霉分泌单宁酶催化单宁发生降解。在本实验中,单宁酶的酶活力随着单宁酸的浓度呈现出先上升后下降的趋势,这是因为单宁酸会与微生物维持生命活动的酶或者细胞膜结合,高浓度的单宁酸对微生物具有毒性从而影响产酶[25],所以选取20 g/L作为单宁酸的最佳添加浓度。另外,单宁酶的酶活力随着速效碳源葡萄糖的添加量的增加而降低,这主要是由于碳源浓度过高,对黑曲霉的酶表达产生碳阻遏效应[26]。对于氮源而言,充足的氮源一方面满足了黑曲霉的生长代谢,另一方面有利于为单宁酶的合成提供了氨基酸原料,黑曲霉用于产单宁酶的最佳氮源酵母浸粉添加量为21 g/L。
正交试验是发酵优化常用的手段,本部分在单因素的试验结果上,选择影响因素较大的5个因素进行4水平的正交试验。根据表2中极差R值可看出,5种因素影响黑曲霉产酶能力的主次顺序为单宁酸质量浓度>氮源酵母浸粉总用量>葡萄糖质量浓度>初始pH>接种量,由k值大小可知最优组合为A3B2C3D3E2,即葡萄糖质量浓度为5 g/L,氮源质量浓度为21 g/L,初始pH值为4.0,接种量为3.5%,单宁酸质量浓度为20 g/L。
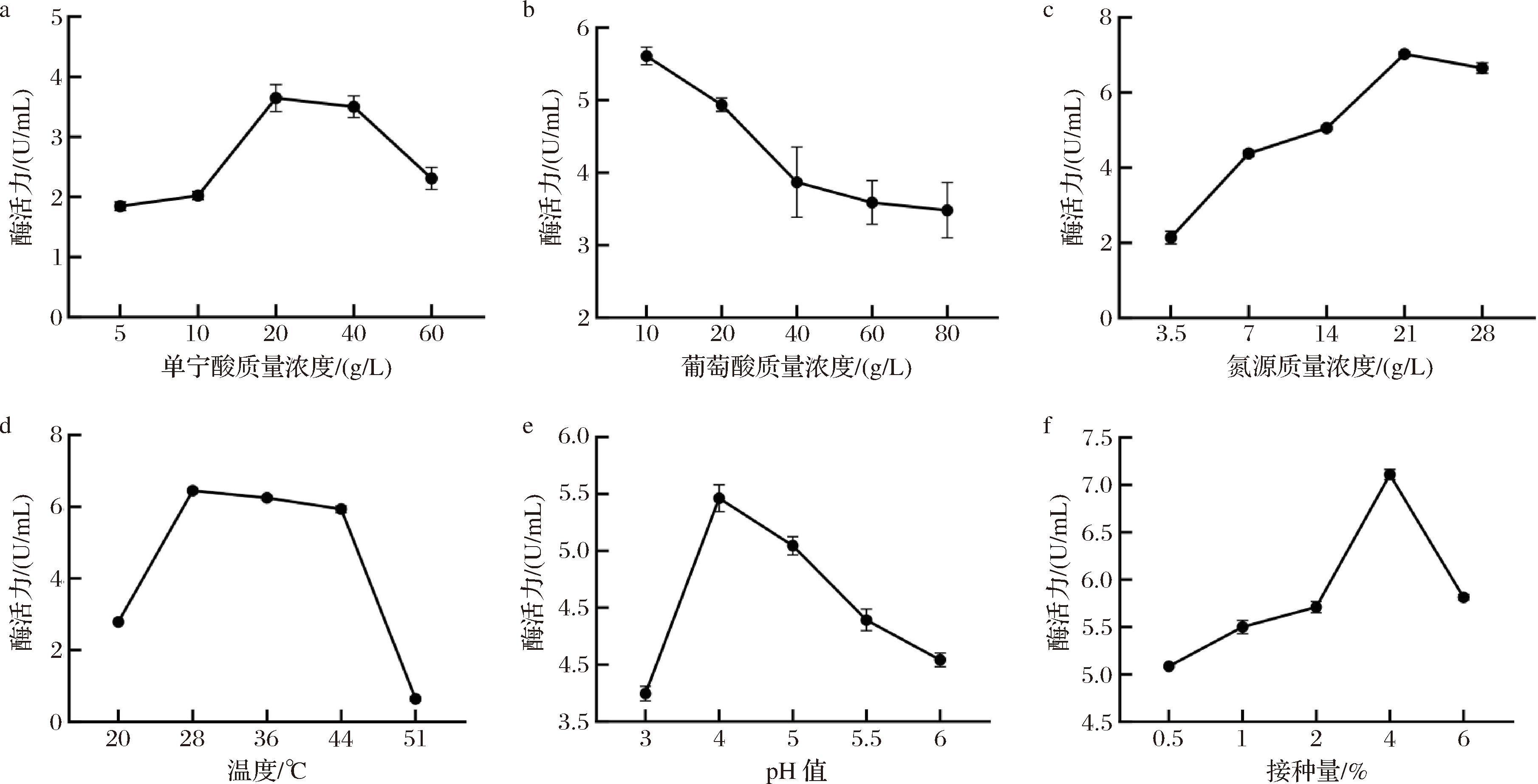
a-不同单宁酸质量浓度;b-不同葡萄糖质量浓度;c-不同氮源质量浓度;d-不同温度;e-不同pH;f-不同接种量
图4 不同培养基成分和培养条件对诱变菌株发酵产酶的影响
Fig.4 Effects of different media components and culture conditions on tannase production by mutant LH2301
表2 正交试验结果
Table 2 Orthogonal experimental results
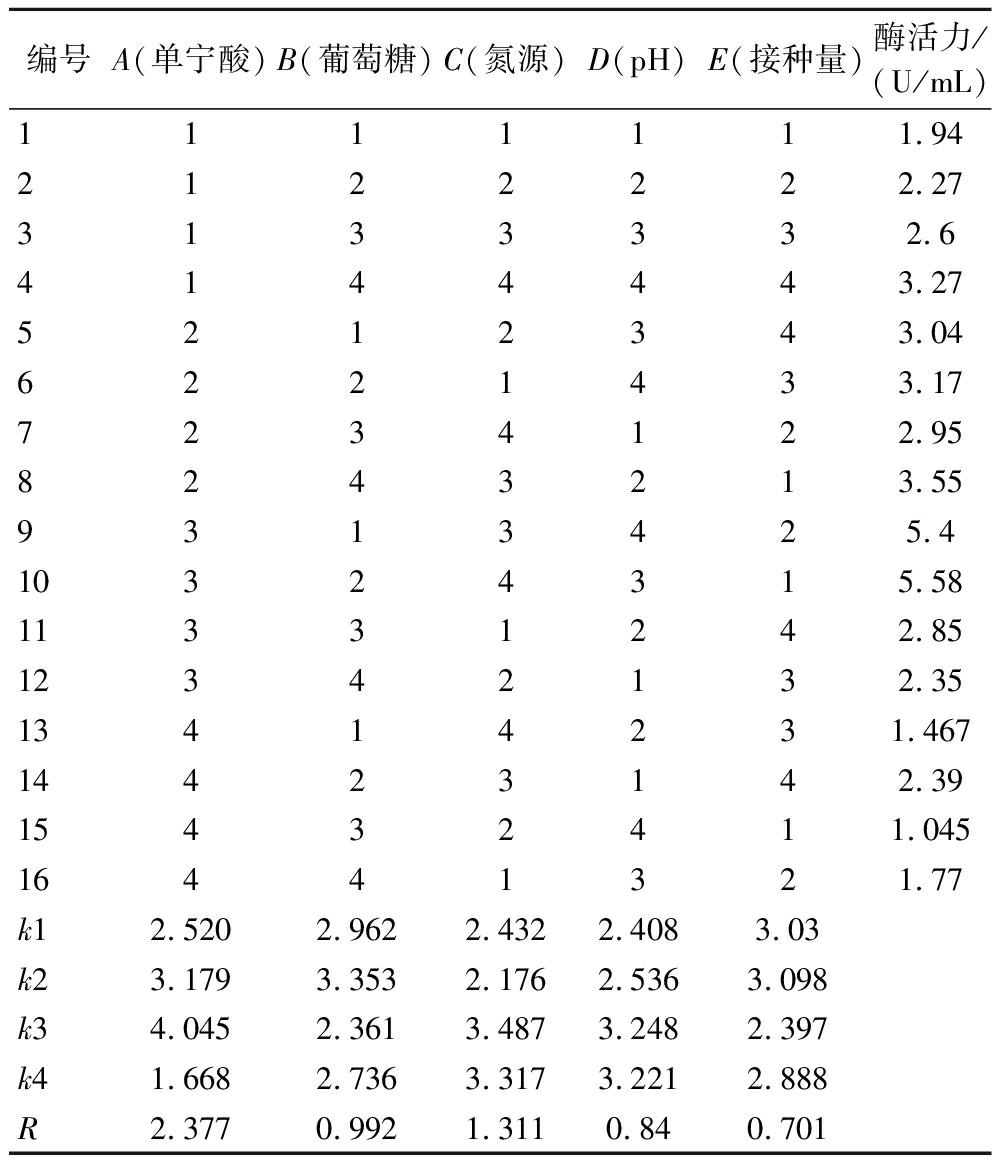
编号A(单宁酸)B(葡萄糖)C(氮源)D(pH)E(接种量)酶活力/(U/mL)1111111.942122222.273133332.64144443.275212343.046221433.177234122.958243213.559313425.410324315.5811331242.8512342132.3513414231.46714423142.3915432411.04516441321.77k12.5202.9622.4322.4083.03k23.1793.3532.1762.5363.098k34.0452.3613.4873.2482.397k41.6682.7363.3173.2212.888R2.3770.9921.3110.840.701
2.4 黑曲霉LH2301液态发酵的产酶验证
按照正交试验优化后的最佳液态发酵工艺培养黑曲霉,分别测定黑曲霉的菌体干重和单宁酶的酶活力(图5)。在0~18 h,菌体生长处于生长延迟期,此时生物量上升缓慢,细胞的生长处于适应阶段。于18 h黑曲霉进入了快速生长期,生物量迅速上涨,在42 h明显减缓,到78 h时菌体量达到最高值,随后进入衰亡期,菌体开始自溶。发酵液中的葡萄糖含量自18 h后呈现急速下降的趋势,在30 h几乎消耗完毕,此时菌体量还在增长,主要是因为所添加的单宁酸会被降解为可利用的小分子葡萄糖碳源供菌体代谢利用[27]。
单宁酶作为一种诱导酶,微生物在含单宁酸等底物或底物类似物的情况下才会生产,本研究发现黑曲霉LH2301在30 h加入单宁酸后才逐渐产生单宁酶,到54 h酶活力达到最大值6.105 U/mL。随着发酵时间的延长,单宁酸浓度因降解会降低,同时发酵环境也不利于产酶,单宁酶的酶活力会随之降低(图5-b)。王喆丽[20]对黑曲霉YY的培养基配方和培养条件优化后,单宁酶活力提升至2.686 U/mL,相比之下,本研究所使用的诱变菌株和发酵工艺更有利于单宁酶的生产。综上,本研究中的黑曲霉诱变菌株的产单宁酶能力能够通过发酵优化得到有效提升。
2.5 单宁酶的酶学特性
对所得单宁酶进行分离纯化,探究温度、pH性质对酶活力影响,以用于指导优化单宁酶水解处理工艺。首先对采用硫酸铵沉淀和超滤离心管,初步纯化黑曲霉LH2301所产单宁酶,通过SDS-PAGE发现此诱变菌株所产单宁酶单体的分子质量为45 kDa左右(图6-a),其与黑曲霉NL112所产单宁酶的单个亚基的分子质量相近[28]。真菌来源的单宁酶常以多聚体的形式存在[29],所以本研究进一步通过Native-PAGE蛋白凝胶电泳,测定了天然单宁酶的分子质量,结果如6-b所示,牛血清白蛋白(bovine serum albumin,BSA)呈现出66 kDa和132 kDa的2条参考条带,而所获单宁酶的条带处于约90 kDa的位置,是单宁酶单体(45 kDa)的2倍,由此推测该单宁酶为同源二聚体,即其分子质量为90 kDa,单个亚基分子质量为45 kDa。诱变菌株所产单宁酶的温度稳定范围为40~60 ℃,相对酶活力达到80%以上,最适温度为50 ℃(图6-c),表明酶分子结构在高温下会变性失活。在pH值为3.0~7.0时,单宁酶活力呈现先上升后下降的趋势,pH值为4.0时酶活力最高,在3.0~5.0时较为稳定(图6-d),说明此单宁酶更偏向于酸性环境中使用。
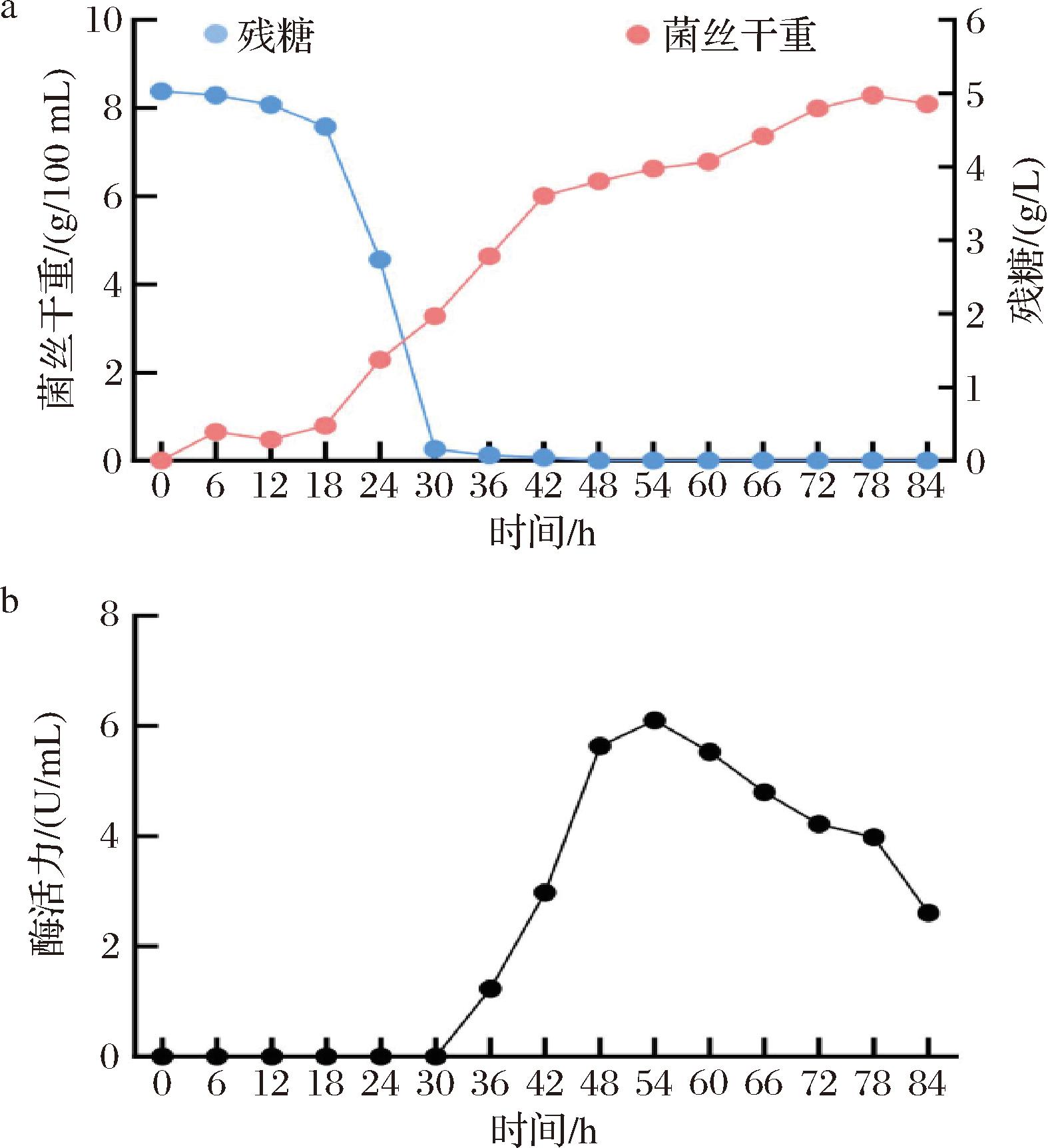
a-菌丝干重和残糖;b-酶活力
图5 黑曲霉突变株产单宁酶的发酵过程
Fig.5 Fermentation process of tannase production by A.niger mutant LH2301
通过在蛋白质上添加特定的配体如底物或辅助因子能够引起构象的变化,也会对其功能和活性造成影响[30]。如图7-a所示,当金属离子浓度为1 mmol/L时,Ca2+、K+、Al3+对单宁酶活力有促进作用,Mg2+、Na+、Ba2+对酶活力无明显影响,而Cu2+、Co2+、Zn2+、Mn2+对酶活力有抑制作用。选择对酶活力有促进作用的金属离子,考察不同浓度的Ca2+、K+、Al3+对单宁酶活力的作用,浓度设置为1、2、4、6、8 mmol/L。结果如图7-b所示,当K+浓度为1 mmol/L时,对酶活力有促进作用,最高相对酶活力为103.6%,随着K+浓度的不断增加,相对酶活力逐渐降低,当浓度到达8 mmol/L时,相对酶活力只有91.4%。Ca2+、Al3+对单宁酶活力的影响随着浓度的上升呈现出,先增高后降低的趋势,Ca2+在4 mmol/L时相对酶活力最高为105.8%,Al3+在2 mmol/L时相对酶活力最高为102.8%。以上对单宁酶活力起促进作用的金属离子和相应的有效浓度,将为该酶在应用过程中提升酶解效率提供良好的参考。
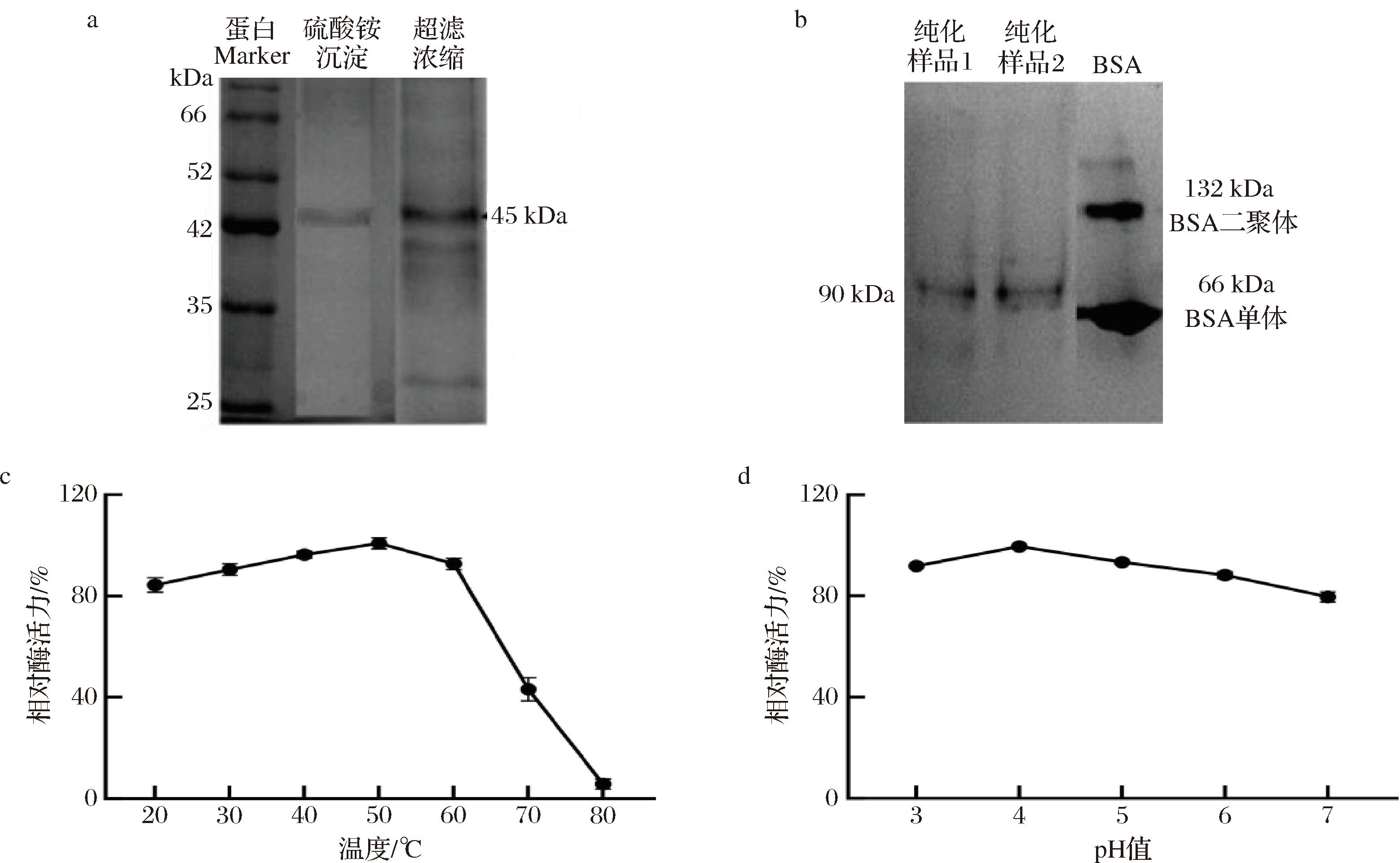
a-SDS-PAGE;b-非变性-PAGE;c-不同温度下的相对酶活力;d-不同pH下的相对酶活力
图6 单宁酶的酶学性质
Fig.6 Enzymatic properties of tannase
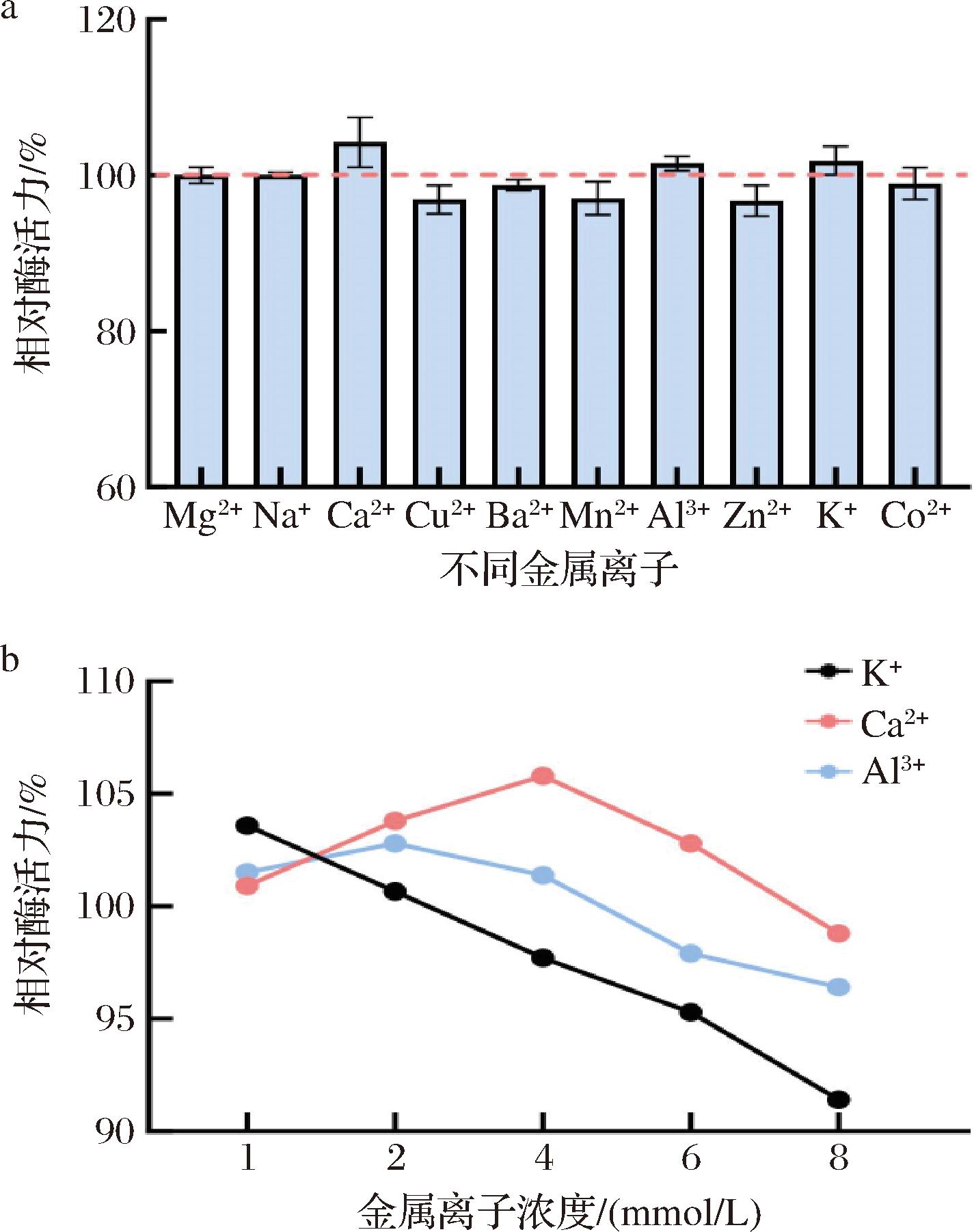
a-不同金属离子对酶活力的影响;b-不同浓度的金属离子对酶活力的影响
图7 金属离子对单宁酶酶活力影响
Fig.7 Effect of metal ions on tannase activity
3 结论与讨论
本文从本实验室保藏的一株黑曲霉菌株出发,ARTP诱变处理并筛选获得产酶优势菌株,研究诱变菌株液态发酵产酶工艺,使黑曲霉来源的单宁酶经液体发酵在摇瓶水上达到6.105 U/mL,成为工业制备单宁酶的候选菌株。同时,考察诱变菌株所产单宁酶的性质,以用于优化后期的单宁酶酶解方案。在诱变功率100 W、气量10 L/min、间距2 mm、孢子浓度3×106 CFU/mL、诱变时间为240 s的条件下,筛选到一株遗传性稳定的优势黑曲霉菌株命名为LH2301,其酶活力较原始出发菌株提高了2.27倍。进一步通过正交试验,确定了黑曲霉LH2301产单宁酶的最佳条件为:葡萄糖质量浓度为5 g/L,氮源质量浓度为21 g/L,初始pH值为4.0,接种量为3.5%,单宁酸质量浓度为20 g/L,酶活力提升了约3倍。另外,研究发现黑曲霉LH2301所产的单宁酶的分子质量为45 kDa,具有较好酶活力的温度为40~60 ℃,pH值为3.0~5.0,最适温度为50 ℃,最适pH值为4.0。金属离子在不同种类和不同浓度下对酶活力的影响表现出差异性,其中K+(1 mmol/L)、Ca2+(4 mmol/L)和Al3+(2 mmol/L)具有激活作用,展示出良好的应用特征。
本文在菌种选育和发酵培养方面,实现了黑曲霉液态发酵产单宁酶工艺的优化。后续将构建产单宁酶的重组工程菌,利用分子改造策略来提高酶活力和反应环境的耐受性,也将探究单宁酶利用富含单宁的原料进行酶解的工艺,以期更好地应用于食品和工业化生产。
[1] DUFOURC E J.Wine tannins, saliva proteins and membrane lipids[J].Biochimica et Biophysica Acta (BBA)-Biomembranes, 2021, 1863(10):183670.
[2] BESKY S.Empire and indigestion:Materializing tannins in the Indian tea industry[J].Social Studies of Science, 2020, 50(3):398-417.
[3] REN Y Y, ZHANG X R, LI T N, et al.Galla chinensis, a traditional Chinese medicine:Comprehensive review of botany, traditional uses, chemical composition, pharmacology and toxicology[J].Journal of Ethnopharmacology, 2021, 278:114247.
[4] GAIDAU C, SIMION D, NICULESCU M, et al.Tara tannin extract improvement I.extraction and concentration through membranary filtration techniques[J].Revista de Chimie, 2014, 65(8):929-933.
[5] CURIEL J A, BETANCOR L, DE LAS RIVAS B, et al.Hydrolysis of tannic acid catalyzed by immobilized-stabilized derivatives of Tannase from Lactobacillus plantarum[J].Journal of Agricultural and Food Chemistry, 2010, 58(10):6403-6409.
[6] ABDEL-NABY M A, EL-TANASH A B, SHERIEF A D A.Structural characterization, catalytic, kinetic and thermodynamic properties of Aspergillus oryzae tannase[J].International Journal of Biological Macromolecules, 2016, 92:803-811.
[7] SAAD M M, SAAD A M, HASSAN H M, et al.Optimization of tannase production by Aspergillus glaucus in solid-state fermentation of black tea waste[J].Bioresources and Bioprocessing, 2023, 10(1):73.
[8] LEKSHMI R, ARIF NISHA S, THIRUMALAI VASAN P, et al.A comprehensive review on tannase:Microbes associated production of tannase exploiting tannin rich agro-industrial wastes with special reference to its potential environmental and industrial applications[J].Environmental Research, 2021, 201:111625.
[9] 何泽琪, 刘果, 阚启鑫, 等.黑曲霉N5-5产单宁酶的酶学性质与固定化[J].现代食品科技, 2021, 37(8):91-96;274.
HE Z Q, LIU G, KAN Q X, et al.Kinetic characterization and immobilization of tannase produced by Aspergillus niger N5-5[J].Modern Food Science and Technology, 2021, 37(8):91-96;274.
[10] ZAKIPOUR-MOLKABADI E, HAMIDI-ESFAHANI Z, SAHARI M A, et al.Improvement of strain Penicillium sp.EZ-ZH190 for tannase production by induced mutation[J].Applied Biochemistry and Biotechnology, 2013, 171(6):1376-1389.
[11] 王玉印, 卢海强, 陈伟, 等.毕赤酵母单宁酶工程菌在固、液发酵中的性质差异分析[J].食品科学, 2022, 43(14):118-124.
WANG Y Y, LU H Q, CHEN W, et al.Effect of fermentation system on the production and properties of recombinant Pichia pastoris tannase[J].Food Science, 2022, 43(14):118-124.
[12] DONG X X, WAN Y, CHEN Y R, et al.Molecular mechanism of high-production tannase of Aspergillus carbonarius NCUF M8 after ARTP mutagenesis:Revealed by RNA-seq and molecular docking[J].Journal of the Science of Food and Agriculture, 2022, 102(10):4054-4064.
[13] LI D A, SHEN J, DING Q, et al.Recent progress of atmospheric and room-temperature plasma as a new and promising mutagenesis technology[J].Cell Biochemistry and Function, 2024, 42(3):e3991.
[14] WU C Z, ZHANG F, LI L J, et al.Novel optimization strategy for tannase production through a modified solid-state fermentation system[J].Biotechnology for Biofuels, 2018, 11:92.
[15] KUMAR M, RANA S, BENIWAL V, et al.Optimization of tannase production by a novel Klebsiella pneumoniae KP715242 using central composite design[J].Biotechnology Reports, 2015, 7:128-134.
[16] GUAN L J, WANG K L, GAO Y, et al.Biochemical and structural characterization of a novel bacterial tannase from Lachnospiraceae bacterium in ruminant gastrointestinal tract[J].Frontiers in Bioengineering and Biotechnology, 2021, 9:806788.
[17] KANPIENGJAI A, KHANONGNUCH C, LUMYONG S, et al.Co-production of Gallic acid and a novel cell-associated tannase by a pigment-producing yeast, Sporidiobolus ruineniae A45.2[J].Microbial Cell Factories, 2020, 19(1):95.
[18] 保玉心, 邱树毅, 李秧针, 等.一种胞外单宁酶的活力检测方法[J].精细化工, 2008, 25(6):621-624.
BAO Y X, QIU S Y, LI Y Z, et al.A method for detecting activity of extracellular tannase[J].Fine Chemicals, 2008, 25(6):621-624.
[19] 张永勤, 王哲平, 宋雨梅, 等.还原糖测定方法的比较研究[J].食品工业科技, 2010, 31(6):321-323;326.
ZHANG Y Q, WANG Z P, SONG Y M, et al.Comparative study on the determination of reducing sugar[J].Science and Technology of Food Industry, 2010, 31(6):321-323;326.
[20] 王喆丽. 微生物源单宁酶的发酵条件优化、性质研究及应用初探[D].秦皇岛:燕山大学, 2019.
WANG Z L.Optimization of fermentation conditions, properties and application of microbial tannase[D].Qinhuangdao:Yanshan University, 2019.
[21] 樊嘉训, 刘松, 陆信曜, 等.高产蛋白酶米曲霉菌株的选育及对酱油风味生成的影响[J].食品与发酵工业, 2021, 47(21):1-8.
FAN J X, LIU S, LU X Y, et al.Breeding Aspergillus oryzae with high-productive protease and its influence on soy sauce fermentation[J].Food and Fermentation Industries, 2021, 47(21):1-8.
[22] 陈颖, 王斌, 潘力.米曲霉谷氨酰胺酶在黑曲霉中的重组表达与酶学特性[J].现代食品科技, 2022, 38(9):126-134.
CHEN Y, WANG B, PAN L.Recombinant expression of glutaminase from Aspergillus oryzae in Aspergillus niger and its enzymatic properties[J].Modern Food Science and Technology, 2022, 38(9):126-134.
[23] 雷丹, 熊德欣, 李祝, 等.青枯雷尔氏菌拮抗菌黑曲霉xj的ARTP诱变选育[J].生物技术, 2021, 31(6):573-578.
LEI D, XIONG D X, LI Z, et al.ARTP mutation breeding of Ralstonia solanacearum antagonistic Aspergillus niger xj[J].Biotechnology, 2021, 31(6):573-578.
[24] 董弦弦, 吴晓江, 张钰龙, 等.常压室温等离子体诱变选育产单宁酶炭黑曲霉及发酵参数优化[J].食品与发酵工业, 2021, 47(15):15-21.
DONG X X, WU X J, ZHANG Y L, et al.Breeding of tannase-producing Aspergillus carbonarius using ARTP mutagenesis and fermentation optimization[J].Food and Fermentation Industries, 2021, 47(15):15-21.
[25] CHUNG K T, WONG T Y, WEI C I, et al.Tannins and human health:A review[J].Critical Reviews in Food Science and Nutrition, 1998, 38(6):421-464.
[26] 胡文斌, 邹佩, 李红歌, 等.单宁及其微生物降解途径研究进展[J].江西科学, 2015, 33(1):85-89;132.
HU W B, ZOU P, LI H G, et al.Research and development of tanninsin and its pathway of microbial degradation[J].Jiangxi Science, 2015, 33(1):85-89;132.
[27] HUBERMAN L B, LIU J, QIN L N, et al.Regulation of the lignocellulolytic response in filamentous fungi[J].Fungal Biology Reviews, 2016, 30(3):101-111.
[28] WAN Y, FAN H W, GAO L, et al.The change mechanism of structural characterization and thermodynamic properties of tannase from Aspergillus niger NL112 under high temperature[J].Applied Biochemistry and Biotechnology, 2021, 193(7):2225-2244.
[29] 詹晶晶, 潘虎, 杨辉, 等.微生物源单宁酶的研究进展[J].中国酿造, 2020, 39(12):15-19.
ZHAN J J, PAN H, YANG H, et al.Research progress on the tannase from microorganisms[J].China Brewing, 2020, 39(12):15-19.
[30] QIU Y, NIU H, HUANG W, et al.Properties and secondary structure of tannase from Penicillium herquei[J].Biotechnology and Bioprocess Engineering, 2011, 16(5):858-866.