驼乳呈白色不透明状,味甜微咸,具有“沙漠白金”的美称。其不仅风味独特,还含有极高的营养成分与药用价值。驼乳具有抗菌消炎、调节胃肠消化机能以及维护菌群健康、降血糖和调节免疫功能的作用[1],对机体健康、疾病预防及辅助治疗等方面具有一定效果[2]。
对小鼠的研究结果显示,驼乳能有效预防小鼠空腹血糖升高及对糖尿病小鼠过度氧化应激具有一定改善作用,常用于辅助糖尿病治疗[3]。另外,驼乳对化学性、酒精性、糖尿病性肝损伤以及热应激引起肝损伤具有一定保护作用[4]。ESLAMI等[5]指出低脂乳制品对慢性肾病具有一定预防作用,而驼乳在脂质代谢以及糖代谢上具有调节作用,并具有一定抗氧化能力[6]。但驼乳对调节炎症等方面的影响机制尚不完全清楚,本研究拟分析灌喂驼奶对小鼠肝脏中细胞因子及免疫蛋白的影响,分析驼奶对小鼠抗炎功能的影响,并进行血液代谢组分析,为探索驼乳抗炎作用及驼乳开发利用提供数据支撑。
1 材料与方法
1.1 材料与试剂
实验用驼乳采自新疆塔城塔里木双峰驼,骆驼挤乳后立即采集新鲜驼乳,并置于-20 ℃条件下保存待用。
ICR小鼠(SPF级),新疆医科大学动物实验中心,所购小鼠年龄为4周龄,体重为18~20 g。
小鼠白细胞介素6(interleukin 6, IL-6)、分泌型免疫球蛋白A(secretory immunoglobulin A, sIgA)、白介素-1β(interleukin 1β, IL-1β)、干扰素γ(interferon γ, IFN-γ)水平、降低肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)ELISA检测试剂盒,江苏酶免实业有限公司。
1.2 仪器与设备
Q ExactiveTM HF/Q ExactiveTM HF-X型质谱仪,德国Thermo Fisher公司;Vanquish UHPLC型色谱仪,德国Thermo Fisher公司;D3024R低温离心机,美国Scilogex公司。
1.3 实验方法
1.3.1 实验分组
选择ICR小鼠18~20 g共32只,公母各半,将其随机分为驼乳组(CM组)、对照组(CG组),4只一笼,公母分笼共8笼。小鼠适应性饲喂1周,期间自由饮水和进食标准饲料,根据体重进行灌喂,驼乳组每日灌喂驼乳10 mL/kg体重,对照组灌喂纯净水10 mL/kg体重。每日灌喂1次,连续灌喂4周。其他时间自由采食与饮水。
1.3.2 样本采集
在28日灌喂结束后禁食12 h、禁水6 h,在第29天采用眼球摘除取血法取其血液,将血液放置抗凝离心管中,2 500 r/min离心10 min后取上清液,液氮保存,用于代谢组学检测。而后对小鼠采用颈椎脱臼法处死,取肝组织,液氮保存,用于抗炎指标检测。
1.3.3 抗炎与免疫指标检测
采用ELISA法检测测定小鼠肝脏IL-6、SIgA、TNF-α、IL-1β和IFN-γ含量,检测方法按照检测试剂盒说明书进行。
1.3.4 代谢组学检测
随机选取每组8只小鼠的血液样本用于代谢组学检测。取100 μL血浆样本置于EP管中,加入400 μL的80%甲醇水溶液;涡旋振荡,冰浴静置5 min,4 ℃、15 000×g进行离心20 min;取一定量的上清加质谱级水稀释至甲醇含量为53%;4 ℃、15 000×g进行离心20 min收集上清液,进样LC-MS进行分析。
色谱条件:Hypersil Gold C18色谱柱(100 mm×2.1 mm,1.9 μm)(Thermo Fisher,USA);柱温40 ℃;流速为0.2 mL/min;正离子模式:流动相为0.1%甲酸(A)和甲醇(B);负离子模式:流动相为5 mmol/L醋酸铵,pH值9.0(A)和甲醇(B)。梯度洗脱程序见表1。质谱条件:Q ExactiveTM HF-X质谱检测仪(Thermo Fisher,Germany),电喷雾离子源(ESI),HF-X扫描范围选择m/z 100~1 500;ESI源喷雾电压3.5 kV;鞘气流速35 psi;辅助气流速10 L/min;离子传输管温度320 ℃;离子导入射频电平60;辅助气加热器温度350 ℃;极性:positive、negative;MS/MS二级扫描为数据依赖性扫描。
表1 梯度洗脱程序
Table 1 Gradient elution program

时间/minA%B%09821.59823158510010010.19821198212982
1.4 数据统计分析
抗炎指标数据采用IBM SPSS Statistics19软件进行独立样本t检验,P<0.01表示差异极显著。
代谢物进行注释使用KEGG数据库、HMD数据库、LIPIDMaps数据库。注释结束后数据转换使用代谢组学数据处理软件metaX,进行偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA)。基于t检验来进行单变量分析,计算各代谢物在2组间统计学显著性(P值)和差异倍数(fold change, FC)。以VIP>1.0,FC>1.2或FC<0.833且P<0.05为标准进行差异代谢物的筛选。并对所筛选到的差异代谢物进行KEGG通路富集分析,以P<0.1为通路显著富集的标准。
2 结果与分析
2.1 驼奶对小鼠抗炎因子的影响
通过对2组小鼠肝脏中SIgA、IL-6、TNF-α、IL-1β和IFN-γ含量进行对比分析,结果见表2。与对照组相比,驼奶组小鼠肝脏中IFN-γ含量增高,但两组间差异不显著(P>0.05),SIgA、IL-6和IL-1β含量极显著增高(P<0.01),TNF-α极显著降低(P<0.01)。
2.2 代谢物PLS-DA
对检测的代谢物进行PLS-DA,结果见图1。由图1-a与图1-b可以看出,2组样品间能够明显区分,进一步PLS-DA模型进行置换检验结果显示,正、负离子模式下Q2与Y轴的截距均小于0(图1-c、图1-d),表明模型未出现“过拟合”现象,该模型具有较好的稳定性。2组样本间代谢物出现了明显的分离。
表2 驼奶对小鼠抗炎因子的影响
Table 2 Effect of camel milk on anti-inflammatory factors in mice

组别SIgA/(ng/mL)IL-6/(pg/mL)TNF-α/(ng/L)IL-1β/(ng/L)IFN-γ/(ng/L)对照组43.60±2.07A143.17±7.58A858.17±41.76B85.70±5.49A879.47±47.94驼奶组47.67±2.54B154.18±6.62B785.30±51.66A100.81±5.39B884.37±46.24
注:同列肩标不同大写字母表示驼乳组与对照组相比差异极显著(P<0.01)。

a-正离子模式下得分图;b-负离子模式得分图;c-正离子模式下置换检验图;d-负离子模式下置换检验图
图1 代谢物PLS-DA
Fig.1 Partial least squares discriminant analysis of metabolites
2.3 差异代谢物筛选
以VIP>1.0,FC>1.2或FC<0.833且P<0.05为标准进行差异代谢物筛选,共筛选出207种代谢物(表3),其中正离子模式下有162种差异代谢物在对照组中显著上调,有1种差异代谢物在对照组中显著下调;负离子模式下有39种差异代谢物在对照组中显著上调,5种差异代谢物在对照组中显著下调。差异代谢物的火山图见图2。这207个差异代谢物中脂质代谢物占比较多,脂质代谢物中溶血脂质类包括溶血磷脂酰胆碱(lysophosphatidyl choline, LPC)、溶血磷脂酰乙醇胺(lysophosphatidyl ethanolamine, LPE)、溶血磷脂酰肌醇(lysophosphatidylinositol, LPI)等数量相对较多。
2.4 差异代谢物通路富集分析
为了能够系统、全面了解驼乳对小鼠抗炎影响的生物学变化,进一步对差异代谢物进行通路富集分析。所有富集的通路中,P值小于0.1的通路共有4条,其中正离子模式下有1条,为嘧啶代谢,负离子模式下有3条,分别为三羧酸循环、碳代谢、天冬氨酸和谷氨酸代谢。各代谢通路的情况见表4。对显著富集的通路绘制气泡图见图3。
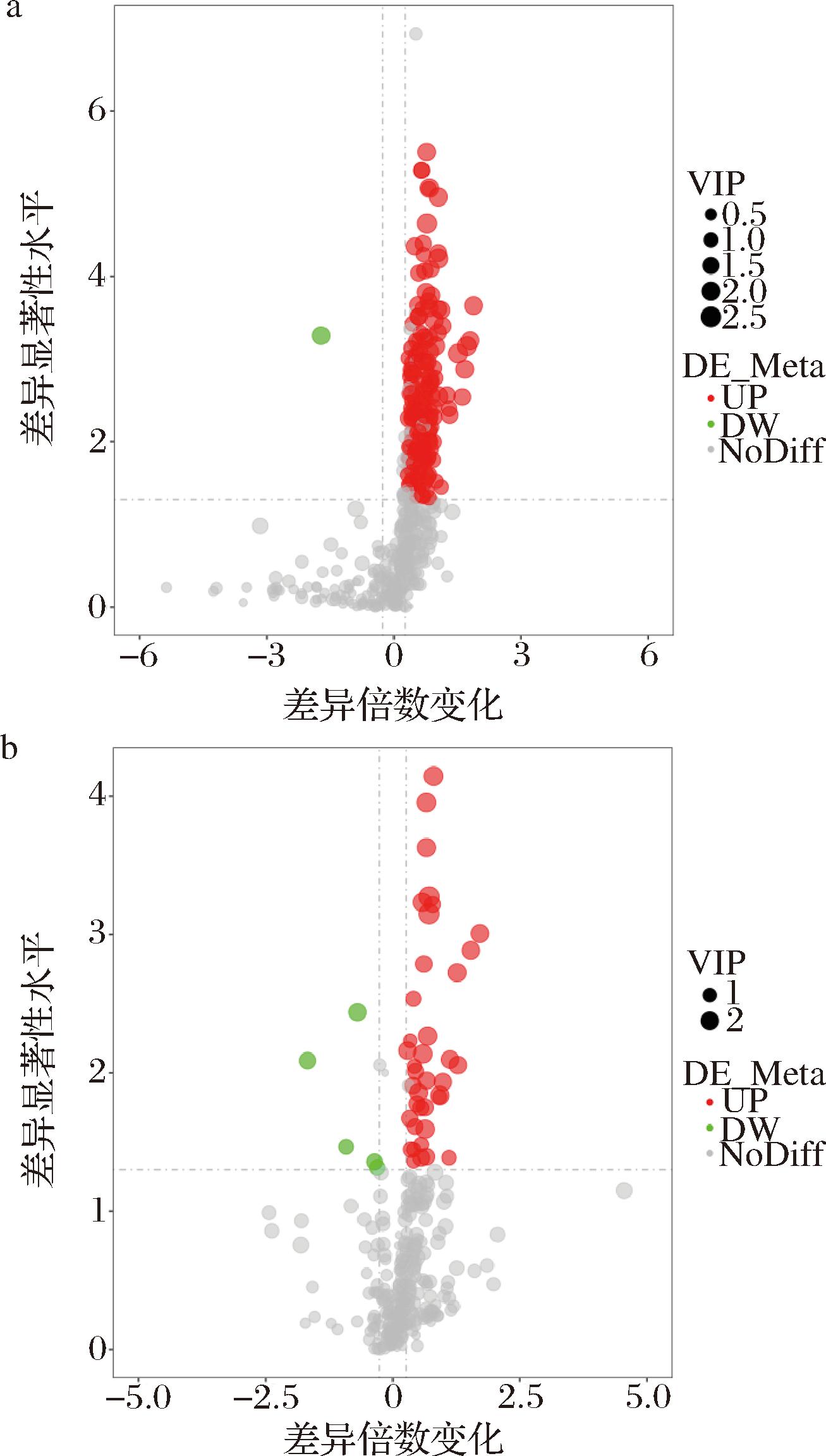
a-正离子模式下差异代谢物火山图;b-负离子模式下差异代谢物火山图
图2 差异代谢火山图
Fig.2 Differential metabolism volcano map
表3 差异代谢物分布
Table 3 Distribution of differential metabolites

序号差异代谢物VIP值差异倍数FCP值变化趋势序号差异代谢物VIP值差异倍数FCP值变化趋势1L-谷氨酸1.841.710上调1054-乙酰基-4-(乙氧羰基)庚二酸1.021.490.01上调2SM 8∶1;2O/26∶11.461.570上调106PC 19∶1_19∶21.451.350.01上调3PC O-39∶81.331.570上调107吡哆醇胺1.721.490.01上调4乙酰胆碱2.081.790上调1085-甲基尿苷1.461.430.01上调5精蛋赖肽1.11.770上调109N-[2-氯-6-(三氟甲氧基)苯基]-2,2-二甲基丙酰胺1.181.50.01上调6亚麻油酸2.12.060上调110γ-谷氨酰甲硫氨酸1.251.590.01上调7辅酶Q22.331.720上调111LPC 20∶5-SN11.131.790.01上调84-甲基-2-(1H-吡咯-1-基)-1,3-噻唑-5-羧酸乙酯1.461.610上调112LPE 17∶01.371.350.01上调94-甲基戊酸1.741.410上调113汕-雌二醇1.471.80.01上调102-羟基-6-[(8Z,11Z)-十五碳-8,11,14-三烯-1-基]苯甲酸1.682.060上调114PC O-20∶21.541.90.01上调112-(3,4-二甲氧基苯基)喹啉1.091.620上调115N-苄基甲酰胺1.381.460.01上调129-十八碳烯酸2.342.060上调11611-脱氧前列腺素f1β1.241.610.01上调13二十二碳五烯酸1.591.830上调117LPC 17∶0-SN11.431.320.01上调14LPC O-18∶41.481.660上调118十六酰胺乙醇1.171.280.01上调15硫辛酸1.471.50上调119PC 20∶2_20∶21.21.530.01上调16PC O-18∶21.851.690上调1202-甲氧基-5-(1H-1,2,4-三唑-5-基)-4-(三氟甲基)吡啶1.621.620.01上调17异喹啉1.741.840上调121PC 40∶61.261.830.01上调18水苏碱1.611.760上调122LPC 22∶5-SN11.331.440.01上调192-花生四烯酸甘油1.641.480上调123阿斯巴甜1.351.440.01上调20髓鞘相关糖蛋白(18∶3)1.973.670上调124乙酰-L-肉碱1.291.410.01上调21溶血磷脂 18∶21.721.780上调125N-乙酰鸟氨酸1.051.460.01上调22PC O-41∶81.211.60上调126PC 20∶0_22∶61.441.750.02上调2318-羟基二十碳四烯酸1.592.070上调127LPC 20∶21.471.670.02上调2413,14-二氢前列腺素E11.912.160上调128PC O-18∶01.231.280.02上调25DL精氨酸1.681.50上调129棕榈酸甲酯1.271.290.02上调26L-(+)-精氨酸1.681.50上调130邻苯二甲酰乙酰胺1.311.730.02上调27LPC 19∶1-SN12.011.930上调131PC 17∶1_18∶21.161.50.02上调28哌啶酸1.261.360上调1325-氟-阿比那卡 N-(4-羟基戊基) 代谢物1.341.890.02上调29吲哚-3-乙酸甲酯1.762.210上调133LPC 20∶2-SN11.411.630.02上调30LPE 16∶11.732.050上调134γ-谷氨酰酪氨酸1.251.650.02上调314-甲氧基苯甲醛1.31.550上调13516,16-二甲基前列腺素A21.311.390.02上调3225-羟基胆钙化醇1.810.30下调136依克戈宁甲酯1.231.530.02上调336-甲基喹啉1.541.640上调1374-羟基异亮氨酸1.121.310.02上调34α-L-谷氨酰-L-谷氨酸1.751.770上调138乙基3-氧基-3-(1H-吡唑-5-氨基)丙酸酯1.031.340.02上调35吲哚1.521.670上调139表没食子儿茶素1.051.530.02上调3616(R)-羟基二十碳四烯酸1.93.470上调1402-氨基-1,3-十八醇1.221.680.02上调375-乙烯基-2-吡咯烷同1.211.510上调141L-(+)-柠檬酸盐1.321.50.02上调382,5-二羟基甲苯1.341.440上调142n1-(2,3-二氢-1,4-苯并二氧杂环己烷-2-基甲基)-2,2-二甲基丙酰胺1.141.780.02上调39文朵灵2.071.970上调143PC 17∶0-17∶11.141.250.03上调401,4-二羟基十七碳-16-烯-2-基乙酸酯2.163.30上调1444-吗啉苯甲酸1.331.750.03上调41甘氨酰-L-亮氨酸1.291.330上调145γ-谷氨酰亮氨酸1.241.50.03上调42胸腺嘧啶1.281.510上调146N-苄基-2-(6-甲氧基-2-萘基)丙酰胺1.121.330.03上调43双亮氨酸拉链激酶1.51.820上调147组成型雄烷受体 17∶011.710.03上调44LPC 15∶0-SN11.841.510上调148LPC O-21∶21.11.990.03上调45脑白质高信号2.172.850上调149LPC 18∶11.261.630.03上调46蛋氨酸1.571.440上调150鸟氨酸1.231.310.03上调47脯氨酸1.371.430上调1515β-二氢孕酮1.071.330.03上调48胞嘧啶1.211.270上调1524-羟基苯甲醛1.171.270.03上调49LPC 16∶21.71.60上调1531-(4-苄基哌嗪)-2-(吡啶-2-基氨基)丙烷-1-酮1.181.440.03上调50LPC 16∶2-SN11.721.730上调154前列腺素 F(2α)1.072.170.04上调513-甲基-5-氧代-5-(4-甲苯氨基)戊酸1.71.670上调1552-(乙酰氨基)-3-(1H-吲哚-3-基)丙酸11.520.04上调52L-缬氨酸1.281.340上调156LPC 22∶41.111.390.04上调
续表3

序号差异代谢物VIP值差异倍数FCP值变化趋势序号差异代谢物VIP值差异倍数FCP值变化趋势53组成型雄烷受体11∶11.441.910上调157PC 18∶0_22∶61.151.710.04上调54二十碳五烯酸乙酯1.913.190上调158SM 42∶1;2O1.091.510.04上调55焦谷氨酸1.461.320上调159DL-2-(乙酰氨基)-3-苯基丙酸1.191.590.04上调56LPC 17∶2-SN11.511.680上调160N1-(2,6-二吗啉-3-吡啶基)-4-甲基苯甲酰胺1.151.450.05上调57PC 34∶21.121.390上调161PC O-20∶11.21.610.05上调58L-天门冬酰胺1.251.320上调162LPC 19∶0-SN11.131.370.05上调597-甲基-3-硝基咪唑并[1,2-α]吡啶1.731.370上调163N-乙酰缬氨酸1.111.780.05上调602′-脱氧尿苷-5′-单磷酸1.041.290上调164柠檬酸2.331.740上调61(2R,3S,4S,5R,6R)-2-(羟甲基)-6-(丙-2-基氧基)恶烷-3,4,5-三醇1.641.80上调165反式乌头酸2.261.580上调625-羟基吲哚1.31.960上调166异柠檬酸2.131.580上调63LPC 17∶1-SN11.631.630上调1672-糠酸2.771.640上调64LPC 19∶11.161.860上调168十五烷酸2.211.50上调65苏氨酸1.261.330上调169LPI 18∶11.571.720上调66PC 35∶21.71.810上调1702′-脱氧尿苷-5-一磷酸2.711.640上调67L-氧化型谷胱甘肽1.411.780上调171(±)18-单羟基脂肪酸2.143.280上调68油酸甘油酯1.571.70上调17211,12-环氧-(5Z,8Z,11Z)-二十碳三烯酸2.082.890上调69氮-(6-甲氧基吡啶-3-基)噻吩-2-甲酰胺1.551.440上调173羟基脂肪酸 20∶3/18∶21.691.530上调70PC O-18∶31.481.650上调174前列腺素A1乙酯2.082.40上调71乙酰胺油1.421.340上调175反式-10-十七碳烯酸1.41.330上调72D-(-)-谷氨酰胺1.361.290上调176脯氨酸羟脯氨酸1.850.620下调73LPC 19∶21.672.390上调177甾醇脂 28∶1;O;六碳糖;脂肪酸 18∶22.211.610.01上调74PC O-22∶41.551.860上调178磷酸肌酸1.061.270.01上调754-乙基苯甲醛2.582.050上调179LPC 15∶02.021.220.01上调76D1吲哚-3-乳酸1.613.060上调180羟基脂肪酸 18∶2/20∶42.251.510.01上调77PC O-15∶01.61.420上调181肉桂酰甘氨酸2.032.190.01上调782-[(3S)-1-(2-甲基苄基)-3-吡咯烷基]-1H咪唑并[4,5-b]吡啶1.431.660上调182(2S)-4-氧代-2-苯基-3,4-二氢-2H-色烯-7-基β-D-吡喃糖苷1.70.310.01下调79花生四烯酸乙醇胺1.181.340上调18317α-羟基孕烯醇酮1.932.430.01上调80DL-5-甲氧基色氨酸1.311.550上调184N-乙酰葡糖胺1-磷酸1.191.350.01上调81甘氨酸-苯丙氨酸1.281.620上调185极性脂质O-24∶4_16∶01.631.370.01上调82烟酰胺1.221.410上调186龙胆酸1.851.590.01上调832,4-二羟基十七碳十六烯-1-基乙酸酯1.261.940上调18711β-前列腺素E22.021.980.01上调84脯氨酸1.491.330上调18811(Z),14(Z)-环氧水杨酸1.741.320.01上调85D-苯丙氨酸1.381.40上调189羟基脂肪酸 18∶1/20∶32.011.420.01上调86枸橘苷1.322.470上调190LPE 18∶32.351.90.01上调87PC O-20∶51.381.630上调191神经酰胺 13∶0;2O1.191.890.01上调88D-鞘氨醇1.411.80上调192羟基脂肪酸16∶0/18∶21.681.390.02上调89油酰基-L-α-溶血磷脂酸1.61.350上调193葡萄糖-葡萄糖1.851.550.02上调90麦芽酚1.461.410上调194前列腺素D31.521.460.02上调91棕榈油酸1.662.490上调195反油酸1.681.260.02上调92肌酸1.461.40上调196棕榈酸1.531.360.02上调935-[(10Z)-14-(3,5-二羟基苯基)十四碳-10-烯-1-基]苯-1,3-二醇1.311.680上调197LPE 18∶22.221.550.03上调94PC O-20∶31.541.80.01上调198琥珀酸1.211.470.03上调95甘油三酯 20∶4_20∶4_32∶51.451.920.01上调19911-脱氢血栓素B21.310.530.03下调96油酸酰胺1.381.330.01上调200棕榈酰溶血磷脂酰乙醇胺1.441.280.04上调97LPC 16∶0-SN11.71.270.01上调201(±)8(9)-二羟基乙二烯1.181.330.04上调98汐-雌二醇1.131.570.01上调202(+/-)12(13)-二羟基丙酮1.671.580.04上调99N1-[2-氧代-6-(1H-吡咯-1-基)-2H-甲烯-3-基]乙酰胺1.341.780.01上调2032-甲基丁基β-D-吡喃葡糖苷1.212.160.04上调100LPC 22∶6-SN21.371.360.01上调20413(S)-羟基十八碳三烯酸1.731.470.04上调1012-(1H-苯并咪唑-2-基)-N-[4-(苄氧基)苯基]苯甲酰胺1.031.390.01上调205LPI 18∶21.061.330.04上调102LPC 20∶11.131.850.01上调206LPA 22∶61.520.780.04下调103鞘氨醇(d18∶1)1.361.790.01上调207LPC 22∶61.40.810.05下调104LPC 20:1-SN11.291.760.01上调
序号1~163号为正离子模式分析结果,序号164~207为负离子模式分析结果。单分子亲核取代反应(unimolecular nucleophilic substitution,SN1);双分子亲核取代反应(bimolecular nucleophilic substitution, SN2);鞘磷脂(sphingomyelin,SM)。
表4 差异代谢物通路富集分析
Table 4 Enrichment analysis of differential metabolite pathways
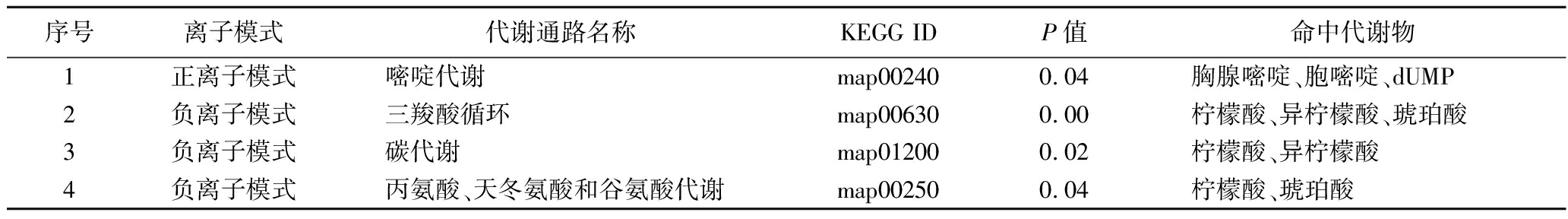
序号离子模式代谢通路名称KEGG IDP值命中代谢物1正离子模式嘧啶代谢map002400.04胸腺嘧啶、胞嘧啶、dUMP2负离子模式三羧酸循环map006300.00柠檬酸、异柠檬酸、琥珀酸3负离子模式碳代谢map012000.02柠檬酸、异柠檬酸4负离子模式丙氨酸、天冬氨酸和谷氨酸代谢map002500.04柠檬酸、琥珀酸
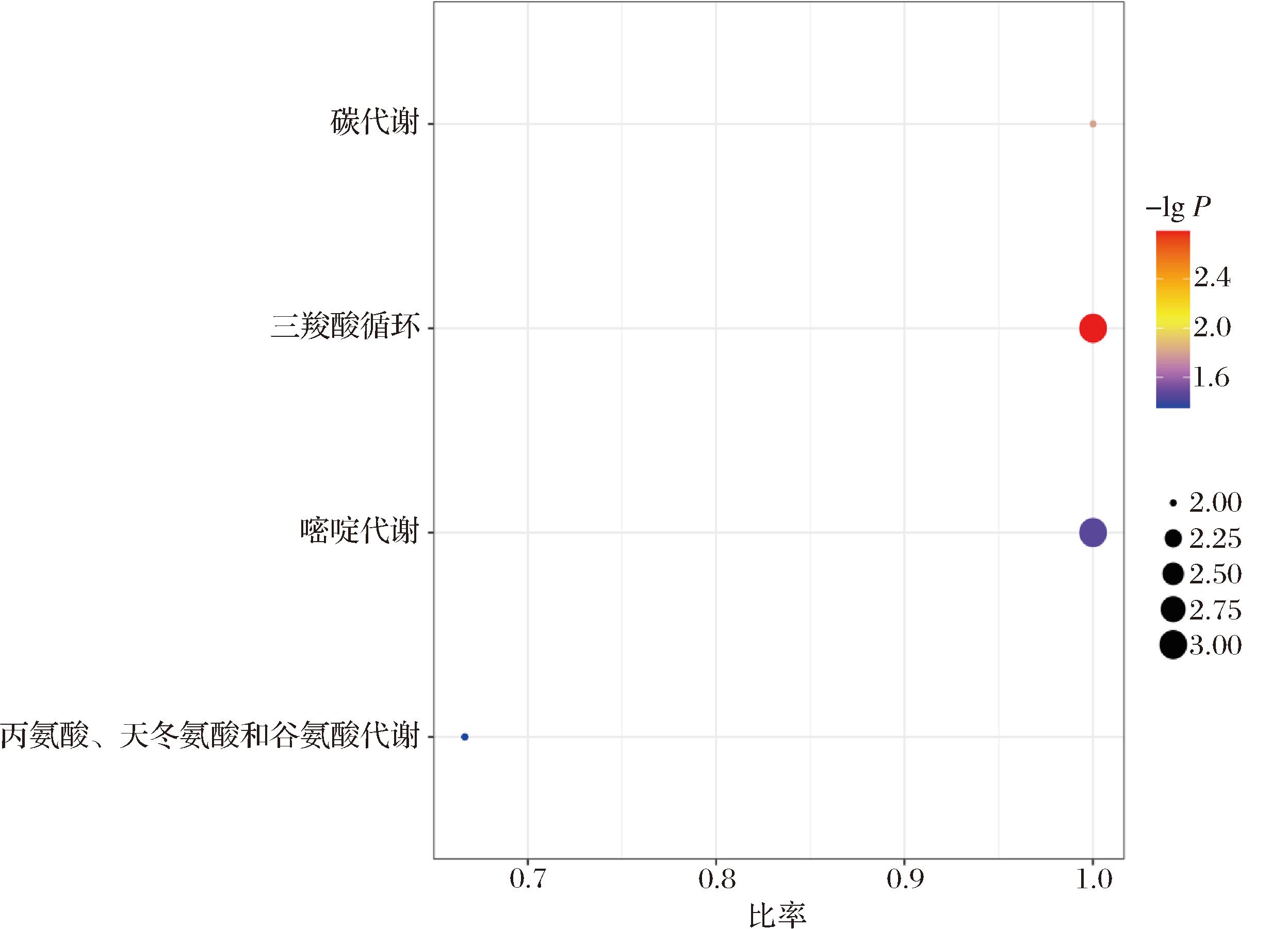
图3 KEGG富集气泡图
Fig.3 KEGG enrichment bubble map
注:图中横坐标为相应代谢通路中差异代谢物的数目/该通路中鉴定出总代谢物数目,值越大,表示该通路中差异代谢物富集程度越高。
点的颜色代表超几何检验的P值,值越小,说明检验的可靠性越大、越具统计学意义。点的大小代表相应通路中差异代谢物的数目,越大,该通路内差异代谢物就越多。
3 讨论
IL-1β是炎症性疾病治疗的重要靶标,然而局部低浓度的IL-1β主要发挥免疫调节作用,间充质干细胞是一种几乎存在于所有组织中具有多分化潜能的干细胞,研究证明IL-1β预处理可增强MSCs的免疫抑制功能与迁移能力,提高免疫抑制功能相关的重要基因COX-2、IDO、IL-8和TSG-6的mRNA水平[7]。IL-6是由淋巴样细胞(如T淋巴细胞、B淋巴细胞)和某些非淋巴样细胞产生的一种多功能性细胞因子,在免疫稳态、炎症、肿瘤、造血、代谢等方面都具有重要作用,有研究结果表明,IL-6可以通过JAK2/STAT3信号通路降低LPS诱导的ALI模型细胞的氧化应激和炎症反应[8]。IFN-γ具有多种生物学效应,在调节免疫、抵御病毒感染等方面发挥作用,此外,IL-1β[9]、IL-6[10]和IFN-γ均可通过刺激B细胞增殖分化从而产生抗体来提高机体免疫。B细胞通过增殖分化,发育为成熟的浆细胞,并分泌多聚体免疫球蛋白A(polymeric immunoglobulin, pIgA),pIgAs经过跨膜转运穿过上皮细胞到达黏膜表面,最终形成slgA。SIgA是黏膜免疫中的主要抗体,局部免疫能力与sIgA含量的多少密切相关。驼乳含有丰富的免疫球蛋白以及乳铁蛋白,可以刺激T淋巴细胞增长,从而增强小鼠免疫力。而IL-6的生成以及调节sIgA的合成、分泌和slgA所介导的免疫应答都依赖于T细胞的辅助以及B细胞增殖发育,本研究结果与此一致。驼乳组IL-6、IL-1β和IFN-γ的升高表明小鼠免疫能力得到了提高。研究表明TNF-α可能通过下调miR-363-3p/EZH2通路来对机体的免疫功能进行调节[11],此外,驼乳中乳铁蛋白、溶菌酶和乳过氧化物酶等抗炎成分对各种炎症性疾病具有一定的作用。李雅菲等[12]通过研究发现驼乳可有效降低小鼠肾毒性标志物并抑制促炎因子TNF-α的上升。本研究结果与此基本一致,灌喂驼乳后小鼠肝脏中TNF-α极显著下降,证明驼乳在抗炎方面具有一定作用。
已有研究结果表明灌喂驼乳可以影响小鼠脂质代谢[13],本研究在差异代谢物筛选中,共筛选出207个差异代谢物,其中与CM组相比,CG组201个差异代谢物相对含量高于CM组,在这些差异代谢物中,脂质代谢物含量最多,包括LPC、LPE和LPI。CG组有50个脂质代谢物分别为20个磷脂酰胆碱(phosphatidylcholine, PC)、24个LPC、4个LPE、2个LPI含量高于CM组,表明灌喂驼乳可有效调节机体脂质代谢物含量。
PC是一种由亲水的头部和疏水的尾部组成的具有良好抗炎作用的磷脂类两性分子。而LPC主要来源于PC,是卵磷脂代谢的中间产物,是具有生物活性的促炎症脂质。研究表明,LPC是促动脉粥样硬化的危险因子[14],LPC可通过诱导血管平滑肌细胞的增殖和迁移、以此破坏血管内皮细胞以及平滑肌细胞的功能[15],从而加速动脉粥样硬化的发生发展,促进其炎性反应,增加机体氧化应激。LPE是构成细胞膜的重要成分,与LPC同样在急性冠状动脉综合征中发挥重要作用,LPE通过诱导巨噬细胞M1极化及泡沫细胞形成,使其分泌大量促炎性细胞因子,从而引起血流动力学变化,进而影响动脉硬化斑块不稳定,导致动脉硬化斑块破裂[16]。LPI是一种由磷脂酰肌醇水解产生的溶血磷脂类,研究表明LPI可以诱发心肌细胞中钙离子的急剧增加,会导致心肌细胞死亡[17]。LPC、LPE和LPI均属于氧化低密度脂蛋白(oxidized low-density lipoprotein, OX-LDL)的主要活性成分,而低密度脂蛋白过高会导致高血压、糖尿病、脂肪肝等疾病风险升高。本研究中,CG组小鼠血浆PC含量显著上升高于CM组,证明对照组小鼠处于炎症反应中,机体生成磷脂酰胆碱以发挥抗炎作用。且CG组LPC等促炎介质含量高于CM组。已有研究表明驼奶不但可以降血糖,还能降低低密度脂蛋白、血清总胆固醇以及总甘油三脂等含量,对肝脏具有一定的保护作用[18],刘宸等[19]通过实验证明,驼乳可以有效改善由糖尿病引起的肝损伤以及糖脂代谢紊乱,降低低密度脂蛋白浓度,减少免疫应激以及炎性反应。而且驼乳含有乳铁蛋白、免疫球蛋白以及外泌体等抗炎物质,具有良好的抗炎作用。本研究结果与此基本一致,驼乳显著降低了小鼠的炎性反应,表明驼乳能够对小鼠的免疫功能进行调节。
本研究中的差异代谢物显著富集到嘧啶代谢通路。嘧啶代谢涉及复杂的酶水解过程[20],其代谢过程紊乱则有可能会引起免疫系统、神经系统等相关疾病,而抑制嘧啶的生物合成则对治疗某些炎症类疾病具有一定作用[21]。本研究结果结果显示,嘧啶代谢通路命中的主要差异代谢物为胸腺嘧啶、胞嘧啶和dUMP,表明这些成分可能是参与嘧啶代谢调节的主要成分;在对照组中这3种成分均显著上调,提示驼乳可能通过下调这些成分,从而抑制或缓解小鼠嘧啶代谢通路被过度激活,从而对小鼠的抗炎起到调节作用,但其具体的调控机制还需要更加深入的研究加以证实。
在负离子模式下,本研究中所筛选出的差异代谢物显著富集到三羧酸循环等通路中。三羧酸循环是糖类、脂肪和蛋白质代谢的联系枢纽与最终分解途径,当巨噬细胞或树突状细胞被干扰素等因子激活时,这些免疫细胞中的三羧酸循环将会在异柠檬酸脱氢酶和琥珀酸脱氢酶处出现代谢断点[22],这将导致三羧酸代谢减弱。本研究中三羧酸循环所命中的代谢物主要有异柠檬酸和琥珀酸,这些三羧酸循环中的代谢中间产物的局部积累可以对炎症反应起到一定的调节作用[23]。本研究中异柠檬酸和琥珀酸在对照组中显著上调,表明灌喂驼乳将有利于抑制免疫细胞被干扰素等因子激活,从而维持免疫细胞中三羧酸循环的完整性,降低异柠檬酸和琥珀酸的含量。此外,线粒体中的柠檬酸主要通过柠檬酸载体运输到细胞质,在巨噬细胞活化过程中[24],柠檬酸载体表达水平提升,线粒体柠檬酸将会加快流出与分解;而当柠檬酸载体表达水平下降时,则可导致炎症介质含量降低[25]。本研究结果表明对照组中柠檬酸含量降低,这可能是由于灌喂驼奶后柠檬酸载体的表达被一定程度上抑制,从而起到了增强小鼠抵御炎症的能力,但相关的调节机制还有待于进一步研究。
4 结论
本研究以驼乳为研究对象,通过免疫分析发现驼乳可显著提高小鼠IL-6、IL-1β和sIgA水平,降低TNF-α水平,表明驼乳能显著提高小鼠免疫抗炎能力。通过差异代谢物分析表明,驼奶组脂质代谢物、氨基酸代谢物、糖代谢产物等207个差异代谢物含量显著低于对照组,其中脂质代谢物占比最多,这些差异代谢物显著富集到嘧啶代谢和三羧酸循环等通路中,表明驼乳可能通过对脂质代谢、嘧啶代谢与三羧酸循环等进行调节从而在抗炎等方面具有一定的生理作用,但其具体机制还需进一步研究。本研究结果望为今后驼乳发展功能性饮品提供一定理论基础。
[1] 张敏, 彭小雨, 高宇, 等.双峰驼乳的营养特性和生物活性研究进展[J].食品与机械, 2022, 38(10):230-234.
ZHANG M, PENG X Y, GAO Y, et al.Research progress on nutritional characteristics and biological activity of bactrian camel milk[J].Food &Machinery, 2022, 38(10):230-234.
[2] 蔡树东, 黄浩, 阿里甫·努肉力, 等.骆驼乳对疾病辅助治疗作用研究进展[J].中国草食动物科学, 2019, 39(6):52-55.
CAI S D, HUANG H, ALIFU·NUROULI, et al.Research progress of the effect of camel milk the adjuvant treatment of diseases[J].China Herbivore Science, 2019, 39(6):52-55.
[3] 王瑞, 周克夫, 汪建红, 等.骆驼奶对I型糖尿病小鼠的辅助治疗效果[J].厦门大学学报, 2015, 54(3):331-334.
WANG R, ZHOU K F, WANG, J H, et al.Prevention and treatment effect of camel milk on type 1 diabetes mellitus[J].Journal of Xiamen University (Natural Science), 2015, 54(3):331-334.
[4] 高天, 杜冬华, 哈斯苏荣.驼乳对不同类型肝损伤的保护作用研究进展[J].畜牧与饲料科学, 2023, 44(4):116-121.
GAO T, DU D H, HA S S R, et al.Research progress on the protective effect of camel milk on different types of liver injury[J].Animal Husbandry and Feed Science, 2023, 44(4):116-121.
[5] ESLAMI O, SHIDFAR F.Dairy products and chronic kidney disease:Protective or harmful? A systematic review of prospective cohort studies[J].Nutrition, 2018, 55-56:21-28.
[6] 何静, 高婉婷, 明亮, 等.驼乳对Ⅱ型糖尿病小鼠的糖脂代谢及胰岛素抵抗的影响[J].中国食品学报, 2019, 19(3):115-120.
HE J, GAO W T, MING L, et al.Effects of camel milk on glucose and lipid metabolism and insulin resistance in a mice model of type II diabetes mellitus[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(3):115-120.
[7] 宋玉仙. IL-1β增强MSCs及其外泌体免疫抑制功能的机制研究[D].南京:南京大学, 2016.
ZHU Y X.Interleukin-1β enhances the immunosuppressive function of mesenchymal stem cell and their secreted exosomes[D].Nanjing:Nanjing University, 2016.
[8] 周斌, 万少兵, 王瑛, 等.IL-6通过调控JAK2/STAT3信号通路减轻急性肺损伤的机制研究[J].浙江医学, 2024, 46(2):131-138;226.
ZHOU B, WAN S B, WANG Y, et al.Mechanism of IL-6 alleviating acute lung injury through regulating JAK2/STAT3 signaling pathway[J].Zhejiang Medical Journal, 2024, 46(2):131-138;226.
[9] 李米亚, 陈越, 兰平, 等.IFN-γ在脑缺血中的双重作用[J/OL].生命科学, 2024.https://link.cnki.net/urlid/31.1600.q.20240807.1728.006.
LI M Y, CHEN Y, LAN P, et al.The dual role of ifen-γ in cerebral ischemia[J/OL].Chinese Bulletin of Life Sciences, 2024.https://link.cnki.net/urlid/31.1600.q.20240807.1728.006.
[10] KANG S, NARAZAKI M, METWALLY H, et al.Historical overview of the interleukin-6 family cytokine[J].Journal of Experimental Medicine, 2020, 217(5):e20190347.
[11] 张琳琳, 陈影, 滕膈玲, 等.TNF-α通过调控miR-363-3p/EZH2促进肺癌细胞增殖、迁移与侵袭[J].中国老年学杂志, 2021, 41(20):4545-4549.
ZHANG L L, CHEN Y, TENG G L, et al.TNF-α promotes the proliferation, migration and invasion of lung cancer cells by regulating miR-363-3p/EZH2[J].Chinese Journal of Gerontology, 2021, 41(20):4545-4549.
[12] 李雅菲, 郝世奇, 明亮, 等.驼乳对顺铂诱导小鼠急性肾损伤的预防保护作用[J].食品与发酵, 2024, 50(18):16-23.
LI Y F, HAO S Q, MING L, et al.Protective effect of camel milk on cisplatin induced acute kidney injury in mice[J].Food and Fermentation Industries, 2024, 50(18):16-23.
[13] 明亮, 赛娜, 其布勒, 等.驼乳预防小鼠急性酒精性肝损伤的代谢组分析[J].中国食品学报, 2023, 23(1):126-134.
MING L, SAI N, QIBULE, et al.Metabolomic analysis of camel milk in preventing acute alcoholic liver injury in mice[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(1):126-134.
[14] 包良, 汪姣, 杜吉雅, 等.溶血磷脂酰胆碱与动脉粥样硬化之间的关系[J].内蒙古医科大学报, 2023, 45(3):310-313;319.
BAO L, WANG J, DU J Y, et al.Relationship between lysophosphatidylcholine and atherosclerosis[J].Journal of Inner Mongolia Medical University, 2023, 45(3):310-313;319.
[15] SU D, LIAO L L, ZENG Q, et al.Study on the new anti-atherosclerosis activity of different herba patriniae through down-regulating lysophosphatidylcholine of the glycerophospholipid metabolism pathway[J].Phytomedicine, 2022, 94:153833.
[16] LI T, DING L J, WANG Y G, et al.Genetic deficiency of phactr1 promotes atherosclerosis development via facilitating M1 macrophage polarization and foam cell formation[J].Clinical Science, 2020, 134(17):2353-2368.
[17] OKA S, NAKAJIMA K, YAMASHITA A, et al.Identification of GPR55 as a lysophosphatidylinositol receptor[J].Biochemical and Biophysical Research Communications, 2007, 362(4):928-934.
[18] 吴育玲. 驼奶体内降糖活性研究[D].呼和浩特:内蒙古大学, 2018.
WU Y L. Study on hypoglycemic activity of camel milk in vivo[D]. Hohhot: Inner Mongolia University, 2017.
[19] 刘宸, 冯鑫欢, 豆智华, 等.新疆双峰驼乳对链脲佐菌素诱导的糖尿病小鼠肝脏的保护作用[J].食品科学, 2020, 41(9):74-80.
LIU C, FENG X H, DOU Z H, et al.Protective effect of Xinjiang bactrian camel milk on the liver of streptozotocin-induced diabetic mice[J].Food Science, 2020, 41(9):74-80.
[20] SHAN S H, WU C H, SHI J Y, et al.Inhibitory effects of peroxidase from foxtail millet bran on colitis-associated colorectal carcinogenesis by the blockage of glycerophospholipid metabolism[J].Journal of Agricultural and Food Chemistry, 2020, 68(31):8295-8307.
[21] 康崇鑫. 基于广靶代谢组学研究柚皮苷与根皮苷治疗溃疡性结肠炎小鼠的作用机制[D].武汉:中南民族大学, 2022.
KANG C X. Study on the mechanism of naringin and phloridzin in the treatment of ulcerative colitis in mice based on wide target metabonomics[D].Wuhan:South-Central Minzu University, 2022.
[22] JHA A K, HUANG S C C, SERGUSHICHEV A, et al.Network integration of parallel metabolic and transcriptional data reveals metabolic modules that regulate macrophage polarization[J].Immunity, 2015, 42(3):419-430.
[23] SEIM G L, BRITT E C, JOHN S V, et al.Two-stage metabolic remodelling in macrophages in response to lipopolysaccharide and interferon-γ stimulation[J].Nature Metabolism, 2019, 1(7):731-742.
[24] IACOBAZZI V, INFANTINO V.Citrate-new functions for an old metabolite[J].Journal of Biological Chemistry, 2014, 395(4):387-399.
[25] INFANTINO V, IACOBAZZI V, PALMIERI F, et al.ATP-citrate lyase is essential for macrophage inflammatory response[J].Biochemical and Biophysical Research Communications, 2013, 440(1):105-111.