姜黄素(curcumin,Cur)为黄色疏水性多酚,提取自姜黄科、天南星科等植物中,是姜黄中的主要生物活性成分[1]。研究证明,姜黄素有抗炎、抗氧化、抗病毒等多种生物活性,对炎症、代谢综合征、肝脏疾病和神经退行性疾病等多种慢性病具有一定的疗效[2-3]。然而,Cur水溶性低、化学结构不稳定、代谢迅速,导致其生物利用度低,限制了在食品及医药领域中的应用[4]。为了提高Cur的化学稳定性和生物利用度,Cur理想载体的开发成了必然趋势。CAI等[5]以太子参蛋白为基质制备的太子参蛋白-Cur纳米复合物,显著提高了Cur的稳定性、细胞摄取率和抗氧化活性。PAN等[6]利用喷雾干燥和pH诱导技术制备酪蛋白酸钠-Cur复合物,发现酪蛋白酸钠的包封提高了Cur的分散性和生物活性。羧甲基短直链葡聚糖-酪蛋白酸钠-果胶三元复合物不仅可以提高Cur的ABTS阳离子自由基清除能力,还可以实现模拟胃肠液中Cur的可控、持续释放[7]。此外,酪蛋白酸钠、玉米醇溶蛋白、果胶或羧甲基纤维素交联形成的纳米颗粒(160~210 nm)对Cur进行包封后,其抗氧化活性大大提高[8]。由此可见,采用适宜的大分子负载可有效提升Cur的稳定性和生物学活性。
生物基材料作为疏水活性分子的载体基质,具有生物降解性、生物相容性、可再生性以及与生物活性成分的强结合能力等诸多优势[9]。其中,蛋白质、多糖是常用基质,而蛋白质-多糖复合载体具有诸多优势,如天然无毒、价格低廉、制备工艺简单,具备大规模工业生产的前景[8]。复合载体中,蛋白质分子对生物活性化合物具有较强的亲和力(包封效率高),而多糖则作为蛋白质表面的保护层,具有较高的稳定性和水溶性,因此蛋白质-多糖复合物载体作为生物活性化合物的优良递送系统有巨大的应用潜力[9]。酪蛋白(casein,CN)是乳源蛋白质,约占牛奶蛋白的80%,含有人体必需的8种氨基酸。CN包括4种单体,分别为αs1-、αs2-、β-和κ-CN,常通过酸沉淀牛奶而制得。因富含亲水性和疏水性氨基酸,使CN成为一种优良的天然嵌段共聚物,在包封疏水性活性分子方面具有优势,常被作为疏水性活性分子载体基质[6]。研究表明,γ-环糊精-CN-海藻酸钠(sodium alginate,SA)协同稳定的纳米乳负载增加了Cur的生物可及性[10]。利用CN、玉米醇溶蛋白以及果胶、羧甲基纤维素的纳米复合物对Cur的包封效率高达80%,其抗氧化活性显著提高[8]。通过离子凝胶法制备的壳聚糖-CN-葡聚糖三元复合纳米颗粒负载后,虾青素的ABTS阳离子自由基清除能力显著提升,水分散性得以改善,细胞生物活性增强[9]。WANG等[11]研究发现CN与可溶性大豆多糖形成的复合物负载增加了Cur的溶解度、稳定性和生物利用度。可见,CN是性能优良的活性因子载体基质。
SA是一种亲水性多糖,来源于褐藻。SA具有良好的凝胶性、稳定性和高黏性,在食品、化妆品和制药工业中常用作增稠剂、胶凝剂等。此外,SA由于低毒性和优异的生物相容性而被广泛应用于生物医学材料[12-13]。LI等[14]研究发现,经SA负载可提高熊果酸的溶解性和抗氧化活性。而乳清蛋白-SA复合乳液凝胶的包封提高了番茄红素的胃肠道稳定性及其在肠上皮细胞的吸收率[15]。因此,蛋白质-多糖复合物在生物活性物质递送方面具有显著优势。然而,CN与SA复合物对Cur的结合作用及递送效果研究鲜有报道。
本文以CN、SA为基质,采用荧光分析法解析了添加不同比例SA后CN与Cur的结合作用,并采用喷雾干燥技术制备了CN-SA-Cur复合物;采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、X-射线衍射(X-ray diffraction,XRD)、扫描电镜(scanning electron microscope,SEM)表征了复合物结构,进而分析了复合物的理化性质和功能性质,并且比较了结合前后Cur的抗氧化活性。研究结果可为Cur的稳定性提升提供理论基础,也可为蛋白质-多糖递送系统的构建提供参考依据。
1 材料与方法
1.1 材料与试剂
将巴氏灭菌乳(购自兰州庄园牧场股份有限公司)于4 000×g离心30 min进行脱脂,收集脱脂乳并将pH值调至4.6沉淀CN;收集沉淀并进行冷冻干燥制得CN,4 ℃冷藏备用。经测定,CN中蛋白质含量为(91.37±0.29)%[16]。
Cur、SA,上海麦克林生化科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
RF-5301PC荧光分光光度计、S-3400 N扫描电子显微镜,日本日立仪器有限责任公司;Nicolet iS50 FTIR光谱仪,美国赛默飞世尔科学公司;XH-T多晶X射线衍射仪,北京普析通用仪器有限责任公司;STA 449 F5 TG-DSC热分析仪、STA449F5同步热分析仪,德国耐驰仪器制造有限公司;NAI-GZJ小型喷雾干燥机,上海那艾精密仪器有限公司;UV-1780双光束紫外可见分光光度计,岛津仪器有限公司;AD500S-H高速分散均质机,上海昂尼仪器仪表有限公司。
1.3 实验方法
1.3.1 CN-SA二元复合物的制备
将适量CN溶解于去离子水中,用1 mol/L NaOH调节pH值保持在6.8,得终质量浓度为2 g/L的CN溶液。取一定量SA溶于去离子水中,在37 ℃下磁力搅拌3 h,并于4 ℃过夜使其完全溶解,制得1 g/L的SA溶液。将制备的CN溶液和SA溶液分别按照10∶0、9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9的体积比混合,在37 ℃下磁力搅拌30 min,制备不同配比的CN-SA二元复合物。
1.3.2 CN-SA-Cur三元复合物的制备
将适量Cur溶于乙醇中,得终浓度为2 mmol/L的Cur乙醇溶液。将不同体积的Cur溶液与10 mL上述不同配比CN-SA二元复合物混合,得到Cur终浓度为0、5、10、20、30、40、50 μmol/L的混合物,使用涡流混合器混合30 s后分别于25、37、45 ℃加热20 min,在室温下冷却,制得CN-SA-Cur三元复合物,分别记作CN-SA-Cur 91、CN-SA-Cur 82、CN-SA-Cur 73、CN-SA-Cur 64、CN-SA-Cur 55、CN-SA-Cur 46、CN-SA-Cur 37、CN-SA-Cur 28、CN-SA-Cur 19。以单一CN基质制备复合物,记作CN-Cur。
采用上述方法,分别配制质量浓度为20、10 g/L的CN溶液和SA溶液。然后,将CN溶液与SA溶液按照1.3.1节的方法制备不同配比的CN-SA二元复合物,向500 mL CN-SA二元复合物中加入一定量的Cur溶液,使得Cur终浓度为50 μmol/L,将三元复合物于25 ℃下加热20 min并进行喷雾干燥,收集粉末用于结构及性质研究。
1.3.3 CN-SA与Cur相互作用分析
用荧光分光光度计测定样品荧光光谱,在290~500 nm范围内记录发射光谱,激发波长为280 nm,CN-SA-Cur 37、CN-SA-Cur 28和CN-SA-Cur 19样品的激发和发射狭缝分别设置为10、20 nm,其余样品的激发和发射狭缝均为10 nm。参考YANG等[17]的方法,利用Stern-Volmer方程和双对数方程计算CN-SA与Cur的结合参数。
1.3.4 CN-SA-Cur复合物的FTIR测定
将少量复合物粉末放于ATR元件上,采集红外图谱,扫描范围4 000~400 cm-1,仪器分辨率为2 cm-1。
1.3.5 CN-SA-Cur复合物的XRD测定
将复合物粉末用X射线多晶衍射仪在Cu Kα辐射下进行XRD扫描。
1.3.6 CN-SA-Cur复合物的SEM观察
取适量复合物粉末置于铜台上的导电胶条表面,小心涂抹使其分散为薄层,喷金后采用S-3400 N扫描电子显微镜观察,电压12.0 kV。
1.3.7 CN-SA-Cur复合物的堆积/敲击密度测定
将1 g样品倒入10 mL量筒(139 mm×13 mm),适当用玻璃棒轻轻敲击至量筒内样品表面水平且体积不再变化,记录样品体积,质量与体积之比即为堆积密度。然后匀速敲击量筒100次,再次记录样品体积,质量与体积之比即为敲击密度[18]。
1.3.8 CN-SA-Cur复合物的溶解性测定
称取适量样品,加入适量去离子水,于恒温磁力搅拌器在45 ℃下搅拌溶解2 h后定容至终质量浓度为1 mg/mL,室温放置2 h。将样品溶液移入15 mL恒重的离心管中,4 000 r/min离心10 min,去掉上清液,沉淀放入烘箱中于65 ℃烘至恒重,称重记为m0,样品溶液中蛋白质质量记为m1,溶解性计算如公式(1)所示[18]:
溶解度![]()
(1)
1.3.9 CN-SA-Cur复合物的热稳定性分析
参照DOH等[19]的方法,使用TG-DSC热分析仪测定复合物粉末的热稳定性。
1.3.10 CN-SA-Cur复合物的吸油性分析
将2.5 mL油加入0.25 g(w0)复合物粉末中,涡旋混合10 min后室温静置2 h,于4 000×g离心30 min,移除上层油相并称重沉淀,记为w1。吸油量的计算如公式(2)所示:
吸油性/(g油/g)![]()
(2)
1.3.11 CN-SA-Cur复合物的乳化性测定
参考GAO等[20]的方法,配制2 mg/mL复合物水溶液;取24 mL样品溶液与8 mL大豆油混合,采用高速分散机在10 000 r/min下均质1 min后,于室温下静置;分别在0、10、30 min时小心移取容器底部的乳化液50 μL,并与5 mL的1 g/L SDS溶液混匀,测定其在500 nm下的吸光值,以1 g/L SDS 溶液做参比。乳化性(emulsifying activity index,EAI)及乳化稳定性(emulsifying stability index,ESI)计算如公式(3)、公式(4)所示:
(3)
(4)
式中:C,乳化液形成前蛋白质的质量浓度,g/mL;θ,乳状液中油相体积分数,0.25;φ,比色池光径,1 cm;A0,乳液静置0 min 时的吸光值;A10/30,乳液静置10 min或30 min时的吸光值。
1.3.12 CN-SA-Cur复合物的发泡性测定
配制5 mg/mL的复合物水溶液,取30 mL样品溶液于50 mL烧杯中,采用高速分散机在10 000 r/min下均质1 min,分别在0、5、10 min测量泡沫体积。发泡性和泡沫稳定性由公式(5)、公式(6)计算:
发泡性![]()
(5)
泡沫稳定性![]()
(6)
式中:V0,0 min时的泡沫体积,mL;Vi,5、10 min时的泡沫体积,mL;Va,均质前样品溶液的总体积,mL。
1.3.13 CN-SA-Cur复合物的抗氧化性测定
抗氧化性测定参考YANG等[17]的方法,略有修改。
1.3.13.1 DPPH自由基清除能力测定
取0.5 mL 2 mg/mL CN-Cur、CN-SA-Cur复合物加入到3.5 mL 0.1 mmol/L的DPPH乙醇溶液中,充分混合均匀,室温下避光静置20 min;以游离Cur、CN和SA为对照。采用紫外-可见分光光度计于517 nm处测定混合物的吸光度。DPPH自由基清除率计算如公式(7)所示:
清除率![]()
(7)
式中:A1,加了DPPH溶液的样品吸光度;A2,用等体积乙醇代替DPPH的溶液吸光度;A0,用等体积水代替样品的溶液吸光度。
1.3.13.2 ABTS阳离子自由基清除能力测定
取0.5 mL 2 mg/mL CN-Cur、CN-SA-Cur复合物与3.5 mL配制好的ABTS储备液混合,室温静置6 min,测定734 nm处的吸光度值。ABTS阳离子自由基清除率计算如公式(8)所示:
清除率![]()
(8)
式中:Ac,等体积水代替样品的吸光度;At,被测样品的吸光度。
1.4 数据统计与分析
所有试验重复3次,试验数据采用Excel 2010处理并用“平均值±标准差”表示,用Origin Pro 9.0作图,用IBM SPSS Statistics 22进行差异显著性分析,数据间差异显著分析采用Duncan法,以P<0.05为显著差异。
2 结果与分析
2.1 Cur与CN-SA相互作用分析
2.1.1 荧光光谱分析
CN-SA-Cur复合物的荧光光谱如图1所示。由图1-A可知,在激发波长为280 nm时,CN的最大荧光发射波长为334.6 nm。添加Cur后,CN的荧光强度随Cur浓度的增加而降低,且其最大发射波长发生明显的蓝移,表明Cur的加入对CN的荧光有猝灭效果并且与CN形成了复合物。另外,活性分子的结合改变了CN的结构,使其色氨酸残基由亲水环境向疏水环境转化。研究发现,叶黄素结合使CN最大发射波长蓝移[21]。
SA的加入使CN的荧光强度降低,并且随着SA浓度的增加而降低(图1-B~图1-J)。当CN与SA的比例达到1∶9时,CN的荧光强度最低(图1-J),一方面是由于CN浓度的降低;另一方面,SA可能与CN形成了复合物,改变了CN结构,使其部分酪氨酸(Tyr)和色氨酸(Trp)残基包埋于复合物内部,从而使CN的荧光强度降低。此外,相同条件下,与CN-Cur复合物相比,SA的加入使Cur对CN的荧光猝灭效果更显著,表明CN-SA-Cur三元复合物的形成,进一步说明SA对Cur和CN的相互作用具有影响。

A-CN-Cur;B-CN-SA-Cur 91;C-CN-SA-Cur 82;D-CN-SA-Cur 73;E-CN-Cur 64;F-CN-SA-Cur 55;G-CN-SA-Cur 46;H-CN-SA-Cur 37;I-CN-SA-Cur 28;J-CN-SA-Cur 19
图1 不同温度下CN-Cur、CN-SA-Cur复合物的荧光光谱图
Fig.1 Fluorescence spectra of CN-Cur and CN-SA-Cur complexes at different temperatures
2.1.2 结合常数和结合位点数分析
Cur与CN、CN-SA结合过程相关参数如表1所示,Cur对CN以及CN-SA的猝灭速率常数Kq均高于猝灭剂对生物大分子的最大扩散碰撞常数[2.0×1010 L/(mol·s)],说明Cur对CN以及CN-SA的荧光猝灭是静态猝灭过程,即Cur与CN、CN-SA形成稳定基态复合物[22]。CN与Cur的结合常数Ka值随温度的升高而降低,说明结合过程为放热过程。然而,当加入SA且CN与SA体积比为9∶1和8∶2时,Ka值随温度的升高而增大,其结合过程变为吸热过程。CN与SA体积比为7∶3~1∶9时,Ka值随温度的升高而降低,其结合过程为放热过程。因此,SA对CN与Cur间相互作用的影响与其添加量有关。观察Ka值变化趋势发现,当CN与SA体积比为9∶1和8∶2时,CN-SA-Cur复合物的Ka值均高于CN-Cur复合物的Ka;而CN与SA体积比为7∶3~1∶9时,25 ℃下的Ka值均高于CN-Cur复合物的Ka,表明CN-SA对Cur的亲和力高于CN,这是因为SA和CN均带负电荷,在SA静电斥力作用下CN结构发生变化,促进了CN与Cur的结合。本团队前期研究发现,酪蛋白胶束与Cur的Ka为(6±0.3)×103 L/mol,与CN-Cur结合常数相近[17]。综合而言,CN-SA体积比为6∶4和5∶5时与Cur的结合常数较高。CN、CN-SA对Cur的结合位点数n约为1,说明SA的添加不影响Cur在CN上结合位点数。
表1 不同温度下CN-SA-Cur复合物的猝灭常数、结合常数和热力学参数
Table 1 The quenching constants, binding constants, and thermodynamic parameters of CN-SA-Cur complex atdifferent temperatures
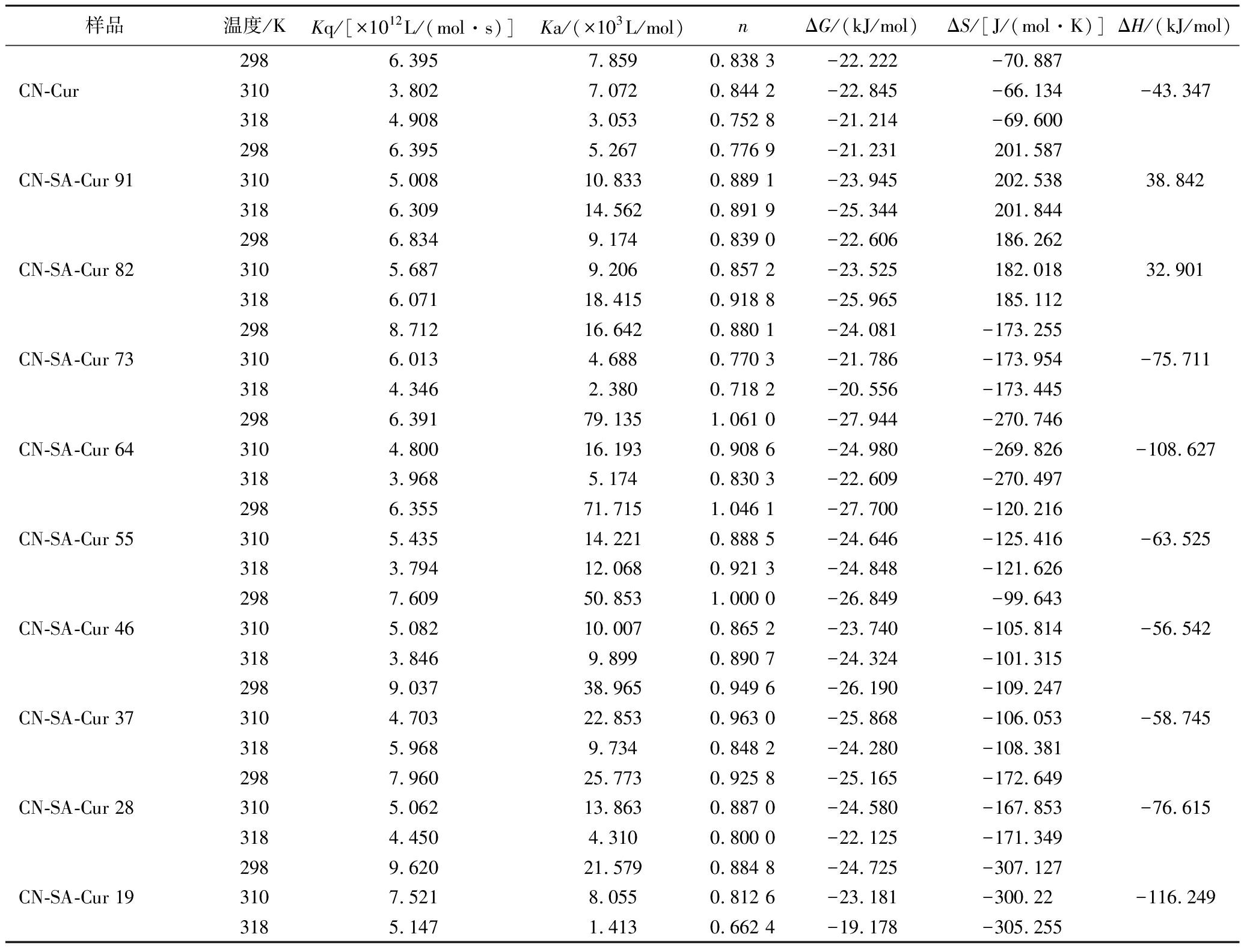
样品温度/KKq/[×1012L/(mol·s)]Ka/(×103L/mol)nΔG/(kJ/mol)ΔS/[J/(mol·K)]ΔH/(kJ/mol)2986.3957.8590.838 3-22.222-70.887CN-Cur3103.8027.0720.844 2-22.845-66.134-43.3473184.9083.0530.752 8-21.214-69.6002986.3955.2670.776 9-21.231201.587CN-SA-Cur 913105.00810.8330.889 1-23.945202.53838.8423186.30914.5620.891 9-25.344201.8442986.8349.1740.839 0-22.606186.262CN-SA-Cur 823105.6879.2060.857 2-23.525182.01832.9013186.07118.4150.918 8-25.965185.1122988.71216.6420.880 1-24.081-173.255CN-SA-Cur 733106.0134.6880.770 3-21.786-173.954-75.7113184.3462.3800.718 2-20.556-173.4452986.39179.1351.061 0-27.944-270.746CN-SA-Cur 643104.80016.1930.908 6-24.980-269.826-108.6273183.9685.1740.830 3-22.609-270.4972986.35571.7151.046 1-27.700-120.216CN-SA-Cur 553105.43514.2210.888 5-24.646-125.416-63.5253183.79412.0680.921 3-24.848-121.6262987.60950.8531.000 0-26.849-99.643CN-SA-Cur 463105.08210.0070.865 2-23.740-105.814-56.5423183.8469.8990.890 7-24.324-101.3152989.03738.9650.949 6-26.190-109.247CN-SA-Cur 373104.70322.8530.963 0-25.868-106.053-58.7453185.9689.7340.848 2-24.280-108.3812987.96025.7730.925 8-25.165-172.649CN-SA-Cur 283105.06213.8630.887 0-24.580-167.853-76.6153184.4504.3100.800 0-22.125-171.3492989.62021.5790.884 8-24.725-307.127CN-SA-Cur 193107.5218.0550.812 6-23.181-300.22-116.2493185.1471.4130.662 4-19.178-305.255
2.1.3 热力学分析
采用Van’t Hoff方程计算了Cur和CN、CN-SA结合过程的热力学参数如表1所示,ΔG为负值,说明CN、CN-SA与Cur之间的结合过程是自发进行的。CN与Cur结合过程的ΔH<0、ΔS<0,表明其结合的主要作用为范德华力和氢键[23];当CN与SA体积比为9∶1和8∶2时,结合过程ΔH>0、ΔS>0,表明Cur与CN-SA间主要结合作用为疏水作用。而当CN-SA体积比为7∶3~1∶9内时,Cur与CN-SA间的结合作用又变为范德华力和氢键。可见,加入少量SA显著影响了CN与Cur的结合作用,可能是SA与CN间的静电斥力改变了CN的结构,使其疏水位点暴露,易于与Cur形成疏水相互作用。当SA添加量较大时,CN被稀释,SA与CN间的相互作增强,SA掩盖了CN的部分疏水基团,改变了其与Cur的结合作用。本团队前期研究发现,酪蛋白胶束与葛根素间主要以氢键相互作用结合,而与黄豆苷元的结合主要以疏水相互作用为主[23]。可见,酪蛋白与活性分子间的结合作用不仅与分子类型和蛋白结构有关,受到体系中其他分子的影响。
由此可见,相比于CN单一负载体系,CN-SA二元复合物对Cur具有更高的亲和力,更利于Cur的负载,且CN-SA-Cur 55复合物于3个温度下的结合常数均可达到104 L/mol。
2.2 CN-SA-Cur复合物的FTIR分析
CN-SA-Cur复合物的FTIR谱如图2所示。其中,Cur在3 505 cm-1处的吸收峰为羟基伸缩振动,在1 627、1 602、1 428 cm-1处的吸收峰分别为C![]() O、C
O、C![]() C、C—C—C的伸缩振动[24]。CN在1 646 cm-1处的吸收峰为C
C、C—C—C的伸缩振动[24]。CN在1 646 cm-1处的吸收峰为C![]() O伸缩振动峰(酰胺I带),1 540 cm-1为N—H弯曲振动峰(酰胺Ⅱ带)[25]。SA在1 410、1 600 cm-1处的特征吸收峰分别为C—O的伸缩振动和—COO—的非对称伸缩振动[26]。在与CN、CN-SA结合后,Cur在1 428、1 602 cm-1处的特征吸收峰消失,说明CN-Cur、CN-SA-Cur复合物的形成。当添加少量SA后,CN的酰胺带未发生明显变化,但是SA在1 410、1 600 cm-1处的吸收峰消失;当SA添加量增加到CN与SA体积比为4∶6时,CN的酰胺I带和酰胺Ⅱ带消失,且SA的特征吸收峰随SA添加量的增加而增强,说明SA与CN发生了相互作用,促使CN结构改变,进而影响了CN与Cur的结合作用,与荧光分析结果一致。研究指出,甘草多糖与CN的结合可引起CN二级结构变化[27]。
O伸缩振动峰(酰胺I带),1 540 cm-1为N—H弯曲振动峰(酰胺Ⅱ带)[25]。SA在1 410、1 600 cm-1处的特征吸收峰分别为C—O的伸缩振动和—COO—的非对称伸缩振动[26]。在与CN、CN-SA结合后,Cur在1 428、1 602 cm-1处的特征吸收峰消失,说明CN-Cur、CN-SA-Cur复合物的形成。当添加少量SA后,CN的酰胺带未发生明显变化,但是SA在1 410、1 600 cm-1处的吸收峰消失;当SA添加量增加到CN与SA体积比为4∶6时,CN的酰胺I带和酰胺Ⅱ带消失,且SA的特征吸收峰随SA添加量的增加而增强,说明SA与CN发生了相互作用,促使CN结构改变,进而影响了CN与Cur的结合作用,与荧光分析结果一致。研究指出,甘草多糖与CN的结合可引起CN二级结构变化[27]。
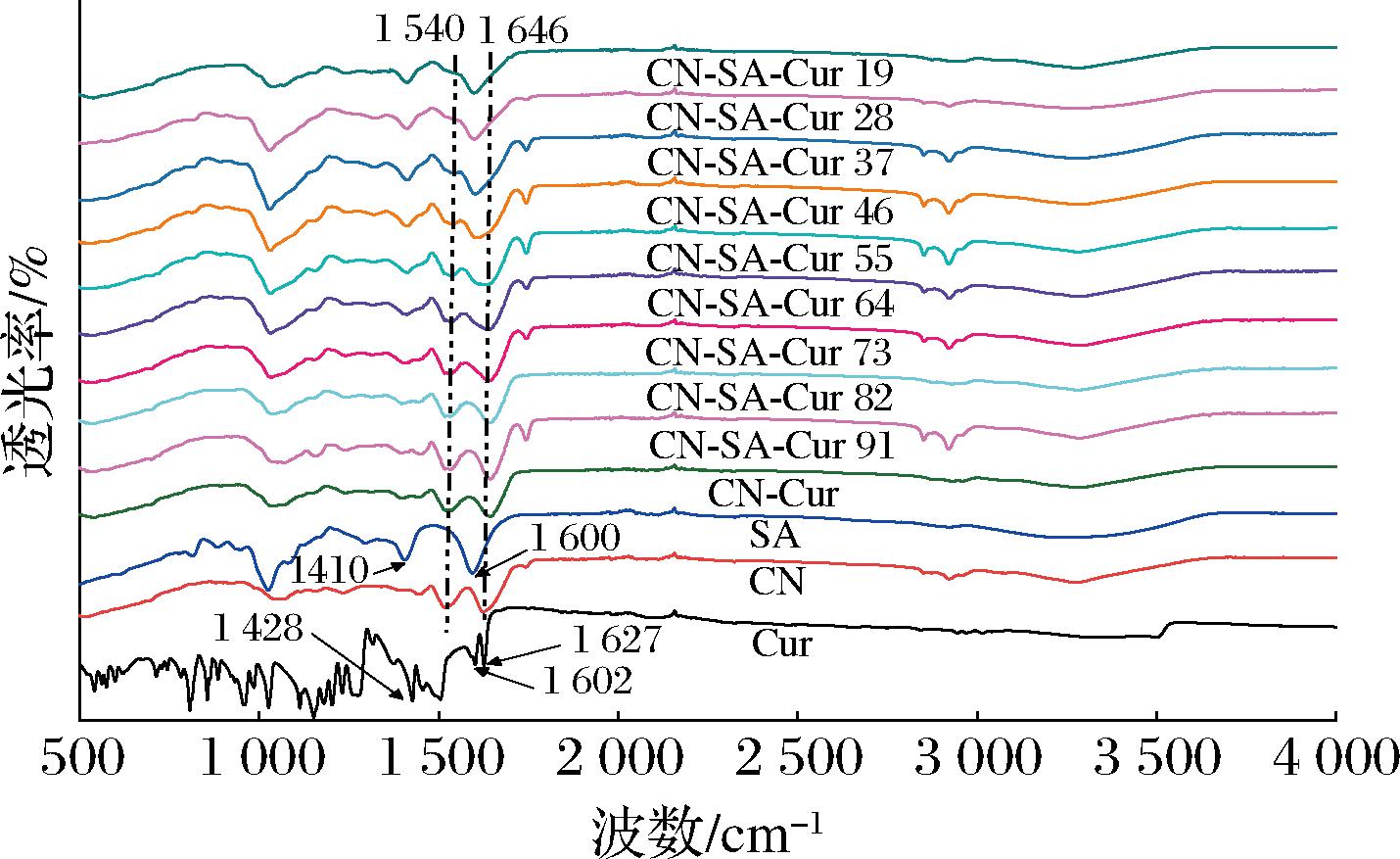
图2 CN-SA-Cur复合物的FTIR图
Fig.2 FTIR spectra of CN-SA-Cur complexes
2.3 CN-SA-Cur复合物的XRD分析
CN-SA-Cur复合物的XRD如图3所示,游离Cur有多个尖锐而窄的衍射峰,表明其具有较强的晶体结构特征;CN显示出聚合物的宽谱带,没有衍射峰,说明CN呈现无定形结构[28]。与CN及CN-SA结合后,Cur的特征衍射峰消失了,表明复合物的形成。有研究结果显示,与乳清蛋白结合后,Cur的特征峰消失,与本研究结果一致[29]。
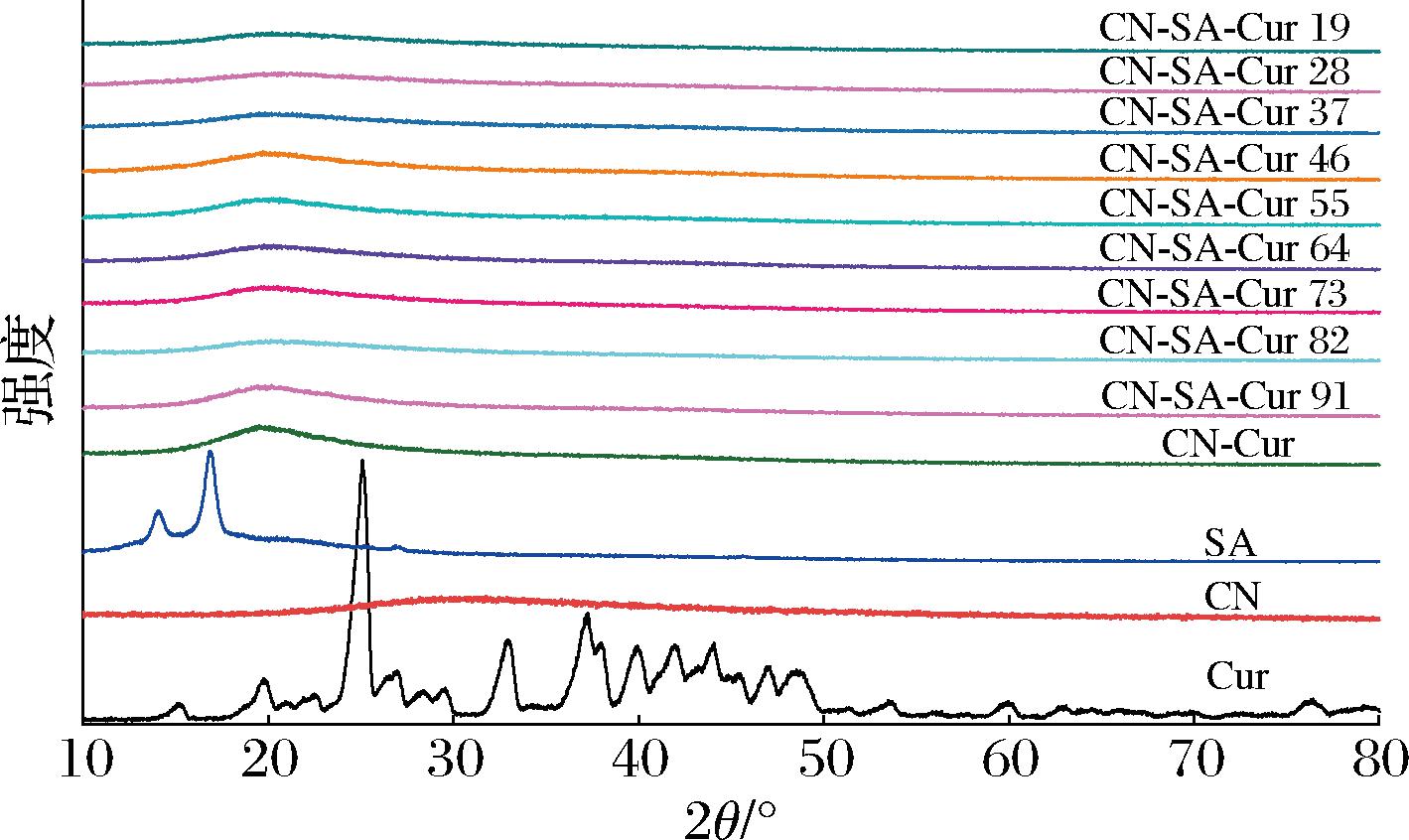
图3 CN-SA-Cur复合物的XRD图
Fig.3 XRD patterns of CN-SA-Cur complexes
2.4 CN-SA-Cur复合物的微观形貌
CN-SA-Cur复合物的微观形貌如图4所示,喷干的CN-Cur及CN-SA-Cur复合物为表面多褶皱的葡萄干状,且粒度分布不均匀。当少量SA添加时(CN-SA-Cur 91、CN-SA-Cur 82),复合物形貌变化不大;随着SA添加量的进一步增加,复合物粒径减小且粒度变得均匀,表面凹陷程度降低。当CN与SA的体积比为5∶5~4∶6时,复合物凹陷程度较低,表面粗糙程度增大,这是因为SA与CN在静电斥力下结构改变,Cur的结合可能在二者间形成了交联作用,使其形成了粗糙且较厚的外壁。当CN与SA的体积比为3∶7~1∶9时,复合物表面凹陷程度随SA添加量的增加而增加,且在1∶9时形貌与CN-Cur类似,这是因为CN量较少,与SA间相互作用减弱,SA作为大分子在喷干过程中迁移速率极慢,因而表面出现与CN类似的凹陷[18]。由此可见,CN-SA-Cur 55与CN-SA-Cur 46样品可形成较为均匀的微米球形颗粒,而荧光分析中CN-SA-Cur 55样品的结合常数最高,更利于其形成球形颗粒。

图4 CN-SA-Cur复合物的SEM图
Fig.4 SEM images of CN-SA-Cur complexes
2.5 CN-SA-Cur复合物的堆积/敲击密度分析
CN-SA-Cur复合物的堆积及敲击密度如图5所示,CN-Cur的堆积密度为(0.143±0.002) g/mL,添加SA对其堆积密度影响不大(P>0.05),SA与CN体积比为6∶4除外。这是由于SA与CN体积比为6∶4时,复合物粒径较小,表面凹陷程度最低(图4)。当SA与CN体积比为8∶2~6∶4时,复合物敲击密度显著减小(P<0.05),这是因为该添加量下复合物粒径减小,粒度变得均匀,表面凹陷程度降低,因而压缩性减小(图4)。当SA添加量进一步增加时,其敲击密度增大。因此,SA的添加对CN的堆积密度影响较小,而敲击密度与其添加量有关,CN与CN-SA负载复合物具有类似的堆积/敲击密度。
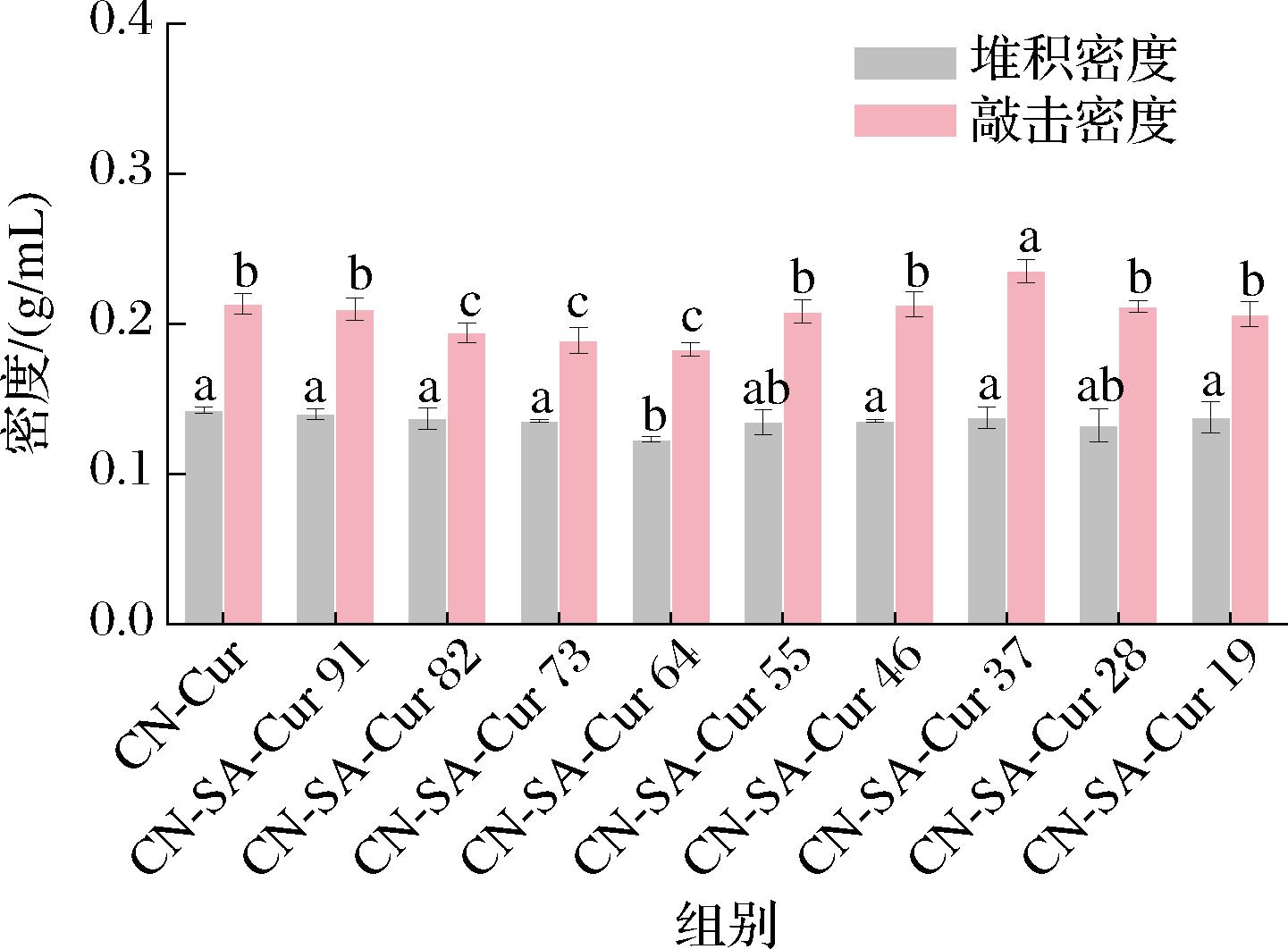
图5 CN-SA-Cur复合物的堆积和敲击密度
Fig.5 Bulk and tapped density of CN-SA-Cur complexes
注:不同小写字母表示不同样品间存在的显著差异(P<0.05)(下同)。
2.6 CN-SA-Cur复合物的溶解性分析
CN-SA-Cur复合物的溶解性如图6所示,CN-Cur的溶解性为(77.2±2.3)%。添加SA后,复合物的溶解性显著增加(P<0.05)。这是因为SA的溶解性高于CN,且SA与CN形成了复合物,溶解性增加。其中,最高达到(89.6±5.1)%(CN-SA-Cur 19)。然而,复合物溶解性随SA添加量的增加变化不显著(P>0.05)。因此,相比于CN-Cur,CN-SA-Cur具有更高的溶解性,且CN-SA更利于Cur的负载。
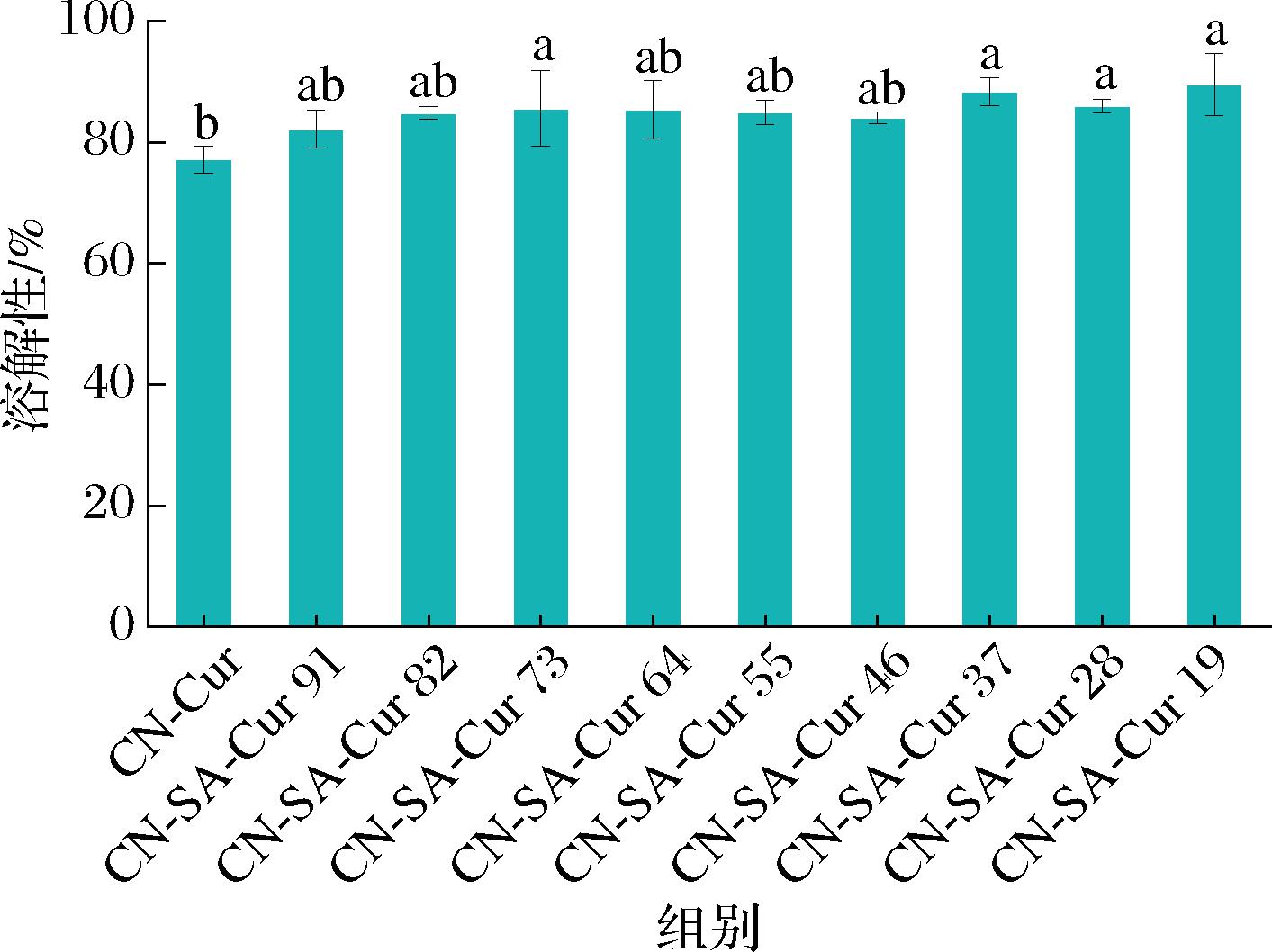
图6 CN-SA-Cur复合物的溶解性
Fig.6 Solubility of CN-SA-Cur complexes
2.7 CN-SA-Cur复合物的热稳定性分析
CN-SA-Cur复合物的差示扫描量热法(differential scanning calorimetry,DSC)、热重法(thermogravimetry,TG)和微商热重法(derivative thermogravimetry,DTG)曲线如图7所示。由图7-A可知,游离Cur在180 ℃出现一个吸热峰,这与之前报道[30]的Cur晶体的吸热峰一致。SA在239 ℃出现放热峰,是SA的热分解所致。但是,Cur与CN及CN-SA结合后,其吸热峰消失,说明复合物的形成。与CN-Cur复合物相比,CN-SA-Cur三元复合物的DSC曲线未发生显著变化,但是SA在239 ℃处的放热峰消失,说明三元复合物的形成。
复合物的TG曲线如图7-B所示,CN-Cur及CN-SA-Cur复合物均经历了2次失重。其中,CN-Cur第一阶段可能是蛋白表面的Cur解离所致,第二阶段是蛋白分解所引起的。CN-SA-Cur复合物的TG曲线与CN-Cur的相似,这是因为复合物基质相似。CN-Cur的剩余质量约为23%,而CN-SA-Cur中除CN-SA-Cur 91外,其余复合物剩余质量为29%~44%,显著高于CN-Cur,具有更高的热稳定性。其中,CN与SA体积比为6∶4~3∶7内复合物的热稳定性较高。
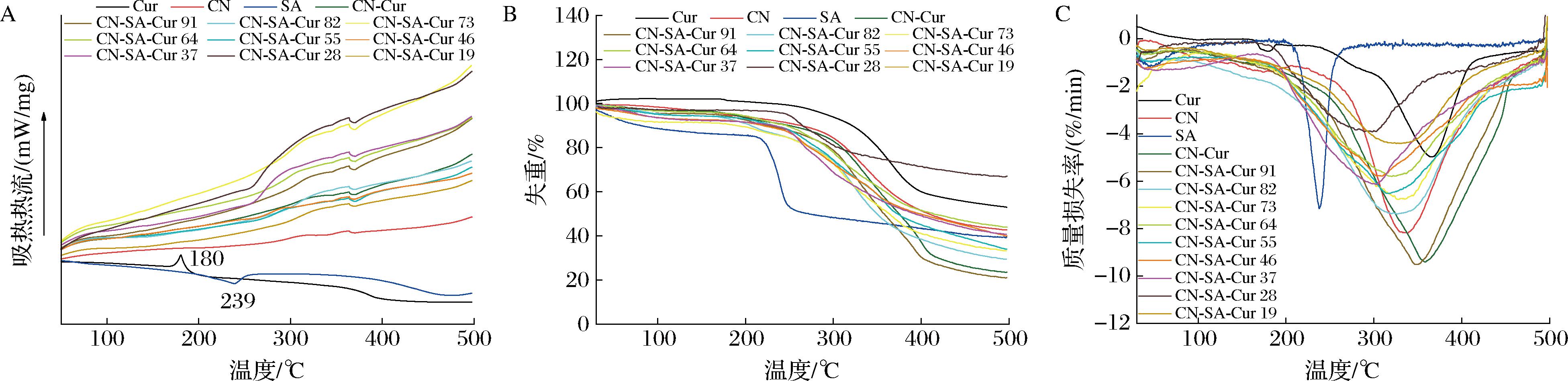
A-DSC;B-TG;C-DTG
图7 CN-SA-Cur复合物的DSC、TG、DTG曲线
Fig.7 DSC, TG, and DTG curves of CN-SA-Cur complexes
复合物的DTG曲线如图7-C所示,CN的热分解温度为336 ℃,SA的热分解温度为238 ℃。与Cur结合后,CN-Cur复合物的分解温度为358 ℃,可见Cur的加入提高了CN的热稳定性。与CN-Cur复合物相比,CN-SA-Cur三元复合物的热分解温度随SA添加量的增加而降低,但当CN与SA体积比达到8∶2以上时,其热分解温度略有增大。这是因为SA的分解温度低于CN,其添加量增大时,复合物分解温度降低。
综上所述,CN-SA负载体系具有更高的热稳定性,其中CN与SA体积比为6∶4~3∶7时形成的复合物热稳定性较高。
2.8 CN-SA-Cur复合物的吸油性分析
CN-SA-Cur复合物的吸油性如图8所示,与CN-Cur的吸油性相比(3.55±0.3) g油/g,添加SA之后复合物吸油性显著升高(P<0.05),之后随着SA添加量的增加先降低后增大,在CN-SA为1∶9时达到最大值,为(5.65±0.1) g油/g。添加少量SA后,复合物的形貌由表面较为光滑、凹陷程度大变为表面粗糙,凹陷变少且粒径变小,其敲击密度呈现先降低后增大的趋势,因此复合物捕捉油的能力也出现相似变化趋势。另外,有研究指出,因多糖的结构和基团与CN显著不同,其吸油性高于CN[31]。
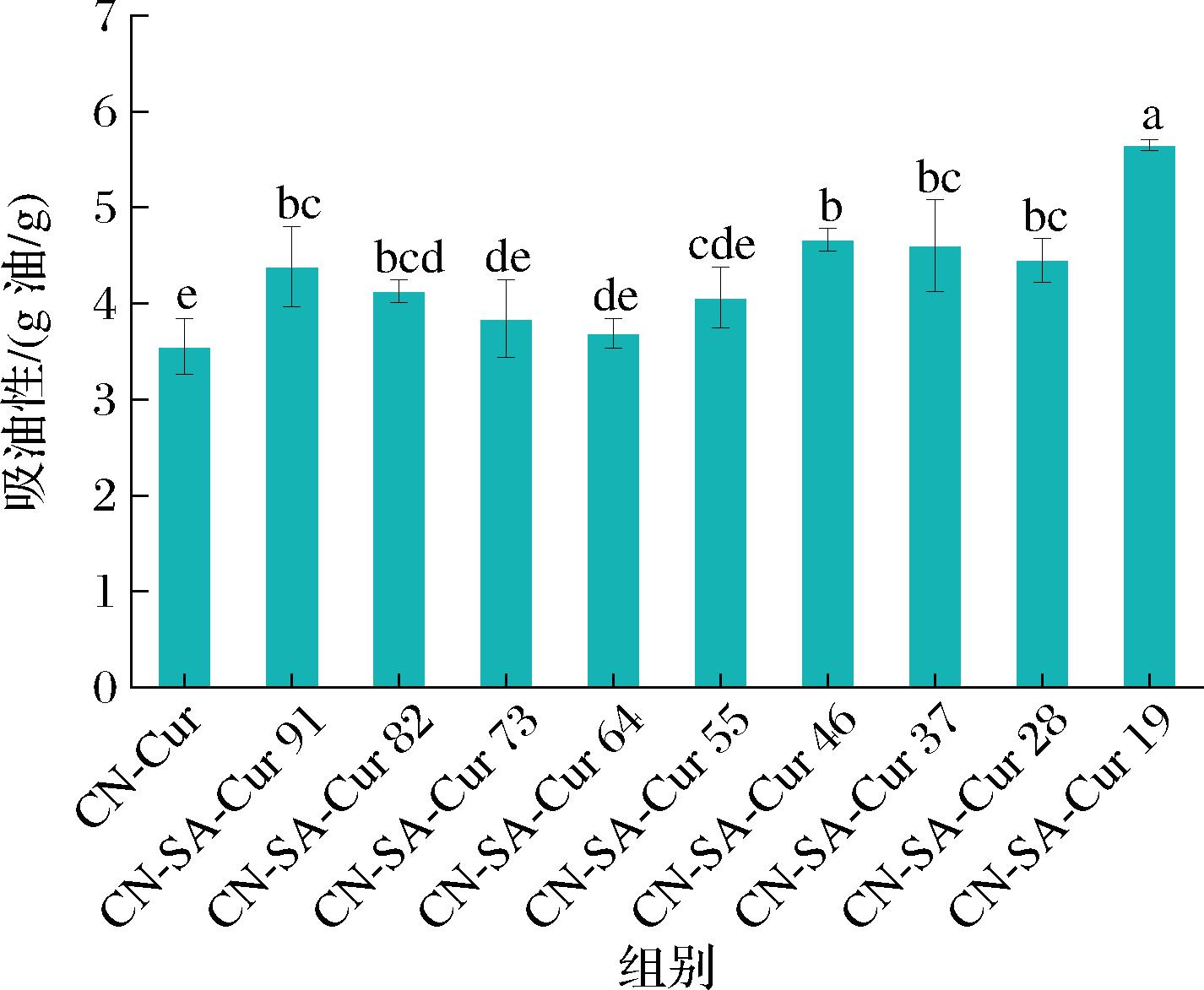
图8 CN-SA-Cur复合物的吸油性
Fig.8 Oil absorption of CN-SA-Cur complexes
2.9 CN-SA-Cur复合物的乳化性分析
CN-SA-Cur复合物的乳化活性和乳化稳定性如图9所示。由图9-A可知,当SA添加量超过20%后,复合物的乳化活性显著增大(P<0.05),并随着SA添加量的增加而增加。当CN-SA体积比达到5∶5时,复合物乳化性迅速增大,之后随SA添加量的增加而变化缓慢。SA与CN之间具有相互作用,此时CN结构改变,进而改变了CN在油水界面的吸附行为及界面薄膜的流变特性,从而提高其乳化性[32]。
由图9-B可知,随着SA添加量的增加,复合物的乳化稳定性呈现出先降低后稳定的趋势,与乳化活性变化趋势恰好相反。添加SA后,虽然增大了CN的乳化活性,但SA与CN的相互作用使得CN结构变化,且CN添加量减少,因此油滴表面吸附的CN与未吸附的SA间相互作用增强,使液滴发生聚集,乳化稳定性降低。相比单一CN,甘草多糖-CN复合体系具有更好的乳化活性,与本研究结果一致[27]。因此,CN-SA相较于单一CN具有更好的乳化活性,且其体积比为5∶5~1∶9最佳。
综合CN/CN-SA与Cur相互作用及复合物结构及性质分析发现,CN-SA二元体系更利于Cur的负载,且CN与SA体积比为5∶5时负载效果较佳。
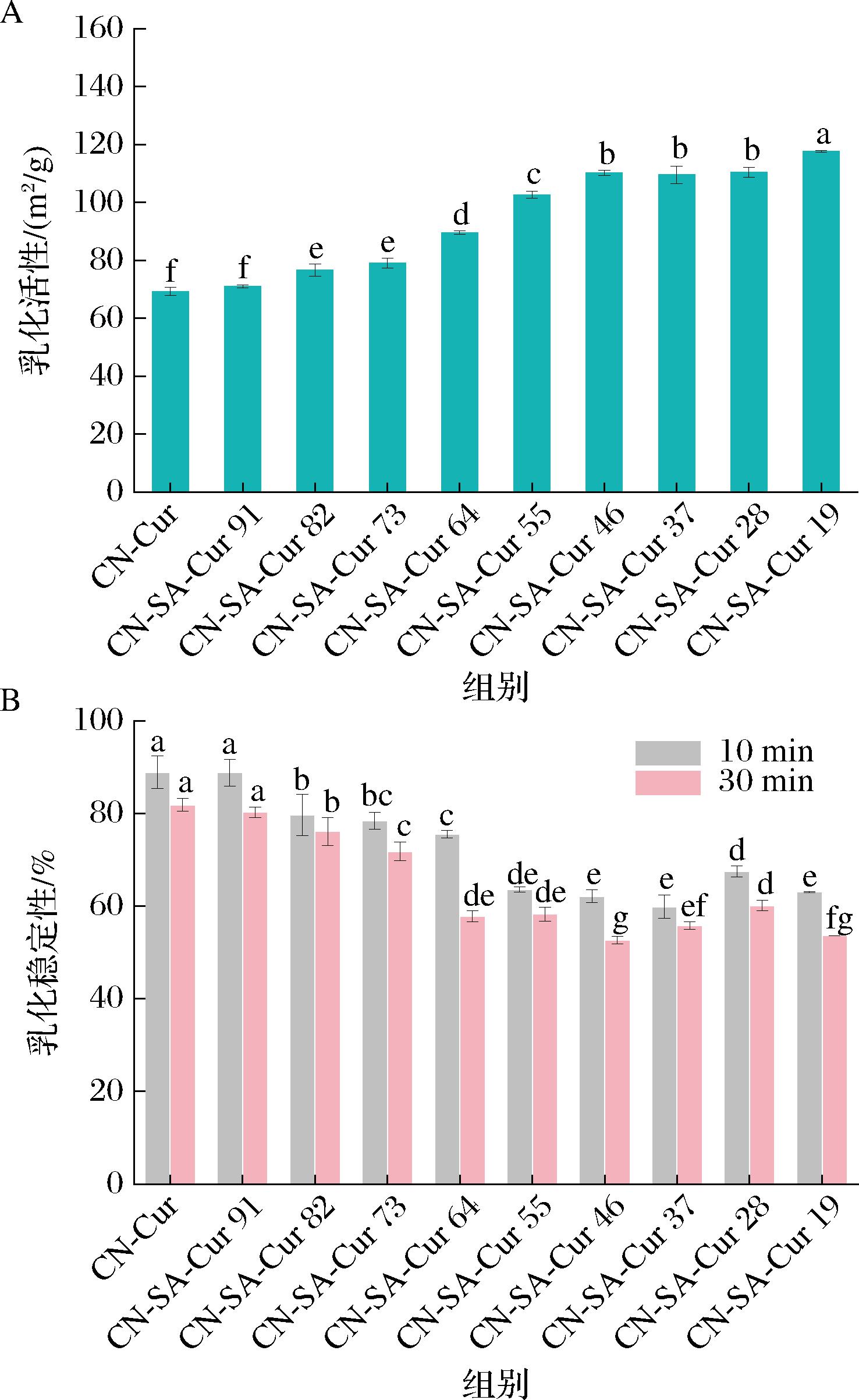
A-乳化活性;B-乳化稳定性
图9 CN-SA-Cur复合物的乳化活性和乳化稳定性
Fig.9 Emulsification activity and emulsification stability of CN-SA-Cur complexes
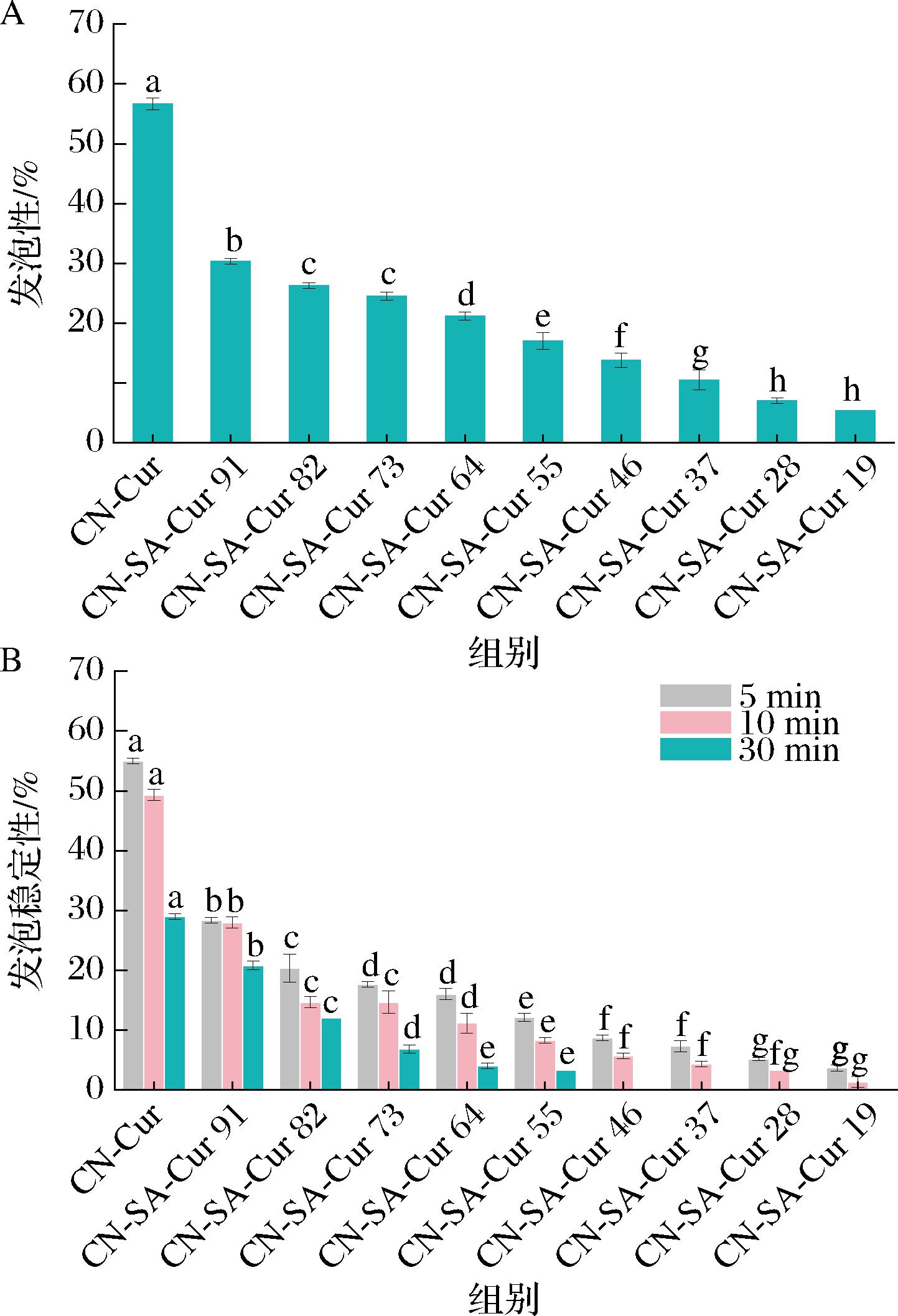
2.10 CN-SA-Cur复合物的发泡性及泡沫稳定性分析
CN-SA-Cur复合物的发泡性及泡沫稳定性如图10所示,CN-Cur的发泡性为(55±0.5)%;加入SA显著降低了CN的发泡性(P<0.05),且随着SA添加量的增加,发泡性降低。泡沫稳定性表现出与发泡性相似的变化趋势。发泡性反映了蛋白质对空气-水界面的稳定能力,发泡过程中蛋白质在界面上进行展开和构象重排[33]。复合物发泡性和泡沫稳定性的降低可能是因为随着SA添加量的增加,CN的量减少所导致的。另一方面,SA与吸附空气-水界面的CN产生相互作用,使其结构发生变化,降低了其界面张力,从而使发泡性及泡沫稳定性降低。
2.11 CN-SA-Cur复合物的抗氧化性
2.11.1 DPPH自由基清除活性
CN-SA-Cur复合物的DPPH自由基清除能力如图11所示,游离Cur与CN具有相似的DPPH自由基清除能力,而SA该能力较差。与CN结合后,Cur的DPPH自由基清除能力增大,但低于游离Cur和CN该能力的加和。总体而言,随着SA的添加,复合物的DPPH自由基清除能力降低,这是因为SA的该能力较低。相似文献报道,酪蛋白酸盐与Cur结合提高了DPPH自由基清除能力[34]。
A-发泡性;B-发泡稳定性
图10 CN-SA-Cur复合物的发泡性和发泡稳定性
Fig.10 Foaming capacity and foaming stability of CN-SA-Cur complexes
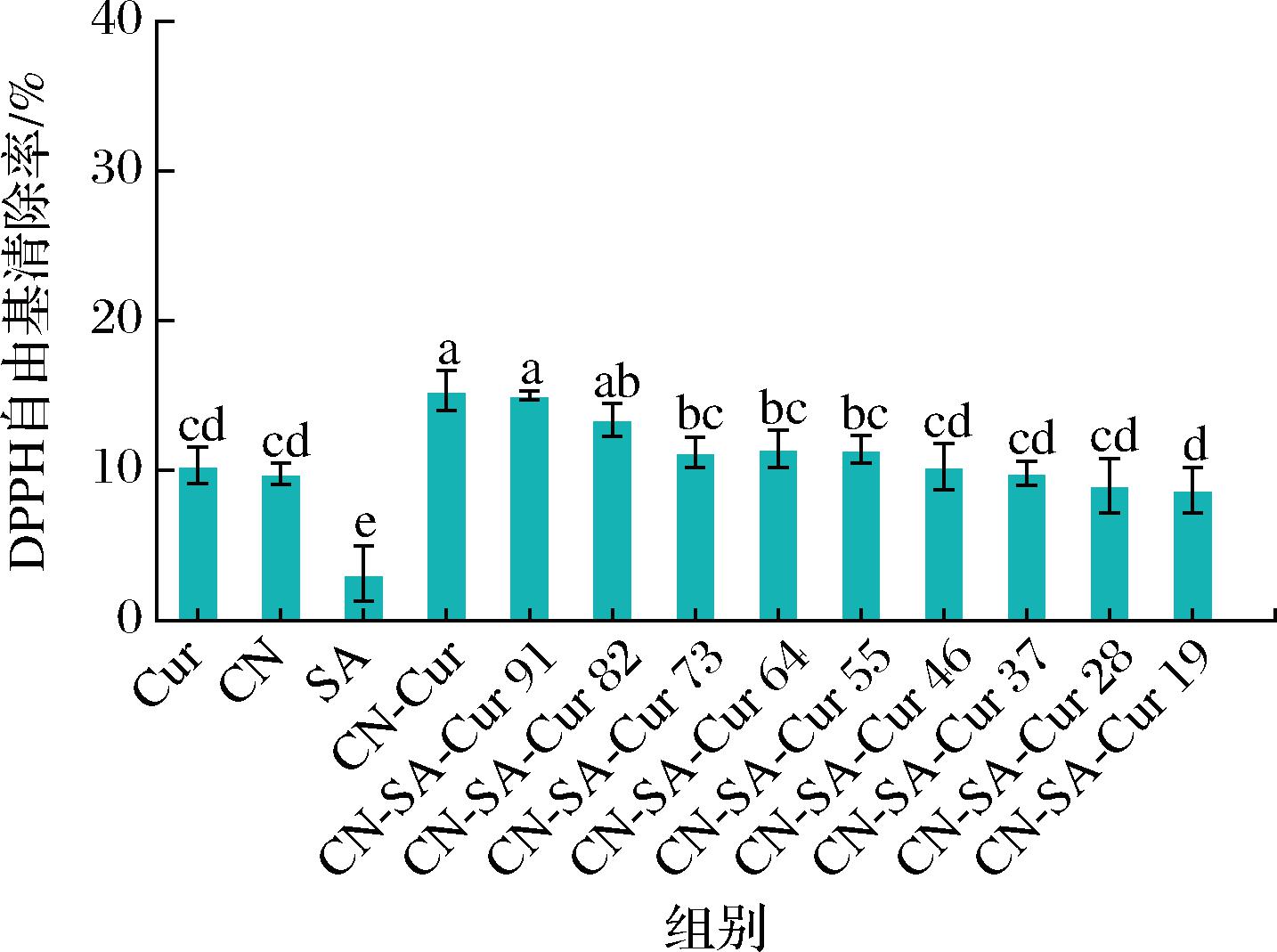
图11 CN-SA-Cur复合物的DPPH自由基清除能力
Fig.11 DPPH free radical scavenging activity of CN-SA-Cur complexes
2.11.2 ABTS阳离子自由基清除活性
CN-SA-Cur复合物的ABTS阳离子自由基清除能力如图12所示,SA基本没有ABTS阳离子自由基清除能力,游离Cur的ABTS阳离子自由基清除能力较低,与CN结合后,其ABTS阳离子自由基清除能力显著提高(P<0.05)。添加SA后,复合物的ABTS阳离子自由基清除能力进一步改善。当CN与SA体积比达到4∶6后,复合物的ABTS阳离子自由基清除能力降低,但当CN∶SA为1∶9时达到最高值,为(64±1.9)%。Cur为疏水性分子,与CN-SA结合使其疏水性降低,分散度增大,因此ABTS阳离子自由基清除能力增加。SA的加入进一步增大了复合物的溶解性,有利于Cur活性的发挥,且复合物CN-SA-Cur 19的溶解性最大(图6)。QU等[34]研究发现,酪蛋白酸盐与Cur复合物的ABTS阳离子自由基清除能力是游离Cur的3~4倍。可见,CN负载有利于改善Cur的活性。
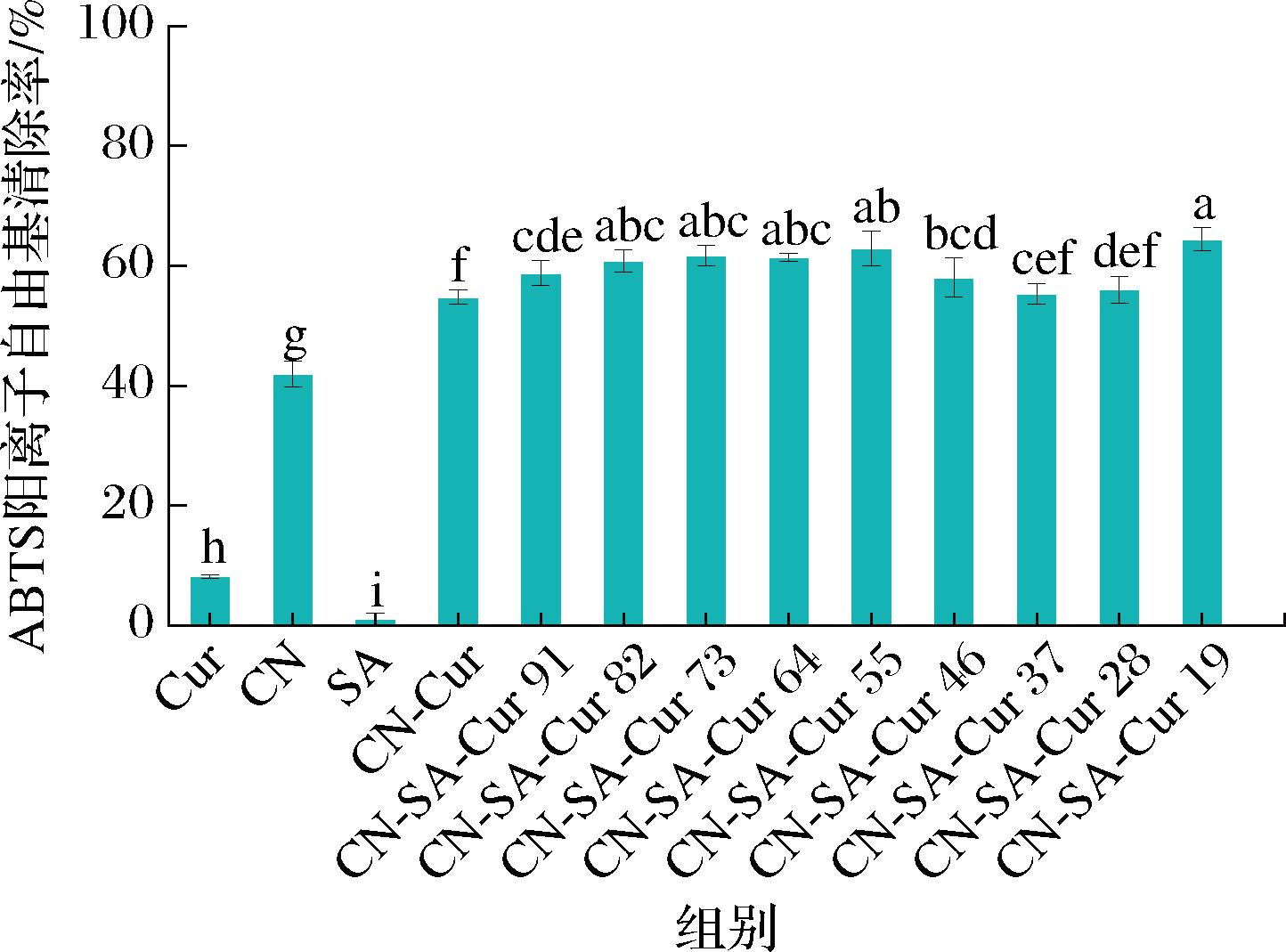
图12 CN-SA-Cur复合物的ABTS阳离子自由基清除能力
Fig.12 ABTS free cationic radical scavenging activity of CN-SA-Cur complexes
3 结论与讨论
相比于单一CN负载体系,CN-SA二元复合体系对Cur具有较高的结合亲和性,其结合常数大于103 L/mol。当CN-SA体积比为5∶5时,3种温度下其与Cur的结合常数均大于104 L/mol,结合亲和性更高,主要结合作用为范德华力和氢键。CN-Cur微胶囊表面凹陷程度大,而CN-SA-Cur 55和CN-SA-Cur 46复合物表面凹陷程度降低,呈现出较为均匀的微米球形颗粒。另外,CN-SA-Cur复合物相较于CN-Cur具有更高的溶解性、吸油性和乳化性。经CN-SA负载后,Cur的DPPH自由基及ABTS阳离子自由基清除能力提升。
综上所述,CN与SA体积比为5∶5时的二元复合体系利于Cur的负载。
[1] SAHNE F, MOHAMMADI M, NAJAFPOUR G D, et al.Enzyme-assisted ionic liquid extraction of bioactive compound from turmeric (Curcuma longa L.):Isolation, purification and analysis of curcumin[J].Industrial Crops and Products, 2017, 95:686-694.
[2] 赵志弘, 王莉娟, 李文惠, 等.姜黄素治疗帕金森病的作用机制研究进展[J].现代药物与临床, 2022, 37(10):2390-2396.
ZHAO Z H, WANG L J, LI W H, et al.Research progress on mechanism of curcumin in treatment of Parkinson’s disease[J].Drugs &Clinic, 2022, 37(10):2390-2396.
[3] GIORDANO A, TOMMONARO G.Curcumin and cancer[J].Nutrients, 2019, 11(10):2376.
[4] MONIRUZZAMAN M, MIN T.Curcumin, curcumin nanoparticles and curcumin nanospheres:A review on their pharmacodynamics based on monogastric farm animal, poultry and fish nutrition[J].Pharmaceutics, 2020, 12(5):447.
[5] CAI X X, WENG Q X, LIN J M, et al.Radix Pseudostellariae protein-curcumin nano complex:Improvement on the stability, cellular uptake and antioxidant activity of curcumin[J].Food and Chemical Toxicology, 2021, 151:112110.
[6] PAN K, LUO Y C, GAN Y D, et al.pH-driven encapsulation of curcumin in self-assembled casein nanoparticles for enhanced dispersibility and bioactivity[J].Soft Matter, 2014, 10(35):6820-6830.
[7] LI W H, YU Y, DAI Z Y, et al.Encapsulation of curcumin in a ternary nano complex prepared with carboxymethyl short linear glucan-sodium-caseinate-pectin via electrostatic interactions[J].Journal of Food Science, 2022, 87(2):780-794.
[8] CHANG C, WANG T R, HU Q B, et al.Caseinate-zein-polysaccharide complex nanoparticles as potential oral delivery vehicles for curcumin:Effect of polysaccharide type and chemical cross-linking[J].Food Hydrocolloids, 2017, 72:254-262.
[9] HU Q B, HU S Q, FLEMING E, et al.Chitosan-caseinate-dextran ternary complex nanoparticles for potential oral delivery of astaxanthin with significantly improved bioactivity[J].International Journal of Biological Macromolecules, 2020, 151:747-756.
[10] WANG C X, LI X J, SANG S Y, et al.Preparation, characterization and in vitro digestive behaviors of emulsions synergistically stabilized by γ-cyclodextrin/sodium caseinate/alginate[J].Food Research International, 2022, 160:111634.
[11] WANG Y H, GUO W Y, GAO X L, et al.Sodium caseinate and soluble soybean polysaccharide complex as nano-carriers of curcumin[J].Journal of Food Measurement and Characterization, 2021, 15(1):478-483.
[12] 王婷婷. 海藻酸钠微球包封L-抗坏血酸的制备及其在化妆品中的应用[D].无锡:江南大学, 2014.
WANG T T.Preparation of sodium alginate microspheres encapsulated L-ascorbic acid and its application in cosmetics[D].Wuxi:Jiangnan University, 2014.
[13] KONG H J, SMITH M K, MOONEY D J.Designing alginate hydrogels to maintain viability of immobilized cells[J].Biomaterials, 2003, 24(22):4023-4029.
[14] LI T, ZHANG X D, WANG H Y, et al.Development, physical-chemical characterization, and molecular docking simulations of ursolic acid-sodium alginate complexes[J].Journal of Agricultural and Food Chemistry, 2021, 69(47):14311-14319.
[15] 梁秀萍. 乳清分离蛋白-海藻酸钠乳液递送体系的设计及其对番茄红素稳态化的机制研究[D].咸阳:西北农林科技大学, 2022.
LIANG X P.Design of whey protein-alginate emulsion delivery system and its mechanism for homeostasis of lycopene[D].Xianyang:Northwest A&F University, 2022.
[16] 梁慧光, 甄晨波, 杨敏, 等.聚乳酸-酪蛋白基复合膜性质及其在草莓保鲜中的应用[J].食品与发酵工业, 2024, 50(18):9-15.
LIANG H G, ZHEN C B, YANG M, et al.Properties of poly (lactic acid)-casein composite membrane and its application on strawberry preservation[J].Food and Fermentation Industries, 2024, 50(18):9-15.
[17] YANG M, WEI Y M, ASHOKKUMAR M, et al.Effect of ultrasound on binding interaction between emodin and micellar casein and its microencapsulation at various temperatures[J].Ultrasonics Sonochemistry, 2020, 62:104861.
[18] 曾秋兵, 杨敏, 王裕成, 等.喷雾干燥工艺对胶束态酪蛋白结构及抗氧化性的影响[J].食品与发酵工业, 2020, 46(6):140-147.
ZENG Q B, YANG M, WANG Y C, et al.Effect of spray-drying conditions on the structure and antioxidant activities of micellar casein[J].Food and Fermentation Industries, 2020, 46(6):140-147.
[19] DOH H, DUNNO K D, WHITESIDE W S.Preparation of novel seaweed nanocomposite film from brown seaweeds Laminaria japonica and Sargassum natans[J].Food Hydrocolloids, 2020, 105:105744.
[20] GAO H, MA L, LI T Q, et al.Impact of ultrasonic power on the structure and emulsifying properties of whey protein isolate under various pH conditions[J].Process Biochemistry, 2019, 81:113-122.
[21] MANTOVANI R A, HAMON P, ROUSSEAU F, et al.Unraveling the molecular mechanisms underlying interactions between caseins and lutein[J].Food Research International, 2020, 138:109781.
[22] KHANJI A N, MICHAUX F, JASNIEWSKI J, et al.Structure and gelation properties of casein micelles doped with curcumin under acidic conditions[J].Food &Function, 2015, 6(12):3624-3633.
[23] WANG Y C, YANG M, QIN J J, et al.Interactions between puerarin/daidzein and micellar casein[J].Journal of Food Biochemistry, 2022, 46(2):e14048.
[24] YADAV D, KUMAR N.Nanonization of curcumin by antisolvent precipitation:Process development, characterization, freeze drying and stability performance[J].International Journal of Pharmaceutics, 2014, 477(1-2):564-577.
[25] AGARRY I E, WANG Z R, CAI T, et al.Chlorophyll encapsulation by complex coacervation and vibration nozzle technology:Characterization and stability study[J].Innovative Food Science &Emerging Technologies, 2022, 78:103017.
[26] QIN J J, YUAN Z W, AN J, et al.Highly stable emulsion gels with micellar casein based on the jamming transition, for bioactive molecule delivery[J].Food Hydrocolloids, 2023, 143:108874.
[27] 郭东起, 殷秀秀, 程焕, 等.甘草多糖与酪蛋白的相互作用及乳化性能[J].中国食品学报, 2023, 23(12):12-19.
GUO D Q, YIN X X, CHENG H, et al.The interaction mechanism and emulsifying properties of Glycyrrhiza polysaccharide and casein[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(12):12-19.
[28] MENG R, WU Z Z, XIE Q T, et al.Preparation and characterization of zein/carboxymethyl dextrin nanoparticles to encapsulate curcumin:Physicochemical stability, antioxidant activity and controlled release properties[J].Food Chemistry, 2021, 340:127893.
[29] MOHAMMADIAN M, SALAMI M, MOMEN S, et al.Fabrication of curcumin-loaded whey protein microgels:Structural properties, antioxidant activity, and in vitro release behavior[J].LWT, 2019, 103:94-100.
[30] MOHAMMADIAN M, MOGHADAM M, SALAMI M, et al.Whey protein aggregates formed by non-toxic chemical cross-linking as novel carriers for curcumin delivery:Fabrication and characterization[J].Journal of Drug Delivery Science and Technology, 2020, 56:101531.
[31] 黄雪松, 李颖思, 石思迷.大蒜多糖功能性质的研究[J].现代食品科技, 2009, 25(6):588-591.
HUANG X S, LI Y S, SHI S M.Study of functions and properties of garlic polysaccharide[J].Modern Food Science and Technology, 2009, 25(6):588-591.
[32] 梁瑞红, 董浩澜, 王学栋, 等.果胶结构特征对果胶-β-酪蛋白复合体系性质的影响[J].中国食品学报, 2020, 20(12):31-38.
LIANG R H, DONG H L, WANG X D, et al.Effects of pectin structure on the properties of pectin-β-casein complex systems[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(12):31-38.
[33] WU W G, CLIFFORD M, HOWELL N K.The effect of instant green tea on the foaming and rheological properties of egg albumen proteins[J].Journal of the Science of Food and Agriculture, 2007, 87(10):1810-1819.
[34] QU B, XUE J Y, LUO Y C.Self-assembled caseinate-laponite® nanocomposites for curcumin delivery[J].Food Chemistry, 2021, 363:130338.