淀粉是农业重要产出和基础工业原料,其基本生物组成单位为葡萄糖,葡萄糖单体经α-1,4糖苷键连接形成直链淀粉分子和在直链淀粉基础上经α-1,6糖苷键分支形成支链淀粉分子[1]。经特异性酶法水解,淀粉可被转化为葡萄糖、麦芽糖、麦芽寡糖或麦芽糊精等系列淀粉糖产品[2-5],并以高葡糖浆为主要淀粉糖产品。
酶法加工淀粉为葡萄糖所需酶制剂,包括淀粉液化酶和淀粉糖化酶。其中,淀粉糖化酶制剂多为复合型,主要组成为:丝状真菌葡糖淀粉酶(也称糖化酶)和细菌普鲁兰酶(总称为淀粉脱支酶)[6-7]。葡糖淀粉酶主要水解液化淀粉分子链末端的α-1,4糖苷键并释放葡萄糖,达到糖化目的[6];普鲁兰酶则主要水解淀粉分子内部α-1,6糖苷键,即淀粉脱支,可加速淀粉糖化反应并显著提升糖化效率和葡萄糖转化率[7]。因此,葡糖淀粉酶与普鲁兰酶间的应用酶学性质适配性与工业应用属性一致性,是影响淀粉酶法糖化和高质量葡萄糖浆制备的关键。现有与葡糖淀粉酶复配使用的普鲁兰酶,其酶学性质与葡糖淀粉酶之间存在一定差异[8-10],通过酶分子的定向进化缩小此差异是进一步提升淀粉高葡糖浆制备质量和效率的重要步骤[11-14]。此外,高葡糖浆产物中通常会形成少量低聚糖如异麦芽糖、潘糖等[15],虽然比例较低但影响产品质量并显著增加后提取精制成本。已有研究揭示,在相对酸性条件下实施淀粉糖化是降低此类副产物生成的有效途径之一,也就成为对普鲁兰酶分子性能改进的重要方向之一[16-17]。
在前期的研究中,作者所在实验室在实现我国普鲁兰酶工业化生产[18]的基础上,进一步就其工业应用属性(低pH、高反应温度)进行了深入研究,获得了反应温度和反应pH范围更有利于葡糖淀粉酶发挥淀粉糖化效能的系列普鲁兰酶新酶分子[16]。本文进一步对普鲁兰酶的耐热酸性进行定向分子进化并就所得新突变体在高葡糖浆制备中的应用性能进行系统评价,研究结果对高效复合糖化酶的质量提升和淀粉制糖工艺的进一步优化等具有指导意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
枯草杆菌(Bacillus subtilis)WB600、地衣芽胞杆菌(Bacillus licheniformis)CBBD302、重组质粒pUBB-PulA-N3以及表达载体pUBB113,为本实验室前期构建并保藏[10-11]。
1.1.2 酶与化学试剂
限制性内切酶等工具酶,宝生物工程(大连)有限公司产品;DNA片段胶回收试剂盒,美国OMEGA生物技术公司产品;普鲁兰酶、葡糖淀粉酶工业产品,山东隆科特酶制剂有限公司产品;异麦芽寡糖标准品(10 mg/mL),江苏锐阳生物科技有限公司;麦芽糊精[还原糖当量(dextrose equivalent,DE)值8~12],美国罗盖特公司;普鲁兰多糖,国药集团化学试剂有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
50 L发酵罐,上海保兴生物设备工程有限公司;Agilent 1200 高效液相色谱仪、Shodex RI-201 示差检测器,日本Shodex公司;SHZ-92A 恒温水浴振荡器,常州金坛良友仪器有限公司。
1.3 实验方法
1.3.1 突变位点选择
普鲁兰酶突变候选位点的遴选,按照前期报道的方法进行[10]。一般过程为:利用I-Mutant[19]预测,并运用Pymol软件[20]等进一步预测分析普鲁兰酶分子三级结构可能改变,初步遴选出候选突变位点。
1.3.2 重组质粒构建
采用重叠PCR方法[21],以重组质粒pUBB-PulA-N3[10] DNA为模板,在如下化学合成的寡核苷酸引物的介导下实施定点突变。所采用的引物为:Pr:5′-CTTCCTTCAACTCCAATTTTAATAGCATCC-3′,Pf:5′-GGATGCTATTAAAATTGGAGTTGAAGGAAG-3′,PulAf:5′-ATAGGATCCGATGGGAACACCACA-3′,PulAr:5′-CTATTTACCATCAGATGGGCTTACTT-3′。重组质粒的构建,按照实验室常规分子克隆技术进行[22]。一般步骤为:重叠PCR方法获得的突变DNA经BamH I酶切后,克隆入表达载体pUBB113中,用化学转化法[23]转化枯草杆菌WB600获得正确转化子,通过常规质粒DNA提取与限制性酶切图谱制备与分析获得正确重组质粒。
1.3.3 表达菌株的构建
通过电转化方法[24],将上述获得的重组质粒转化入表达宿主地衣芽胞杆菌CBBD302中,电转条件为:1 800 V,5 ms。电转培养液经复苏培养后涂布选择性培养基(LB中补充20 μg/mL卡那霉素)上,37 ℃培养36 h,将阳性菌落点种在含普鲁兰多糖的鉴定平板[22]上,对形成透明水解圈的重组菌进行质粒抽提、限制性酶切图谱进一步确认获得正确转化子。
1.3.4 突变体酶的制备
将上述获得的地衣芽胞杆菌CBBD302正确转化子,按照实验室常规方法[22]在50 L发酵罐中制备突变体酶液。一般过程为:在LB培养基中制备种子培养液,按3%接种量接种50 L发酵罐,发酵在45 ℃和200~800 r/min下进行,发酵过程维系溶解氧(dissolved oxygen,DO)在20%以上,必要时补加60%麦芽糖浆,发酵120 h并定时取样分析酶活。发酵结束后,发酵液经离心去除菌体并经微滤进一步净化酶液,以此作为普鲁兰酶突变体的粗酶液用于后续实验。
1.3.5 酶活测定及应用环境条件对酶活力的影响
普鲁兰酶活力的测定,参考GB 1886.174—2016《食品安全国家标准 食品添加剂 食品工业用酶制剂》中A.9普鲁兰酶活力的测定方法进行。酶活力定义为:在给定的反应条件下(pH 4.5,65 ℃),每分钟水解普鲁兰多糖产生相当于1 μmol葡萄糖所需的酶量,即为1个酶活力单位。葡糖淀粉酶活力的测定,参考GB 1886.174—2016中A.3葡糖淀粉酶活力的测定方法进行。酶活力定义为:在40 ℃、pH 4.6的条件下,1 h水解可溶性淀粉产生1 mg葡萄糖所需的酶量,即为1个酶活力单位,以U/mL或U/g表示。温度和pH对酶活力的影响,参照前期实验方法进行[16]。
1.3.6 淀粉葡萄糖浆的制备
参照前期文献方法进行[16]。其基本糖化工艺为:30%质量分数麦芽糊精;糖化条件:61 ℃,pH 4.3;酶添加量为:150 U/g(干重,下同)葡糖淀粉酶和1 U/g普鲁兰酶。反应在0.2 mol/L、pH 4.3磷酸氢二钠-柠檬酸缓冲液[22]中进行。期间定时取样,测定葡萄糖含量。评价不同普鲁兰酶的添加量(5、25、50 U/g)、不同葡糖淀粉酶添加量(150、125、100、75、50 U/g)、不同糖化温度下(61、63、65、67 ℃)、不同pH下(pH 4.0、4.1、4.2、4.3),糖化36 h,期间定时取样进行糖谱分析。淀粉高葡糖浆的放大制备试验在最适条件下于25 L糖化罐内进行,反应在150 r/min下持续36 h,定时取样分析。
1.3.7 糖液组成与糖谱分析
待检测样本煮沸灭酶后,加入等体积100 g/L三氯乙酸去除蛋白,上清液经适当稀释后,采用HPLC分析测定糖谱组成与葡萄糖含量。所采用的HPLC系统组成为:Agilent 1200高效液相色谱仪、Shodex RI-201示差检测器,色谱柱为:Alltech Prevail Carbohydrate Es 5 μm,流动相为65%(体积分数)乙腈,流速为1 mL/min,进样量为20 μL,柱温为35 ℃。以外标法通过出峰面积计算糖浆中葡萄糖等物质的含量。淀粉葡萄糖浆葡萄糖值(dextrose value,DX值)的计算,采用糖化样本中葡萄糖占干物质的比进行计算。干物质测定参考GB/T 22428.4—2008《葡萄糖浆干物质测定》的葡萄糖浆干物质测定方法进行。
2 结果与分析
2.1 普鲁兰酶N709I突变后在高温酸性条件下的酶活力得到提升
2.1.1 普鲁兰酶分子中N709I突变与突变体的制备
天然普鲁兰酶分子在酸性条件下的酶活力偏低,由此造成其在与葡糖淀粉酶复配使用时不能高效发挥其淀粉脱支作用[10]。在前期研究中,借助计算机分析与辅助设计经定点突变与实验分析获得高温酸性普鲁兰酶突变体PulA-N3,其在60 ℃和pH 4.5下呈现最高酶活力且在45~60 ℃或pH 4.0~5.5条件下呈现90%以上的最适酶活,与现有葡糖淀粉酶复合使用时可提升0.82%淀粉葡萄糖浆的DX值,达到96.08%[10]。由此可见,针对普鲁兰酶工业应用属性的改善,可显著改善其应用价值。本研究进一步尝试在普鲁兰酶突变体PulA-N3的基础上,针对其中的N709残基进行进一步突变。通过同源建模、结构模拟与比对发现,其N709残基突变为异亮氨酸(I)后,不会改变其主体结构,但因为异亮氨酸残基具有更高的疏水性且与邻近丙氨酸残基间新增1对氢键,极有可能会进一步改善酶分子的工业应用属性。
基于以上分析,以pUBB-PulA-N3质粒DNA为模板,通过重叠PCR扩增并引入N709I突变位点并克隆入表达载体pUBB113获得重组质粒pPulA-I(图1-A)。提取此重组质粒DNA并转化入地衣芽胞杆菌CBBD302,正确的转化子在普鲁兰多糖鉴定平板上呈现明显普鲁兰多糖水解圈(图1-B),将此突变体命名为PulA-N9(简称N9)。进一步按照本实验室常规在50 L发酵罐中制备酶液,发酵持续120 h,发酵最高酶活达到1 200 U/mL以上,收集发酵液,离心收集上清液作为粗酶液于4 ℃保存,用于后续试验。
2.1.2 普鲁兰酶突变体N9的应用酶学性质分析
对突变体N9的作用pH和作用温度等酶学性质进行了分析并与其复配的葡糖淀粉酶比较,结果如图2所示。突变体N9在60 ℃和pH 4.5下表现出最佳酶活力,与突变体PulA-N3相似[10,16],但明显优于野生型普鲁兰酶PulA[16]。突变体N9在60~65 ℃可保留95%以上酶活力,则明显优于突变体PulA-N3[10,16];在pH 4.3和4.0下可分别保留96%和85%酶活力,与突变体PulA-N3相似但也明显优于野生型[10,16]。另一方面,现阶段工业上使用的葡糖淀粉酶,其最适作用条件为60 ℃和pH 4.0,并且在65 ℃和pH 4.0~4.5均具有90%以上的酶活力(图2)。由此可见,本研究获得的突变体N9与现工业上使用的葡糖淀粉酶呈现几乎一致的工业应用属性,预示其在淀粉葡萄糖浆酶法制备中的可能具有更优的应用价值。
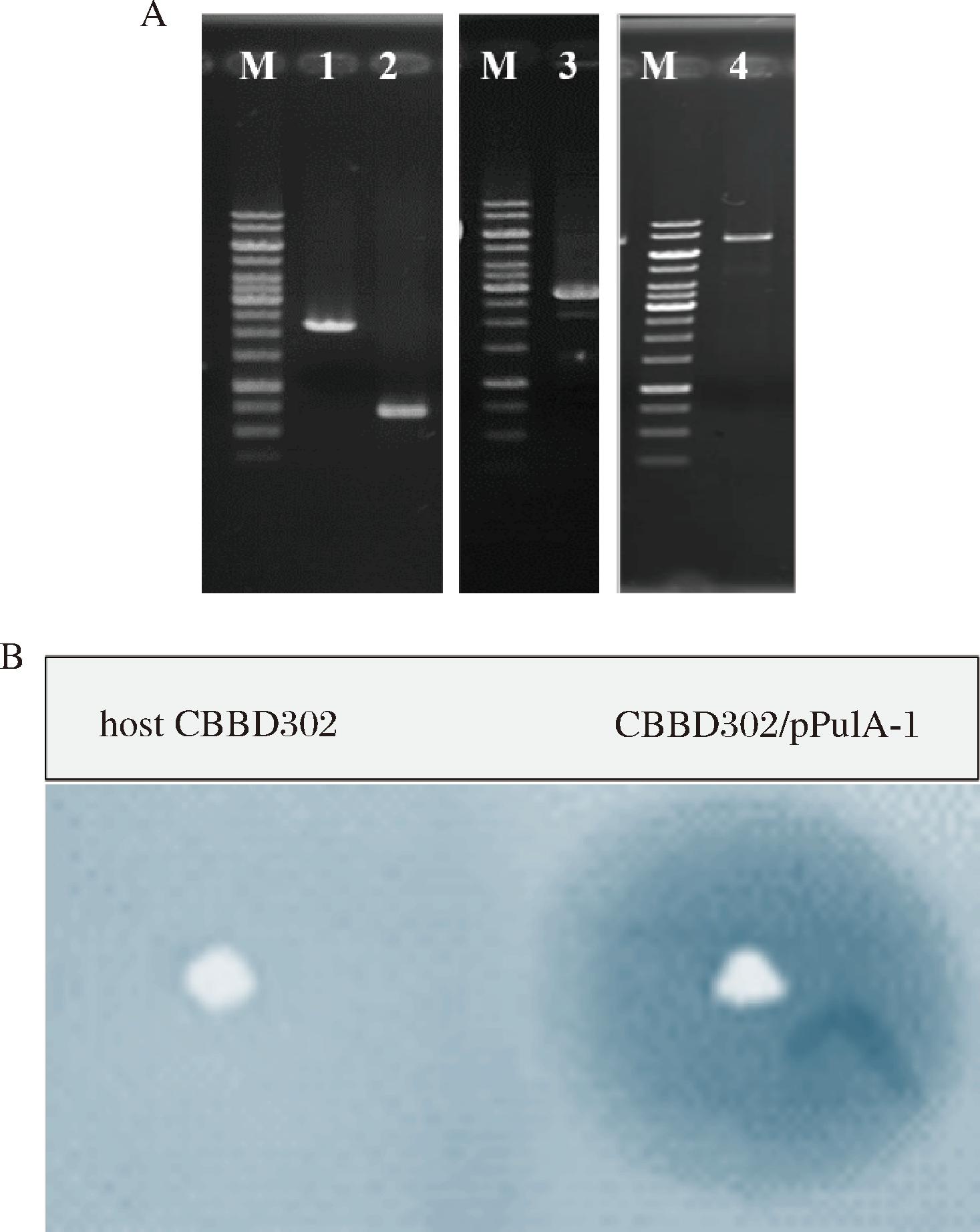
1、2-点突变重叠PCR制备的上、下游片段;3-重叠PCR全长基因片段;4-重组表达质粒pPulA-I/BamH I物理图谱;M-DNA分子量参照,1 kb Ladder。
A-普鲁兰酶PulA定点突变;B-重组菌在普鲁兰糖平板上呈现明显普鲁兰糖水解活性
图1 普鲁兰酶PulA 定点突变及其重组菌构建
Fig.1 The site-directed mutagenesis of pullulanase PulA and its expression recombinant development
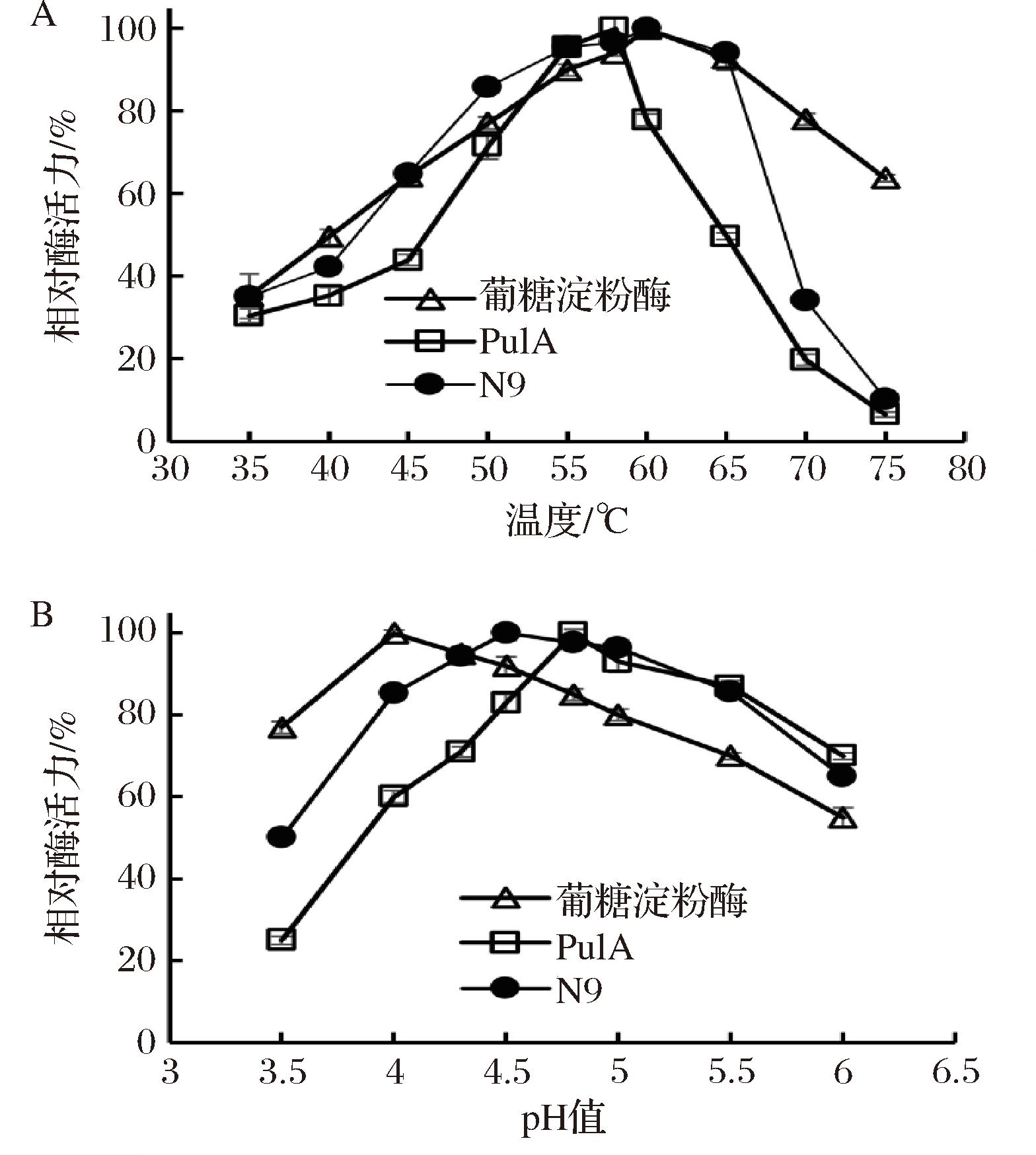
A-温度对酶活力的影响;B-pH对酶活力的影响
图2 温度和pH对普鲁兰酶突变体酶活力的影响
Fig.2 Effect of temperature and pH on activities of pullulanase mutant N9
2.2 普鲁兰酶N9在淀粉糖化中的作用特征
2.2.1 普鲁兰酶突变体N9具有更好辅助葡糖淀粉酶糖化的性能
模拟现有工业体系淀粉制葡萄糖浆的糖化工艺,在相同糖化工艺条件下,比较分析突变体N9在淀粉制葡萄糖中的作用,结果如图3所示。普鲁兰酶突变体N9辅助葡糖淀粉酶的淀粉糖化,其葡糖糖浆DX值最高达到96.50%,较对照PulA的DX值提高0.72%(96.50%/95.78%),且糖化时间相缩短了12 h。由此可见,普鲁兰酶N9可更好配合葡糖淀粉酶的淀粉糖化,有必要就其相关应用可能性进行进一步分析。
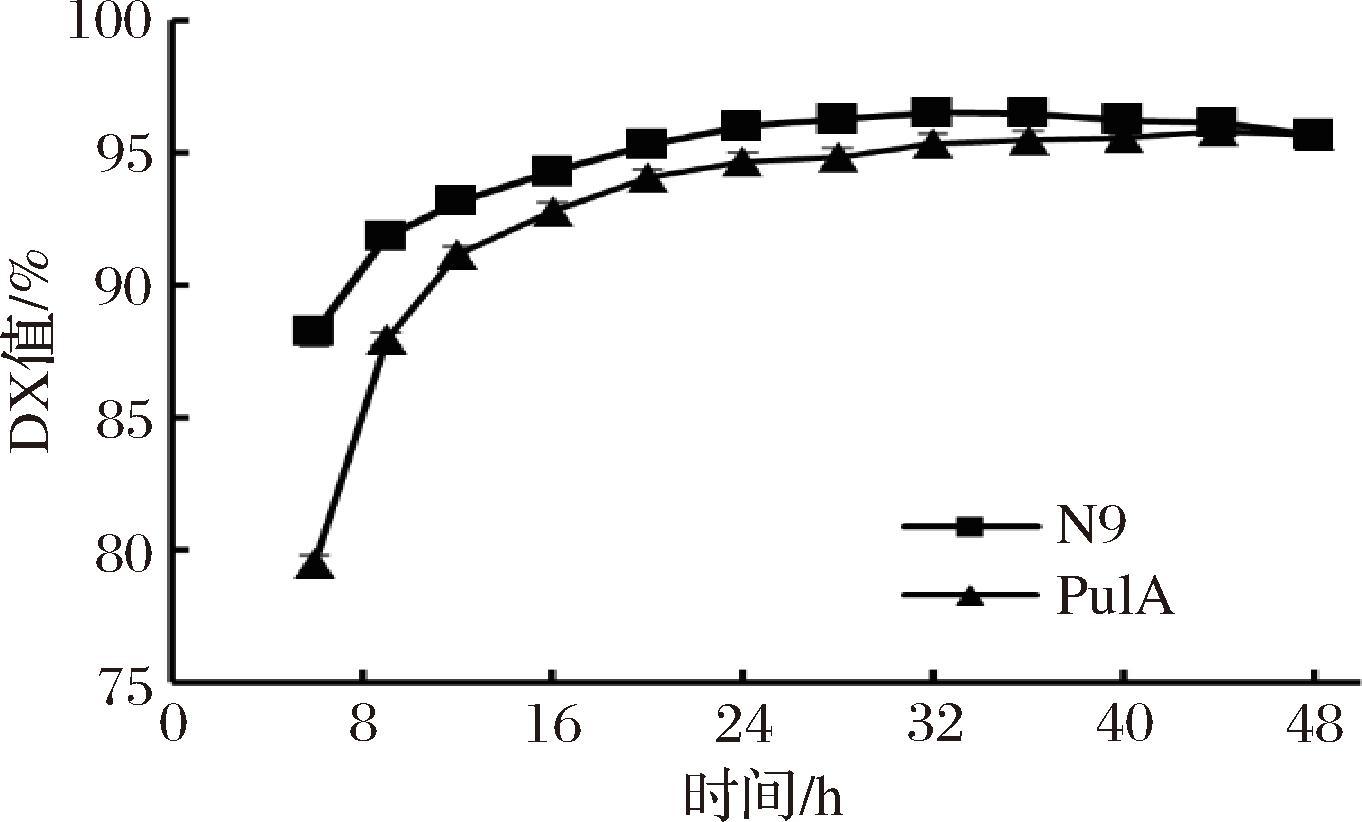
图3 普鲁兰酶N9在酶法制高葡糖浆中的作用
Fig.3 Effect of pullulanase N9 on preparation of high glucose syrup
2.2.2 提高普鲁兰酶突变体N9用量可显著缩短糖化时间
在相同剂量的淀粉糖化酶和不同剂量的普鲁兰酶N9作用下,淀粉糖化达到预设终点的时间变化如图4所示。在5 U/g普鲁兰酶N9作用20 h或25 U/g普鲁兰酶N9作用16 h后,糖浆DX值分别达到97.20%和97.39%。使用50 U/g普鲁兰酶N9作用16 h后,糖液DX值增加到97.81%,并且较25 U/g普鲁兰酶N9添加量下提高了0.42%(97.81%/97.39%),但糖化所需时间并未缩短。由此可见,提高普鲁兰酶N9的添加量可以明显缩短糖化时长并提升葡萄糖的生成量,25 U/g添加量已经可以在较短时间内完成淀粉脱支反应。后续实验基于25 U/g的添加量进行。
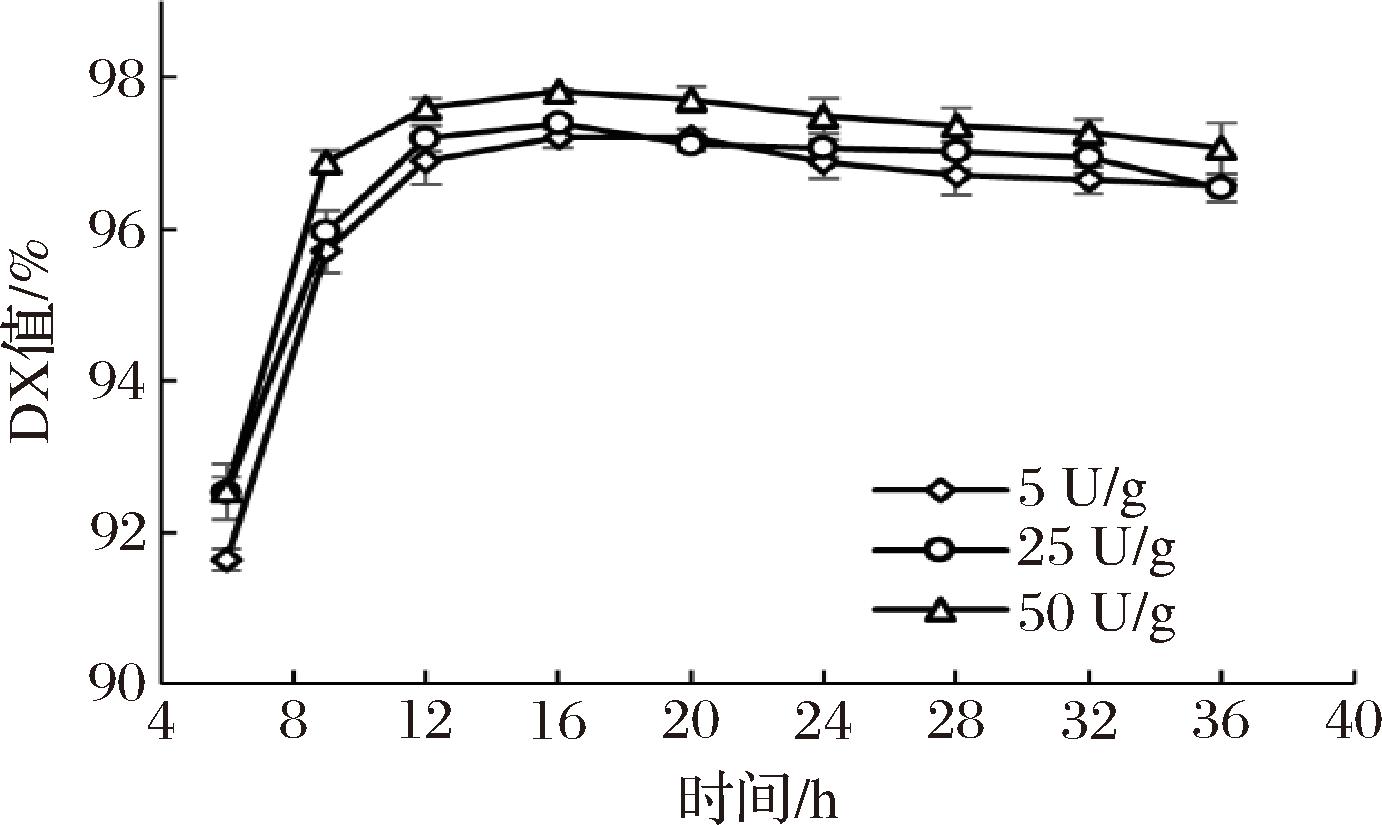
图4 普鲁兰酶突变体N9添加量对淀粉酶法糖化效率的影响
Fig.4 Effect of pullulanase N9 dosage on starch saccharification efficiency
2.2.3 提高糖化温度或降低糖化pH皆有利于淀粉高葡糖浆的制备
在淀粉酶法制糖过程中,在保证酶催化活力的前提下,提高糖化温度,可以在一定程度上提升酶促反应速率,提升糖化效率[25]。在现有葡糖淀粉酶工业酶制剂主导下,进一步降低糖化pH,则有可能降低葡糖淀粉酶在糖化后期催化生成异麦芽糖并影响产品质量的副反应[16]。上述实验结果已经显示,普鲁兰酶突变体N9具有在较高温度和较低pH下发挥催化作用。为此,进一步在61、63、65、67 ℃温度下进行淀粉糖化试验,结果如图5所示。在61、63、65 ℃下糖化16 h,糖液中葡萄糖含量分别达到最大值97.36%、97.41%、97.50%;糖化温度从61 ℃提高至65 ℃,糖浆的最高DX值提高了0.14%(97.50%/97.36%)。继续升高糖化温度至67 ℃后,在最初6 h内,反应体系中葡萄糖生成速率保持最高,但后续降速明显;糖化20 h后,糖浆中葡萄糖含量达到最大的96.61%。由此可见,使用普鲁兰酶突变体N9后,淀粉糖化温度最高可以提升到不超过65 ℃,在提高酶促糖化温度下,除了DX略有提升外,淀粉糖化效率也得到有效提升。
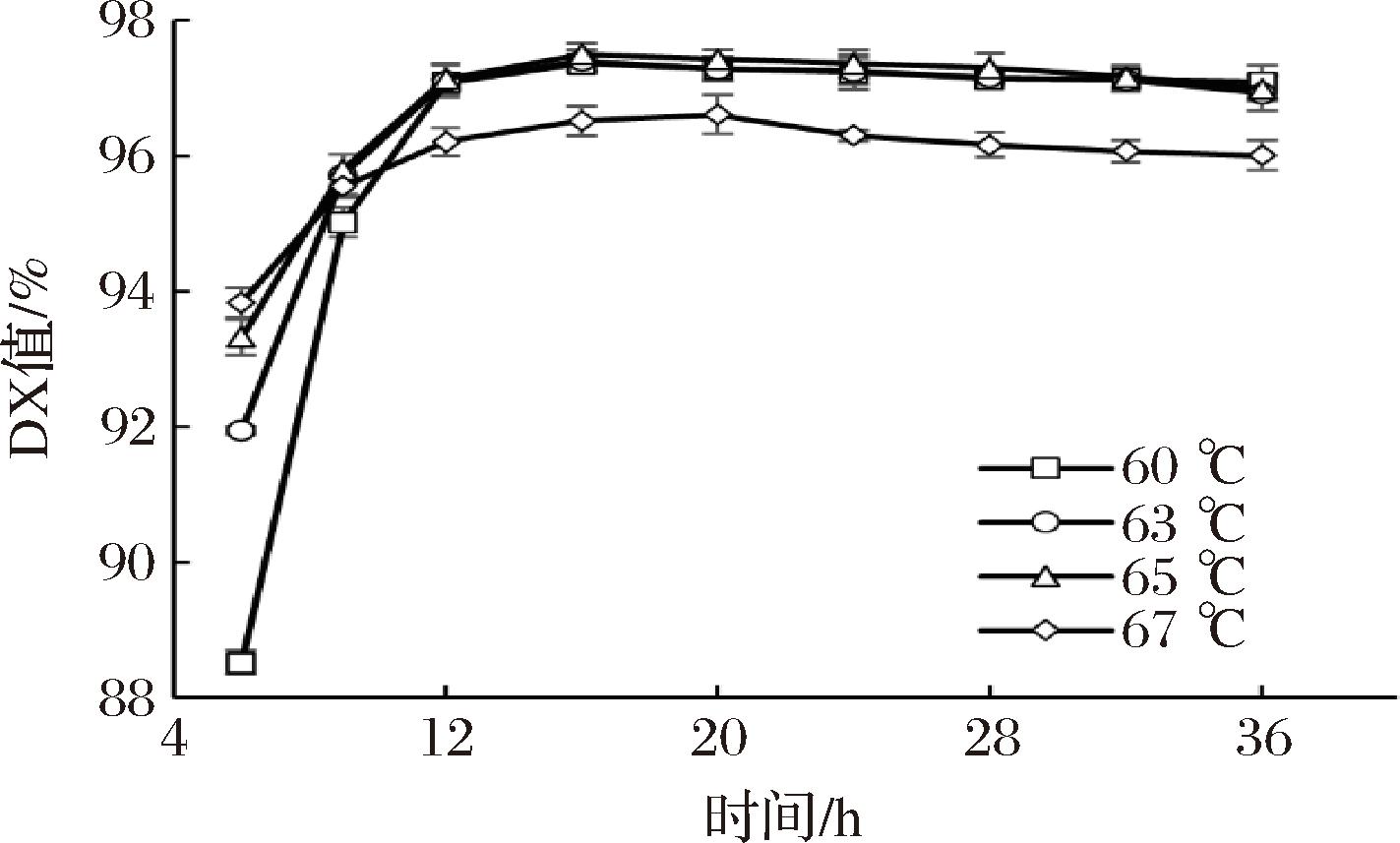
图5 提高糖化温度对淀粉糖化的影响
Fig.5 Effect of increasing incubation temperature on starch saccharification
进一步在更低的pH下进行糖化,结果如图6所示。在pH 3.9、4.0、4.1、4.2、4.3下糖化,糖浆的DX值分别在28、20、20、16、16 h达到峰值,分别为97.32%、97.51%、97.41%、97.45%、97.35%。可以看出,普鲁兰酶突变体N9可以在较低糖化pH下协同葡糖淀粉酶的糖化作用。进一步分析了不同pH条件下糖浆中异麦芽糖含量变化,结果汇总于表1。在淀粉葡萄糖浆的准备过程中,副产物异麦芽糖的生成量随反应pH的降低而降低。当反应pH从4.3降低至4.0后,糖化36 h的异麦芽糖生产量减少了0.18%;继续降低糖化pH至3.9,异麦芽糖生成量有进一步降低的趋势,但同时也发现,在此条件下淀粉糖化需要28 h才能完成,最大DX值也较pH 4.0下降低了0.19%。由此可见,在pH 4.0~4.3,糖化均可在24 h内完成,所制得糖浆的最大DX值可以维持在97.35%以上,糖化36 h糖液中异麦芽糖含量可维系在1.52%以内。
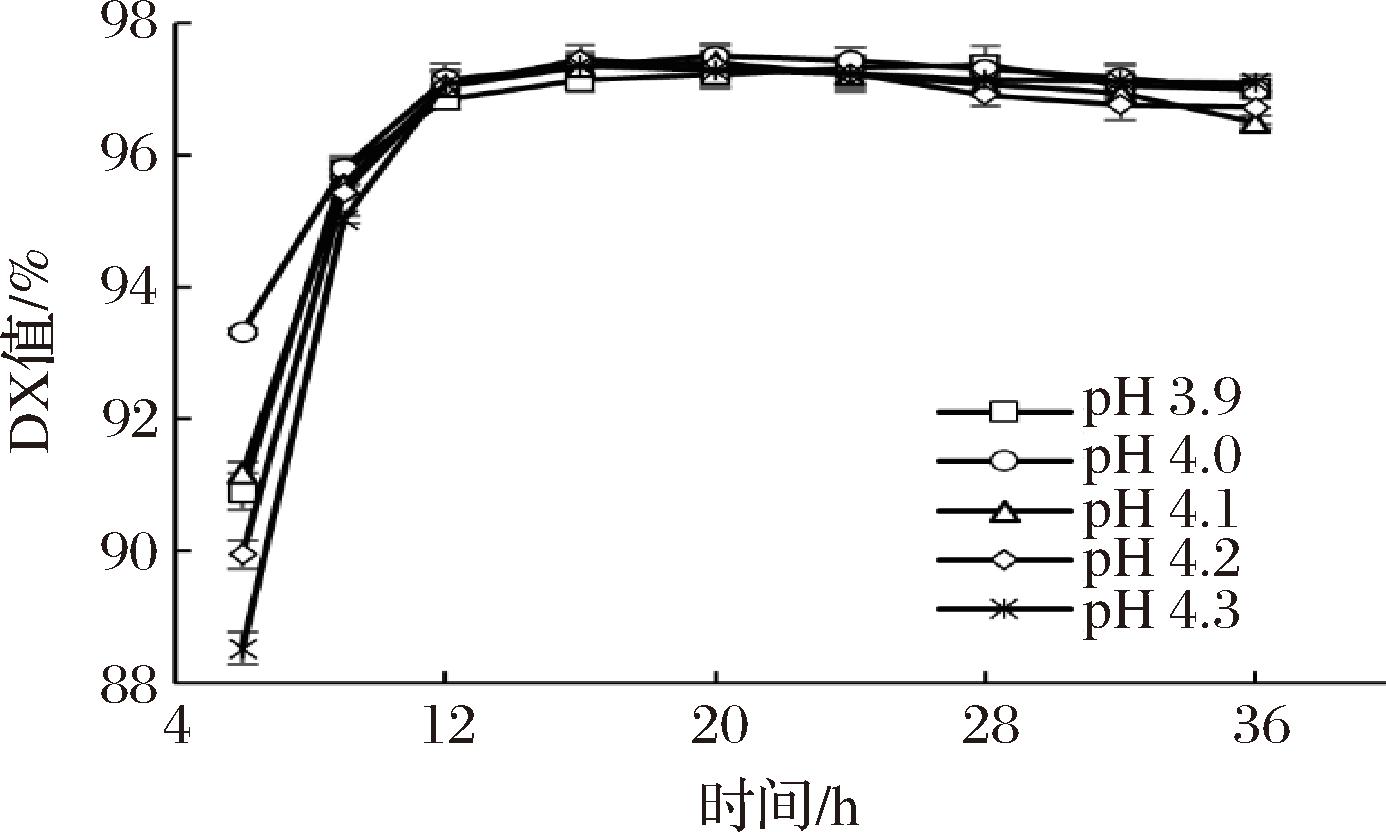
图6 较低pH下淀粉糖化特征
Fig.6 Starch saccharification characteristics at lower pH
表1 不同pH下进行淀粉糖化时的异麦芽糖形成变化
Table 1 Changes of isomaltose formation during starch saccharification at different pH
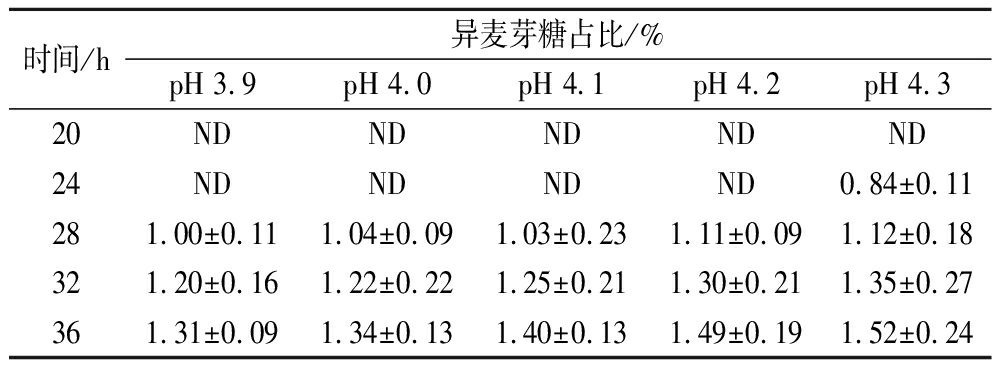
时间/h异麦芽糖占比/%pH 3.9pH 4.0pH 4.1pH 4.2pH 4.320NDNDNDNDND24NDNDNDND0.84±0.11281.00±0.111.04±0.091.03±0.231.11±0.091.12±0.18321.20±0.161.22±0.221.25±0.211.30±0.211.35±0.27361.31±0.091.34±0.131.40±0.131.49±0.191.52±0.24
注:ND表示未检出。
2.2.4 普鲁兰酶N9可配合较少用量葡糖淀粉酶实现淀粉糖化
葡糖淀粉酶能够高效水解α-1,4糖苷键,是糖化阶段释放葡萄糖的主导酶制剂。在保证达到糖化质量要求与满足工艺要求的前提下,如果降低葡糖淀粉酶的用量,则一方面可以降低用酶成本,且有可能同步降低糖化后期低聚异麦芽糖生成量。为此,设定普鲁兰酶N9使用量为25 U/g,在不同葡糖淀粉酶下进行糖化,结果如图7所示。在葡糖淀粉酶的添加量为125、100、75、50 U/g时,糖浆DX值分别在糖化20、24、32、36 h时达到峰值,分别为97.39%、97.35%、97.30%、97.19%。在25 U/g普鲁兰酶N9下,使用125 U/g或100 U/g葡糖淀粉酶,所得葡萄糖浆均在24 h以内完成糖化;大幅度降低葡糖淀粉酶添加量,则糖化达到最大DX值的时间明显延长(图7-A)。进一步对125 U/g或100 U/g葡糖淀粉酶添加量下的糖化样本进行糖谱组成分析。添加125 U/g的葡糖淀粉酶糖化24 h,糖浆中检测到异麦芽糖(isomaltose,IM),添加100 U/g葡糖淀粉酶糖化相同时间未检测到异麦芽糖;延长糖化时间至36 h,糖浆中均有异麦芽糖积累(图7-B)。可以看出,添加125 U/g葡糖淀粉酶不会影响到糖化时间,葡糖淀粉酶的添加量减少至100 U/g,糖化时间有所延长(24 h),糖浆的质量基本不受影响。可见,使用普鲁兰酶N9,有可能在后续工业实践中减少葡糖淀粉酶的添加量。
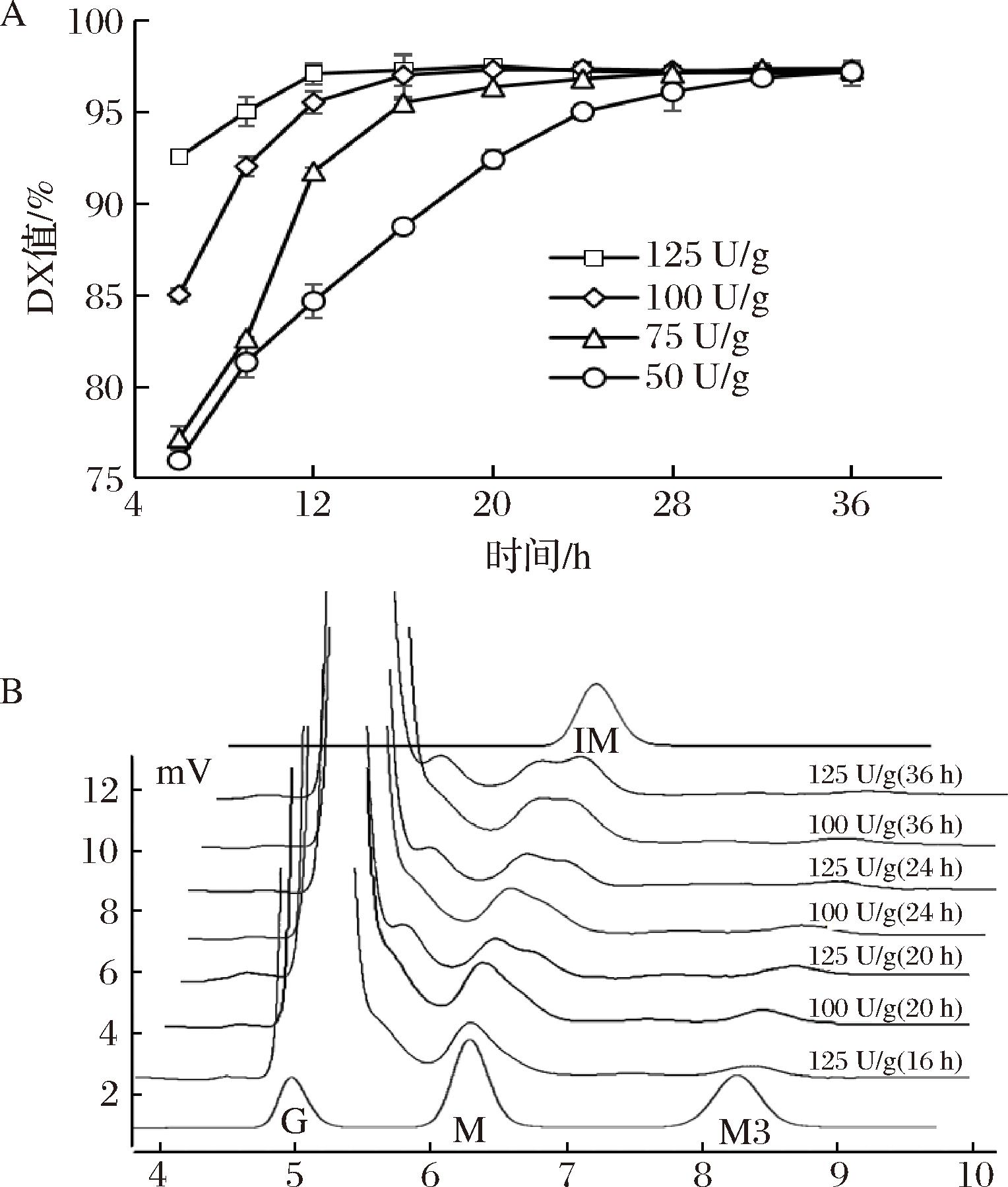
A-在25 U/g普鲁兰酶突变体N9下不同葡糖淀粉酶下葡萄糖转化特征;B-特征性HPLC糖谱(G-葡萄糖,M-麦芽糖,M3-麦芽三糖,IM-异麦芽糖)
图7 葡糖淀粉酶添加量降低对淀粉糖化的影响
Fig.7 Effect of reducing the dosage of glucoamylase on starch saccharification
3 结论
普鲁兰酶PulA-N3中第709位氨基酸残基突变为异亮氨酸后,获得了最适作用温度进一步提升的酸性普鲁兰酶突变体N9,在65 ℃下保留95%以上酶活力,在pH 4.0下保留85%以上酶活力。新普鲁兰酶突变体可在更高温度和更低酸性条件下与现有葡糖淀粉酶工业酶制剂复合使用,且以更高的葡萄糖转化率和效率催化淀粉转化为葡萄糖,糖液最高DX值可达97.5%以上,显示所获得的普鲁兰酶新酶分子具有潜在的工业应用价值。
[1] JANE J L.Structural Features of Starch Granules Ⅱ[M].Third Eclition.Amsterdam:Elsevier, 2009:193-236.
[2] NIU D D, QIAO J, LI P J, et al.Highly efficient enzymatic preparation of isomalto-oligosaccharides from starch using an enzyme cocktail[J].Electronic Journal of Biotechnology, 2017, 26:46-51.
[3] NIU D D, LI P J, HUANG Y S, et al.Preparation of maltotriitol-rich malto-oligosaccharide alcohol from starch[J].Process Biochemistry, 2017, 52:159-164.
[4] NAIK B, KUMAR V, GOYAL S K, et al.Pullulanase:Unleashing the power of enzyme with a promising future in the food industry[J].Frontiers in Bioengineering and Biotechnology, 2023, 11:1139611.
[5] 佟毅. 中国玉米淀粉与淀粉糖工业技术发展历程与展望[J].食品与发酵工业, 2019, 45(17):294-298.
TONG Y.Development history and prospect of China corn starch and starch sugar industry technology[J].Food and Fermentation Industries, 2019, 45(17):294-298.
[6] ZONG X Y, WEN L, WANG Y T, et al.Research progress of glucoamylase with industrial potential[J].Journal of Food Biochemistry, 2022, 46(7):e14099.
[7] XU P, ZHANG S Y, LUO Z G, et al.Biotechnology and bioengineering of pullulanase:State of the art and perspectives[J].World Journal of Microbiology and Biotechnology, 2021, 37(3):43.
[8] NIE Y, YAN W, XU Y, et al.High-level expression of Bacillus naganoensis pullulanase from recombinant Escherichia coli with auto-induction:Effect of lac operator[J].PLoS One, 2013, 8(10):e78416.
[9] AKASSOU M, GROLEAU D.Advances and challenges in the production of extracellular thermoduric pullulanases by wild-type and recombinant microorganisms:A review[J].Critical Reviews in Biotechnology, 2019, 39(3):337-350.
[10] NIU D D, CONG H H, ZHANG Y N, et al.Pullulanase with high temperature and low pH optima improved starch saccharification efficiency[J].Scientific Reports, 2022, 12(1):21942.
[11] 丛慧慧. 长野芽胞杆菌普鲁兰酶工业应用属性的分子进化[D].天津:天津科技大学, 2022.
CONG H H.Improvement of industrial properties of Bacillus naganoensis pullulanase by molecular evolution[D].Tianjin:Tianjin University of Science and Technology, 2022.
[12] PANG B, ZHOU L, CUI W J, et al.Improvement of the thermostability and activity of pullulanase from Anoxybacillus sp.WB42[J].Applied Biochemistry and Biotechnology, 2020, 191(3):942-954.
[13] XIE T, ZHOU L, HAN L C, et al.Modulating the pH profile of the pullulanase from Pyrococcus yayanosii CH1 by synergistically engineering the active center and surface[J].International Journal of Biological Macromolecules, 2022, 216:132-139.
[14] WANG Q Y, XIE N Z, DU Q S, et al.Active hydrogen bond network (AHBN) and applications for improvement of thermal stability and pH-sensitivity of pullulanase from Bacillus naganoensis[J].PLoS One, 2017, 12(1):e0169080.
[15] ABE K, KURODA A, TAKESHITA R.Engineering of Escherichia coli to facilitate efficient utilization of isomaltose and panose in industrial glucose feedstock[J].Applied Microbiology and Biotechnology, 2017, 101(5):2057-2066.
[16] 丛慧慧, 张亚楠, 牛丹丹, 等.酸性普鲁兰酶显著提升淀粉酶法制备葡萄糖的效率[J].食品与发酵工业, 2022, 48(17):16-20.
CONG H H, ZHANG Y N, NIU D D, et al.Acid pullulanase significantly improved the efficiency of glucose preparation from starch[J].Food and Fermentation Industries, 2022, 48(17):16-20.
[17] WANG X Y, NIE Y, XU Y.Industrially produced pullulanases with thermostability:Discovery, engineering, and heterologous expression[J].Bioresource Technology, 2019, 278:360-371.
[18] 张亚楠, 申培立, 牛丹丹, 等.普鲁兰酶N467G突变体的酶学性质分析[J].食品与发酵工业, 2021, 47(5):7-11.
ZHANG Y N, SHEN P L, NIU D D, et al.Enzymatic characterization of the pullulanase mutant N467G[J].Food and Fermentation Industries, 2021, 47(5):7-11.
[19] CAPRIOTTI E, FARISELLI P, CASADIO R.I-Mutant2.0:Predicting stability changes upon mutation from the protein sequence or structure[J].Nucleic Acids Research, 2005, 33(suppl_2):W306-W310.
[20] YUAN S G, STEPHEN, FILIPEK S, et al.PyMOL and inkscape bridge the data and the data visualization[J].Structure, 2016, 24(12):2041-2042.
[21] 杨林, 王柳月, 李慧美, 等.改进的多片段重叠延伸PCR制作基因多位点突变[J].中国生物工程杂志, 2019, 39(8):52-58.
YANG L, WANG L Y, LI H M, et al.Multi-site specific mutagenesis by multi-fragment overlap extension PCR[J].China Biotechnology, 2019, 39(8):52-58.
[22] 诸葛健, 王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社, 1994.
ZHUGE J, WANG Z X.Technical manual of industrial microbiology experiment[M].Beijing:China Light Industry Press, 1994.
[23] SHEN P L, NIU D D, LIU X L, et al.High-efficiency chromosomal integrative amplification strategy for overexpressing α-amylase in Bacillus licheniformis[J].Journal of Industrial Microbiology and Biotechnology, 2022, 49(3):kuac009.
[24] NIU D D, ZUO Z R, SHI G Y, et al.High yield recombinant thermostable α-amylase production using an improved Bacillus licheniformis system[J].Microbial Cell Factories, 2009, 8:58.
[25] 赵伟超, 聂尧, 穆晓清, 等.采用复合保护剂提高重组普鲁兰酶稳定性[J].食品与发酵工业, 2015, 41(5):48-53.
ZHAO W C, NIE Y, MU X Q, et al.Enhancement of stability of recombinant pullulanase by combination additive[J].Food and Fermentation Technology, 2015, 41(5):48-53.