传统发酵酱油,作为中国餐桌上的基本调味品,以其鲜咸口感和独特香气正逐步获得全球消费者的青睐[1]。酱油的风味形成主要源自发酵过程中微生物的代谢作用,尤其是耐盐微生物对大豆和小麦中的糖类及蛋白质的分解,产生多肽、氨基酸及挥发性香气化合物,形成其香醇的风味[2]。特别是采用稀态发酵工艺的广式酿造酱油,其适宜的液态环境有利于微生物生长和物质转化,使得产品具有滋味醇厚、回味悠长的特点,广受市场和消费者欢迎。然而,在稀态发酵过程中,为防止腐败,通常需添加较高浓度的盐分(150~200 g/L)[3-4],这限制了微生物活性和物质转化效率,并导致最终产品中钠盐浓度偏高,影响了产品的广泛应用[5]。因此,基于稀态发酵工艺,探索降低盐分、提高转化效率并增强产品健康性的发酵工艺,成了目前发酵酱油的研究热点。
低盐稀态发酵酱油面临的两个关键问题为:一是发酵菌群调控:低盐发酵体系渗透压低,难以抑制腐败菌和其他有害微生物生长;二是酱油风味调控:在低盐发酵体系中,传统嗜盐发酵菌群的生长代谢受到影响,进而影响酱油中风味物质的累积。李心智等[6]发现通过梯度升温工艺(15 ℃-20 ℃-25 ℃-30 ℃)可有效限制低盐(120 g/L)发酵酱醪中前期酵母菌的生长,提升低盐发酵原油的整体风味。鲁氏接合酵母(Zygosaccharomyces rouxii)以其耐盐性(160 g/L NaCl)和产酯能力,在传统酱油发酵领域备受关注[7]。JANSEN等[8]通过在180 g/L酱醪发酵中补充添加鲁氏接合酵母增强了酱油的风味,接入的鲁氏接合酵母加强了其在体系中的主导地位,通过强化Strecker降解途径,产生更多提升酱油风味的醇和酯,包括乙醇、2-苯乙醇、5-乙基-4-羟基-2-甲基-3(2H)-呋喃酮(5-ethyl-4-hydroxy-2-methyl-3(2H)-furanone,HEMF)、4-羟基-2,5-二甲基-3(2H)-呋喃酮(4-hydroxy-2,5-dimethyl-3(2H)-furanone,HDMF)等,可以加快酱油产品的风味形成[9]。此外,也有研究报道在低盐(<150 g/L)酱醪发酵中使用非耐盐产酯酵母,可增强低盐发酵酱油整体香气和风味,如王靖雯等[10-11]在酱油发酵时分别添加似平滑假丝酵母(Millerozyma farinosa)及汉逊德巴利酵母(Debaryomyces hansenii),获得了滋味和香气增强的低盐酱油。LI等[12]和LIU等[13]发现添加异常威客汉逊酵母(Wickerhamomyces anomalus)后,发酵酱油中芳香型酯类物质含量达到30.14 μg/L,大大提高了发酵酱油的香气。SINGRACHA等[9]发现,在酱醪发酵阶段,通过将盐分浓度降至120 g/L并引入鲁氏接合酵母、嗜盐四联球菌(Tetragenococcus halophilus)和季也蒙毕赤酵母[Meyerozyma (Pichia) guilliermondii],所得低盐酱油与传统发酵酱油相比,其关键风味物质HDMF和麦芽酚等含量更高。
然而,目前以低盐发酵酱醪中原生产酯酵母作为前期发酵补充菌株的研究仍然较少,并且普遍采用恒温发酵,这在大规模室外发酵环境中很难实现。因此,本文通过依次添加接种耐盐产香的鲁氏接合酵母及非耐盐产酯酵母异常威克汉逊酵母至低盐120 g/L稀态酱醪中,并采用发酵前期梯度升温的工艺进行为期60 d的原油发酵,探究该工艺对低盐稀态发酵酱油的风味提升作用,为现代食品工业开发新的低盐稀态酱油发酵工艺提供一定的理论和实践指导。
1 材料与方法
1.1 菌种与材料
发酵酱油所使用的曲料和饱和盐水,佛山市海天(高明)调味食品股份有限公司;鲁氏接合酵母,中国工业微生物菌种保藏管理中心(CICC);异常威客汉逊酵母,实验室自有菌种库;YM培养基等微生物扩增培养所需的原料,广东环凯生物;纳他霉素、氯霉素,湖南汇百侍生物科技有限公司。
1.2 实验试剂
高浓度甲醛、氢氧化钠标准溶液、硝酸银标准溶液等,天津市大茂化学试剂厂;DNS显色剂,福州飞净生物科技有限公司;苹果酸、乳酸、乙酸、富马酸和2-辛醇(均≥99%),上海麦克林生化科技有限公司;17种游离氨基酸标准品(≥99%),天津市科密欧化学试剂有限公司;以上未标注纯度的化学试剂均为分析纯。
1.3 仪器与设备
DL-CJ-2 NDI型超净工作台,中国北京东联哈尔仪器制造有限公司;LDZH-200L型立式高压蒸汽灭菌器,中国上海东亚压力容器制造有限公司;905 Titrando自动电位滴定仪,瑞士万通中国有限公司;1290 infinity Ⅱ高压液相-质谱联用仪、7890B-5977B型气相色谱-质谱联用仪,美国安捷伦科技有限公司;LA8080型高速氨基酸分析仪,日立科学仪器(北京)有限公司;DT Ar/He Basic型杜马斯定氮仪,德国格哈特分析仪器有限公司。
1.4 实验方法
1.4.1 酱醪发酵实验设计
将黄豆成曲与饱和盐水按照质量比1∶2配至盐分为120 g/L的酱醪,设置实验组和对照组。落黄当天为发酵0 d,实验组和对照组采用在发酵过程中的四阶段梯度升温模式模拟实际工业生产中大发酵罐梯度升温的进程(表1),即a)0~5 d发酵温度为15 ℃;b)5~15 d发酵温度为20 ℃;c)15~30 d发酵温度为25 ℃;d)30~60 d发酵温度为30 ℃;实验组菌株的接入时间和顺序参考生产实际和前期试验,其中的鲁氏接合酵母在发酵第5天接入,异常威客汉逊酵母在第15天接入。对照组则维持梯度升温发酵,但不接入外源菌株。
表1 菌株接种顺序与发酵温度控制
Table 1 Inoculation sequences and fermentation temperature control
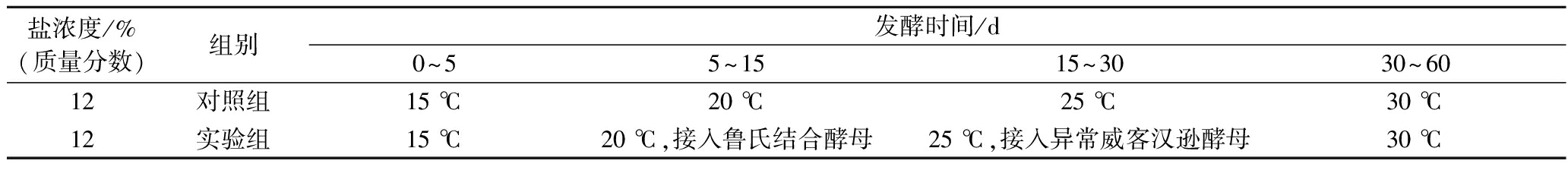
盐浓度/%(质量分数)组别发酵时间/d0~55~1515~3030~6012对照组15 ℃20 ℃25 ℃30 ℃12实验组15 ℃20 ℃,接入鲁氏结合酵母25 ℃,接入异常威客汉逊酵母30 ℃
1.4.2 酱醪发酵实验设计
参考SINGRACHA等[9]的方法,将冻存于-80 ℃冰箱的鲁氏结合酵母和异常威客汉逊酵母种子液取出,接种到灭菌后的YM液体培养基(酵母麦芽提取物培养基)中,在30 ℃培养箱中振摇活化培养约48 h。活化后的菌液在4 ℃,8 000 r/ min条件下离心5 min,再用8.5 g/L盐溶液清洗2次,然后再将用8.5 g/L的盐溶液稀释至活菌数约105~106 CFU/mL的菌液接种至酱醪中进行发酵[12]。另一组作空白对照,不添加酵母菌。分别于0、5、15、30、45、60 d这6个取样点进行无菌取样约50 g,先进行微生物计数及pH测定。其余样品先冻存,等全部取样后,通过滤布、离心过滤后,得到上清液,用于理化指标、有机酸、游离氨基酸、挥发性物质的测定及感官鉴评。
1.4.3 微生物计数
参考李心智等[6]微生物菌落计数方法并适当调整,将取到的酱醪用8.5 g/L生理盐水进行稀释至合适梯度,取1.0 mL稀释液至PCA培养基上,在30 ℃培养箱内培养约48 h后进行总菌落计数;取1.0 mL稀释液于平皿,倒入添加了0.5 g/L纳他霉素的MRS培养基上,于37 ℃培养24~48 h后进行乳酸菌计数;取0.1 mL稀释液均匀涂布于添加了0.1 g/L氯霉素的PDA培养基上,于30 ℃培养5 d后进行酵母计数。
1.4.4 理化指标的测定
参考GB/T 18186—2000《酿造酱油》,测定各发酵阶段样品的pH、总酸、氨氮、全氮以及固形物含量;有机酸的测定参考LI等[12]开发的方法,即将样品以0.22 μm滤膜过滤后,用纯水稀释20倍,在4 ℃沉淀蛋白质1 h以上,然后在4 ℃、4 500 r/min离心15 min,取上清液用于检测;游离氨基酸测定参考GB 5009.124—2016 《食品安全国家标准 食品中氨基酸的测定》。
1.4.5 风味物质测定
参考于茜雅等[14]测定酱油挥发性风味物质的方法对样品进行处理和进样,使用NIST 17.0质谱库进行比对,并以2-辛醇为内标物进行半定量分析。
所采用的GC条件为:HP-INNO Wax毛细色谱柱(60 m×250 μm,0.25 μm);进样口:250 ℃;升温程序:40 ℃保持5 min,以5 ℃/min升至240 ℃,保持15 min;载气为氦气,流速1.5 mL/min。
所采用的MS条件为:离子源为EI,温度为250 ℃;电子能量:80 eV;四级杆:200 ℃;传输线:250 ℃;质量扫描范围为35~550 amu。
1.4.6 感官评价
参考GB/T 18186—2000《酿造酱油》中感官评价方法和苏国万等[15]使用的方法,共邀请22名对酱油产品感官鉴评有丰富经验的从业者对本实验中的2组样品进行品评,记录不同发酵原油在各项评分标准上的得分。取各项评分平均值并绘制雷达图。感官评价标准如表2所示。
表2 发酵原油的感官评分标准
Table 2 Scoring criteria for the sensory evaluation of fermented soy sauce

评分/分色泽香气滋味体态综合喜好度1棕褐色,色泽黑暗,无光泽酱香味很淡,无不良气味鲜味非常淡,醇味薄,咸味适度悬浮物和杂质较多不喜欢2深褐色,色泽较暗,无光泽酱香味平淡,无不良气味鲜味较淡,醇味薄,咸味适度有少量悬浮物和杂质不太喜欢3红褐色或红棕色,有光泽具有较浓的酱香味,无不良气味味鲜美适口,咸味适度较澄清喜欢4色泽鲜艳,呈深红色,具光泽具有酱香特有的浓郁香气,无不良气味味道鲜美适口,醇厚,柔和绵长,咸味适度澄清,无漂浮物,无杂质十分喜欢
1.5 数据处理
本实验中每个参数在同等条件下重复测定3次,采用SPSS Statistics 29.0进行数据分析,以“平均值±标准差”表示,并进行单因素方差分析(P<0.05)。采用GraphPad Prism 10.1.1、Origin2021绘图。
2 结果与分析
2.1 添加产酯酵母联合梯度升温工艺发酵过程中微生物菌落数的变化
图1-a为实验组和对照组在发酵60 d过程中总菌落数的变化情况。从发酵5 d开始,2组样品中的总菌落数均逐渐下降,而实验组的微生物活性在发酵后期仍保持较高,表现为发酵至60 d时实验组比对照组总菌落数高1.48 lg CFU/g。这可能是由于依次添加的2种酵母通过调整发酵中后期与乳酸菌之间的相互作用,促进了实验组在发酵后期维持较高的微生物活性[16]。
乳酸菌是酱醪发酵初期阶段的主要优势微生物群体[6]。在本研究发酵的0~5 d,实验组和对照组样品中的乳酸菌计数均约为6.2 lg CFU/g。随着发酵过程的进行,体系中的营养物质逐渐被消耗,pH值下降,同时醇类代谢物含量升高,这些因素共同作用,抑制了乳酸菌的生长和代谢[17]。发酵结束时,2组样品中的乳酸菌计数降至2.4~2.6 lg CFU/g水平,两者间计数无显著性差异。这一结果表明,在低盐梯度升温发酵体系中,依次添加2种酵母对乳酸菌的生长和代谢的影响并不显著。
图1-c为实验组和对照组在发酵60 d过程中总酵母数的变化。两组总酵母数的变化趋势均在15 d达到最大值,分别为4.83 lg CFU/g和5.12 lg CFU/g,随后逐渐减少。不同的是实验组的总酵母数在发酵15~45 d期间均保持较高含量,发酵结束时较对照组高0.28 lg CFU/g。这表明依次添加鲁氏接合酵母和异常威客汉逊酵母有助于提升整个发酵时期酵母的含量,不仅缓解了早期较低温度对发酵速率的潜在抑制作用,还降低了不良风味物质形成的风险,对酱油风味物质的形成具有积极意义。
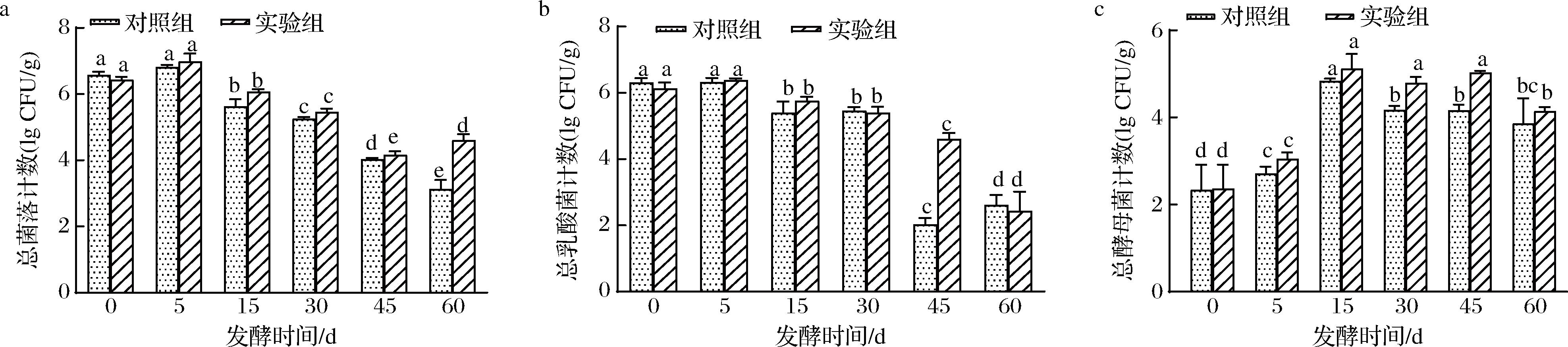
a-总菌落计数;b-总乳酸菌计数;c-总酵母菌计数
图1 梯度升温发酵条件下未添加产酯酵母与依次添加产酯酵母发酵过程中微生物变化
Fig.1 Microbial changes in the fermentation process of ester-producing-yeast without and sequentially added yeast under gradient
注:不同字母表示同一样品在不同发酵时间存在显著性差异(P<0.05)(下同)。
2.2 添加产酯酵母联合梯度升温工艺发酵对酱醪理化指标的影响
2.2.1 pH值和总酸
2组样品pH、总酸变化情况如图2所示。在发酵前中期(0~30 d),酱醪中的微生物生长代谢旺盛,乙酸、乳酸等酸性物质逐渐累积,对照组与实验组的pH也随之降低,总酸含量逐渐升高[12]。对照组在发酵中期(30 d)pH降低至4.52,并且在后续发酵过程中无显著变化,而实验组的pH于60 d才降到最低值4.81。图2-b总酸结果显示,实验组的总酸含量于30 d达到最大值1.91 g/100 mL。到了发酵末期,实验组的总酸含量显著降低,同时,对照组的总酸含量达到了最大值1.79 g/100 mL,是实验组的1.1倍。整体结果表明,在低盐梯度升温发酵过程中,梯度升温控制和依次添加产酯酵母通过影响发酵菌群的结构,从而改善了低盐酱醪体系易过快变酸的问题。
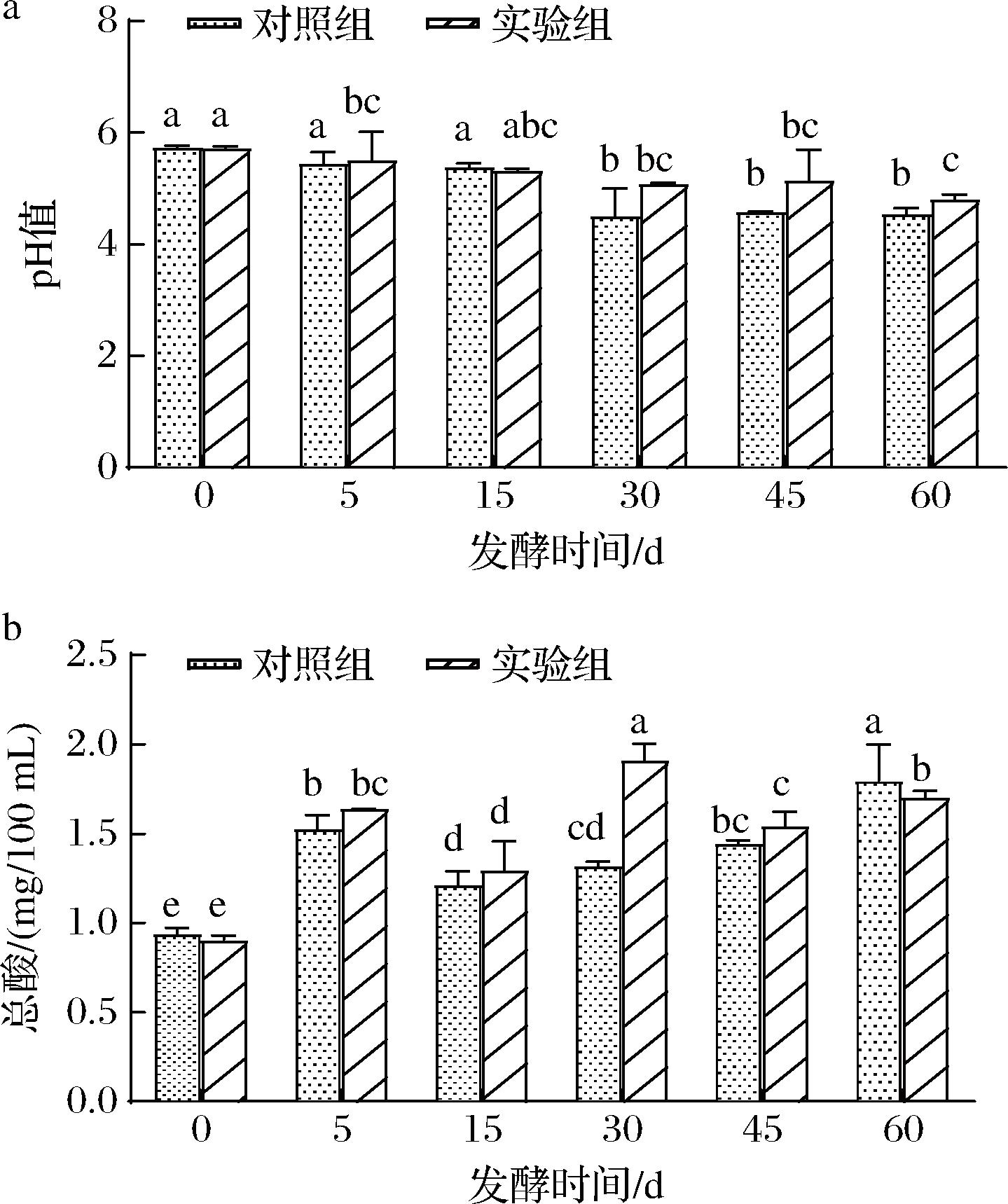
a-pH;b-总酸
图2 酱醪发酵过程中pH及总酸的变化
Fig.2 pH and titratable acidity changes during soy sauce fermentation
2.2.2 氨基酸态氮和可溶性全氮
酱油中氨基酸态氮的含量是评价其质量好坏的直接指标之一[18]。图3为2组样品在发酵过程中氨基酸态氮和可溶性全氮含量的变化情况。图3-a显示,对照组的氨基酸态氮含量呈逐渐增加的趋势,发酵60 d时,其含量达到1.13 g/100 mL。而实验组的氨基酸态氮含量则在发酵期间出现了一定波动,其含量峰值出现在发酵30 d时,为1.20 g/100 mL,发酵至60 d时则降至1.11 g/100 mL。在酱醪发酵中,氨基酸态氮的降低与微生物代谢旺盛有关,说明依次添加2种酵母极可能加速了发酵进程,从而弥补了梯度升温过程中因温度较低对发酵造成的不良影响。
可溶性全氮主要来自微生物对原料的分解,因此其含量变化代表了发酵过程中微生物对原料的分解利用情况[18]。从图3-b可以看出,对照组和实验组的可溶性全氮含量均呈先上升后下降的趋势,实验组中可溶性全氮含量最高值出现在发酵30 d,而对照组则在45 d,其含量分别为1.57、1.49 g/100 mL,这也进一步印证了依次添加2种酵母可以加速发酵进程。发酵至60 d时,对照组和实验组的可溶性全氮含量分别为1.43、1.38 g/100 mL。结合以上数据来看,对照组与实验组的氨基酸态氮与可溶性全氮最终累积量无显著性差异,但依次添加2种酵母的实验组提升了发酵速率。
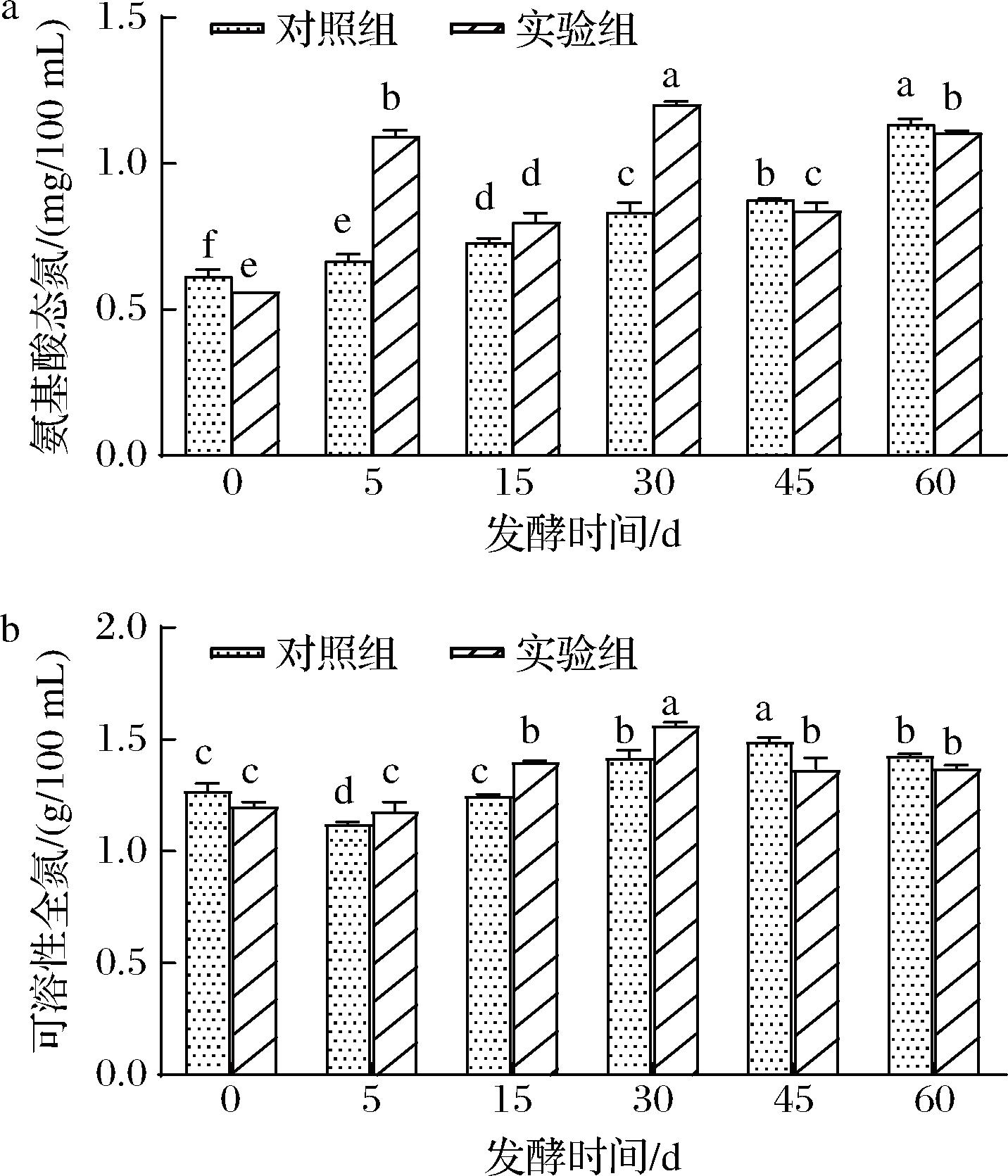
a-氨基酸态氮;b-可溶性全氮
图3 酱醪发酵过程中氨基酸态氮及可溶性全氮的变化
Fig.3 Amino nitrogen and total nitrogen changes during soy sauce fermentation
2.2.3 总还原糖和可溶性无盐固形物
在酱醪发酵期间,样品中总还原糖(主要为葡萄糖)的变化如图4-a所示。2组样品的总还原糖含量均呈逐渐下降趋势,从3.90 g/100 mL左右下降至1.60 g/100 mL左右。还原糖在酱醪发酵过程中一方面由原料分解产生,一方面又被微生物消耗利用,是一种动态的过程[19]。在发酵前期,酱醪中的米曲霉仍存在一定活性,原料中的淀粉被分解为葡萄糖等,因此出现了样品中还原糖含量短暂升高的现象[12]。在本研究中,随着发酵温度升高以及酵母的添加,发酵体系中的还原糖逐渐被消耗,实验组的还原糖含量较对照组在15 d后下降的更快,表明其发酵速率更快。
可溶性无盐固形物则是可溶性糖类、有机酸、游离氨基酸、游离脂肪酸等营养和呈味物质的整体累积物,是评估酱油品质的另一重要因素,其变化情况如图4-b所示,2组样品的可溶性无盐固形物含量呈先上升后下降再上升的波动情况。发酵60 d时,对照组和实验组的可溶性无盐固形物含量分别为18.48、19.49 g/100 mL,无显著性差异,则说明梯度升温联合顺序添加产酯酵母对低盐酱油的可溶性无盐固形物含量影响不显著。
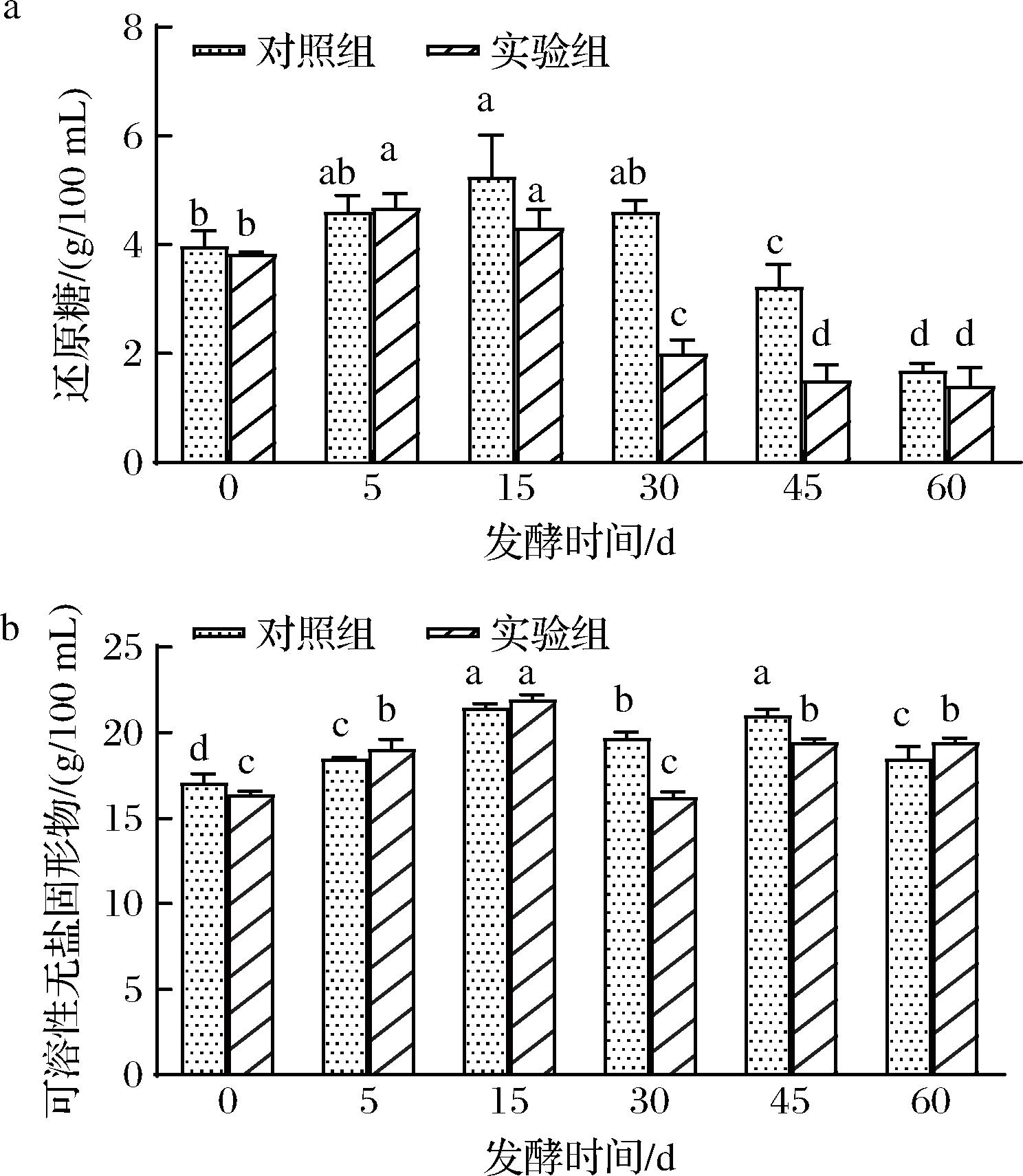
a-还原糖;b-可溶性无盐固形物
图4 酱醪发酵过程中还原糖及可溶性无盐固形物的变化
Fig.4 Reducing sugar and soluble unsalted solids changes during soy sauce fermentation
2.3 添加产酯酵母联合梯度升温工艺发酵对酱醪有机酸的影响
图5为对照组与实验组的有机酸变化情况,包括了苹果酸、乳酸、乙酸以及富马酸。苹果酸、乙酸不仅是酱油中酸味物质的主要成分之一,也是生物机体代谢过程中重要的中间产物,其含量高低与菌群代谢活跃程度呈现相关性[19]。如图5-a所示,2组样品中的苹果酸含量均呈现先上升后下降的变化趋势。具体来说,对照组的苹果酸含量在30~60 d维持在大约3.5 mg/mL水平,而实验组的苹果酸含量则从3.27 mg/mL显著下降至1.92 mg/mL。这一显著的下降趋势表明,在发酵的中后期,实验组展现出了更高的微生物代谢活性。乙酸和乳酸是酱油的两大主体酸,在发酵后期参与酯化反应,如乳酸乙酯和乙酸乙酯的形成[16]。此前,有研究表明酱油中的乳酸/乙酸的值越大,则酱油的口感越醇香、柔和[20]。发酵60 d时,实验组的乳酸与乙酸之比为1.59,对照组仅为0.97,这意味着实验组酱油的刺激性更低,更具“醇香、柔和”感。在发酵30 d时,对照组中未再检测到富马酸,而实验组则维持了更为完整的有机酸组成。总体来看,采用梯度升温并结合次序添加产酯酵母的工艺,不仅有利于低盐酱油中乳酸和乙酸的生成,还有助于保持酱油风味的完整性和丰富性。
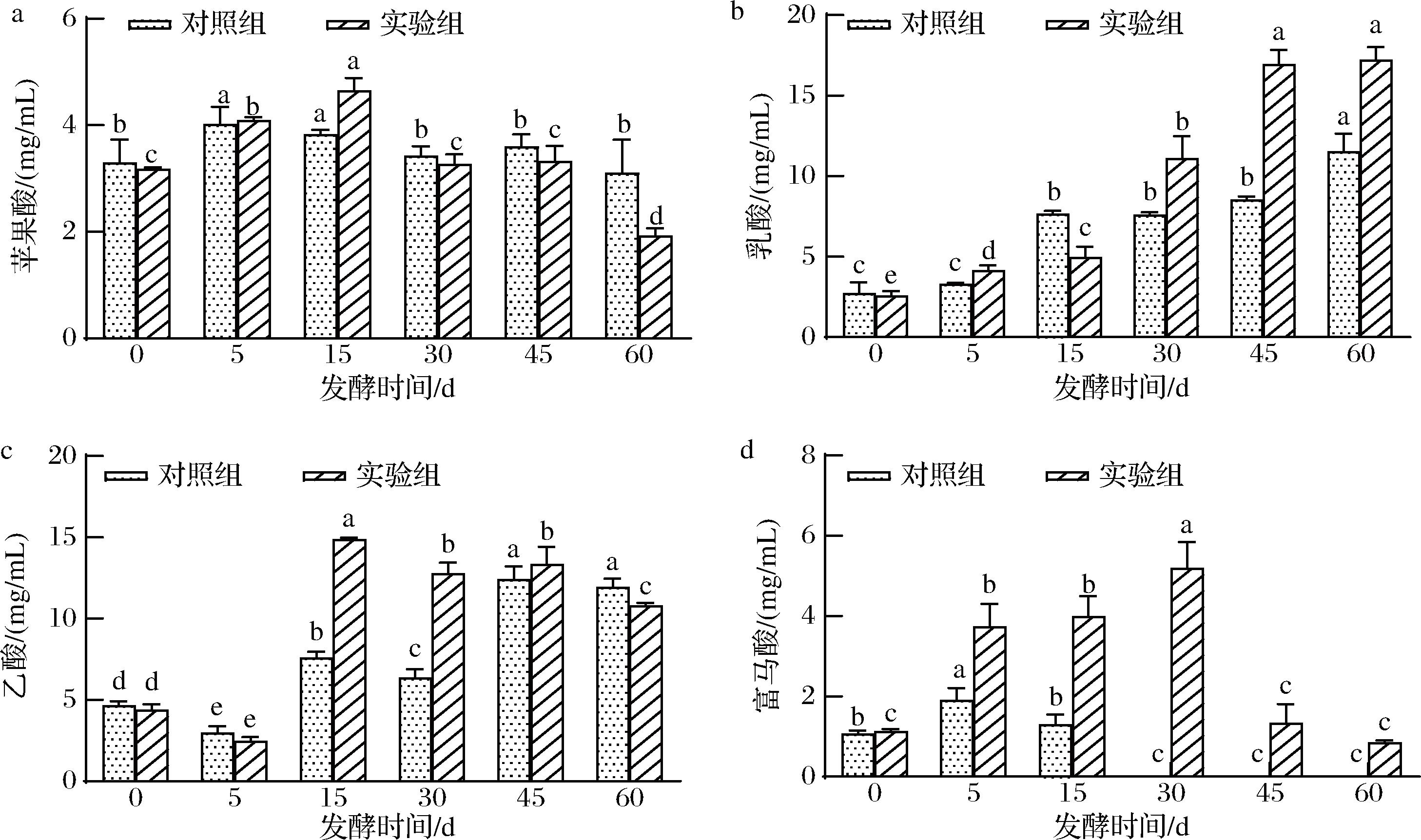
a-苹果酸;b-乳酸;c-乙酸;d-富马酸
图5 酱醪发酵过程中各有机酸的变化
Fig.5 Changes of organic acids content during soy sauce fermentation
2.4 添加产酯酵母联合梯度升温工艺发酵对酱醪中游离氨基酸的影响
实验组和对照组的游离氨基酸对比情况。如表3所示,对照组与实验组样品中总游离氨基酸含量在发酵结束(60 d)相较于0 d均显著增加(P<0.05)。发酵至60 d时,实验组的总游离氨基酸含量为77.01 g/L,是对照组的1.2倍。依次添加产酯酵母能显著提升低盐控温发酵体系的蛋白水解活性。另外,实验组的鲜味氨基酸含量占比约为36.16%,较对照组高出6.97%;甜味氨基酸占比约为33.11%,较对照组高出3.47%;同时,苦味氨基酸较对照组下降了10.97%,表明低盐梯度控温结合依次添加产酯酵母发酵有利于酱油的鲜味、甜味的提升,并减少了苦味。在发酵过程中,半胱氨酸(Cys)和甲硫氨酸(Met)参与了美拉德反应,这一反应与酱油中挥发性风味物质如3-甲硫基丙醛、2-糠硫醛等的生成紧密相关,这些物质对增强酱油的整体风味具有重要作用[21-22]。实验组中Cys和Met的含量显著高于对照组,因此可以推测,实验组原油的“焦香、酱香”风味更为明显。
表3 酱醪发酵过程中游离氨基酸含量的变化 单位:g/L
Table 3 Changes of free amino acid contents during soy sauce fermentation

氨基酸分类未发酵0 d30 d60 d对照组实验组对照组实验组鲜味(Asp)1.78±0.01e7.68±0.02b8.18±0.19c5.55±0.01d9.88±0.07a鲜味(Glu)4.25±0e10.44±0.03d13.68±0.08b13.48±0.04c17.97±0.03a占比 19.89%31.55% 34.18% 29.19% 36.16% 合计6.03±3.11e18.12±0.05d21.87±0.26b19.03±0.04c27.85±0.1a 甜味(Ser)1.46±0.26d2.61±0.01c4.21±0.03b4.2±0.01b5.38±0.01a甜味(Thr)1.03±0.01d2.60±0.02c3.25±0.05b3.2±0.02b5.99±0.04a甜味(gly)1.62±0d3.08±0b 3.08±0.02b2.99±0.01c3.64±0.01a甜味(Ala)2.35±0.01e4.44±0.01c3.84±0.02d5.49±0.02a4.81±0.01b甜味(Pro)1.97±0.15d3.73±0.06b3.31±0.05c3.44±0.05c5.68±0.01a占比 27.80%28.66% 35.12% 29.64%33.11% 合计8.43±0.08e16.46±0.06d22.47±0.07b19.32±0.08c25.50±0.03a苦味(Val)2.50±0.01d6.66±0.01a4.2±0.02c4.26±0.01c5.36±0.01b苦味(Ile)1.62±0.01d4.25±0.01b3.9±0.02c3.91±0.01c4.79±0.01a苦味(Leu)2.52±0c2.46±0.01b5.78±0.03a5.89±0.01a2.1±0.01b苦味(Tyr)0.77±0.01c0.56±0d 0.86±0.06b0.45±0d 1.04±0a 苦味(Phe)2.32±0.01d4.26±0.01b3.62±0.02c3.74±0.01c4.69±0.01a苦味(Lys)2.48±0.58b0.27±0.01d4.78±0.02a4.78±0.02a0.61±0c 苦味(His)1.20±0c2.12±0.01a1.84±0.01b1.87±0b 0.24±0d 苦味(Arg)1.10±0.1b0.21±0c 0±0d 0.25±0c 2.43±0.01a占比 47.86%36.19% 31.57% 38.58% 27.61% 合计14.51±2.01c 20.79±0.03b20.2±0.13b25.15±0.04a21.26±0.04b硫磺(Cys)0.61±0c0.82±0b 0.51±0.01c0.56±0.01c1±0.01a硫磺(Met)0.74±0e1.25±0b 1.06±0.01d1.13±0.01c1.4±0.01a占比 4.45%3.60% 2.47% 2.59% 3.12% 合计1.35±0e2.07±0b 1.58±0.01d1.69±0c 2.40±0.01a 总游离氨基酸含量32.63±0.49d 57.44±0.03c 63.98±1.64b 65.19±3.83b77.01±0.13a
注:同一行的上标字母表示差异显著(P<0.05),数值为“平均值±标准差”(n=3)(表4同)。
2.5 添加产酯酵母联合梯度升温工艺发酵对酱醪中关键挥发性风味物质的影响
为了探究2组样品在发酵过程中挥发性风味的差异,将检出的物质与文献所报道[22-25]的酱油特征性风味物质作比对,筛选出20种香气活性值≥1的主要挥发性化合物(表4)。发酵至30 d时,醇类物质成为酱醪中含量最高的挥发性风味成分。这些醇类物质不仅在抑制杂菌生长和赋予产品独特香气方面发挥着重要作用,还为后续的酯化反应提供了必要的前体物质,从而有助于酱油香气的进一步形成[21]。在这一阶段,实验组中的醇类物质含量显著高于对照组,高达710.09 μg/L,而对照组的含量则相对较低,仅为235.75 μg/L。特别是乙醇和苯乙醇,分别贡献了“酒香”和“花香、蜂蜜香”,对酱油的风味特征具有显著影响[16]。这些醇类物质的形成主要是通过酵母在厌氧条件下的发酵作用,这与对照组样品中酵母含量较高相符合。充足的前体物质与较长的发酵时间促进了酯类物质的生成,至60 d时,实验组中酯类物质含量达到335.64 μg/L,而对照组仅有217.73 μg/L。呈“酱油香”的HEMF仅在实验组中检出,是鲁氏结合酵母的特征代谢产物,与JANSEN等[8]报道的结果相吻合。此外,实验组在酱油中检测到的乙酸乙酯、棕榈酸乙酯含量显著高于对照组,其含量分别达到303.14、71.81 μg/L,是对照组的1.68、1.97倍,这些酯类物质呈“果香、甜香”[16]。梯度升温联合依次添加产酯酵母可能在低盐酱油的传统“酱香”基础上,进一步赋予其更为浓郁的“酒香”、“蜂蜜香”以及“果香、甜香”等风味特征,显著提升了低盐酱油的风味丰富度。
表4 酱醪发酵过程中关键性风味物质含量变化 单位:g/L
Table 4 Changes in the key aromatic compounds during soy sauce fermentation
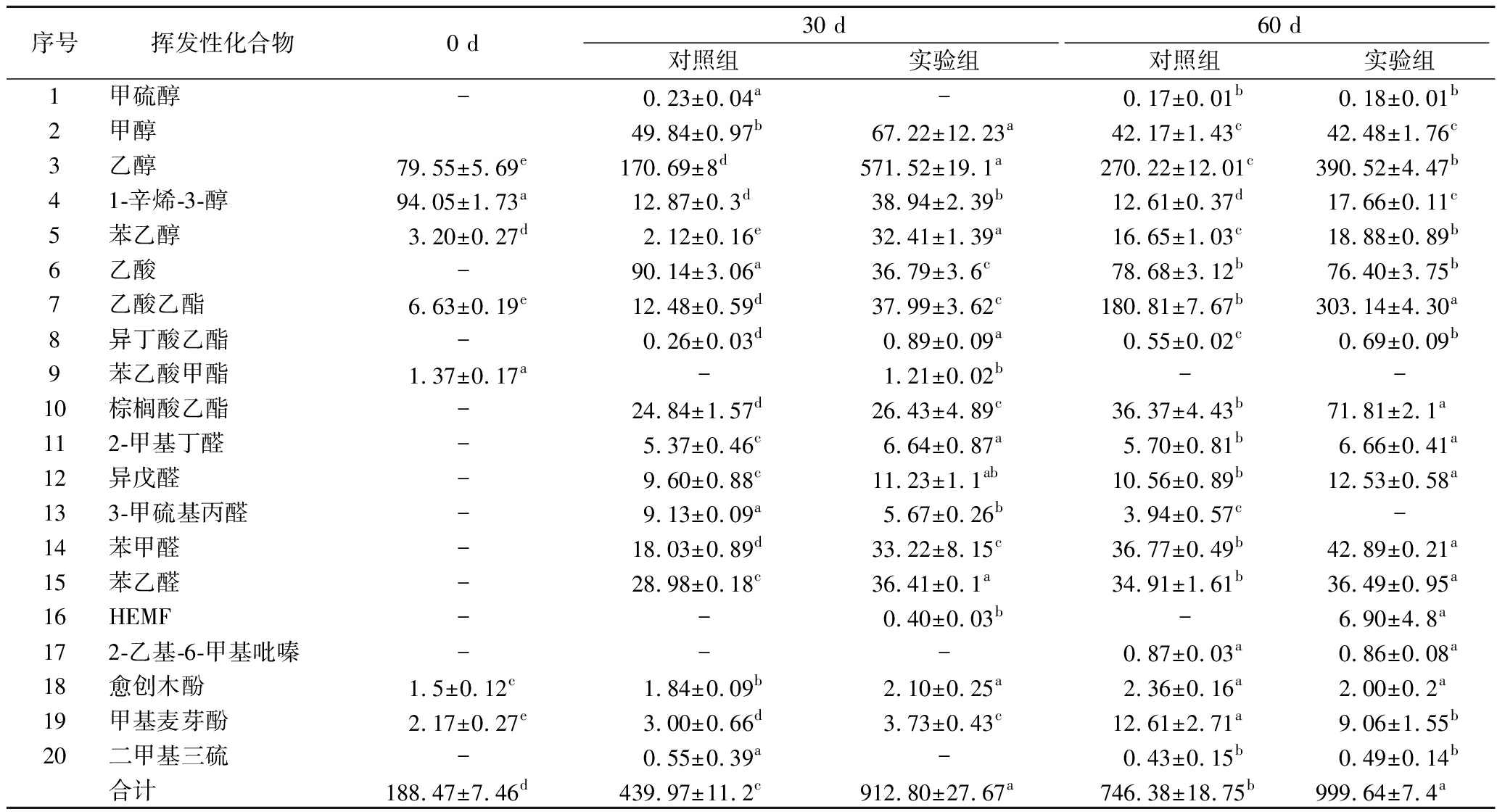
序号挥发性化合物0 d30 d60 d对照组实验组对照组实验组1甲硫醇-0.23±0.04a-0.17±0.01b0.18±0.01b2甲醇49.84±0.97b67.22±12.23a42.17±1.43c42.48±1.76c3乙醇79.55±5.69e170.69±8d571.52±19.1a270.22±12.01c390.52±4.47b41-辛烯-3-醇94.05±1.73a12.87±0.3d38.94±2.39b12.61±0.37d17.66±0.11c5苯乙醇3.20±0.27d2.12±0.16e32.41±1.39a16.65±1.03c18.88±0.89b6乙酸-90.14±3.06a36.79±3.6c78.68±3.12b76.40±3.75b7乙酸乙酯6.63±0.19e12.48±0.59d37.99±3.62c180.81±7.67b303.14±4.30a8异丁酸乙酯-0.26±0.03d0.89±0.09a0.55±0.02c0.69±0.09b9苯乙酸甲酯1.37±0.17a-1.21±0.02b--10棕榈酸乙酯-24.84±1.57d26.43±4.89c36.37±4.43b71.81±2.1a112-甲基丁醛-5.37±0.46c6.64±0.87a5.70±0.81b6.66±0.41a12异戊醛-9.60±0.88c11.23±1.1ab10.56±0.89b12.53±0.58a133-甲硫基丙醛-9.13±0.09a5.67±0.26b3.94±0.57c-14苯甲醛-18.03±0.89d33.22±8.15c36.77±0.49b42.89±0.21a15苯乙醛-28.98±0.18c36.41±0.1a34.91±1.61b36.49±0.95a16HEMF--0.40±0.03b-6.90±4.8a172-乙基-6-甲基吡嗪---0.87±0.03a0.86±0.08a18愈创木酚1.5±0.12c1.84±0.09b2.10±0.25a2.36±0.16a2.00±0.2a19甲基麦芽酚2.17±0.27e3.00±0.66d3.73±0.43c12.61±2.71a9.06±1.55b20二甲基三硫-0.55±0.39a-0.43±0.15b0.49±0.14b合计188.47±7.46d439.97±11.2c912.80±27.67a746.38±18.75b999.64±7.4a
2.6 添加产酯酵母联合梯度升温工艺发酵对酱油感官的影响
对发酵到期的2款原油进行短时间高温灭菌,依据表2中酱油感官评价标准,对其进行系统的感官评价。通过图6(雷达图)可以发现,实验组的色泽、滋味、香气及综合喜好度评分均高于对照组。酱油的滋味主要由鲜、甜、苦、咸、酸构成,实验组中甜味氨基酸及鲜味氨基酸含量均显著高于对照组,苦味氨基酸显著低于对照组,同时其有机酸种类更丰富,故而呈现的整体滋味较对照组更饱满。实验组更高的香气评分一定程度上得益于其高含量的酯类物质以及HEMF,它们在对照组原有的香气基础上增加了“甜香”及“酱油香”。对照组和实验组的综合喜好度评分分别为2.25和3.68,则说明实验组的整体风味更好,原油质量较佳。以上结果进一步印证了梯度控温的同时添加产酯酵母对促进低盐酱油风味的形成具有重大积极意义。
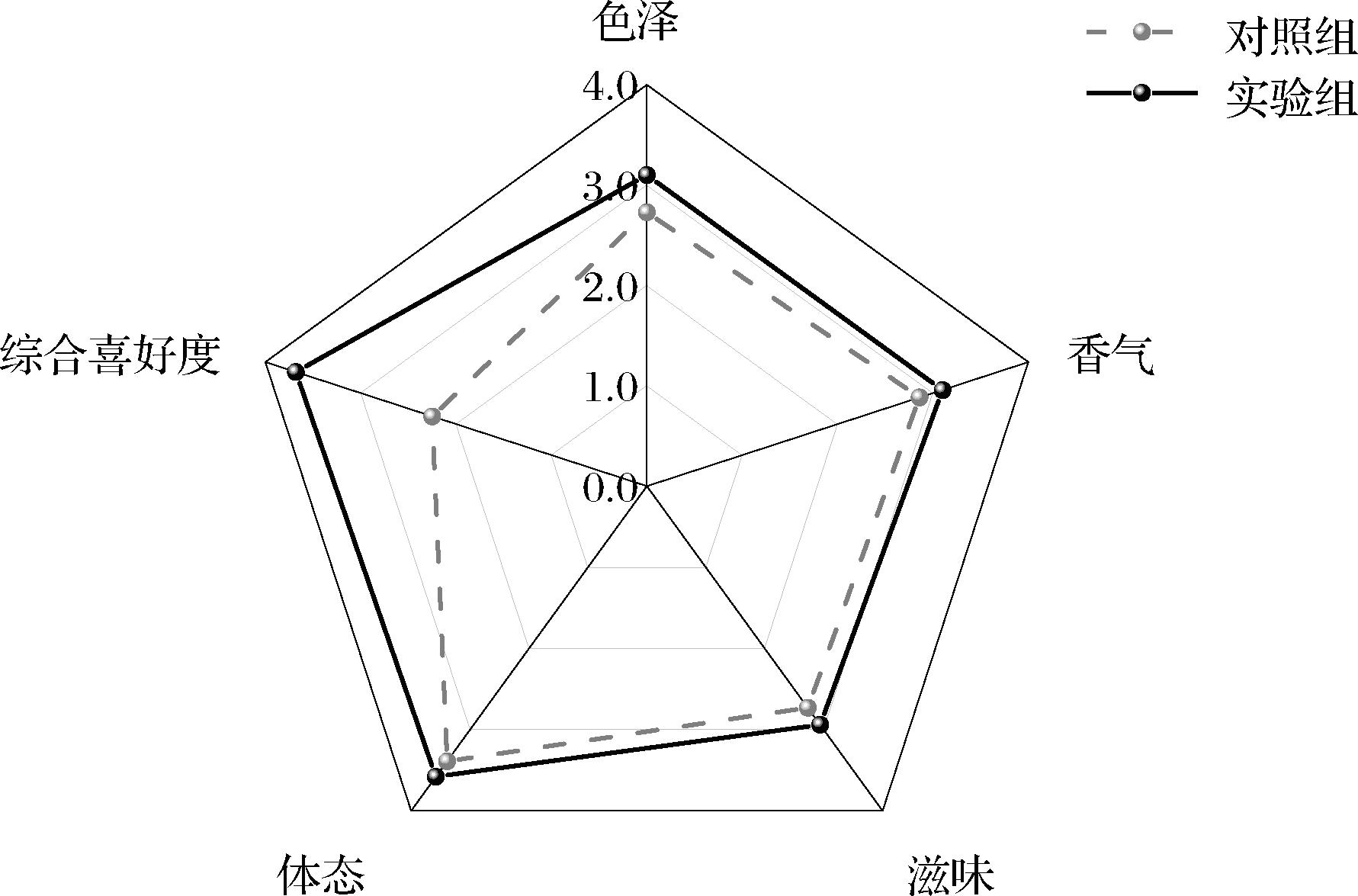
图6 不同发酵实验酱油感官评分比较
Fig.6 Sensory scores of different types of fermented soy sauce samples
3 结论
本研究成功展示了在低盐稀态酱油发酵过程中,依次添加鲁氏接合酵母和异常威克汉逊酵母并结合梯度升温工艺对低盐发酵酱油风味的提升效果。实验结果显示发酵到期时实验组中总菌落计数较对照组高1.48 lg CFU/g,总酸、氨基酸态氮及可溶性全氮含量的最大值分别比对照组提前了30、30、15 d,发酵速率有较大的提升。同时,该工艺还提高了酱油的香气和总体感官品质,表现为鲜味和甜味氨基酸含量提升,在发酵60 d时,实验组较未添加产酯酵母的对照组分别高出3.47%和6.97%;挥发性风味物质结果也显示实验组乙酸乙酯、棕榈酸乙酯和HEMF含量更高,增加了“甜香”和“酱油香”,丰富了发酵原油风味廓形。这一发现对于食品科学领域尤其是低盐酱油生产具有重要意义,它不仅为低盐酱油的风味改善提供了新的技术路线,也为未来的工业应用奠定了基础。虽然该工艺得到的发酵原油与传统高盐酱油在某些风味特性上仍有差异,但本研究提出的工艺在进一步优化后,有望在酱油工业中得到广泛应用。
[1] ZHANG L J, ZHANG L, XU Y.Effects of Tetragenococcus halophilus and Candida versatilis on the production of aroma-active and umami-taste compounds during soy sauce fermentation[J].Journal of the Science of Food and Agriculture, 2020, 100(6):2782-2790.
[2] WANG J W, ZHAO M M, XIE N Y, et al.Community structure of yeast in fermented soy sauce and screening of functional yeast with potential to enhance the soy sauce flavor[J].International Journal of Food Microbiology, 2022, 370:109652.
[3] SONG Y R, JEONG D Y, BAIK S H.Effects of indigenous yeasts on physicochemical and microbial properties of Korean soy sauce prepared by low-salt fermentation[J].Food Microbiology, 2015, 51:171-178.
[4] RIIS N L, BJOERNSBO K S, TOFT U, et al.Impact of salt reduction interventions on salt taste sensitivity and liking, a cluster randomized controlled trial[J].Food Quality and Preference, 2021, 87:104059.
[5] DEVANTHI P V P, LINFORTH R, ONYEAKA H, et al.Effects of co-inoculation and sequential inoculation of Tetragenococcus halophilus and Zygosaccharomyces rouxii on soy sauce fermentation[J].Food Chemistry, 2018, 240:1-8.
[6] 李心智, 刘希, 徐新玉, 等.梯度升温发酵工艺对不同盐分稀态发酵酱油微生物变化和风味形成的影响[J].食品工业科技, 2024, 45(9):106-114.
LI X Z, LIU X, XU X Y, et al.Effect of gradient heating method on the microbial changes and flavor formation of liquid-state soy sauce fermented with different salt concentrations[J].Science and Technology of Food Industry, 2024, 45(9):106-114.
[7] 吕变梅, 蒋雪薇, 彭东, 等.酱油酿造用耐盐产乙醇风味酵母的选育及其应用[J].食品科学, 2020, 41(20):119-126.
LYU B M, JIANG X W, PENG D, et al.Breeding and application of salt-tolerant ethanol-producing yeast for soy sauce brewing[J].Food Science, 2020, 41(20):119-126.
[8] JANSEN M, VEURINK J H, EUVERINK G J W, et al.Growth of the salt-tolerant yeast Zygosaccharomyces rouxii in microtiter plates:Effects of NaCl, pH and temperature on growth and fusel alcohol production from branched-chain amino acids[J].FEMS Yeast Research, 2003, 3(3):313-318.
[9] SINGRACHA P, NIAMSIRI N, VISESSANGUAN W, et al.Application of lactic acid bacteria and yeasts as starter cultures for reduced-salt soy sauce (moromi) fermentation[J].LWT, 2017, 78:181-188.
[10] 王靖雯, 赵谋明, 陈涛, 等.高盐稀态酱醪中功能性酵母菌的筛选、鉴定及发酵特性[J].食品科学, 2021, 42(22):91-97.
WANG J W, ZHAO M M, CHEN T, et al.Screening, identification and fermentation characteristics of functional yeasts from high-salt liquid-state moromi[J].Food Science, 2021, 42(22):91-97.
[11] 王靖雯. 高盐稀态酱油风味功能酵母菌的筛选和应用研究[D].广州:华南理工大学, 2022.
WANG J W.Screening and application research of functional yeasts in high-salt liquid soy sauce[D].Guangzhou:South China University of Technology, 2022.
[12] LI X Z, XU X Y, WU C Z, et al.Effect of sequential inoculation of Tetragenococcus halophilus and Wickerhamomyces anomalus on the flavour formation of early-stage moromi fermented at a lower temperature[J].Foods, 2023, 12(18):3509.
[13] LIU B, LI Y, CAO Z N, et al.Effect of Tetragenococcus halophilus, Zygosaccharomyces rouxii, and Torulopsis versatilis addition sequence on soy sauce fermentation[J].Innovative Food Science &Emerging Technologies, 2021, 69:102662.
[14] 于茜雅, 鲁骞, 吴昌正, 等.温度对广式高盐稀态酱油原油品质的影响[J].食品科学, 2023, 44(22):55-63.
YU X Y, LU Q, WU C Z, et al.Effect of ambient temperature on the quality of Cantonese-style high-salt liquid-state base soy sauce[J].Food Science, 2023, 44(22):55-63.
[15] 苏国万, 赵炫, 张佳男, 等.酱油中鲜味二肽的分离鉴定及其呈味特性研究[J].现代食品科技, 2019, 35(5):7-15.
SU G W, ZHAO X, ZHANG J N, et al.Isolation, identification and taste characteristics of umami dipeptides from soy sauce[J].Modern Food Science and Technology, 2019, 35(5):7-15.
[16] WANG Q F, CUI R R, LIU X L, et al.Examining the impact of Tetragenococcus halophilus, Zygosaccharomyces rouxii, and Starmerella etchellsii on the quality of soy sauce:A comprehensive review of microbial population dynamics in fermentation[J].Critical Reviews in Food Science and Nutrition, 2024, 641(29):10873-10884.
[17] ZHANG L L, XIONG S J, DU T H, et al.Effect of microbiota succession on the dynamics of characteristic flavors and physicochemical properties during the soy sauce fermentation[J].Food Bioscience, 2023, 54:102883.
[18] 梁寒峭, 陈建国, 刘伟, 等.酿造酱油中特征氨基酸含量检测及对氨基酸态氮贡献的分析[J].食品与发酵工业, 2018, 44(4):198-203.
LIANG H Q, CHEN J G, LIU W, et al.Analysis of amino acids content and contribution to amino nitrogen in fermented soy sauce[J].Food and Fermentation Industries, 2018, 44(4):198-203.
[19] PARK Y C, PARK D H.Making soy sauce using direct fermentation of defatted soybean meal without the meju (soybean Koji) preparation process[J].Food Science and Biotechnology, 2016, 25(3):777-784.
[20] 张露, 梁寒峭, 陈建国, 等.酿造酱油中有机酸种类与含量的检测分析[J].食品科技, 2019, 44(3):295-299.
ZHANG L, LIANG H Q, CHEN J G, et al.Analysis of 10 kinds of organic acids composition in fermented soy sauce[J].Food Science and Technology, 2019, 44(3):295-299.
[21] ZHANG W W, HAN Y Q, SHI K X, et al.Effect of different sulfur-containing compounds on the structure, sensory properties and antioxidant activities of Maillard reaction products obtained from Pleurotus citrinopileatus hydrolysates[J].LWT, 2022, 171:114144.
[22] 冯云子, 周婷, 吴伟宇, 等.酱油风味与功能性成分研究进展[J].食品科学技术学报, 2021, 39(4):14-28.
FENG Y Z, ZHOU T, WU W Y, et al.Research progress on flavor and functional components of soy sauce[J].Journal of Food Science and Technology, 2021, 39(4):14-28.
[23] 张翀, 雷艳平, 王丹妮, 等.红曲霉菌混合制曲高盐稀态发酵过程挥发性物质的变化[J].食品工业科技, 2021, 42(13):51-58.
ZHANG C, LEI Y P, WANG D N, et al.Variation of volatile substances in high-salt dilute fermentation process of Monascus mixed koji production[J].Science and Technology of Food Industry, 2021, 42(13):51-58.
[24] 冯云子. 高盐稀态酱油关键香气物质的变化规律及形成机理的研究[D].广州:华南理工大学, 2016.
FENG Y Z.The evolution and formation mechanism of key aroma compounds during the process of high-salt liquid fermentation soy sauce[D].Guangzhou:South China University of Technology, 2016.
[25] ZHOU T, FENG Y Z, THOMAS-DANGUIN T, et al.Enhancement of saltiness perception by odorants selected from Chinese soy sauce:A gas chromatography/olfactometry-associated taste study[J].Food Chemistry, 2021, 335:127664.