燕麦是一种有益于健康的谷物,由于其优异的营养特性而受到越来越多的关注。包括其蛋白质含量高,必需氨基酸配比合理、具有不饱和脂肪酸和膳食纤维,以及一些有生物活性的物质,如维生素、酚类化合物、燕麦生物碱和其他微量营养素[1]。燕麦及其制品也被证实与降低胆固醇和心脑血管疾病的风险以及预防糖尿病等有关[2]。
种子发芽作为一种传统的生物加工方法,通过激活内源酶来打破种子休眠,可以增加生物活性物质含量,如酚类等抗氧化物质,降解抗营养因子含量从而提高矿物质吸收率等[3],这些变化使得发芽燕麦成为一种具有潜力的功能性食品,国内外学者的研究也证实发芽燕麦在降血压、改善血糖、降低心血管疾病风险等方面具有积极作用[4],但不能归因于单一化合物,而是多种生物活性化合物,如γ-氨基丁酸(γ-aminobutyric acid,GABA)、酚类、膳食纤维、氨基酸等在发芽中诱导的功能成分协同作用[5]。《中国药典》中将麦芽、稻芽、谷芽作为中药材,帮助改善消化,健脾开胃。萌发能够促进燕麦中功能性物质的释放以及生物活性的增强,如提高蛋白质消化率[6]、增加燕麦中酚类化合物的含量,从而提高其抗氧化能力[7]。萌芽燕麦作为一种功能性食品原料在提高营养价值方面具有较大的潜力,但关于萌发处理对燕麦蛋白质营养价值以及功能性物质含量的研究较为有限。
本文以燕麦为原料,综合分析萌发过程中芽长、干物质损耗、燕麦蛋白质及其溶解性、氨态氮,功能性成分[必需氨基酸(essential amino-acid,EAA)、GABA、总酚、膳食纤维]、抗营养因子植酸的影响,评估萌芽燕麦蛋白质营养价值和功能成分含量的变化,为燕麦芽开发天然、健康食品提供参考。
1 材料与方法
1.1 材料与试剂
燕麦:黑龙江产,品种:坝莜,2023年收获;乙腈(色谱纯),上海星可高纯溶剂有限公司;氨基酸标准品,上海安谱璀世标准技术服务有限公司;α-淀粉酶(活力10万 U/g)、蛋白酶(活力2 500 U/mg),上海源叶生物科技公司;植酸钠、没食子酸、福林酚,上海阿拉丁生化科技股份有限公司;次氯酸钠,上海凌峰化学试剂有限公司;氢氧化钠、碳酸钠、氯化钠、葡萄糖等试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
SHP-100生物培养箱,上海三发科学仪器有限公司;GZX-9140MBE电热鼓风干燥箱,上海博讯实业有限公司医疗设备厂;HH-2数显电子恒温水浴锅,常州国华电器有限公司;TG16KR台式高速冷冻离心机,长沙东旺实验仪器有限公司;RE-52旋转蒸发仪,上海亚荣生化仪器厂;X-500R液相色谱-四级杆飞行质谱仪,SCIEX中国公司。
1.3 实验方法
1.3.1 燕麦芽粉的制备
燕麦粒经挑选除杂后,用2%(质量分数)次氯酸钠溶液浸泡30 s消毒,去离子水冲洗干净,在室温下浸泡16 h。浸泡后的样品滤干水分平铺在纱布上,置于20 ℃的生物培养箱中发芽72 h,发芽过程中培养箱湿度保持在95%以上。每间隔12 h取样。将原料及所取得的样品置于50 ℃恒温鼓风干燥箱中干燥至恒重,粉碎,过60目筛,4 ℃保存备用。
1.3.2 部分指标的测定
水分:GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;蛋白质:GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;氨基酸态氮:GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》;游离氨基酸:GB 30987—2020《食品安全国家标准 植物中游离氨基酸的测定》;膳食纤维:GB 5009.88—2023《食品中膳食纤维的测定》。
1.3.3 燕麦芽长和干物质损耗的测定
芽长的测定:每隔12 h随机挑选出20粒发芽种子,使用Image J软件对芽长进行测量,取平均值。
干物质损耗:参考TIAN等[8]的方法。不同萌发时间随机选择100粒发芽种子至烘箱105 ℃烘干至恒重。干物质损耗的计算如公式(1)所示:
干物质损耗/%
(1)
1.3.4 燕麦芽蛋白质溶解性测定
参考马萨日娜[9]的方法。以蛋白质的溶解度表示,将1.0 g燕麦芽粉加入到50 mL的蒸馏水中,在25 ℃下保温搅拌约1 h,将悬浮液分离出,4 000 r/min离心30 min,分离上清液。每份样品取10 mL,用凯氏定氮法测定上清液蛋白质含量,蛋白质溶解度的计算如公式(2)所示:
蛋白质溶解度![]()
(2)
1.3.5 燕麦芽中必需氨基酸含量测定及蛋白质营养评价
准确称取0.1 g不同萌发时间的燕麦芽粉,参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》进行水解、干燥,用1.0 mL水溶解残留物,振荡后通过0.22 μm滤膜后转移至仪器进样瓶,为样品测定液。参考GB/T 30987—2020通过液相色谱-质谱联用仪对蛋白质中必需氨基酸进行分析。必需氨基酸评分(amino acid score,AAS)以及化学评分(chemical score,CS)的计算如公式(3)和公式(4)所示:
AAS
(3)
(4)
1.3.6 燕麦芽中GABA测定
准确称取燕麦芽粉约2.0 g,参考GB/T 30987—2020测定样品中GABA含量。取适量样品溶液经0.22 μm 滤膜后转移至仪器进样瓶,通过液相色谱-质谱联用仪对GABA进行定性与定量分析。
1.3.7 燕麦芽中总酚测定
参考卢宇[10]的方法。以没食子酸质量浓度为横坐标、吸光度值为纵坐标绘制标准曲线。吸取1.0 mL样品液于10 mL试管中,加入0.5 mL福林酚试剂混匀,反应5 min,加入1 mL 70 g/L的Na2CO3溶液混匀,加水定容至10 mL,室温放置1 h,在760 nm波长下测定吸光值。
1.3.8 燕麦芽中植酸测定
参考甘镜君[11]的方法。以植酸钠为标准溶液,于519 nm处测定吸光值,绘制标准曲线。称取25 mg燕麦芽粉,加入2.5 mL 30 g/L的三氯乙酸和5 mL 0.2 g/L的NH4Fe(SO4)2。加盖振荡均匀,于519 nm处测定吸光值。依据从标准曲线中查得的植酸浓度,计算样品中植酸含量。
1.4 统计与分析
采用Microsoft Excel软件进行数据整理,SPSS 29统计软件处理数据进行单因素方差分析(one-way analysis of variance,ANOVA),显著水平P<0.05。所有实验重复3次,结果以“平均值±标准差”表示,采用Graphpad Prism 9绘图。
2 结果与分析
2.1 萌发过程中燕麦芽长和干物质损耗、水分的变化
图1显示了燕麦芽长以及干物质损耗随着萌发时间的变化,燕麦在发芽过程中,芽长不断增加。如图1所示0~36 h期间芽长生长趋势较缓,萌发36~60 h芽长增长较快,由2.13 mm生长到6.13 mm,同时干物质损耗也随着萌发时间的延长而增加,其原因可能是该阶段种子已经充分吸水,体内发生大量代谢反应,如蛋白质、淀粉被酶分解,为生长中的胚胎提供能量供应,从而导致干物质损耗增加[12]。继续萌发到72 h平均芽长达到8.09 mm,干物质损耗为15.13%。
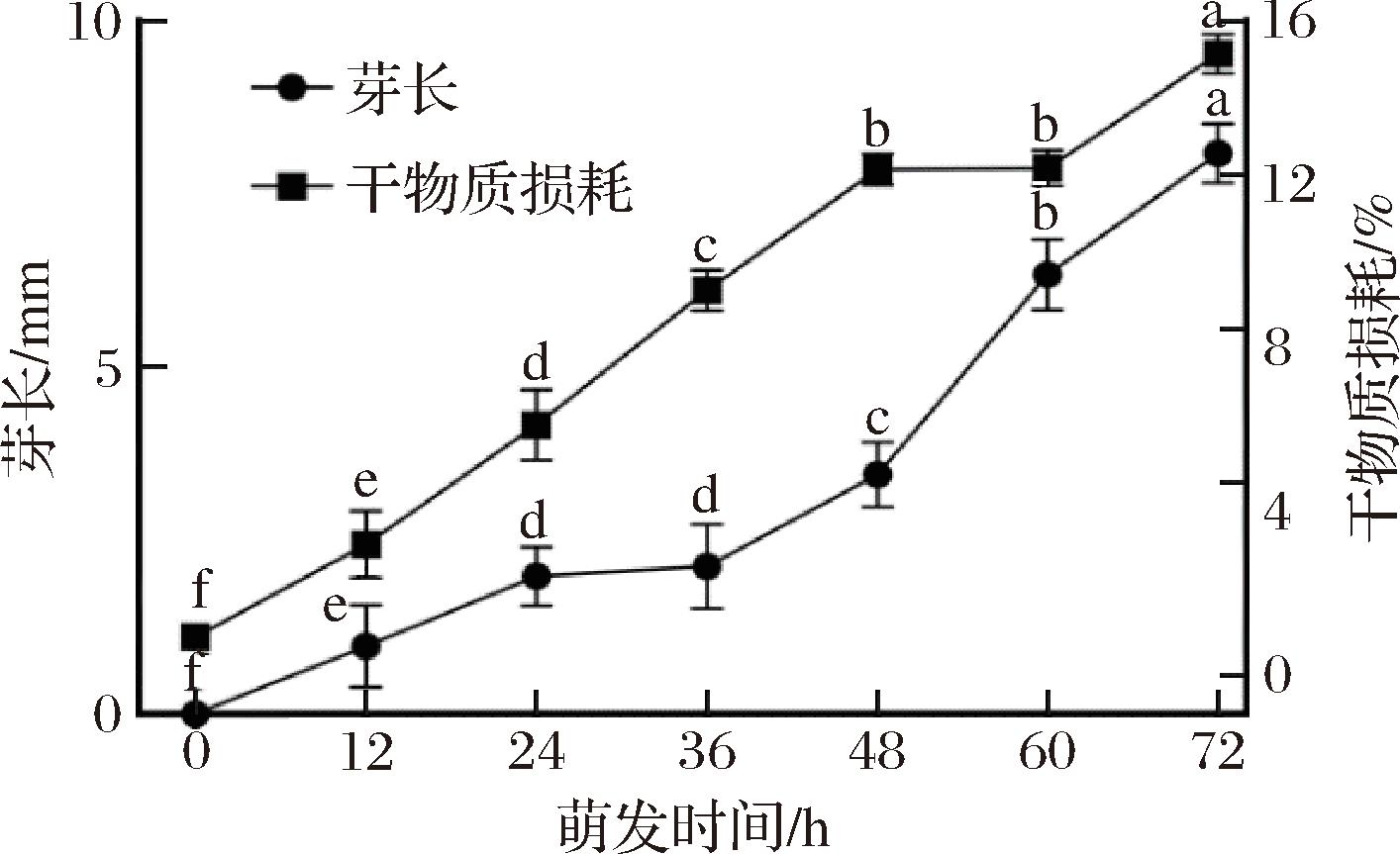
图1 不同时间萌发燕麦芽长及干物质损耗的变化
Fig.1 Changes in sprout length and dry matter loss of oat at different germination time
注:图中小写字母表示显著差异(P<0.05)(下同)。
从植物生理学的角度来看,种子的萌发始于吸收水分,种子吸水主要包括3个阶段:吸胀作用;吸水缓慢阶段,这一阶段包括动员储备物质以及激活种子生长所必需的内源代谢反应;种子进一步吸水,营养物质为呼吸作用以及种子生长提供燃料[13]。如图2所示,当燕麦萌发12 h时,水分含量由原料的12.76%增加到37.31%,符合种子发芽的第一阶段,即快速吸水阶段,种子新陈代谢会被唤醒,休眠结束,芽长生长也较为缓慢。随后萌发24~60 h,水分含量由41.99%增加到45.21%,符合种子发芽的第二阶段,为种子生长提供了适宜的水分。结合图1可以看出,在此阶段燕麦芽长增长较快。萌发60~72 h时,种子进一步吸收水分,萌发72 h时燕麦芽水分含量达到了47.96%。
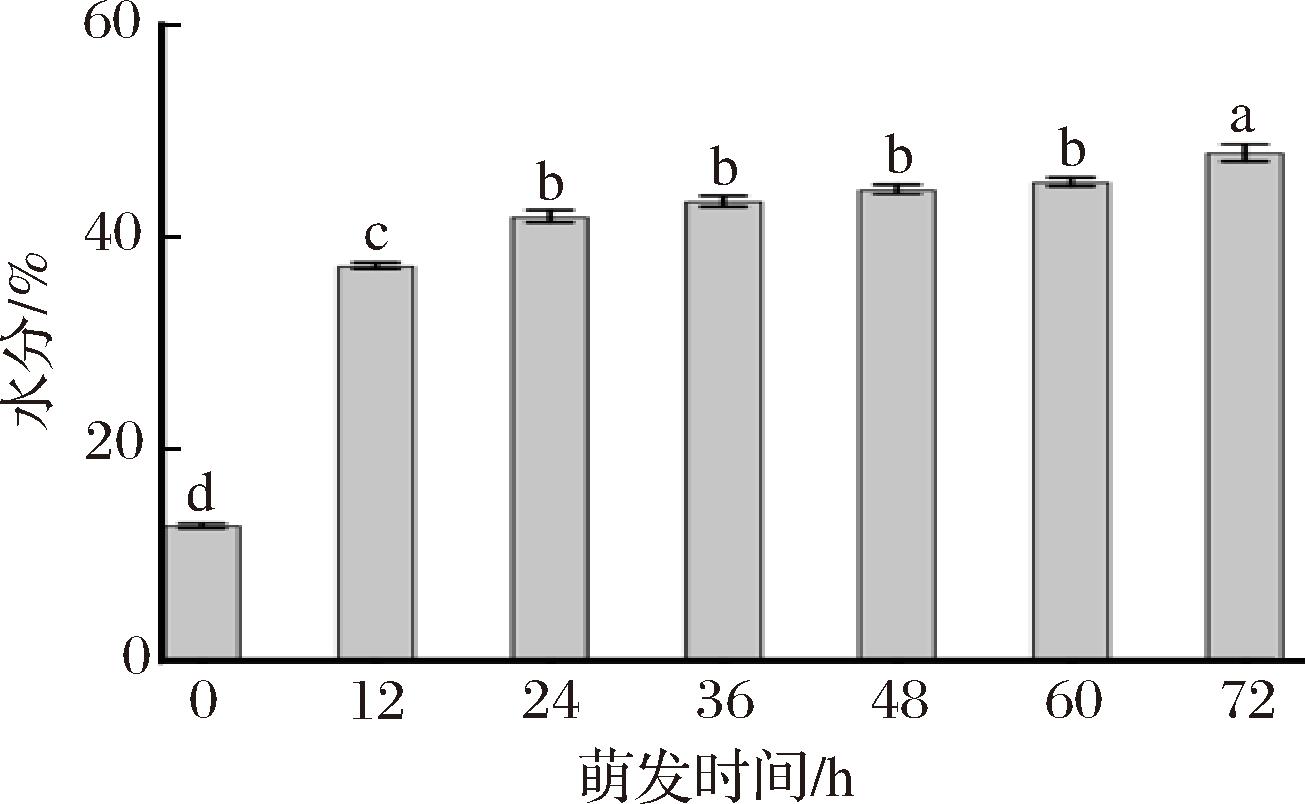
图2 不同时间萌发燕麦水分的变化
Fig.2 Changes in water content of oats at different germination time
2.2 萌发过程中燕麦蛋白质含量及其溶解性、氨基酸态氮含量的变化
如图3所示,原料燕麦中蛋白质含量为13.90 g/100 g,经萌发处理,燕麦蛋白质含量呈先上升后下降再上升的趋势,发芽0~12 h时,蛋白质含量从原料的13.90 g/100 g显著增加到15.75 g/100 g(P<0.05),增加了约13%。随后,蛋白质含量开始降低,萌发36 h 时燕麦蛋白质含量最低,为13.18 g/100 g,其原因可能是蛋白质被分解用于种子的新陈代谢;随着发芽的持续,种子生长不断消耗能源物质,蛋白质合成能力增强,因此蛋白质含量开始上升。
燕麦球蛋白表面具有富含谷氨酰胺的部分,使其比其他植物球蛋白亲水性差,而燕麦蛋白中主要组分为球蛋白,导致燕麦蛋白溶解度较低。溶解性是蛋白质水化作用的重要体现,决定和影响着蛋白质的其他功能特性[14]。如图3所示,原料燕麦蛋白质溶解度为5.4%,随着萌发时间的延长,燕麦籽粒蛋白溶解度总体呈现不断上升的趋势。萌发72 h时,萌芽燕麦蛋白溶解度由原料的5.4%显著增加到8.8%(P<0.05),增加了约63%。原因可能是种子体内发生大量代谢反应,内源蛋白酶酶活性提高,贮藏蛋白水解为小分子多肽和游离氨基酸,同时蛋白质组分发生变化,提高了可溶性蛋白的比例[15],因此蛋白溶解度不断增加,在不需要任何化学修饰的情况下改善燕麦蛋白质的性质。
由图3可知,氨基酸态氮含量在萌发初期有所下降;萌发24~48 h氨基酸态氮含量呈上升趋势,48 h时氨基酸态氮含量达到最高,为6.3 g/100 g,相比原料增加了约2.9倍。萌发72 h时氨基酸态氮含量较原料降低了约42%。可能是萌发初期需要氨基酸来合成新组织中的蛋白质,随后为了保证发芽过程中所需的物质和能量,内源酶活性升高,蛋白质在蛋白酶的作用下被分解成肽和氨基酸[16]。
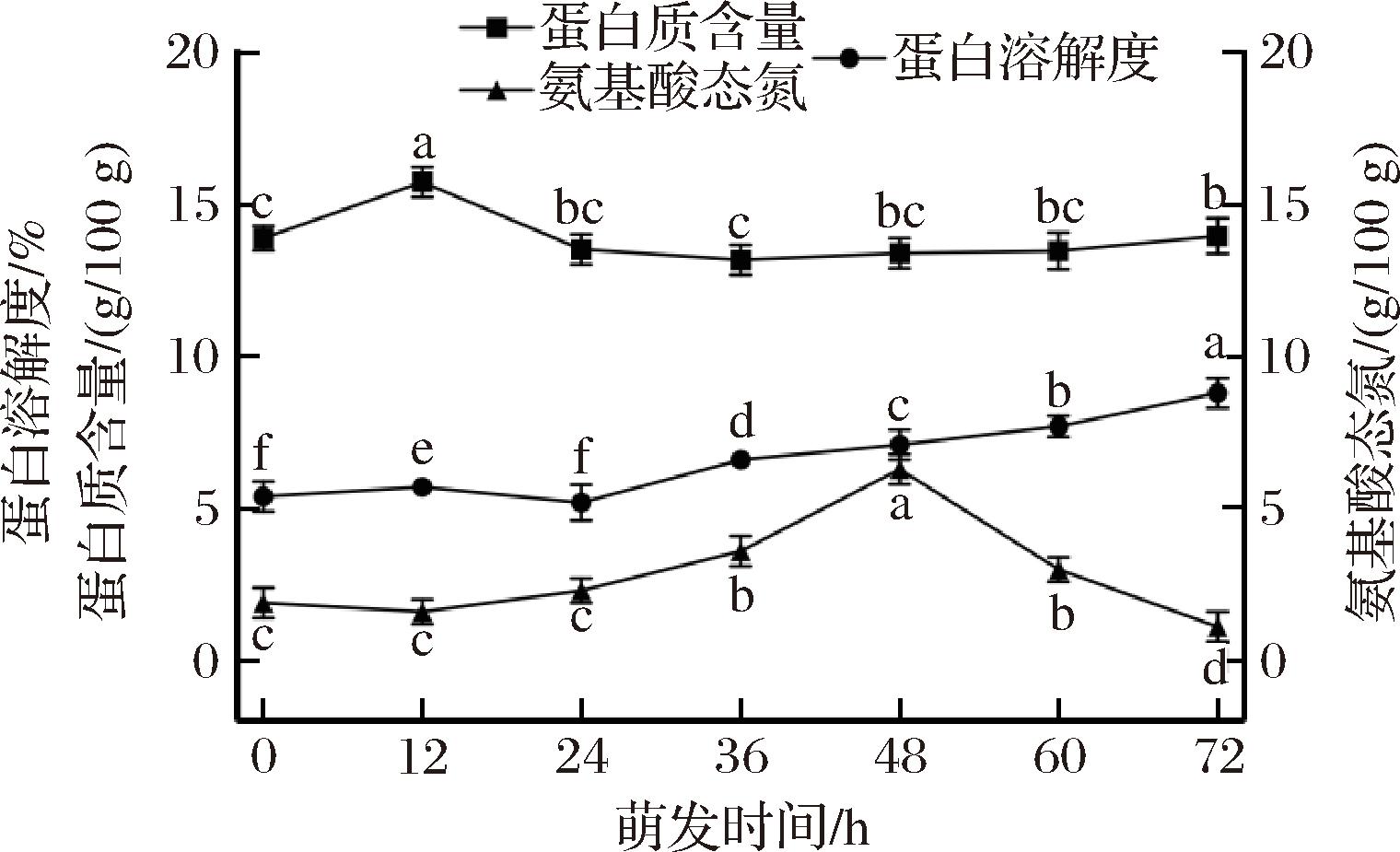
图3 不同时间萌发燕麦蛋白质、氨态氮以及蛋白溶解度的变化
Fig.3 Changes in protein, ammonium nitrogen, and protein solubility of oats at different germination time
2.3 萌发过程中燕麦游离EAA的变化
如表1所示,随着萌发时间的延长,燕麦芽游离EAA含量均有增加。萌发72 h时,其总量达到65.8 mg/100 g,较原料(31.78 mg/100 g)相比显著(P<0.05)增加了2.1倍。可能是种子中的蛋白质在内源酶的作用下被水解成游离氨基酸;以及一些游离氨基酸被降解成为植物中主要氮素来源进入氮素循环合成新的氨基酸[17]。此外,萌芽燕麦中Lys含量由原料的13.23 mg/100 g极显著(P<0.001)增加到27.37 mg/100 g,增加了2.06倍。Lys可以有效提高人体对蛋白质的吸收和利用,改善中枢神经系统功能,在未来将萌芽燕麦用于食品加工时,也可弥补我国传统膳食结构所引起的“赖氨酸缺乏症”[18];同时,游离EAA总量的增加反映了蛋白质在萌发过程中水解程度较高,这也是发芽燕麦体外消化率更高的原因[19]。
表1 不同时间萌发燕麦游离EAA含量的变化 单位:mg/100 g DW
Table 1 Changes in the content of free EAA in oats at different germination time
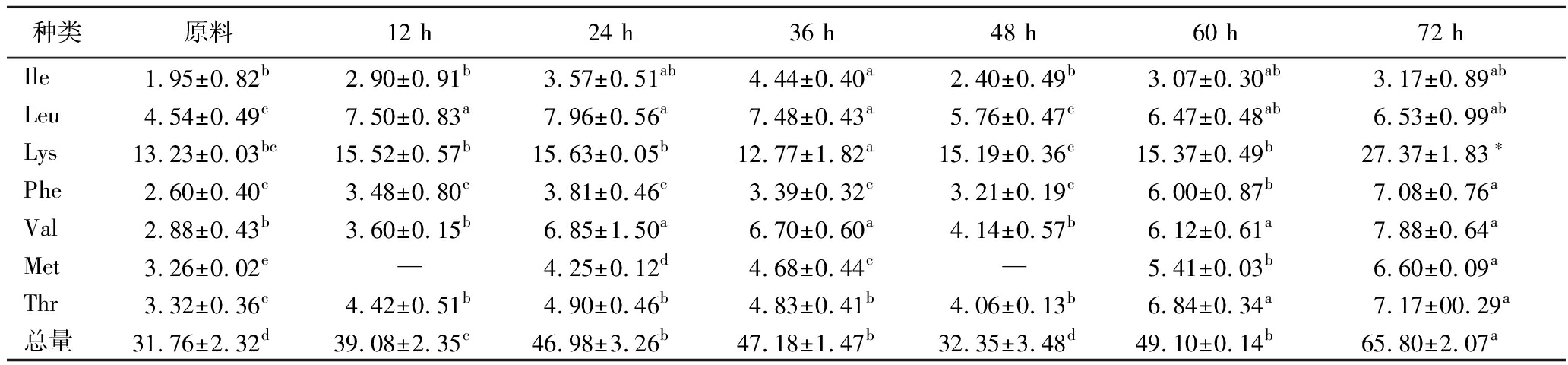
种类原料12 h24 h36 h48 h60 h72 hIle1.95±0.82b2.90±0.91b3.57±0.51ab4.44±0.40a2.40±0.49b3.07±0.30ab3.17±0.89abLeu4.54±0.49c7.50±0.83a7.96±0.56a7.48±0.43a5.76±0.47c6.47±0.48ab6.53±0.99abLys13.23±0.03bc15.52±0.57b15.63±0.05b12.77±1.82a15.19±0.36c15.37±0.49b27.37±1.83∗Phe2.60±0.40c3.48±0.80c3.81±0.46c3.39±0.32c3.21±0.19c6.00±0.87b7.08±0.76aVal2.88±0.43b3.60±0.15b6.85±1.50a6.70±0.60a4.14±0.57b6.12±0.61a7.88±0.64aMet3.26±0.02e—4.25±0.12d4.68±0.44c—5.41±0.03b6.60±0.09aThr3.32±0.36c4.42±0.51b4.90±0.46b4.83±0.41b4.06±0.13b6.84±0.34a7.17±00.29a总量31.76±2.32d39.08±2.35c46.98±3.26b47.18±1.47b32.35±3.48d49.10±0.14b65.80±2.07a
注:Ile:异亮氨酸(isoleucine);Leu:亮氨酸(leucine);Lys:赖氨酸(lysine);Phe:苯丙氨酸(phenylalanine);Val:缬氨酸(valine);Met:蛋氨酸(methionine);Thr:苏氨酸(threonine);—表示未检测到;小写字母表示同一测量指标不同组间存在显著性差异(P<0.05);*表示同一测量指标不同组间存在极显著性差异(P<0.001)(下同)。
2.4 萌发过程中燕麦蛋白质EAA含量的变化
由表2可知,随着萌发时间的延长,大多数EAA呈现上升趋势。
特别是在萌发48 h,燕麦蛋白质中EAA总量达到最高,为54.54 mg/g,相比原料燕麦(37.88 mg/g)显著增加了44%(P<0.05),随后其含量出现降低,但仍高于原料燕麦。其中Lys、Leu含量显著增加(P<0.05),在萌发48 h达到最大,分别增加了71%、46%。且萌发48 h的燕麦芽中各EAA含量均高于鸡蛋、牛奶。萌芽燕麦中EAA含量的增加,可能与萌发过程中酶活性的增加和代谢过程的增强有关。
表2 不同时间萌发燕麦蛋白质中EAA含量的变化 单位:mg/g DW
Table 2 Changes in the content of EAA in oat protein at different germination time
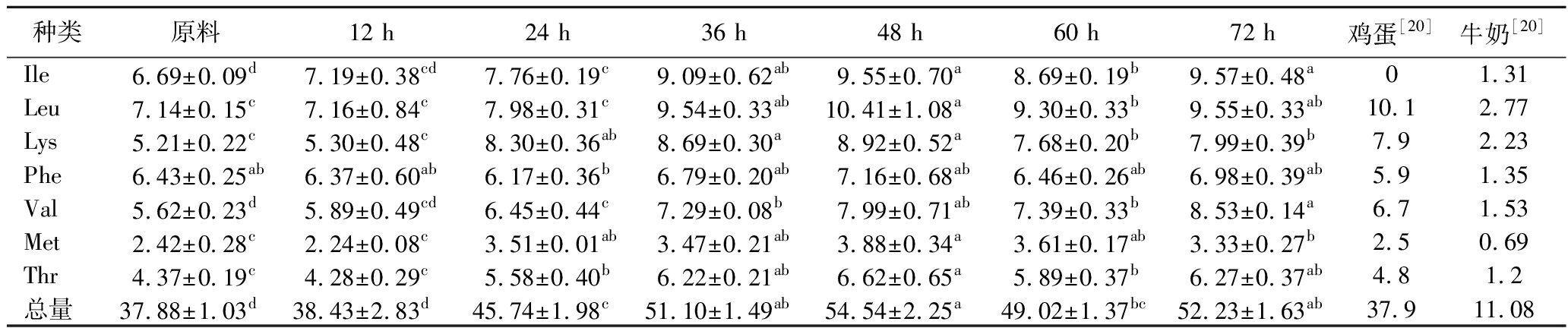
种类原料12 h24 h36 h48 h60 h72 h鸡蛋[20]牛奶[20]Ile6.69±0.09d7.19±0.38cd7.76±0.19c9.09±0.62ab9.55±0.70a8.69±0.19b9.57±0.48a01.31Leu7.14±0.15c7.16±0.84c7.98±0.31c9.54±0.33ab10.41±1.08a9.30±0.33b9.55±0.33ab10.12.77Lys5.21±0.22c5.30±0.48c8.30±0.36ab8.69±0.30a8.92±0.52a7.68±0.20b7.99±0.39b7.92.23Phe6.43±0.25ab6.37±0.60ab6.17±0.36b6.79±0.20ab7.16±0.68ab6.46±0.26ab6.98±0.39ab5.91.35Val5.62±0.23d5.89±0.49cd6.45±0.44c7.29±0.08b7.99±0.71ab7.39±0.33b8.53±0.14a6.71.53Met2.42±0.28c2.24±0.08c3.51±0.01ab3.47±0.21ab3.88±0.34a3.61±0.17ab3.33±0.27b2.50.69Thr4.37±0.19c4.28±0.29c5.58±0.40b6.22±0.21ab6.62±0.65a5.89±0.37b6.27±0.37ab4.81.2总量37.88±1.03d38.43±2.83d45.74±1.98c51.10±1.49ab54.54±2.25a49.02±1.37bc52.23±1.63ab37.911.08
EAA对于人类的营养至关重要,其不能由人体自身合成,必须通过食物摄入。分别以世界卫生组织(World Health Organization,WHO)/联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)提出的成人EAA模式以及鸡蛋蛋白质为标准,计算AAS以及CS。结果如表3所示。燕麦经过萌发72 h,7种必需氨基酸的AAS均高于原料燕麦。除Met外,其他EAA在萌发48 h时,CS均大于0.75,其中部分氨基酸(Phe+Tyr、The、Ile)CS>1,超过鸡蛋蛋白。由此可见,萌发处理不仅提高了燕麦中EAA的含量,且萌芽燕麦AAS指数也高于原料燕麦,更接近WHO/FAO标准模式,CS也均接近或超过鸡蛋蛋白,表明燕麦芽可以作为一种更优质的蛋白质来源。
2.5 萌发过程中燕麦膳食纤维的变化
燕麦作为膳食纤维的良好来源,具有极高的营养价值,其在调节血脂、血糖和降低胆固醇水平等方面具有较强的作用。膳食纤维还可以调节营养物质在人体内消化和吸收的速率,作为肠道微生物菌群的底物,促进益生菌的生长[21]。
表3 不同时间萌发燕麦蛋白质AAS及CS的变化
Table 3 Changes in AAS and CS of oat at different germination time
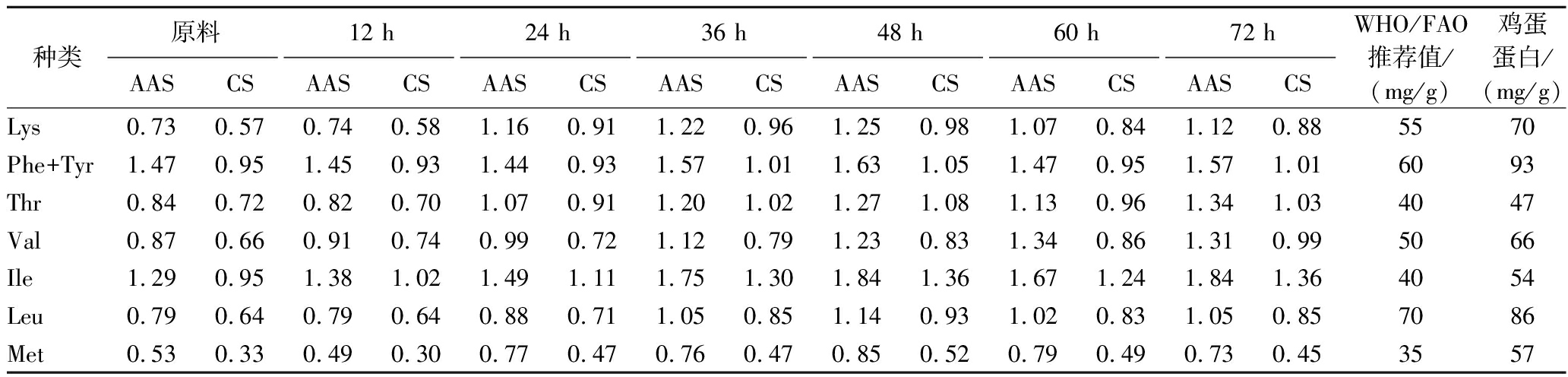
种类原料12 h24 h36 h48 h60 h72 hAASCSAASCSAASCSAASCSAASCSAASCSAASCSWHO/FAO推荐值/(mg/g)鸡蛋蛋白/(mg/g)Lys0.730.570.740.581.160.911.220.961.250.981.070.841.120.885570Phe+Tyr1.470.951.450.931.440.931.571.011.631.051.470.951.571.016093Thr0.840.720.820.701.070.911.201.021.271.081.130.961.341.034047Val0.870.660.910.740.990.721.120.791.230.831.340.861.310.995066Ile1.290.951.381.021.491.111.751.301.841.361.671.241.841.364054Leu0.790.640.790.640.880.711.050.851.140.931.020.831.050.857086Met0.530.330.490.300.770.470.760.470.850.520.790.490.730.453557
如图4所示,燕麦萌发过程中,总膳食纤维含量不断增加,萌发72 h时由原料的15.696 g/100 g增加到18.640 g/100 g,约增加19%;可溶性膳食纤维含量由7.178 g/100 g增加到13.213 g/100 g,约增加84%;不溶性膳食纤维含量由8.158 g/100 g降低为6.394 g/100 g,约降低22%;可溶性膳食纤维占总膳食纤维的比例由原料的45%增加到67%。发芽过程中不溶性膳食纤维含量降低可能是因为发芽过程中半纤维素酶作用于胚乳细胞壁使半纤维素水解;可溶性膳食纤维含量增加可能是因为在发芽期间,麦粒中的半纤维素分解形成新的糖类[22]。
可溶性膳食纤维在营养价值上更具有优势,其是结肠中微生物发酵的主要底物之一,主要发酵产物包括短链脂肪酸,这些脂肪酸可以通过为结肠细胞提供能量和降低肠道渗透性来促进肠道健康[12]。经过萌发处理后的燕麦芽可溶性膳食纤维占总膳食纤维的比例有所增加,使得萌芽燕麦营养价值更高。此外,通过对比其他谷物发现萌发过程中部分营养成分的变化与燕麦有类似的趋势:糙米经发芽后不溶性膳食纤维含量下降,可溶性膳食纤维含量增加,使得其更利于人体消化吸收[23]。萌发处理可以作为一种提高谷物营养物质含量的有效手段。
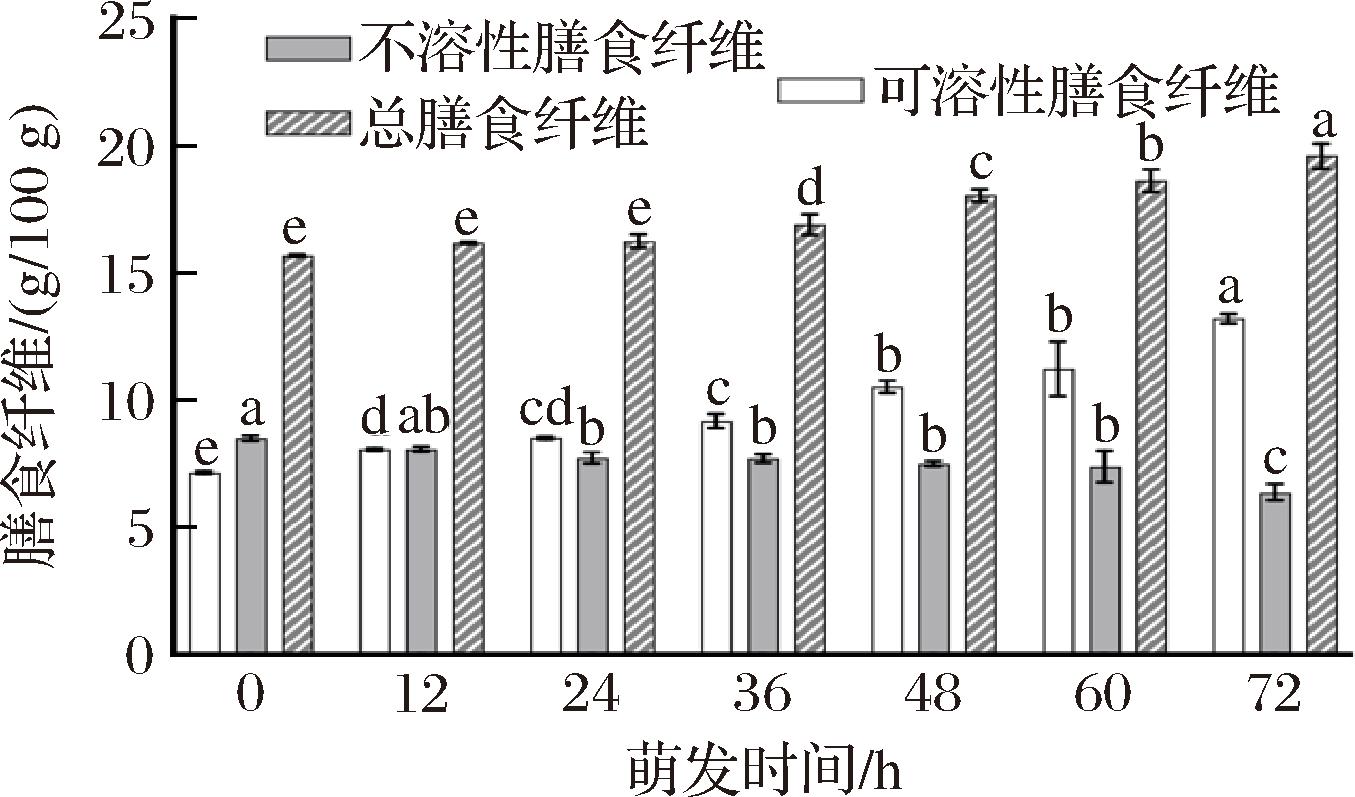
图4 不同时间萌发燕麦膳食纤维含量的变化
Fig.4 Changes in the content of dietary fiber in oats at different germination time
2.6 萌发过程中燕麦总酚的变化
燕麦萌发过程中总酚含量的测定结果如图5所示,总酚的含量随着萌发时间的延长而逐渐增加。萌发72 h时,燕麦总酚含量由原料的0.99 mg/g增加到1.85 mg/g,约增加87%。其原因主要是萌发过程中苯丙氨酸解氨酶被激活[24],促进酚类物质的合成;以及燕麦中的部分酚类化合物通过与细胞壁多糖共价连接,不易被释放,萌发过程中由于多种酶的作用,细胞壁会被分解,结合在细胞壁上的酚类物质可以被释放出来[25]。另外,酚类物质是燕麦中重要的抗氧化剂,将具有较高抗氧化水平的发芽燕麦应用于产品时可抑制酸败和颜色变化,有效改善产品的腐败变质[26]。因此,总酚不仅能作为功能性成分,提高萌芽燕麦的营养价值,且在产品应用中,能保护食物免受酸败,延长货架期,有利于天然健康产品的开发。
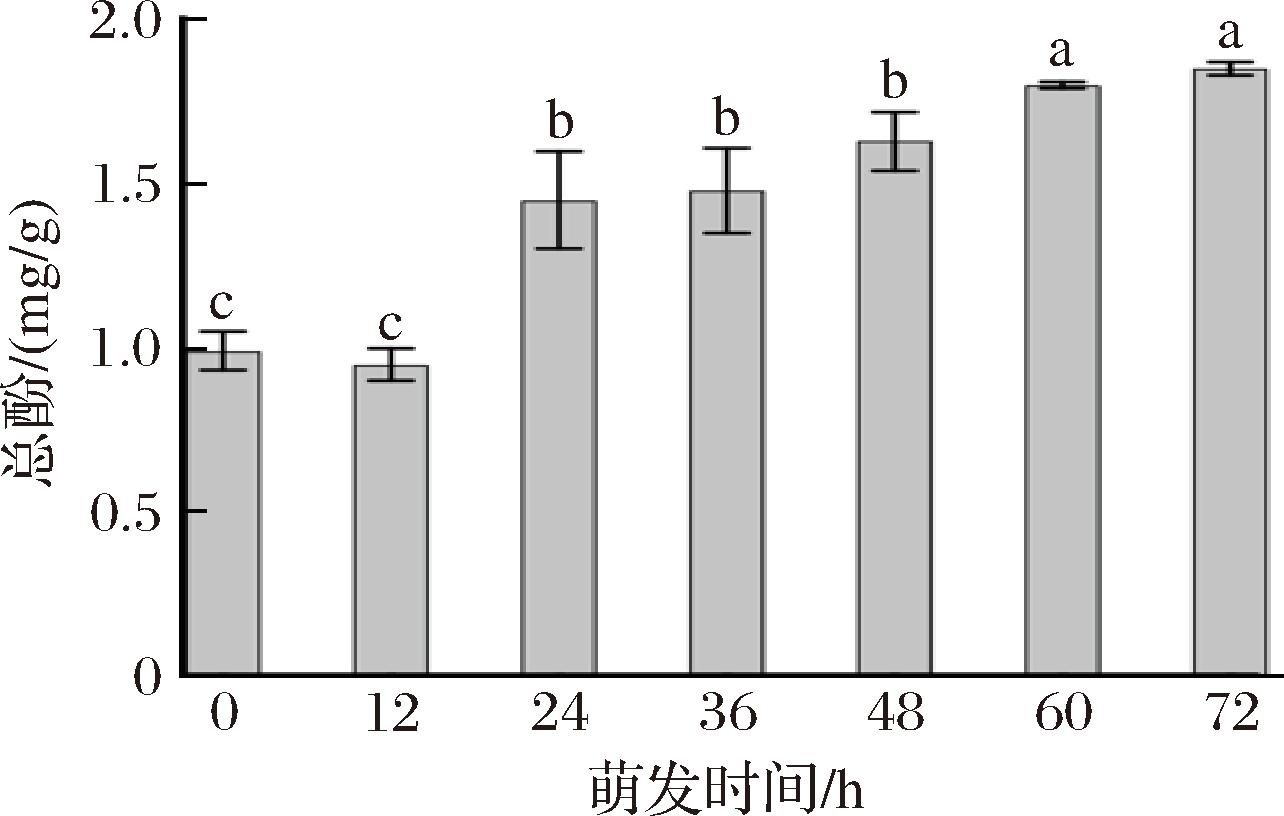
图5 不同萌发时间燕麦总酚含量的变化
Fig.5 Changes in the content of total phenols in oats at different germination time
2.7 萌发过程中燕麦GABA的变化
GABA是动物中枢神经系统中的主要抑制性神经递质,对缓解精神压力、预防心脑血管疾病等方面具有一定的生理功能。如图6所示,随着萌发时间的延长,燕麦中GABA的含量呈上升趋势,萌发60 h时,其含量由原料的6.79 mg/100 g增加到10.68 mg/100 g,增加了57%。在萌发过程中,蛋白质被部分水解,增加了游离氨基酸的含量,并且谷氨酸脱氢酶(glutamate dehydrogenase,GAD)的活性增强[27],促进萌芽燕麦中GABA的积累。
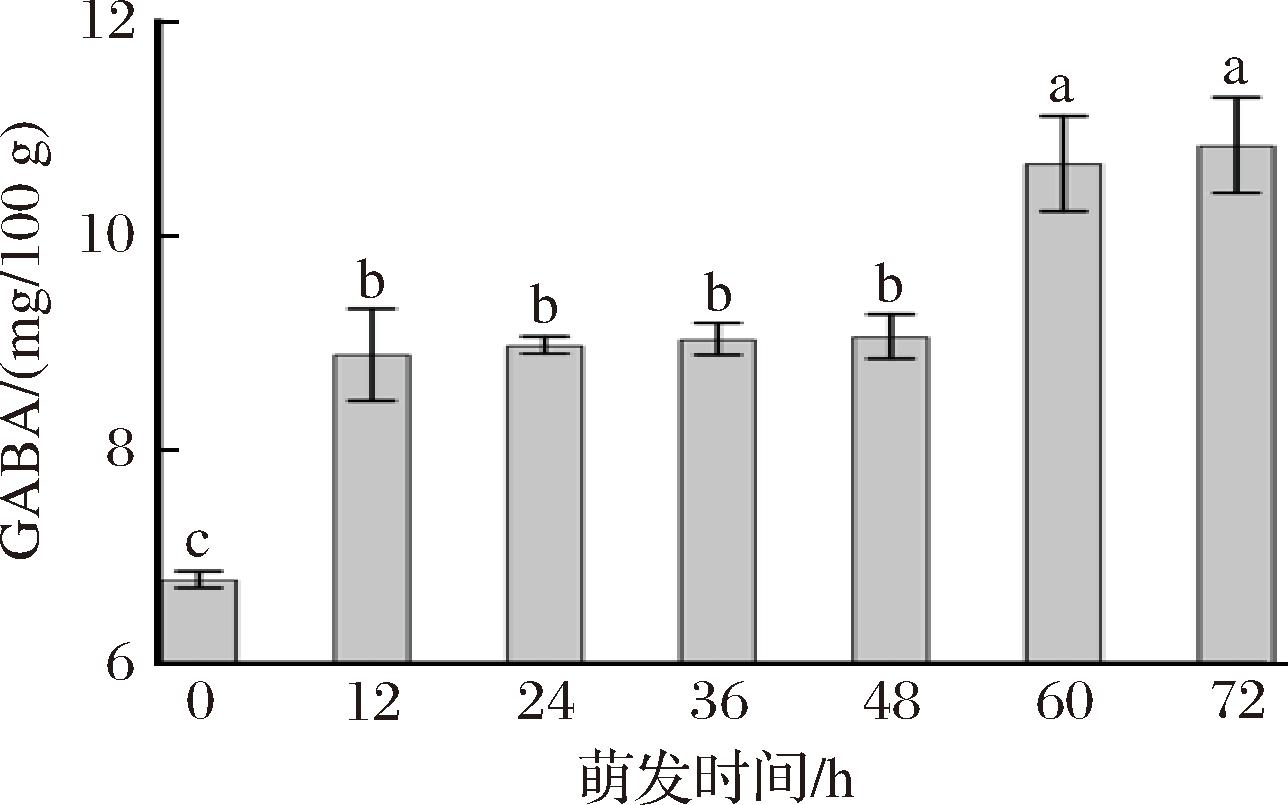
图6 不同萌发时间燕麦GABA含量的变化
Fig.6 Changes in GABA content in oats at different germination time
2.8 萌发过程中燕麦植酸的变化
在燕麦中,植酸是最丰富的抗营养因子,它可以与金属离子和蛋白质结合,抑制微量元素的吸收和胃肠道的蛋白质活性[28]。
燕麦经萌发处理后植酸含量的变化如图7所示,原料燕麦的植酸含量为1.79%。随着萌发时间的延长,植酸含量不断降低。经过72 h的发芽后,燕麦中植酸含量降解至0.4%。这种降低的趋势在其他谷物中也较为明显,如水稻、小麦,经发芽处理后植酸含量分别降低了14%~16%[25]。原因可能是发芽期间植酸酶活性的增加,植酸被降解为肌醇和磷酸肌醇盐以及部分植酸在浸泡过程中溶于水中[8]。萌发处理可以有效降低燕麦中植酸含量,植酸降解后,与其呈结合状态的微量元素游离出来,有利于人体对微量元素的吸收。
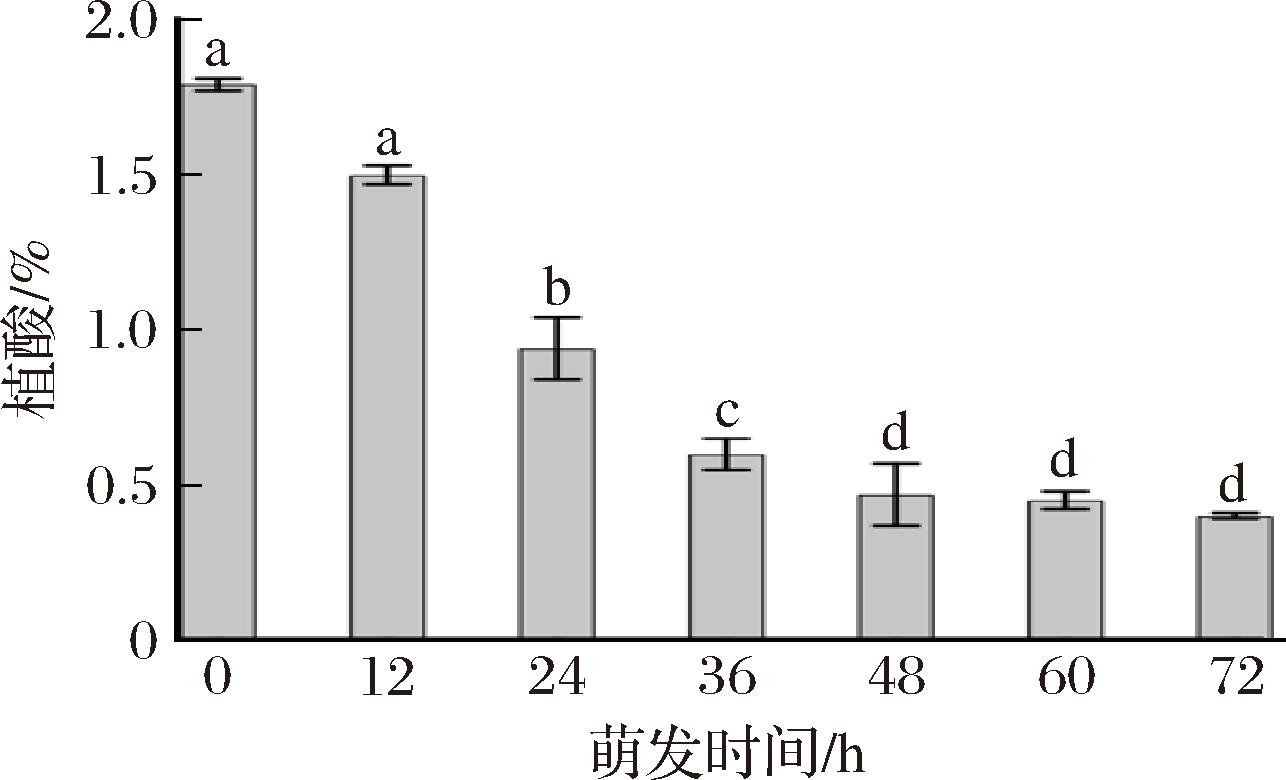
图7 不同时间萌发燕麦植酸含量的变化
Fig.7 Changes in phytic acid content in oats at different germination time
3 结论
本研究表明,萌芽燕麦是一个非常丰富的营养来源,其蛋白质营养价值及功能性成分含量均有所提升。通过对比不同萌发时间燕麦芽各指标的变化发现,当萌发时间为48 h时,燕麦芽长为3.45 mm,燕麦芽干物质损耗率为10.5%;氨态氮含量、必需氨基酸总量达到最大,分别增加了2.9倍、44%;各EAA含量超过牛奶和鸡蛋,AAS评分除Met外均高于WHO/FAO标准模式,CS评分均接近或超过鸡蛋蛋白;蛋白溶解度增加了31%。萌发48 h时,燕麦芽可溶性膳食纤维占总纤维比例由45%增加到58%,萌芽燕麦具有更优质的纤维;功能性成分GABA、总酚含量分别提高了33%、65%;抗营养因子植酸由原料的1.79%降解至0.47%,有利于人体更好地利用燕麦中的矿物质与微量元素,且适当的萌发时间可以显著提升燕麦的营养价值,选择48 h作为燕麦的适宜萌发时间,以最大化燕麦芽的功能性和健康益处,使其成为更有价值的谷类加工原料。
[1] ZHANG K L, DONG R, HU X Z, et al.Oat-based foods:Chemical constituents, glycemic index, and the effect of processing[J].Foods, 2021, 10(6):1304.
[2] APARICIO-GARC A N, MART
A N, MART NEZ-VILLALUENGA C, FRIAS J, et al.Sprouted oat as a potential gluten-free ingredient with enhanced nutritional and bioactive properties[J].Food Chemistry, 2021, 338:127972.
NEZ-VILLALUENGA C, FRIAS J, et al.Sprouted oat as a potential gluten-free ingredient with enhanced nutritional and bioactive properties[J].Food Chemistry, 2021, 338:127972.
[3] YANG Z, XIE C, BAO Y L, et al.Oat:Current state and challenges in plant-based food applications[J].Trends in Food Science &Technology, 2023, 134:56-71.
[4] LISKA D J, DIOUM E, CHU Y F, et al.Narrative review on the effects of oat and sprouted oat components on blood pressure[J].Nutrients, 2022, 14(22):4772.
[5] BENINCASA P, FALCINELLI B, LUTTS S, et al.Sprouted grains:A comprehensive review[J].Nutrients, 2019, 11(2):421.
[6] 周雯瑾, 黄凯, 李森, 等.发芽对裸燕麦营养品质的影响[J].上海理工大学学报, 2024, 46(2):206-213.
ZHOU W J, HUANG K, LI S, et al.Effect of germination on nutrition quality of naked oat[J].Journal of University of Shanghai for Science and Technology, 2024, 46(2):206-213.
[7] TANG S Y, MAO G, YUAN Y, et al.Optimization of oat seed steeping and germination temperatures to maximize nutrient content and antioxidant activity[J].Journal of Food Processing and Preservation, 2020, 44(9):e14683.
[8] TIAN B Q, XIE B J, SHI J, et al.Physicochemical changes of oat seeds during germination[J].Food Chemistry, 2010, 119(3):1195-1200.
[9] 马萨日娜. 裸燕麦总蛋白,谷蛋白酶解物的功能特性及其抗氧化活性研究[D].呼和浩特:内蒙古农业大学, 2015.
MA S R N.The study of functional characteristics and antioxidant activity on enzyme hydrolyzed protein and glutelin in naked oats[D].Hohhot:Inner Mongolia Agricultural University, 2015.
[10] 卢宇. 藜麦营养特性及其多酚化合物分离纯化和抗氧化活性研究[D].呼和浩特:内蒙古农业大学, 2017.
LU Y.Nutritional characteristic and polyphenol isolation purification and antioxidant activity of quinoa[D].Hohhot:Inner Mongolia Agricultural University, 2017.
[11] 甘镜君. 普通小麦主要营养品质与籽粒形态特性研究[D].雅安:四川农业大学, 2019.
GAN J J.Study on mian nutritional quality and grain morphological characteristics in common wheat[D].Ya’an:Sichuan Agricultural University, 2019.
[12] LEMMENS E, MORONI A V, PAGAND J, et al.Impact of cereal seed sprouting on its nutritional and technological properties:A critical review[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(1):305-328.
[13] IKRAM A, SAEED F, AFZAAL M, et al.Nutritional and end-use perspectives of sprouted grains:A comprehensive review[J].Food Science &Nutrition, 2021, 9(8):4617-4628.
[14] KUMAR L, SEHRAWAT R, KONG Y Z.Oat proteins:A perspective on functional properties[J].Lwt, 2021, 152:112307.
[15] DEL ROSARIO MOGUEL CONCHA D, MART NEZ J E B, VEL
NEZ J E B, VEL ZQUEZ T G G, et al.Impact of germination time on protein solubility and anti-inflammatory properties of Pisum sativum L. grains[J].Food Chemistry:X, 2022, 13:100219.
ZQUEZ T G G, et al.Impact of germination time on protein solubility and anti-inflammatory properties of Pisum sativum L. grains[J].Food Chemistry:X, 2022, 13:100219.
[16] APARICIO-GARC A N, MART
A N, MART NEZ-VILLALUENGA C, FRIAS J, et al.Changes in protein profile, bioactive potential and enzymatic activities of gluten-free flours obtained from hulled and dehulled oat varieties as affected by germination conditions [J].LWT, 2020, 134:109955.
NEZ-VILLALUENGA C, FRIAS J, et al.Changes in protein profile, bioactive potential and enzymatic activities of gluten-free flours obtained from hulled and dehulled oat varieties as affected by germination conditions [J].LWT, 2020, 134:109955.
[17] 徐建国. 燕麦发芽过程中主要营养、活性成分的动态变化及其特性研究[D].西安:陕西师范大学, 2011.
XU J G.Study on the dynamic changes and characteristics of main nutrients and active ingredients during oat germination process [D].Xian:Shaanxi Normal University, 2011.
[18] 邵玉芳, 苑学霞, 邵世勤.浸泡和发芽处理对全籽粒燕麦中蛋白质、氨基酸和矿物质特性的影响[J].粮食与油脂, 2017, 30(8):75-80.
SHAO Y F, YUAN X X, SHAO S Q.Effect of soaking and germination treatment on characteristics of protein, amino acid and minerals in whole-grain oats[J].Cereals &Oils, 2017, 30(8):75-80.
[19] NKHATA S G, AYUA E, KAMAU E H, et al.Fermentation and germination improve nutritional value of cereals and legumes through activation of endogenous enzymes[J].Food Science &Nutrition, 2018, 6(8):2446-2458.
[20] 贾青慧, 沈奇, 陈莉.紫苏籽蛋白质与氨基酸的含量测定及营养评价[J].食品研究与开发, 2016, 37(10):6-9.
JIA Q H, SHEN Q, CHEN L.The content determination and nutritional evaluation of perilla seed protein and amino acids[J].Food Research and Development, 2016, 37(10):6-9.
[21] FABIANO G A, SHINN L M, ANTUNES A E C.Relationship between oat consumption, gut microbiota modulation, and short-chain fatty acid synthesis:An integrative review[J].Nutrients, 2023, 15(16):3534.
[22] 张端莉, 桂余, 方国珊, 等.大麦在发芽过程中营养物质的变化及其营养评价[J].食品科学, 2014, 35(1):229-233.
ZHANG D L, GUI Y, FANG G S, et al.Nutrient change and nutritional evaluation of barley during germination[J].Food Science, 2014, 35 (1):229-233.
[23] 刘瑞, 于章龙, 柴永峰, 等.粮谷及其发芽物质变化研究进展[J].食品工业科技, 2019, 40(13):293-298.
LIU R, YU Z L, CHAI Y F, et al.Research advances of substances variation in grain and germinated grain[J].Science and Technology of Food Industry, 2019, 40(13):293-298.
[24] 崔江明, 周海龙, 马利华.发芽、发酵对燕麦营养性及抗氧化性的影响[J].食品科技, 2021, 46(2):130-134.
CUI J M, ZHOU H L, MA L H.Effects of germination and fermentation on nutritional and antioxidant properties of oat[J].Food Science and Technology, 2021, 46(2):130-134.
[25] GUNATHUNGA C, SENANAYAKE S, JAYASINGHE M A, et al.Germination effects on nutritional quality:A comprehensive review of selected cereals and pulses changes[J].Journal of Food Composition and Analysis, 2024, 128:106024.
[26] KRAPF J, KANDZIA F, BRÜHAN J, et al.Sprouting of oats:A new approach to quantify compositional changes[J].Cereal Chemistry, 2019, 96(6):994-1003.
[27] 郭芳. 富含γ-氨基丁酸燕麦发芽条件的优化[J].粮食与油脂, 2021, 34(7):35-38.
GUO F.Optimization of germination conditions of the oat rich in γ-aminobutyric acid[J].Cereals &Oils, 2021, 34(7):35-38.
[28] SAMTIYA M, ALUKO R E, DHEWA T.Plant food anti-nutritional factors and their reduction strategies:An overview[J].Food Production, Processing and Nutrition, 2020, 2(1):6.