硒是人体内多种活性酶的重要组成成分[1],参与机体正常的免疫功能,对防治疾病、增进健康和防止衰老具有重要意义,被誉为“生命的奇效元素”[2]。然而,硒在人体不能贮存,因此食物是人体补硒的重要来源。其中农作物喷洒无机硒和土壤施无机硒肥是富硒农产品生产最常见的方式。一般来说,作物籽粒吸收的硒80%以上转化为有机硒,其中有机硒又主要与蛋白结合[3]。大豆蛋白质含量高,约占种子干重的35%~40%,硒含量可达1.36~3.02 mg/kg[4]。并且,2018年国家卫生健康委员会批准富硒大豆的硒蛋白可作为食品营养强化剂使用,因此,富硒大豆是食品加工的优质原料,也是硒生物强化的理想载体。
植物蛋白在食品工业中的成功应用很大程度上取决于其功能特性的多样性,而提取方法是影响其功能特性多样性的重要因素。很多研究表明,采用不同提取方法获得的植物蛋白具有不同的结构、理化和功能特性。相较于传统碱提法(traditional alkali extraction,AE),超声辅助提取(ultrasonic-assisted extraction,UAE)和脉冲电场辅助提取(pulsed electric field assisted extraction,PEF)作为快速、经济、方便的提取技术,在食品和天然产物工业中得到了广泛的应用。在UAE中,超声波产生高剪切力和机械力引起细胞膜破裂[5];PEF可以使细胞产生不可逆电穿孔,从而增强细胞膜通透性[6],2种方法都促进了蛋白从细胞向提取溶剂的扩散,提高了提取效率,且均可通过低温传质获得蛋白,对蛋白硒含量和有机硒的结构具有保护作用。为了解AE、UAE和PEF 3种方法提取过程的本质和实用性,通过Fick定律的传质动力学模型来建立碱提过程蛋白提取率和时间的函数关系,阐述不同提取条件对蛋白碱提过程的影响。事实上,传质动力学对于理解影响提取的复杂扩散和传质参数具有重要意义[7],不仅可以简化过程设计来获得优化条件,而且还可以节省实践所需的时间和精力。目前,对于不同提取方法对富硒大豆蛋白的相关研究和对蛋白提取的传质机理影响研究较少。
因此,本研究以富硒大豆为原料,利用不同提取方法(AE、UAE和PEF)制备大豆蛋白,并从动力学角度出发,对大豆蛋白传质规律进行探讨。并对比3种不同提取方法得到的普通大豆蛋白(ordinary soybean protein,OSP)和富硒大豆蛋白(selenium-enriched soybean protein,SSP)结构及其理化性质,为SSP在后续食品工业生产中的应用提供数据支撑,实现富硒大豆的高值化利用。
1 材料与方法
1.1 材料与试剂
东升19富硒/普通大豆,黑龙江新三农大豆种植合作社;石油醚、氢氧化钠、盐酸、硝酸、五水合硫酸铜、硫酸钾、硫酸、硼酸、亚甲基红、溴甲酚绿、β-巯基乙醇、溴化钾、磷酸二氢钾、ANS荧光染料、硼氢化钾、牛血清蛋白,均为分析纯,国药集团化学试剂有限公司;硒标品,国家有色金属及电子材料分析测试。
1.2 仪器与设备
KQ3200DE超声波清洗器,昆山市超声仪器有限公司;高压脉冲电场发生仪,自制;K9840自动凯氏定氮仪,海能仪器有限公司;A580 AOELAB紫外分光光度计,翱艺仪器上海有限公司;NEXUS670傅里叶变换红外光谱,美国尼高力仪器公司;Multiwave PRO微波消解仪,奥地利安东帕(中国)有限公司;AFS-8530原子荧光光谱仪,北京海光仪器有限公司;EClassical3200液相色谱,大连依利特分析仪器有限公司。
1.3 实验方法
1.3.1 原料预处理
选取颗粒饱满的富硒大豆磨粉过80目筛,向富硒大豆粉末加入石油醚[料液比(g∶mL)1∶5]搅拌4 h,重复3次,静置分层后,将沉淀置于通风橱中风干,即得到脱脂富硒大豆粉,保存在4 ℃冰箱中备用。
1.3.2 普通/富硒大豆蛋白的制备
参照高思薇等[8]的方法并稍作修改,取一定量的普通/富硒大豆粉与去离子水以1∶20的料液比(g∶mL)混合,用0.05 mol/L NaOH调节溶液pH至8.0。后续步骤:a)直接热水搅拌浸提;b)超声预处理(超声过程中利用搅拌装置使溶液充分混合)后,继续热水搅拌浸提;c)脉冲电场预处理后,继续热水搅拌浸提;此过程称为碱提。浸提液冷却至室温后在8 000 r/min离心20 min,弃去沉淀,用0.05 mol/L HCl将上清液pH调至4.5,4 ℃静置1 h,8 000 r/min离心20 min,弃去上清液,将沉淀用去离子水洗涤3次并复溶,调pH至7.0,冷冻干燥72 h,冻干样品于4 ℃ 密封保存。传统碱提法得到的普通大豆蛋白记为AE-OSP,富硒大豆蛋白记为AE-SSP;超声预处理分别记为UAE-OSP和UAE-SSP;脉冲电场预处理分别记为PEF-OSP和PEF-SSP。
1.3.3 单因素试验设计
根据预实验结果,设计富硒大豆蛋白碱提过程的单因素试验参数,即将提取液进行超声/脉冲电场预处理后继续进行恒温水浴搅拌提取,分别于5、15、25、35、60、90、120、180 min取样,采用Bradford法测定提取液中富硒大豆蛋白的浓度。其中传统碱提法参数为:温度30、40、50 ℃;超声预处理参数为:超声功率150、200、250 W,超声频率25、33、40 kHz,温度30、40、50 ℃,超声水浴温度30 ℃,超声时间25 min;脉冲电场预处理参数为:电场强度2.67、3.33、4.00 kV/cm,温度30、40、50 ℃,循环4次(对应的时间为30 min)。
1.3.4 富硒大豆蛋白的提取率
用GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法测定冻干样品的蛋白含量。Bradford法参考雷海容等[9]的方法测定液体的蛋白浓度。即取500 μL样品溶液,在4 ℃下4 500 r/min离心5 min,测定上清液中富硒大豆蛋白的浓度。蛋白质提取率的计算如公式(1)所示:
提取率![]()
(1)
式中:V,富硒大豆提取液体积,mL;C,上清液蛋白质量浓度,mg/mL;M,富硒大豆样品质量,mg。
1.3.5 传质提取动力学模型
富硒大豆被粉碎后部分细胞发生变化,细胞以部分破裂细胞和完整细胞2种形态存在。破裂细胞蛋白扩散速度较快,传质阻力较小;完整细胞蛋白扩散速度较慢。假设富硒大豆蛋白的碱提分为3个过程,第1个过程指提取液到达富硒大豆颗粒表面后,一部分残留在颗粒表面的蛋白瞬间进入提取液的过程,即洗涤过程;第2个过程与第3个过程分别为快速提取过程和慢速提取过程[10]。并根据Fick第二定律推导出一级三项动力学模型,如公式(2)所示[11]:
Ct/%=C0[1-exp(-K0t)]+C1[1-exp(-K1t)]+C2[1-exp(-K2t)]
(2)
与K1和K2相比,洗涤过程提取速率常数K0可认为无穷大,即洗涤过程在富硒大豆蛋白碱提过程初始时刻瞬间完成,一级三项动力学可化简,如公式(3)所示:
Ct/%=C0+C1[1-exp(-K1t)]+C2[1-exp(-K2t)]
(3)
式中:Ct,t时刻提取液中富硒大豆蛋白的提取量,%;C0,洗涤阶段所得的富硒大豆蛋白提取量,%;C1,快速提取阶段所得的富硒大豆蛋白提取量,%;C2,慢速提取阶段所得的富硒大豆蛋白提取量,%;K1,快速提取阶段提取速率常数,min-1;K2,慢速提取阶段提取速率常数,min-1;t,提取时间,min。
1.3.6 硒含量的测定
用GB 5009.93—2017《食品安全国家标准 食品中硒的测定》氢化物原子荧光光谱法测定硒含量。
1.3.7 普通/富硒大豆蛋白结构表征
1.3.7.1 内源荧光测定
采用荧光分光光度计测定蛋白样品的内源荧光发射光谱。将样品分散在磷酸盐缓冲溶液(10 mmol/L,pH 7.0)中,配制成1 mg/mL的蛋白分散液。离心去除不溶物,然后将上清液在295 nm激发波长(狭缝宽度5 nm)和300~400 nm发射波长(狭缝宽度=5 nm),10 nm/s的扫描速度下测定,每次扫描进行5次。
1.3.7.2 表面疏水性
采用ANS荧光探针法测定蛋白质的表面疏水性[12]。用荧光分光光度计测定其荧光强度,设定激发波长390 nm,发射波长470 nm。
1.3.7.3 游离巯基和总巯基的测定
参考EZE等[13]的方法测定游离巯基和总巯基的含量。游离巯基和总巯基的计算如公式(4)所示:
游离巯基或总巯基含量![]()
(4)
式中:A412,412 nm处的吸光度;D,稀释倍数;C,蛋白质量浓度,mg/mL。
1.3.7.4 傅里叶变换红外(Fourier transform infrared spectroscopy,FT-IR)光谱分析
红外光谱分析采用FT-IR光谱仪,根据WANG等[14]的方法分析了样品蛋白的二级结构。
1.3.7.5 氨基酸组成的测定
参考Elite-AKK氨基酸试剂盒的方法进行测定并稍加改动。称取25 mg样品于安瓿瓶中,加入3 mL 6 mol/L HCl溶液。高温封口后于105 ℃高温水解33 h,然后敞口放于100 ℃烘箱中直至烘干。用衍生缓冲溶液多次洗涤并定容至25 mL容量瓶中。取已定容的样品液2 mL至10 mL棕色容量瓶中,加入衍生试剂1 mL,混匀。60 ℃水浴避光反应60 min。冷却至室温后用平衡缓冲溶液定容,用0.45 μm滤膜过滤,取50 μL进样。
1.4 数据处理
所有实验均重复3次,数据表示为“平均值±标准差”的形式。使用DPS数据处理系统对数据进行方差分析,P<0.05为显著性差异。图表使用Origin 2021及Excel 2010进行绘制。
2 结果与分析
2.1 富硒大豆蛋白碱提过程动力学研究
由图1和表1可知,不同提取温度的拟合度R2均大于0.99,说明富硒大豆蛋白碱提过程符合一级三项动力学模型,即碱提阶段包括洗涤、快速提取和慢速提取3个过程。如表1所示,其中快速提取过程的蛋白提取率大于慢速提取过程,说明快速提取过程占据富硒大豆蛋白碱提过程的主要地位。由图1可知,在相同的提取时间下,蛋白提取率随温度的升高而增加。在碱提过程中,当提取温度由30 ℃升高至50 ℃时,碱提液中蛋白提取率由(29.27±0.58)%上升至(32.39±0.63)%。原因可能是水的表面张力、内聚能密度及介电常数通常随温度的升高而下降,即水的黏度下降、扩散系数上升,蛋白更易溶解,这使得固液内部传质增强[15],加速了蛋白溶出。因此,根据一级三项动力学模型初步得到传统碱提法提取富硒大豆分离蛋白的最优条件:恒温水浴温度50 ℃,时间120 min。
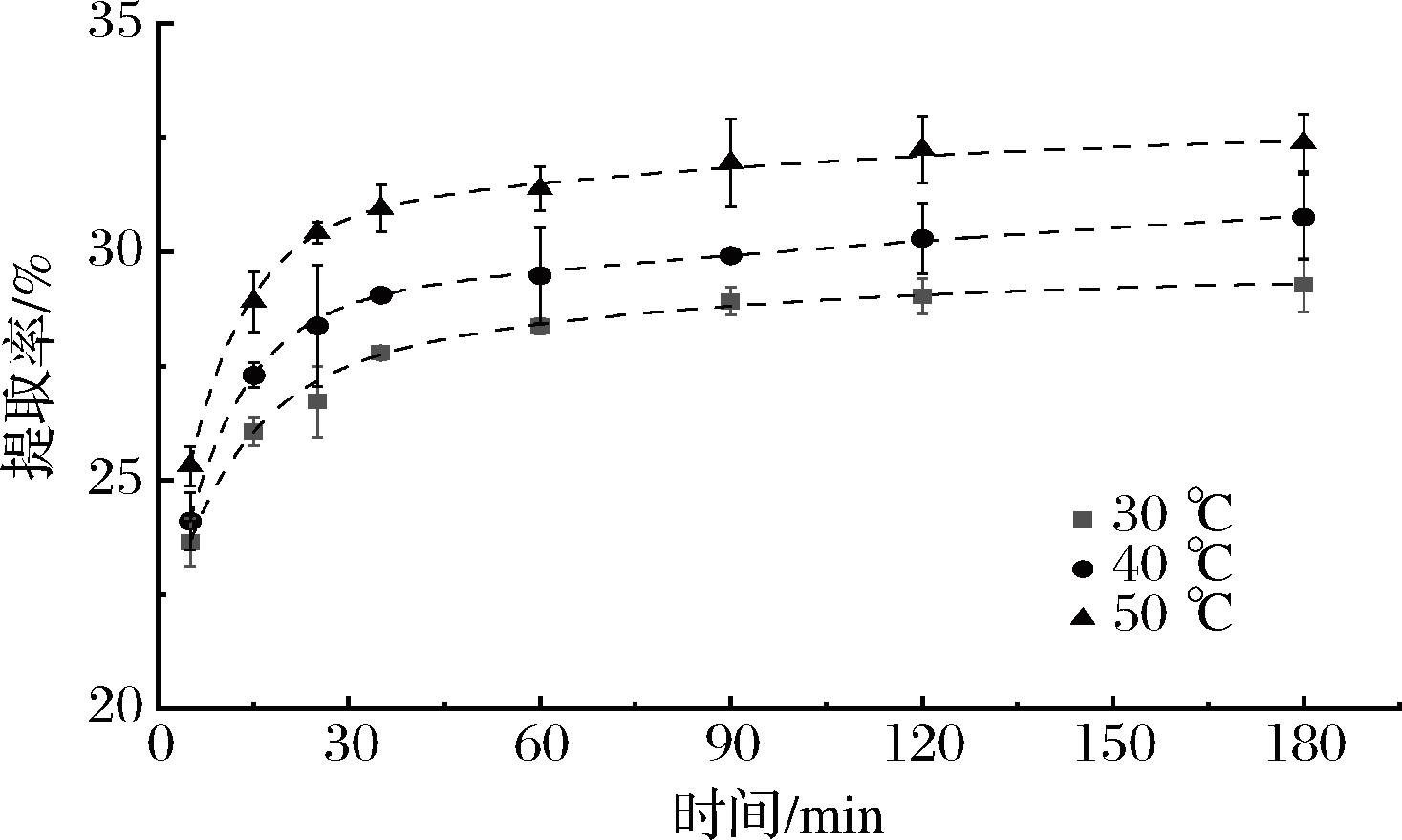
图1 不同温度下富硒大豆蛋白碱提过程的一级三项动力学模型拟合分析
Fig.1 Kinetic analysis of selenium-enriched soybean protein alkali extraction process at various temperatures by the three-site kinetic model
表1 不同温度下富硒大豆蛋白碱提过程的一级三项动力学模型拟合结果
Table 1 Kinetic results of selenium-enriched soybean protein alkali extraction process at various temperatures by the three-site kinetic model
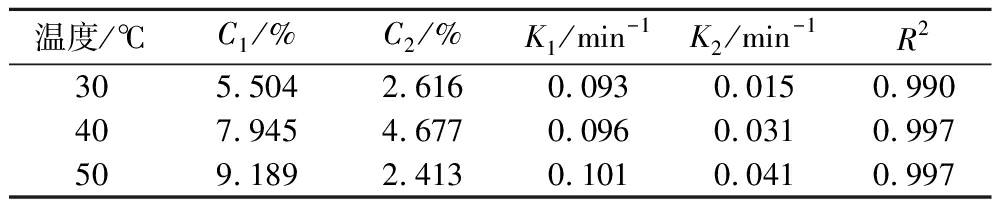
温度/℃C1/%C2/%K1/min-1K2/min-1R2305.5042.6160.0930.0150.990407.9454.6770.0960.0310.997509.1892.4130.1010.0410.997
2.2 富硒大豆蛋白超声辅助提取过程动力学研究
2.2.1 超声频率对富硒大豆蛋白提取过程的影响
表2显示了不同超声频率下富硒大豆蛋白提取过程的一级三项动力学模型拟合结果。如图2所示,超声频率为40 kHz时蛋白提取率最高,可达43.94%。超声频率25 kHz的蛋白提取率最低。该结果主要归因于超声产生的空化气泡的共振机制。只有当超声频率等于空化泡的共振频率时,超声能量才会发生最大的耦合,有利于细胞的溶胀和细胞壁表面积的增大,提高传质速率,进而增加提取率[16]。最终选择超声频率为40 kHz。
表2 不同超声频率下富硒大豆蛋白提取过程的一级三项动力学模型拟合结果
Table 2 Kinetic results of selenium-enriched soybean protein extraction process at various ultrasonic frequencies by the three-site kinetic model
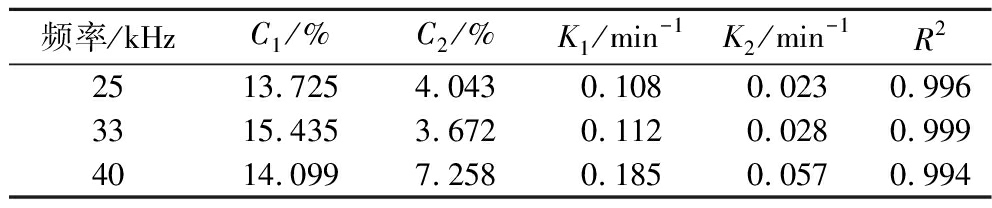
频率/kHzC1/%C2/%K1/min-1K2/min-1R22513.7254.0430.1080.0230.9963315.4353.6720.1120.0280.9994014.0997.2580.1850.0570.994
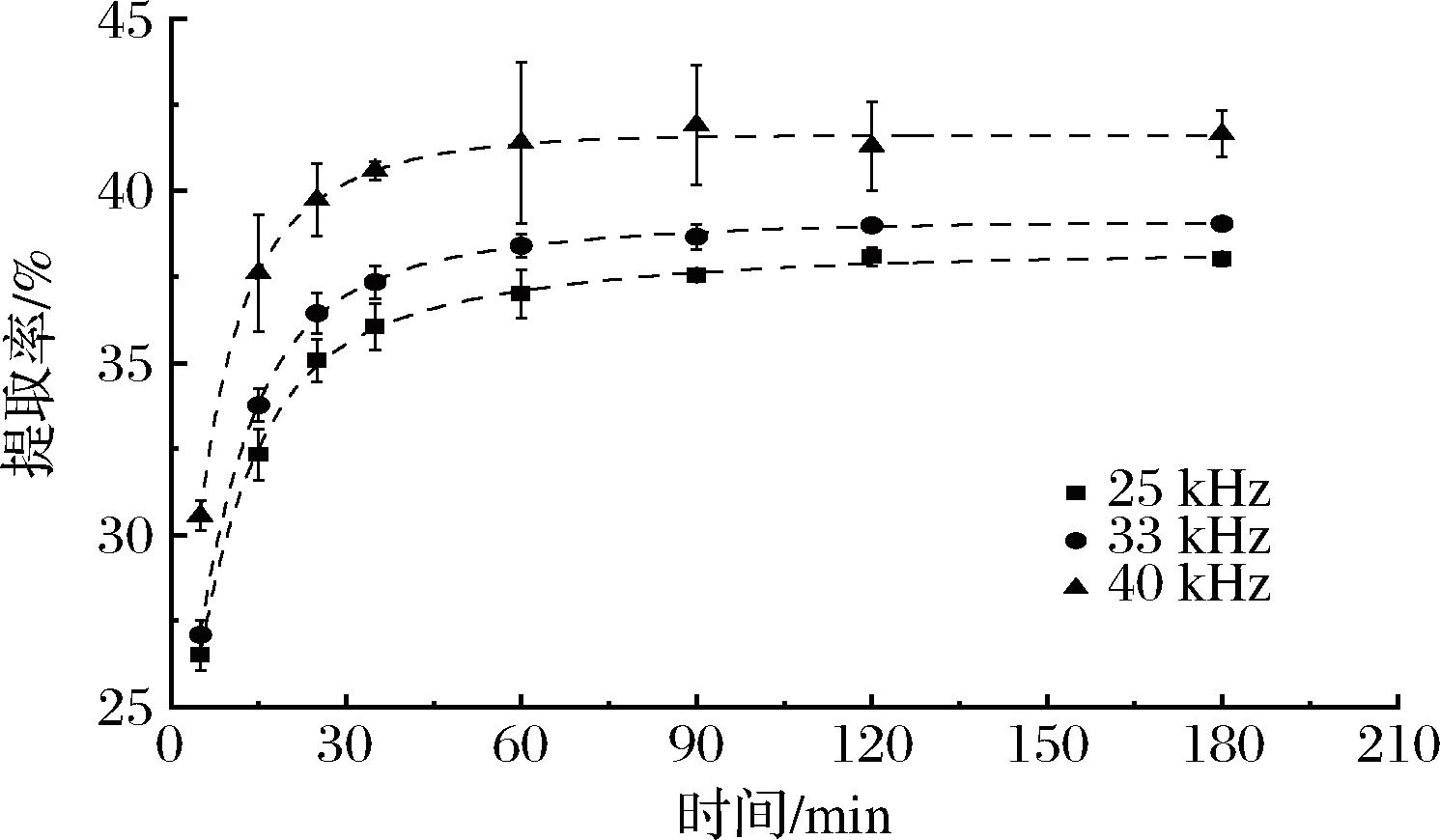
图2 不同超声频率下富硒大豆蛋白提取过程的一级三项动力学模型拟合分析
Fig.2 Kinetic analysis of selenium-enriched soybean protein extraction process at various ultrasonic frequencies by the three-site kinetic model
2.2.2 超声功率对富硒大豆蛋白提取过程的影响
由图3可看出,富硒大豆蛋白提取率随超声功率的增加而增加。由表3可知,K1值随超声功率的增大而增加,这是因为在一定条件下,更大的超声功率能产生更强的空化效应[17],更能促进植物细胞破碎,提高固液间的传质系数K1。所以选择超声功率为250 W。
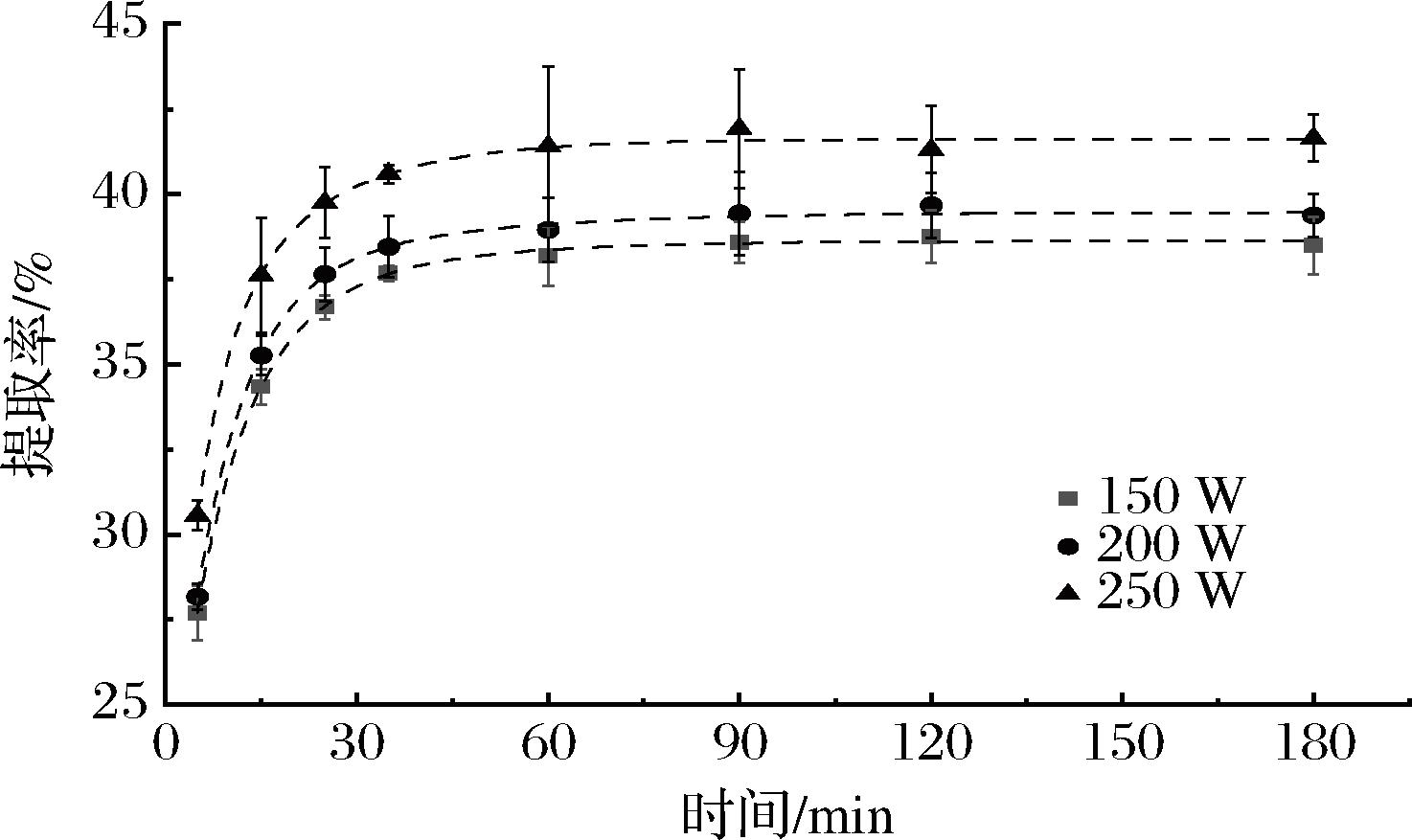
图3 不同超声功率下富硒大豆蛋白提取过程的一级三项动力学模型拟合分析
Fig.3 Kinetic analysis of selenium-enriched soybean protein extraction process at various ultrasonic powers by the three-site kinetic model
表3 不同超声功率下富硒大豆蛋白提取过程的一级三项动力学模型拟合结果
Table 3 Kinetic results of selenium-enriched soybean protein extraction process at various ultrasonic powers by the three-site kinetic model
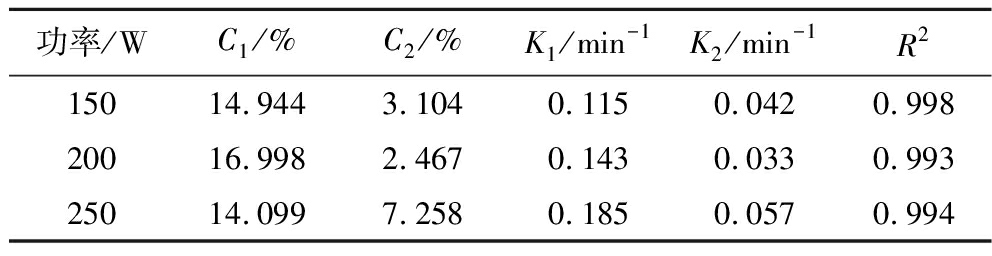
功率/WC1/%C2/%K1/min-1K2/min-1R215014.9443.1040.1150.0420.99820016.9982.4670.1430.0330.99325014.0997.2580.1850.0570.994
2.2.3 不同温度对超声预处理富硒大豆蛋白提取过程的影响
由表4可知,在50 ℃时,超声预处理组K1值达到0.185,相比之下,对照组K1值仅为0.101;且对照组富硒大豆蛋白提取率为32.39%,超声条件优化后的提取率可达到43.94%,比对照样品提高了35.66%,体现了超声辅助蛋白提取技术的优越性。因此,根据一级三项动力学模型得到超声辅助提取富硒大豆分离蛋白的最优条件(图4):超声频率40 kHz,超声功率250 W,恒温水浴温度50 ℃,时间60 min。
表4 不同温度下富硒大豆蛋白提取过程的一级三项动力学模型拟合结果
Table 4 Kinetic results of selenium-enriched soybean protein extraction process at various temperatures by thethree-site kinetic model
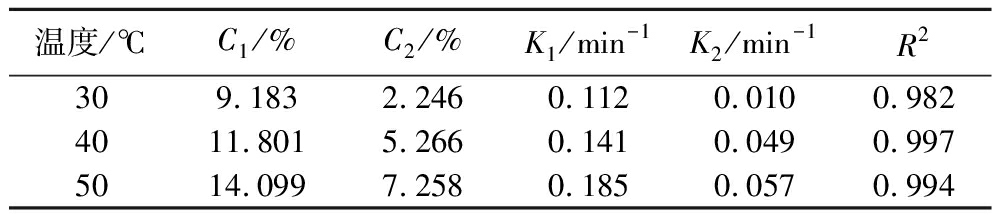
温度/℃C1/%C2/%K1/min-1K2/min-1R2309.1832.2460.1120.0100.9824011.8015.2660.1410.0490.9975014.0997.2580.1850.0570.994
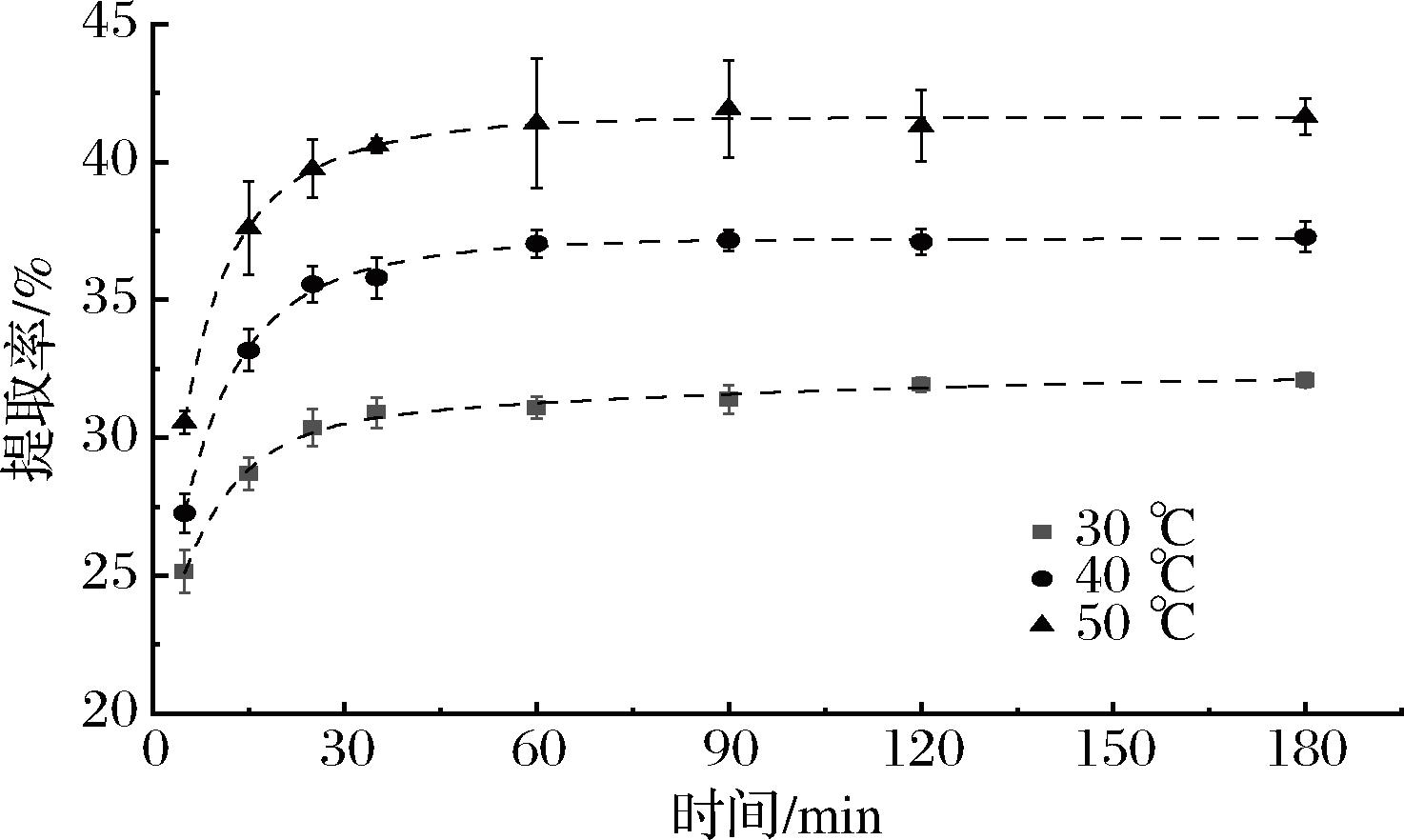
图4 不同温度下富硒大豆蛋白提取过程的一级三项动力学模型拟合分析
Fig.4 Kinetic analysis of selenium-enriched soybean protein extraction process at various temperatures by the three-site kinetic model
2.3 富硒大豆蛋白脉冲电场辅助提取过程动力学研究
2.3.1 不同电场强度对富硒大豆蛋白提取过程的影响
提取速率常数K1随电场强度的增加而增大。如表5所示,当电场强度为4.00 kV/cm时,提取量C1达到13.53%,提取速率常数K1达到0.138,与传统碱提法相比,C1和K1均有一定的增加,说明脉冲电场对富硒大豆蛋白提取有促进作用。是因为脉冲电场可使细胞膜的两侧产生相反极性的电荷,跨膜电位增加,引起细胞膜变薄,增加了细胞膜的通透性,此时细胞膜上将形成许多微孔,进而促进蛋白的流出[18]。如图5所示,进行了不同脉冲电场强度下富硒大豆蛋白提取过程的一级三项动力学模型拟合分析。
表5 不同脉冲电场强度下富硒大豆蛋白提取过程的一级三项动力学模型拟合结果
Table 5 Kinetic results of selenium-enriched soybean protein extraction process at various pulse electric field intensities by the three-site kinetic model
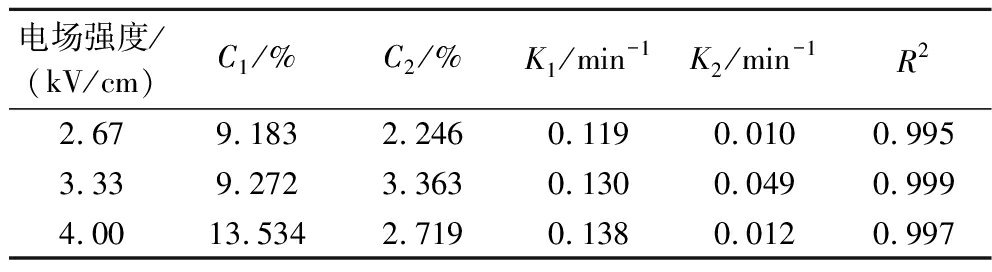
电场强度/(kV/cm)C1/%C2/%K1/min-1K2/min-1R22.679.1832.2460.1190.0100.9953.339.2723.3630.1300.0490.9994.0013.5342.7190.1380.0120.997
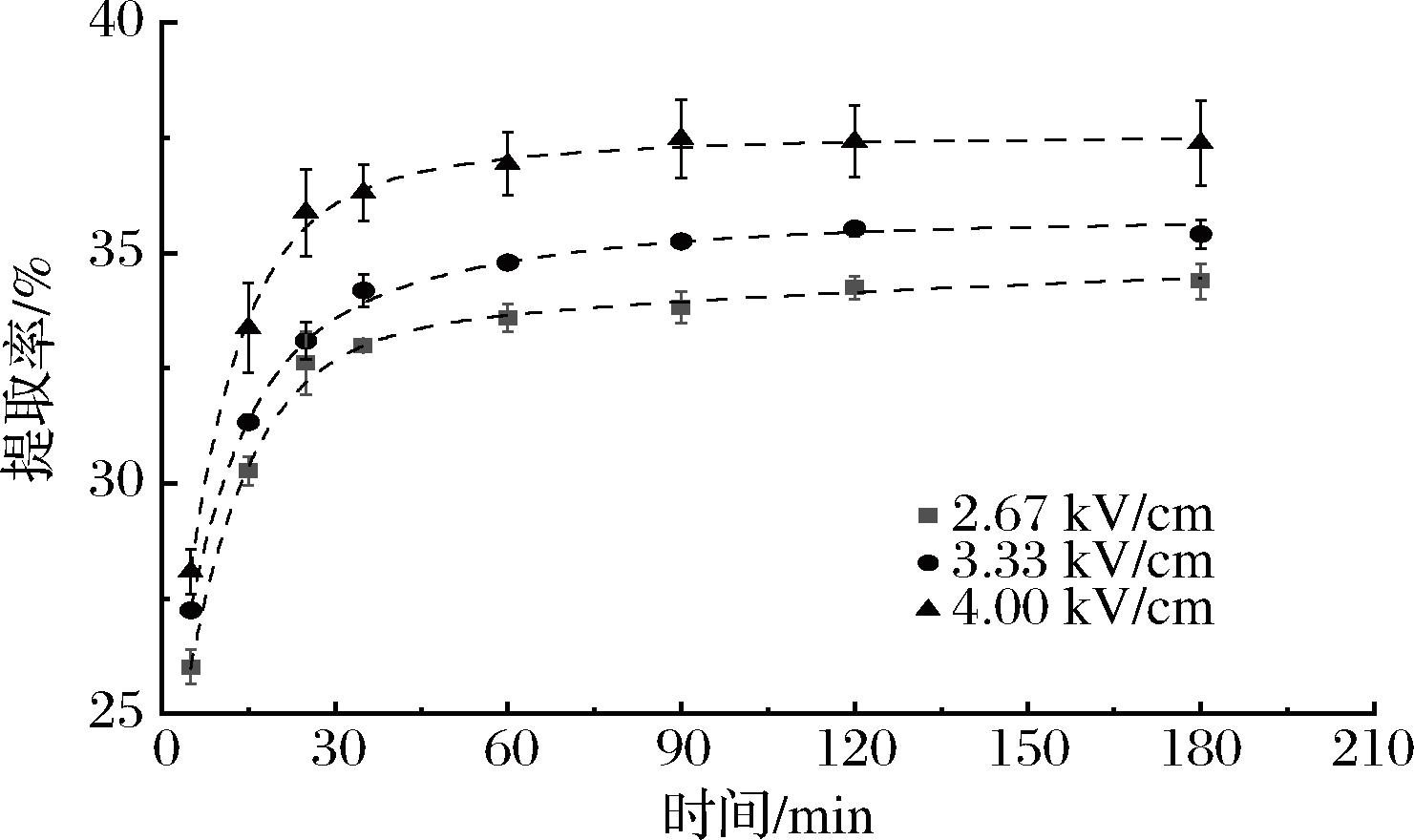
图5 不同脉冲电场强度下富硒大豆蛋白提取过程的一级三项动力学模型拟合分析
Fig.5 Kinetic analysis of selenium-enriched soybean protein extraction process at various pulse electric field intensities by the three-site kinetic model
2.3.2 不同温度对脉冲电场辅助提取富硒大豆蛋白提取过程的影响
随着温度的增加,提取速率常数K1增大(表6)。因此,根据一级三项动力学模型初步得到脉冲电场辅助提取富硒大豆分离蛋白的最优条件(图6):脉冲电场强度4.00 kV/cm,恒温水浴温度50 ℃,时间90 min。
2.4 提取物中蛋白和硒含量
不同大豆及不同方法下制备的蛋白样品其蛋白和硒含量如表7所示,UAE和PEF预处理显著提高了蛋白含量,硒对蛋白含量无显著影响。在富硒大豆中,UAE-SP的硒含量显著高于AE-SP和PEF-SP,提高了10.3%~17.9%。
表6 不同温度下富硒大豆蛋白提取过程的一级三项动力学模型拟合结果
Table 6 Kinetic results of selenium-enriched soybean protein extraction process at various temperatures by the three-site kinetic model
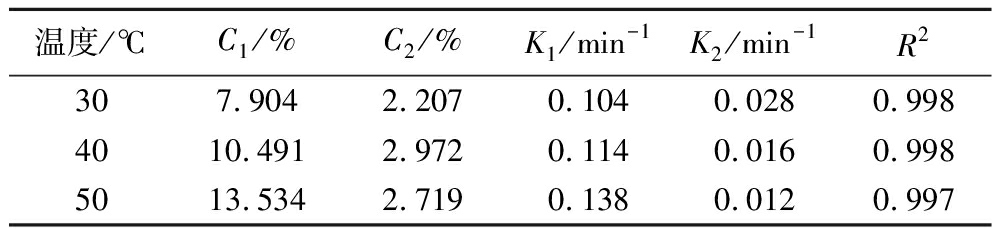
温度/℃C1/%C2/%K1/min-1K2/min-1R2307.9042.2070.1040.0280.9984010.4912.9720.1140.0160.9985013.5342.7190.1380.0120.997
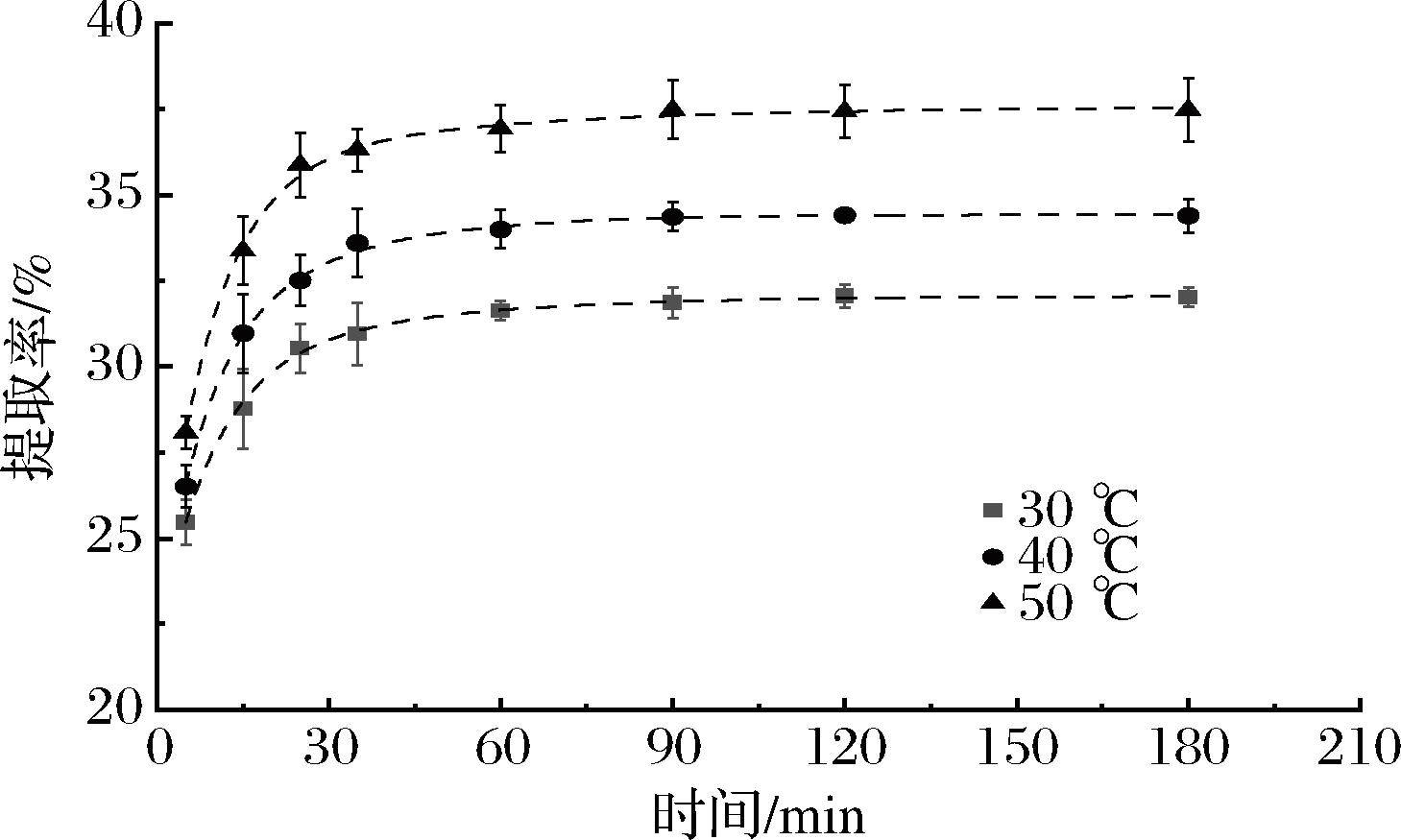
图6 不同温度下富硒大豆蛋白提取过程的一级三项动力学模型拟合分析
Fig.6 Kinetic analysis of selenium-enriched soybean protein extraction process at various temperatures by the three-site kinetic model
表7 不同大豆蛋白提取物的蛋白和硒含量
Table 7 Protein and Se content of different soybean proteins extracts
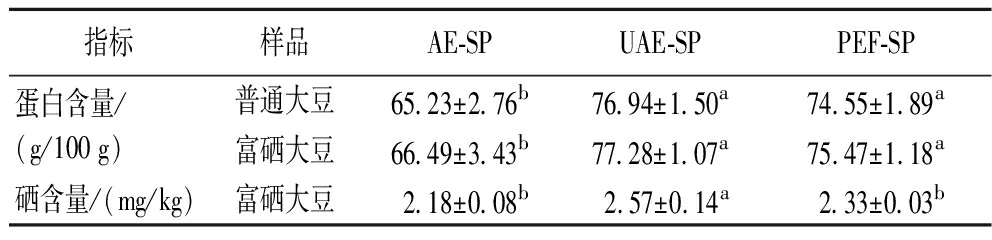
指标样品AE-SPUAE-SPPEF-SP蛋白含量/(g/100 g)普通大豆65.23±2.76b76.94±1.50a74.55±1.89a富硒大豆66.49±3.43b77.28±1.07a75.47±1.18a硒含量/(mg/kg)富硒大豆 2.18±0.08b 2.57±0.14a 2.33±0.03b
注:不同字母表示同个指标之间的差异显著(P<0.05)(下同)。
2.5 普通/富硒大豆蛋白结构表征
2.5.1 内源荧光光谱
通常,如果λmax>330 nm,则色氨酸(Trp)被指定为极性环境;如果λmax<330 nm,则Trp被指定为非极性环境[19]。由图7可知,所有样品的Trp被确定存在于极性环境中。UAE和PEF的预处理均未改变OSP和SSP的λmax。由图7可看出,UAE-OSP的荧光强度最大,PEF-OSP次之,AE-OSP最小。说明UAE和PEF处理破坏蛋白质分子的疏水相互作用诱导蛋白质分子展开,诱导蛋白质分子的部分去折叠[20],导致暴露更多的疏水基团使得荧光强度增加。SSP的荧光强度比OSP的低,推测可能是硒的原子大小和离子化条件会改变蛋白的三级结构[21],导致荧光强度减小。
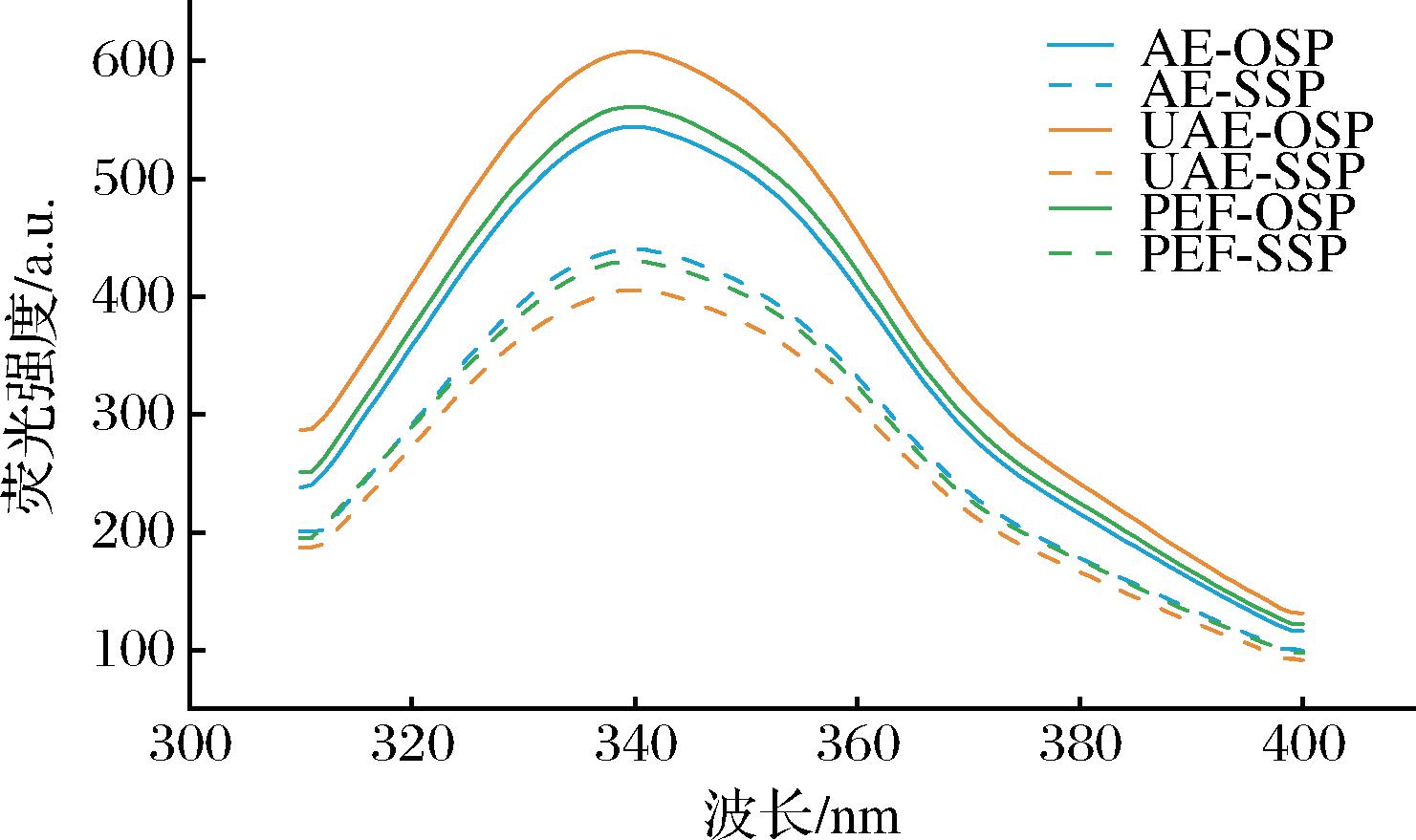
图7 六种蛋白的内源荧光光谱图
Fig.7 Intrinsic fluorescence spectra of six proteins
2.5.2 表面疏水性
蛋白质表面疏水性(H0)是指存在于蛋白质分子表面的疏水基团的数量[22]。从图8可以看出,与对照组的OSP样品相比,UAE和PEF预处理的OSI样品的H0更高。这表明UAE和PEF诱导了蛋白质一定程度的分子去折叠,从而导致原本处于分子内部的疏水基团的数量增加,暴露在极性周围环境中。SSP的H0比OSP的低,这与内源荧光的结果一致。
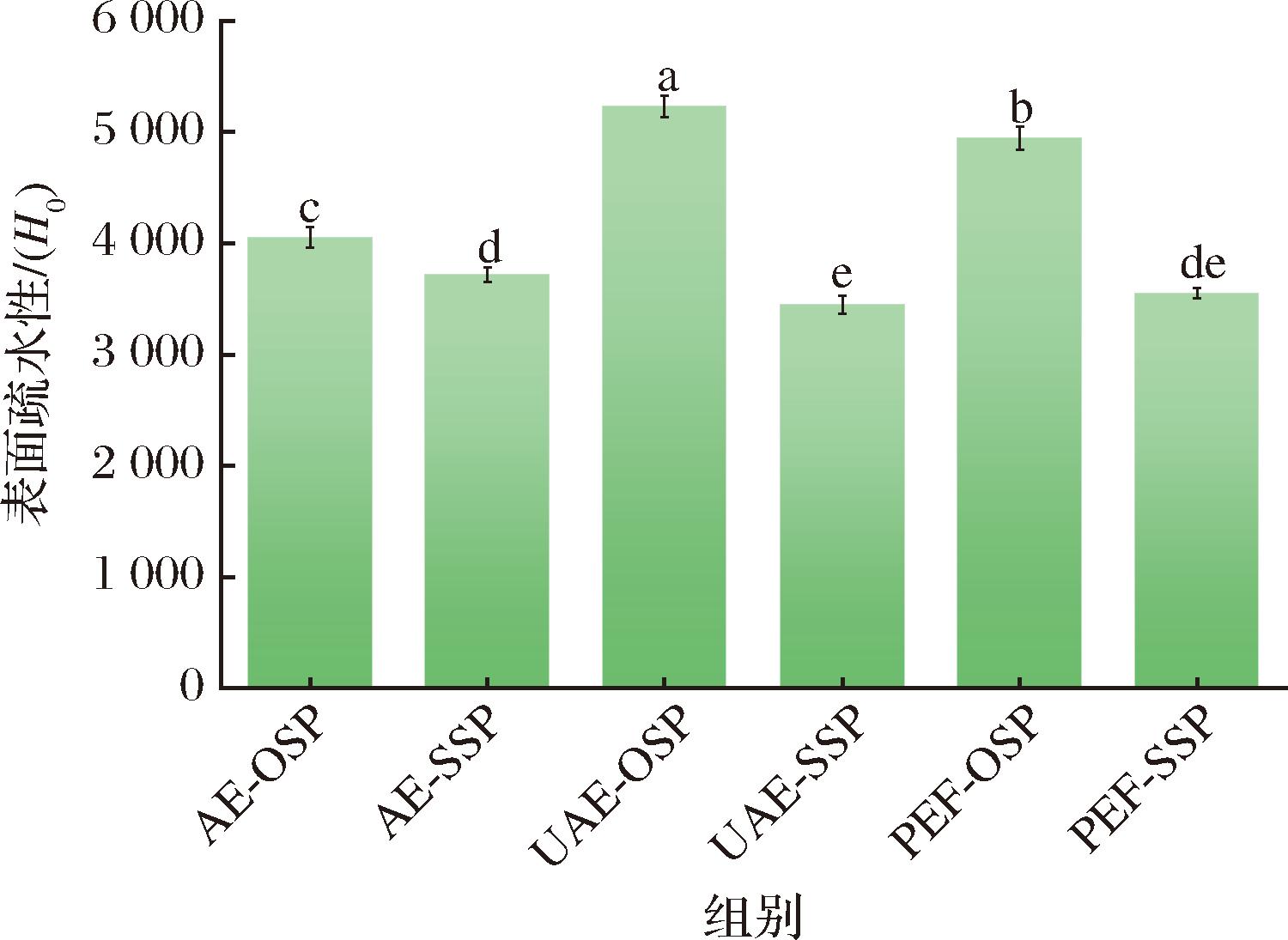
图8 六种蛋白质的表面疏水性
Fig.8 The surface hydrophobicity of six proteins
2.5.3 游离巯基和总巯基
与AE-OSP[(0.70±0.15) μmol/g]相比,UAE-OSP[(1.06±0.05) μmol/g]和PEF-OSP[(1.07±0.15) μmol/g]的游离巯基含量增加,总巯基含量减少(图9)。说明超声产生的机械、空化作用促进蛋白质展开导致内部巯基暴露[23]。脉冲电解过程中,水被氧化成H+,并与电子转化为吸附氢,诱导蛋白质中二硫键的还原而形成游离巯基[24]。其中部分暴露的游离巯基易被氧化成二硫键,导致总巯基含量有一定的减少。本文还探究了硒对巯基含量的影响,发现硒可以通过取代氨基酸中硫原子与巯基形成配位键结合到蛋白上,导致巯基的数量有一定的减少[25]。
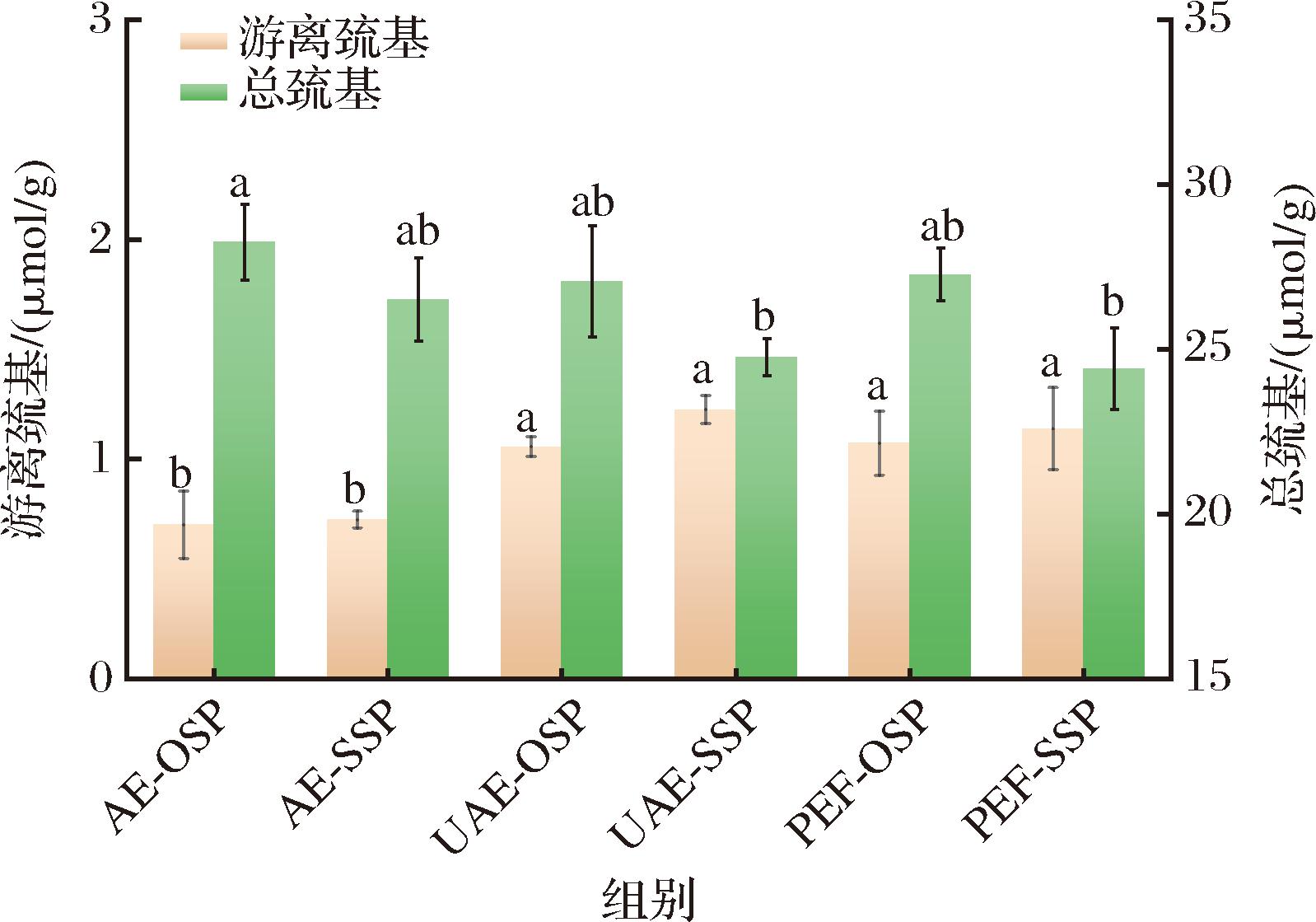
图9 六种蛋白质的游离巯基和总巯基含量
Fig.9 The free sulfhydryl and total sulfhydryl content of six proteins
2.5.4 氨基酸组成分析
3种提取方法得到的大豆蛋白氨基酸组成大体一致(表8),但与UAE-OSP相比,UAE-SSP的甲硫氨酸含量有一定的降低,DENG等[26]的研究也发现SSP的甲硫氨酸含量相比OSP显著降低。总氨基酸、必需氨基酸含量在超声和脉冲电场处理后均显著增加,表明物理场处理有利于蛋白质的分解和氨基酸的提取,同时,超声的机械力破坏蛋白质聚集体,增强溶解性,促进氨基酸释放[27]。物理场处理后带电荷氨基酸和疏水性氨基酸含量的增加也是导致总氨基酸、必需氨基酸含量增加的原因之一。脉冲电场通过释放瞬间高强电压诱导氨基酸极化,使带电氨基酸的含量增多[28];超声和脉冲电场处理使蛋白质的结构展开,暴露出更多的疏水性氨基酸侧链。图10反映了6种蛋白质的氨基酸种类分布情况。
表8 六种大豆蛋白的氨基酸组成 单位:g/100 g
Table 8 Amino acid composition of six soybean protein

氯基酸种类AE-OSPIAE-SSPIUAE-OSPIUAE-SSPIPEF-OSPIPEF-SSPI天门冬氨酸8.448.539.809.439.679.67谷氨酸13.7413.9015.8516.2015.4115.83丝氨酸3.583.644.143.963.563.58精氨酸4.534.585.094.985.075.11甘氨酸3.493.524.163.964.054.22苏氨酸2.762.803.213.033.052.76脯氨酸3.943.974.454.284.454.36丙氨酸2.932.963.393.243.333.35缬氨酸4.194.244.204.144.304.19甲硫氨酸0.130.130.170.140.120.13异亮氨酸0.490.500.640.540.510.49亮氨酸2.512.502.922.902.722.51苯丙氨酸5.185.306.637.336.345.14组氨酸1.871.891.901.871.901.87赖氨酸4.914.915.064.944.964.99酪氨酸0.230.240.290.250.420.43
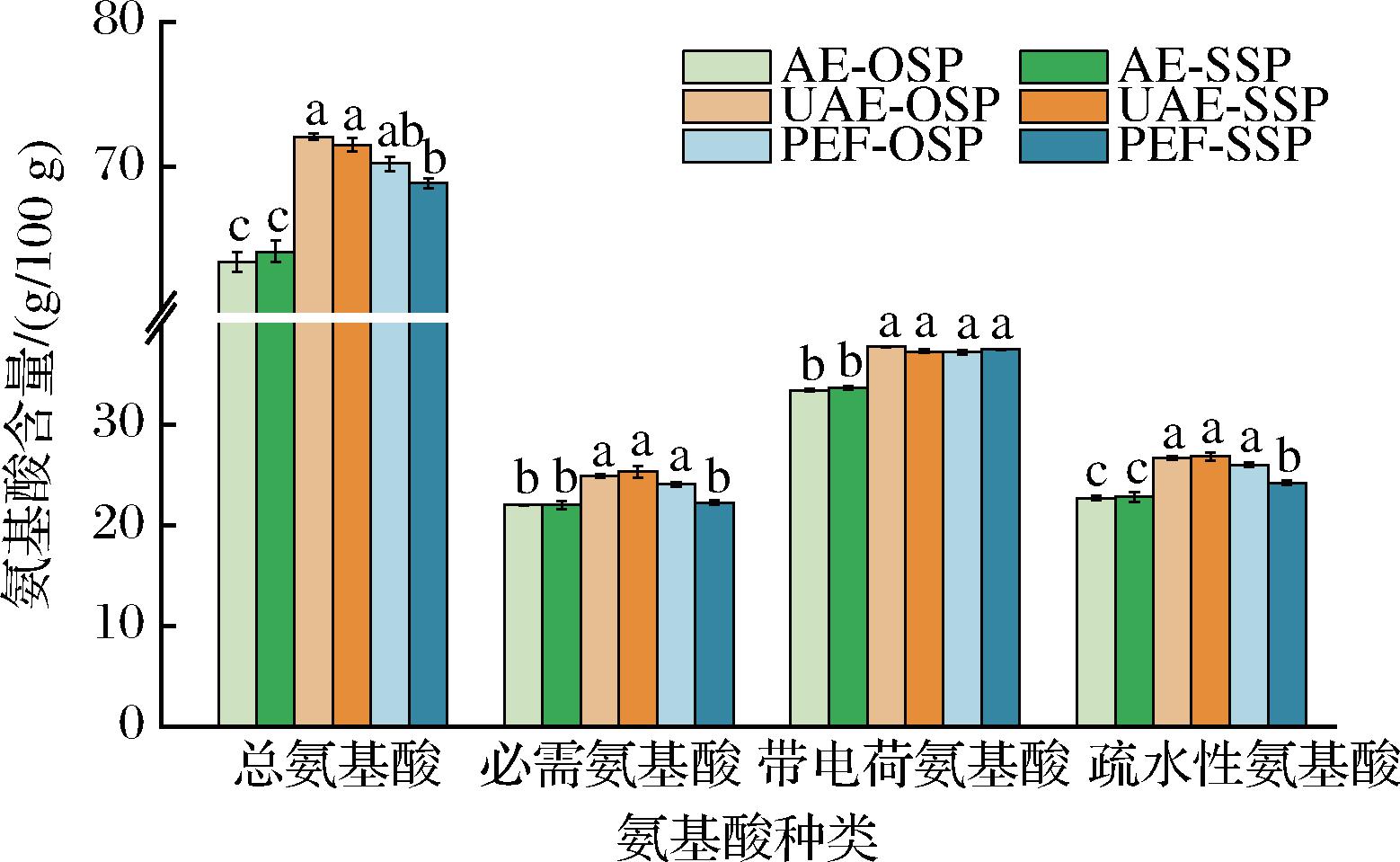
图10 六种蛋白质的氨基酸种类分布情况
Fig.10 The distribution of amino acid types of six proteins
2.5.5 傅里叶变换红外光谱
如图11-A所示,6种蛋白样品在4 000~400 cm-1之间没有产生新的特征吸收峰。FT-IR可用于表征蛋白质二级结构的变化,图11-B为6种蛋白样品的红外光谱(1 600~1 700 cm-1),并给出了AE-OSP的典型的去卷积谱和酰胺Ⅰ区的6个峰位,即1 618.2、1 631.6、1 645.3、1 659.0、1 672.3和1 686.1 cm-1,发现UAE-OSP、UAE-SSP、PEF-OSP、PEF-SSP的峰位发生蓝移,说明其二级结构的疏水性氨基酸比例增加[21]。
为了观察二级结构的详细变化,使用Peakfit软件处理并计算α-螺旋、β-折叠、β-转角和无规卷曲的百分比。6种蛋白的二级结构所占比例如图11-C所示。蛋白的二级结构组成依次为β-折叠>β-转角>无规则卷曲>α-螺旋。相较于传统碱提法,超声和脉冲预处理改变了蛋白的二级结构,显著增加了α-螺旋和β-转角组分,减少了β-折叠含量。β-折叠含量减少的原因可能是超声过程中产生的空化效应、机械效应等作用力使维持β-折叠的氢键断裂[23]。脉冲电场能使细胞膜穿孔、破裂,进而导致β-折叠结构丢失[29]。通过比较OSP和SSP的二级结构组成,发现硒对其没有显著影响。
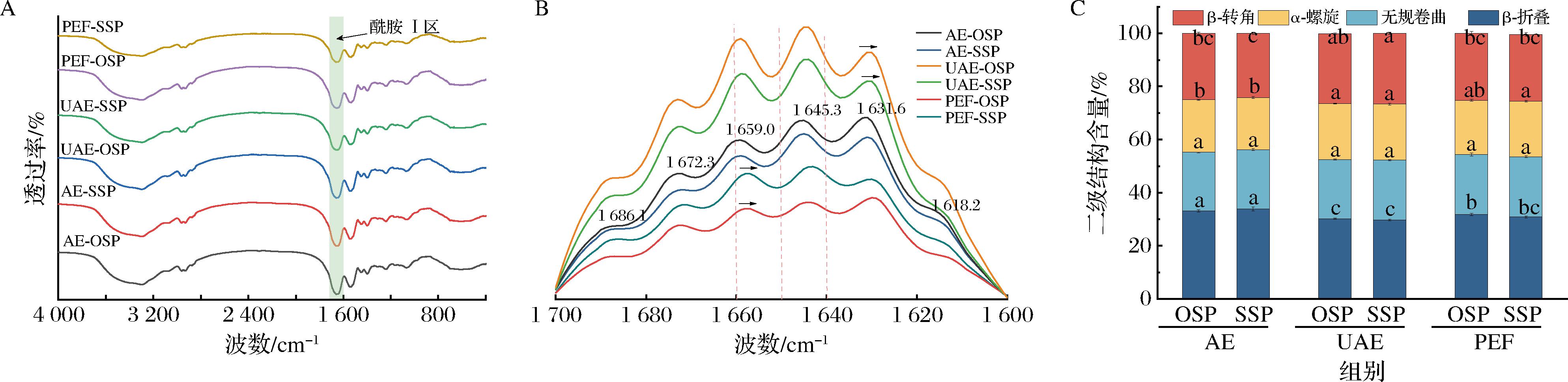
A-红外谱图(4 000~400 cm-1);B-红外谱图(1 600~1 700 cm-1);C-二级结构含量
图11 六种蛋白质的红外和二级结构图
Fig.11 FT-IR and secondary structure of six proteins
3 结论与讨论
本文采用传统碱提法、超声辅助法和脉冲电场辅助法3种不同方法进行富硒大豆蛋白的提取,利用传质动力学模型分析富硒大豆蛋白的碱提过程,发现碱提过程包含洗涤、快速提取、慢速提取3个过程,且快速提取占碱提过程的主导地位。在最优的提取条件下,UAE的快速提取速率常数K1值(0.185 min-1)和提取率(41.6%)最大且耗时最短(60 min),PEF提取次之(K1值为0.138 min-1,提取率为37.9%,耗时90 min),AE不仅耗时最长(120 min)而且K1值(0.101 min-1)和提取率(32.3%)最小。在此条件下,UAE-SSP的硒含量和蛋白含量显著高于AE-SSP和PEF-SSP。进一步对3种制备方法得到的OSP和SSP进行结构表征,发现UAE和PEF预处理使蛋白的内源荧光和表面疏水性增大;硒的影响则反之。UAE和PEF预处理改变了蛋白的游离巯基、总巯基含量,总氨基酸、必需氨基酸含量和二级结构,而硒对其没有显著影响。
[1] ZHANG X, JIA L, HE H, et al.Modulation of oxidative stress and gut microbiota by selenium-containing peptides from Cardamine enshiensis and structural-based characterization[J].Food Chemistry, 2022, 395:133547.
[2] BLAZINA T, SUN Y B, VOEGELIN A, et al.Terrestrial selenium distribution in China is potentially linked to monsoonal climate[J].Nature Communications, 2014, 5:4717.
[3] ZHANG X, HE H, HOU T.Molecular mechanisms of selenium-biofortified soybean protein and polyphenol conjugates in protecting mouse skin damaged by UV-B[J].Food &Function, 2020, 11(4):3563-3573.
[4] 魏龙, 郭楠楠, 段秋虹.大豆发芽富硒工艺条件研究[J].粮食与油脂, 2018, 31(10):21-23.
WEI L, GUO N N, DUAN Q H.Study on the technological conditions of soybean germination and selenium enrichment[J].Cereals &Oils, 2018, 31(10):21-23.
[5] SHA L, XIONG Y L.Comparative structural and emulsifying properties of ultrasound-treated pea (Pisum sativum L.) protein isolate and the legumin and vicilin fractions[J].Food Research International, 2022, 156:111179.
[6] XUE D N, FARID M M.Pulsed electric field extraction of valuable compounds from white button mushroom (Agaricus bisporus)[J].Innovative Food Science &Emerging Technologies, 2015, 29:178-186.
[7] WANG Y G, WANG C L, XUE H Y, et al.Comparative analysis of three kinds of extraction kinetic models of crude polysaccharides from Codonopsis pilosula and evaluate the characteristics of crude polysaccharides[J].Biomass Conversion and Biorefinery, 2023, 13(14):12917-12933.
[8] 高思薇, 张健, 张祺悦, 等.富硒大豆肽的制备及体内吸收性分析[J].食品科学, 2021, 42(3):165-172.
GAO S W, ZHANG J, ZHANG Q Y, et al.Preparation and in vivo absorption characteristics of selenium-enriched soybean peptides[J].Food Science, 2021, 42(3):165-172.
[9] 雷海容, 刘雷, 梁洪祥.超声辅助提取豆粕水溶性蛋白质工艺优化[J].粮食与油脂, 2023, 36(4):36-39.
LEI H R, LIU L, LIANG H X.Optimization of ultrasonic-assisted extraction of water-soluble protein from soybean meal[J].Cereals &Oils, 2023, 36(4):36-39.
[10] SO G C, MACDONALD D G.Kinetics of oil extraction from canola (rapeseed)[J].The Canadian Journal of Chemical Engineering, 1986, 64(1):80-86.
[11] 孙卓. 柠条蛋白水提动力学及蛋白粗提物成分分析[D].天津:天津科技大学, 2015.
SUN Z.The dynamics on water extraction process of proteins and component analysis of protein isolates from Caragana korshinskii Kom.[D].Tianjin:Tianjin University of Science and Technology, 2015.
[12] SUN P, ZHANG Q, ZHAO Y, et al.Improving gel properties of soy protein isolate through alkaline pH-shifting, mild heat treatment, and TGase cross-linking[J].Food Hydrocolloids, 2023, 144:108924.
[13] EZE O F, CHATZIFRAGKOU A, CHARALAMPOPOULOS D.Properties of protein isolates extracted by ultrasonication from soybean residue (okara)[J].Food Chemistry, 2022, 368:130837.
[14] WANG R X, LI Y Q, SUN G J, et al.The improvement and mechanism of gelation properties of mung bean protein treated by ultrasound[J].LWT, 2023, 182:114811.
[15] ISLAM M N, JO Y T, PARK J H.Remediation of soil contaminated with lubricating oil by extraction using subcritical water[J].Journal of Industrial and Engineering Chemistry, 2014, 20(4):1511-1516.
[16] LIAO J Q, QU B D, ZHENG N.Extraction of glycyrrhizic acid from Glycyrrhiza uralensis using ultrasound and its process extraction model[J].Applied Sciences, 2016, 6(11):319.
[17] WANG F, ZHANG Y Z, XU L, et al.An efficient ultrasound-assisted extraction method of pea protein and its effect on protein functional properties and biological activities[J].LWT, 2020, 127:109348.
[18] ZHANG C, LYU X M, ARSHAD R N, et al.Pulsed electric field as a promising technology for solid foods processing:A review[J].Food Chemistry, 2023, 403:134367.
[19] WANG Q, WANG Y, HUANG M G, et al.Ultrasound-assisted alkaline proteinase extraction enhances the yield of pecan protein and modifies its functional properties[J].Ultrasonics Sonochemistry, 2021, 80:105789.
[20] WANG R, ZENG M Q, WU Y W, et al.Enhanced encapsulation of lutein using soy protein isolate nanoparticles prepared by pulsed electric field and pH shifting treatment[J].Food Chemistry, 2023, 424:136386.
[21] LUO L P, ZHANG J P, ZHANG K Y, et al.Peanut selenium distribution, concentration, speciation, and effects on proteins after exogenous selenium biofortification[J].Food Chemistry, 2021, 354:129515.
[22] WANG W N, WANG X, ZHANG H R, et al.Effects of electric field intensity regulation on protein aggregation behaviour and foaming property of soybean 7S globulin[J].International Journal of Biological Macromolecules, 2023, 248:125784.
[23] CHEN Y X, SHENG L, GOUDA M, et al.Impact of ultrasound treatment on the foaming and physicochemical properties of egg white during cold storage[J].LWT, 2019, 113:108303.
[24] WANG R, WANG L H, WEN Q H, et al.Combination of pulsed electric field and pH shifting improves the solubility, emulsifying, foaming of commercial soy protein isolate[J].Food Hydrocolloids, 2023, 134:108049.
[25] 刘思杉, 冮洁, 朱淑珍, 等.富锌、富硒秀珍菇蛋白质结构特征及其功能特性[J].食品科学, 2021, 42(12):52-59.
LIU S S, GANG J, ZHU S Z, et al.Structural and functional characteristics of proteins extracted from zinc-enriched and selenium-enriched fruit bodies of Pleurotus geesteranus[J].Food Science, 2021, 42(12):52-59.
[26] DENG X F, LIAO J X, ZHAO Z Q, et al.Distribution and speciation of selenium in soybean proteins and its effect on protein structure and functionality[J].Food Chemistry, 2022, 370:130982.
[27] DNYANESHWAR PATIL N, BAINS A, KAUR S, et al.Influence of dual succinylation and ultrasonication modification on the amino acid content, structural and functional properties of Chickpea (Cicer arietinum L.) protein concentrate[J].Food Chemistry, 2024, 445:138671.
[28] 刘燕燕, 曾新安.脉冲电场对大豆分离蛋白溶解性及亚基的影响[J].食品工业科技, 2009,30(7):77-80.
LIU Y Y, ZENG X A.Effects of pulsed electric fields on solubility and subunits structure of soybean protein isolates[J].Science and Technology of Food Industry, 2009,30(7):77-80.
[29] HU X F, WANG H, HU Y M, et al.Insight into the effects of pulsed electric field on the structure, aggregation characteristics and functional properties of whey proteins[J].Food Hydrocolloids, 2024, 154:110111.