糖尿病(diabetes mellitus, DM)因其严重程度和高发病率引起全世界的广泛关注。餐后高血糖是糖尿病患者的主要症状。α-葡萄糖苷酶(α-glucosidase, AG)是位于小肠细胞中消化碳水化合物最后一步的关键葡萄糖苷水解酶,催化二糖和低聚糖转化为可吸收的单糖,从而引发后高血糖现象。AG抑制剂可通过竞争性抑制糖苷酶活力,延缓碳水化合物的消化和减少葡萄糖的吸收,可有效降低餐后高血糖,有助于治疗糖尿病及相关并发症[1-3]。目前,市场上常用的降糖药物是阿卡波糖[4]和伏格列波糖[5],均属于化学合成类药物,对人体有许多副作用,如胃肠功能障碍、腹胀和腹泻[6]。因此,开发具有高葡萄糖苷酶抑制活性和低毒性的新药具有重要意义。
药物开发工作的早期阶段主要集中在药物的识别及筛选。近年来,研究者从食品蛋白质水解物中提取多种生物活性肽[7-9],然而要从成分复杂的蛋白酶解液中分离出生物活性肽,需经过多步纯化,步骤繁琐,耗时长。固定化酶利用酶与抑制剂间的特异性相互作用,可实现复杂混合物中目标分子的快速筛选和富集[10-11]。已有课题组利用磁性介质固定化血管紧张素转换酶(angiotensin converting enzyme,ACE),用于分离和识别长蛇鲻鱼蛋白水解物中ACE抑制肽的分离[12];孙美玲[13]将ACE固定在介孔分子筛Zn-SBA-15上,用于ACE抑制肽的亲和分离,并结合反相高效液相色谱(reverse phase high performance liquid chromatography,RP-HPLC)对亲和分离组分进一步分离纯化,最终分离得到2个ACE抑制肽。可见,将固定化酶用于酶抑制剂的分离纯化是可行的[14-16],由于金属有机骨架(metal organic frameworks, MOFs)具有高比表面积、高孔隙率以及良好稳定性等特点,已成为一种很有前途的酶固定化载体。目前,利用MOFs固定化AG,并将其作为亲和分离介质,用于AG抑制剂的分离纯化鲜见文献报道。
本研究将AG原位封装在沸石咪唑酯骨架结构材料(zeolitic imidazolate framework,ZIF-7)中,然后利用多巴胺的自聚合反应[17],在其表面包裹一层聚多巴胺(polydopamine,PDA),制备得到一种新型的固定化酶3-MPBA/AG@aZIF-7/PDA。然后以2种不同类型的AG抑制剂:Ile-Tyr-Gly(ITG,非竞争型抑制剂)与Cys-Tyr-Gly(CTG,竞争型抑制剂)[18]作为抑制剂模型分子,考察了多肽浓度、吸附时间、pH和温度等因素对3-MPBA/AG@aZIF-7/PDA吸附能力的影响,并对其吸附机理进行探讨,为酶抑制剂的产业化制备提供参考。
1 材料与方法
1.1 材料与试剂
多肽ITG和CTG(98%),吉尔生化(上海)有限公司;HPLC级三氟乙酸(99.9%),上海阿拉丁生化技术有限公司;HPLC级甲醇、乙腈,上海麦克林生化科技有限公司;其余试剂均为国产分析纯;实验用水为娃哈哈纯净水。
1.2 仪器与设备
Agilent 1260型高效液相色谱仪,美国安捷伦公司;反相色谱柱(Zorbax SB-C18,4.6 mm×150 mm)、BCE224I-1CCN型分析天平,赛多利斯有限公司;DF-101S型集热式恒温磁力搅拌器,上海力辰邦西仪器科技有限公司;H1850R型低温高速离心机,湖南湘仪实验室仪器开发有限公司;FD-1A-50型冷冻干燥机,博医康(北京)仪器有限公司;PHS-3E型pH计,上海仪电科学仪器股份有限公司;SUPRA 55 Sapphire场发射电子显微镜(scanning electron microscopy,SEM);JSM-F200透射电子显微镜(transmission electron microscope,TEM),JEOL公司;MiniFlex600 X射线衍射(X-ray diffraction,XRD),Rigaku公司;Nicolet IS10傅里叶变换红外光谱仪(Fourier transform infrared spectrometry,FT-IR),Thermo公司。
1.3 实验方法
1.3.1 3-MPBA/AG@aZIF-7/PDA的制备
采用一步原位包埋法合成了3-MPBA/AG@aZIF-7。用磷酸盐缓冲溶液(pH=6.8, 50 mmol/L)配制AG溶液(8 mg/mL)。取1 mL酶溶液与5.2 mg 3-巯基苯硼酸(3-mercaptophenylboronic acid,3-MPBA,溶于20 μL 乙醇)混合,加入到25 mL楔形瓶中,然后加入0.5 mL六水合硝酸锌溶液(56 mmol/L)和5 mL苯并咪唑(50 mmol/L),在25 ℃下持续搅拌50 min。反应结束后,离心(10 000 r/min,10 min)收集沉淀,并用磷酸盐缓冲溶液反复清洗,得到3-MPBA/AG@aZIF-7。
用Tris-HCl(pH=8.5,50 mmol/L)缓冲液配制1 mg/mL多巴胺溶液。吸取10 mL上述溶液,然后加入3-MPBA/AG@aZIF-7(1 g)和48.13 mg过硫酸铵(ammonium persulfate,APS),混匀后,在25 ℃,150 r/min条件下,振荡2 h。反应结束后,离心(10 000 r/min,10 min)收集沉淀,并用去离子水反复洗涤3次,冷冻干燥24 h后,得到3-MPBA/AG@aZIF-7/PDA。
1.3.2 材料表征
使用场发射电子显微镜和TEM对材料表面形貌结构进行表征;采用XRD分析样品的晶体结构;利用FT-IR对材料的表面官能团进行分析。
1.3.3 多肽的测定方法
采用HPLC法测定多肽浓度,测定条件为:使用液相色谱柱Zorbax SB-C18(4.6 mm×150 mm,5 μm),柱温25 ℃,进样量20 μL,检测波长220 nm;检测ITG流动相:95%纯水[含有0.1%体积分数三氟乙酸(trifluoroacetic acid,TFA)]:5%纯乙腈(含0.1%TFA);检测CTG流动相:90%纯水(含有0.1%TFA):10%纯乙腈(含有0.1%TFA);流速为1.0 mL/min。
1.3.4 吸附单因素试验
称取10 mg 3-MPBA/AG@aZIF-7/PDA,与1 mL多肽溶液混合,吸附一定时间,然后采用HPLC法测定上清液的多肽浓度,按照公式(1)计算材料对多肽的吸附量:
(1)
式中:C0表示吸附前溶液中AG抑制肽的质量浓度,mg/mL;Ct表示时间t时溶液中AG抑制肽的质量浓度,mg/mL;Qt表示给定时间t时溶液中AG抑制肽的吸附量,mg/g;V表示吸附溶液的体积,mL;W表示吸附剂的干重,g。分别考察多肽质量浓度、吸附时间、吸附pH和吸附温度对吸附量的影响。
1.3.5 吸附动力学和吸附等温线研究
基于优化的单因素试验,对3-MPBA/AG@aZIF-7/PDA的吸附机理进行研究。实验条件设置如下:3-MPBA/AG@aZIF-7/PDA 10 mg;温度25 ℃(ITG)或20 ℃(CTG);pH 7.0;多肽质量浓度 4.8 mg/mL(ITG)和3.0 mg/mL(CTG)。采用拟一级动力学模型、拟二级动力学模型拟合实验数据[19]。拟一级和拟二级动力学方程分别如公式(2)、公式(3)所示:
Qt=Qe(1-e-k1t)
(2)
(3)
式中:Qe为平衡吸附容量拟合值,mg/g;Qt为t时间时对应的吸附容量,mg/g;k1为一级吸附速率常数,min-1;k2为二级吸附速率常数,g/(mg·min);t为吸附时间,min。
采用Langmuir和Freundlich等温吸附模型对吸附数据进行分析,研究3-MPBA/AG@aZIF-7/PDA与多肽之间的吸附[20]。Langmuir、Freundlich方程分别如公式(4)、公式(5)所示:
(4)
(5)
式中:Ce为吸附平衡时溶液中抑制肽的质量浓度,mg/mL;Qm为最大吸附量,mg/g;Qe为平衡吸附量,mg/g;KL为Langmuir常数,L/mg;KF为Freundlich常数,mg/g;n为表征吸附强度的Freundlich常数。
1.3.6 复杂体系中AG抑制肽的筛选
1.3.6.1 火麻仁蛋白酶解液中AG抑制肽的吸附及洗脱
按照参考文献的方法制备火麻仁蛋白酶解液[21]。称取20 mg固定化酶3-MPBA/AG@aZIF-7/PDA,加入2 mL火麻仁蛋白酶解液,在室温下振荡吸附30 min后,离心(7 000 r/min,10 min),弃上清液,用纯水洗涤材料3次,将未吸附的多肽洗净。随后加入2 mL 2 mol/L氯化钠对吸附的多肽进行洗脱(室温,30 min),离心(7 000 r/min,10 min),收集上清液,并测定其AG抑制率。
1.3.6.2 AG抑制率的测定方法
在EP管中依次加入20 μL AG溶液、30 μL待测样品和700 μL 磷酸盐缓冲溶液(pH=6.8, 50 mmol/L),混合均匀后在37 ℃下孵育10 min,随后加入100 μL 4-硝基苯-α-D-葡萄糖苷溶液(4-nitrophenyl-α-D-glucopyranoside,PNPG,20 mmol/L),37 ℃条件下反应10 min。加入150 μL 碳酸钠溶液(1 mol/L)终止反应。用紫外分光光度计测定反应液在405 nm下的吸光度值,并按照公式(6)计算AG抑制率:
AG抑制率![]()
(6)
式中:A0为不加样品的空白组的吸光值;A1为加入样品组的吸光值;A2为不加样品、不加酶溶液的对照组的吸光值。
2 结果与分析
2.1 生物复合材料结构表征
2.1.1 SEM和TEM分析
采用SEM和TEM对3-MPBA/AG@aZIF-7/PDA的微观形貌进行表征,结果如图1所示。由图1-a可知,3-MPBA/AG@aZIF-7/PDA为不规则的球形纳米颗粒。TEM图如图1-b所示,同样显示了该固定化酶团簇是不规则的球形纳米颗粒组成,这与SEM结果一致。
2.1.2 XRD分析
通过粉末X射线衍射对3-MPBA/AG@aZIF-7/PDA的结构进行分析,结果如图2所示。3-MPBA/AG@aZIF-7/PDA的峰型较宽,表现为弥散峰,说明该生物复合材料属于无定形材料。在本文中,固定化AG是在低浓度的苯并咪唑和Zn(NO3)2条件下制备,已有研究表明,低浓度有机配体和金属离子合成的MOFs多为无定型结构[22]。

a-SEM;b-TEM
图1 3-MPBA/AG@aZIF-7/PDA的SEM和TEM图
Fig.1 SEM and TEM images of 3-MPBA/AG@aZIF-7/PDA
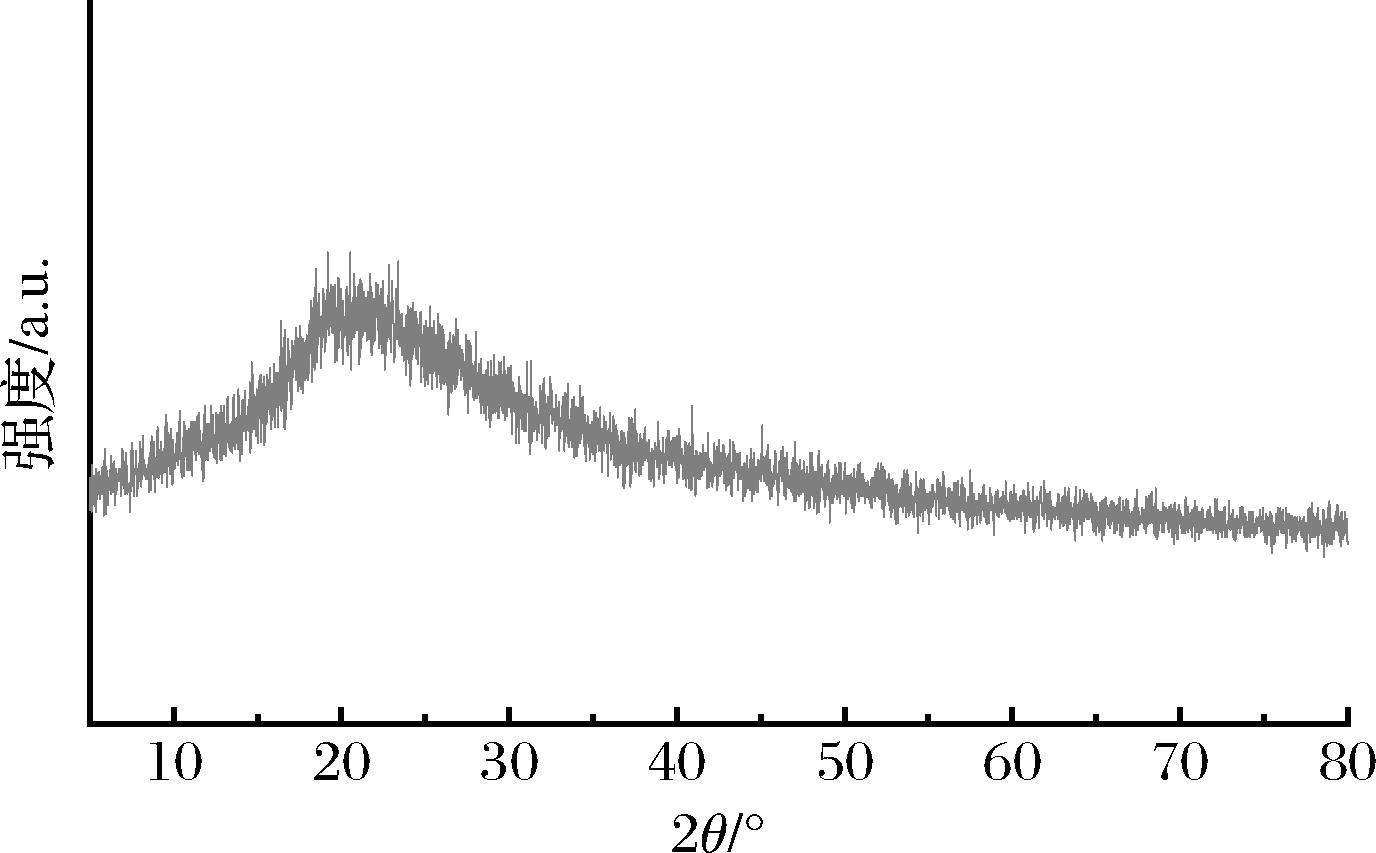
图2 3-MPBA/AG@aZIF-7/PDA 的XRD图
Fig.2 XRD pattern of 3-MPBA/AG@aZIF-7/PDA
2.1.3 FT-IR分析
图3为3-MPBA/AG@aZIF-7/PDA的FT-IR图谱。428、742、1 466、1 241、680、1 370 cm-1处的特征峰分别对应于苯环的Zn—N键、C—H、C—C振动、咪唑环的C—C拉伸振动、3-MPBA的C—S和B—O。1 641 cm-1处的信号对应于AG上Zn2+与羧基之间的配位[23]。3-MPBA/AG@aZIF-7/PDA在3 200~3 650 cm-1处出现较宽的红外光谱带,对应于PDA中醇、儿茶酚和N—H键的拉伸[24],这些结果表明生物复合材料的成功合成。
2.2 ITG和CTG标准曲线
根据HPLC的分析结果,绘制多肽的标准曲线,如图4所示。ITG的标准曲线拟合方程为y=5 188.728 7x-619.507 59,R2=0.995 7;CTG的标准曲线拟合方程为y=9 407.559 12x+518.555 98,R2=0.995 6。2个拟合方程在多肽质量浓度为0.5~2.5 mg/mL时呈良好的线性关系。
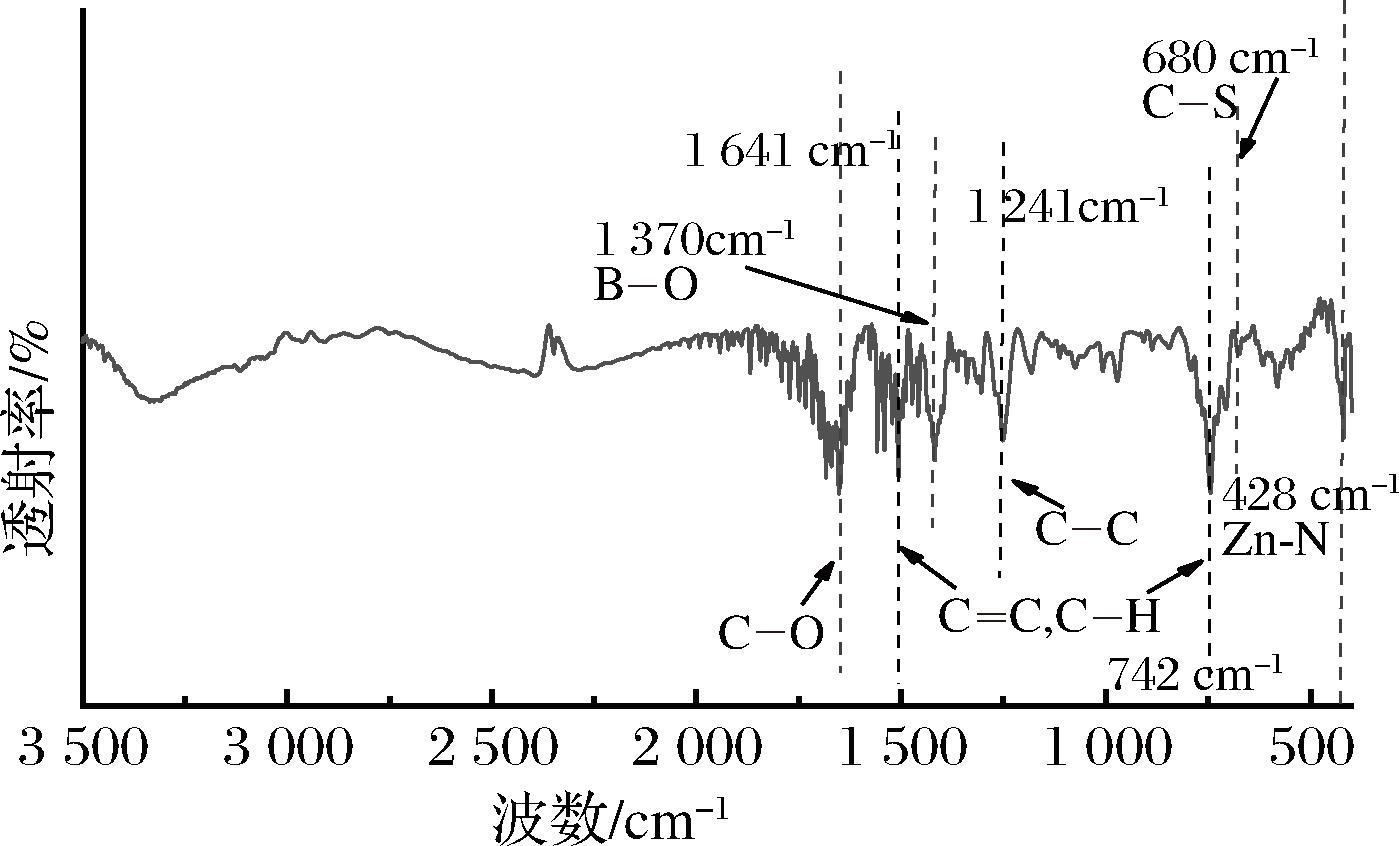
图3 3-MPBA/AG@aZIF-7/PDA 的FT-IR图
Fig.3 FT-IR spectra of 3-MPBA/AG@aZIF-7/PDA
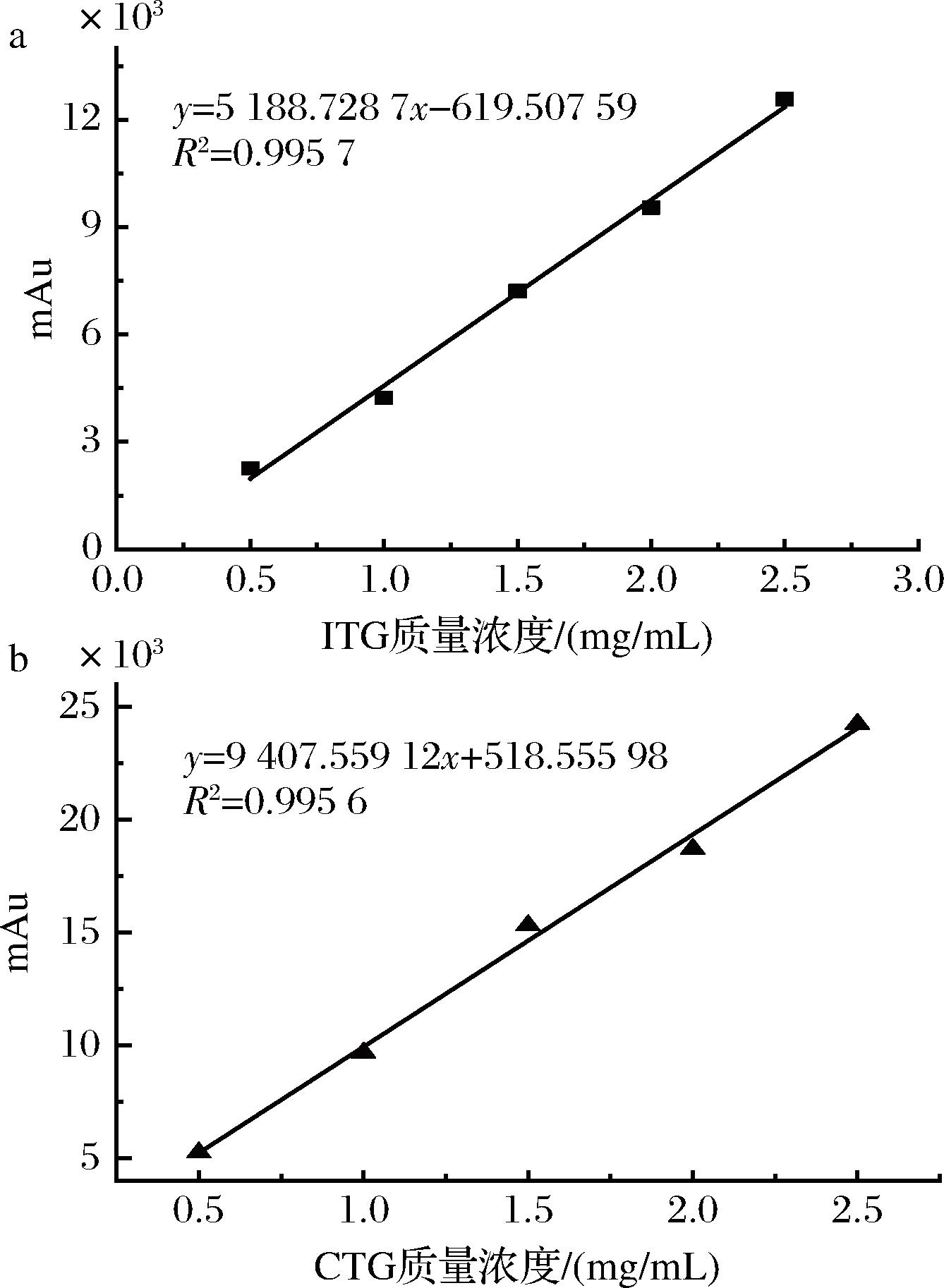
a-ITG;b-CTG
图4 ITG和CTG标准曲线
Fig.4 Standard curves of ITG and CTG
2.3 3-MPBA/AG@aZIF-7/PDA的吸附性能
以ITG和CTG作为多肽模型对3-MPBA/AG@aZIF-7/PDA的吸附性能进行研究。
2.3.1 多肽浓度对吸附效果的影响
固定化酶3-MPBA/AG@aZIF-7/PDA在不同多肽浓度下的吸附效果如图5所示。复合材料对ITG和CTG的吸附量随着多肽浓度的增加而增加,但是超过一定浓度后,吸附量基本保持不变。固定化酶对抑制肽的吸附量受酶负载量的影响,不能无限增加。当多肽浓度较低时,增加浓度,可以提高多肽的传质速率,但是达到吸附饱和后,继续增大多肽浓度,吸附量不会发生明显变化。此外,ITG的吸附量高于CTG,这可能是因为ITG是一种非竞争型抑制肽,在AG上有多个结合位点,而CTG是一种竞争型抑制肽,主要结合到酶的活性位点上[18]。
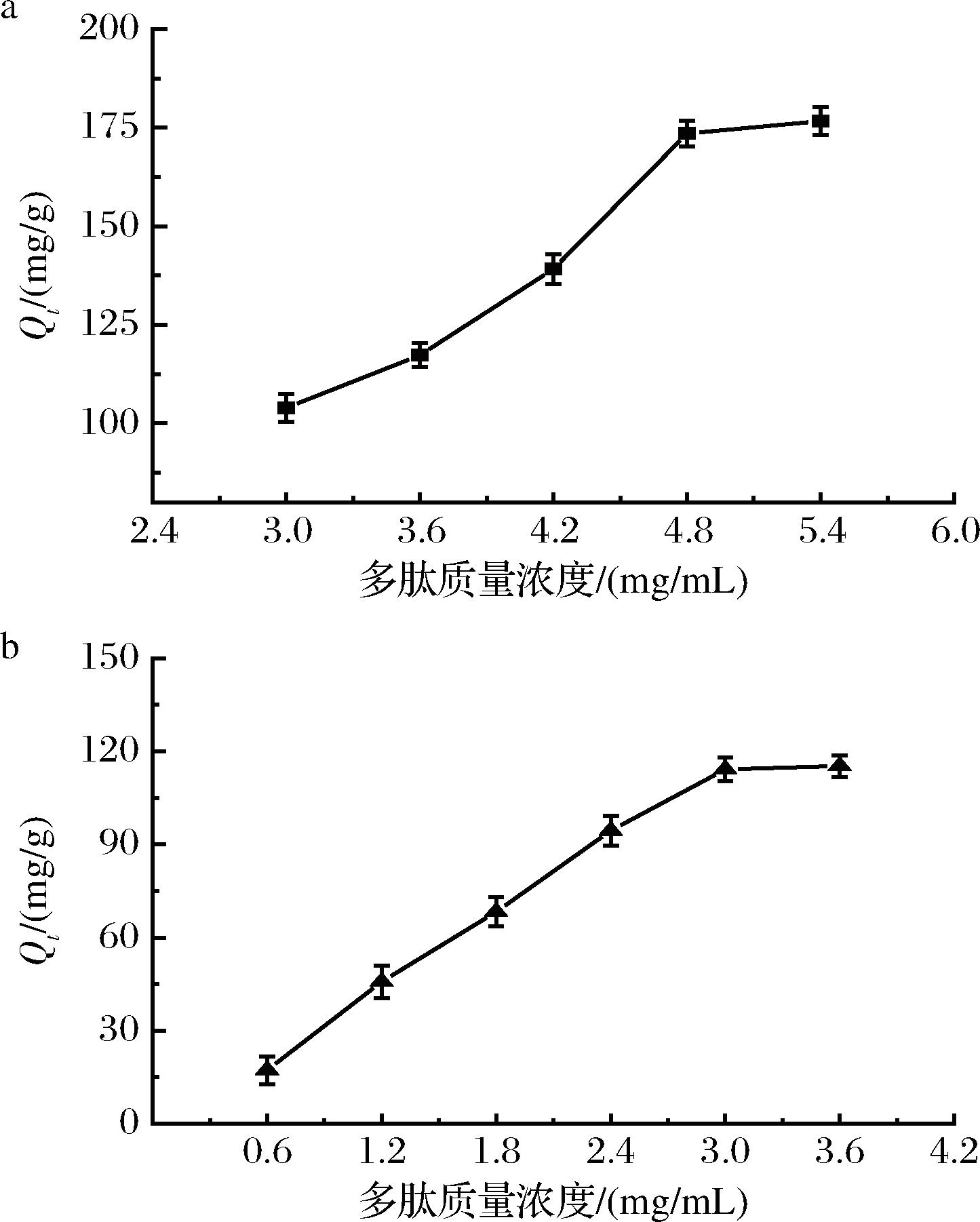
a-ITG;b-CTG
图5 ITG和CTG质量浓度对3-MPBA/AG@aZIF-7/PDA吸附的影响
Fig.5 Effect of ITG and CTG concentrations on the adsorption of 3-MPBA/AG@aZIF-7/PDA
2.3.2 吸附时间对吸附效果的影响
在ITG和CTG初始质量浓度分别为4.8和3.0 mg/mL时,测定不同吸附时间条件下3-MPBA/AG@aZIF-7/PDA的吸附量,结果如图6所示。在0~20 min内,吸附量随吸附时间的延长逐渐增加,这可能是因为多肽从溶液中到达吸附位点需要一定的时间。当吸附时间达到20 min,继续延长吸附时间,吸附量增加不明显,此时材料上大量的吸附位点被占据,吸附与解吸逐渐达到平衡状态[25]。
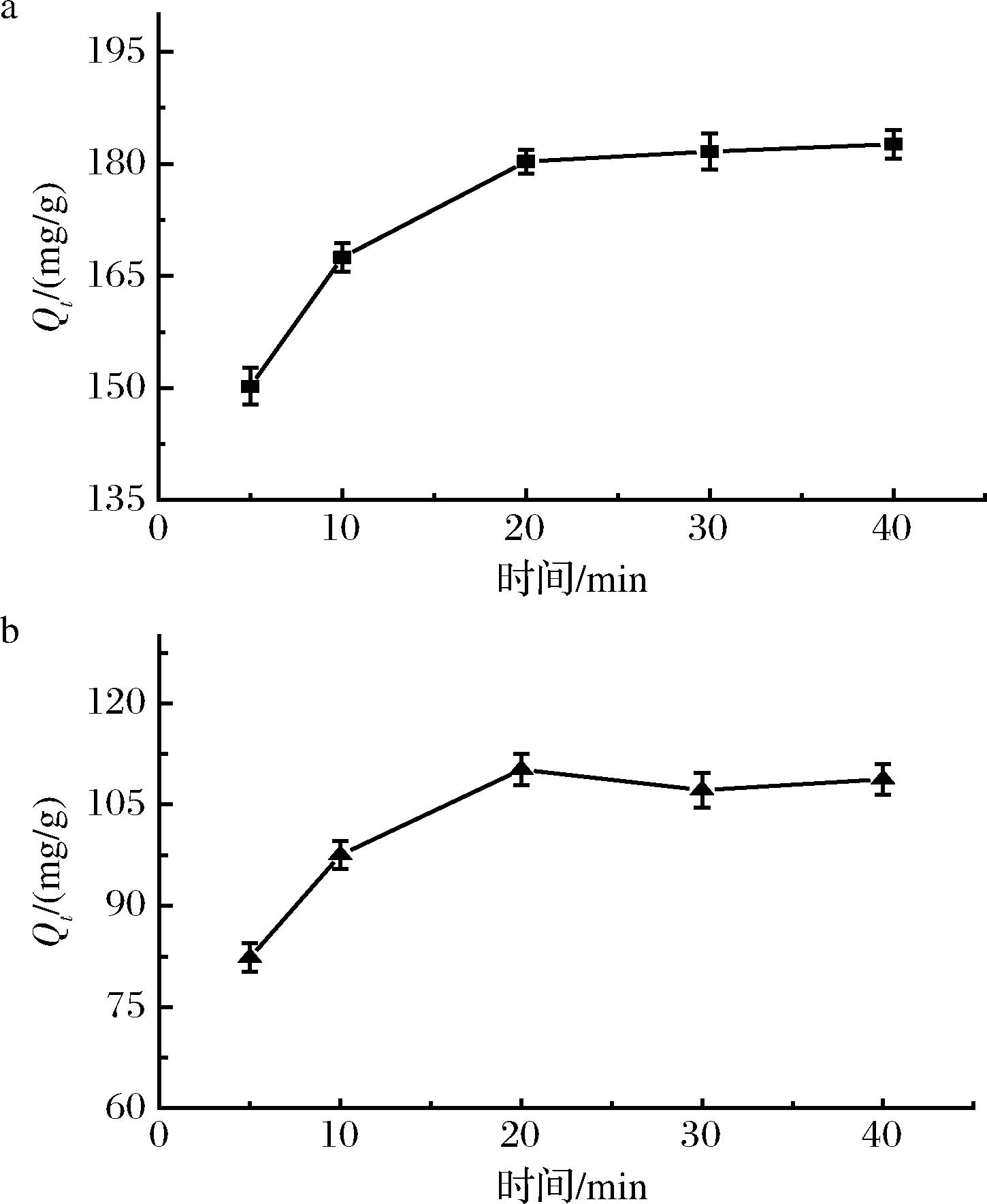
a-ITG;b-CTG
图6 吸附时间对3-MPBA/AG@aZIF-7/PDA 吸附ITG和CTG的影响
Fig.6 Effect of adsorption time on the adsorption of ITG and CTG by 3-MPBA/AG@aZIF-7/PDA
2.3.3 pH对吸附效果的影响
不同pH条件下,3-MPBA/AG@aZIF-7/PDA对ITG和CTG的吸附如图7所示。吸附量随pH值的变化而变化,因为这2种肽的吸附是基于酶与抑制肽的特异性相互作用。在不同pH条件下,多肽的结构发生了变化,影响了传质速率,从而改变了吸附行为。对于ITG,pH值在5.0~8.0保持不变,选温和的中性条件进行吸附,即选择pH值为7.0;CTG的最佳吸附pH值为7.0。
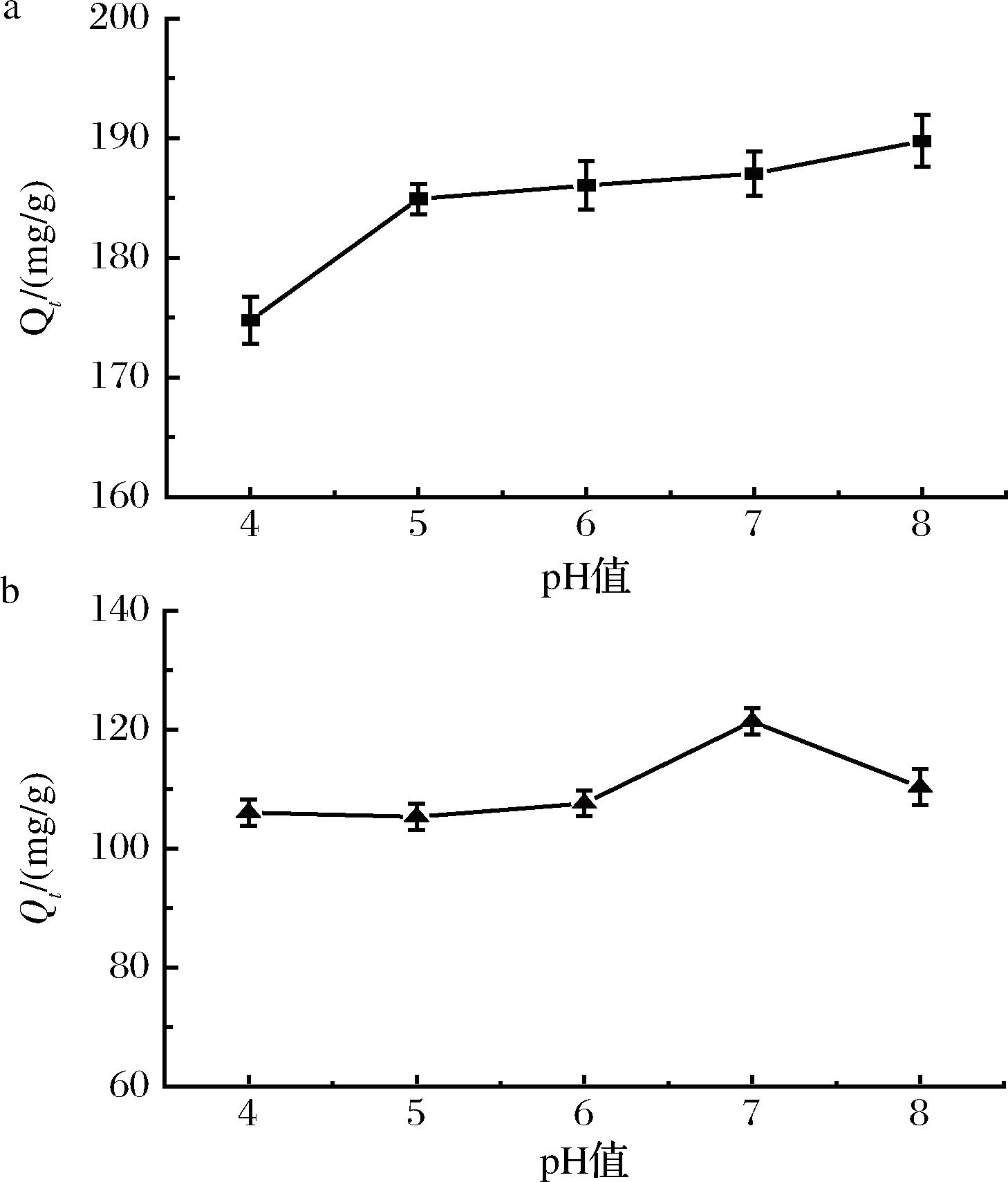
a-ITG;b-CTG
图7 pH对3-MPBA/AG@aZIF-7/PDA 吸附ITG和CTG的影响
Fig.7 Effect of pH on the adsorption of ITG and CTG by 3-MPBA/AG@aZIF-7/PDA
2.3.4 温度对吸附效果的影响
在不同温度条件下,3-MPBA/AG@aZIF-7/PDA对ITG和CTG的吸附如图8所示。温度对固定化酶吸附抑制肽的影响取决于具体的酶和肽的性质。一般来说,升高温度可能会增加酶的活力和亲和力,从而增强固定化酶对抑制肽的吸附[26]。然而,过高的温度可能会导致酶的变性或失活,从而减弱对抑制肽的吸附能力。ITG的最佳的吸附温度为25 ℃;CTG最佳的吸附温度为20 ℃。
2.4 吸附动力学研究
为进一步探究ITG和CTG在3-MPBA/AG@aZIF-7/PDA上的吸附机理,分别采用拟一级动力学模型(pseudo-first-order kinetic model,PFO)和拟二级动力学模型(pseudo-secord-order kinetic model,PSO)对实验数据拟合,结果如图9所示。3-MPBA/AG@aZIF-7/PDA对ITG和CTG的吸附量随着吸附时间的延长而增加,在20 min后达到吸附平衡。根据拟合结果得到的吸附参数如表1所示,对于ITG和CTG,PFO的R2分别为0.996 8和0.994 7,高于PSO的R2,且PFO拟合得到平衡吸附量更接近实验值,表明3-MPBA/AG@aZIF-7/PDA对ITG和CTG的吸附更符合拟一级动力学模型,以物理吸附为主。
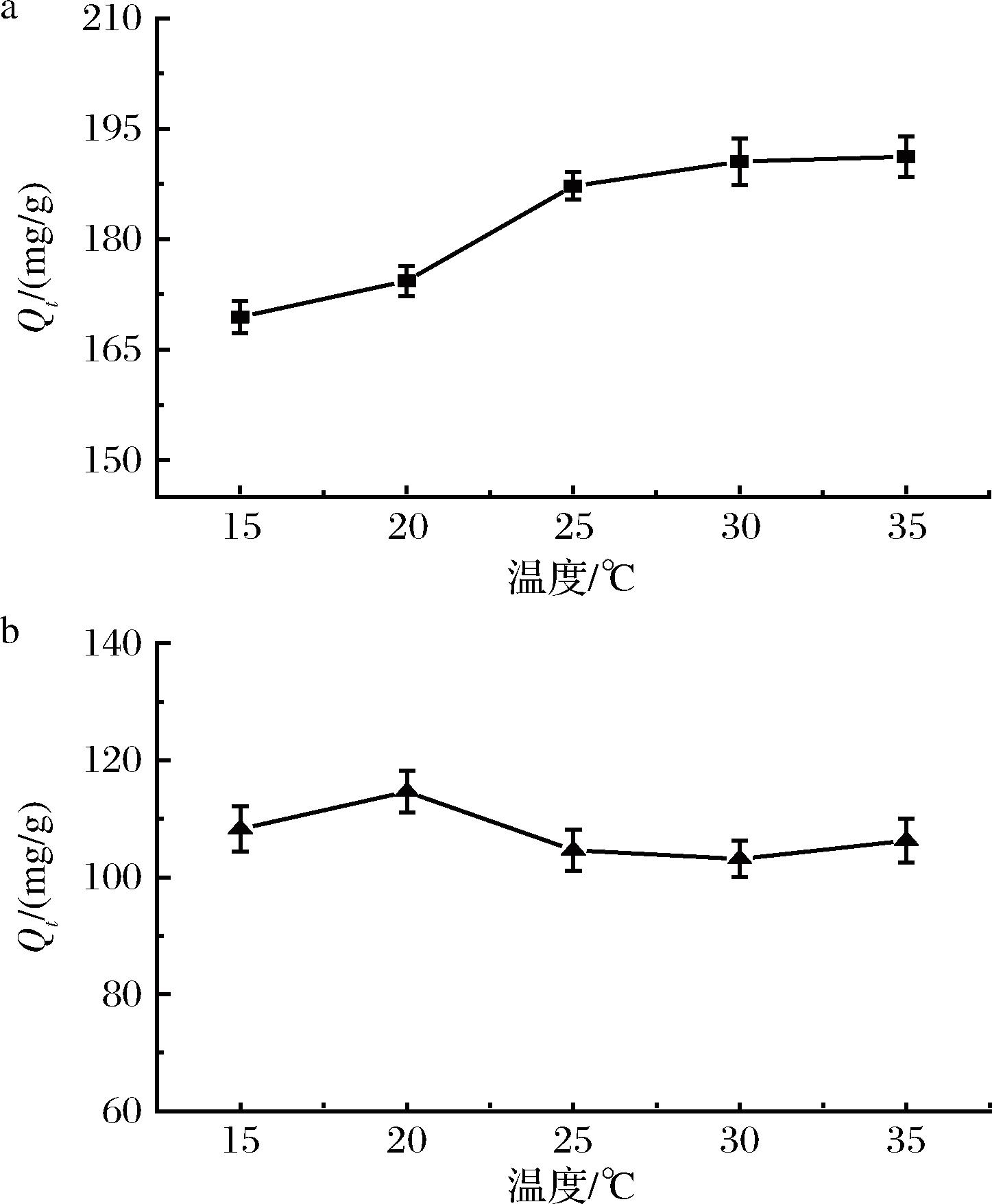
a-ITG;b-CTG
图8 温度对3-MPBA/AG@aZIF-7/PDA 吸附ITG和CTG的影响
Fig.8 Effect of temperature on the adsorption of ITG and CTG by 3-MPBA/AG@aZIF-7/PDA
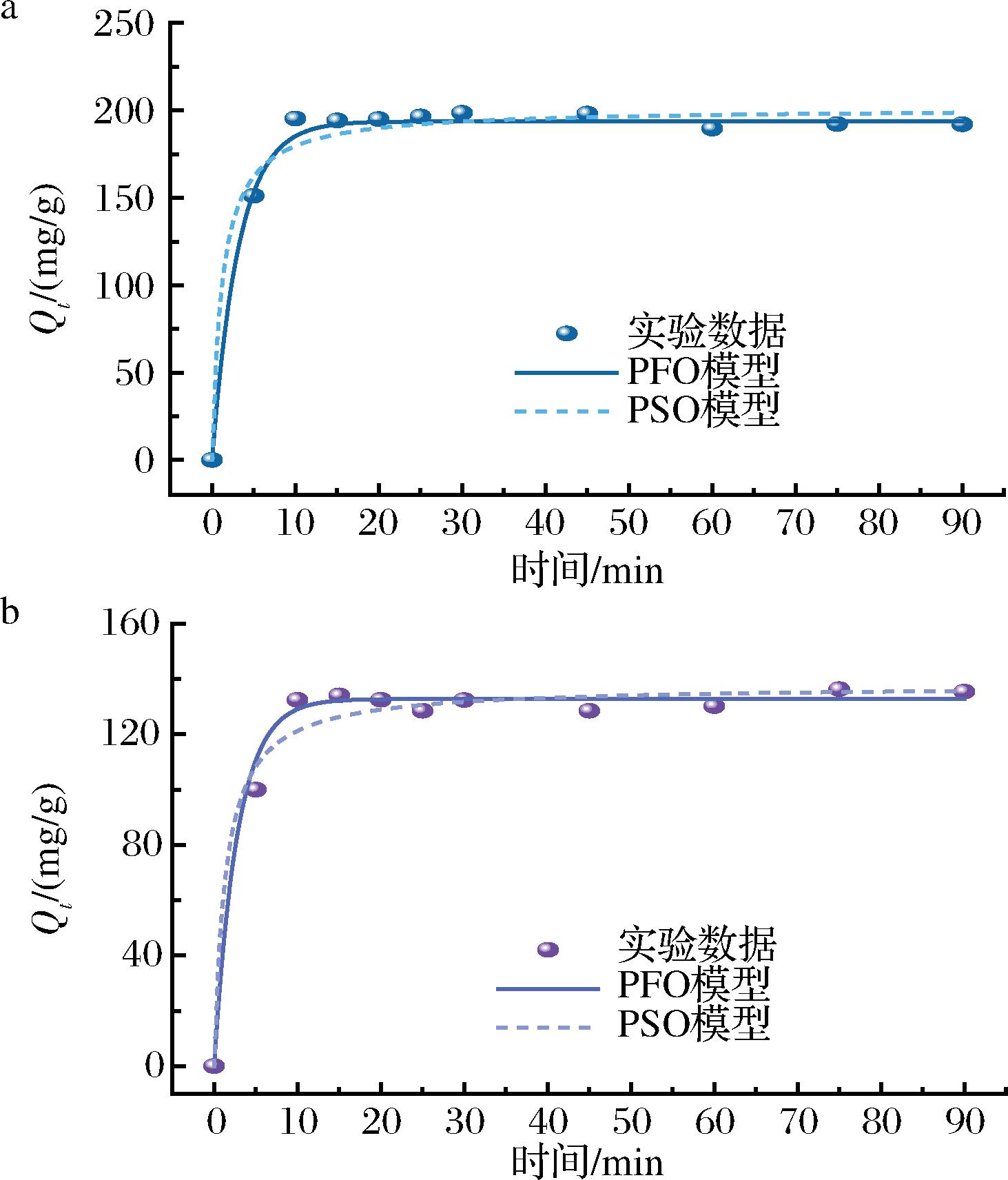
a-ITG;b-CTG
图9 ITG和CTG在 3-MPBA/AG@aZIF-7/PDA上的吸附动力学拟合图
Fig.9 Fitted plot of adsorption kinetics of ITG and CTG on 3-MPBA/AG@aZIF-7/PDA
表1 3-MPBA/AG@aZIF-7/PDA对ITG和CTG的吸附动力学拟合参数
Table 1 Kinetic fitting parameters for the adsorption of ITG and CTG by 3-MPBA/AG@aZIF-7/PDA
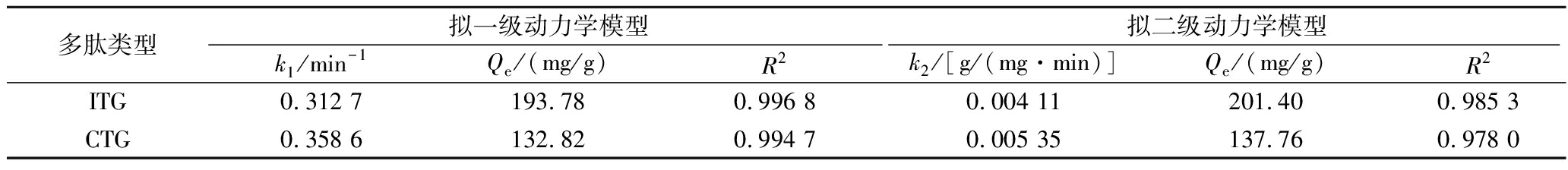
多肽类型拟一级动力学模型拟二级动力学模型k1/min-1Qe/(mg/g)R2k2/[g/(mg·min)]Qe/(mg/g)R2ITG0.312 7193.780.996 80.004 11201.400.985 3CTG0.358 6132.820.994 70.005 35137.760.978 0
2.5 吸附等温线研究
配制一系列不同浓度的多肽溶液,测定不同多肽浓度条件下3-MPBA/AG@aZIF-7/PDA对多肽的吸附效果,然后分别采用Langmuir模型和Freundlich模型对数据进行拟合,结果如图10所示,吸附参数如表2所示。对于ITG的吸附,Langmuir模型和Freundlich模型的相关系数R2分别为0.928 4和0.883 3,表明Langmuir模型拟合出来的结果与实际的测定数据更吻合,吸附是一个单分子层吸附过程,吸附位点是有限的。对于CTG的吸附,同样Langmuir模型拟合出来的结果与实际的测定数据更吻合,属于单分子层吸附。此外,Langmuir模型拟合得到的ITG和CTG最大吸附量Qmax分别为372.83 mg/g和183.33 mg/g,表明3-MPBA/AG@aZIF-7/PDA是一种很有前途的富集AG抑制肽的材料。
2.6 复杂体系中AG抑制肽的筛选
将3-MPBA/AG@aZIF-7/PDA作为亲和分离介质,对火麻仁蛋白酶解液中的AG抑制肽进行分离纯化,收集洗脱液,并测定其对AG的抑制活性,结果如表3所示。火麻仁蛋白酶解液质量浓度为1 mg/mL时,AG抑制率为13.89%,经过分离纯化,相同条件下洗脱液的AG抑制活性提高到73.81%,说明3-MPBA/AG@aZIF-7/PDA能与酶解液中的AG抑制肽发生特异性结合,可有效地对其进行纯化。
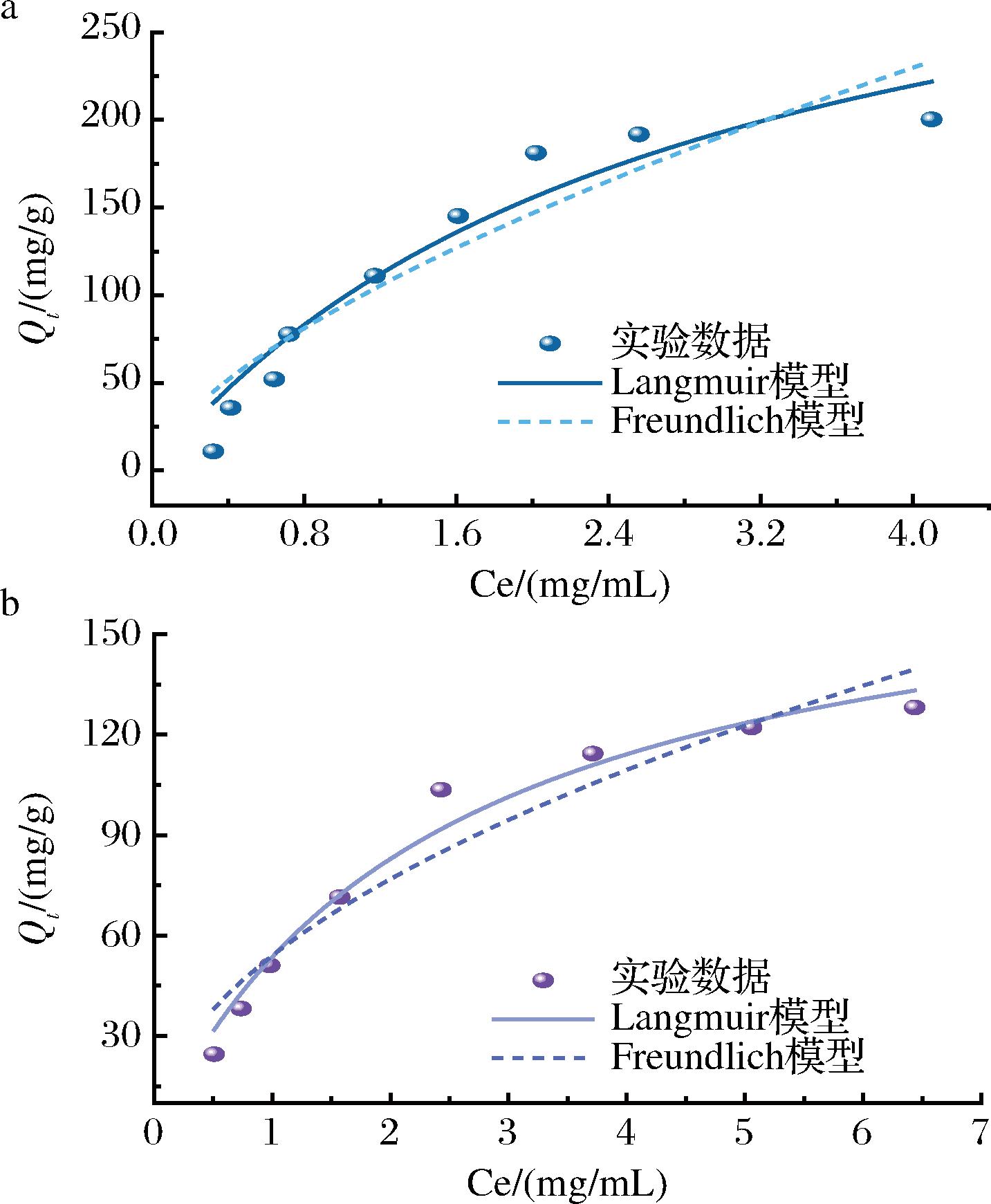
a-ITG;b-CTG
图10 ITG和CTG在3-MPBA/AG@aZIF-7/PDA上的吸附等温模型拟合图
Fig.10 Fitted plot of the adsorption isothermal model of ITG and CTG on 3-MPBA/AG@aZIF-7/PDA
表2 3-MPBA/AG@aZIF-7/PDA对ITG和CTG的吸附等温线拟合参数
Table 2 Adsorption isotherm fitting parameters for ITG and CTG by 3-MPBA/AG@aZIF-7/PDA
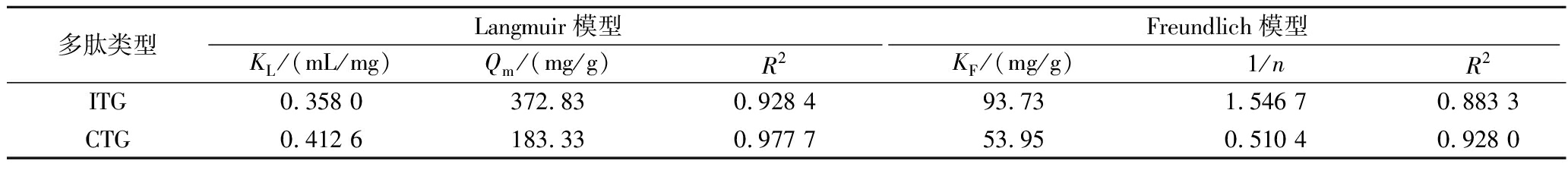
多肽类型Langmuir模型Freundlich模型KL/(mL/mg)Qm/(mg/g)R2KF/(mg/g)1/nR2ITG0.358 0372.830.928 493.731.546 70.883 3CTG0.412 6183.330.977 753.950.510 40.928 0
表3 3-MPBA/AG@aZIF-7/PDA对复杂体系中AG抑制肽的纯化效果
Table 3 Effectiveness of 3-MPBA/AG@aZIF-7/PDA on the purification of AG inhibitory peptides in complex systems

样品(1 mg/mL)AG抑制率/%火麻仁蛋白酶解液13.893-MPBA/AG@aZIF-7/PDA洗脱液73.81
3 结论与讨论
该研究制备了一种新型的固定化酶3-MPBA/AG@aZIF-7/PDA,并研究了该材料对2种不同类型的AG抑制肽ITG和CTG的吸附行为,验证3-MPBA/AG@aZIF-7/PDA在AG抑制剂快速筛选中的应用潜力。结果表明,制备得到的3-MPBA/AG@aZIF-7/PDA为不规则球形纳米材料,具有无定形结构。对于ITG,在多肽质量浓度为4.8 mg/mL,吸附时间为20 min,pH值为7.0,温度为25 ℃时,最大吸附量为191.06 mg/g;对于CTG,在多肽质量浓度为3.0 mg/mL,吸附时间为20 min,pH值为7.0,温度为20 ℃时,最大吸附量为129.50 mg/g。吸附动力学和吸附等温线结果表明,3-MPBA/AG@aZIF-7/PDA对ITG和CTG的吸附符合拟一级动力学吸附模型,属于单分子层吸附的物理吸附过程。拟合得到的ITG和CTG最大吸附量可分别达到372.83和183.33 mg/g。复杂体系筛选实验结果表明,经固定化酶分离纯化的洗脱液对AG抑制率从13.89%提高至73.81%。由此可见,3-MPBA/AG@aZIF-7/PDA有望在AG抑制剂快速筛选领域实现广泛应用。
[1] WAN G Z, MA X H, JIN L, et al.α-glucosidase immobilization on magnetic core-shell metal-organic frameworks for inhibitor screening from traditional Chinese medicines[J].Colloids and Surfaces B:Biointerfaces, 2021, 205:111847.
[2] TAN K M, TESAR C, WILTON R, et al.Interaction of antidiabetic α-glucosidase inhibitors and gut bacteria α-glucosidase[J].Protein Science, 2018, 27(8):1498-1508.
[3] YIN Z H, ZHANG W, FENG F J, et al.α-Glucosidase inhibitors isolated from medicinal plants[J].Food Science and Human Wellness, 2014, 3(3-4):136-174.
[4] 刘平, 舒文娟, 冯秀, 等.阿卡波糖片治疗2型糖尿病的应用研究进展[J].中国处方药, 2020, 18(3):13-14.
LIU P, SHU W J, FENG X, et al.Research progress of acarbose tablets in the treatment of type 2 diabetes mellitus[J].Journal of China Prescription Drug, 2020, 18(3):13-14.
[5] 杨洁. 伏格列波糖片对2型糖尿病空腹血糖、餐后2 h血糖、糖化血红蛋白的影响[J].中国医药指南, 2019, 17(29):70-71.
YANG J.Effect of voglibose tablets on fasting blood glucose, 2 h postprandial blood glucose and glycosylated hemoglobin in type 2 diabetes mellitus[J].Guide of China Medicine, 2019, 17(29):70-71.
[6] WAN G Z, MA X H, JIN L, et al.Fabrication of a magnetic porous organic polymer for α-glucosidase immobilization and its application in inhibitor screening[J].Langmuir, 2023, 39(15):5239-5249.
[7] LEE H J, LEE H S, CHOI J W, et al.Novel tripeptides with α-glucosidase inhibitory activity isolated from silk cocoon hydrolysate[J].Journal of Agricultural and Food Chemistry, 2011, 59(21):11522-11525.
[8] ZHANG Y P, WU F H, HE Z P, et al.Optimization and molecular mechanism of novel α-glucosidase inhibitory peptides derived from Camellia seed cake through enzymatic hydrolysis[J].Foods, 2023, 12(2):393.
[9] YU Z P, YIN Y G, ZHAO W Z, et al.Novel peptides derived from egg white protein inhibiting alpha-glucosidase[J].Food Chemistry, 2011, 129(4):1376-1382.
[10] LI X H, SU Z R, LUO Y S, et al.Modelling of oligodextran production via an immobilized enzyme membrane reactor:Bioreaction-separation coupling mechanism[J].Separation and Purification Technology, 2022, 282:120024.
[11] MUJTABA N, JAHAN N, SULTANA B, et al.Isolation and characterization of antihypertensive peptides from soy bean protein[J].Brazilian Journal of Pharmaceutical Sciences, 2021, 57.DOI:10.1590/s2175-97902020000419061.
[12] LAN X D, LIAO D K, WU S G, et al.Rapid purification and characterization of angiotensin converting enzyme inhibitory peptides from lizard fish protein hydrolysates with magnetic affinity separation[J].Food Chemistry, 2015, 182:136-142.
[13] 孙美玲. 基于亲和色谱的皮氏蛾螺ACE抑制肽分离及其特性评价[D].大连:大连工业大学, 2017.
SUN M L.Isolation and characterization of ACE inhibitory peptides from Oncomelania pipiens based on affinity chromatography[D].Dalian:Dalian Polytechnic University, 2017.
[14] HIPPAUF F, HUETTNER C, LUNOW D, et al.Towards a continuous adsorption process for the enrichment of ACE-inhibiting peptides from food protein hydrolysates[J].Carbon, 2016, 107:116-123.
[15] LIU L, QIAO Z W, CUI X F, et al.Amino acid imprinted UiO-66 s for highly recognized adsorption of small angiotensin-converting-enzyme-inhibitory peptides[J].ACS Applied Materials &Interfaces, 2019, 11(26):23039-23049.
[16] HUETTNER C, HAGEMANN D, TROSCHKE E, et al.Tailoring the adsorption of ACE-inhibiting peptides by nitrogen functionalization of porous carbons[J].Langmuir, 2019, 35(30):9721-9731.
[17] 刘思媛, 刘精杏, 王则奋, 等.水相中GOx@ZIF-7/PDA的制备及酶学性能研究[J].食品与发酵工业, 2023, 49(18):157-164.
LIU S Y, LIU J X, WANG Z F, et al.Preparation of GOx@ZIF-7/PDA in aqueous phase and its enzymatic properties[J].Food and Fermentation Industries, 2023, 49(18):157-164.
[18] KHAN S N, SHAHEEN F, ALEEM U, et al.Peptide conjugates of 18β-glycyrrhetinic acid as potent inhibitors of α-glucosidase and AGEs-induced oxidation[J].European Journal of Pharmaceutical Sciences, 2022, 168:106045.
[19] 苏会东, 黄维华.D113大孔树脂吸附Ni2+的动力学与热力学研究[J].环境科学与技术, 2009, 32(10):49-52.
SU H D, HUANG W H.Kinetics and thermodynamics of sorption of Ni2+ macroporous adsorption resin D113[J].Environmental Science &Technology, 2009, 32(10):49-52.
[20] GEORGIANOS P, POURNARA A D, ANDREOU E K, et al.Composite materials based on a Zr4+ MOF and aluminosilicates for the simultaneous removal of cationic and anionic dyes from aqueous media[J].Molecules, 2023, 28(2):815.
[21] REN Y, LIANG K, JIN Y Q, et al.Identification and characterization of two novel α-glucosidase inhibitory oligopeptides from hemp (Cannabis sativa L.) seed protein[J].Journal of Functional Foods, 2016, 26:439-450.
[22] LIN Z X, RICHARDSON J J, ZHOU J J, et al.Direct synthesis of amorphous coordination polymers and metal-organic frameworks[J].Nature Reviews.Chemistry, 2023, 7(4):273-286.
[23] JIAO R, WANG Y M, PANG Y X, et al.Construction of macroporous β-glucosidase@MOFs by a metal competitive coordination and oxidation strategy for efficient cellulose conversion at 120 ℃[J].ACS Applied Materials &Interfaces, 2023, 15(6):8157-8168.
[24] MOHAMMAD M, RAZMJOU A, LIANG K, et al.Metal-organic-framework-based enzymatic microfluidic biosensor via surface patterning and biomineralization[J].ACS Applied Materials &Interfaces, 2019, 11(2):1807-1820.
[25] WANG Z F, ZHOU Q, LIU S Y, et al.Anchoring of polymer loops on enzyme-immobilized mesoporous ZIF-8 enhances the recognition selectivity of angiotensin-converting enzyme inhibitory peptides[J].Molecules, 2023, 28(7):3117.
[26] 肖志红, 吴红, 李昌珠, 等.固定化假丝酵母脂肪酶对光皮树油的吸附性能[J].中南林业科技大学学报, 2014, 34(2):117-121.
XIAO Z H, WU H, LI C Z, et al.Adsorption kinetics of immoblized Candida lipase to Swida wilsoniana oil[J].Journal of Central South University of Forestry &Technology, 2014, 34(2):117-121.