火腿在世界上具有悠久的历史,且世界各地有制作火腿的独特条件,形成了各自的特点。其中我国的金华、宣威与如皋火腿、意大利的帕尔马火腿和西班牙的伊比利亚火腿都是享誉全球的火腿产品[1-2]。由于不同种类火腿制作的菌种、工艺、原料和环境等不同,导致风味、质地和色泽差异明显。目前,国内火腿企业均尝试在菌种的开发中有所突破,突破解决自然发酵时间长、批次间风味、颜色和质地差异大等“卡脖子”问题,从而进行稳定的工业化生产。
火腿自然发酵过程有许多菌种参与,细菌主要包括乳酸菌和葡萄球菌、真菌包括酵母和霉菌等,这些菌株在火腿风味形成中起到了重要的作用[3]。在宣威火腿中乳酸菌对风味的主要贡献可归因于有机酸的产生、抑制腐败菌的生长;产生蛋白酶和脂肪酶的菌株同样对火腿的风味形成具有关键性的作用;葡萄球菌的优势在于其过氧化氢酶、脂解和蛋白水解活性较强;酵母菌和霉菌的添加可以在增加香气的同时提高感官品质[4-6]。
乳酸菌的蛋白酶可将肉中蛋白分解成多肽,多肽再分解形成寡肽和氨基酸[7]。其中半胱氨酸和丝氨酸转化为丙酮酸;支链氨基酸在酶的作用下转化为3-甲基丁醛等,醛类可以在酶的作用下继续生成醇类[8]。乳酸菌还可以将葡萄糖转化为丙酮酸,产生具有香气的酯类[9],促进风味形成。米瑞芳等[10]发现添加了植物乳植杆菌的酸肉中乙酯类物质含量较高;吴双慧等[11]发现用植物乳植杆菌(L77)发酵香肠,醛类物质种类明显变多,风味更丰富;LIU等[12]发现接种了乳杆菌YZU-06的香肠3-甲基丁醛的含量更高。
宣威火腿是云南的标签食品,为了更好地对其风味、品质和批次间的稳定性等进行控制,本研究从宣威火腿中筛选乳酸菌,研究其对发酵火腿的风味、颜色和质构等的影响及其与优质宣威火腿的品质差异,以期为宣威火腿乳酸菌直投发酵剂的开发提供理论基础和思路。
1 材料和方法
1.1 材料与试剂
宣威优质火腿(自然发酵),宣威永进火腿厂;合格的猪后腿肉修整后备用,肉块质量为(500±2) g,超市;MRS液体培养基、MRS琼脂培养基,北京奥博星生物技术有限责任公司;石蕊牛奶培养基,北京索莱宝科技有限公司;食品级氯化钠,国药集团化学试剂有限公司;食品级亚硝酸钠,四川金山制药有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
YXQ-70A立式压力蒸汽灭菌锅,上海博讯医疗生物仪器股份有限公司;THZ-1008恒温培养摇床、LRHA-250F生化培养箱,上海一恒科学仪器有限公司;TGL-16aR离心机,上海安亭科学仪器厂;SW-CJ-2G净化工作台,苏州净化设备有限公司;Eon全波长酶标仪,美国BioTek公司;TQ8040气相色谱-质谱联用仪,日本岛津公司;TA-XT2i质构仪,英国STable Micro Systems公司;CR-410色差仪,日本柯尼卡美能达公司;cNose-18电子鼻,上海保圣实业发展有限公司;HD-5水分活度仪,美国Aqua Lab公司;ICTHI-450恒湿恒温箱,施都凯仪器设备有限公司。
1.3 实验方法
1.3.1 菌株的分析及筛选
将企业提供的优质宣威火腿去皮,内部切块粉碎后,取10 g样品与90 mL无菌生理盐水混合后匀浆,匀浆液进行梯度稀释,将稀释液涂布于MRS固体培养基中,挑选湿润,乳白色,菌落边缘光滑的菌落进行牛奶石蕊复筛。对鉴定为乳酸菌的菌株进行生产性能评价,其中包括产黏实验、产蛋白酶实验、产酸实验、产氨基酸脱羧酶、产氨实验与产硫化氢实验。复筛以菌株的耐盐性作为评价指标。
1.3.2 菌株的鉴定
将上述实验中挑选到的适合菌株进行分子生物学鉴定,利用剂盒中提取细菌DNA作为PCR扩增的模板,以正向引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′),反向引物1492R(5′-TACGGYTACCTTGTTACGACTT-3′)进行16S rDNA片段扩增。PCR扩增条件为94 ℃预变性2 min、90 ℃变性15 s、55 ℃退火30 s以及72 ℃延伸1 min,共35个循环,最后一次延伸后,4 ℃终止反应。将PCR产物进行测序,测序后的结果进行拼接,然后通过www.ncbi.nlm.nih.gov网站中的BLAST进行核苷酸分析[13]。
1.3.3 干腌肉块的制备
将6%(质量分数)的食品级NaCl和150 mg/kg食品级亚硝酸盐分3次涂抹揉搓进行腌制。将肉块堆叠于温度为4 ℃,相对湿度为90%的腌制室1 d排除血水;3次的盐(质量分数)分别为2.5%、2.5%和1%。腌制完成后将肉块表面清洗干净擦干后,将浓度为107 CFU/mL的菌液按照肉块质量2%的体积均匀涂抹于肉块表面,将肉块悬挂于温度为12 ℃,相对湿度为60%的环境风干3 d。发酵置于恒湿恒温箱分前中后3个阶段进行发酵。前期温度为20 ℃,相对湿度为60%发酵15 d;中期温度为30 ℃,相对湿度为75%发酵40 d;发酵后期温度为20 ℃,相对湿度为65%发酵30 d至成熟[14]。每组6个平行。
1.3.4 理化指标检测
对发酵后肉块的物理性性质包括色差、水分活度(water activity,Aw)、pH和质构特性进行检测。从而评价乳酸菌对发酵肉块品质的影响。
1.3.4.1 色差的测定
根据李佳林等[15]的方法进行色差的测定,用标准白校准色度计,为防止氧化带来的误差,肉块色差测定为现切现测,所得数值用亮度(L*)、红度(a*)与黄度(b*)表示,每个样品3个平行样。
1.3.4.2 Aw的测定
将5 g粉碎后的样品置于水分分析仪内进行测定并计算其Aw,每个样品测定3个平行样。
1.3.4.3 质构的测定
根据W![]() SIERSKA等[16]的方法并稍作修改,以“二次压缩”试验测定样品的硬度、弹性、内聚性、咀嚼性、回复性。将干腌肉块切成1 cm×1 cm×1 cm的小块,选用P50探头,测前速度1.0 mm/s,测试速度1.0 mm/s,测试后速度5 mm/s,下压形变量75%,触发力为30.0 g,每个样品重复测定6次。参数如表1所示。
SIERSKA等[16]的方法并稍作修改,以“二次压缩”试验测定样品的硬度、弹性、内聚性、咀嚼性、回复性。将干腌肉块切成1 cm×1 cm×1 cm的小块,选用P50探头,测前速度1.0 mm/s,测试速度1.0 mm/s,测试后速度5 mm/s,下压形变量75%,触发力为30.0 g,每个样品重复测定6次。参数如表1所示。
表1 质构检测参数
Table 1 Detection of texture parameters

指标定义硬度 探头第一次压缩样品时的压力峰值弹性 样品经过第一次压缩后能够再恢复的程度内聚性样品经过第二次压缩的相对抵抗能力咀嚼性硬度×弹性×内聚性回复性第一次挤压样品时,形变之前与之后的面积比值
1.3.5 电子鼻气味测定
根据TOLEDANO等[17]的方法利用电子鼻对肉块气味进行测定,电子鼻参数设定:固定时间间隔1.0 s,清洗时间120 s,准备进样时间5 s,检测时间60 s,载气流速300 mL/min,进样流量300 mL/min,每次测定后将通道清零再进行第二轮的顶空进样,每组样品测定3次。
1.3.6 干腌肉块中挥发性风味物质的测定
采用顶空固相微萃取结合气相色谱-质谱联用对肉块的挥发性化合物进行检测,采用内标法对挥发性风味化合物含量变化进行定量。根据LI等[18]的方法进行测定并分析,使用NIST 2011库并比较保留指数来鉴定挥发性化合物。气味活性值(odor active value,OAV)根据公式(1)计算:
(1)
式中:C为挥发性化合物的浓度,μg/kg;OT是挥发性化合物的气味阈值,μg/kg。
1.3.7 感官评定
由12位有感官评定经验的人员对肉块进行感官评定。将肉块切成3 cm×3 cm,放置于随机数编号的锡箔纸中,随机分发给品评员,对颜色与纹理、嗅闻气味和品尝滋味进行评价。采用描述性分析对肉块的色泽、质地、滋味、香气和整体接受度进行评价[19]。感官评分标准见表2所示。
表2 发酵肉块感官评分指标
Table 2 Sensory evaluation indicators of fermented meat

项目评分描述评分/分色泽肌肉切面玫瑰红色,脂肪切面呈白色,有光泽10肌肉切面暗红,脂肪切面呈黄色0质构质地紧密,切面平整,细腻10组织疏松,切面松散0气味有类似火腿香气,味纯正,无异味10无清香味,有腐臭味0滋味有类似火腿香味,口感细腻,咸淡适中10无香味,有哈喇味,咸淡不适0整体可接受度颜色,气味,质构,滋味与火腿一致10颜色,气味,质构,滋味与火腿差别较大0
1.4 数据分析
采用SPSS 19.0软件对数据进行单因素方差分析(One-Way ANOVA),实验结果以“平均值±标准差”表示,对组间平均数进行差异比较。当P<0.05时,代表组间存在显著性差异。采用Origin 2022和GraphPad Prism 8进行数据可视化。
2 结果与分析
2.1 菌株筛选
乳酸菌的筛选依据是具有良好的蛋白酶活力和降低pH的能力,同时还要不产黏、不产氨、不产硫化氢和无氨基酸脱羧酶活力等。根据以上要求,筛选得到乳酸菌的结果如表3所示。菌株根据筛选顺序命名为KULG+序号。
2.2 菌种复筛结果
火腿中食盐添加量一般为6%[20],以此作为依据对乳酸菌耐盐性进行复筛,其结果见图1所示,不同字母表示组间差异性显著(P<0.05)。
表3 菌株初筛结果
Table 3 Preliminary screening results of strains
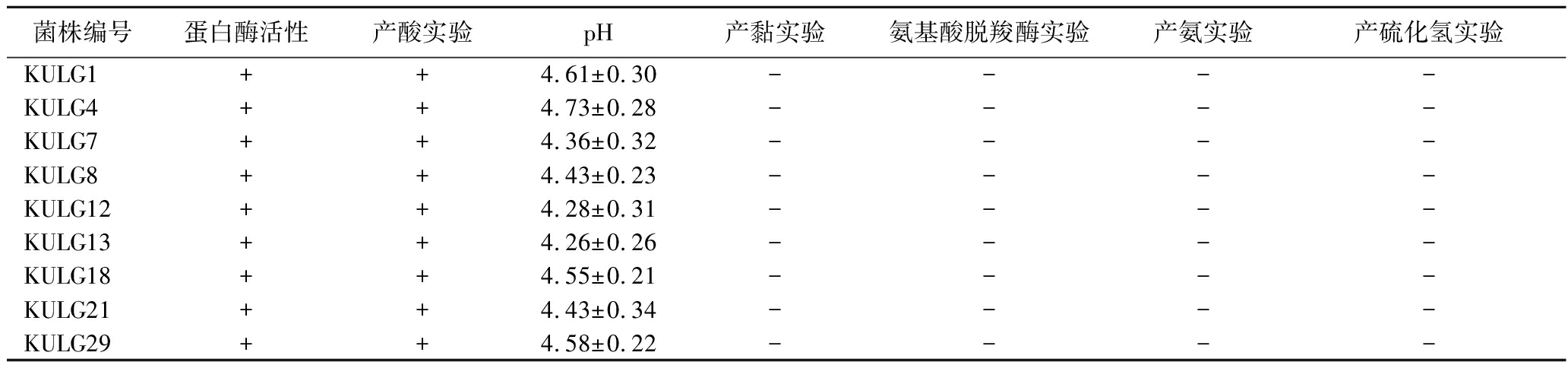
菌株编号蛋白酶活性产酸实验pH产黏实验氨基酸脱羧酶实验产氨实验产硫化氢实验KULG1++4.61±0.30----KULG4++4.73±0.28----KULG7++4.36±0.32----KULG8++4.43±0.23----KULG12++4.28±0.31----KULG13++4.26±0.26----KULG18++4.55±0.21----KULG21++4.43±0.34----KULG29++4.58±0.22----
注:“+”表示活性为阳性,“-”表示活性为阴性。
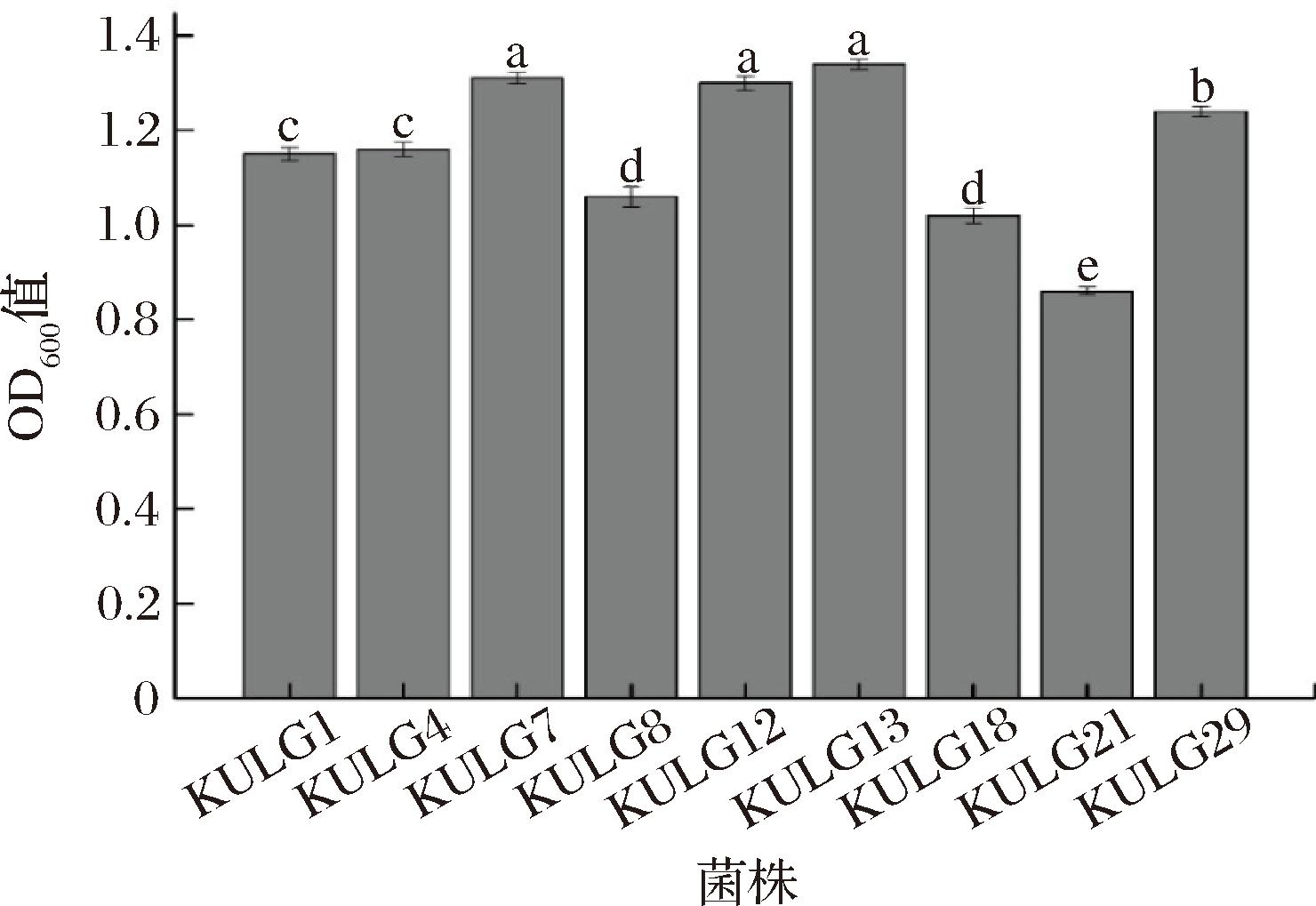
图1 菌株的耐盐性
Fig.1 Salt tolerance of strains
注:不同小写字母表示差异显著(P<0.05)(下同)。
由图1可知,9株乳酸菌在含6%NaCl的MRS肉汤培养基中均可生长,其中KULG7、KULG12和KULG13的耐盐性显著高于其他菌株(P<0.05),但这3株相比较,之间的差异性不显著,因此选择这3株乳酸菌进行后续研究。KULG7、KULG12、KULG13与自然发酵分别命名为A、B、D和E组。
2.3 菌株生物学鉴定
分别将KULG7、KULG12与KULG13的16S rDNA序列通过NCBI数据库中BLAST进行同源性比对,并构建系统发育树。KULG7与KULG13为植物乳植杆菌(Lactobacillus plantarum)、KULG12为戊糖片球菌(Pediococcus pentosaceus)。其系统发育树如图2所示。
2.4 菌株对火腿色差的影响
色差值是评判干腌肉块品质的重要指标。由表4可知,发酵前期,4组L*均有显著差异(P<0.05),其中,自然发酵的E组L*最高,这可能是因为添加了乳酸菌的干腌肉块,Aw和水分含量减小,使其相对于自然发酵较干燥,从而亮度降低;发酵前期D组a*值显著(P<0.05)高于其他组,一方面因为亚硝酸盐的发色作用,另一方面,乳酸菌可以与亚硝酸盐进行反应产生NO,而NO可与肌红蛋白结合产生亚硝基肌红蛋白和亚硝基血红蛋白,赋予干腌肉块鲜红色,使干腌肉块的颜色更红[21]。
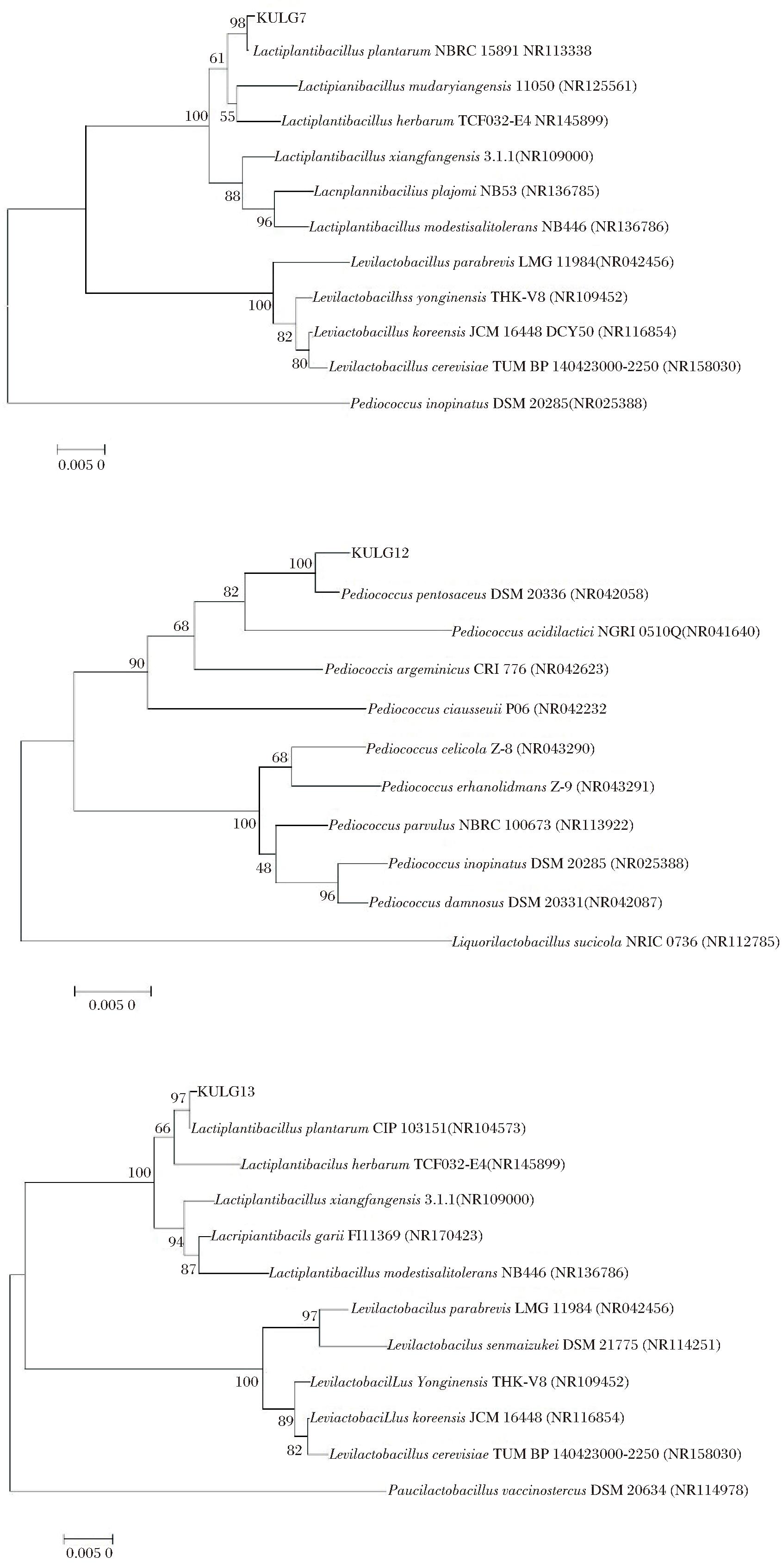
图2 菌株系统发育树
Fig.2 Phylogenetic tree of strains
表4 色差测定结果
Table 4 Results of color difference measurement
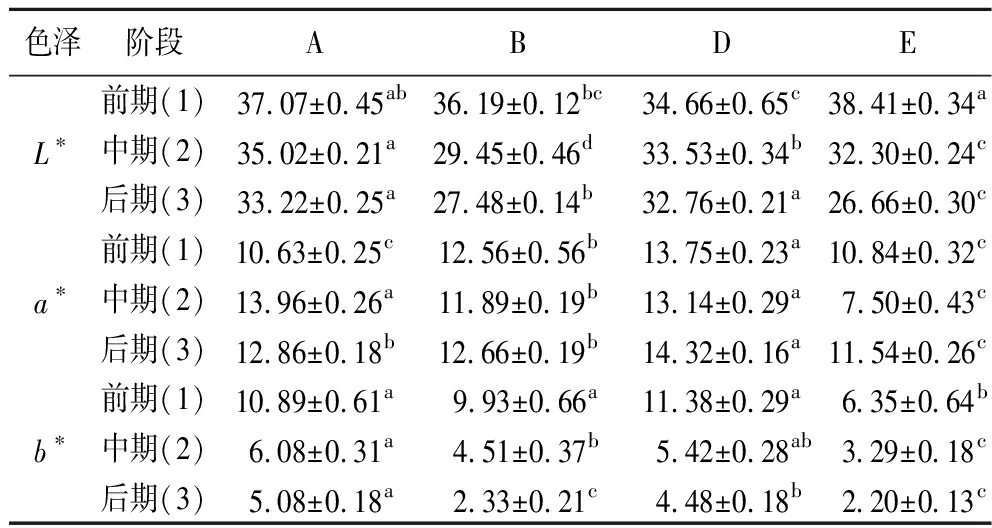
色泽阶段ABDEL∗前期(1) 37.07±0.45ab36.19±0.12bc34.66±0.65c38.41±0.34a中期(2)35.02±0.21a29.45±0.46d33.53±0.34b32.30±0.24c后期(3)33.22±0.25a27.48±0.14b32.76±0.21a26.66±0.30ca∗前期(1)10.63±0.25c12.56±0.56b13.75±0.23a10.84±0.32c中期(2)13.96±0.26a11.89±0.19b13.14±0.29a7.50±0.43c后期(3)12.86±0.18b12.66±0.19b14.32±0.16a11.54±0.26cb∗前期(1)10.89±0.61a 9.93±0.66a11.38±0.29a 6.35±0.64b中期(2)6.08±0.31a4.51±0.37b5.42±0.28ab3.29±0.18c后期(3)5.08±0.18a2.33±0.21c4.48±0.18b2.20±0.13c
注:同一行中的不同上标代表数理统计上存在显著差异(P<0.05);KULG7、KULG12、KULG13与自然发酵分别命名为A、B、D和E组(下同)。
2.5 菌株对肉块Aw的影响
Aw通常用来评价肉制品中水分自由度,通常是从高Aw的区域向低Aw区域迁移,4组肉块发酵过程中Aw变化如图3所示。
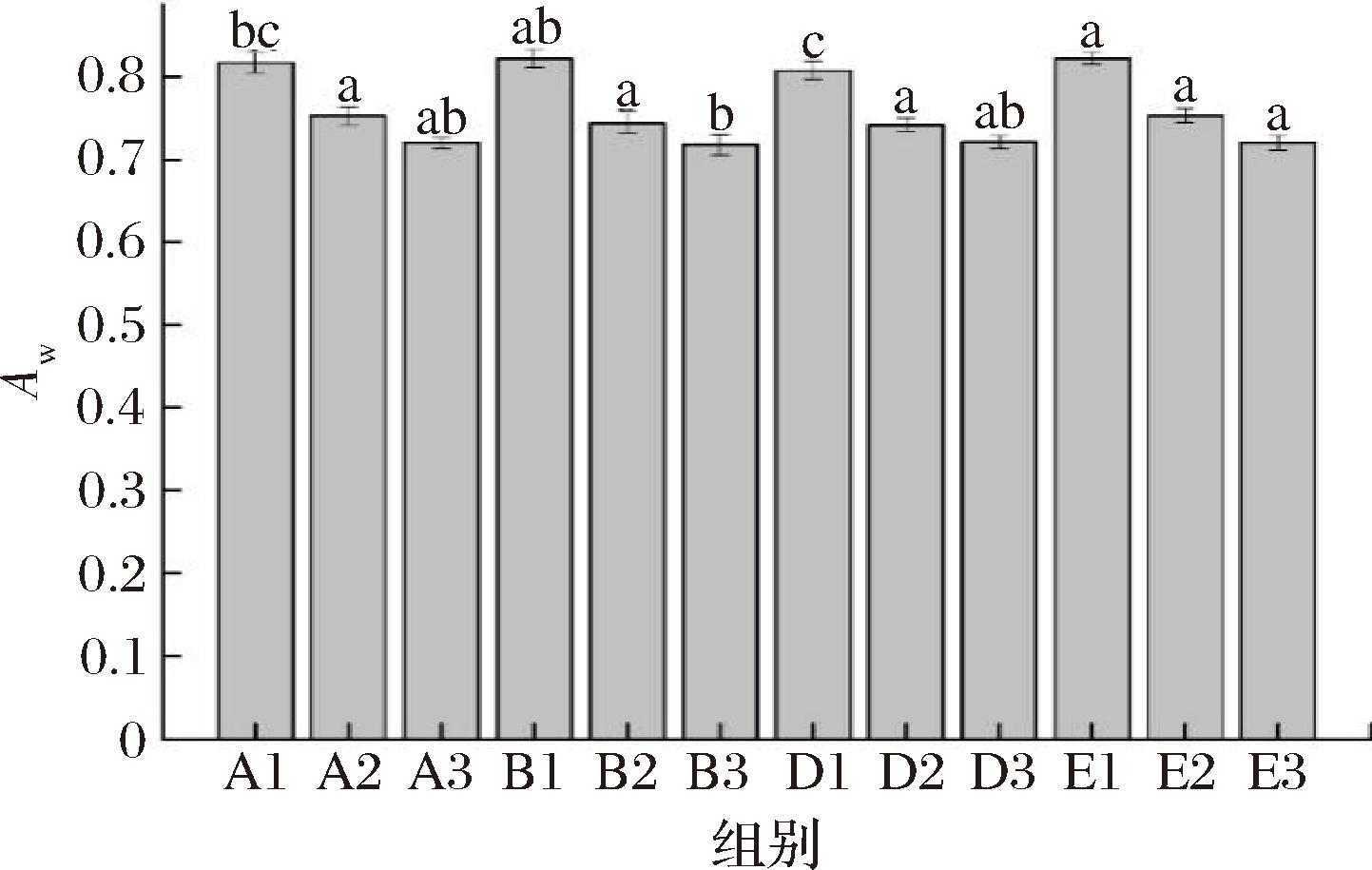
图3 水分活度测定
Fig.3 Determination of water activity
由图3可知,干腌肉块中Aw随着发酵时间延长呈下降趋势。发酵前期,A、B、D与E组的Aw分别为0.817、0.822、0.808与0.833,E组显著高于A、B和D组(P<0.05),这可能是乳酸菌的作用导致肉块pH值降低,部分蛋白质变性从而影响网络空间结构并加速水分流失,较低的Aw能够有效抑制病原微生物的生长繁殖[22],更有利于生产和保藏。发酵后期Aw相比发酵前期显著降低(P<0.05),4组样品Aw均为0.720左右。
2.6 菌株对火腿质构特性的影响
通过分析4组前、中和后期质构特性的变化,间接描述乳酸菌的作用,其结果见表5所示。
由表5可知,在干腌肉块腌制过程中,4组干腌肉块的硬度与咀嚼性均呈上升趋势,且添加乳酸菌可使得肉块硬度与咀嚼性大于自然发酵肉块,导致该现象的部分原因与水分含量有关,结合2.5节中Aw的变化可以说明该问题。另外由于乳酸菌产生的蛋白酶使肉块蛋白质变性导致硬度变大[23]。其中,在发酵中期D组硬度为464.21 N,显著高于其他组(P<0.05),说明菌株KULG13在中期作用效果明显。在干腌肉块腌制过程中,4组干腌肉块的弹性、内聚性与回复性均呈下降趋势。这说明随着发酵时间延长,干腌肉块中的肌肉在酶和微生物的作用下降解,从而导致干腌肉块的肌肉组织变松散,细胞间的作用力不断减小。
表5 质构测定结果
Table 5 Results of texture detection
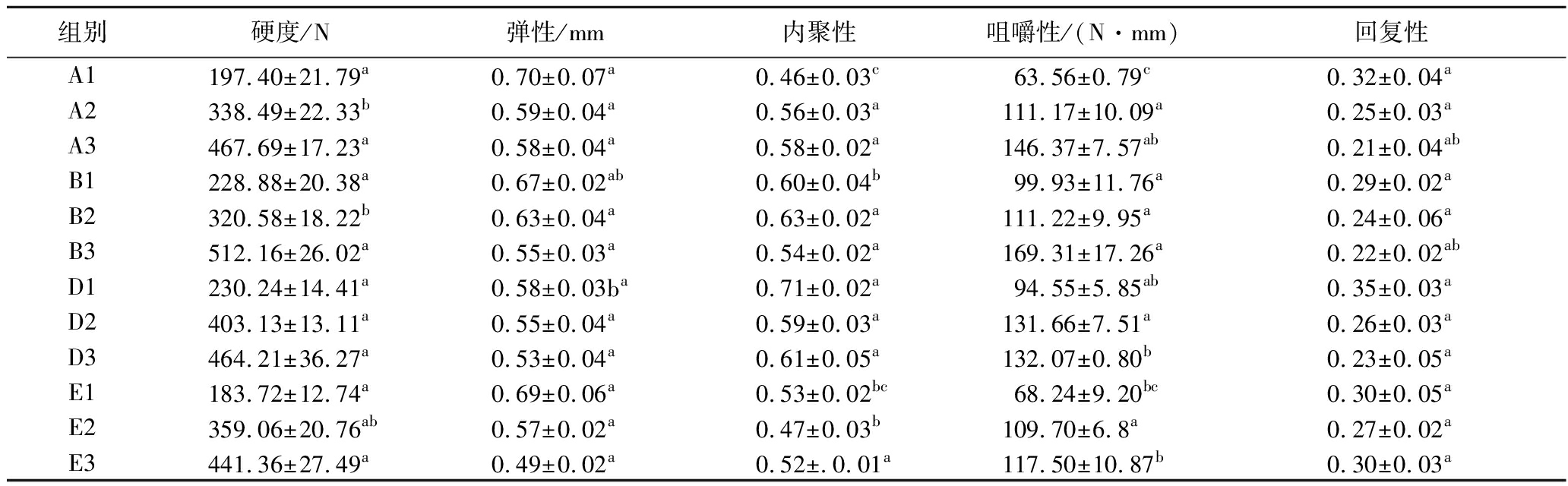
组别硬度/N弹性/mm内聚性咀嚼性/(N·mm)回复性A1197.40±21.79a0.70±0.07a0.46±0.03c63.56±0.79c0.32±0.04aA2338.49±22.33b0.59±0.04a0.56±0.03a111.17±10.09a0.25±0.03aA3467.69±17.23a0.58±0.04a0.58±0.02a146.37±7.57ab0.21±0.04abB1228.88±20.38a0.67±0.02ab0.60±0.04b99.93±11.76a0.29±0.02aB2320.58±18.22b0.63±0.04a0.63±0.02a111.22±9.95a0.24±0.06aB3512.16±26.02a0.55±0.03a0.54±0.02a169.31±17.26a0.22±0.02abD1230.24±14.41a0.58±0.03ba0.71±0.02a94.55±5.85ab0.35±0.03aD2403.13±13.11a0.55±0.04a0.59±0.03a131.66±7.51a0.26±0.03aD3464.21±36.27a0.53±0.04a0.61±0.05a132.07±0.80b0.23±0.05aE1183.72±12.74a0.69±0.06a0.53±0.02bc68.24±9.20bc0.30±0.05aE2359.06±20.76ab0.57±0.02a0.47±0.03b109.70±6.8a0.27±0.02aE3441.36±27.49a0.49±0.02a0.52±.0.01a117.50±10.87b0.30±0.03a
注:不同字母代表同一时期组间存在显著差异(P<0.05);数字1、2和3代表前中后期。
2.7 菌株对挥发性成分的影响
电子鼻是一种可以模仿人类鼻子对样品的气味进行区分的仪器[24]。肉块电子鼻雷达图和主成分分析(principal component analysis,PCA)图分别如图4和图5所示。电子鼻18个探头代表的气味见附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.040260,后附表同)。
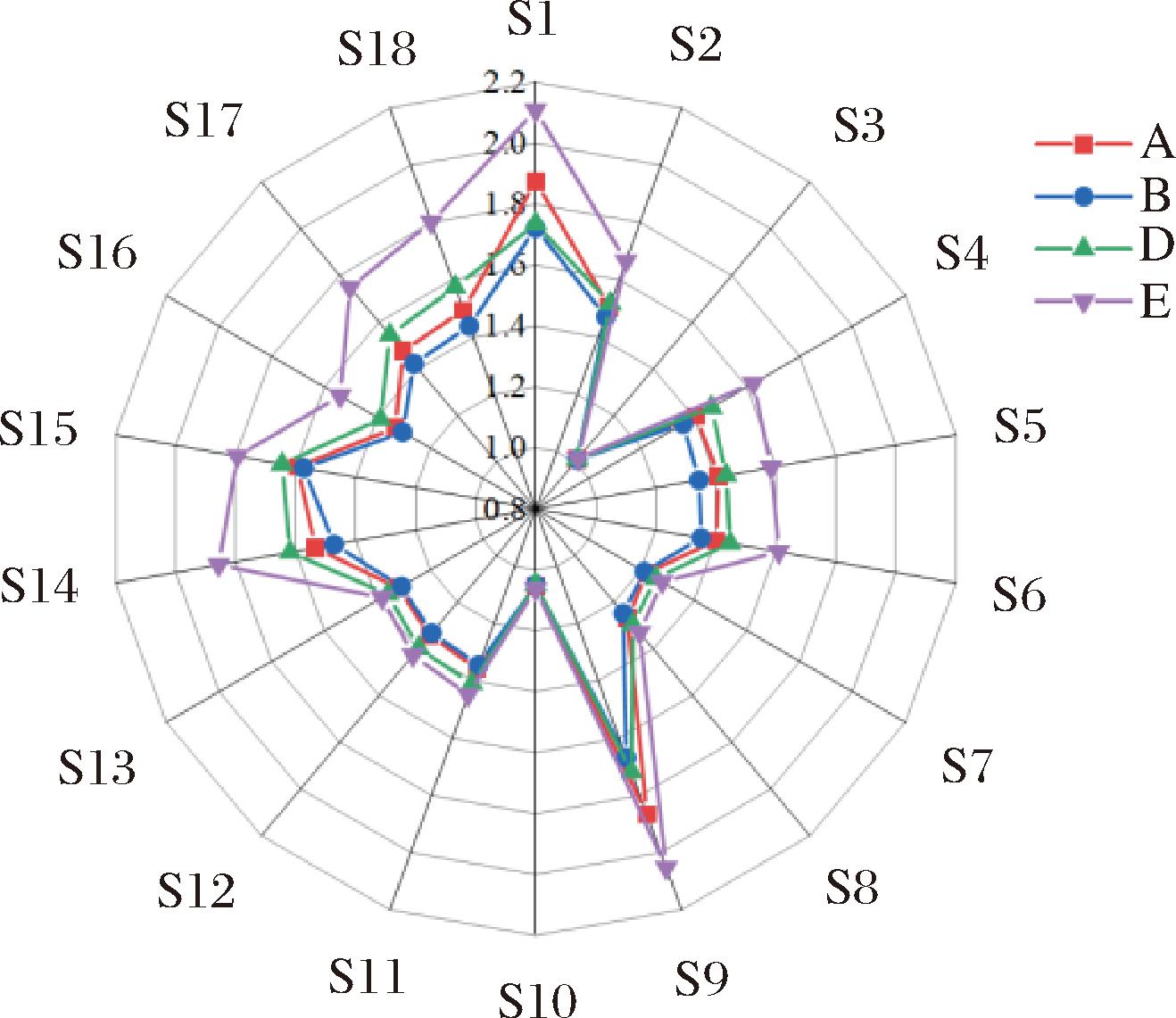
图4 电子鼻雷达图
Fig.4 Radar diagram of electronic nose
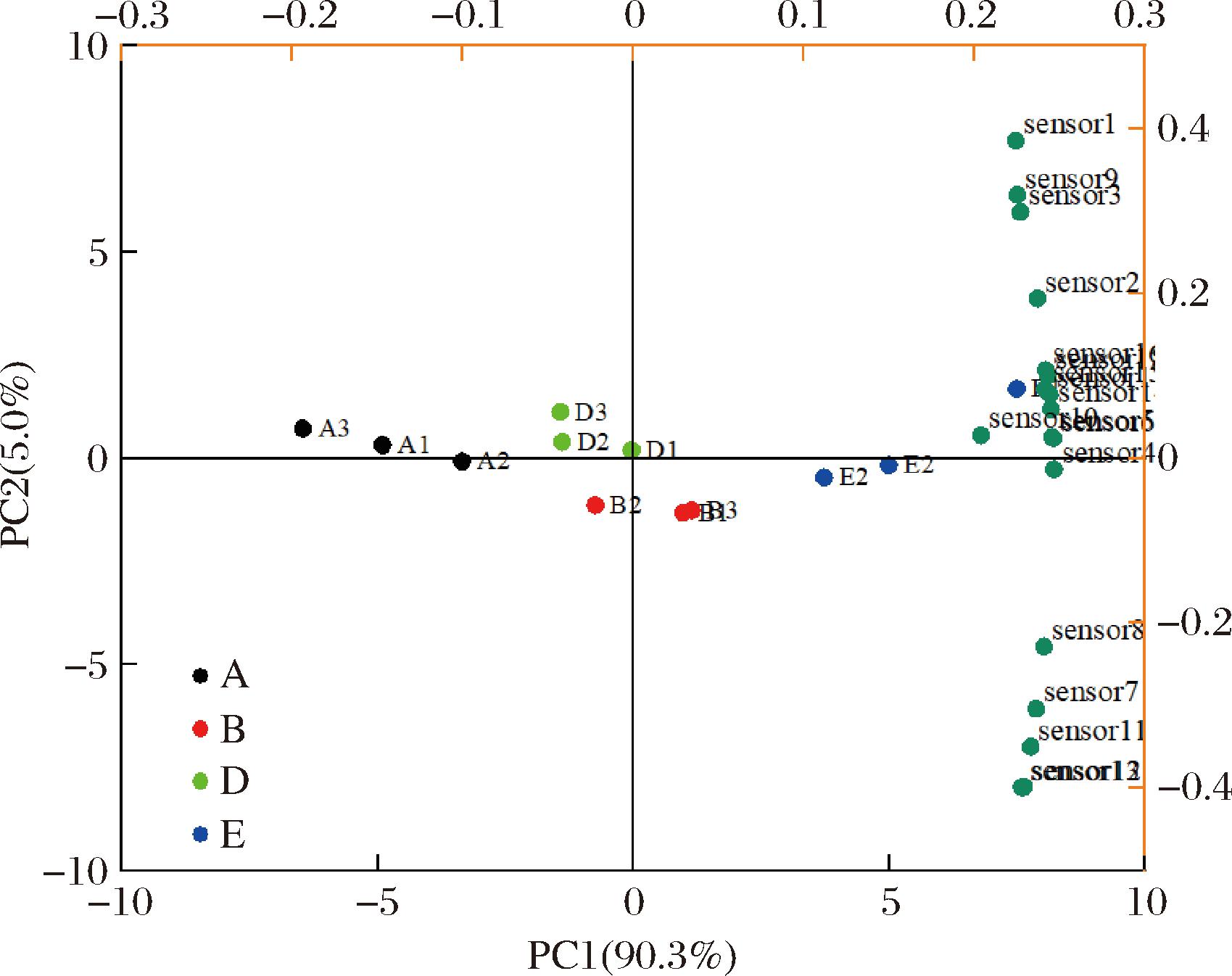
图5 电子鼻PCA图
Fig.5 PCA diagram of electronic nose
由图4可知,E组肉块的S1、S4、S5、S6、S9、S14、S15、S16、S17与S18显著高于其他3个乳酸菌组,这些探头代表了烟雾、丙烷、胺类和硫化物等,给肉块带来不愉悦的味道。乳酸菌的作用可能明显降低这些物质的含量,改善风味。
PCA反映了样品气味的可辨别性,图5为干腌肉块成品样品的气味轮廓PCA图。PC1和PC2的贡献率分别为90.3%和5.0%,累计贡献率为95.3%(>85.0%),因此,PC1和PC2包含了大量可以反映成品干腌火腿整体气味特征的信息。
2.8 干腌肉块中挥发性风味物质种类及含量
利用GC-MS测定了乳酸菌对干腌肉块在发酵过程中挥发性风味物质的影响。其结果见图6和附表2。
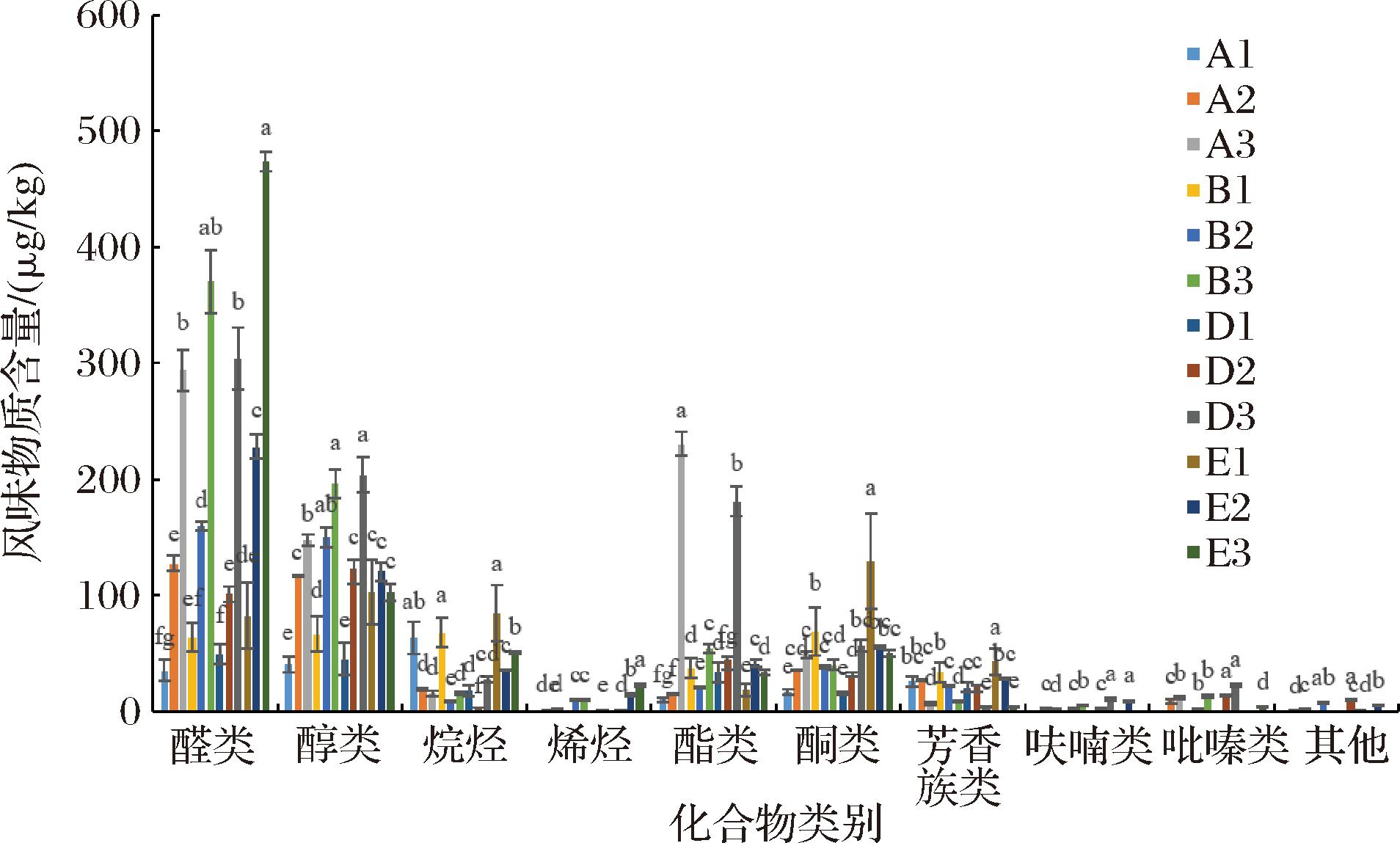
图6 不同发酵剂对肉块挥发性化合物含量的影响
Fig.6 Effects of different starter cultures on volatile compounds in meat
4组干腌肉块中共检测出64种挥发性物质,其中A组共检测53种,B组共检测出55种,D组共检测出59种,E组共检测出59种。由图6可知,醛类、醇类和酯类是4组干腌肉块中主要的风味物质。其中A~E组醛类物质占比分别为38.68%、51.88%、37.48%和63.77%,添加乳酸菌可以显著降低干腌肉块醛类物质(P<0.05),表明乳酸菌的加入降低了醛类物质的含量,在一定程度上延缓了脂肪氧化。4组酯类物质占比分别为30.32%、7.63%、22.26%和4.55%,植物乳植杆菌KULG7和KULG13显著提高了肉块中酯类物质的含量(P<0.05),可能与这2株菌明显降低pH,产生酸类物质多有关联。酯类生成需要的醇类主要来自甲基酮的还原,碳水化合物和氨基酸的代谢以及脂质的氧化[25],大部分醇类化合物具有较高的阈值,对风味的贡献不显著,有些不饱和醇类阈值较低,具有令人愉快的香气,对风味有一定影响。3株乳酸菌均可使肉块产生具有花香味的2-乙基-1-己醇,可以丰富干腌肉块的风味[25];KULG7和KULG13使肉块中的1-辛烯-3-醇含量分别为21.42 μg/kg和25.65 μg/kg,显著高于自然发酵组(P<0.05),该物质具有蘑菇香和花香[26];此外,KULG13使得肉块中的3-甲基-1-丁醇含量(10.85 μg/kg)显著高于其他3组(P<0.05),这3种物质对风味有积极贡献。与其他物质相比,烷烃类物质在干腌肉块中的含量非常少,共检测到6种,主要存在于干腌肉块发酵前期。其中3种吡嗪类化合物分别为川芎嗪、2,6-二甲基吡嗪与2,3,5-三甲基吡嗪。2,6-二甲基吡嗪与2,3,5-三甲基吡嗪具有烤土豆的气味[26],被认为是火腿中重要的风味化合物。每种挥发性化合物对干腌肉块整体气味的贡献不仅与其相对含量有关,而且受到其感官阈值影响。为了进一步确定每种风味物质对整体风味的贡献,对不同处理组样品进行了OAV分析对比,见附表3。当挥发性物质的OAV>1时,该物质即为关键风味物质。对干腌肉制品整体风味起显著贡献作用的挥发性化合物有13种,包括7种醛类(己醛、异戊醛、2-甲基丁醛、戊醛、庚醛、辛醛与壬醛)、2种醇类(庚醇和1-辛烯-3-醇)、1种酯类(正己酸乙酯)、2种酮类(2-戊酮和3-羟基-2-丁酮)和1种呋喃类(2-正戊基呋喃)。
综上可知,乳酸菌较自然发酵更有利于肉块中挥发性化合物的形成,其中KULG13的作用使得风味化合物形成情况更优,说明该菌具有作为发酵剂的潜在优势。
2.9 干腌肉块感官评价
对4组肉块进行感官评价,结果如表6所示。4组干腌肉块整体可接受度从高到低排名为:D>A>B>E。
表6 肉块感官评分 单位:分
Table 6 Sensory score of fermented meat
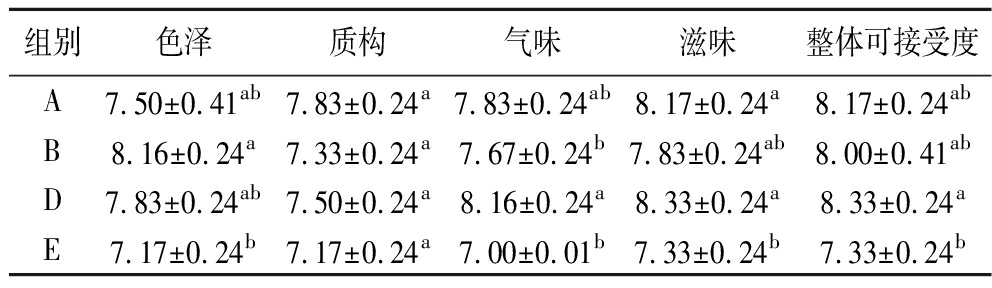
组别色泽质构气味滋味整体可接受度A7.50±0.41ab7.83±0.24a7.83±0.24ab8.17±0.24a8.17±0.24abB8.16±0.24a7.33±0.24a7.67±0.24b7.83±0.24ab8.00±0.41abD7.83±0.24ab7.50±0.24a8.16±0.24a8.33±0.24a8.33±0.24aE7.17±0.24b7.17±0.24a7.00±0.01b7.33±0.24b7.33±0.24b
在色泽上,B组(8.16分)评分较高;在质构上,A组(7.83分)评分较高;在气味和滋味上,D优于其他3组,且均高于E组,这可能是乳酸菌的作用使干腌肉块的品质得到了改善,更易于风味与滋味的形成,提升干腌肉块的可接受度。由此可见,乳酸菌KULG13的发酵性能优于KULG7与KULG12。
2.10 干腌肉块风味相似度评价
对干腌肉块的风味与优质火腿风味物质的相似度和浓度进行对比,从而评价3株乳酸菌的效果。其结果见表7和附表4。
表7 发酵肉块与宣威火腿风味物质及含量对比
Table 7 Comparison of flavor compounds and contents between fermented meat and Xuanwei ham
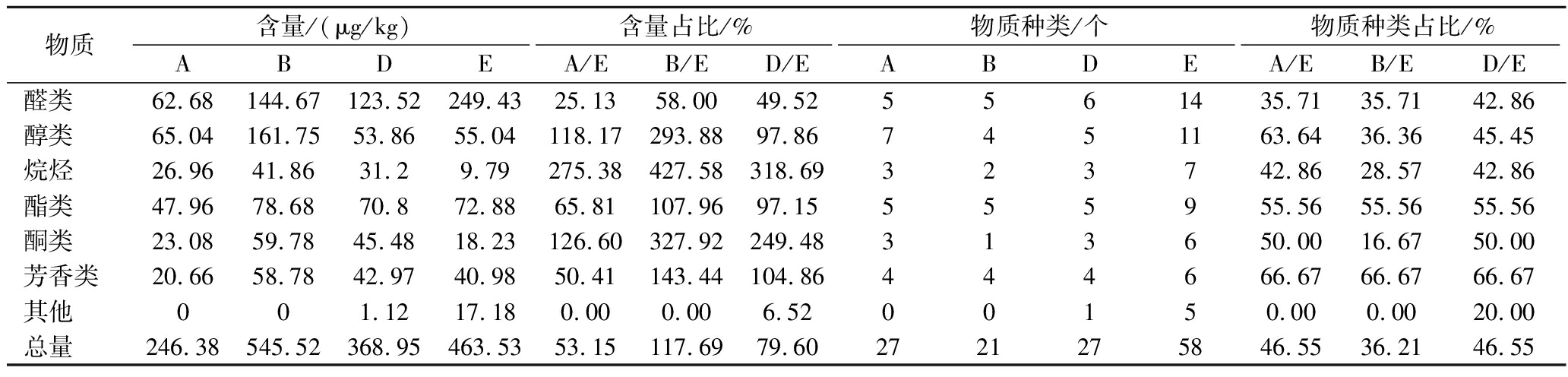
物质含量/(μg/kg)含量占比/%物质种类/个物质种类占比/%ABDEA/EB/ED/EABDEA/EB/ED/E醛类62.68144.67123.52249.4325.1358.0049.525561435.7135.7142.86醇类65.04161.7553.8655.04118.17293.8897.867451163.6436.3645.45烷烃26.9641.8631.29.79275.38427.58318.69323742.8628.5742.86酯类47.9678.6870.872.8865.81107.9697.15555955.5655.5655.56酮类23.0859.7845.4818.23126.60327.92249.48313650.0016.6750.00芳香类20.6658.7842.9740.9850.41143.44104.86444666.6766.6766.67其他001.1217.180.000.006.5200150.000.0020.00总量246.38545.52368.95463.5353.15117.6979.602721275846.5536.2146.55
由表7可知,3株乳酸菌KULG7、KULG12和KULG13发酵肉块的风味物质中含有醛类、醇类、烷烃、酯类、酮类和芳香类六大类,其中KULG13还可以产生其他风味物质。KULG7、KULG12和KULG13相对于优质宣威火腿的物质含量分别为53.15%、117.39%和79.60%,虽然KULG12的占比最高,但其发酵肉块的醇类和酮类的含量显著高于对照组(P<0.05),过高的醇和酮类物质含量导致感官气味上接受程度低;KULG7、KULG12和KULG13分别有27、21和27种物质与对照组一致,分别占46.55%、36.21%和46.55%。虽然KULG7和KULG13在物质种类占比上一致,但二者在物质浓度占比相比较,KULG13显著优于KULG7。
3 结论
本研究从宣威优质火腿筛选出了9株乳酸菌,其中3株可能作为发酵剂的菌株为KULG7、KULG12和KULG13,其中KULG7和KULG13为植物乳植杆菌,KULG12为戊糖片球菌,将3株乳酸菌分别用于肉块发酵。结果表明,与KULG12和KULG13两株乳酸菌发酵肉块和自然发酵的肉块相比,KULG13可以显著提高肉块的a*值和硬度、降低Aw和负面风味化合物的形成以及提高肉类风味化合物的浓度(P<0.05),KULG13发酵肉块与优质宣威火腿相比,其风味物质含量占比为79.60%,物质种类占比为46.55%,显著高于KULG7和KULG12的作用,结合感官评价结果,认为KULG13最有可能作为产生宣威火腿风味的潜在发酵剂。
[1] DE L AGÜERO N, FRIZZO L S, OUWEHAND A C, et al.Technological characterisation of probiotic lactic acid bacteria as starter cultures for dry fermented sausages[J].Foods, 2020, 9(5):596.
[2] CANDOGAN K, KARTIKA S, WARDLAW F B, et al.Type of bacterial starter culture, aging and fermentation effects on some characteristics of inoculated beef sausages[J].European Food Research and Technology, 2008, 227(6):1651-1661.
[3] 刘柳, 刘学文, 张鑫燚.发酵肉传统制作工艺参数优化研究[J].食品工业科技, 2008, 29(1):202-204.
LIU L, LIU X W, ZHANG X Y.Study on optimization of traditional processing parameters of fermented meat[J].Science and Technology of Food Industry, 2008, 29(1):202-204.
[4] PETROVA I, AASEN I M, RUSTAD T, et al.Manufacture of dry-cured ham:A review.Part 1.Biochemical changes during the technological process[J].European Food Research and Technology, 2015, 241(5):587-599.
[5] 孔维严. 宣威火腿工艺及当代发展概况调查报告[D].重庆:重庆师范大学, 2016.
KONG W Y.Investigation report on Xuanwei ham technology and its contemporary development[D].Chongqing:Chongqing Normal University, 2016.
[6] LI C L, MORA L, GALLEGO M, et al.Evaluation of main post-translational modifications occurring in naturally generated peptides during the ripening of Spanish dry-cured ham[J].Food Chemistry, 2020, 332:127388.
[7] SUN Q X, CHEN Q, LI F F, et al.Biogenic amine inhibition and quality protection of Harbin dry sausages by inoculation with Staphylococcus xylosus and Lactobacillus plantarum[J].Food Control, 2016, 68:358-366.
[8] HUGHES M C, KERRY J P, ARENDT E K, et al.Characterization of proteolysis during the ripening of semi-dry fermented sausages[J].Meat Science, 2002, 62(2):205-216.
[9] CHEN Q, KONG B H, SUN Q X, et al.Antioxidant potential of a unique LAB culture isolated from Harbin dry sausage:in vitro and in a sausage model[J].Meat Science, 2015, 110:180-188.
[10] 米瑞芳, 陈曦, 戚彪, 等.乳杆菌发酵剂对酸肉挥发性风味成分的影响[J].肉类研究, 2018, 32(4):48-55.
MI R F, CHEN X, QI B, et al.Effect of Lactobacillus starter cultures on the volatile flavor components of sour meat[J].Meat Research, 2018, 32(4):48-55.
[11] 吴双慧, 杨梓垚, 牛茵, 等.复配发酵剂对发酵香肠的品质及挥发性风味的影响[J].食品工业科技, 2024, 45(5):126-133.
WU S H, YANG Z Y, NIU Y, et al.Effects of mixed starter culture on quality and volatile flavor of fermented sausages[J].Science and Technology of Food Industry, 2024, 45(5):126-133.
[12] LIU R, MA Y, CHEN L, et al.Effects of the addition of leucine on flavor and quality of sausage fermented by Lactobacillus fermentum YZU-06 and Staphylococcus saprophyticus CGMCC 3475[J].Frontiers in Microbiology, 2022, 13:1118907.
[13] 孙庆申, 王钰涵, 韩德权, 等.酸菜中具有抑菌活性乳酸菌的分离鉴定及其产细菌素特性[J].食品科学技术学报, 2022, 40(4):64-73.
SUN Q S, WANG Y H, HAN D Q, et al.Isolation and identification of lactic acid bacteria with antibacterial activity in pickles and their bacteriocin production characteristics[J].Journal of Food Science and Technology, 2022, 40(4):64-73.
[14] 蒋云升, 潘明, 汪志君, 等.如皋火腿用霉菌性表面涂膜发酵剂的应用研究[J].食品与发酵工业, 2007, 33(7):81-84.
JIANG Y S, PAN M, WANG Z J, et al.The study of application of fermentation on the surface of Rugao ham[J].Food and Fermentation Industries, 2007, 33(7):81-84.
[15] 李佳林, 梁超, 黄青.均匀交变磁场对鲫鱼肉冷冻保鲜效果的影响[J].安徽大学学报(自然科学版), 2023, 47(6):37-41.
LI J L, LIANG C, HUANG Q.Effect of uniform alternating magnetic field on freezing and freshness-keeping of crucian carp meat[J].Journal of Anhui University (Natural Science Edition), 2023, 47(6):37-41.
[16] W![]() SIERSKA E, PALKA K, BOGDAÉSKA J, et al.Sensory quality of selected raw ripened meat products[J].Acta Scientiarum Polonorum.Technologia Alimentaria, 2013, 12(1):41-50.
SIERSKA E, PALKA K, BOGDAÉSKA J, et al.Sensory quality of selected raw ripened meat products[J].Acta Scientiarum Polonorum.Technologia Alimentaria, 2013, 12(1):41-50.
[17] TOLEDANO A, JORDANO R, L PEZ C, et al.Proteolytic activity of lactic acid bacteria strains and fungal biota for potential use as starter cultures in dry-cured ham[J].Journal of Food Protection, 2011, 74(5):826-829.
PEZ C, et al.Proteolytic activity of lactic acid bacteria strains and fungal biota for potential use as starter cultures in dry-cured ham[J].Journal of Food Protection, 2011, 74(5):826-829.
[18] LI C, ZOU Y L, LIAO G Z, et al.Identification of characteristic flavor compounds and small molecule metabolites during the ripening process of Nuodeng ham by GC-IMS, GC-MS combined with metabolomics[J].Food Chemistry, 2024, 440:138188.
[19] VERPLANKEN K, WAUTERS J, VERCRUYSSE V, et al.Sensory evaluation of boar-taint-containing minced meat, dry-cured ham and dry fermented sausage by a trained expert panel and consumers[J].Food Chemistry, 2017, 233:247-255.
[20] 包媛媛, 林奇, 黄艾祥.传统宣威火腿的加工工艺[J].肉类工业, 2007(7):16-18.
BAO Y Y, LIN Q, HUANG A X.Processing technology of traditional Xuan-Wei ham[J].Meat Industry, 2007(7):16-18.
[21] HU Y Y, LI Y J, LI X G, et al.Application of lactic acid bacteria for improving the quality of reduced-salt dry fermented sausage:Texture, color, and flavor profiles[J].LWT, 2022, 154:112723.
[22] KATO T, MATSUDA T, TAHARA T, et al.Effects of meat-conditioning and lactic fermentation on pork muscle protein degradation[J].Bioscience, Biotechnology, and Biochemistry, 1994, 58(2):408-410.
[23] WANG D X, CHENG F, WANG Y, et al.The changes occurring in proteins during processing and storage of fermented meat products and their regulation by lactic acid bacteria[J].Foods, 2022, 11(16):2427.
[24] DU H Z, CHEN Q, LIU Q, et al.Evaluation of flavor characteristics of bacon smoked with different woodchips by HS-SPME-GC-MS combined with an electronic tongue and electronic nose[J].Meat Science, 2021, 182:108626.
[25] WANG J, AZIZ T, BAI R X, et al.Dynamic change of bacterial diversity, metabolic pathways, and flavor during ripening of the Chinese fermented sausage[J].Frontiers in Microbiology, 2022, 13:990606.
[26] LIU D Y, BAI L, FENG X, et al.Characterization of Jinhua ham aroma profiles in specific to aging time by gas chromatography-ion mobility spectrometry (GC-IMS)[J].Meat Science, 2020, 168:108178.