酒曲是酿造传统白酒重要的原料之一,素有“曲为酒之骨”之美誉。酒曲是以粮谷为主要原料,通过自然接种、开放式培养而成的物系、酶系、菌系三者共存的糖化发酵剂[1-2]。白酒发酵实质是多种微生物协同作用的过程,而酒曲是白酒发酵中微生物主要的来源,其质量对酿造白酒品质的形成具有重要的意义[3-4]。
绿衣红心观音土曲为湖北、湖南酿造清香型白酒的酿造用曲,其是由种曲接种制作而成[5],种曲质量的好坏决定着绿衣红心观音土曲的质量。种曲形状为圆饼状,原料为大米和油糠,其厚度为1.5~3.0 cm,直径8.0~10.0 cm,外观白色或淡黄色,多有褶皱,成曲闻之无异味[6]。种曲的质量尚无统一标准,首先由于种曲在开放生产时,受环境温湿度变化、人工操作水平等因素影响较多。其次,生产的种曲质量评价仍以感官为主,理化为辅[7-9],而种曲表面形成的一层褶皱常被技术人员用于种曲质量的评价指标。只有褶皱达到一定面积时,种曲的质量才符合要求,但对种曲褶皱具体形成机理及种曲质量优化,目前尚无系统研究。
在其他酿造酒曲中也存在不同的外在特征用于判断酒曲质量的情况,如质量较好的清香大曲红心曲中,曲心会出现红色部分,当温度控制不好,红心曲会出现异味,并伴随严重黑圈或黑道,会影响白酒发酵,而产生红心的原因正是因为有益微生物红曲霉的作用[10]。青稞酒满天星酒曲,在曲块表皮有色泽一致的白色斑点酵母菌落,曲香浓郁扑鼻;槐瓤曲因曲心区域有灰黄色或黄色如槐花的斑块而得名,大曲断面茬口周围颜色呈麦仁青色,中间部位呈金黄色或淡黄色,曲香清香纯正。目前部分研究人员对酒曲的外在特征进行了一定研究,发现微生物是影响酒曲外在特征的主要因素。如DONG等[11]发现酱酒的黑色、黄色和白色大曲的优势菌分别为克罗彭斯特菌属、枝芽胞杆菌属和芽孢菌属,并且克罗彭斯特菌属是影响这些大曲颜色形成的关键细菌。YANG等[12]发现高温大曲群落中特定微生物是促进群落在特定环境下向相应稳态转换的内在因素,枝芽胞杆菌属、构巢曲霉、枯草芽孢杆菌和大洋芽孢杆菌可以调控大曲五元杂环氨基酸代谢,从而引起大曲微生态分化的特定功能微生物,进而形成酒曲三色的差异。因此,酒曲的外观表型是酒曲微生物群落分布形态的外在表现,而微生物群落的组成和代谢将直接影响酒曲的质量,从而影响白酒的质量。
本文通过对湖北清香型酒曲母曲-种曲褶皱中的微生物进行筛选分离,借助体式显微观察、分子生物学技术和菌株原位生产验证,确定了引起种曲生产褶皱的菌株,并对起褶机理进行了探究。通过最适添加量生产试验,明确了褶皱对种曲、土曲和酿造原酒质量的影响,本研究为酒曲的特殊形态研究提供了试验思路和方法,为提升酒曲质量和白酒品质提供了理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
大米、油糠,阳新白沙海信米厂;琼脂、葡萄糖、酒石酸钾钠、氢氧化钠、硫酸铜,国药集团化学试剂有限公司。
1.1.2 培养基
PDA培养基:200 g土豆去皮后切成小块,加水煮沸20 min,过滤后,加入20 g葡萄糖,15 g琼脂粉,以蒸馏水定容至1 000 mL,pH值自然。
1.2 仪器与设备
MJ-250BSH-Ⅱ霉菌培养箱,上海新苗医疗器械制造有限公司;YXQ-LS-75SII高压灭菌锅,上海博迅实业有限公司医疗设备厂;SW-CJ-1B净化工作台,苏州智净净化设备有限公司;5804R离心机,德国Eppendorf 公司;JJ6000电子天平,常熟市双杰测试仪器厂;STEMI508-蔡司体式显微镜,卡尔蔡司股份有限公司。
1.3 实验方法
1.3.1 样品菌种分离与计数
准确称取样品5 g加入95 mL无菌水中,150 r/min振荡20 min,配制成菌悬液。分别取1 mL混合液至盛有9 mL灭菌水的试管中,依次制作成10-1、10-2、10-3和10-4梯度菌液,取200 μL的不同稀释液涂布PDA培养基平板中,放置于30 ℃培养,2~5 d后观察计数。
1.3.2 体式显微镜观察试验
用镊子挑取种曲表皮样品约1 mm×1 mm大小,置于体式显微镜操作台上,调节焦距进行形态观察,主要记录其样品显微结构、质地和菌丝疏密情况等,记录并拍照[13]。在显微镜头中找取单根菌丝,使用尖头镊子,进行挑取,将挑取菌丝转移至无菌培养基中,置于培养箱中进行培养活化。
1.3.3 形态学观察
酵母菌株形态学观察:将分离纯化的酵母接种到PDA培养基上,30 ℃培养2~3 d,滴一滴无菌水在载玻片上,刮取少量菌体,在水滴中顺时针转圈,盖上盖玻片,在显微镜下观察酵母细胞形态和出芽情况,记录并拍照。
霉菌菌株形态学观察:取无菌盖玻片,以倾斜约45°方式插入PDA培养基中,每皿插入3~4片,30 ℃培养箱中倒置培养5 d,取盖玻片在显微镜下观察包括菌丝颜色,粗细及形态、孢子形态在内的显微形态特征,记录并拍照[14]。
1.3.4 分子生物学鉴定
真菌模板的制备:使用土壤中微生物基因提取试剂盒(DP336-02 离心柱型)提取法提取模板DNA。
PCR反应体系为30 μL:PremixTaq(EX Taq Version 2.0)15 μL,DNA模板2 μL,引物1 μL,采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′),ddH2O 12 μL。PCR扩增程序为:95 ℃ 5 min;95 ℃ 45 s,52 ℃ 45 s,72 ℃ 110 s,循环35次;72 ℃ 10 min,4 ℃保温。琼脂糖凝胶电泳检测PCR产物,送往武汉华大基因科技股份有限公司完成测序。测序结果与NCBI数据库中已知序列进行BLAST比对。采用构建系统发育树软件MEGA 6,与GenBank数据库中相关属种基因序列进行系统发育分析。
1.3.5 种曲制备
米粉与水混合,水分控制在43%~46.5%,捏成直径约6 cm的曲饼,培养室温度控制在28~32 ℃,入箱约16 h后,检查箱内曲坯温度,入箱后20~24 h,曲坯品温升至33~35 ℃时,查看种曲表面收汗起皱纹,此时即可开箱。将曲折子抬入烘房中烘干,烘干48 h,烘房温度控制在35~38 ℃。烘干后的种曲搓去底部的谷壳,于干燥通风处贮存。
1.3.6 糖化力与发酵力检测
糖化力的测定方法参考郑东影等[15]的二硝基水杨酸(dinitrosalicylic acid,DNS)法,具体为将称好的1.00 g样品接种至100 g蒸熟的米饭中,盖上盖子,置于30 ℃培养箱中培养24 h。称取10.0 g糖化醪,于250 mL三角瓶中,加无菌水100 mL,在20 ℃摇床上140 r/min摇30 min,浸泡30 min后取上清液备用。吸取斐林试剂甲、乙液各5.0 mL置于150 mL锥形瓶中,加入待测上清液1.0 mL,再用滴定管加入适量0.1%葡萄糖标准液,摇匀,在电炉上加热,使其在2 min内沸腾,沸腾10 s后,立即以先快后慢的速度滴入0.1%葡萄糖标准液,并保持溶液沸腾状态,待溶液颜色变浅时,以1滴/2 s速度滴定,直至蓝色消失即为终点。此滴定应在1 min内完成。记录沸腾前后共耗用葡萄糖液体积(mL)。
发酵力的测定方法:将上述糖化醪装入1 000 mL三角瓶中,加水300 mL,摇匀后塞上棉塞,置于30 ℃培养箱中培养72 h。将发酵醪倒入2 000 mL平底蒸馏瓶中蒸馏(沸腾后蒸馏时间应控制在30~40 min内完成),接取100 mL馏出液。将上述馏出液倒入洁净、干燥的100 mL量筒中,静置数分钟,待气泡消失后,放入洗净、擦干的酒精计,再轻轻按一下,静止后,水平观测与弯月面相切的刻度示值,同时插入温度计记录温度,根据测得的温度和酒精计示值,查表换算成20 ℃时的酒精度,酒精度数值即为发酵率,单位%。
1.3.7 绿衣红心观音土曲制备
将观音土∶油糠∶种曲按照质量比60∶20∶20进行混合,加水使混合料中的含水量为36%,人工捏成直径为8 cm的球形曲坯。将捏好的曲坯放置在曲房箱床中,表面盖上一层竹垫,控制培养室的温度为27 ℃,当曲坯品温升至30 ℃以上时,揭开竹垫,转入曲架上进行下步培养,集中培菌期时间为23 h。将得到曲坯按照放置在上下间隔13 cm的钢制曲架表面,曲坯间间隔2~3 cm,控制培养室的温度为30 ℃,当曲坯表面逐渐长满绿衣,曲心含有红色时,停止培养,分散培菌期时间为7 d,将培养好的曲坯,从曲架上取下,放在培养室中间平板上,控制培养室的温度在35 ℃,培养24 h,曲坯成熟期结束时曲球水份含量小于10%。
1.3.8 酿造小试实验
糯高粱经65 ℃水浸泡24 h,浸泡好的粮食放入灭菌锅中进行初蒸(115 ℃,10 min)、焖粮(100 ℃,5 min)、复蒸(111 ℃,10 min)。将复蒸好的粮食冷却至30 ℃,分装进12号自封袋中,每袋1.05 kg,按干粮质量1 %的下曲量加入绿衣红心观音土曲,将曲与粮食搅拌均匀,放入培养箱在30 ℃下开口糖化24 h。糖化完成后,按照单个样品500 g的量称取酒糟,将糖化好的粮食与酒糟按质量比为1∶1进行混合,混匀后装入气体采样袋,密封,抽真空,放入培养箱于30 ℃发酵7 d,7 d后将发酵好的酒醅装入特制三角烧瓶中进行蒸馏,取前100 mL酒样进行色谱检测。
1.3.9 气相色谱数据检测
准确移取1 mL酒样于2 mL样品瓶中,加入10 μL内标使用液[叔戊醇(IS1):17 028.1 mg/L,乙酸正戊酯(IS2):16 864 mg/L,2-乙基己醇(IS3):12 104.2 mg/L],盖上瓶盖,摇匀,采用气相色谱法测定原酒中各成分含量。色谱条件为:Agilent 7890A气相色谱仪,检测器FID,CP WAX毛细管色谱柱(50 m×0.2 μm×0.25 mm);升温程序:柱温40 ℃保持8 min,以5 ℃/min升至150 ℃;进样口温度250 ℃,检测器温度260 ℃,空气、氢气流速比300∶30,载气为氮气,分流比30∶1,柱流量1.0 mL/min;进样方式:自动进样。
2 结果与分析
2.1 不同感官种曲菌落数量
选取同期生产的褶皱完好和无褶皱的种曲作为研究对象,对不同表观的种曲样品进行稀释涂布分离,微生物统计结果如图1和表1所示。
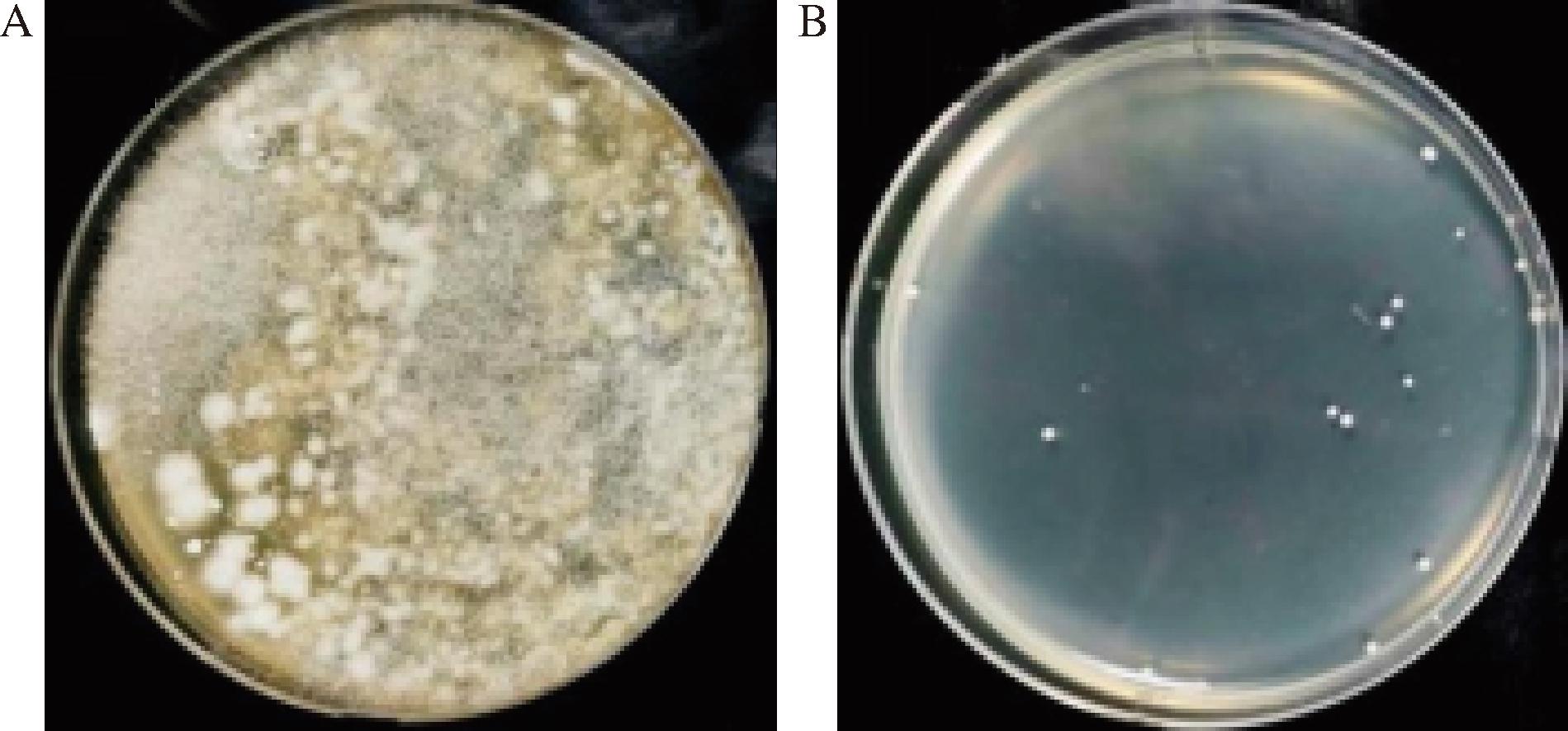
A-褶皱完好的种曲样品;B-无褶皱的种曲样品
图1 不同种曲样品平板涂布分离结果
Fig.1 Separation results of different Zhongqu samples based on plate separation
表1 不同种曲样品微生物分离计数结果 单位:CFU/g
Table 1 Microbial separation and counting results of different Zhongqu samples

种曲疑似细菌疑似酵母疑似霉菌褶皱种曲 3.05×1061.20×1061.00×105无褶皱种曲1.50×105——
注:—表示无数据。
分离结果表明,不同感官种曲的表皮中包含的微生物的种类与数量存在显著差异,褶皱完好的种曲中的微生物数量明显多于无褶皱种曲中的微生物,褶皱完好的种曲中存在大量单一的疑似霉菌、疑似酵母和疑似细菌;无褶皱种曲中只有较少的疑似细菌。即不同感官种曲中的主要微生物区别为疑似霉菌和疑似酵母,分别编号为M1和J1。
2.2 不同感官种曲显微形态差异
不同褶皱感官种曲表皮其细微特征肉眼不易识别,因表皮质地较厚实,不透光,常规光学显微镜无法进行显微观察,表皮微性状鉴别采用体式显微镜,可清楚地观察到种曲表皮的表面、断面等细微特征,具有简单、快速、直观等特点[16]。将样品置于体式显微镜下观察,进行显微挑取操作,挑取单根菌丝,直径约为15 μm,将单根菌丝转移至无菌的PDA平板中,进行培养活化,结果如图2所示。
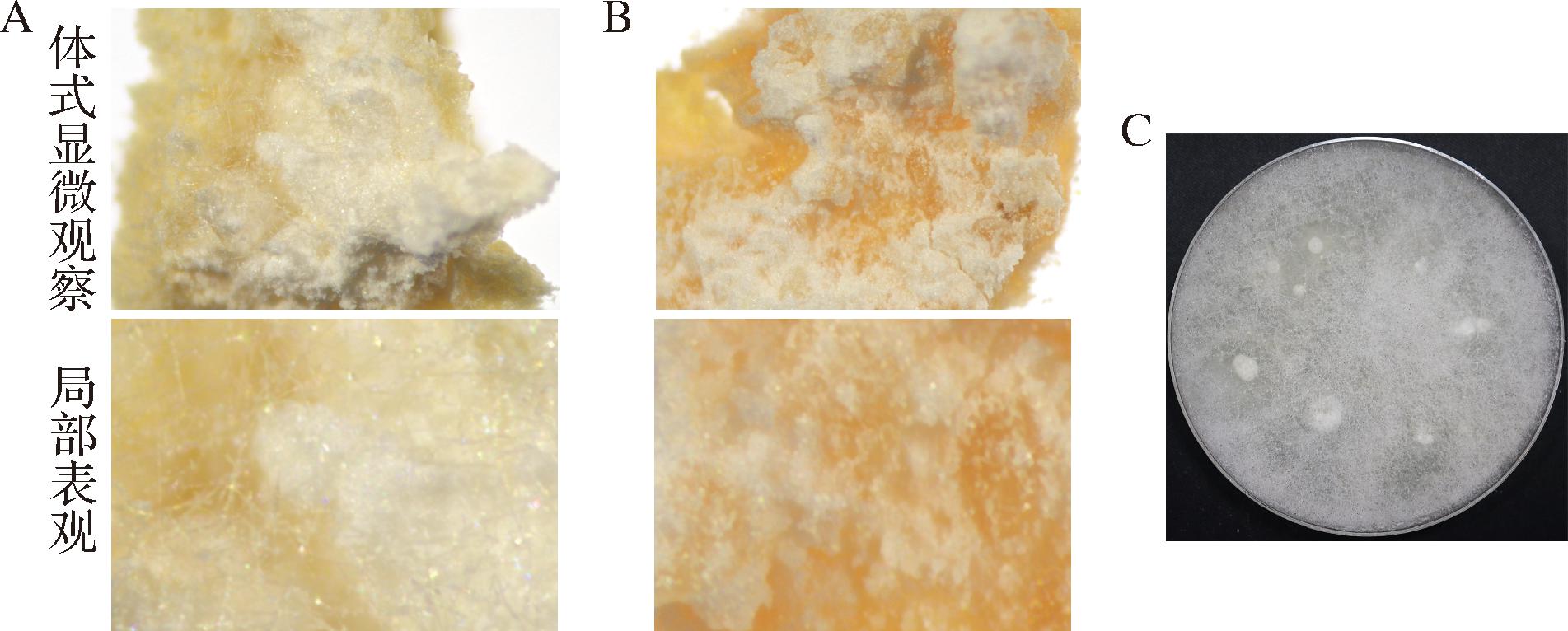
A-褶皱完好的种曲样品;B-没有褶皱的种曲样品;C-挑选菌丝培养活化的菌落形态
图2 不同种曲样品表皮局部显微观察及菌丝分离培养的菌落形态
Fig.2 Localized microscopic observation of different Zhongqu samples and colony morphology
体式显微镜观察结果显示,褶皱完好的种曲表皮布满了白色菌丝,米粉培养基的结构相对较松散;没有褶皱的种曲表皮未见明显的菌丝,且米粉培养基的结构较为致密。通过体式显微镜挑取褶皱较好的种曲表皮菌丝,进行分离纯化培养,菌落形态如上图2-C所示,标记为疑似霉菌M2。
2.3 形态学鉴定
为探究褶皱形成的原因,选取前期实验室从种曲和土曲样品中分离得到的6株霉菌,包括单孢共头霉(Syncephalastrum monosporum)M3,戴尔根霉(Rhizopus delemar)M4,黄曲霉(Aspergillus flavus)M11,横梗霉(Lichtheimia ramosa)M12,米根霉(Rhizopus oryzae)M15,棒曲霉(Aspergillus clavatus)M18[17]与本次研究中筛选得到疑似酵母菌J1,疑似霉菌M1和M2共同进行对比研究,探究其菌落生长情况和菌丝形态等差异。
疑似酵母菌J1在PDA固体培养基上的菌落形态如图3所示,为淡黄色,菌落隆起无光泽,边缘整齐;显微形态下:单个细胞为球形或短矩圆形,有假菌丝,初步确认为酵母菌。
种曲在培养24 h开始出现褶皱,故取上述8株霉菌菌株点接于PDA平板中央,同等条件下培养24 h后,测量各菌株蔓延区域的直径,直径越大表明霉菌生长速度越快,结果如菌落形态图3所示:8株霉菌的生长速度快慢依次为:M4(8.50 cm)>M2(5.11 cm)≈M15(5.03 cm)≈M1(5.00 cm)>M3(2.08 cm)>M11(1.43 cm)≈M12(1.40 cm)>M18(0.95 cm)。其中,戴尔根霉M4生长速度最快,经过24 h生长,已经覆盖整个平板。而R.oryzae M15、疑似霉菌M1和M2的生长速度相当,慢于R.delemar M4。S.monosporum M3生长速度,再次之。
观察各菌株在显微形态下的菌丝生理结构、粗细、内容物等情况,如图3的显微形态所示。根据显微镜软件附带的比例尺,在100倍物镜下估算菌株菌丝直径大小,各霉菌菌丝粗细依次为:M15≈M1≈M2(12 μm)>M3(11 μm)>M4(9 μm)>M12(7 μm)>M18(4 μm)>M11(3 μm),可以明显看出R.oryzae M15、疑似霉菌M1、疑似霉菌M2和S.monosporum M3的菌丝较其霉菌的菌丝粗壮,且这4株菌丝细胞内充满了内容物,而其他霉菌菌丝内填充物较少或无。R.oryzae M15、疑似霉菌M1、疑似霉菌M2、A.flavus M11和A.clavatus M18菌丝中具有横隔膜结构,可使菌丝更“坚固强劲”。通过菌落形态和显微形态观察发现R.oryzae M15、疑似霉菌M1和疑似霉菌M2较为相似,推测M15、M1和M2为同一种霉菌。

图3 菌株菌落形态与显微形态(10×100)
Fig.3 Colony morphology and microscopic morphology of strains (10×100)
2.4 分子生物学鉴定结果分析
提取上述疑似霉菌M1、疑似酵母J1和疑似霉菌M2的菌株DNA,作为模板,进行PCR扩增,经琼脂糖凝胶电泳检测PCR产物,送往华大基因有限公司进行测序,测序结果在NCBI库当中进行Blast比对分析,并使用MEGA 11软件进行系统发育树构建,结果如图4所示。
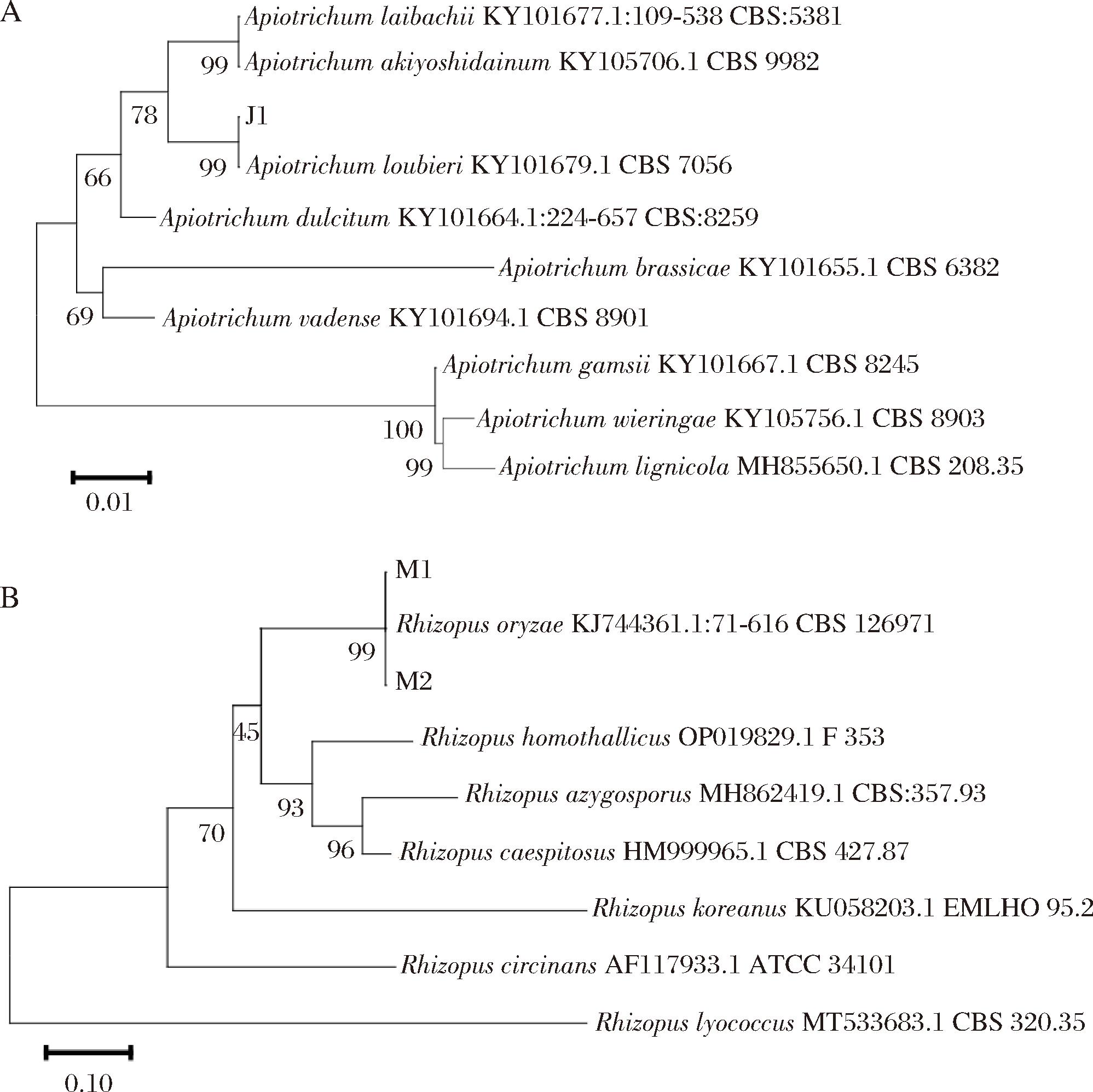
A-疑似酵母J1;B-疑似霉菌M1和M2
图4 基于ITS基因菌株的系统发育树
Fig.4 Phylogenetic tree of strains based on ITS gene
根据NCBI数据库BLAST结果显示,疑似酵母J1与Apiotrichum loubieri的序列相似度为100.00%,并根据系统发育树图4-A结果,疑似酵母J1鉴定为A.loubieri。疑似霉菌M1和疑似霉菌M2与R.oryzae的序列相似度为100.00%,并根据系统发育树图4-B结果,鉴定疑似霉菌M1和疑似霉菌M2为R.oryzae;结合平板形态观察,确定M1、M2和M15为同一株R.oryzae,故将其命名为R.oryzae MZ1。
2.5 目标菌株原位生产验证
根据上述研究结果,选取菌株A.loubieri J1、R.oryzae MZ1、S.monosporum M3、R.delemar M4、A.flavus M11、L.ramosa M12和A.clavatus M18作为实验菌,根据现行种曲生产工艺,以接种量为0.20‰(质量分数)在车间进行纯种接种原位生产验证,以正常生产种曲作为对照,观察实验种曲的起褶情况,实验结果如图5所示。

图5 目标菌株接种生产种曲感官特征
Fig.5 Sensory characteristics of Zhongqu produced by inoculation of target strains
培养结果显示,正常对照组褶皱表型一致性较好;R.oryzae MZ1实验组表面褶皱数量与正常对照基本相同;S.monosporum M3实验组出显少量类似对照组的褶皱;R.delemar M4实验组的种曲表面有大量绒毛状的菌丝;A.loubieri J1、A.flavus M11、L.ramosa M12和A.clavatus M18实验组种曲无褶皱,且表面光滑。分析其结果,R.delemar M4的生长速度最快,菌丝相对较粗壮,能够迅速在种曲中生长,覆盖整个种曲表面形成绒毛状。S.monosporum M3菌丝粗壮,能够穿透种曲的米粉培养基进行生长,但生长速度适中,形成少量褶皱。A.loubieri J1、A.flavus M11、L.ramosa M12和A.clavatus M18生长速度较慢,且菌丝较细弱,不能穿透菌丝生长,均未产生褶皱。分析R.oryzae MZ1形成褶皱的原因,可能是R.oryzae MZ1适合于在种曲的表皮生长(图1、图2),能迅速形成优势菌种,且由于菌丝较粗状、发达(图3),能穿透米粉培养基生长,疏松培养基形成小型隆起,从而形成褶皱的现象。故R.oryzae MZ1为引起种曲形成褶皱的菌株。
2.6 R.oryzae添加量对种曲褶皱和糖化力的影响
为考察R.oryzae MZ1不同添加量对种曲形成褶皱程度及质量的影响,按照质量分数分别在原料中添加0.125‰、0.25‰、0.50‰、1.00‰和2.00‰的R.oryaze MZ1麸皮种进行种曲制作,使用正常生产的种曲作为对照组,记为CK。试验种曲出箱感官如图6所示。质量指标则检测种曲的糖化力,糖化力是酒曲糖化发酵能力的重要指标之一[18],检测不同添加量种曲的糖化力结果如图7所示。
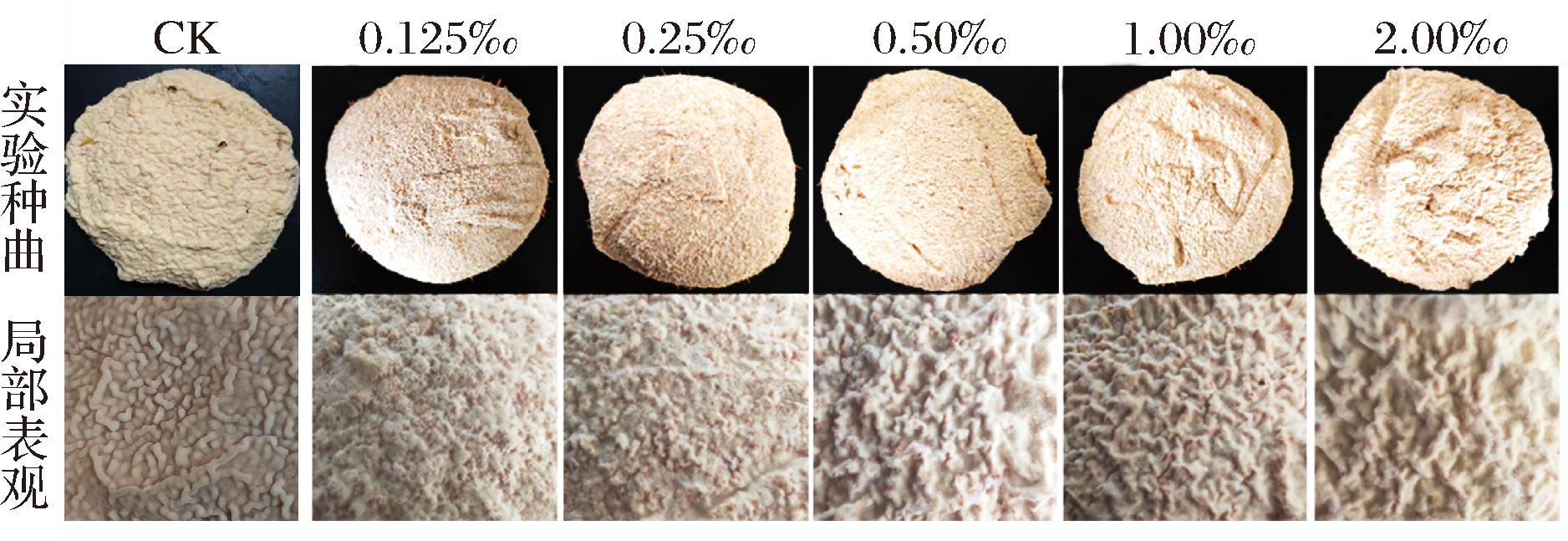
图6 R.oryaze MZ1不同添加量的试验种曲感官特征
Fig.6 Sensory characteristics of experimental Zhongqu with different additive amounts of R.oryzae MZ1
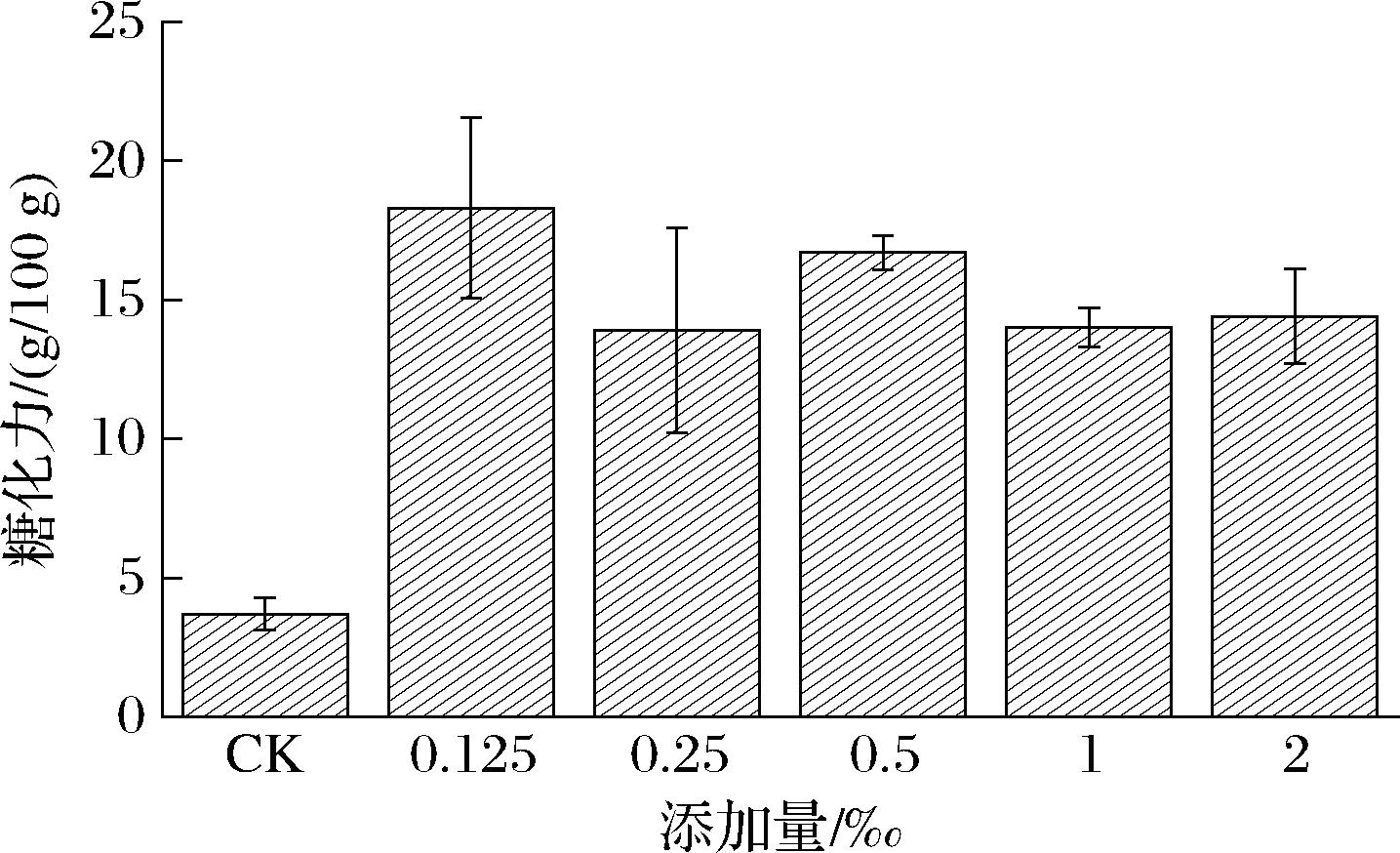
图7 R.oryzae MZ1不同添加量的种曲糖化力的影响
Fig.7 Effect of additive amount of R.oryzae MZ1 on the saccharification power of Zhongqu
实验结果表明,种曲褶皱与R.oryzae MZ1密切相关,随着R.oryzae MZ1添加量的增加种曲褶皱形态越饱满,完整的褶皱密度越大。不同添加量的种曲糖化力检测结果表明,添加纯R.oryzae MZ1可以显著提高种曲的糖化力,但当添加量过多时,糖化力会出现降低。添加0.125‰、0.50‰和2.00‰时,糖化力相对较高,当R.oryzae MZ1添加0.125‰时,种曲的糖化力最高为18.3 g/100 g。
2.7 不同R.oryzae MZ1添加量种曲制备土曲的质量评价
选取米根霉MZ1添加量为0.125‰、0.50‰和2.00‰时制作的3组种曲进一步制作成绿衣红心观音土曲,考察不同的褶皱大小种曲对土曲质量的影响。目前常用来评价土曲质量的指标为糖化力和发酵力[19-20],当土曲糖化力大于19.0 g/100 g,发酵力大于30%时,土曲酿造的原酒品质较好。通过测定土曲的糖化力和发酵力,考察了不同添加量的R.oryzae MZ1对土曲质量的影响,结果如图8所示。
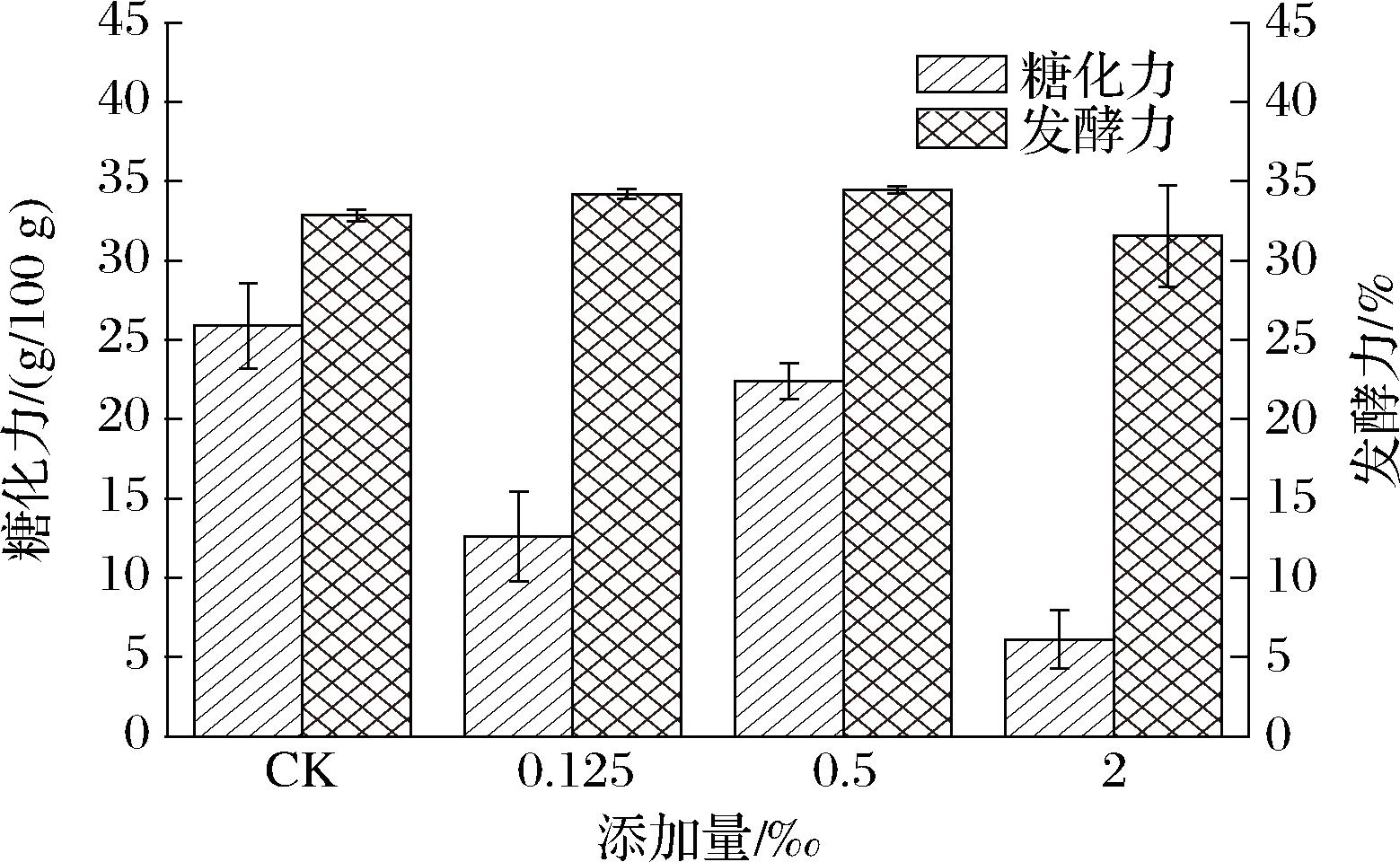
图8 三组试验种曲生产土曲的理化指标
Fig.8 Quality indicators of Tuqu produced by inoculation of three experimental groups of Zhongqu
结果表明添加R.oryzae MZ1的种曲制作出的土曲糖化力相较对照组有所降低,而发酵力随添加量的增加先增加后降低。0.50‰实验组的种曲所生产的土曲糖化力和发酵力最高,分别为22.4 g/100 g和34.45%,而当R.oryzae MZ1添加过低(0.125‰)和过高(2.00‰)时,制备的土曲的糖化力均较低,分别为12.6 g/100 g和6.1 g/100 g,表明过少和过多的R.oryzae制备的种曲可能会影响酒曲中的微生物群落结构[21],从而对生产出的土曲质量造成影响,表现出糖化力有所降低。
2.8 土曲酿造质量评价
将不同R.oryzae MZ1添加量(0.125‰、0.50‰和2.00‰)的种曲制作成土曲,验证3组土曲的酿酒性能,评价R.oryzae MZ1不同的添加量对酿造原酒的影响。乙酸乙酯是清香型白酒的关键呈香物质[22-23],另外,适量的杂醇油有利于白酒的醇香感的形成,而过量的杂醇油会给酒带来邪杂味,且易引起酒后头痛[24-25]。以同期正常土曲为对照,原酒色谱结果如下。
如表2所示,对比正常土曲,0.50‰实验种曲所生产的土曲原酒中乙酸乙酯含量最高,为1.85 g/L,提升了69.7%;2.00‰实验组其次,提升了20.2%。在杂醇油方面,2.00‰实验组含量最低,相比对照组降低了28.3%;0.50‰实验组其次,降低了22.3%。实验组与对照组相比,乙醛均有所提升,甲醇影响不大,正丙醇均有所降低。综合分析,0.50‰实验组的土曲酿造的原酒酒质相对较好,表明适量R.oryzae MZ1的添加对原酒提酯降杂有较好的影响。
表2 三组试验土曲实验室规模发酵原酒色谱指标 单位:g/L
Table 2 Chromatographic indexes of basic liquor fermented by three groups of experimental Tuqu in laboratory scale
组别乙醛甲醇正丙醇乙酸乙酯杂醇油CK0.15±0.150.07±0.010.42±0.041.09±0.171.48±0.230.125‰0.61±0.400.07±0.010.28±0.070.95±0.471.28±0.200.50‰0.22±0.150.06±0.000.29±0.081.85±0.211.15±0.192.00‰0.32±0.270.06±0.010.23±0.021.31±0.911.06±0.05
3 结论
本实验通过筛选鉴定及原位生产验证,阐明了引起种曲产生褶皱的菌株为R.oryzae MZ1,并解析了起褶机理。通过添加不同含量的R.oryzae MZ1,考察其对种曲、土曲和原酒质量的影响,发现种曲褶皱感官与R.oryzae MZ1添加量呈正相关,即R.oryzae MZ1的添加量越多种曲褶皱越多,且当R.oryzae添加量为0.50‰时,种曲的糖化力相对较高,为16.7 g/100 g;制备出的土曲糖化力和发酵力最高,为22.4 g/100 g和34.45%;且酿造出的原酒酒质较好,与对照土曲相比,原酒乙酸乙酯含量提升了69.7%,杂醇油降低了22.3%。
[1] DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology, 2019, 297:32-40.
[2] ZHU L P, LI L Q, YANG Q, et al.Study on microbial community of “green-covering” Tuqu and the effect of fortified autochthonous Monascus purpureus on the flavor components of light-aroma-type Baijiu[J].Frontiers in Microbiology, 2022, 13:973616.
[3] ZHENG X W, HAN B Z.Baijiu (白酒), Chinese liquor:History, classification and manufacture[J].Journal of Ethnic Foods, 2016, 3(1):19-25.
[4] JIANG X L, XU J P, LUO J R, et al.Network design towards sustainability of Chinese Baijiu industry from a supply chain perspective[J].Discrete Dynamics in Nature and Society, 2018,2018:4391351.
[5] 冯春, 汪光明, 梁运祥, 等.绿衣观音土曲中棒曲霉的研究[J].酿酒科技, 2004(5):40-43.
FENG C, WANG G M, LIANG Y X, et al.Researchon Aspergillus clavatus in green-covering Guanyin Tuqu[J].Liquor-Making Science and Technology, 2004(5):40-43.
[6] 李锐利, 方尚玲, 陈茂彬, 等.绿衣观音土曲中霉菌糖化酶活力的研究[J].酿酒, 2010, 37(1):50-52.
LI R L, FANG S L, CHEN M B, et al.Research of glucoamylase activity of molds in green-covering Guanyin Taqu[J].Liquor Making, 2010, 37:50-52.
[7] 沈才洪, 张良, 应鸿, 等.大曲质量标准体系设置的探讨[J].酿酒科技, 2005(11):19-24.
SHEN C H, ZHANG L, YING H, et al.Study on Daqu quality standards (Ⅴ): Investigation on the setting of Daqu quality judgment standards system[J].Liquor-Making Science &Technology, 2005(11):19-24.
[8] 沈毅, 陈波, 张亚东, 等.影响高温大曲质量的关键控制点[J].酿酒科技, 2019(8):17-21.
SHEN Y, CHEN B, ZHANG Y D, et al.Key control points to guarantee the quality of high-temperature Daqu[J].Liquor-Making Science &Technology, 2019(8):17-21.
[9] 蒋英丽, 邓皖玉, 王亚军, 等.酱香高温大曲微生物菌群演化规律研究[J].酿酒科技, 2018(12):33-38;44.
JIANG Y L, DENG W Y, WANG Y J, et al.Evolution rules of microbial flora in the production process of high-temperature Jiangxiang Daqu[J].Liquor-Making Science &Technology, 2018(12):33-38;44.
[10] 刘昌录, 魏耀成, 任润斌.汾酒红心曲制作“三要诀”[J].酿酒科技, 2012(6):73-75.
LIU C L, WEI Y C, REN R B.Three tips in the production of red core starter for Fenjiu[J].Liquor-Making Science &Technology, 2012(6):73-75.
[11] DONG W W, YU X, WANG L Y, et al.Unveiling the microbiota of sauce-flavor Daqu and its relationships with flavors and color during maturation[J].Frontiers in Microbiology, 2024, 15:1345772.
[12] YANG L, FAN W L, XU Y.Chameleon-like microbes promote microecological differentiation of Daqu[J].Food Microbiology, 2023, 109:104144.
[13] 刘爱朋, 张树旺, 王世信, 等.10种细小果实种子类药材的微性状鉴别[J].中成药, 2022, 44(6):1869-1874.
LIU A P, ZHANG S W, WANG S X, et al.Microscopic characteristics identification of ten medicinal materials with small fruits and seeds[J].Chinese Traditional Patent Medicine, 2022, 44(6):1869-1874.
[14] 朱丽萍, 陈福生, 杨强, 等.ISSR标记技术辅助形态学的红曲菌株分类鉴定[J].中国酿造, 2020, 39(8):175-181.
ZHU L P, CHEN F S, YANG Q, et al.Classification and identification of Monascus strains by ISSR marker-assisted morphology[J].China Brewing, 2020, 39(8):175-181.
[15] 郑东影, 梅婕, 陈玮, 等.DNS法与菲林试剂法测定酿酒大曲糖化酶活力的比较分析[J].酿酒, 2023, 50(5):134-138.
ZHENG D Y, MEI J, CHEN W, et al.Comparison of the DNS method and the film reagent method for determination of Daqu glucoamylase activity[J].Liquor Making, 2023, 50(5):134-138.
[16] 李明雨, 吴昱果, 洪军, 等.一种便捷的小粒种子表型观测方法[J].草学, 2023(1):15-21.
LI M Y, WU Y G, HONG J, et al.A convenient method for observing the phenotype of small seeds[J].Journal of Grassland and Forage Science, 2023(1):15-21.
[17] 王昊乾, 刘昌录, 顾铁刚, 等.顶温对红心曲微生物群落结构及理化性质的影响[J].中国食品学报, 2024, 24(3):75-85.
WANG H Q, LIU C L, GU T G, et al.Effect of peak-temperature on the microbial community structure and physicochemical properties of Hongxinqu[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(3):75-85.
[18] 朱丽萍, 杨强, 江威, 等.清香型小曲白酒霉菌菌群解析与酶活特性研究[J].食品与发酵工业, 2022, 48(7):70-77.
ZHU L P, YANG Q, JIANG W, et al.Mold communities and enzyme activity characteristics in light-flavor Xiaoqu Baijiu[J].Food and Fermentation Industries, 2022, 48(7):70-77.
[19] 李小杰, 吕志远, 张梦梦, 等.紫外法、气相法、二氧化碳法检测大曲发酵力的方法对比[J].酿酒, 2024, 51(2):122-126.
LI X J, LYU Z Y, ZHANG M M, et al.Comparison of UV, gas phase, and carbon dioxide methods for detecting the fermentation power of Daqu[J].Liquor Making, 2024, 51(2):122-126.
[20] FU G M, DENG M F, CHEN Y, et al.Analysis of microbial community, physiochemical indices, and volatile compounds of Chinese te-flavor Baijiu Daqu produced in different seasons[J].Journal of the Science of Food and Agriculture, 2021, 101(15):6525-6532.
[21] 蒲升惠, 秦辉, 徐琼, 等.根霉功能曲制曲工艺条件优化研究[J].酿酒科技, 2024(1):24-29.
PU S H, QIN H, XU Q, et al.Optimization of production process of functional Rhizopus starter[J].Liquor-Making Science &Technology, 2024(1):24-29.
[22] FAN G S, SUN B G, FU Z L, et al.Analysis of physicochemical indices, volatile flavor components, and microbial community of a light-flavor Daqu[J].Journal of the American Society of Brewing Chemists, 2018, 76(3):209-218.
[23] YE H, WANG J, SHI J, et al.Automatic and intelligent technologies of solid-state fermentation process of Baijiu production:Applications, challenges, and prospects[J].Foods, 2021, 10(3):680.
[24] TANG J, LIU Y C, LIN B, et al.Effects of ultra-long fermentation time on the microbial community and flavor components of light-flavor Xiaoqu Baijiu based on fermentation tanks[J].World Journal of Microbiology &Biotechnology, 2021, 38(1):3.
[25] 樊杉杉, 唐洁, 乐细选, 等.基于HS-SPME-Arrow-GC-MS和化学计量学的小曲清香型原酒等级判别[J].食品与发酵工业, 2021, 47(13):254-260.
FAN S S, TANG J, YUE X X, et al.Grade discrimination of Xiaoqu light aroma Baijiu based on HS-SPME-Arrow-GC-MS and chemometrics[J].Food and Fermentation Industries, 2021, 47(13):254-260.