柠檬醛是一种单萜类化合物,为橙花醛(顺式柠檬醛)和香叶醛(反式柠檬醛)2种异构体组成的混合物,具有浓郁的柠檬香味[1],是一种广泛应用于酸性饮料,尤其是柑橘类饮料中的食品添加剂,但因其水溶性低以及在酸性环境下极易发生氧化降解,导致其香味减弱并生成具有不良风味的化合物[2]。而多数的柑橘类果汁饮料体系的pH值维持在3.0左右[3],柠檬醛难以在体系中发挥理想作用。因此,如何稳定柠檬醛在酸性饮料中的浓度,保证其在饮料中持续释放清新的柠檬香气,同时抑制具有汽油味、苦杏仁味的对甲酚、对甲基苯乙酮和对伞花烃等降解产物的生成[4],成为其在酸性饮料中应用的关键。
目前关于柠檬醛包封的技术已有大量研究,采用大豆美拉德反应结合喷雾干燥包封柠檬醛,负载柠檬醛的微粒粉末相对于胃部在动物肠道内表现出优先释放的效果[5],但疏水性粉末在水溶液中难以均匀分散,影响饮料外观的稳定性;由单宁酸-FeⅢ配位配合物构建负载柠檬醛的微胶囊具有pH响应性,其释放速率随体系pH的降低而升高[6],不利于酸性饮料中柠檬醛的保存;表面活性剂胶束能够提高柠檬醛在酸性饮料乳液中的稳定性,但因胶束实现显著提高柠檬醛稳定性所需的表面活性剂浓度过高,不适用于可食用饮料中[7];通过β-环糊精与柠檬醛形成颗粒包合物用以制备柠檬醛的Pickering乳液,与中性环境相比,在酸性环境下具有较小的粒径(685 nm)和较高的Zeta电位绝对值(37.4 mV)[8],但其酸稳定性尚待考究;相对于纳米乳液,在酸性环境中纳米脂质体封装的柠檬醛在相同的贮存期内具有更高的保留率,且添加负载柠檬醛的纳米脂质体饮料体系在贮存第12天具有较高的感官评分[9]。纳米结构脂质载体(nanostructured lipid carriers,NLC)是在纳米脂质体的基础上,将纳米脂质体中的部分固体脂质替换为液体脂质,形成在室温和体温下为固态的混合脂质,其中含有的液体脂质具有更加无序的晶体结构,存在更多可用于包封物质的空间,是一种可用于食品中的亲脂性化合物的良好载体[10],具有更高的载药量、更好的稳定性、更低的包埋物泄漏量,可封装一种或多种物质,保护封装物质远离酸性环境[11]。因此,本研究选择NLC作为柠檬醛的递送载体,并将其应用于酸性饮料的模拟体系中,探究NLC抑制柠檬醛不良降解造成酸性饮料品质劣化的改善效果。
在之前的研究中已经比较筛选出超声法所制备的负载柠檬醛的纳米脂质载体具有更好的稳定性[12],随后研究筛选出以二硬脂酸甘油酯、中链甘油三酯、柠檬醛混合为脂相,分别以葵花磷脂(sunflower phospholipid,PC)和氢化卵磷脂(hydrogenated lecithin,HPC)和司盘65复配为表面活性剂的2种NLC(PC-NLC和HPC-NLC)具有较好的酸稳定性[13]。本研究旨在探究上述2种NLC对于模拟酸性饮料体系品质变化的影响,分析酸性饮料品质指标之间的相关性,为酸性饮料中柠檬醛以及NLC的应用提供参考。
1 材料与方法
1.1 材料与试剂
柠檬醛、二硬脂酸甘油酯、司盘65(非离子型)、氢化卵磷脂、葵花磷脂,上海麦克林生化科技有限公司;中链甘油三酯,上海源叶生物科技有限公司;无水葡萄糖,西王药业有限公司;无水柠檬酸、柠檬酸钠,潍坊英轩实业有限公司;苯甲酸钠,武汉有机实业有限公司;HP001菌落总数检测片,广东环凯生物科技有限公司。
1.2 仪器与设备
ME204/02高精度分析天平,梅特勒-托利多仪器(上海)有限公司;T18高速分散机,艾卡(广州)仪器设备有限公司;JY92-IIN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;CR21 N高速冷冻离心机,日本Eppendorf Himac科技有限公司;P7紫外分光光度计,上海美谱达仪器有限公司;PHS-3E型pH计,上海仪电科学仪器有限公司;HT-400B恒温培养箱,江苏金坛春兰仪器厂;HT7700 EXALENS透射电子显微镜,日本Hitachi公司;Nano-ZS光粒度仪,英国Malvern仪器公司。
1.3 实验方法
1.3.1 纳米结构脂质载体的制作
二硬脂酸甘油酯、中链甘油三酯、柠檬醛混合为脂相,葵花磷脂、氢化卵磷脂与司盘65以质量比3∶1复配为表面活性剂,于50 mL水中加热融化为水相。水相于75 ℃,1 000 r/min条件下高速分散,将脂相逐滴加入水相后继续高速分散10 min。待冷却至室温后,分散液于超声波细胞粉碎机(260 W,21 kHz,超声开3.0 s关3.0 s)中处理20 min。
1.3.2 纳米结构脂质载体理化性质的表征
1.3.2.1 粒径、多分散系数(polydispersity index,PDI)和Zeta电位的测定
通过动态光散射测量NLC的粒径、PDI、Zeta电位,平衡时间120 s,温度25 ℃,测量3次取平均值。测量前,样品以超纯水稀释30倍,消除NLC颗粒聚集导致的多重散射现象。
1.3.2.2 包封率和载药量的测定
取NLC分散液于超滤离心内管,在8 000 r/min、4 ℃下离心20 min,收集滤液为游离柠檬醛。另取柠檬醛NLC分散液于无水乙醇中溶解并超声破乳30 min为柠檬醛总量。在238 nm处测定吸光值,根据标准曲线计算柠檬醛含量,柠檬醛的包封率和载药量的计算如公式(1)、公式(2)所示:
包封率![]()
(1)
载药量![]()
(2)
1.3.3 纳米结构脂质载体透射电子显微镜观察(transmission electron microscopy,TEM)
将新鲜制备的NLC稀释2倍后,转移至碳包覆的铜网上,在25 ℃下干燥,于加速电压100 kV下观察颗粒形态。
1.3.4 模拟酸性饮料体系制备
将100 g/L葡萄糖,20 mmol/L柠檬酸以及柠檬酸钠缓冲溶液,1 g/L苯甲酸钠溶于超纯水,用1 mol/L柠檬酸调整所得体系pH至3.5[14]。依据9.2 mg/kg的为柠檬醛有效添加量的标准于模拟饮料体系中添加柠檬醛NLC样品或柠檬醛(用于制备NLC的司盘65,根据GB 2760—2014《食品安全国家标准 食品添加剂使用标准》,山梨醇酐三硬脂酸酯(司盘65)可作为乳化剂添加于风味饮料中)。置于75 ℃的水浴环境中加热15 min,进行巴氏杀菌,冷却后分别于4、25、37 ℃下贮存,每5 d测定样品的各项指标。
1.3.5 饮料体系pH值的测定
用pH计于室温下测定体系pH值。
1.3.6 饮料体系浊度、相对浊度的测定
采用分光光度法比较样品离心前后的浊度,确定系统稳定性[15]。样品于20 ℃,4 200×g下离心15 min,以去离子水为空白,于660 nm波长测定上清液吸光度,浊度为样品离心前的吸光值。相对浊度(Trel)为上清液吸光度值(Ts)与离心前样品吸光度值(T0)的比值(%),计算如公式(3)所示:
(3)
1.3.7 饮料体系的感官评价
感官评价小组成员10位(5位男性,5位女性,年龄为20~25岁),均由接受过专业感官评价训练的浙江工业大学食品专业学生组成。如表1所示,感官评价采用1~9的享乐量表对样品进行评分,1分表示“极度不喜欢”,9分表示“极度喜欢”,评价包含色泽,滋味、气味,状态,总体可接受度,评分为4分则表示为不可接受的程度[16]。
表1 感官评分表
Table 1 Sensory rating scale

评分/分色泽滋味、气味状态总体可接受度很好(8~9)色泽均匀一致柠檬香味明显澄清 很好 好(6~8)色泽均匀柠檬香味较明显澄清 可以接受一般(4~6)色泽较均匀柠檬香味弱有部分絮凝一般 差(<4)色泽不均匀无柠檬香味,有异味有明显沉淀不能接受
1.3.8 饮料体系菌落总数的测定
饮料样品菌落总数采用菌落总数检测片测定。打开测试片上层薄膜,吸取1 mL样品滴在测试片中央后盖上薄膜,静置5 min待样品成凝胶后,将测试片置于30 ℃恒温培养72 h,计数检测片中的红色斑点为菌落总数,控制计数范围小于300 CFU。
1.3.9 斯皮尔曼相关性分析
使用SPSS 27和Origin 2021软件对饮料体系的pH、浊度、相对浊度和感官评分作斯皮尔曼相关性分析。
1.4 数据处理与分析
使用SPSS 27对数据进行差异显著性分析,使用Origin 2021软件作图。
2 结果与分析
2.1 纳米结构脂质载体稳定性分析
2.1.1 纳米结构脂质载体基础表征
对于所制备的2种NLC(PC、HPC)的粒径、PDI、Zeta电位、包封率以及载药量进行评价,结果如图1所示。表面活性剂降低界面张力的能力越强,形成的NLC的粒径越小[17],HPC的分子质量(762.09 g/mol)大于PC(758.06 g/mol),HPC的高分子质量降低其在界面的扩散速度,导致HPC-NLC的粒径(145.5 nm)大于PC-NLC的粒径(128.9 nm)。PDI越小,则颗粒在体系中的分布越均匀,体系越稳定,HPC组(0.216)的PDI值显著小于PC组(0.266),即HPC-NLC更稳定。Zeta电位值绝对值越高,表明NLC携带的电荷越多,NLC之间斥力越大,体系越稳定[18]。而HPC组的Zeta电位绝对值显著高于PC组,表明HPC组NLC在体系中具有更好的分散稳定性。PC组对于柠檬醛具有更高的包封率,但是其载药量与PC组并无显著差异。因此,HPC组的NLC在体系中可能具有更高的稳定性。
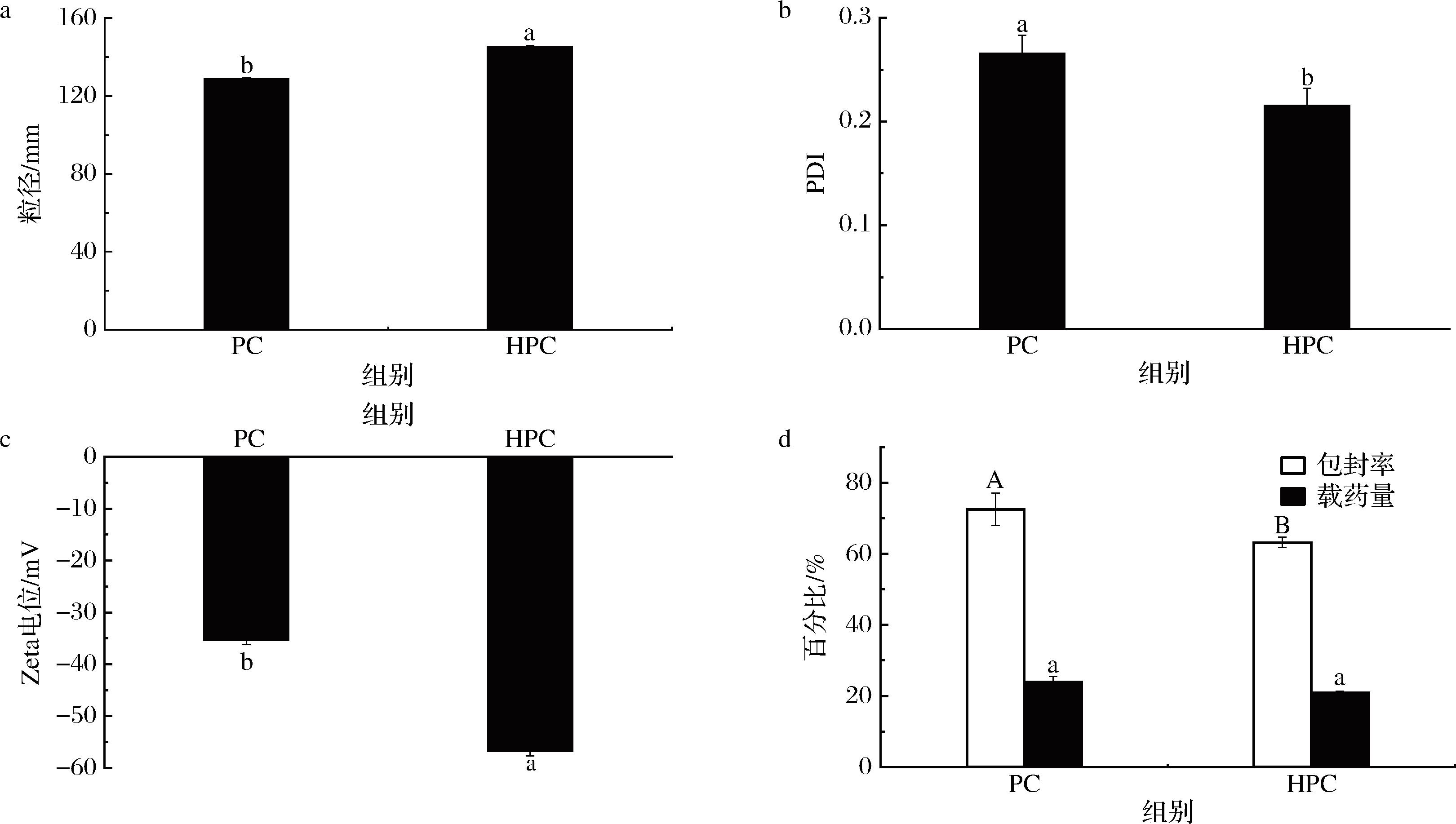
a-粒径;b-多分散系数;c-Zeta电位;d-包封率及载药量
图1 纳米结构脂质载体的基础表征
Fig.1 The basic characterization of nanostructured lipid carriers
注:不同小写字母表示差异显著(P<0.05)。
2.1.2 纳米结构脂质载体形态分析
PC-NLC和HPC-NLC的TEM图如图2所示。PC组和HPC组样品均呈现出较为完整的NLC颗粒形态,PC组的部分颗粒呈现相互黏连的状态,HPC组颗粒则呈现更好的分散性,颗粒之间相互黏连的情况较少。
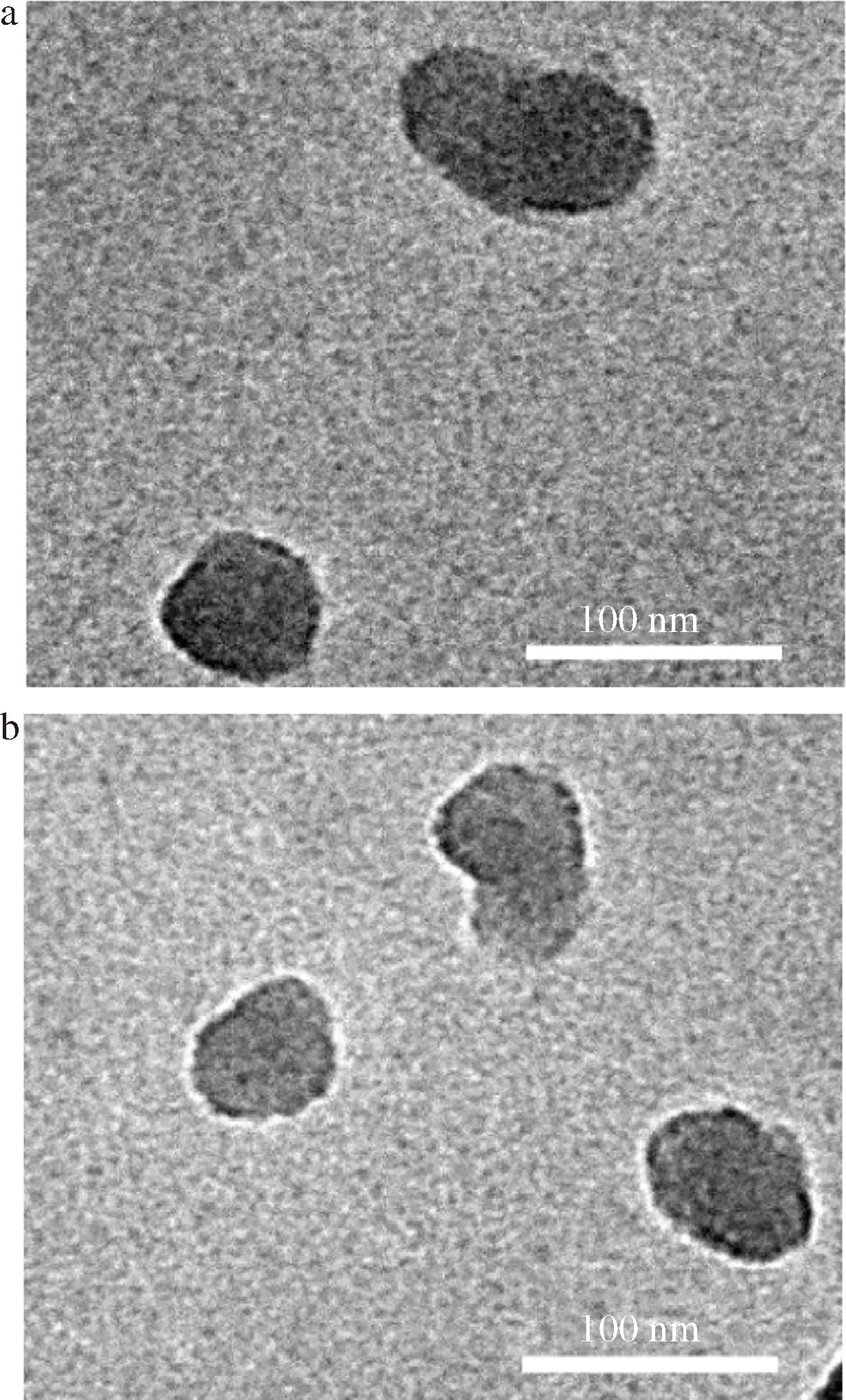
a-PC-组;b-HPC-组
图2 纳米结构脂质载体TEM图
Fig.2 The TEM images of nanostructured lipid carriers
2.2 模拟饮料体系的品质分析
2.2.1 pH值变化分析
模拟饮料体系在4、25、37 ℃的pH值变化分别如图3所示,所有样品的pH值随贮存时间的延长而增大,且整体变化趋势相似。在贮藏的第5天,所有样品的pH值都有所下降,且柠檬醛组因体系中游离柠檬醛含量高,而导致pH下降最为显著,NLC组可能因部分表面水解,释放少量柠檬醛,导致体系pH下降。在第30天,所有样品pH值呈现大幅度的上升,可能因饮料体系基质中柠檬酸和柠檬酸钠缓冲液的存在,柠檬酸在体系中先电离后水解,从而出现体系pH先下降后上升的变化趋势。但随贮藏温度升高,模拟饮料体系最终的pH值逐渐降低。NLC对于柠檬醛在饮料体系中的降解有显著的抑制效果,直接添加游离柠檬醛组的模拟饮料体系pH值显著低于其他3组,可能是由于NLC对于柠檬醛的封装,阻碍了柠檬醛与酸性饮料体系接触,降低了体系中游离柠檬醛的浓度,进而减缓柠檬醛降解生成苯酚等酸性物质的速度,抑制体系pH的降低[19]。

a-4 ℃;b-25 ℃;c-37 ℃
图3 在不同贮存温度下饮料pH的变化情况
Fig.3 The changes in pH of beverages under different temperature storage condition
注:大写字母表示不同样品在同一时间的显著差异(P<0.05),小写字母表示同一样品在不同时间的显著差异(P<0.05)(下同)。
2.2.2 浊度变化分析
各样品组的浊度、相对浊度如图4所示。在所有温度的贮藏过程中,空白组和柠檬醛组的样品始终呈现澄清状态。在贮存初期,HPC和PC组则呈现均匀的白色浑浊状态,且HPC组的较PC组的更为浑浊;在4 ℃贮存条件下,PC组样品浊度呈现逐渐下降的变化,HPC组则呈现较为稳定的浑浊状态;在其余温度下,HPC组和PC组外观则呈现由浑浊转变为澄清的状态。柠檬醛组与空白组的浊度相近,即柠檬醛的添加对饮料体系的浊度无显著影响,且样品外观澄清透明。PC组的浊度在第5、25天发生较大幅度改变,尤其在37 ℃时,样品浊度从第1天的0.185降至第5天的0.055。其原因在于NLC表面含有的PC为不饱和磷脂,含不饱和双键,易受酸和氧的作用发生水解,破坏NLC颗粒,导致体系中游离柠檬醛含量增加,进而体系浊度下降。HPC组在4 ℃贮存的第40天浊度从第35天的0.078增至0.091,样品外观浑浊,可能是低温贮存的后期NLC中脂质的沉淀结晶加剧[20],纳米颗粒发生絮凝,体系出现浑浊。
空白组和柠檬醛组的浊度在所有温度下无显著变化,且二者的浊度均显著低于PC和HPC组,产品外观澄清。相对浊度是饮料体系在贮存期间稳定性的体现,相对浊度变化越小,则体系越稳定[21]。在4、25 ℃下,HPC组、游离柠檬醛组以及空白组3组的相对浊度保持在90%以上,无显著差异变化,三者处于较为稳定的状态。而在25、37 ℃的条件下,PC组的相对浊度不断下降,体系不稳定。在4、25 ℃的贮存条件HPC组保持稳定的相对浊度,HPC为饱和磷脂,其分子链的高饱和度导致范德华相互作用增加,减少磷脂的空间位阻,同时高熔点HPC在脂质基质之前固化,在相邻分子之间形成多个氢键,导致界面形成致密保护外壳,延缓了因脂肪链水解而对NLC颗粒造成破坏[22-24],从而保持体系相对浊度稳定的状态。因此,含HPC-NLC的饮料体系在低温和常温状态下其品质更稳定。当贮存温度升至37 ℃时,NLC中的脂质基质因温度升高而发生水解[25],颗粒在体系中的分散稳定性下降,相对浊度显著下降,含NLC的饮料体系变得不稳定。
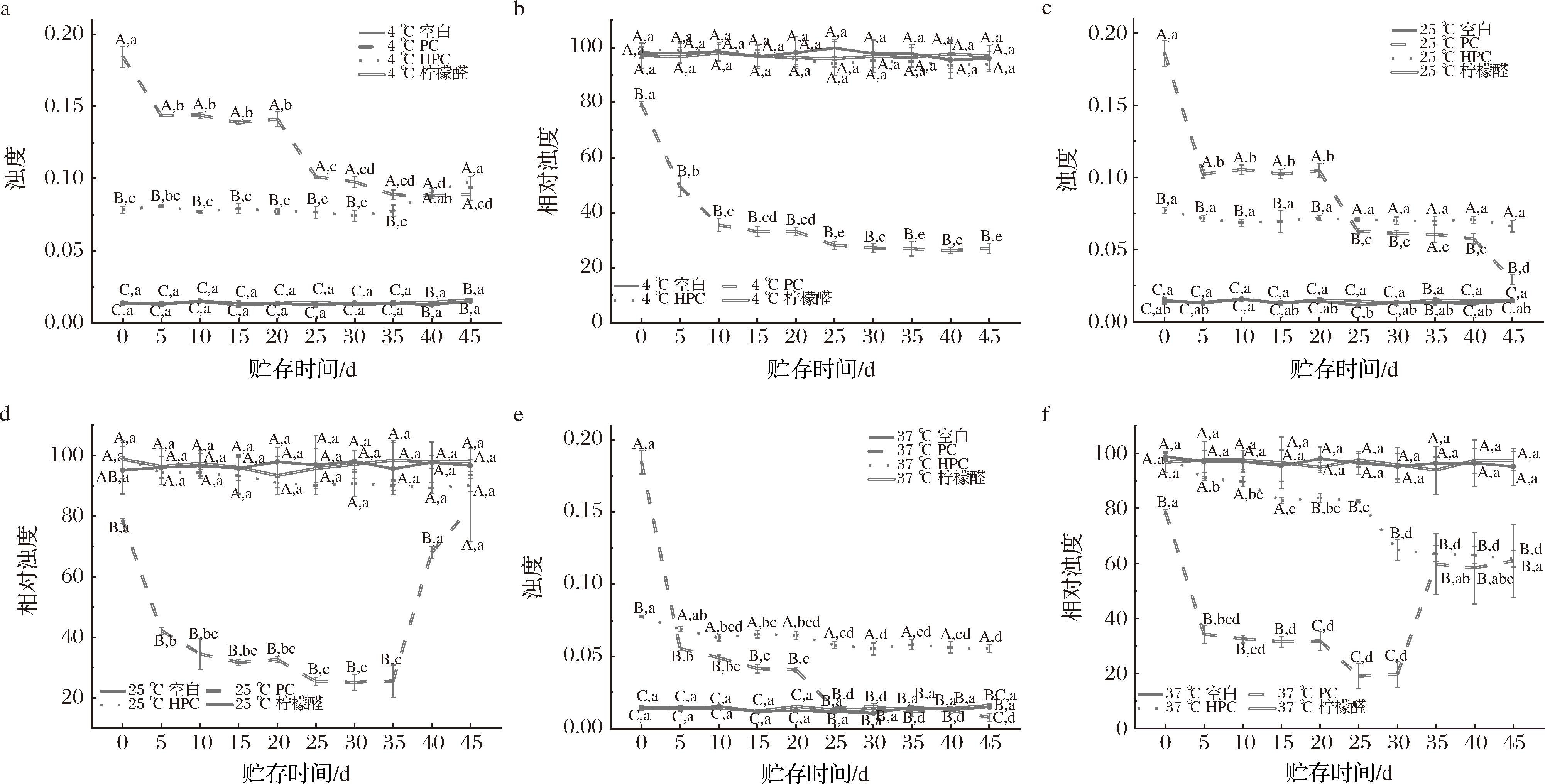
a-4 ℃浊度;b-4 ℃相对浊度;c-25 ℃浊度;d-25 ℃相对浊度;e-37 ℃浊度;f-37 ℃相对浊度
图4 不同贮存温度条件下饮料浊度、相对浊度的变化情况
Fig.4 The changes in turbidity and relative turbidity of beverages under different storage temperature conditions
2.2.3 感官可接受度分析
感官评价小组成员对于饮料的评价结果如图5所示。柠檬醛常见的降解产物有对伞花烃、对甲酚和对甲基苯乙酮,这些产物的气味分别与酚类、汽油和苦杏仁的气味相似[26]。柠檬醛组的样品分别在4、25 ℃的第35天,37 ℃的第10天,柠檬香味消失,出现明显的苦味,评分降至4及以下,为不可接受的程度。37 ℃下贮存的PC组和HPC组样品在第10天出现杏仁苦味。随温度下降,样品在感官可接受的水平内可贮存的时间随之延长,PC组在25 ℃下贮存的第40天,其评分降为4.3,而HPC组的评分则在第45天降至4.2。4 ℃下PC、HPC组饮料在贮存的第45天,二者的评分分别是5.20和5.50分,处于可接受水平。温度升高,NLC的脂质基质水解速率加快,导致体系中游离柠檬醛含量上升,柠檬醛降解速率加快,加速苦味生成。低温下,NLC对于柠檬醛的保护效果更佳,而常温下,HPC组在感官可接受水平下保存的时间最长,因此,HPC-NLC更有利于柠檬醛在酸性饮料中保存柠檬香气,降低柠檬醛因降解产生苦味的速率。
2.2.4 菌落总数变化分析
所有样品在经过巴氏杀菌后,分别在4、25、37 ℃下贮存45 d,每隔5 d,对样品进行一次菌落总数检测,检测结果以测试片中出现的红色斑点的数量计为菌落的数量。所有菌落测试片在添加样品后呈现淡黄色透明的外观,未出现红色斑点。且所有样品测试片在恒温培养结束后,依旧呈现淡黄色透明的外观均未见红色斑点,则表明在贮存过程中,饮料体系始终保持无菌的状态,样品品质并未出现因微生物污染而产生变化,影响饮料品质的评价结果,符合GB 7101—2022《食品安全国家标准 饮料》的要求。
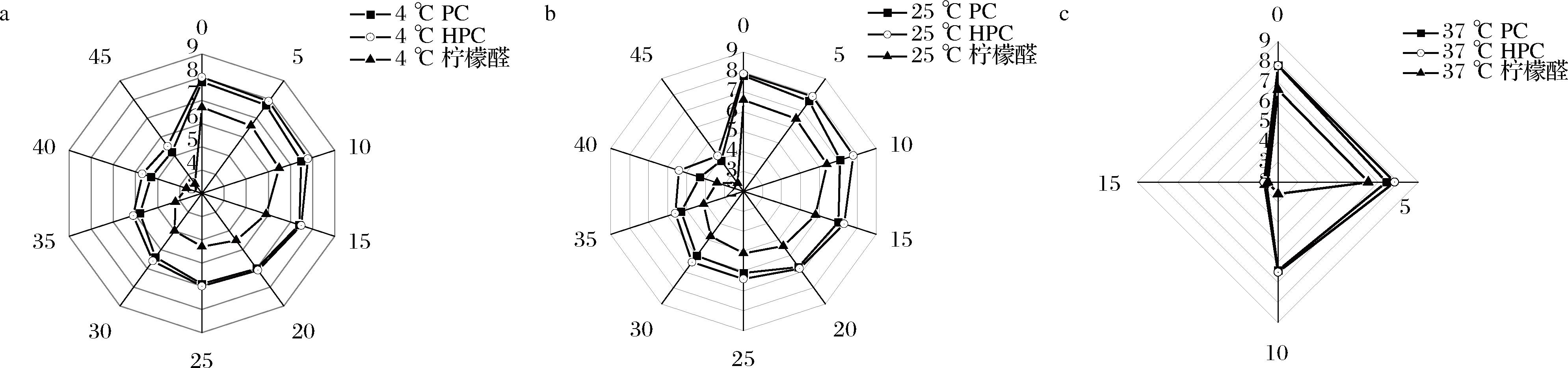
a-4 ℃;b-25 ℃;c-37 ℃
图5 不同贮存温度条件下酸性饮料感官分雷达图
Fig.5 The radar of sensory evaluation for acidic beverages under different storage temperature conditions
2.3 斯皮尔曼相关性分析
为探究含柠檬醛饮料的各个品质指标之间的相关性(P<0.05),对pH、浊度、相对浊度以及感官评分进行斯皮尔曼相关性分析,结果如图6所示。在4 ℃下,PC组的pH与浊度、相对浊度以及感官评分的相关系数分别为-0.68、-0.56、-0.77,呈显著负相关;浊度与相对浊度、感官评分的相关系数分别为0.89、0.92,相对浊度和感官评分的相关系数为0.83,呈显著正相关。HPC组中各个指标之间的相关性与PC组存在差异,4 ℃下,其pH与浊度的相关系数分别为0.35,体系中pH因NLC颗粒解体释放柠檬醛而下降,导致体系浊度下降;感官评分与相对浊度的相关系数为0.53,为显著正相关,相对浊度降低,则体系易产生沉淀,感官评分降低。柠檬醛组的pH与感官评分在4、25 ℃下的相关系数分别为-0.51、-0.4,呈显著负相关,在37 ℃下,二者相关系数为0.57,呈显著正相关,其余指标之间则不存在显著相关性,可能因贮存温度升高导致柠檬醛降解速率加快,体系内产生大量降解产物,出现异味,处于感官不可接受水平,各指标之间的关联性失去意义。

a-4 ℃ PC;b-25 ℃ PC;c-37 ℃ PC;d-4 ℃ HPC;e-25 ℃ HPC;f-37 ℃ HPC;g-4 ℃柠檬醛;h-25 ℃柠檬醛;i-37 ℃柠檬醛
图6 pH值、浊度、相对浊度(Trel)、感官评分的相关性分析
Fig.6 The correlation analysis of pH value, turbidity, relative turbidity (Trel), and sensory score
3 结论
在酸性饮料中,表面活性剂中含HPC或PC的NLC对于柠檬醛的不良降解均有一定的抑制效果,HPC-NLC相对于PC-NLC在酸性饮料中具有更稳定的相对浊度,对柠檬醛风味的保留以及柠檬醛降解的抑制效果更优,从而具有更理想的感官特性,且4 ℃贮存条件下饮料体系品质评价指标之间存在显著相关性。
基于HPC-NLC在酸性饮料中表现出相对较好的稳定性,可为NLC应用于饮料工业中改善柠檬醛的不良降解提供一定参考。
[1] 黄亚茹, 高芳, 迟韵阳, 等.天然柠檬醛提取方法与生物活性研究进展[J].南方农业学报, 2022, 53(11):3217-3228.
HUANG Y R, GAO F, CHI Y Y, et al.Research progress of extraction method and biological activity of natural citral[J].Journal of Southern Agriculture, 2022, 53(11):3217-3228.
[2] MASWAL M, DAR A A.Formulation challenges in encapsulation and delivery of citral for improved food quality[J].Food Hydrocolloids, 2014, 37:182-195.
[3] 李丹凤, 徐婷, 胡静, 等.香料化合物柠檬醛稳定性研究进展[J].食品工业, 2016, 37(9):215-219.
LI D F, XU T, HU J, et al.Research progress on stability of citral[J].The Food Industry, 2016, 37(9):215-219.
[4] YANG X Q, TIAN H X, HO C T, et al.Inhibition of citral degradation by oil-in-water nanoemulsions combined with antioxidants[J].Journal of Agricultural and Food Chemistry, 2011, 59(11):6113-6119.
[5] YANG Y X, NIU F G, CUI S W, et al.Spray-drying microencapsulation of citral with soy protein-soy polysaccharide Maillard reaction products:Stability and release characteristics[J].Food Hydrocolloids, 2022, 132:107842.
[6] XU R Y, DENG W J, DAI Y L, et al.pH-responsive citral microcapsules with tannic acid-FeIII coordination complexes[J].Food Chemistry, 2022, 397:133715.
[7] CHOI S J, DECKER E A, HENSON L, et al.Inhibition of citral degradation in model beverage emulsions using micelles and reverse micelles[J].Food Chemistry, 2010, 122(1):111-116.
[8] 王相凡, 李学红, 于国强, 等.β-环糊精稳定柠檬醛Pickering乳液的制备及其稳定性研究[J].食品与发酵工业, 2019, 45(24):124-129.
WANG X F, LI X H, YU G Q, et al.Preparation of citral emulsion stabilized by β-cyclodextrin and its stability[J].Food and Fermentation Industries, 2019, 45(24):124-129.
[9] TIAN H X, LU Z Y, LI D F, et al.Preparation and characterization of citral-loaded solid lipid nanoparticles[J].Food Chemistry, 2018, 248:78-85.
[10] DA SILVA SANTOS V, BADAN RIBEIRO A P, ANDRADE SANTANA M H.Solid lipid nanoparticles as carriers for lipophilic compounds for applications in foods[J].Food Research International, 2019, 122:610-626.
[11] 赵家和, 刘媛媛, 姚丹, 等. 固体脂质纳米粒与纳米结构脂质载体的制备和质量评估研究进展[J]. 中国油脂, 2024 ,49 (10):72-79;89.
ZHAO J H, LIU Y Y, YAO D, et al. Research progress of solid lipid nanoparticles and nanostructure lipid carriers[J]. China Oils and Fats, 2024 ,49 (10):72-79;89.
[12] FENG S M, SHENG J L, YU J H, et al.Encapsulation and release of citral using nanostructured lipid carriers:A study on the impact of different preparation methods[J].Food Bioscience, 2023, 56:103185.
[13] FENG S M, SHENG J L, YU J H, et al.Enhancing acid stability of citral through internal structure modulation in nanostructured lipid carriers with solid lipids and phospholipids[J].Food Research International, 2024, 182:114148.
[14] LIN M H, SUN C C, GAO Q C, et al.Effect of five polyphenols on the stability of purple cabbage anthocyanins in simulated beverage systems containing L-ascorbic acid[J].Food Packaging and Shelf Life, 2023, 37:101065.
[15] SCHULTZ A K, ANTHON G E, DUNGAN S R, et al.Effect of pectin methylesterase on carrot (Daucus carota) juice cloud stability[J].Journal of Agricultural and Food Chemistry, 2014, 62(5):1111-1118.
[16] RAN M, HE L P, LI C Q, et al.Quality changes and shelf-life prediction of cooked cured ham stored at different temperatures[J].Journal of Food Protection, 2021, 84(7):1252-1264.
[17] LÜDTKE F L, STAHL M A, GRIMALDI R, et al.High oleic sunflower oil and fully hydrogenated soybean oil nanostructured lipid carriers:Development and characterization[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2022, 654:130039.
[18] 朱子昊, 卢晓明.纳米结构脂质载体的制备、表征及其在食品领域的研究进展[J].中国食品学报, 2021, 21(12):311-322.
ZHU Z H, LU X M.Preparation and characterization of nanostructured lipid carriers and their research progress in food[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(12):311-322.
[19] 王根女, 赵华杰, 陈雄, 等.植物基天然抗氧化剂抑制柠檬醛降解的研究[J].香料香精化妆品, 2019(1):29-32.
WANG G N, ZHAO H J, CHEN X, et al.Study on the inhibition of citral degradation by plant-based natural antioxidants[J].Flavour Fragrance Cosmetics, 2019(1):29-32.
[20] 黄威, 窦华亭, 吴厚玖, 等.川陈皮素纳米结构脂质载体的制备及稳定性评价[J].食品与发酵工业, 2017, 43(8):169-176.
HUANG W, DOU H T, WU H J, et al.Preparation and stability evaluation for nobiletin nanostructured lipid carriers[J].Food and Fermentation Industries, 2017, 43(8):169-176.
[21] 邹波, 吴继军, 徐玉娟, 等.不同紫肉甘薯品种饮料加工特性评价[J].广东农业科学, 2017, 44(4):118-124.
ZOU B, WU J J, XU Y J, et al.Evaluation of processing characteristics of beverageby different purple-fleshed sweetpotato (Ipomoea batatas L.) varieties[J].Guangdong Agricultural Sciences, 2017, 44(4):118-124.
[22] SONG F F, YANG G L, WANG Y H, et al.Effect of phospholipids on membrane characteristics and storage stability of liposomes[J].Innovative Food Science &Emerging Technologies, 2022, 81:103155.
[23] TAI K D, RAPPOLT M, MAO L K, et al.Stability and release performance of curcumin-loaded liposomes with varying content of hydrogenated phospholipids[J].Food Chemistry, 2020, 326:126973.
[24] VERGARA D, L PEZ O, BUSTAMANTE M, et al.An in vitro digestion study of encapsulated lactoferrin in rapeseed phospholipid-based liposomes[J].Food Chemistry, 2020, 321:126717.
PEZ O, BUSTAMANTE M, et al.An in vitro digestion study of encapsulated lactoferrin in rapeseed phospholipid-based liposomes[J].Food Chemistry, 2020, 321:126717.
[25] LU J, LANGTON M, SAMPELS S, et al.Lipolysis and oxidation in ultra-high temperature milk depend on sampling month, storage duration, and temperature[J].Journal of Food Science, 2019, 84(5):1045-1053.
[26] TIAN H X, LI D F, XU T, et al.Citral stabilization and characterization of nanoemulsions stabilized by a mixture of gelatin and Tween 20 in an acidic system[J].Journal of the Science of Food and Agriculture, 2017, 97(9):2991-2998.