冰酒,起源于200多年前的德国,是一种典型的甜型葡萄酒,特别之处在于它是由在寒冷天气(温度低于8 ℃)下自然冻结于藤上的葡萄制成[1],独特的酿造工艺赋予冰葡萄酒深厚的香气,包括浓郁的蜂蜜、杏仁和焦糖等特征[2]。近年来,中国的冰酒产业迅速崛起,已成为一个重要的冰酒生产国。在中国西北地区,威代尔白葡萄因其耐寒性和厚皮质结构,适合在寒冷环境中生长,从而成为该地区冰酒生产的首选[3]。
威代尔冰葡萄酒风味的决定因素涉及复杂的微生物作用过程,其中酿酒酵母扮演着重要角色。它们主要负责将葡萄汁中的糖分转化为酒精和二氧化碳,并赋予葡萄酒特定的香气和口感[4]。然而,长期以来,依赖单一酿酒酵母导致了威代尔冰酒品质的同质化,影响了其在国际市场的竞争力。这种酵母虽然在乙醇转化方面能力强,但在创造复杂香气方面能力有限,这导致了许多冰酒在香气和口感上的相似性,限制了其风格的多样性[5]。
近年来,非酿酒酵母的应用日渐增多,为威代尔冰葡萄酒风味的创新提供了新的可能性。研究显示,非酿酒酵母能产生多种香气化合物,如酯类和高级醇类,显著改善葡萄酒的风味[6]。其中一些非酵母菌属还能产生水解酶,促进芳香前体的释放[7]。目前,许多酿酒厂倾向于筛选和利用本土非酿酒酵母菌株发酵,因为这些非酿酒酵母能较好地适应葡萄酒产区的微观条件,并能在冰酒产品中创造地域特色[8]。LIN等[9]研究发现南澳大利亚本土非酿酒酵母之间的相互作用促进了灰比诺葡萄酒中短链脂肪酸乙酯的生成,显著提高了香气成分,从而增强了葡萄酒的地域特征。因此,筛选自产酵母菌株和了解这些酵母菌株在发酵过程中的作用非常重要。然而,目前关于威代尔冰酒的研究主要集中在不同产地、品种、年份的感官评价、挥发性成分检测以及菌种多样性分析上。针对本土非酿酒酵母对威代尔冰酒风味特征和感官特性的影响,相关报道较少。
本研究以贺兰山东麓葡萄酒产区的威代尔冰酒为对象,选取了从宁夏贺兰山东麓威代尔冰酒产区分离筛选的9株本土非酿酒酵母菌株进行研究,旨在探究不同本土非酿酒酵母对威代尔冰酒风味物质和感官特性的影响,为我国优质冰酒的生产提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 威代尔葡萄
本试验所用葡萄品种为‘威代尔’酿酒葡萄(采摘于宁夏省银川市永宁县玉泉营)。葡萄原料于2022年12月在-12 ℃下收获,其总糖含量为344 g/L,酸度为4.3 g/L(以酒石酸计),pH值为3.58,成熟度良好。
1.1.2 菌种
本试验所用9株非酿酒酵母菌株均分离纯化于宁夏贺兰山东麓威代尔冰酒产区,且保藏于宁夏农产品质量标准与检测技术研究所实验室,在使用前重新通过26S rRNA基因序列D1/D2区鉴定,确认菌种后备用;商业酿酒酵母F15菌株购于法国拉福德公司,菌种名称及编号如表1所示。
表1 本实验中所用的非酿酒酵母和酿酒酵母
Table 1 Non-Saccharomyces yeast and Saccharomyces yeast used in this experiment
编号菌种拉丁名 菌种中文名菌种编号 来源1Saccharomyces cerevisiae酿酒酵母F15拉福德公司,法国2Clavispora lusitaniae葡萄牙棒孢酵母CL115宁夏农产品质量标准与检测技术研究所实验室3Cyberlindnera fabianii费比恩塞伯林德纳氏酵母CF20宁夏农产品质量标准与检测技术研究所实验室4Rhodotorula mucilaginosa胶红酵母RM147宁夏农产品质量标准与检测技术研究所实验室5Candida glabrata光滑假丝酵母CG196宁夏农产品质量标准与检测技术研究所实验室6Torulaspora delbrueckii德尔布有孢圆酵母(1)TD141宁夏农产品质量标准与检测技术研究所实验室7Torulaspora delbrueckii德尔布有孢圆酵母(2)TD16宁夏农产品质量标准与检测技术研究所实验室8 Hanseniaspora opuntiae仙人掌有孢汉逊酵母HO52宁夏农产品质量标准与检测技术研究所实验室9Hanseniaspora uvarum葡萄汁有孢汉逊酵母HU181宁夏农产品质量标准与检测技术研究所实验室10Naganishia globosa —NG212宁夏农产品质量标准与检测技术研究所实验室
注:—表示无资料。
1.2 仪器与设备
Thermo TSQ ALTIS超高效液相色谱串联三重四极杆质谱仪,美国赛默飞公司;GC-MS TQ8050 NX 气相色谱串联三重四极杆质谱联用仪、LC-15C高效液相色谱仪(配备二极管阵列检测器和SIL10AF自动进样器),日本岛津公司;ST-50H型恒温摇床,冠森生物科技上海公司;BKQ-B50II立式压力蒸汽灭菌锅,山东博科消毒设备有限公司。
1.3 实验方法
1.3.1 实验处理
对照组:只接种单一的酿酒酵母F15(CK)。
实验组:将表1中的9株本土非酿酒酵母(2~10号)分别与酿酒酵母F15按1∶1的比例同时接种进行混菌发酵。以CL115、CF20、RM147、CG196、TD141(TD16)、HO52、HU181、NG212来表示不同混菌发酵处理组依次为葡萄牙棒孢酵母、费比恩塞伯林德纳氏酵母、胶红酵母、光滑假丝酵母、德尔布有孢圆酵母、仙人掌有孢汉逊酵母、葡萄汁有孢汉逊酵母、Naganishia globosa。
其中,非酿酒酵母和酿酒酵母的接种量同为1×106 CFU/mL,同时接种指同时加入非酿酒酵母与酿酒酵母进行乙醇发酵。
1.3.2 冰葡萄酒酿造工艺
参照HU等[10]的发酵工艺。分别将表1中活化后的9株非酿酒酵母及酿酒酵母菌株接种至已灭菌的100 mL葡萄汁中(100 ℃,10 min)。在28 ℃下,通过摇床培养4~5 h,随后,以3%接种量将适应后的菌液接入150 mL灭菌处理的葡萄汁中,摇床培养(28 ℃,2.5 ×g)约24 h。待发酵液菌种生物量达到106 CFU/mL后,与商业酿酒酵母按照1∶1的接种比例接入350 mL灭菌葡萄汁中,置于500 mL的三角瓶中。在18 ℃下进行静置培养约18 d,直至发酵液连续3 d失重不再变化。发酵结束后,采取所有葡萄酒样品(350 mL),通过离心(4 000 ×g,4 ℃,5 min)的方式分离沉淀物。随后,弃去沉淀物,保存上清液于-20 ℃,以备后续测定。
1.3.3 理化指标的测定
参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》规定的方法,本研究对各处理组威代尔冰酒样本进行总糖含量、总酸度和乙醇含量的定量分析。
1.3.4 有机酸的测定
有机酸的测定参考郑海宏等[11],使用超高效液相色谱串联三重四极杆质谱仪检测。检测色谱分离过程采用迪马 Spursil 3 μm C18色谱柱(150 mm×2.1 mm)和Waters XSelect R HSS T3反向色谱柱(250 mm×4.6 mm,5 μm),流动相A和B分别为0.1%(体积分数)甲酸水和乙腈。洗脱程序在20 min 内完成,其中在0~12 min内,流动相A逐渐增至2%,后保持不变。整个分析过程中色谱柱温度保持在40 ℃,进样量为10 μL。定性方法采用目标化合物与标准品保留时间比对的方法,定量方法为峰面积外标定量法。
1.3.5 酚酸的测定
酚酸的测定参考WEI等[12]的方法,采用LC-15C高效液相色谱仪进行分析。所使用的色谱柱为Waters xTerra MS C18反向色谱柱(250 mm×4.6 mm,粒径为5 μm)。流动相A为2%(体积分数)乙酸水溶液,流动相B为0.5%乙酸水溶液-乙腈(体积比50∶50)。
检测波长:黄烷-3-醇类以及二氢查耳酮类280 nm,羟基肉桂酸类320 nm,黄酮醇类360 nm。定性方法采用目标化合物与标准品保留时间比对的方法,定量方法为峰面积外标定量法。
1.3.6 香气物质的测定
香气物质的测定参考PRIOR等[13]的方法,采用顶空-固相微萃取法(head space solid phase micro extractions,HS-SPME)对葡萄酒香气物质进行测定。首先,样品瓶中添加1.5 g NaCl和5 mL葡萄酒样品,再加入40 μL质量浓度为394.08 μg/L的内标物4-甲基-1-戊醇。密封后,在45 ℃条件下,使用CAR/DVB/PDMS萃取纤维进行30 min吸附。吸附后,将萃取纤维放入气相色谱仪进样口,在250 ℃下进行3 min 解吸。最后,通过GC-MS对样品进行分析。
定性定量分析:采用Kovats法确定香气组分的保留指数,并通过对照标准物质的保留时间和保留指数进行定性分析。定量分析方面,对有标准品的化合物采用外标法,而无标准品的化合物则以4-甲基-1-戊醇作为内标进行半定量分析。
1.3.7 感官分析
参照田秀等[14]的评价方法。通过组织10位葡萄酒评审专家,采用8分结构化数值尺度,全面评估威代尔冰酒的多个感官属性。评价指标涵盖了酒的外观(如色泽)、香气(包括花香、果香和浓郁度)、口感(评估酸度、甜酸平衡及余味)及整体感受。感官评分标准见表2。
表2 葡萄酒感官评分标准
Table 2 Criteria for sensory evaluation of wine

项目满分/分评分标准外观色泽8无光泽,呈橙黄色(0~3 分);强度中等,具有宝石红色 (4~6 分);色泽澄澈透亮,深红色(7~8 分)浓郁度8香气单一,气味分散(0~3 分);有少许浓郁的花、果香和酒香,香气较复杂(4~6 分);香气浓郁,成分复杂协调(7~8 分)香气花香8无花、果香气,或香气微弱(0~3 分);花、果香气中等,香气明显(4~6 分);花、果香特征明显,馥郁纯正(7~8 分)酒香8无酒香,或香气微弱(0~3 分);酒香明显,强度中等 (4~6 分);酒香舒适,特征鲜明气味醇厚协调(7~8 分)口感酸度8无酸味(0~3 分);酸度较低,酒样品尝平淡无奇 (4~6 分);酸度适中,口腔中酸度刺激平衡(7~8 分)余味8余味短(0~3 分);余味较长(4~6 分);余味长,酸甜适口,回味较好(7~8 分)平衡感8甜酸平衡感差(0~3 分);甜酸平衡感欠佳(4~6 分);甜酸平衡感好,酒体协调(7~8 分)整体评分8酒体寡淡,口感不佳,香气不足,余味短(0~3 分);酒体丰满,香气复杂、明显,口感较佳,余味较长(4~6 分);酒体 圆润协调,香气典型、浓郁,口感舒适,余味长(7~8 分)
1.4 数据处理分析
通过Excel进行数据统计,利用SPSS 26.0对数据进行显著性分析,应用R语言和sim-ca14.1软件绘图。
2 结果与分析
2.1 不同非酿酒酵母对威代尔冰酒理化指标的影响
如表3所示,各处理条件下的冰酒均完成了乙醇发酵,其乙醇体积分数约为8.50%。研究发现,在使用本土非酿酒酵母HO52进行发酵的酒样中,总酸质量浓度最高,达到6.88 g/L。此外,与使用F15酿酒酵母单一发酵的冰酒相比,混合发酵的酒样显示出总酸含量有所增加,并且乙醇体积分数减少了16.01%~24.27%。这种乙醇体积分数的降低可能与非酿酒酵母在代谢过程中的氧化特性有关,它们在消耗葡萄糖时不直接转化为乙醇,而是通过其他代谢路径转换为甘油等化合物[15]。
2.2 不同非酿酒酵母对威代尔冰酒有机酸含量的影响
图1为10个不同发酵组酒精发酵结束后酒样的有机酸含量分布热图,颜色渐变代表物质含量变化:颜色越深红,含量越高;颜色越深蓝,含量越低。有机酸可赋予葡萄酒清新爽快的口感、平衡饱满的酒体[16]。由表4可知, 不同非酿酒酵母发酵酒中10种有机酸总量为13.42~15.75 g/L。其中,苹果酸、酒石酸、柠檬酸和琥珀酸为主要有机酸成分,这与唐柯等[17]的研究相吻合。酒石酸不仅是葡萄酒酸度的关键来源,而且对于维持葡萄酒的酸味平衡与低pH值具有重要作用[18]。RM147和HU181混菌发酵组酒样中酒石酸含量较高,说明RM147、和HU181菌株可有效增加酒石酸含量;琥珀酸复杂的味感能够呈现葡萄酒的醇厚感[19],其中TD141组的琥珀酸含量最高,其次是CG196混菌发酵组和CL115混菌发酵组,可以看出不同酵母混菌发酵会导致琥珀酸含量有较大差异[20]。
表3 发酵结束后酒样的基本理化指标
Table 3 Basic physico-chemical indexes of wine samples at the end of fermentation

组别乙醇(体积分数)/%总糖含量/(g/L)总酸含量/(g/L)pHCK10.30±0.59870.55±0.1556.09±0.1223.77±0.065CL1158.53±1.09636.45±0.1586.43±0.2803.86±0.168CF208.56±0.31532.59±0.2376.81±0.6293.89±0.367RM1478.62±0.46235.20±0.1286.14±0.2213.83±0.101CG1968.47±0.20837.63±0.1586.21±0.0623.88±0.077TD1418.65±1.07538.25±0.1956.59±0.6033.84±0.472TD167.80±0.31536.48±0.0696.47±0.2823.86±0.134HO528.53±0.85939.39±0.3596.88±0.6313.89±0.350HU1818.41±0.45335.64±0.2626.00±0.1203.90±0.273NG2128.49±1.18137.59±0.2356.54±0.2853.85±0.116
注:数据表示为“平均值±标准差”(下同)。
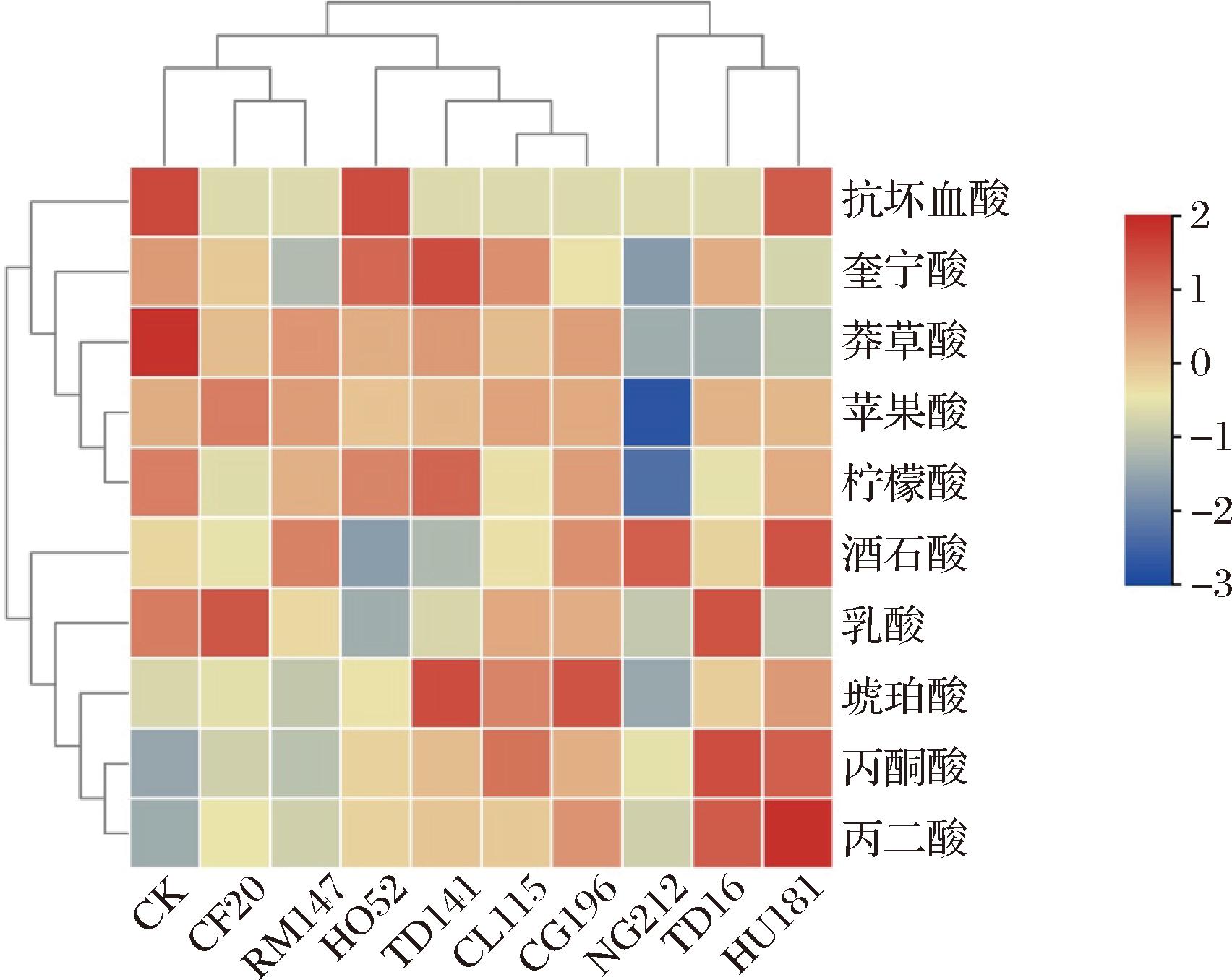
图1 不同发酵组酒样有机酸含量分布
Fig.1 Distribution of organic acid content in wine samples of different fermentation groups
表4 不同发酵组有机酸物质含量 单位:mg/L
Table 4 Organic acid content of different fermentation groups
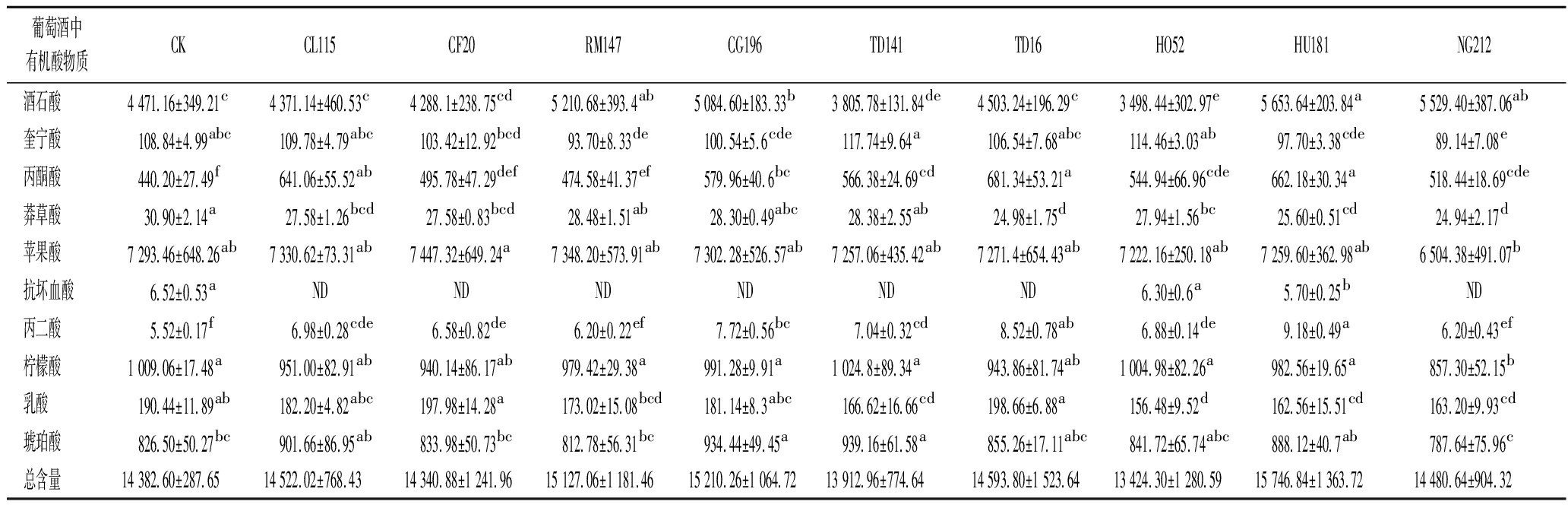
葡萄酒中有机酸物质CKCL115CF20RM147CG196TD141TD16HO52HU181NG212酒石酸4 471.16±349.21c4 371.14±460.53c4 288.1±238.75cd5 210.68±393.4ab5 084.60±183.33b3 805.78±131.84de4 503.24±196.29c3 498.44±302.97e5 653.64±203.84a5 529.40±387.06ab奎宁酸108.84±4.99abc109.78±4.79abc103.42±12.92bcd93.70±8.33de100.54±5.6cde117.74±9.64a106.54±7.68abc114.46±3.03ab97.70±3.38cde89.14±7.08e丙酮酸440.20±27.49f641.06±55.52ab495.78±47.29def474.58±41.37ef579.96±40.6bc566.38±24.69cd681.34±53.21a544.94±66.96cde662.18±30.34a518.44±18.69cde莽草酸30.90±2.14a27.58±1.26bcd27.58±0.83bcd28.48±1.51ab28.30±0.49abc28.38±2.55ab24.98±1.75d27.94±1.56bc25.60±0.51cd24.94±2.17d苹果酸7 293.46±648.26ab7 330.62±73.31ab7 447.32±649.24a7 348.20±573.91ab7 302.28±526.57ab7 257.06±435.42ab7 271.4±654.43ab7 222.16±250.18ab7 259.60±362.98ab6 504.38±491.07b抗坏血酸6.52±0.53aNDNDNDNDNDND6.30±0.6a5.70±0.25bND丙二酸5.52±0.17f6.98±0.28cde6.58±0.82de6.20±0.22ef7.72±0.56bc7.04±0.32cd8.52±0.78ab6.88±0.14de9.18±0.49a6.20±0.43ef柠檬酸1 009.06±17.48a951.00±82.91ab940.14±86.17ab979.42±29.38a991.28±9.91a1 024.8±89.34a943.86±81.74ab1 004.98±82.26a982.56±19.65a857.30±52.15b乳酸190.44±11.89ab182.20±4.82abc197.98±14.28a173.02±15.08bcd181.14±8.3abc166.62±16.66cd198.66±6.88a156.48±9.52d162.56±15.51cd163.20±9.93cd琥珀酸826.50±50.27bc901.66±86.95ab833.98±50.73bc812.78±56.31bc934.44±49.45a939.16±61.58a855.26±17.11abc841.72±65.74abc888.12±40.7ab787.64±75.96c总含量14 382.60±287.65 14 522.02±768.4314 340.88±1 241.9615 127.06±1 181.4615 210.26±1 064.7213 912.96±774.6414 593.80±1 523.6413 424.30±1 280.5915 746.84±1 363.7214 480.64±904.32
注:同行不同字母表示处理间差异显著(P<0.05);ND表示未检测到(下同)。
2.3 不同非酿酒酵母对威代尔冰酒多酚含量的影响
为了更好地了解不同非酿酒酵母对威代尔葡萄酒多酚组成及含量的影响,本研究测定了19种葡萄酒中常见的多酚类物质,由图2、表5可知,多数混菌发酵总酚含量比对照组均显著提高,其中CG196、HU181和CL115混菌发酵组酒样的多酚物质总含量在所有酒样中为最高,分别比对照组高出39.59、38.96、21.76 mg/L。此外,与对照组相比,除根皮苷和香草酸甲酯浓度有所降低,其余酚类物质含量均有不同程度提高。
没食子酸、原儿茶酸和龙胆酸等羟基苯甲酸类物质是葡萄酒中多酚含量的重要来源,直接影响酒的抗氧化能力和口感[21]。在本研究中,HO52处理组的羟基苯甲酸含量显著高于对照组,达到了1.30倍,同时也超过了其他处理组的1.26~1.49倍。此外,咖啡酸、香豆酸和阿魏酸等肉桂酸类物质作为重要的辅色素,能显著提高花色苷的稳定性[22]。特别是在HU181处理组中,肉桂酸类含量是对照组的1.17倍,这可能表明HU181所酿冰酒具有较强的花色苷稳定性。
为探究不同本土非酿酒酵母与单体酚之间联系,对不同发酵组进行聚类分析,结果如图2所示,10组酒样可划分为两类:一类为HO52组酒样,另一类包括其余9组酒样。在区分HO52组与其他组方面,龙胆酸、槲皮素、3-羟基肉桂酸和对香豆酸表现出较好的效果。
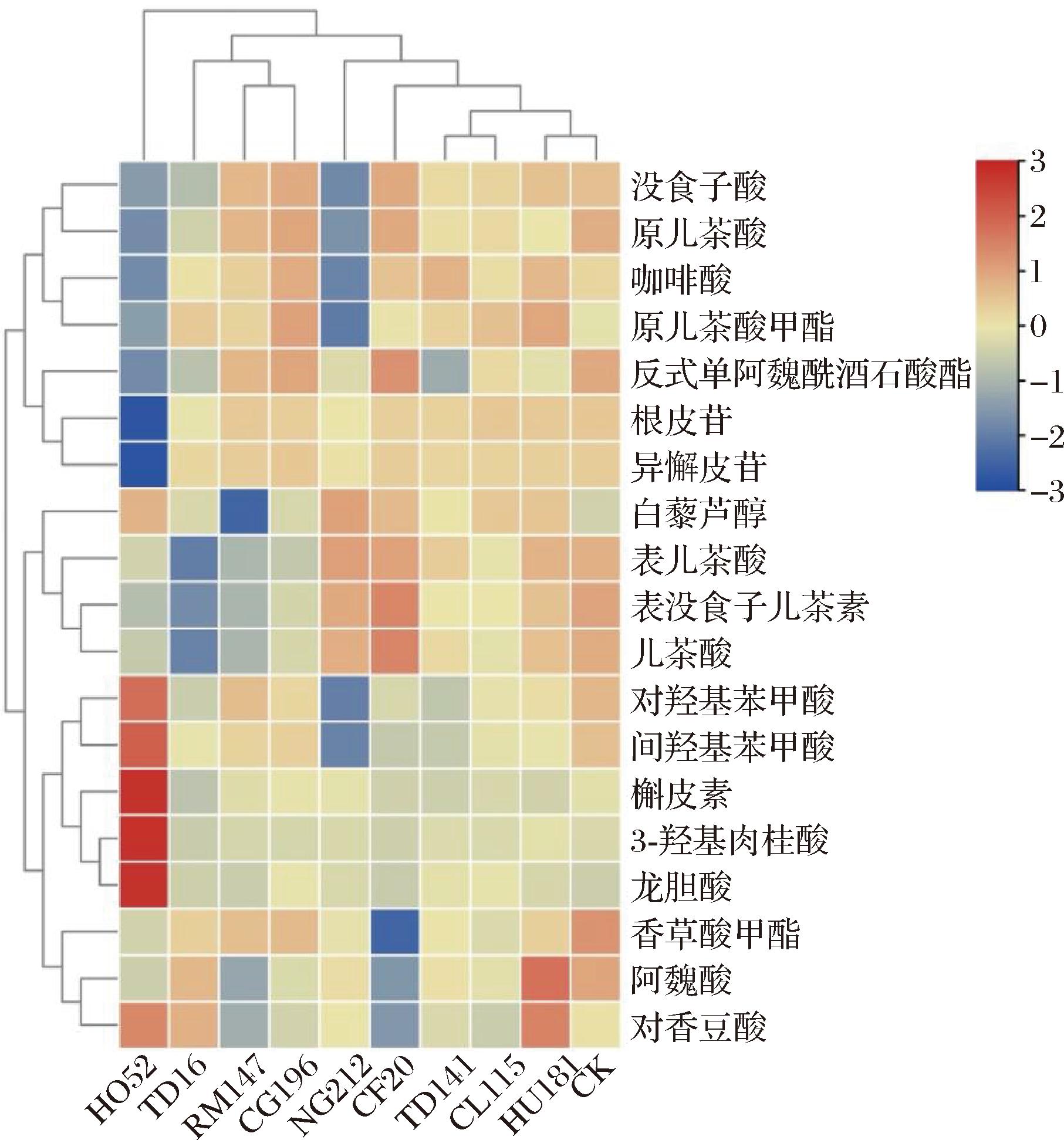
图2 不同发酵组多酚含量分布及聚类
Fig.2 Polyphenol content and clustering of different fermentation groups
表5 不同发酵组多酚含量 单位:mg/L
Table 5 Polyphenol content of different fermentation groups
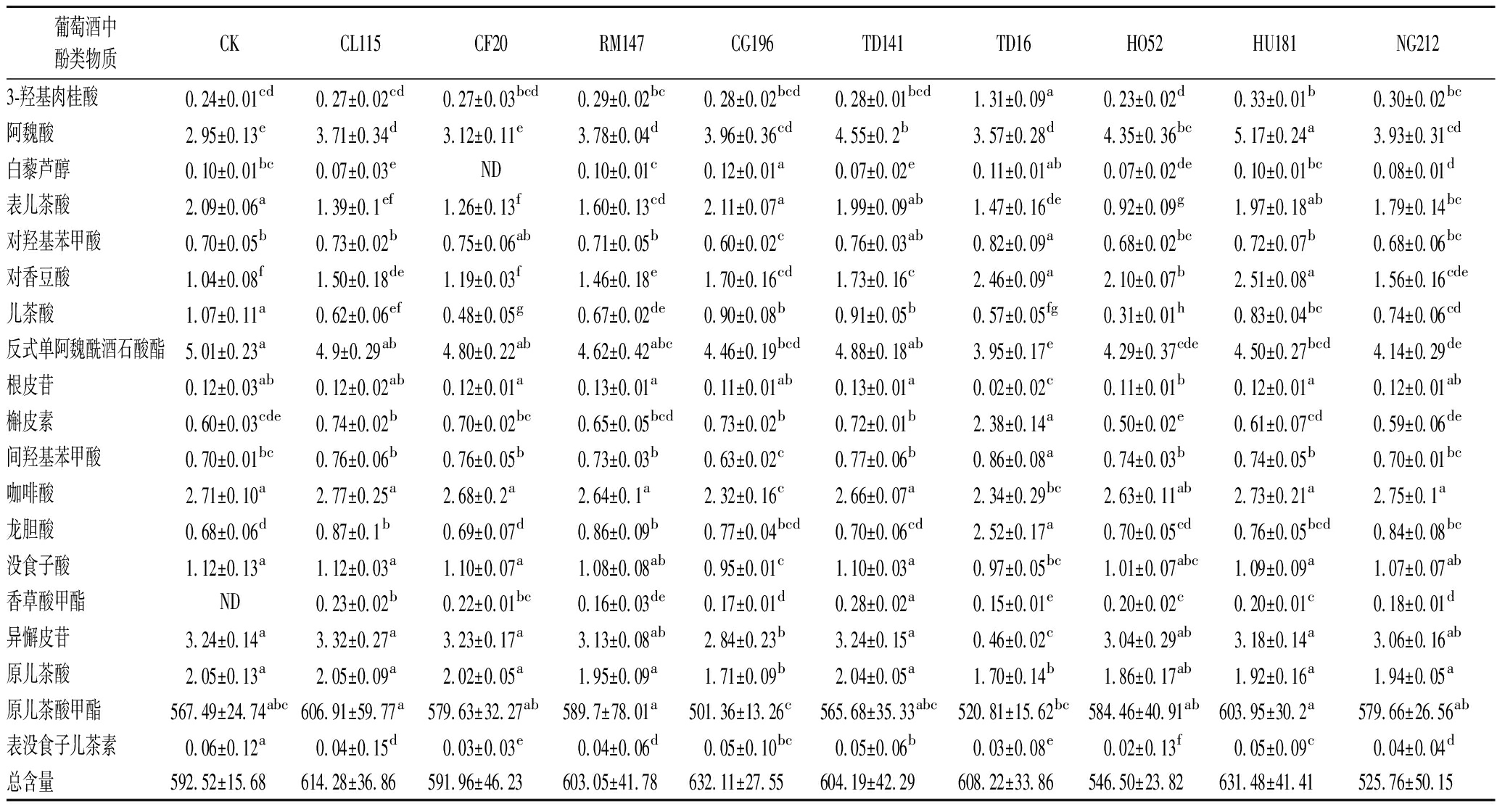
葡萄酒中酚类物质CKCL115CF20RM147CG196TD141TD16HO52HU181NG2123-羟基肉桂酸0.24±0.01cd0.27±0.02cd0.27±0.03bcd0.29±0.02bc0.28±0.02bcd0.28±0.01bcd1.31±0.09a0.23±0.02d0.33±0.01b0.30±0.02bc阿魏酸2.95±0.13e3.71±0.34d3.12±0.11e3.78±0.04d3.96±0.36cd4.55±0.2b3.57±0.28d4.35±0.36bc5.17±0.24a3.93±0.31cd白藜芦醇0.10±0.01bc0.07±0.03eND0.10±0.01c0.12±0.01a0.07±0.02e0.11±0.01ab0.07±0.02de0.10±0.01bc0.08±0.01d表儿茶酸2.09±0.06a1.39±0.1ef1.26±0.13f1.60±0.13cd2.11±0.07a1.99±0.09ab1.47±0.16de0.92±0.09g1.97±0.18ab1.79±0.14bc对羟基苯甲酸0.70±0.05b0.73±0.02b0.75±0.06ab0.71±0.05b0.60±0.02c0.76±0.03ab0.82±0.09a0.68±0.02bc0.72±0.07b0.68±0.06bc对香豆酸1.04±0.08f1.50±0.18de1.19±0.03f1.46±0.18e1.70±0.16cd1.73±0.16c2.46±0.09a2.10±0.07b2.51±0.08a1.56±0.16cde儿茶酸1.07±0.11a0.62±0.06ef0.48±0.05g0.67±0.02de0.90±0.08b0.91±0.05b0.57±0.05fg0.31±0.01h0.83±0.04bc0.74±0.06cd反式单阿魏酰酒石酸酯5.01±0.23a4.9±0.29ab4.80±0.22ab4.62±0.42abc4.46±0.19bcd4.88±0.18ab3.95±0.17e4.29±0.37cde4.50±0.27bcd4.14±0.29de根皮苷0.12±0.03ab0.12±0.02ab0.12±0.01a0.13±0.01a0.11±0.01ab0.13±0.01a0.02±0.02c0.11±0.01b0.12±0.01a0.12±0.01ab槲皮素0.60±0.03cde0.74±0.02b0.70±0.02bc0.65±0.05bcd0.73±0.02b0.72±0.01b2.38±0.14a0.50±0.02e0.61±0.07cd0.59±0.06de间羟基苯甲酸0.70±0.01bc0.76±0.06b0.76±0.05b0.73±0.03b0.63±0.02c0.77±0.06b0.86±0.08a0.74±0.03b0.74±0.05b0.70±0.01bc咖啡酸2.71±0.10a2.77±0.25a2.68±0.2a2.64±0.1a2.32±0.16c2.66±0.07a2.34±0.29bc2.63±0.11ab2.73±0.21a2.75±0.1a龙胆酸0.68±0.06d0.87±0.1b0.69±0.07d0.86±0.09b0.77±0.04bcd0.70±0.06cd2.52±0.17a0.70±0.05cd0.76±0.05bcd0.84±0.08bc没食子酸1.12±0.13a1.12±0.03a1.10±0.07a1.08±0.08ab0.95±0.01c1.10±0.03a0.97±0.05bc1.01±0.07abc1.09±0.09a1.07±0.07ab香草酸甲酯ND0.23±0.02b0.22±0.01bc0.16±0.03de0.17±0.01d0.28±0.02a0.15±0.01e0.20±0.02c0.20±0.01c0.18±0.01d异懈皮苷3.24±0.14a3.32±0.27a3.23±0.17a3.13±0.08ab2.84±0.23b3.24±0.15a0.46±0.02c3.04±0.29ab3.18±0.14a3.06±0.16ab原儿茶酸2.05±0.13a2.05±0.09a2.02±0.05a1.95±0.09a1.71±0.09b2.04±0.05a1.70±0.14b1.86±0.17ab1.92±0.16a1.94±0.05a原儿茶酸甲酯567.49±24.74abc606.91±59.77a579.63±32.27ab589.7±78.01a501.36±13.26c565.68±35.33abc520.81±15.62bc584.46±40.91ab603.95±30.2a579.66±26.56ab表没食子儿茶素0.06±0.12a0.04±0.15d0.03±0.03e0.04±0.06d0.05±0.10bc0.05±0.06b0.03±0.08e0.02±0.13f0.05±0.09c0.04±0.04d总含量592.52±15.68614.28±36.86591.96±46.23603.05±41.78632.11±27.55604.19±42.29608.22±33.86546.50±23.82631.48±41.41525.76±50.15
2.4 香气物质
2.4.1 总挥发性香气物质种类和含量分析
本文通过固相微萃取-气相色谱-质谱(solid-phase microextraction gas chromatography mass spectrometry,SPME-GC-MS)技术对10组酒样进行综合分析,定量其挥发性香气成分。分析共鉴定出187种香气化合物,包括46种醇类、64种酯类、15种酸类、10种酚醛类、8种酮类、23种烷烃类、14种萜烯类和7种其他类香气化合物。其中,醇类和酯类为主要贡献者,其含量之和占到了总挥发性物质的90%以上。如图3所示,各处理组样品中挥发性香气总含量的差异显著,总量为97.82~162.17 mg/L,HO52酒样显示出较高的挥发性香气物质含量。这一结果表明非酿酒酵母的共发酵体系中,香气物质的生成具有显著的协同作用[23]。此外,值得注意的是,与对照组相比,NG212处理组的挥发性香气物质总含量较低,这可能表明该菌株对冰酒发酵过程的贡献较小,类似的观察也见于VICENTE等[24]的研究。
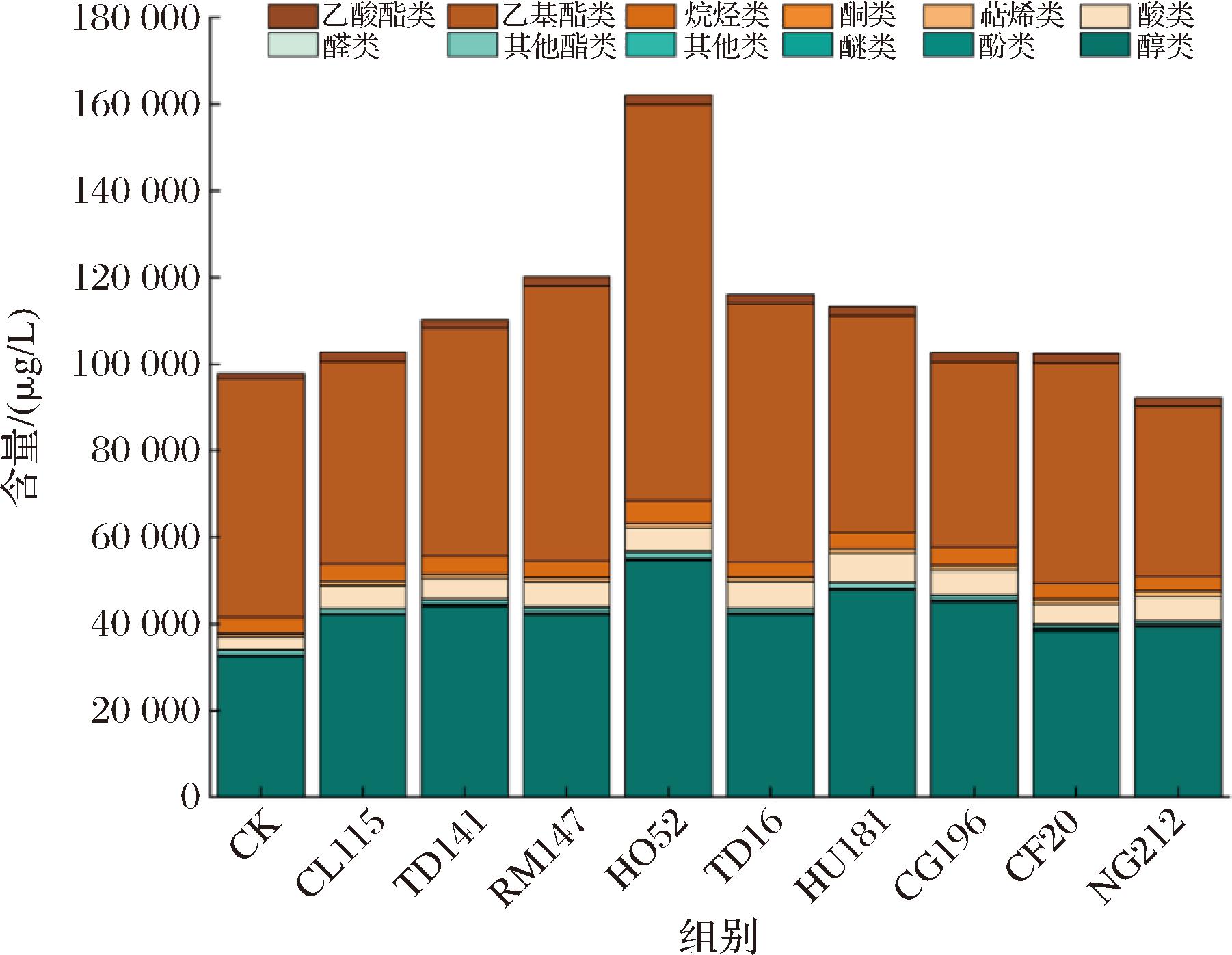
图3 不同发酵组酒样挥发性香气物质组成
Fig.3 Volatile aroma composition of wine samples from different fermentation groups
2.4.2 香气活性值(odour activity value,OAV)
OAV由物质含量除以其嗅觉阈值得到[25]。由图4可知,10组不同处理组酒样共有24种挥发性香气化合物的浓度超过了其活性阈值(OAV>1)。其中,HU181酒样中高活性香气化合物种类最多,比对照组酒样中的种类多了3种。
酯类化合物作为乙醇发酵的主要副产品之一,对于葡萄酒的花香和果香贡献显著[26]。由图4可知,与商业酿酒酵母单独发酵相比,混菌发酵可以显著提高酯类化合物的产量,进而增加葡萄酒的果香和香气的复杂度。这种效应可能是由于不同酵母在发酵过程中的相互作用,促进了酯类化合物的生成[27]。特别地,乙酸苯乙酯,作为一种关键的芳香化合物,在其质量浓度超过0.25 mg/L时,能显著丰富葡萄酒的香气,赋予其诸如香蕉般的独特果味[28]。进一步研究显示,葡萄汁有孢汉逊酵母(HU181)可增加葡萄酒中乙酸异戊酯的含量,与现有文献结果一致[29]。在HO52组酒样中,己酸乙酯和月桂酸乙酯等酯类物质含量显著高于对照组,其中己酸乙酯的OAV为对照组的2.50倍,对冰酒的甜水果气味和葡萄香气具有重要贡献,这一发现验证了汉逊酵母在增加葡萄酒香气风味丰富度方面的潜力[30]。然而,其他非酿酒酵母相对于汉逊酵母对酯类化合物的影响并无显著差异,相比之下,对照组的异戊酸乙酯含量较高,这进一步突出了其花果香特征。
高级醇是冰酒中关键的香气成分。研究表明,当高级醇的总含量超过400 mg/L时,会引发一种强烈且不愉快的气味;相反,当这些醇类化合物的质量浓度保持在300 mg/L以下时,它们有助于提升香气的复杂性和层次感[30]。本研究中,所有酒样的高级醇含量均保持在300 mg/L以下。相较于对照组,采用混合发酵处理的酒样中高级醇的总量显著增加,其中HO52组酒样的高级醇浓度最高,为对照组的2.06倍。特别地,异戊醇作为一种重要的高级醇,能够为葡萄酒带来指甲油般的清新香气[31]。研究发现,HO52和HU181组中异戊醇的含量显著提升,其中HO52组的异戊醇含量最高,达到37.94 mg/L。此外,HO52菌株混合发酵显著提高了己醇含量, 这为冰酒增添了松子或坚果等愉悦的香气[32],从而显著提升了冰酒的香气品质。
萜烯类化合物的阈值较低,是形成花果香主要来源,其含量显著受到发酵菌株种类的影响[33]。β-大马士酮是威代尔冰酒中的关键香气化合物,能够增强蜂蜜、焦糖、热带水果和玫瑰的香气特征[31]。由表6和图4-a可知,HO52和商业酿酒酵母混菌发酵时,β-大马士酮和香茅醇的含量比对照组增加了约50%,此外,其余实验组酒样中β-大马士酮的OAV值是对照组的1.7~2.5倍,充分展示了本土非酿酒酵母对提升冰酒香气质量的潜力。
2.4.3 主成分分析(principal component analysis,PCA)
为了更清晰地区分各处理之间高活性挥发性香气成分的差异,利用R语言软件对所有OAV>1的25种挥发性香气成分进行PCA。由图5可知,PC1与PC2分别占数据总体方差的41.78%和26.72%,总贡献率为68.50%。
由图5可知,HO52和TD141酒样位于分布在PC1正半轴及PC2负半轴上,显示出与月桂酸乙酯、乙酸异戊酯、辛酸乙酯、癸酸乙酯等酯类物质以及癸醛、正己醇和正庚醇等的香气物质信息的正相关性,这一特征赋予了酒样浓郁复杂的花果香和水果香。且HO52酒样与其他处理组酒样相距较大,这表明与其他处理组的香气特性存在较大差异。CG196和CL115分布在PC1、PC2正半轴上,与3-苯丙酸乙酯、乙酸苯乙酯、乙基9-癸烯酸酯、辛酸等物质的香气特征呈正相关。此外,NG212、RM147、HU181、TD16和CF20等酒样集中分布在PC2正半轴上。其中,CG196、HU181和CL115酒样与癸酸乙酯、乙酸苯乙酯、辛酸等物质的香气特征呈正相关。相对而言,CF20、RM147和NG212等酒样所处区域挥发性物质单一,主要表现为辛醇的玫瑰香气特征。在对照组中,酒样所处区域远离其他9组实验组,表明对照组香气物质相对单一,进一步强调了实验处理组对冰酒香气特征的显著影响。

a-OAV>1香气物质含量叠堆图;b-聚类热图;c-韦恩图
图4 不同发酵组酒样香气活性物质(OAV>1)
Fig.4 Aromatic activity substances in wine samples from different fermentation groups (OAV>1)
2.5 感官分析
各处理组酒样感官评价雷达图结果表明(图6),所有冰酒样品均符合‘威代尔’冰葡萄酒的标准,呈现澄清透明和透明金黄色外观。在对照组的酒样中,生青味和酒精味较为明显,与测定的理化指标一致。尽管香气较为单一,但由异戊酸乙酯产生的愉悦果香为整体香气带来了一定的平衡。HU181组的酒样由于酒石酸等有机酸含量较高,入口感偏酸;然而,其热带水果香气浓郁,主要得益于较高的乙基酯类物质含量。TD141组和HO52组在酸甜平衡方面表现出色,特别是HO52组,其酒样不仅展现了复杂的花香和果香层次,而且香气得分高,呈现出浓郁而纯正的特征香气,较好地保留了威代尔冰葡萄酒的特征风味。这些特征与月桂酸乙酯、乙酸异戊酯等酯类物质以及癸醛、正己醇和正庚醇等香气物质的高含量密切相关。其他混菌发酵组的酒样之间未显示出显著差异。总体而言,HO52组的表现优于其他酒样。
表6 不同发酵组冰酒中OAV>1的香气成分
Table 6 Aroma composition of OAV>1 in ice wines from different fermentation groups

香气化合物含量/(μg/L)CKCL115CF20RM147CG196阈值/(μg/L)[28,31-32,34-35]香气特征描述[28,31-32]庚酸乙酯37.09±3.4de46.18±1.67c25.90±2.21g33.10±1.52ef42.89±3.81cd2.2菠萝、果香 辛酸乙酯23 176.45±1447.37c22 147.81±585.98c16 097.43±425.9ef17 086.39±1459.86de19 259.69±694.42d5杏子香,果香月桂酸乙酯730.24±59.77e2 164.57±156.09bNDND1 725.43±96.07c1 500甜味、奶油味异戊酸乙酯985.3±61.53aNDNDNDND3菠萝癸酸乙酯24 318.86±2867.15bND17 838.38±1 634.91d26 475.93±2 426.56bND200果香味、脂肪正己酸乙酯1 669.71±132.53de2 003.66±183.64bc1 313.44±102.58f1 600.87±16.01e1 918.31±76.73cd5青苹果、草莓3-苯丙酸乙酯ND592.37±46.27ab168.56±2.92d550.90±62.57bc625.57±34.83a1.6 —乙基9-癸烯酸酯13 730.51±951.28ef18 927.40±378.55c13 690.66±1 086.66ef15 464.61±557.58de18 382.90±486.37c100 —乙酸苯乙酯1 094.12±47.69d1 892.55±199.39abc2 024.75±105.21a1 971.27±219.51abc1 989.95±155.42ab250花香、水果香乙酸异戊酯96.95±7.94c93.91±7.45c86.38±7.92c93.28±5.19c112.57±4.91b30果香、鲜香蕉正己醇110.84±10.16ef99.30±8.66f113.53±3.93def124.38±11.19cde128.12±5.87c110生青味、果香正庚醇310.44±31.51f418.58±36.25de339.50±8.98f383.24±32.74e447.11±17.88cd250生青味、甜味辛醇207.55±8.3d387.34±10.25b393.42±13.63b436.86±47.25a397.24±24.16ab40玫瑰、柑橘 异戊醇18 088.93±1253.24g25 800.25±1 787.49def24 146.76±638.86ef23 207.63±1 624.53f29 502.28±1 063.72bc30 000指甲油味1,3-丙二醇单乙醚48.75±3.41e83.16±7.93bc108.03±8.57a86.12±4.31b85.29±6.98b100 —2-甲基萘41.86±2.55gh40.38±3.31h54.93±3.85def62.25±4.94bc58.97±5.24cd58.1 —辛酸异戊酯112.38±9.8h194.37±18.54b116.54±3.5gh113.67±3.41gh150.73±7.83de125奶酪、果香癸醛54.12±3.38b40.31±3.69def42.93±1.97cd48.39±1.74c43.36±1.89cd10 —十四醛三聚物NDNDNDNDND6 —辛酸445.67±34.81f2 081.61±62.45a1 319.46±26.39e1 643.99±32.88d1 920.16±38.4b500杏仁味、黄油味9-癸烯酸ND194.75±22.96b135.53±4.89de163.52±14.99c226.92±14.17a40 —香茅醇146.58±14.66g250.56±23.9bc237.44±16.62cde232.67±9.31cde274.27±5.49b100玫瑰、青柠檬大马士酮34.30±1.71d67.39±7.29b64.76±4.53bc67.18±4.7b70.48±6.26b0.05甜苹果、梨子1,1-二乙氧基乙烷ND538.41±32.75e619.69±28.4de568.05±26.03de715.60±31.19c1 000 —香气化合物含量/(μg/L)TD141TD16NG212HU181HO52阈值/(μg/L)[28,31-32,34-35]香气特征描述[28,31-32]庚酸乙酯57.72±4.62b33.96±1.7e38.68±3.44de27.39±2.51fg78.39±7.48a2.2菠萝、果香 辛酸乙酯26 021.52±2 253.53b16 128.93±739.12ef18 089.00±2 014.31de13 645.87±894.82f35 830.71±3 061.38a5杏子香,果香月桂酸乙酯1 745.95±87.3c1 635.47±117.94cdND1 531.79±0d2 451.37±106.85a1 500甜味、奶油味异戊酸乙酯NDNDNDNDND3菠萝癸酸乙酯ND25 337.02±913.54bND20 567.15±1 068.7c34 574.24±1 246.59a200果香味、脂肪正己酸乙酯2 229.37±176.95b1 207.44±73.45fg1 783.35±175.64cde1 019.97±53.97g4 174.26±356.65a5青苹果、草莓3-苯丙酸乙酯591.96±41.44ab578.49±41.72ab619.26±37.67a493.70±19.75c533.49±19.24bc1.6 —乙基9-癸烯酸酯20 864.98±1 460.55b14 020.07±1516.5e16 265.01±1759.33d12 076.66±435.43f22 653.72±599.36a100 —乙酸苯乙酯1 728.59±103.72bc1 944.40±121.43abc1 985.46±221.09ab1 912.08±163.37abc1 709.40±149.02c250花香、水果香乙酸异戊酯124.31±5.42b93.98±1.88c94.21±3.4c115.33±9.15b395.69±18.13a30果香、鲜香蕉正己醇112.48±6.75ef115.59±4.17cde189.36±8.68a126.86±12.23cd155.62±8.23b110生青味、果香正庚醇496.24±8.6b390.99±32e481.38±24.07bc407.21±22.67de599.61±17.99a250生青味、甜味辛醇223.97±19.53d391.74±15.67b437.31±34.15a335.90±30.79cND40玫瑰、柑橘 异戊醇28 249.73±747.42bcd27 268.94±2329.86cde25 183.94±908.02def31 183.60±2974.73b37 937.25±3307.29a30 000指甲油味1,3-丙二醇单乙醚85.28±4.51b74.8±3.26cd75.30±6.9cd85.09±1.47b73.20±1.27d100 —2-甲基萘48.92±4.26ef55.59±4.41cde48.55±2.23fg68.02±3.53ab73.05±4.44a58.1 —辛酸异戊酯176.96±14.49bc163.09±11.42cd138.22±3.66ef131.11±5.72fg230.92±16.16a125奶酪、果香癸醛36.69±1.1f43.53±3.87cd42.38±3.39de36.93±3.28ef67.06±5.85a10 —十四醛三聚物NDNDND11.55±0.4aND6 —辛酸1 430.59±62.36e2 095.80±41.92a1 801.57±90.08c2 095.33±55.44a1 707.28±139.75cd500杏仁味、黄油味9-癸烯酸137.26±5.98de149.9±11.9cd125.01±1.25e238.09±25.75a153.40±14.06cd40 —香茅醇244.01±30.48bcd213.07±2.13def204.27±24.08ef196.09±3.92f375.22±41.78a100玫瑰、青柠檬大马士酮58.74±5.29c66.83±1.77bc63.43±2.91bc65.11±2.84bc88.74±6.7a0.05甜苹果、梨子1,1-二乙氧基乙烷842.67±33.71b583.86±42.1de628.15±33.24d1 042.67±128.13a595.80±31.53de1 000 —
注:—表示未查阅到相关资料。
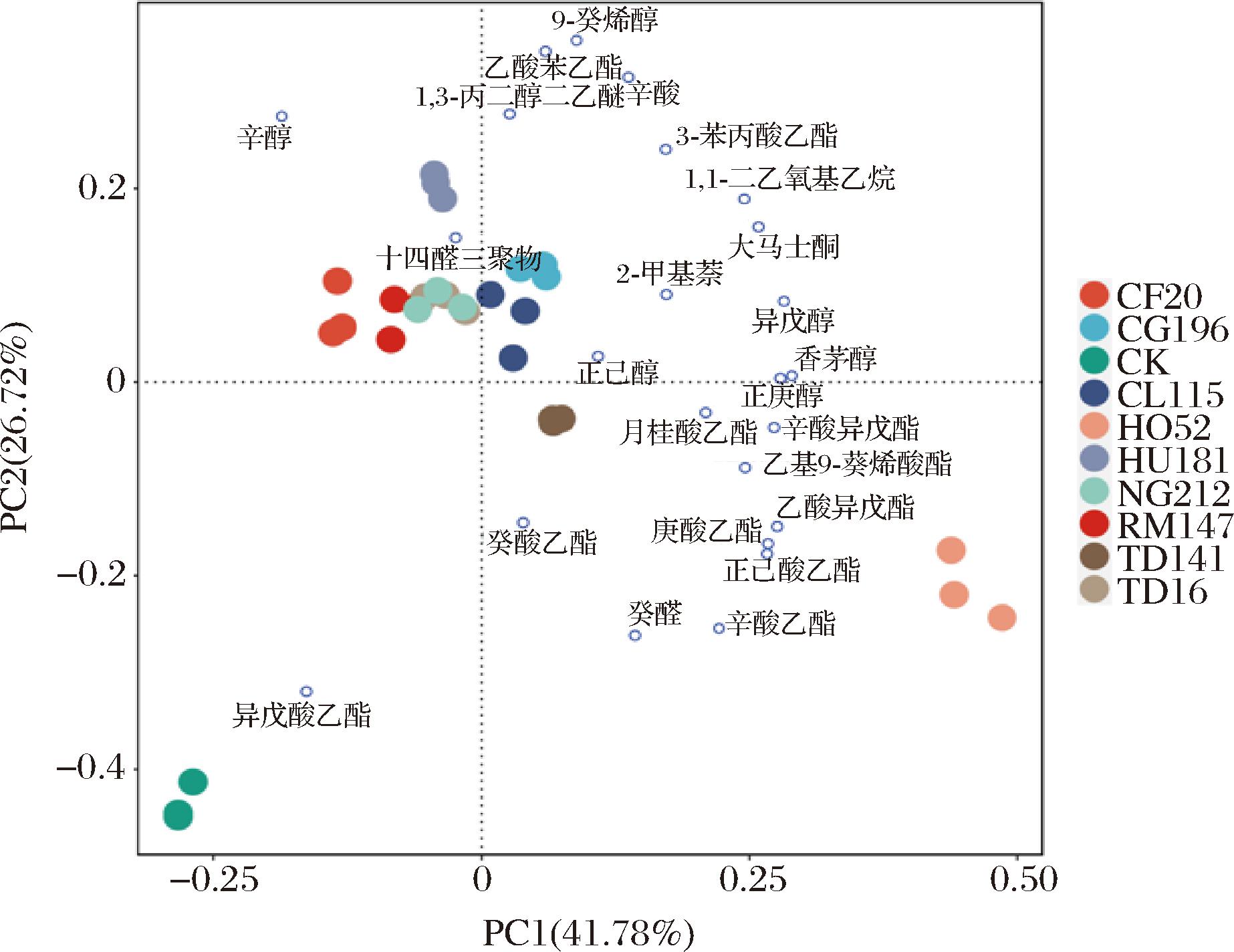
图5 不同发酵组酒样OAV>1的香气化合物PCA图
Fig.5 Plot of PCA of aroma compounds for wine samples with OAV>1 from different fermentation groups
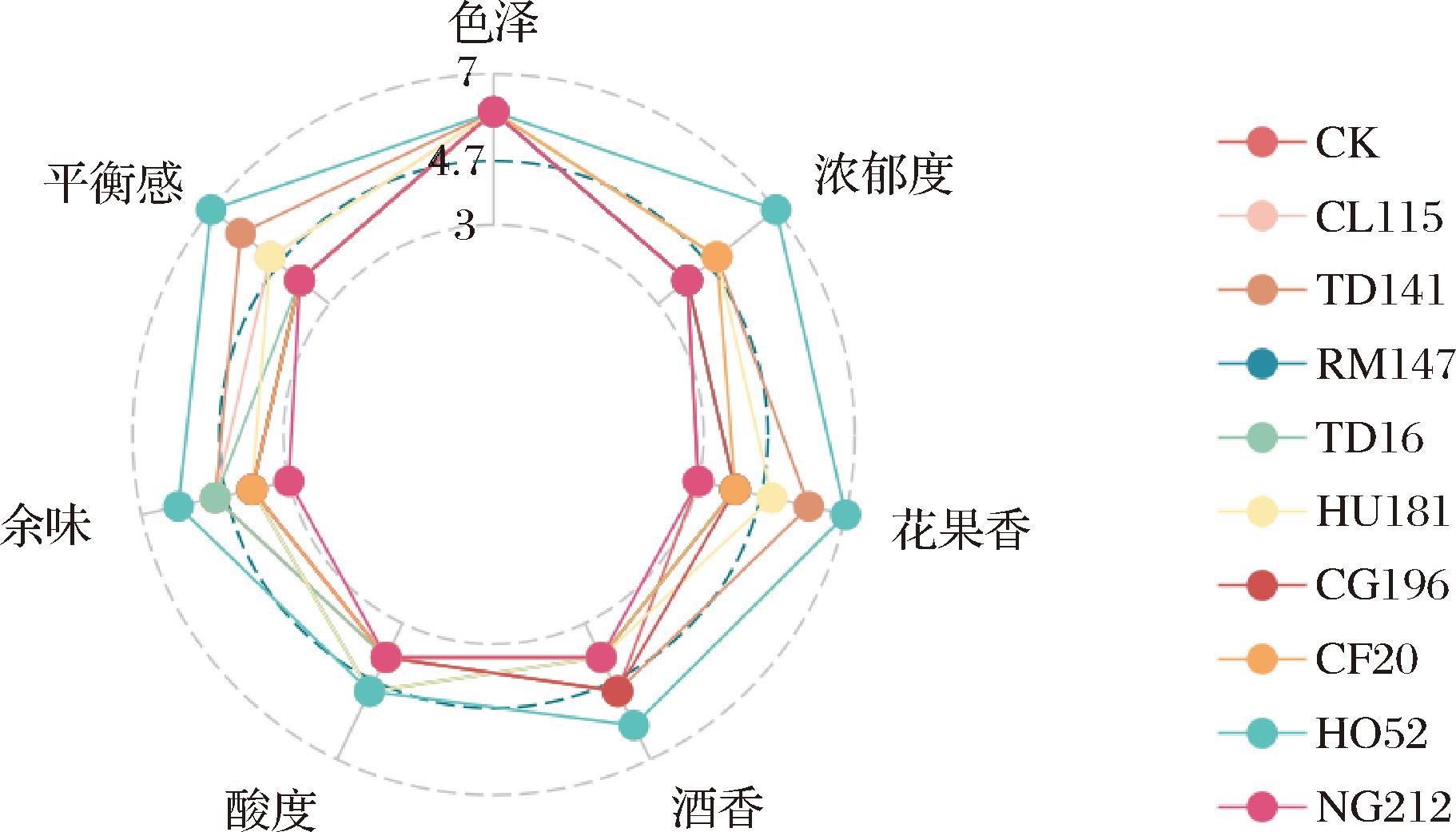
图6 感官分析雷达图
Fig.6 Sensory analysis radar chart
3 结论
本研究系统地探讨了利用本土非酿酒酵母混菌发酵对贺兰山东麓‘威代尔’冰酒的风味品质的影响。与传统酿酒酵母单一发酵相比,本土非酿酒酵母显著影响了冰酒的风味轮廓,尤其是在香气特性的形成上。具体而言,HO52菌株显著增加了冰酒中3-羟基肉桂酸、槲皮素和龙胆酸等关键多酚的含量,TD141菌株则在提高琥珀酸含量方面表现突出。而CF20菌株混菌发酵的冰酒中,表没食子儿茶素、儿茶酸和没食子酸的浓度最为集中。
在香气成分的研究中,HU181菌株显著提高了冰酒中乙酸异戊酯等酯类化合物的含量,增强了冰酒的香蕉等果香特征。同时,HO52和TD141两组酒样在挥发性高活性香气物质的表达上显示出显著差异,尤其是HO52菌株混酿酒样,挥发性香气物质总量增加了60.6%,包括己酸乙酯、月桂酸乙酯、异戊醇和β-大马士酮等,显著增强了冰酒的花果香和坚果等香气特征。相比之下,RM147、CF20和CG196等菌株虽然也能增加冰酒的香气多样性,但其香气差异性并不显著。最后,NG212菌株由于在发酵过程的贡献较小,对所酿冰酒香气轮廓的影响也较为有限。
以上结果表明,HO52菌株和商业酿酒酵母混菌发酵对改善贺兰山东麓威代尔冰葡萄酒风味品质的效果更好。这些发现进一步验证了本土非酿酒酵母在冰酒生产中的应用潜力,尤其是在增强冰酒的香气复杂性和层次感方面的贡献。后续研究将深入探讨本土非酿酒酵母与酿酒酵母的互作机制,以全面评估并优选出适合酿造冰酒的本土非酿酒酵母,旨在为贺兰山东麓威代尔冰葡萄酒酿造提供坚实的理论支撑。
[1] CHIDI B S, MAFATA M, NOTSHOKOVU N Z, et al.Impact of grape temperature at pressing on organic acids and oenological characteristics of methode cap classique wines[J].South African Journal of Enology and Viticulture, 2018, 39(1):106-115.
[2] 马玥, 唐柯, 徐岩, 等.固相萃取结合GC-O/MS分析威代尔冰葡萄酒中的香气活性化合物[J].食品与发酵工业, 2015,41(4):153-159.
MA Y, TANG K, XU Y, et al.Solid-phase extraction-GC-O/MS for the analysis of odor-active volatile compounds in Vidal icewine[J].Food and Fermentation Industries, 2015, 41(4):153-159.
[3] HUANG L, MA Y, TIAN X, et al.Chemosensory characteristics of regional Vidal icewines from China and Canada[J].Food Chemistry, 2018, 261:66-74.
[4] 卜光明, 周化斌, 周茂洪, 等.酿造酒中非酿酒酵母的研究进展[J].食品工业科技, 2019, 40(14):346-352.
BU G M, ZHOU H B, ZHOU M H, et al.Research progress on the non-Saccharomyces in the brewing wine fermentation[J].Science and Technology of Food Industry, 2019, 40(14):346-352.
[5] TUFARIELLO M, FRAGASSO M, PICO J, et al.Influence of non-Saccharomyces on wine chemistry:A focus on aroma-related compounds[J].Molecules, 2021, 26(3):644.
[6] ZHANG B Q, SHEN J Y, DUAN C Q, et al.Use of indigenous Hanseniaspora vineae and Metschnikowia pulcherrima co-fermentation with Saccharomyces cerevisiae to improve the aroma diversity of Vidal Blanc icewine[J].Frontiers in Microbiology, 2018, 9:2303.
[7] JIANG X H, LU Y Y, LIU S Q.Effects of different yeasts on physicochemical and oenological properties of red dragon fruit wine fermented with Saccharomyces cerevisiae, Torulaspora delbrueckii and Lachancea thermotolerans[J].Microorganisms, 2020, 8(3):153.
[8] SUN Y, LI E H, QI X T, et al.Changes of diversity and population of yeasts during the fermentations by pure and mixed inoculation of Saccharomyces cerevisiae strains[J].Annals of Microbiology, 2015, 65(2):911-919.
[9] LIN M M H, BOSS P K, WALKER M E, et al.Evaluation of indigenous non-Saccharomyces yeasts isolated from a South Australian vineyard for their potential as wine starter cultures[J].International Journal of Food Microbiology, 2020, 312:108373.
[10] HU K, JIN G J, MEI W C, et al.Increase of medium-chain fatty acid ethyl ester content in mixed H.uvarum/S.cerevisiae fermentation leads to wine fruity aroma enhancement[J].Food Chemistry, 2018, 239:495-501.
[11] 郑海宏, 罗华, 侯红萍.葡萄醋发酵工艺研究及其有机酸组分分析[J].中国酿造, 2019, 38(2):139-143.
ZHENG H H, LUO H, HOU H P.Fermentation technology of grape vinegar and analysis of its organic acid components[J].China Brewing, 2019, 38(2):139-143.
[12] WEI J P, ZHANG Y X, QIU Y, et al.Chemical composition, sensorial properties, and aroma-active compounds of ciders fermented with Hanseniaspora osmophila and Torulaspora quercuum in co- and sequential fermentations[J].Food Chemistry, 2020, 306:125623.
[13] PRIOR K J, BAUER F F, DIVOL B.The utilisation of nitrogenous compounds by commercial non-Saccharomyces yeasts associated with wine[J].Food Microbiology, 2019, 79:75-84.
[14] 田秀, 许引虎, 李惠琳, 等.产硫化氢酿酒酵母菌株对黑比诺干红葡萄酒品质的影响[J].食品与发酵工业, 2018, 44(5):115-124.
TIAN X, XU Y H, LI H L, et al.Effects of Saccharomyces cerevisiae strains producing hydrogen sulfide on the quality of Pinot Noir dry red wine[J].Food and Fermentation Industries, 2018, 44(5):115-124.
[15] CONTRERAS A, HIDALGO C, SCHMIDT S, et al.The application of non-Saccharomyces yeast in fermentations with limited aeration as a strategy for the production of wine with reduced alcohol content[J].International Journal of Food Microbiology, 2015, 205:7-15.
[16] BALMASEDA A, ROZ S N, BORDONS A, et al.Torulaspora delbrueckii promotes malolactic fermentation in high polyphenolic red wines[J].LWT, 2021,148:111777.
S N, BORDONS A, et al.Torulaspora delbrueckii promotes malolactic fermentation in high polyphenolic red wines[J].LWT, 2021,148:111777.
[17] 唐柯, 王蓓, 马玥, 等.不同酵母与温度发酵的威代尔冰葡萄酒有机酸分析[J].食品与发酵工业, 2015,41(8):153-158.
TANG K, WANG B, MA Y, et al.Analysis of organic acids in Vidal ice wine fermented with different species of yeast strains at different temperatures[J].Food and Fermentation Industries, 2015, 41(8):153-158.
[18] 曾竟蓝, 马胤鹏, 秦丹, 等.果酒中有机酸的作用及检测方法研究[J].中国酿造, 2018, 37(6):183-187.
ZENG J L, MA Y P, QIN D, et al.Research on effect and detection method of organic acids in fruit wine[J].China Brewing, 2018, 37(6):183-187.
[19] 刘晓燕, 张小月, 阿卜杜喀依尔·阿卜杜艾尼, 等.混菌发酵、酒泥陈酿结合β-葡聚糖酶对赤霞珠干红葡萄酒有机酸含量的影响[J].食品与发酵工业, 2022, 48(15):55-61.
LIU X Y, ZHANG X Y, ABUDUOAINI A, et al.Effects of mixed fermentation,wine lees aging combined with β-glucanase on organic acid content of Cabernet Sauvignon dry red wine[J].Food and Fermentation Industries, 2022, 48(15):55-61.
[20] 邓海霞, 郭晨晨, 李二虎.酿酒酵母乙酸代谢调控机制及低产菌株选育的研究进展[J].食品科学, 2023,44(13):183-192.
DENG H X, GUO C C, LI E H.Research progress on the regulation mechanism of acetic acid metabolism in Saccharomyces cerevisiae and breeding of low acetic acid-producing strains[J].Food Science, 2023, 44(13):183-192.
[21] 张欣珂, 赵旭, 成池芳, 等.葡萄酒中的酚类物质Ⅰ:种类、结构及其检测方法研究进展[J].食品科学, 2019, 40(15):255-268.
ZHANG X K, ZHAO X, CHENG C F, et al.Phenolics in wines Ⅰ:A review of categories, structures and detection methods[J].Food Science, 2019, 40(15):255-268.
[22] 万宁静, 尹鼎泽, 王平, 等.不同生态区摩尔多瓦葡萄酒的风味物质及感官特征解析[J].食品与发酵工业, 2025,51(5):299-309.
WAN N J, YIN D Z, WANG P, et al.Analysis of flavor compounds and sensory characteristics of Moldovan wines from different ecological zones[J].Food and Fermentation Industries, 2025,51(5):299-309.
[23] SADOUDI M, TOURDOT-MARÉCHAL R, ROUSSEAUX S, et al.Yeast-yeast interactions revealed by aromatic profile analysis of Sauvignon Blanc wine fermented by single or co-culture of non-Saccharomyces and Saccharomyces yeasts[J].Food Microbiology, 2012, 32(2):243-253.
[24] VICENTE J, RUIZ J, TOMASI S, et al.Impact of rare yeasts in Saccharomyces cerevisiae wine fermentation performance:Population prevalence and growth phenotype of Cyberlindnera fabianii, Kazachstania unispora, and Naganishia globosa[J].Food Microbiology, 2023, 110:104189.
[25] 张文静, 杨诗妮, 杜爽, 等.本土毕赤克鲁维酵母与酿酒酵母混合发酵葡萄酒的增香潜力分析[J].食品科学, 2020, 41(12):84-90.
ZHANG W J, YANG S N, DU S, et al.Potential application of mixed starter cultures of indigenous Pichia kluyveri and Saccharomyces cerevisiae to wine aroma enhancement[J].Food Science, 2020, 41(12):84-90.
[26] LIU P T, LU L, DUAN C Q, et al.The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J].LWT, 2016, 71:356-363.
[27] 申静云, 刘沛通, 段长青, 等.不同有孢汉逊酵母与酿酒酵母混合发酵对威代尔冰葡萄酒香气的影响[J].食品与发酵工业, 2017, 43(10):16-23.
SHEN J Y, LIU P T, DUAN C Q, et al.Effects of mixed fermentation by different Hanseniaspora genus yeasts and Saccharomyces cerevisiae on the aroma compounds in Vidal ice wine[J].Food and Fermentation Industries, 2017, 43(10):16-23.
[28] 李俊娥, 毛亚玲, 祝霞, 等.苹果酸-乳酸发酵接种方式对赤霞珠干红葡萄酒香气品质的影响[J].食品与发酵工业, 2021, 47(19):126-136.
LI J E, MAO Y L, ZHU X, et al.Effects of different inoculation on aroma quality of Cabernet Sauvignon dry red wine[J].Food and Fermentation Industries, 2021, 47(19):126-136.
[29] MOREIRA N, MENDES F, GUEDES DE PINHO P, et al.Heavy sulphur compounds, higher alcohols and esters production profile of Hanseniaspora uvarum and Hanseniaspora guilliermondii grown as pure and mixed cultures in grape must[J].International Journal of Food Microbiology, 2008, 124(3):231-238.
[30] VIANA F, GIL J V, VALLÉS S, et al.Increasing the levels of 2-phenylethyl acetate in wine through the use of a mixed culture of Hanseniaspora osmophila and Saccharomyces cerevisiae[J].International Journal of Food Microbiology, 2009, 135(1):68-74.
[31] 梁丽红, 高娉娉, 张馨文, 等.优选本土非酿酒酵母混合发酵在干红葡萄酒中的应用潜力分析[J].食品与发酵工业, 2022, 48(14):118-124.
LIANG L H, GAO P P, ZHANG X W, et al.Potential application of mixed fermentation of superior indigenous non-Saccharomyces cerevisiae on dry red wine[J].Food and Fermentation Industries, 2022, 48(14):118-124.
[32] 赵美, 田秀, 李敏, 等.粟酒裂殖酵母与酿酒酵母共同接种发酵对‘黑比诺’干红葡萄酒品质的影响[J].食品科学, 2021, 42(24):108-116.
ZHAO M, TIAN X, LI M, et al.Effect of mixed culture fermentation with Schizosaccharomyces pombe and Saccharomyces cerevisiae on the quality of ‘Pinot Noir’ dry red wine[J].Food Science, 2021, 42(24):108-116.
[33] 谭凤玲, 王宝石, 胡培霞, 等.非酿酒酵母在葡萄酒混菌发酵中的应用及其挑战[J].食品与发酵工业, 2020, 46(22):282-286.
TAN F L, WANG B S, HU P X, et al.Application and challenge of non-Saccharomyces cerevisiae yeast in the mixed fermentation of fruit wineA[J].Food and Fermentation Industries, 2020, 46(22):282-286.
[34] 胡瑞祺, 杨薇熹, 凌梦琪, 等.贺兰山东麓产区地块间‘赤霞珠’和‘马瑟兰’葡萄酒香气差异分析[J].中国酿造, 2024, 43(6):49-58.
HU R Q, YANG W X, LING M Q, et al.Analysis of aroma difference between ‘Cabernet Sauvignon’ and ‘Marselan’ wines among parcels in the Eastern Foothills of Helan Mountain[J].China Brewing, 2024, 43(6):49-58.
[35] 唐柯, 马玥, 徐岩, 等.冰葡萄酒重要风味化合物嗅觉阈值的研究[J].食品与发酵工业, 2016, 42(1):148-151.
TANG K, MA Y, XU Y, et al.Study on olfactory thresholds for several flavor components in ice wine[J].Food and Fermentation Industries, 2016, 42(1):148-151.