普鲁兰多糖是一种α-葡聚糖,由重复的麦芽三糖单位组成,这些单位由α-葡萄糖分子以α-1,4糖苷键连接而成,这些单位又以α-1,6连接方式相互连接[1]。不过,偶尔也会出现麦芽四糖单元。普鲁兰多糖是可食用、可生物降解的、无色无味的高分子聚合物,具有高保湿性,可限制水分迁移等作用[2],通常在食品中用作低热量食品添加剂、黏合剂、增稠剂和延伸剂等[3-4]。同时,由于普鲁兰多糖的特殊性质,除了在食品领域的应用,还广泛应用于医药、环保、农业等相关领域。这些独特的性质使它成为一种极具价值的生物材料。
溶氧对菌种发酵有着重要影响,它直接影响微生物的菌体形态、酶的活性、代谢途径及产物产量[5]。在工业微生物发酵中,溶氧是通过发酵罐的搅拌转速和通风量控制的。所以,它们也是普鲁兰多糖发酵生产的关键因素。搅拌可以使培养基更好地气液混合,从而有助于维持细胞内部和外部之间的浓度梯度。出芽短梗霉发酵生产普鲁兰多糖是耗氧过程,如果发酵过程中没有氧存在, 细胞既不会生长也不会合成普鲁兰多糖。WECKER等[6]研究报道了,出芽短梗霉(ATCC9348)在溶氧恒定、较低的转速下普鲁兰多糖的产量有较大提高。CHENG等[7]研究发现,出芽短梗霉(ATCC201253)在低转速和较高的通风量条件下有利于提高普鲁兰多糖产量。但BADHWAR等[8]在做工艺优化研究时却表明,出芽短梗霉(MTCC1991)在更高的搅拌转速下菌落数更多,从而产生的普鲁兰多糖也是最高。WANG等[9]研究时采用两级搅拌速度控制策略,在发酵的前18 h将搅拌速度控制在500 r/min,18 h后将转速改变到400 r/min,两阶段控制策略有效地实现了普鲁兰多糖的高产。
本研究通过调控不同通风条件,探讨其对于出芽短梗霉发酵过程中产普鲁兰多糖产量的影响。通过代谢组学技术对高通风组(1∶0.8)和低通风组(1∶1.4)普鲁兰多糖发酵前期(36 h)、发酵中期(60 h)、发酵后期(96 h)的出芽短埂霉胞内代谢物进行生物学分析,目的在于了解溶氧对于普鲁兰多糖合成的影响,为出芽短埂霉合成普鲁兰多糖的机理研究提供参考。
1 材料与方法
1.1 材料与试剂
菌株:本文所使用的菌种为出芽短梗霉(Aureobsidium pullulans)CGMCCNO.7055,保藏于中国微生物菌种保藏管理委员会普通微生物中心。
试剂:葡萄糖、酵母浸粉、磷酸氢二钾、酵母抽提物、硫酸铵、无水硫酸钠、氯化钠、硫酸镁、硫酸亚铁、无水乙醇,所有试剂均为国产分析纯。
种子培养基(g/L):葡萄糖75.0,酵母浸粉2.0,(NH4)2SO4 0.5,K2HPO4 3.0,MgSO4·7H2O 0.8,NaCl 3.0,FeSO4·7H2O 0.06,初始pH 7.0,121 ℃灭菌20 min。
发酵培养基(g/L):葡萄糖132.0,酵母提取物7.2,MgSO4·7H2O 1.4,K2HPO4 6.9,NaCl 7.0,pH自然,121 ℃灭菌20 min[10]。
1.2 仪器与设备
SKY-2102型恒温摇床,上海苏坤实业有限公司;LC-20A液相色谱仪,日本岛津有限公司;5977B-7890B气相质谱联用仪,德国安捷伦科技有限公司;TDL-5-A型高速离心机,上海安亭科学仪器厂;GRJB-5D型5L发酵控制系统,镇江格瑞生物工程有限公司。
1.3 实验方法
1.3.1 斜面培养
取出4 ℃冰箱中保存的新鲜斜面,28 ℃培养箱活化30 min[11]。
1.3.2 种子培养
挑取一环斜面培养基上的菌种接入装液量20%种子培养基的500 mL挡板瓶中,在28 ℃、180 r/min的摇床中培养22~24 h。当测定OD620值在0.2~0.3时,完成种子培养[12]。
1.3.3 发酵培养
将发酵液按照60%的体积装入5 L发酵罐进行灭菌,在自然pH条件下,以3%的接种量接入种子液,初始条件中转速设定为350 r/min,通风比设定为1∶1,罐压设定为0.02 MPa。培养时间为96 h,其中前24 h的培养温度设定为32 ℃,后72 h的培养温度设置为28 ℃。
1.3.4 转速对普鲁兰多糖发酵影响实验方法
按照1.3.3节方法,在5 L发酵罐进行实验,设定3个搅拌转速,分别为350、400、450 r/min。
1.3.5 通风比对普鲁兰多糖发酵影响实验方法
为研究不同通风比对普鲁兰多糖发酵的影响,转速按最优发酵工艺400 r/min设定,5个不同通风比值分别为1∶0.8、1∶1、1∶1.2、1∶1.4和1∶1.6。
1.3.6 指标测定
普鲁兰多糖产量及菌体生物量测定方法参照文献[13]。
1.3.7 代谢组学实验方法
1.3.7.1 样品预处理
选取高通风组(1∶1.4)与低通风组(1∶0.8)发酵过程中发酵前期(36 h)、发酵中期(60 h)和发酵后期(90 h)3个不同时间点的适量发酵液于离心管中,在进行离心弃上清液。用生理盐水反复洗涤3次。最后放入-80 ℃冰箱冷冻保存。
1.3.7.2 提取胞内代谢物
参照文献[14]的方法,获得样品。
1.3.7.3 样品衍生化
参照文献[14]的方法,进行GC-MS检测。
1.3.7.4 GC-MS检测
GC-MS检测条件参照文献[14]设定。
1.3.8 代谢组学数据分析方法
1.3.8.1 数据预处理
将GC-MS检测得到的数据,通过软件分析获得代谢物的原始峰面积,通过NIST17.L数据库中对比获取菌体代谢物,选取匹配度高于90的代谢物,由内标法计算细胞代谢物的相对含量。
1.3.8.2 多元统计分析
将所得到的数据用MetaboAnalyst网站进行多元统计分析,寻找显著差异代谢物。
1.3.9 转录水平分析实验方法
将不同通风和不同时间条件下发酵的菌种进行收集,共12个样本。即36、90 h两个时间点低通风组(A、C)和高通风组(B、D),每个时间点各3个重复。通过Illumina NOvaSeq 6000高通量测序仪进行测序。原始数据处理后用Clean Reads进行生物信息学分析。
2 结果与分析
2.1 不同转速对普鲁兰多糖发酵的影响
按照1.3.4节所描述的实验方法研究搅拌转速对普鲁兰多糖发酵的影响。结果如图1所示。
由图1可知,不同转速对普鲁兰多糖发酵的影响不是很大。由图1-a可知,在3组不同的转速下,400 r/min下的菌体量相对较大,为(32.6±0.3) g/L,由图1-b可知,此时的普鲁兰多糖的产量也是400 r/min发酵结束后最大为(73.4±1.2) g/L。高于或低于此转速时,普鲁兰多糖的产量和菌体量均有一定程度的下降。原因可能是在低转速下,发酵液的整个流场的运动速度变低,流场运动更缓慢,致使发酵液中氧气含量变低,不足以使菌体生长和普鲁兰多糖的高产;在高转速的情况下,会产生较大的剪切力,从而影响细胞合成普鲁兰多糖。
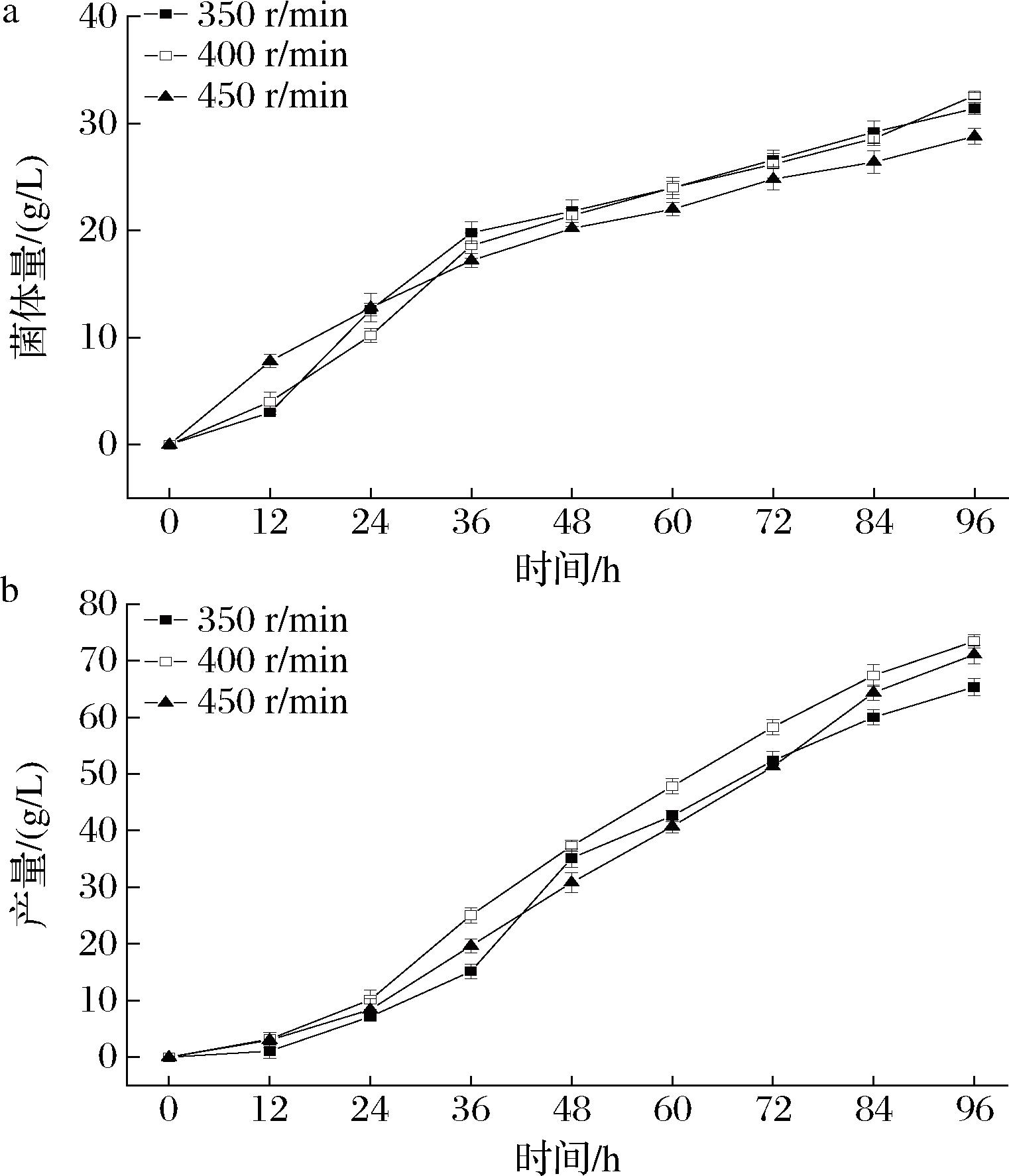
a-菌体量;b-产量
图1 转速对普鲁兰多糖发酵的影响
Fig.1 Effect of rotating speed on pullulan polysaccharide fermentation
2.2 不同通风比对普鲁兰多糖发酵的影响
按照1.3.5节所描述的实验方法研究通风对普鲁兰多糖发酵的影响。结果如图2所示。
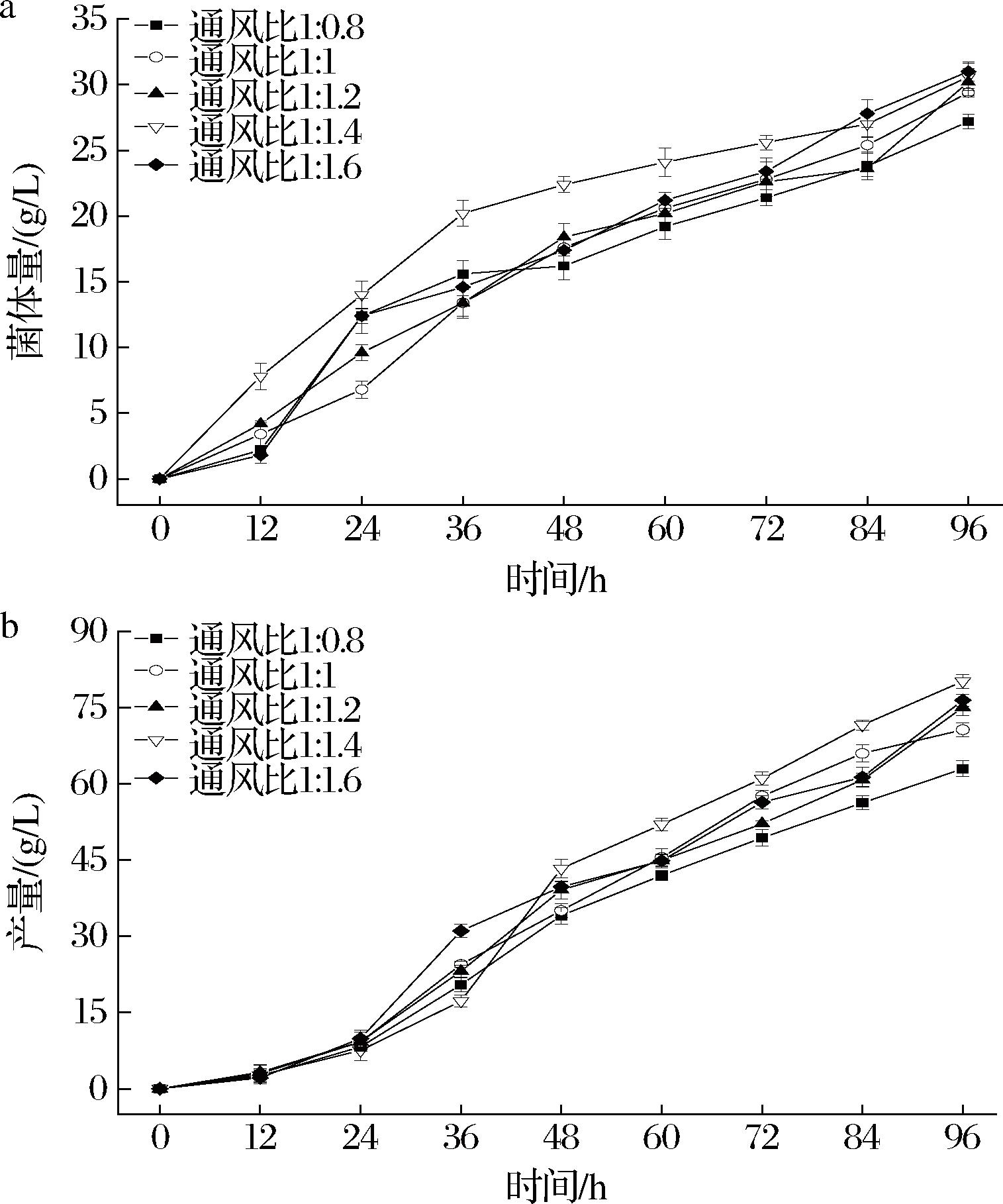
a-菌体量;b-产量
图2 通风对普鲁兰多糖发酵的影响
Fig.2 Effect of ventilation on pullulan polysaccharide fermentation
由图2可知,不同的通风量对普鲁兰多糖发酵有明显影响。随着通风比的增大,菌体量和普鲁兰多糖的产量均有所提高,当通风比为1∶1.6时,菌体量最大为(31.0±1.1) g/L,但此时普鲁兰多糖的产量并非最大。多糖产量最大为(80.2±1.4) g/L,此时的通风比为1∶1.4。由图2-b还可以看出,在通风比最低和最高之间,普鲁兰的产量相差13.50 g/L。分析原因可能是因为通风量高虽然利于菌体生长及产物合成,溶解氧过大反而抑制产物的合成。但通风量低时,由于氧气含量的不足会造成代谢异常,产量降低。本文通过对通风比进行单因素优化后发现,当通风比不同时发酵结束后普鲁兰多糖的产量差异较大。为此,对出芽短梗霉在不同通风比(1∶0.8、1∶1.4)条件下将菌种发酵过程中产生的胞内代谢产物通过代谢组学进行相关分析,在分子的角度分析普鲁兰多糖的合成情况。
2.3 不同通风条件下胞内代谢物的检测分析
为了解不同通风条件对普鲁兰多糖发酵过程代谢物质的影响,分别对高通风组(1∶1.4)和低通风组(1∶0.8)不同发酵时期的代谢物,按照1.3.7节所描述方法进行实验。分析结果与NIST 17.L数据库比对,共匹配到45种代谢物,结果如表1所示。
表1 GC-MS检测到的胞内代谢物
Table 1 Intracellular metabolites identified by GC-MS

分类物质名称氨基酸类L-丙氨酸甘氨酸缬氨酸L-苏氨酸L-亮氨酸苯丙氨酸天冬氨酸L-蛋氨酸酸类 丙二酸乳酸丁酸硬脂酸苯甲酸棕榈酸丙酮酸草酸柠檬酸苹果酸丁二酸肉豆蔻酸3-羟基丁酸2-丁烯二酸4-氨基丁酸丙酸十五烷酸糖类 D-甘露糖鼠李糖阿拉伯糖D-果糖D-半乳糖乳糖D-甘露吡喃糖D-吡喃葡萄糖醇类 2,3-丁二醇阿拉伯糖醇D-甘露醇肌醇赤藓糖醇D-葡萄糖醇D-山梨糖醇甘油木糖醇其他 甲胺腺苷乙酰胺
由表1可知,经处理分析,得到了一些糖类、有机酸类、氨基酸类、醇类和一些其他类型的代谢物质共45种。结合代谢路径分析,这些物质主要涉及碳水化合物和氨基酸代谢等多条代谢途径。由图3代谢物质热图可以看出在不同的通风条件下各物质在各发酵时期的相对浓度情况。由于各时期菌种发酵过程不同,因此不同物质含量也不同。发酵前期一些糖类转化较多,用于菌种生长,因此此时期积累了一些糖类物质,中后期开始进行初级代谢和次级代谢,有较多代谢产物产生,如一些有机酸类和醇类,因此中后期检测到醇类和有机酸含量相对较高。
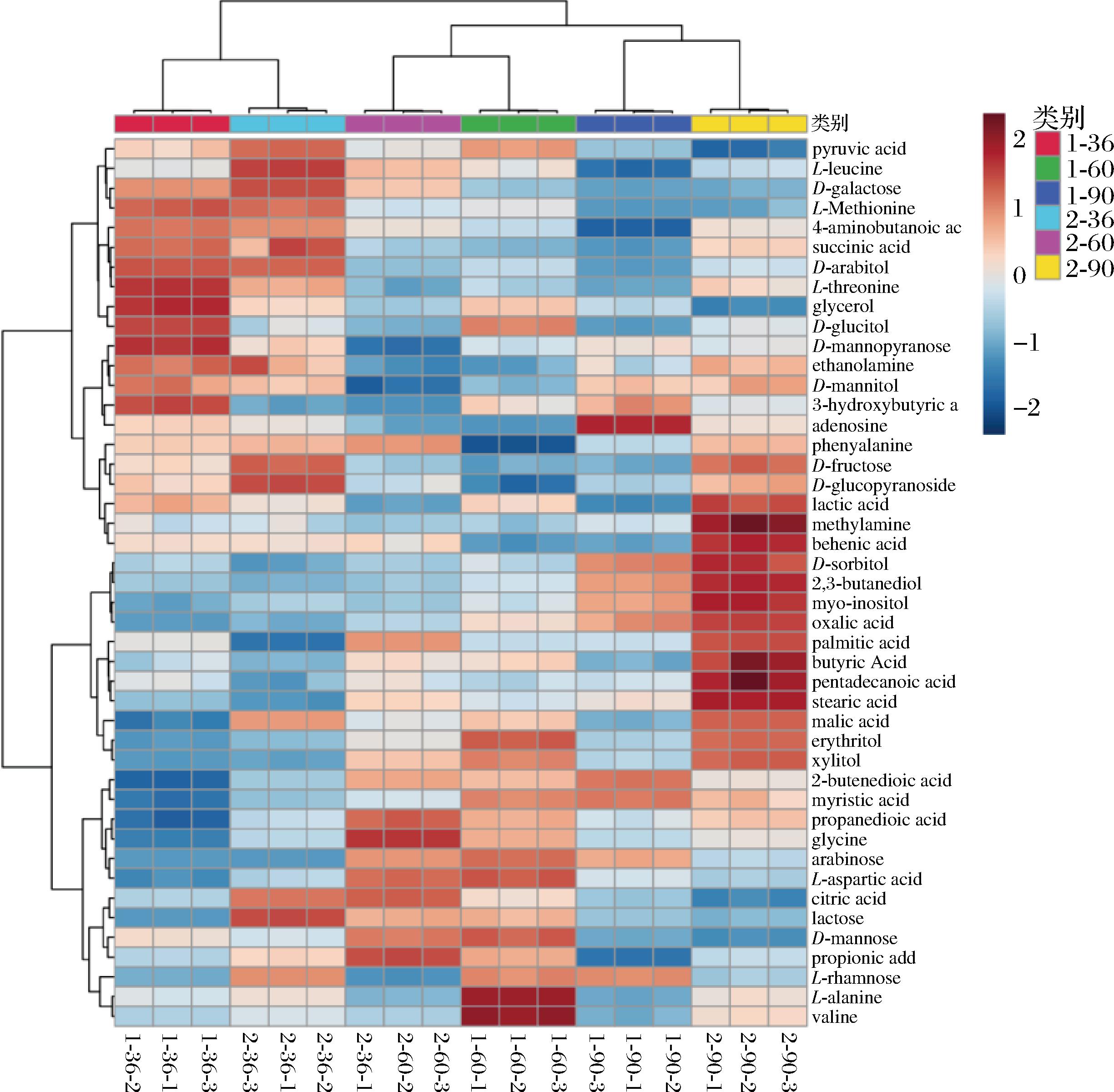
图3 低通风与高通风代谢物相对浓度
Fig.3 Heat map of relative metabolite concentration in low ventilation and high ventilation
注:pyruvic acid,丙酮酸;L-leucine,L-亮氨酸;D-galactose,D-半乳糖;L-methionine,L-蛋氨酸;4-Aminobutanoic acid,4-氨基丁酸;succinic acid,琥珀酸;D-arabitol,D-阿拉伯糖醇;L-threonine,L-苏氨酸;glycerol,甘油;D-glucitol,D-葡萄糖醇;D-mannopyranose,D-甘露糖;ethanolamine,乙醇胺;D-mannitol,甘露醇;3-hydroxybutyric acid,3-羟基丁酸;adenosine,腺苷;phenylalanine,苯丙氨酸;D-fructose,D-果糖;D-glucopyranoside,D-吡喃葡萄糖苷;lactic acid,乳酸;methylamine,甲胺;behenic acid,二十二烷酸;D-sorbitol,D-山梨醇;2,3-butanediol,2,3-丁二醇;myo-Inositol,肌醇;oxalic acid,草酸;palmitic acid,棕榈酸;butyric acid,丁酸;pentadecanoic acid,十五烷酸;stearic acid,硬脂酸;malic acid,苹果酸;erythritol,赤藓糖醇;xylitol,木糖醇;2-butenedioic acid,2-丁二酸;myristic acid,肉豆蔻酸;propanedioic acid,丙二酸;glycine,甘氨酸;arabinose,阿拉伯糖;L-aspartic acid,L-天冬氨酸;citric acid,柠檬酸;lactose,乳糖;D-mannose,D-木糖;propionic acid,丙酸;L-rhamnose,L-鼠李糖;L-alanine,L-丙氨酸;valine,缬氨酸。
2.4 胞内代谢物的差异性分析
在得到了相关的代谢物质后,又将代谢物质进行了主成分分析(principal component analysis,PCA),并应用正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,PLS-DA)进行了多元统计。之后又结合了普鲁兰多糖合成的代谢途径,对在不同的通风条件下培养出芽短梗霉而使普鲁兰多糖的产量提高的情况做出相应的解释。
2.4.1 PCA
本文将试验中36、60、90 h 3个时间点取样并测定后得到的低通风组和高通风组的数据导入MetaboAnalyst网站中进行处理。PCA得分图如图4所示。
由图4可知,在不同时间点下,低通风与高通风两个不同组分之间能够明显被分开,组间差异明显。而3个时间点的PCA总得分均在90%以上,因此可以说明该主成分能解释的代谢数量的百分比均大于90%。即在不同通风条件下菌体胞内代谢物差异明显。
2.4.2 PLS-DA
PLS-DA,是一种能进行监督性分类的判别方法。采用此方法对PCA模型得到的结果准确性进行评估和判断。实验数据经判别处理后得到的评判结果如图5所示。
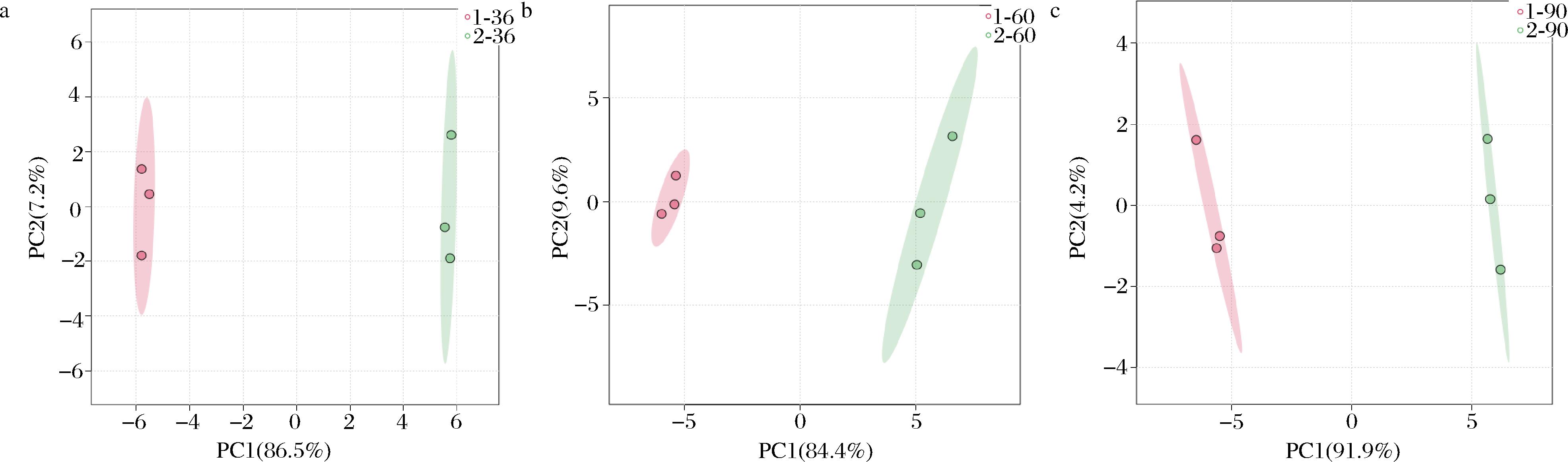
a-36 h;b-60 h;c-90 h
图4 低通风与高通风样品的PCA得分图
Fig.4 PCA score chart of low ventilation and high ventilation samples
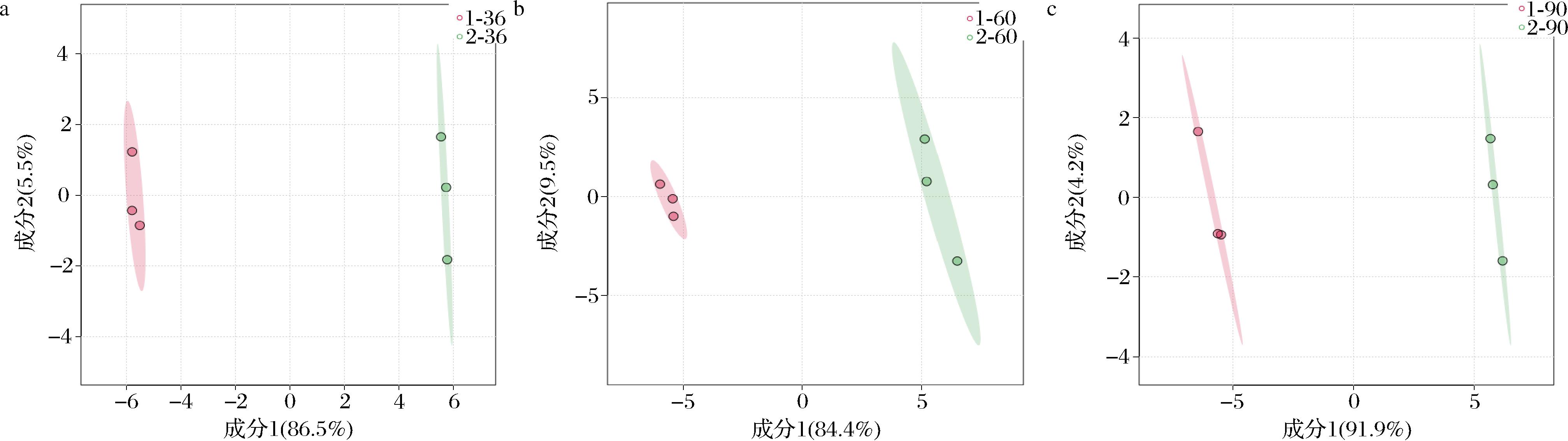
a-36 h;b-60 h;c-90 h
图5 低通风与高通风样品的PLS-DA得分图
Fig.5 PLS-DA score chart of low ventilation and high ventilation samples
由图5可知,低通风与高通风样本能相互分开,而且能在各自的置信区间内聚集,有的样本点还出现了重叠的情况,这就说明了代谢模型的真实可靠性,同时也表现了出样本的代谢差异性。这样的结果与PCA分析所得到的结果一致。
为了进一步说明模型的质量和可靠性,又分析了交叉验证的结果,如表2所示。
表2 交叉验证的主要统计学数据
Table 2 Main statistical data of cross-validation
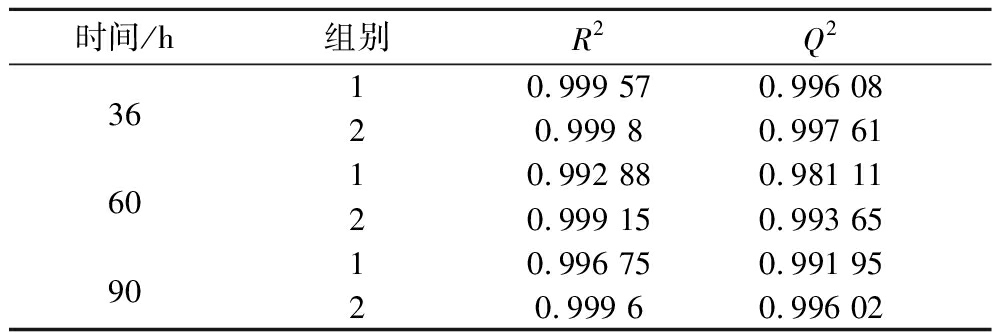
时间/h组别R2Q23610.999 570.996 0820.999 80.997 616010.992 880.981 1120.999 150.993 659010.996 750.991 9520.999 60.996 02
由表2可知,低通风和高通风2个组别样本的R2和Q2值均在0.95以上,因此,能够表明试验结果理想,模型很可靠。
为了分析在不同通风条件下不同时间点代谢物的差异性,通过PLS-DA模型中的变量在预测中的重要性(variable importance in projection, VIP)图来寻找差异代谢物质,其结果如图6所示。
由图6可知在不同发酵条件下3个时间点的差异代谢物情况,发酵36 h的显著代谢差异物有乳糖、L-鼠李糖、棕榈酸、D-半乳糖、柠檬酸、2-丁烯二酸、L-亮氨酸、甘油、3-羟基丁酸、丙二酸、苹果酸、L-苏氨酸、缬氨酸、肉豆蔻酸。发酵中60 h的显著代谢差异物有苯丙氨酸、L-丙氨酸、棕榈酸、甘氨酸、缬氨酸、4-氨基丁酸、赤藓糖醇、阿拉伯糖、草酸、D-阿拉伯糖醇、D-葡萄糖醇、L-鼠李糖、肉豆蔻酸、柠檬酸、D-半乳糖。发酵90 h的显著代谢差异物有腺苷、棕榈酸、4-氨基丁酸、苹果酸、丙二酸、苯甲酸、2-丁烯二酸、赤藓糖醇、阿拉伯糖、D-阿拉伯糖醇、丁二酸、苯丙氨酸、木糖醇、乳酸、硬脂酸。
2.5 结合出芽短梗霉代谢途径分析不同通风条件下的菌体代谢差异
本实验将出芽短梗霉发酵过程中产生的差异代谢物质与代谢途径来相结合,进而分析在不同的通风条件下对普鲁兰多糖产量的影响。

a-36 h;b-60 h;c-90 h
图6 低通风和高通风样品的VIP得分图
Fig.6 VIP score chart of low ventilation and high ventilation samples
2.5.1 半乳糖代谢相关代谢物的变化
D’HULST等[15]在研究葡萄糖聚合物时发现,在所有真核细胞中,多糖的形成都是以二磷酸尿苷(uridine diphosphate, UDP)葡萄糖(UDP-葡萄糖)开始,即UDP-葡萄糖作为前体物质,然后在通过自身葡萄糖基化产生短的线性α-(1,4)-葡萄糖基链延伸形成多糖。在半乳糖代谢中,半乳糖经过代谢可以生成UDP-葡萄糖,同时还能生成其他一些用于细胞生命活动的物质。
由图7可知,在发酵前期在不同的通风条件下2组均有大量的D-半乳糖合成,并且高通风组高于低通风组。因此推测,高通风提高了半乳糖代谢通路中物质合成水平,而随着时间的增加,D-半乳糖含量逐渐降低,而高通风降低幅度要高于低通风组。因此推测,此时半乳糖代谢途径中的D-半乳糖逐渐转化成UDP-葡萄糖,为普鲁兰多糖的合成提供更多的前提物质,从而提高普鲁兰多糖的产量。
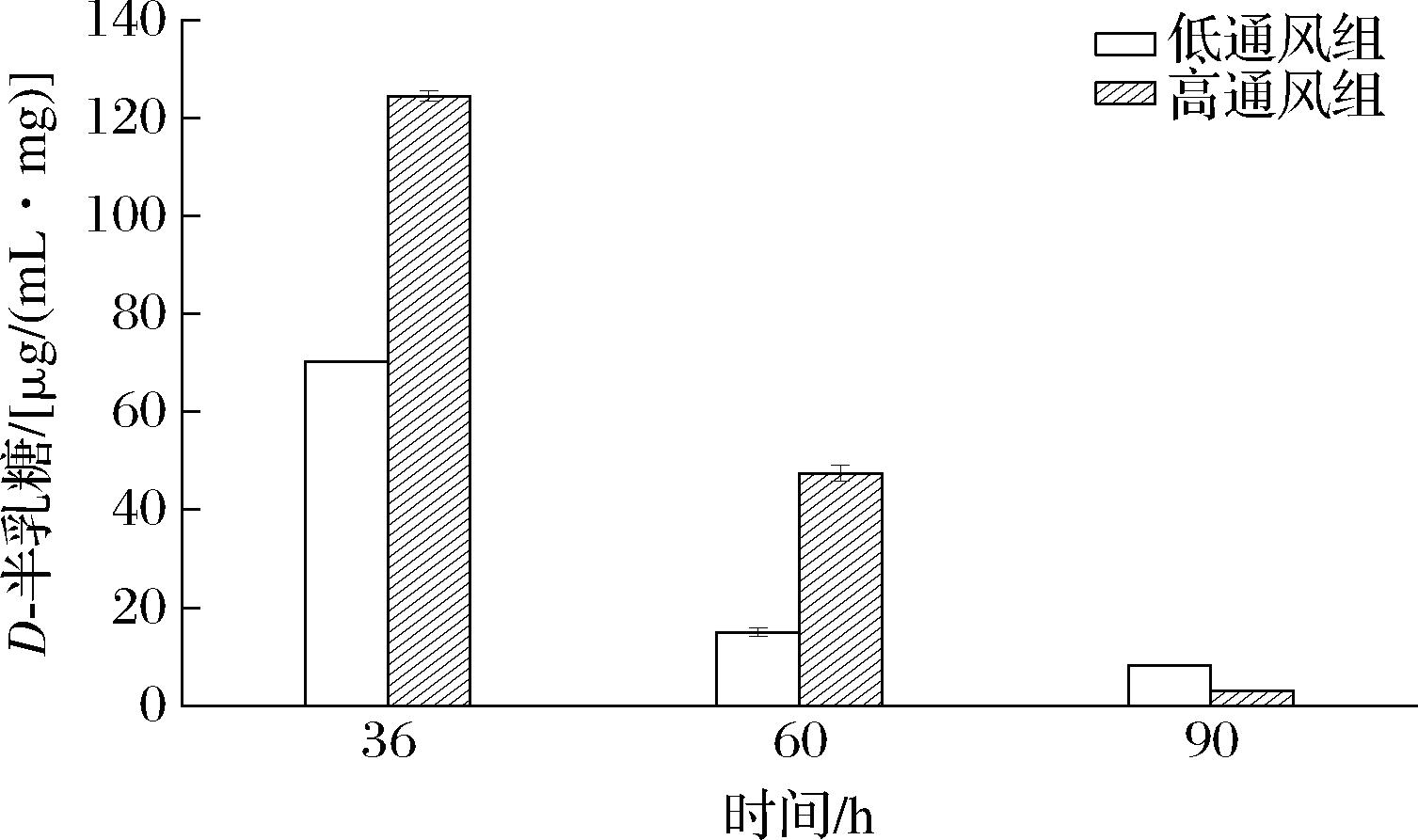
图7 D-半乳糖物质变化
Fig.7 Changes of D-galactose substance
2.5.2 三羧酸循环(tricarboxylic acid cycle,TCA循环)相关代谢物的变化
由图8-a可知,柠檬酸在前中期发酵中在逐渐积累,并且高通风组的含量要高于低通风组。由图8-b可知,苹果酸在前期的含量在高通风条件下发酵要高于低通风组,并且在低通风条件下发酵前中期的苹果酸含量在积累。因此推测,高通风能提高TCA循环的代谢水平,有利于物质间的转化。而在发酵后期含量下降,最终高通风组的含量反而低于低通风组,分析原因可能是物质在发酵后期转化为普鲁兰多糖合成的所需物质和能量。
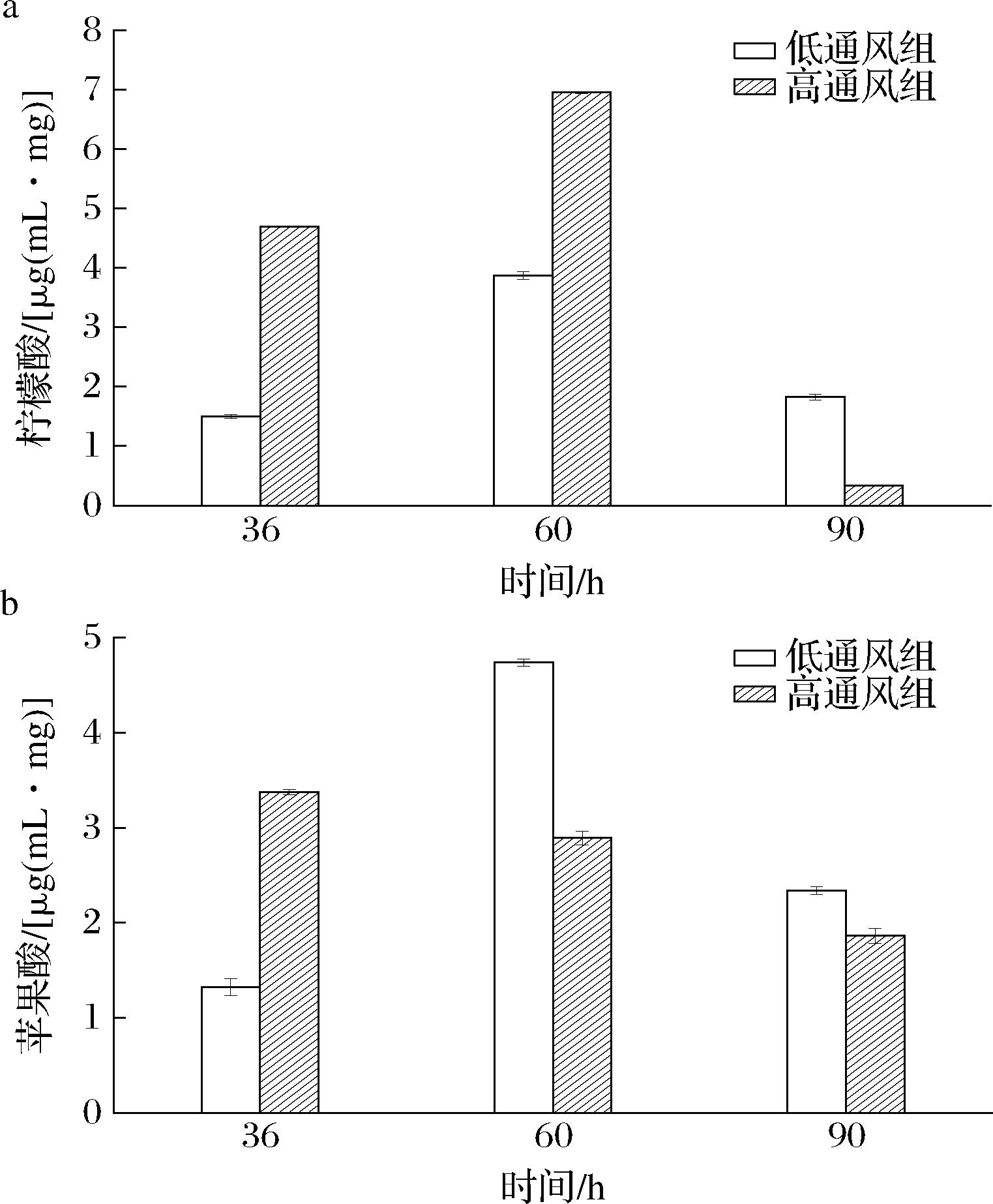
a-柠檬酸;b-苹果酸
图8 柠檬酸和苹果酸物质变化
Fig.8 Changes of citric acid and malic acid substances
2.5.3 果糖-甘露糖代谢相关代谢物的变化
由图9可知,随着时间的延长,D-甘露糖和D-甘露醇2种代谢物质出现相反的变化趋势,可能是在代谢过程中2种物质发生了相互的转化。由图9还可以看出,2种物质的含量高通风组低于低通风组,可能是因为,高通风并没有使果糖-甘露糖代谢途径中的甘露糖和甘露醇进行积累,而是转化为别的产物。由图9-a可知,在低通风条件下,发酵结束后D-甘露醇仍有一定的积累,这就可能影响了普鲁兰多糖合成过程中所需物质的含量,从而影响了普鲁兰多糖的产量。
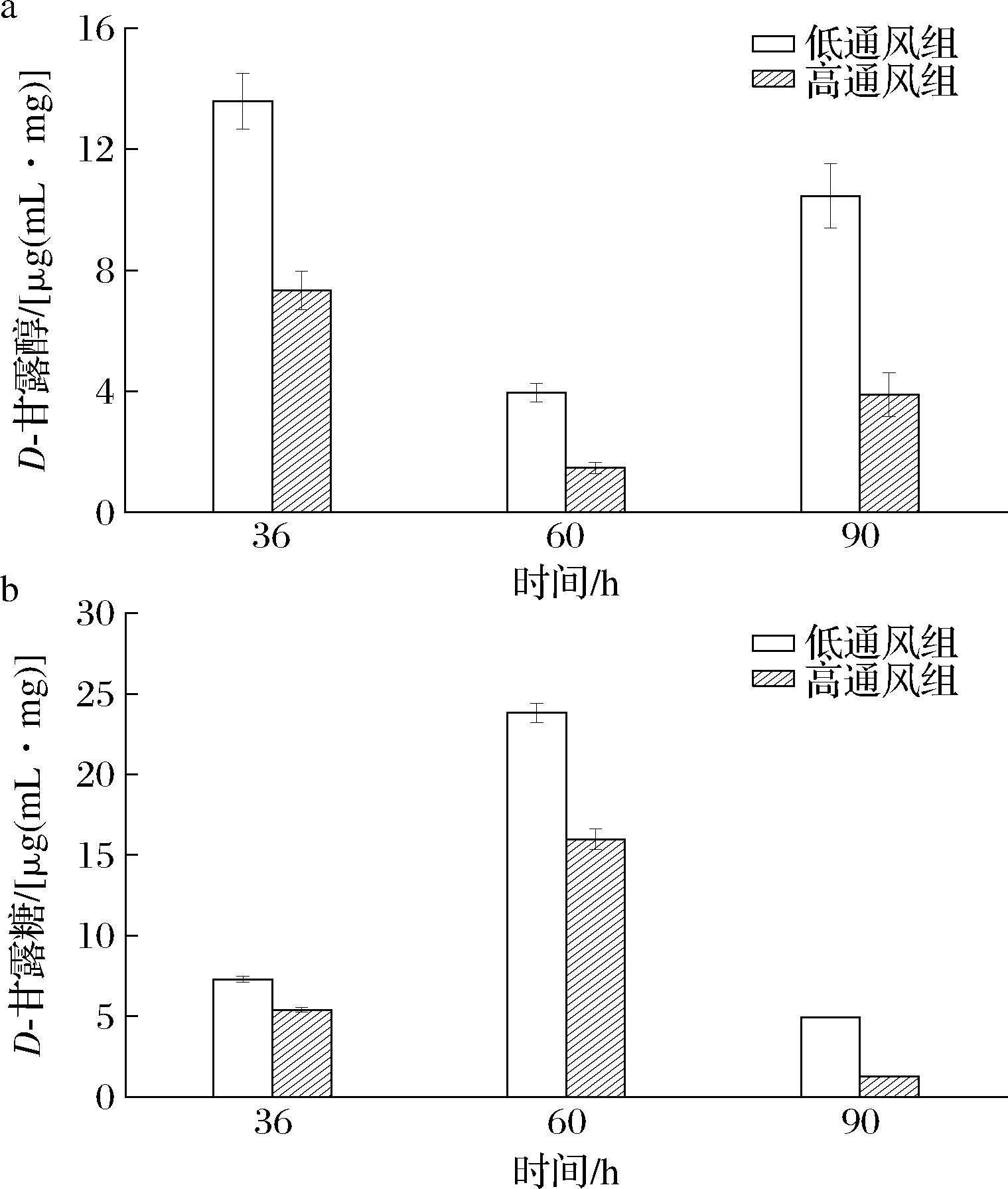
a-D-甘露醇;b-D-甘露糖
图9 D-甘露醇和D-甘露糖物质变化
Fig.9 Changes of D-mannitol and D-mannose substances
2.5.4 戊糖-葡萄糖醛酸转换途径相关代谢物的变化
酵母细胞能在高浓度的葡萄糖浓度下转化葡萄糖形成阿拉伯糖醇,而阿拉伯糖醇能在较高葡萄糖浓度的溶液中对细胞起到调节渗透压的作用[16]。由图10可知,在戊糖-葡萄糖醛酸转换途径中,发酵前期由于在环境中的葡萄糖浓度较高,因此生成了大量的阿拉伯糖醇,从而使菌体适应溶液环境。但高通风组并没有提高该途径的强度。随着时间的延长,葡萄糖被消耗利用,阿拉伯糖醇的含量也逐渐降低,转化为其他物质,为普鲁兰多糖的合成提供了能量。
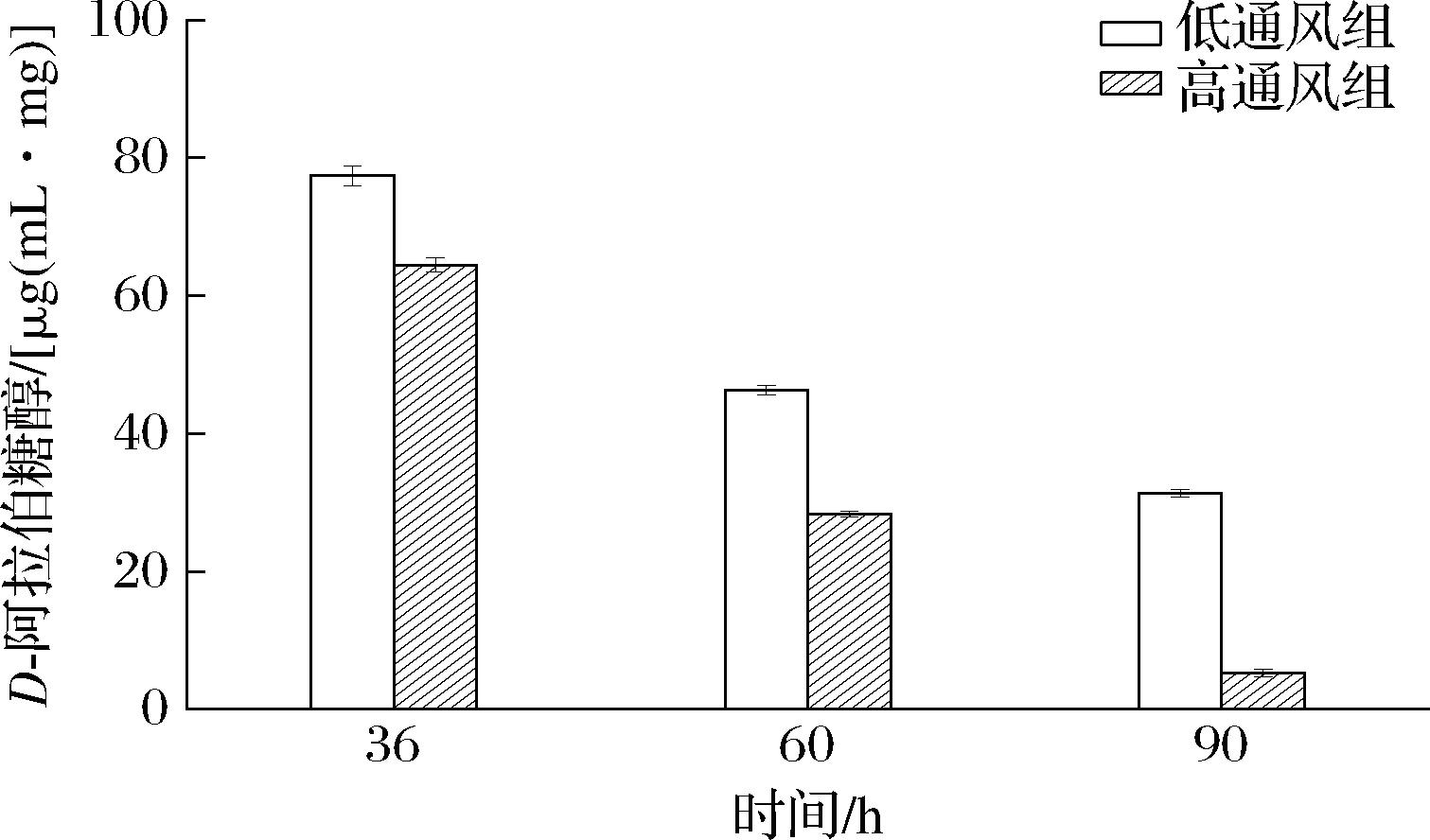
图10 D-阿拉伯糖醇物质变化
Fig.10 Changes of D-arabinol substance
2.5.5 与缬氨酸、亮氨酸途径相关代谢物的变化
由图11可知,发酵前期高通风组缬氨酸和L-亮氨酸的含量均高于低通风组,因此,高通风提高了缬氨酸、亮氨酸和异亮氨酸代谢途径的强度,有利于物质的合成。随着发酵时间的增加,缬氨酸和L-亮氨酸的含量呈先上升后下降的趋势,但高通风组的L-亮氨酸除外。由图11-b可知,在高通风的条件下前期就形成了大量的L-亮氨酸,中后期逐渐降低,可能是L-亮氨酸可以调节蛋白质代谢,而在发酵过程中的酶大多数为蛋白质,因此前期合成了大量L-亮氨酸为蛋白质调节储备物质。而L-亮氨酸氧化产生ATP的效率高于其他氨基酸[17],因此中后期含量降低转化为草酰乙酸等有利于普鲁兰多糖合成的物质和产生更多的能量。
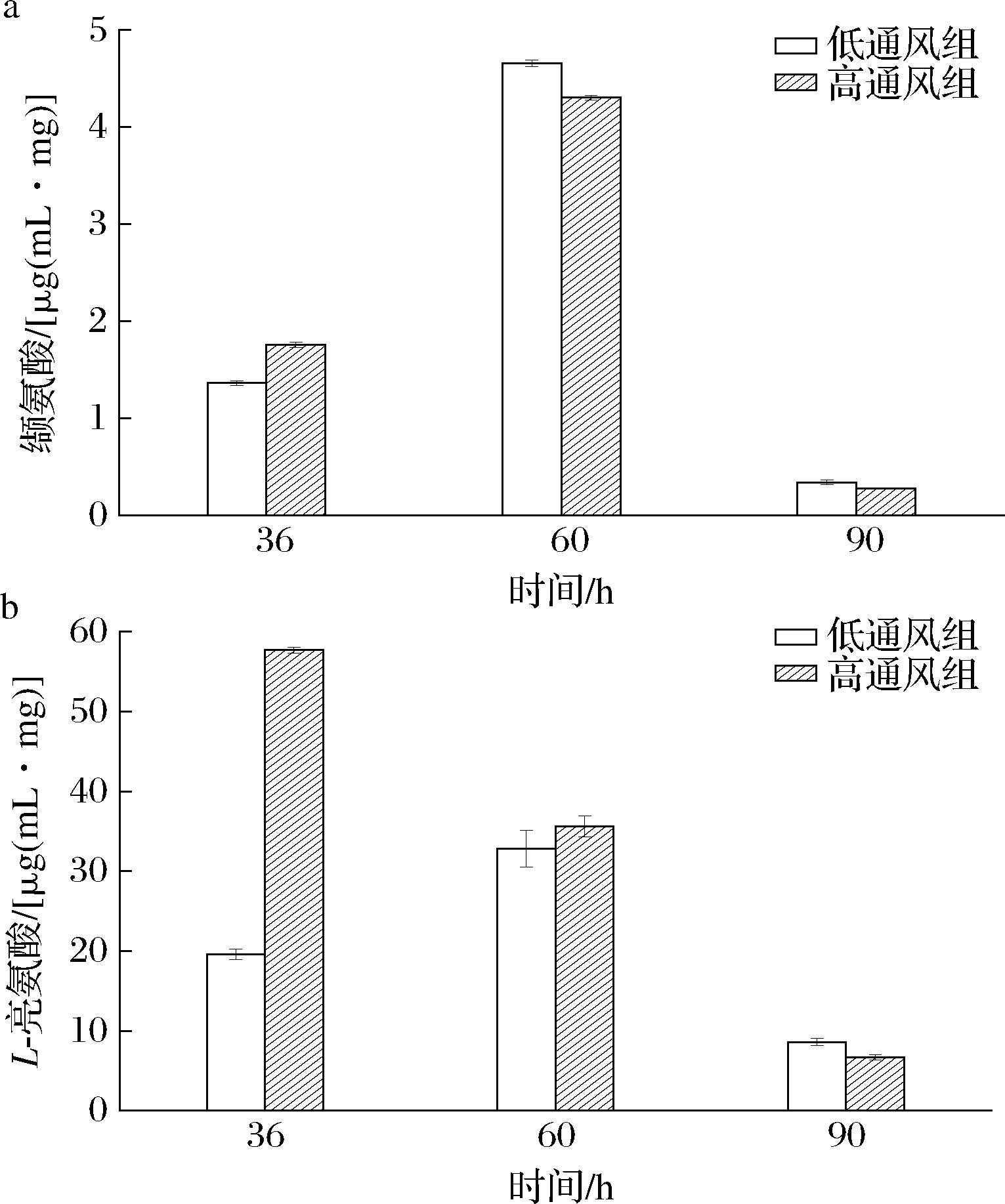
a-缬氨酸;b-L-亮氨酸
图11 缬氨酸与L-亮氨酸物质变化
Fig.11 Changes of valine and L-leucine substances
2.6 差异基因的代谢途径转录水平分析
基因转录表达后以蛋白质形式呈现,将变化倍数大于1.5的差异表达基因与KEGG通路结合分析代谢途径,部分差异基因如表3所示。
表3 差异基因结果统计
Table 3 Differential genes statistics

基因基因功能基因表达情况Kgd1α-酮戊二酸脱氢酶上升Acuf磷酸烯醇丙酮酸羧激酶 (ATP)上升HXT9己糖转运蛋白HXT9上升CYB2L-乳酸脱氢酶上升TKT1转酮酶1下降pfkAATP依赖型6-磷酸果糖激酶上升cit-1柠檬酸合酶上升mtlD甘露醇-1-磷酸 5-脱氢酶下降pgiA葡萄糖-6-磷酸异构酶上升ipgm-12,3-二磷酸甘油酸非依赖性磷酸甘油酸变位酶上升pgmA磷酸葡萄糖变位酶上升TUR1肌醇 3-磷酸合酶下降PDA1丙酮酸脱氢酶E1 成分亚基 alpha上升pgk1磷酸甘油酸激酶上升MDH1苹果酸脱氢酶上升Marme_2490D-甘露糖异构酶下降fyu1UTP-葡萄糖-1-磷酸尿苷酰转移酶上升gpt1UDP-葡萄糖糖基转移酶上升LAC4β-半乳糖苷酶上升glkA己糖激酶上升
由表3可知,差异基因表达量上调的为kgd1、acuF、HXT9、CYB2、pfkA、cit-1、ipgm-1、pgmA、PDA1、pgk1、MDH1、glkA、LAC4、pgiA、fyu1和gpt1,而这些上调基因经翻译表达后所对应的蛋白质分别为α-酮戊二酸脱氢酶、磷酸烯醇丙酮酸羧激酶、己糖转运蛋白、L-乳酸脱氢酶、6-磷酸果糖激酶、柠檬酸合酶、2,3-二磷酸甘油酸非依赖性磷酸甘油酸变位酶、磷酸葡萄糖变位酶、丙酮酸脱氢酶E1、磷酸甘油酸激酶、苹果酸脱氢酶、己糖激酶、β-半乳糖苷酶、葡萄糖-6-磷酸异构酶、UTP-葡萄糖-1-磷酸尿苷酰转移酶和UDP-葡萄糖糖基转移酶。表达量下调的有TKT1、mtlD、TUR1和Marme_2490,对应的蛋白质分别为转酮酶、甘露醇-1-磷酸 5-脱氢酶、肌醇 1-磷酸合酶和D-甘露糖异构酶。这些基因表达后对应的蛋白主要参与果糖和甘露糖代谢、糖酵解、半乳糖代谢、磷酸肌醇代谢以及柠檬酸循环等。
糖酵解中的蛋白酶所对应的表达基因的提高,有利于糖酵解过程对葡萄糖的利用,为普鲁兰多糖合成了更多的前体物质,从而促进普鲁兰多糖的合成。参与柠檬酸循环的蛋白酶表达量提高有利于柠檬酸循环的进行,加速了糖类与蛋白之间的转化,还为菌种的生长和普鲁兰多糖的合成提供了能量。半乳糖代谢中相关蛋白酶基因表达的上调有利于更多UDP-葡萄糖合成的方向进行,从而促进普鲁兰多糖的合成。甘露醇-1-磷酸-5-脱氢酶和D-甘露糖异构酶基因表达的下调减少了发酵过程中其他副产物的积累,有利于碳源流向普鲁兰多糖。己糖激酶参与D-果糖与β-D-果糖-6-磷酸之间的转化,该蛋白酶表达量的提高有利于果糖转化为糖酵解代谢中相关物质,最终流向普鲁兰多糖的代谢过程,有利于普鲁兰多糖的合成。L-乳酸脱氢酶参与丙酮酸代谢过程,该蛋白酶基因表达量的上调有利于L-乳酸合成丙酮酸,而丙酮酸脱氢酶E1基因表达量的上调促进了丙酮酸与草酰乙酸之间的相互转化,从而加强了丙酮酸和乙酰-CoA的生成,为柠檬酸循环提供更多前体物质。
综上所述,研究发酵过程中不同通风量对出芽短梗霉胞内代谢物的影响,结合KEGG代谢通路分析,可得出其对出芽短梗霉代谢途径的影响,在高通风的条件下发酵生产普鲁兰多糖时,致使出芽短梗霉胞内相关基因表达量发生了一定的变化,最终影响了代谢途径的变化,如图12所示。
3 结论
为研究不同通风条件对普鲁兰多糖合成的影响,本文利用GC-MS技术,一共检测到45种胞内小分子代谢物质,主要包括氨基酸类、有机酸类、糖类、醇类及一些其他类的代谢物质,这些物质主要涉及了碳水化合物代谢和氨基酸代谢等多条代谢途径。用PCA模型和PLS-DA模型分析后发现,组间的代谢物质差异较大,但组内差异较小,因此说明了不同通风组之间存在着较大的代谢差异。通过PLS-DA模型中VIP数据分析图找到几种差异明显的代谢物质,有D-甘露糖、D-甘露醇、半乳糖、苹果酸、柠檬酸等。最后,将普鲁兰的代谢途径结合KEGG分析,发现提高发酵过程中的通风量有利于戊糖-葡萄糖醛酸转换途径和果糖-甘露糖代谢途径中物质流向普鲁兰多糖合成所需的物质和能量,同时,还提高了缬氨酸、亮氨酸和异亮氨酸途径和半乳糖代谢途径水平,使更多的碳和能量流向主代谢途径中,为普鲁兰多糖的合成提供更多的前体物质。本文通过转录组学技术研究了在不同通风条件下对出普鲁兰多糖合成过程中基因表达情况的影响,最终发现在发酵36 h时筛选出了上调基因693段,下调基因598段,合计1 291段;在发酵90 h时筛选出上调基因669段,下调基因811段,合计1 480段。相关的差异表达基因分别对糖酵解过程、柠檬酸代谢、半乳糖代谢、果糖甘露糖代谢、肌醇磷酸代谢以及丙酸代谢过程产生了一定的影响。研究结果有助于了解溶氧对于普鲁兰多糖合成机制的影响,同时为出芽短埂霉合成普鲁兰多糖的机理研究提供参考。

图12 差异明显代谢物对普鲁兰多糖代谢途径的影响
Fig.12 Effects of different metabolites on the metabolic pathway of pullulan polysaccharide
[1] WANI S M, MASOODI F A, AHMAD MIR S, et al.Pullulan production by Aureobasidium pullulans MTCC 1991 from apple pomace and its characterization[J].Food Bioscience, 2023, 51:102254.
[2] HONG T T, MA Y, YUAN Y R, et al.Understanding the influence of pullulan on the quality changes, water mobility, structural properties and thermal properties of frozen cooked noodles[J].Food Chemistry, 2021, 365:130512.
[3] 黄威, 刘颖, 刘路, 等.短梗霉多糖生物膜形成及食品添加剂对膜特性影响的研究[J].食品工业科技, 2012, 33(9):197-201.
HUANG W, LIU Y, LIU L, et al.Study on formation of pullulan membrane and effect of food additives on its properties[J].Science and Technology of Food Industry, 2012, 33(9):197-201.
[4] DING Y Y, JIANG F, CHEN L, et al.An alternative hard capsule prepared with the high molecular weight pullulan and gellan:Processing, characterization, and in vitro drug release[J].Carbohydrate Polymers, 2020, 237:116172.
[5] 张智, 滕婷婷, 王淼.溶氧对发酵的影响及控制[J].科学咨询(决策管理), 2008(11):63-64.
ZHANG Z, TENG T T, WANG M.Effect of dissolved oxygen on fermentation and its control[J].Policy &Management, 2008(11):63-64.
[6] WECKER A, ONKEN U.Influence of dissolved oxygen concentration and shear rate on the production of pullulan by Aureobasidium pullulans[J].Biotechnology Letters, 1991, 13(3):155-160.
[7] CHENG K C, DEMIRCI A, CATCHMARK J M.Evaluation of medium composition and fermentation parameters on pullulan production by Aureobasidium pullulans[J].Food Science and Technology International, 2011, 17(2):99-109.
[8] BADHWAR P, KUMAR A, YADAV A, et al.Improved pullulan production and process optimization using novel GA-ANN and GA-ANFIS hybrid statistical tools[J].Biomolecules, 2020, 10(1):124.
[9] WANG D H, BIAN J J, WEI G Y, et al.Simultaneously enhanced production and molecular weight of pullulan using a two-stage agitation speed control strategy[J].Journal of Chemical Technology &Biotechnology, 2016, 91(2):467-475.
[10] 张攀. 维生素B5对出芽短梗霉发酵产普鲁兰多糖分子量及产量影响的研究[D].天津:天津科技大学, 2021.
ZHANG P.Study on the effect of calcium pantothenate on the molecular weight and yield of pullulan produced by Aureobasidium pullulans fermentation[D].Tianjin:Tianjin University of Science &Technology, 2021.
[11] 王建梓. 出芽短梗霉发酵产普鲁兰多糖工艺条件优化[D].天津:天津科技大学, 2016.
WANG J Z.Optimization of fermentation conditions for pullulan production by Aureobasidium pullulans[D].Tianjin:Tianjin University of Science &Technology, 2016.
[12] 宋亚琼. 普鲁兰多糖发酵工艺优化及中试生产[D].天津:天津科技大学, 2015.
SONG Y Q.Optimization and pilot production of pullulan fermentation process[D].Tianjin:Tianjin University of Science &Technology, 2015.
[13] 赵廷彬, 殷海松, 张琳, 等.普鲁兰多糖产生菌出芽短梗霉的紫外诱变及其培养基优化[J].食品研究与开发, 2023, 44(4):188-196.
ZHAO T B, YIN H S, ZHANG L, et al.Ultraviolet mutagenesis of pullulan-producing strain Aureobasidium pullulans and optimization of its medium[J].Food Research and Development, 2023, 44(4):188-196.
[14] 张攀, 张伊凡, 成刚刚, 等.基于代谢组学分析MgSO4·7H2O和K2HPO4协同对普鲁兰多糖生物合成的影响[J].食品科技, 2021, 46(4):1-8.
ZHANG P, ZHANG Y F, CHENG G G, et al.Analysis of the effect of MgSO4·7H2O and K2HPO4 on pullulan biosynthesis based on metabolomics[J].Food Science and Technology, 2021, 46(4):1-8.
[15] D’HULST C, MÉRIDA  .The priming of storage glucan synthesis from bacteria to plants:Current knowledge and new developments[J].New Phytologist, 2010, 188(1):13-21.
.The priming of storage glucan synthesis from bacteria to plants:Current knowledge and new developments[J].New Phytologist, 2010, 188(1):13-21.
[16] 唐晓芳, 张国栋, 王刚.Hansenula anomala转化葡萄糖生产阿拉伯糖醇的研究[J].食品工业科技, 2012, 33(1):314-317.
TANG X F, ZHANG G D, WANG G.Study on production of Arabitol from glucose by Hansenula anomala[J].Science and Technology of Food Industry, 2012, 33(1):314-317.
[17] 王彬, 李奇.亮氨酸的代谢及营养生理作用研究进展[J].饲料研究, 2012, 35(1):14-16.
WANG B, LI Q.Research progress on metabolism and nutritional physiological function of leucine[J].Feed Research, 2012, 35(1):14-16.