白酒,又可将其称之为烧酒、烧刀子、白干等,在我国具有较为悠久的历史文化,是世界六大蒸馏酒之一[1]。根据生产工艺的不同,可以分为固态白酒、半固态白酒、液态白酒[2]。由于固态发酵法对粮食原料需求量较大以及白酒多样化的产品提出,基于液态法发酵白酒(液态白酒)成为白酒生产的重要手段之一。
液态发酵法又可称之为“一步法”,其是从原料蒸煮、糖化、发酵直到蒸馏,都保持原料处于液态的白酒酿造方法[3]。相比于固态法白酒,液态发酵法有着节约粮食[4]、出酒率高、原料利用率高[5]、机械化程度高、工艺设备简单[6]等优点,但同时液态法白酒也存在质量较为参差不齐,质量不严格的情况等问题[7],且由于发酵过程中微生物较为单一,酶和代谢产物相较于固态发酵有所不同,因此液态发酵白酒酒体中酸酯等物质有所欠缺[8],使得其风味不够丰满,口感较为淡薄且辛辣。目前对于液态法白酒质量的提高措施主要有:固液结合法[9]、固液勾兑法[10]、调香法[11-12]、多种菌混合发酵[13]等方法。多菌种混合发酵是将多种微生物混合发酵,利用其协同作用,既可以提高酒体风味,又能提升出酒率。
由于酒类发酵是微生物复杂作用的过程,常规的分析检测手段较难对发酵体系中的所有代谢物进行定性定量分析,而代谢组学作为一种问题和数据驱动的方法,代谢组学已经在酿酒发酵研究中显示出巨大的潜力。代谢组学属于最新引入的“组学”技术之一,根据研究目的的不同,可以分为靶向代谢组学和非靶向代谢组学[14],靶向代谢组学是指对某个或某几个特定蛋白或代谢物进行针对性分析[15],非靶向代谢组学则可以对生物体系内所有小分子代谢物进行没有偏移性的定性定量检测[16]。由于代谢组学具有更高的灵敏度、更准确的分辨率等特点,可用于研究代谢产物与其他研究间的规律,因此代谢组学现常用于医疗、药学、食品、发酵等领域。近年来,代谢组学在微生物发酵研究领域备受欢迎,在发酵酒方面的研究也取得了重要进展,如WANG等[17]利用代谢组学从黄酒中分析鉴定出1 146个非挥发性化合物,其中997个为首次从黄酒中鉴定,此外,通过比较分析和京都百科全书的基因和基因组途径富集度分析,发现不同地区的黄酒在代谢物组成上存在差异。
本研究选用四川某酒精厂糖化醪为原料,选用均匀设计实验对液态白酒混菌发酵条件进行优化,再运用非靶向代谢组学研究多菌种混合发酵对液态白酒发酵液胞外代谢产物的影响,探讨基于特征风味物质形成的生物代谢途径,以期为液态白酒品质评价和风味形成机制提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
糖化醪,四川某酒精厂;安琪酵母菌粉、法尔凯酵母菌粉(酿酒酵母),四川某酒精厂;毕赤酵母(非酿酒酵母),四川轻化工大学某实验室收藏菌株(SCFF 282);干酪乳酪杆菌,四川省微生物资源平台菌种保藏关联中心(SICC 1.1343)。
酵母培养基(YPD培养基)(g/L):酵母浸粉10.0,葡萄糖20.0,蛋白胨20.0。
干酪乳酪杆菌培养基(MRS培养基)(g/L):蛋白胨10.0,醋酸钠5.0,牛肉膏10.0,柠檬酸二胺2.0,酵母浸粉5.0,磷酸氢二钾2.0,硫酸锰0.25,硫酸镁0.58,葡萄糖20.0,吐温1.0 mL/L。
1.2 仪器与设备
MicroScreen-HT实时微生物生长分析系统,杰灵仪器制造有限公司;LRH-250生化培养箱,上海一恒科学仪器有限公司;SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;ZWY-1102恒温培养振荡器,上海智城分析仪器制造有限公司;Centrifuge 5424 R冷冻离心机,德国Eppendorf公司;SBL-10TD控温超声波清洗机-10 L,宁波新芝生物科技股份有限公司;Vanquish Horizon system型UHPLC液相色谱系统、Q-Exactive HF-X质谱仪,美国Thermo Scientific公司。
1.3 实验方法
1.3.1 菌种活化及种子液制备
分别将斜面保存的毕赤酵母接种于100 mL YPD培养基中、干酪乳酪杆菌接种于100 mL MRS培养基中,放置于150 r/min,30 ℃摇床中培养16 h。将上述菌液按照2%(体积分数)转接至新的YPD培养基及MRS培养基中,在相同条件下继续培养24 h以得到毕赤酵母种子液及干酪乳酪杆菌种子液。
1.3.2 活菌数测定
1)酿酒酵母活菌数计数:按7∶3(质量比)准确称取安琪酵母及法尔凯酵母共10 g,置入装有90 mL无菌生理盐水的250 mL三角瓶中,振荡均匀,在30 ℃条件下放置30 min,再取1 mL加入无菌水9 mL,按照此操作重复6~8次,选择3个合适的稀释梯度,取100 μL稀释液在YPD固体培养基上进行涂布,在30 ℃恒温培养箱培养24 h,进行菌落数的计算。
2)毕赤酵母活菌数计数:移取1 mL毕赤酵母种子液加入无菌水9 mL,按照此操作重复6~8次,选择3个合适的稀释梯度,准确吸取100 μL稀释液涂布于YPD固体培养基上,并置于30 ℃恒温培养箱中培养24 h后计数。
1.3.3 发酵样品总酯的测定
参考GB/T 10345—2022《白酒分析方法》中总酯含量的检测方法对发酵样品中的总酯含量进行检测。
1.3.4 液态白酒混菌发酵均匀设计实验
根据均匀设计实验原理,考察原料混菌发酵后液态白酒发酵液中总酯含量与酿酒酵母:毕赤酵母、酿酒酵母接种量、干酪乳酪杆菌接种量、酵母接种时间、干酪乳杆菌接种时间5个实验因素间的相关性,5因素分别安排10、10、10、5、5个水平进行实验。各因素考察水平表如表1所示。实验选用的是U10(103×52)的混合水平均匀设计表,利用DPS(data processing system)数据处理系统,对表1中液态白酒混菌发酵各因素进行均匀设计实验,得到均匀设计实验表。
取150 mL糖化醪于250 mL锥形瓶中,固定安琪酵母与法尔凯酵母比例为7∶3,其余条件根据均匀设计实验表设计不同组发酵条件,实验样品均放置于150 r/min,30 ℃摇床中,发酵3 d后对发酵液总酯含量进行测定。
1.3.5 代谢组学分析样品制作
设置2组实验,分别为最优条件组(ZY组):酿酒酵母添加量∶毕赤酵母添加量=5.3∶1、酿酒酵母接种量为0.006 5 g/g、干酪乳酪杆菌接种量1.9%、酵母接种时间第23.5 h、干酪乳酪杆菌接种时间第0 h;以及对照组(JM组):按添加量0.005 g/g添加酿酒酵母。所有样品均放置于150 r/min,30 ℃摇床中发酵3 d,每组实验均设置6组平行。
1.3.6 代谢组学分析样品制作
取40 mL样品于离心管中,以4 ℃,12 000 r/min离心15 min,取上层清液,于真空冷冻干燥机中干燥至水分去除完全,于-80 ℃保存样品。
1.3.7 样品处理
取20 mg经冷冻干燥后的发酵液样品,加入400 μL提取液研磨6 min,低温超声提取30 min后放入-20 ℃冰箱中冷冻30 min,离心15 min后取上清液,用氮气吹干后加入120 μL复溶液;涡旋混匀30 s,低温超声萃取5 min,离心15 min后取上清液上机分析;每个样本分别移取20 μL上清液,混合后作为质控样本。
表1 均匀实验因素水平表
Table 1 Uniform experimental factor level table
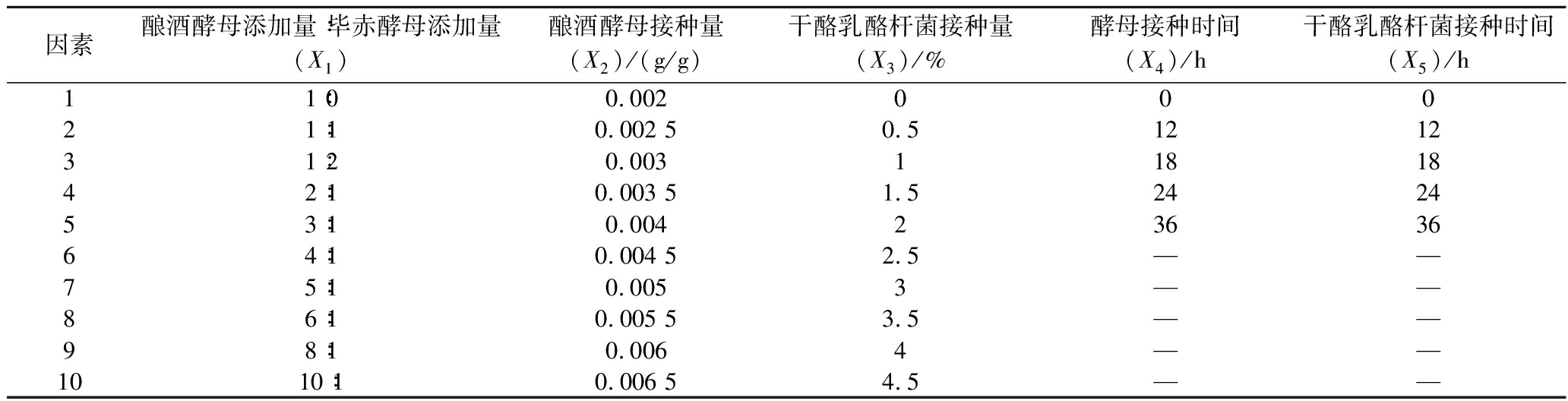
因素酿酒酵母添加量∶毕赤酵母添加量(X1)酿酒酵母接种量(X2)/(g/g)干酪乳酪杆菌接种量(X3)/%酵母接种时间(X4)/h干酪乳酪杆菌接种时间(X5)/h11∶00.00200021∶10.002 50.5121231∶20.0031181842∶10.003 51.5242453∶10.0042363664∶10.004 52.5——75∶10.0053——86∶10.005 53.5——98∶10.0064——1010∶10.006 54.5——
注:—表示此因素水平无对应参数。
1.3.8 LC-MS检测
色谱条件:流动相A为95%水+5%乙腈(含0.1%甲酸),流动相B为47.5%乙腈+47.5%异丙醇+5%水(含0.1%甲酸),进样量为3 μL,柱温为40 ℃(均为体积分数)。
质谱条件:样品经电喷雾电离,分别采用正、负离子扫描模式采集质谱信号。具体参数见表2:
表2 质谱参数
Table 2 Mass spectrometry parameters

参数数值扫描范围(m/z)70~1 050鞘气流速/(L/min)50辅助气流速/(L/min)13加热温度/℃425毛细管温度/℃325喷雾电压/V3 500S-Lens 电压/V50碰撞能/eV204 060全扫描质谱分辨率60 000二级质谱分辨率7 500
1.4 数据统计分析
均匀设计实验采用DPS 8.0进行数据处理,代谢组学数据导入代谢组学处理软件Progenesis QI v3.0(Waters Corporation,Milford,USA),进行代谢物鉴定。
2 结果与分析
2.1 菌落数计数
通过平板计数法测得1 g酿酒酵母菌落数为1.49×1010 CFU/g,1 mL毕赤酵母种子液菌落数为1.25×108 CFU/mL,得1 g酿酒酵母菌落数约为1 mL毕赤酵母种子液的120倍。
2.2 均匀设计实验结果及分析
均匀设计实验优化液态白酒混菌发酵条件的结果如表3所示,将表3数据通过DPS 8.0软件进行回归分析,得回归方程:
Y=1.404-0.280X1+0.029X4-0.022X5-0.473×10-3X42+0.610×10-3X52+0.014X1X4+0.954X2X4-0.653×10-3X4X5
相关系数R为1,决定系数R2为0.999,剩余标准差S=0.004,调整后的相关系数Ra=0.999,P=0.010<0.05,F=5 606.474,作F检验,F>F0.05(5,1)。DurbinWatson统计量d=1.515,接近2,说明残差服从正态分布,模型恰当[18]。从这些统计学参数可以看出,此回归方程显著,准确度较高。
利用DPS软件,对所得模型进行寻优,得到最佳总酯产量的混菌发酵条件为:酿酒酵母添加量∶毕赤酵母添加量=5.3∶1、酿酒酵母接种量为0.006 5 g/g、干酪乳杆菌接种量1.9%、酵母接种时间23.5 h、干酪乳杆菌接种时间0 h为条件进行验证实验,验证结果如表4所示。自然发酵酒精度为10.5%vol,平均总酯产量为2.040 g/L,比预测总酯产量高出0.042 g/L,相对偏差为0.029%,该实验准确度较高。
2.3 多菌种混合发酵液态白酒非靶向代谢组学分析
2.3.1 主成分分析(principal component analysis,PCA)及偏最小二乘判别分析(partial least-squares discriminant analysis,PLS-DA)
图1为正离子模式下、负离子模式下ZY组及JM组样本以及QC样本的PCA得分图,由图1可看出,QC样本的聚集性良好,相较于ZY组及JM组样本,QC样本的离散度有明显的降低,表明系统稳定性良好。正离子模式下、负离子模式下两组样本之间的分离度均较高,说明添加不同微生物进行混菌发酵能导致液态白酒代谢差异。
表3 均匀实验结果表
Table 3 Uniform experimental results table
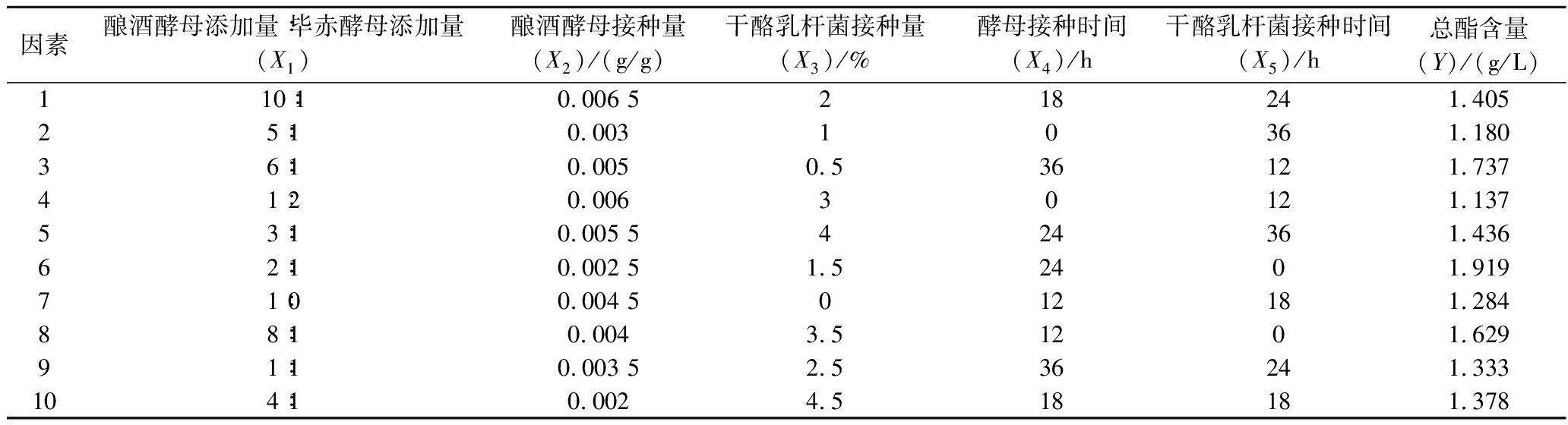
因素酿酒酵母添加量∶毕赤酵母添加量(X1)酿酒酵母接种量(X2)/(g/g)干酪乳杆菌接种量(X3)/%酵母接种时间(X4)/h干酪乳杆菌接种时间(X5)/h总酯含量(Y)/(g/L)110∶10.006 5218241.40525∶10.00310361.18036∶10.0050.536121.73741∶20.00630121.13753∶10.005 5424361.43662∶10.002 51.52401.91971∶00.004 5012181.28488∶10.0043.51201.62991∶10.003 52.536241.333104∶10.0024.518181.378
表4 验证实验结果
Table 4 verifies the experimental results
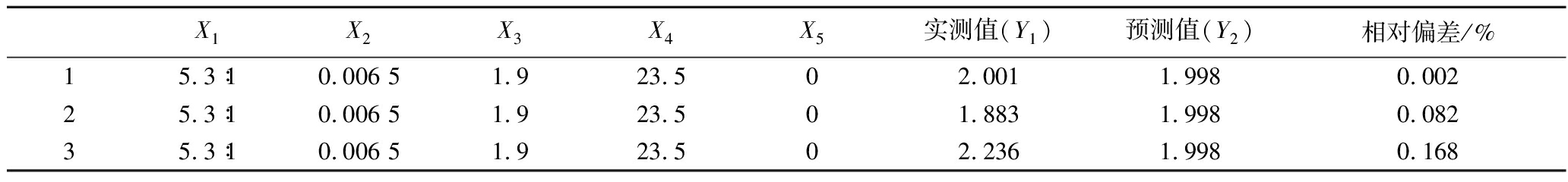
X1X2X3X4X5实测值(Y1)预测值(Y2)相对偏差/%15.3∶10.006 51.923.502.0011.9980.00225.3∶10.006 51.923.501.8831.9980.08235.3∶10.006 51.923.502.2361.9980.168
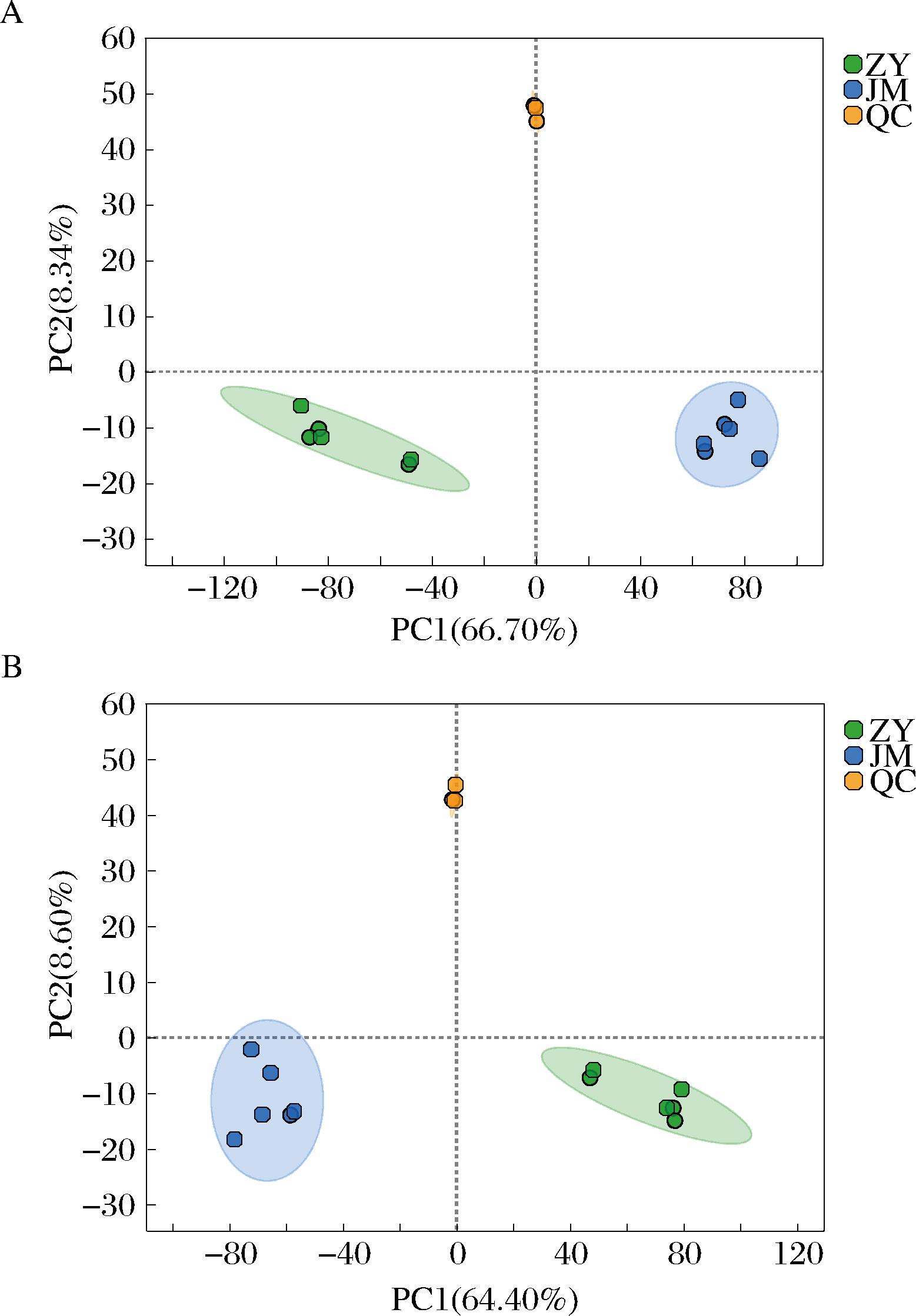
A-正离子模式;B-负离子模式
图1 正负离子模式下PCA得分图
Fig.1 PCA score plot in positive and negative ion mode
图2为正、负离子模式下ZY组和JM组样本及QC样本的PLS-DA得分图及置换检验图。由PLS-DA得分图可看出,在正离子、负离子模式下,ZY组与JM组之间均存在较大差异。为避免PLS-DA模型过度拟合,对模型进行200次的随机置换检验,由图2可看出,随着置换保留度的下降,R2和Q2下降,回归线呈向上的趋势,说明置换检验过关,模型不存在过拟合现象[19]。且在正离子模式下,R2X累积值为0.751,R2Y累积值为0.541,Q2为0.534,在负离子模式下,R2X累积值为0.772,R2Y累积值为0.545,Q2为0.539,表明PLS-DA模型均具有较好的拟合性和预测能力。
2.3.2 差异代谢物分析
2.3.2.1 代谢产物概况
将代谢物在HMDB、KEGG数据库的功能注释进行汇总,在ZY组与JM组中共检测到的峰共计1 261个。在KEGG数据库中共注释到84种代谢化合物,主要包含脂质类29种、核酸类12种,肽类11种,碳水化合物4种等,如图3所示。在HMDB数据库中共注释到1 179个代谢化合物,主要包括有机酸及其衍生物324种,脂质和类脂分子270种,有机杂环化合物156种,有机氧化合物92种,选取代谢物数量前15的HMDB分类制作饼图,结果如图4所示。
2.3.2.2 差异代谢物分析
筛选Fold Change为1、VIP≥1、P<0.05的代谢产物作为差异代谢产物[20],发现ZY组与JM组共存在1 261种差异代谢物。影响液态白酒风味的多是以原料中的脂肪、淀粉、蛋白质等作为前体物质,由微生物通过代谢作用分解产生氨基酸、脂类、糖类等,因此将氨基酸、有机酸、脂肪酸作为重要的分析目标,筛选出与液态白酒品质形成相关的代谢产物。两组样品间的部分差异代谢物如表5所示。
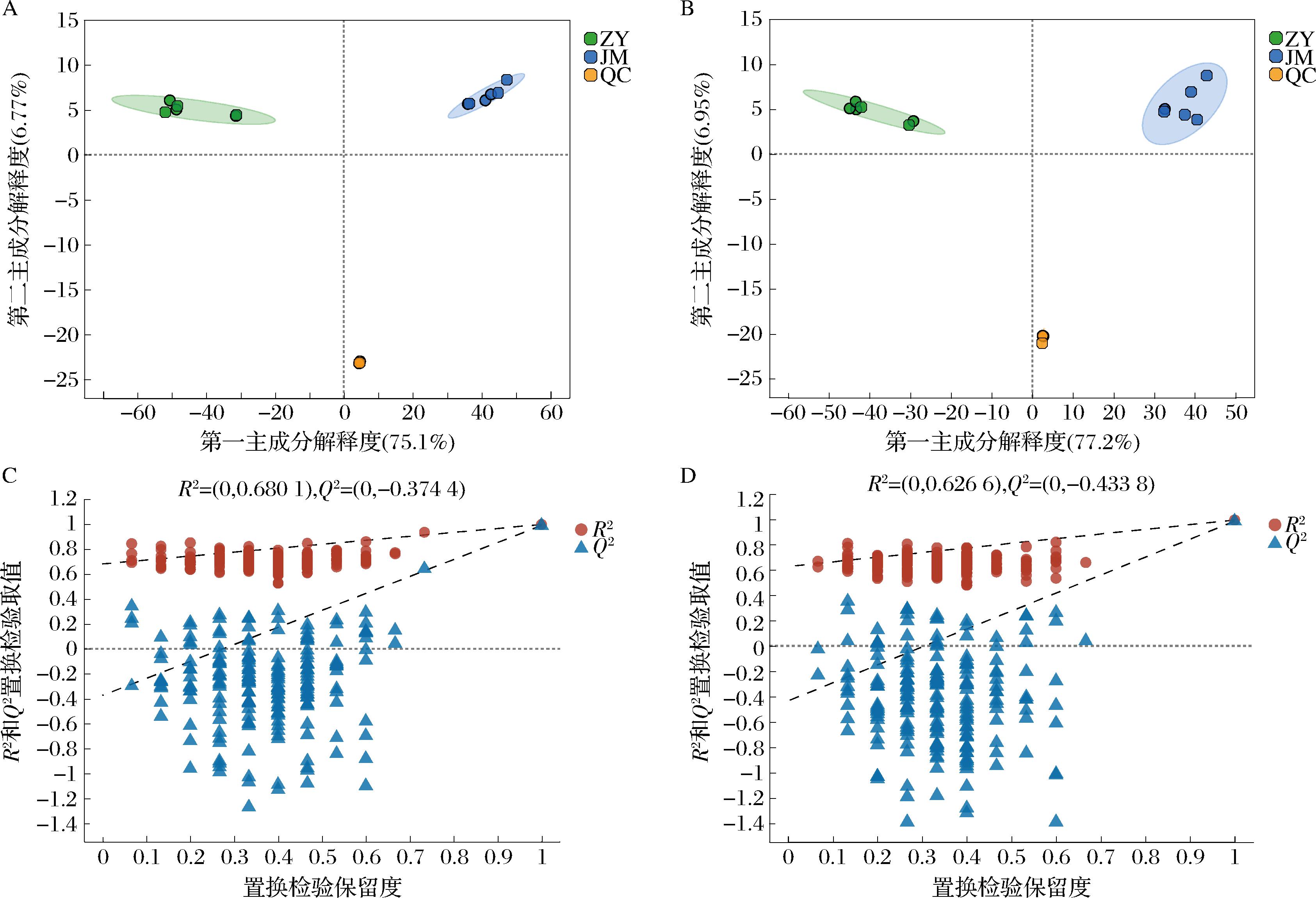
A-正离子模式下得分图;B-负离子模式下得分图;C-正离子模式下置换检验图;D-负离子模式下置换检验图
图2 正负离子模式下PLS-DA得分图及置换检验图
Fig.2 PLS-DA score plot and permutation test plot in positive and negative ion mode
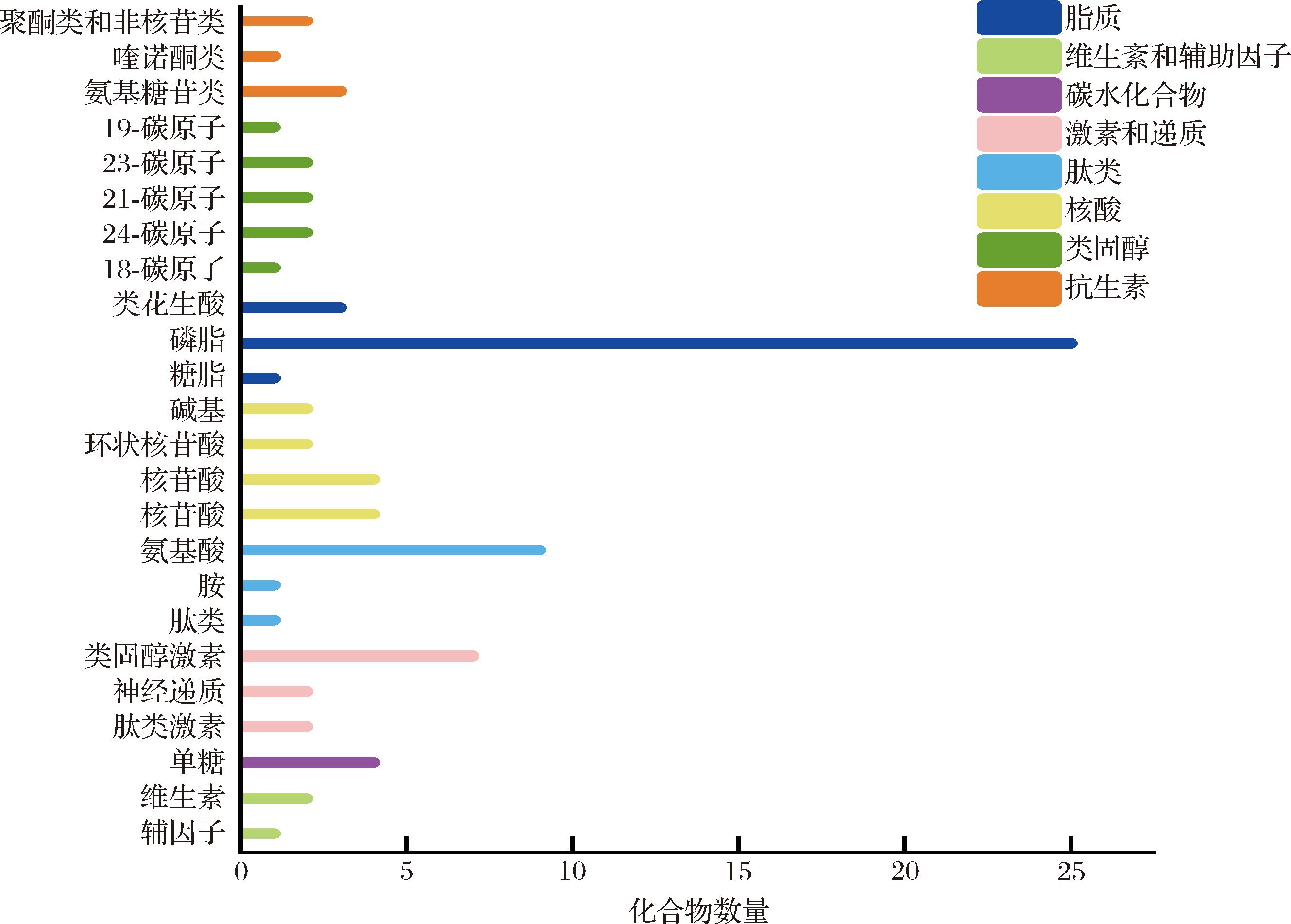
图3 KEGG数据库化合物分类
Fig.3 KEGG database compound classification
由于本实验主要研究添加多种微生物进行多菌发酵对液态白酒品质的影响,因此主要对ZY组与JM组进行分析。ZY组与JM组中差异代谢物主要可分为氨基酸、有机酸类、核酸类、碳水化合物等,其中具有天冬氨酸、L-天门冬酰胺、腺嘌呤、鸟嘌呤、次黄嘌呤、脱氧鸟苷酸、鸟嘌呤、柠檬酸、琥珀酸等关键差异代谢产物。其中腺嘌呤、鸟嘌呤、脯氨酸、柠檬酸、琥珀酸、天冬氨酸、L-天门冬酰胺、异丙酰胺等含量上升,鸟苷、次黄嘌呤等含量下降。
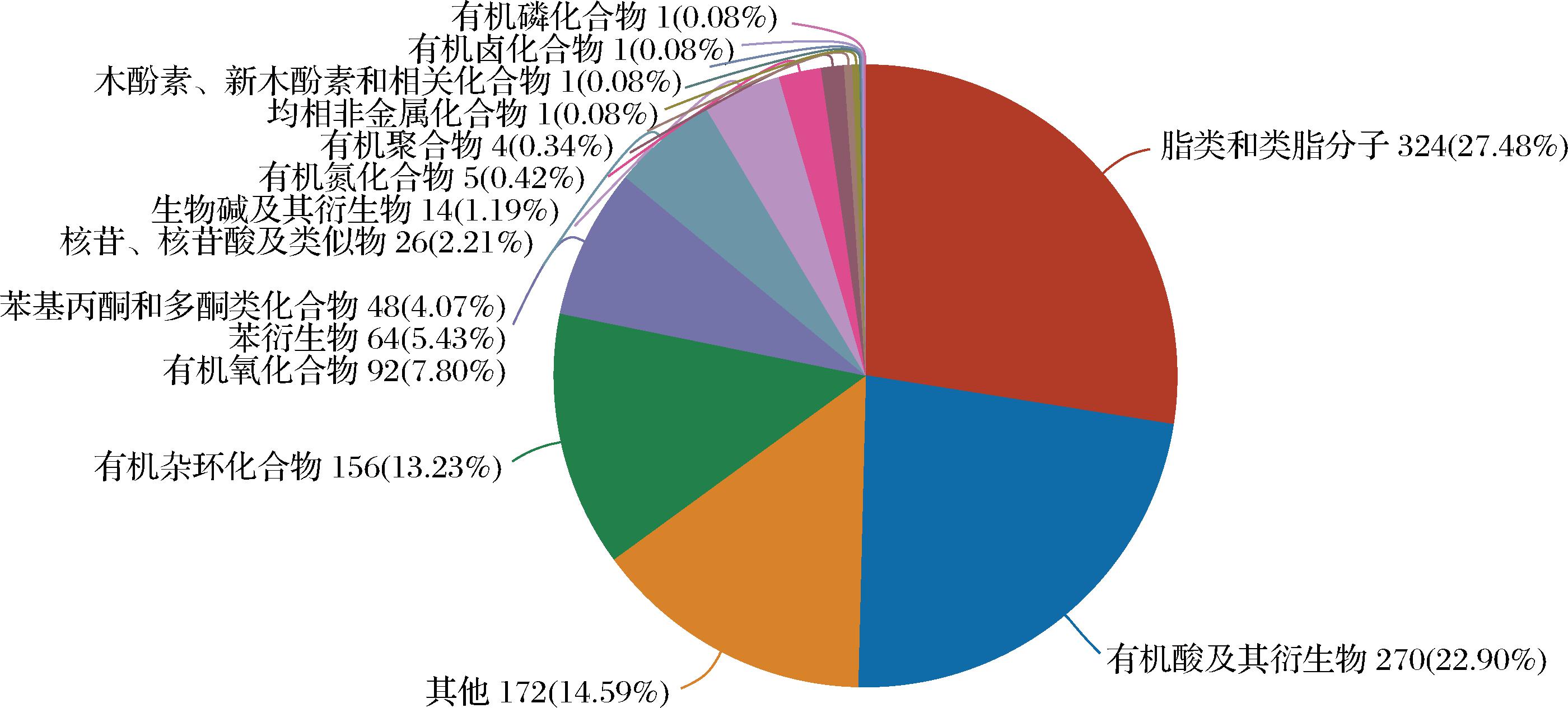
图4 HMDB数据库化合物分类
Fig.4 Compounds classification in HMDB database
有机酸是酒体重要风味物质之一,在酒体中种类及含量均较为复杂。有机酸是三羧酸循环(tricarboxylic acid cycle,TCA循环)的重要产物,对白酒风味的形成起着至关重要的作用,被称为“白酒骨架”,有机酸含量的高低直接影响着液态白酒的味、香、色的平衡,最终影响液态白酒的品质,适量的有机酸可以改善感官品质。葡萄糖在相关酶的作用下生成丙酮酸,然后再丙酮酸脱氢酶作用下生成乙酰辅酶A,进入TCA循环生成柠檬酸、苹果酸和琥珀酸等有机酸。柠檬酸、苹果酸和琥珀酸在两实验组中存在较为明显的差异,ZY组中柠檬酸、苹果酸和琥珀酸等关键有机酸含量相较于JM组均有所上调。
腺嘌呤和黄嘌呤是维持机体代谢功能所必需的嘌呤类物质,而黄嘌呤和次黄嘌呤多是液态白酒酒体中的苦味来源[21]。通过对比ZY组与JM组中的差异代谢物,发现ZY组种黄嘌呤及次黄嘌呤含量有所下降,说明添加毕赤酵母和干酪乳杆菌与酿酒酵母进行混菌发酵能有利于降低液态白酒酒体中苦味物质的含量,与李东娜[21]的研究一致。
氨基酸是酯、醛、高级醇等风味物质的前提,氨基酸还具有一定的酸、甜、苦、咸、鲜等风味[22],有助于提高液态白酒风味、增加复杂口感,改善酒体的品质。在发酵过程中,氨基酸可为微生物代谢提供氮源,氨基酸的碳骨架可参与微生物细胞内其他氨基酸或蛋白的合成,从而影响酒体口感。如脯氨酸可以平衡酒体口感并提供柔软感;苯丙氨酸在转氨酶、相应解氨酶或者脱羧酶作用下生成芳香族化合物,成为白酒风味的组成部分[23]。通过对比ZY组与JM组的差异氨基酸类代谢物,发现包含L-天门冬酰胺、L-丝氨酸、L-色氨酸、L-亮氨酸、苯丙氨酸、脯氨酸、天冬氨酸、组氨酸等多种氨基酸,且大部分氨基酸含量均相较于JM组有所上调。
表5 ZY组与JM组发酵体系中的部分差异代谢物
Table 5 Some differential metabolites in the fermentation system of ZY group and JM group
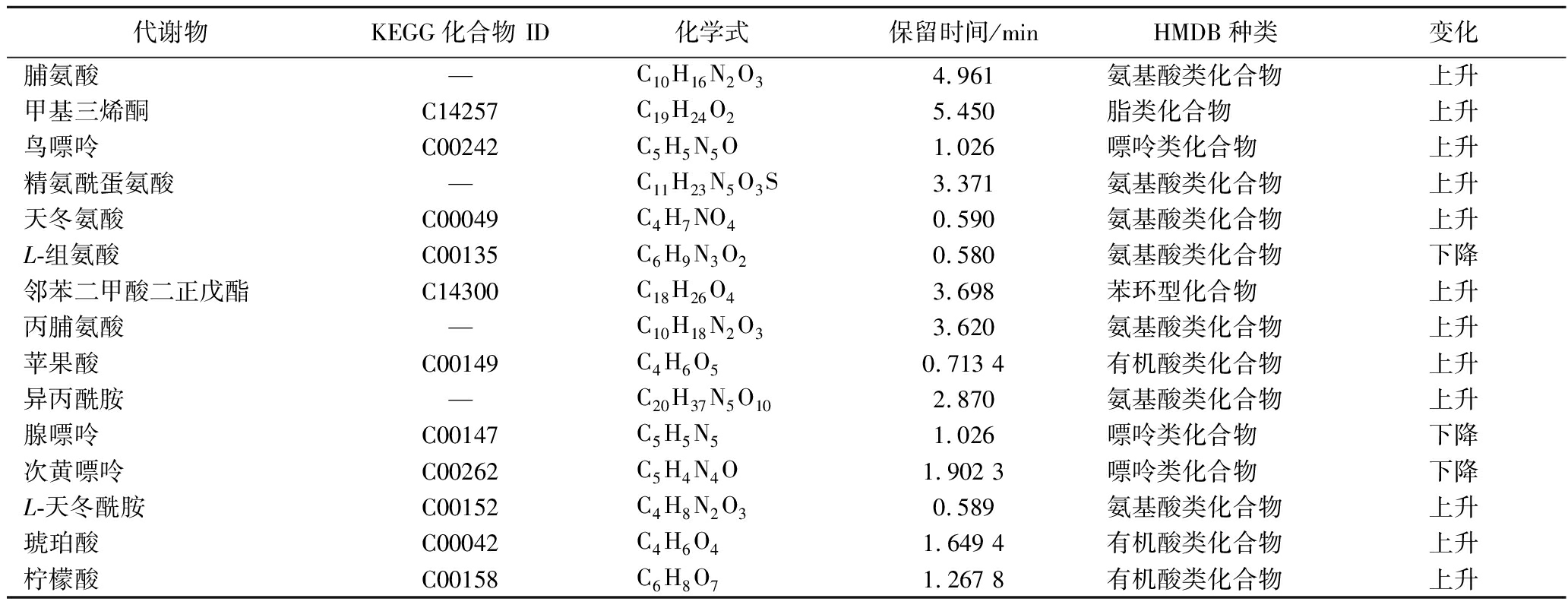
代谢物KEGG化合物 ID化学式保留时间/minHMDB种类变化脯氨酸—C10H16N2O34.961氨基酸类化合物上升甲基三烯酮C14257C19H24O25.450脂类化合物上升鸟嘌呤C00242C5H5N5O1.026嘌呤类化合物上升精氨酰蛋氨酸—C11H23N5O3S3.371氨基酸类化合物上升天冬氨酸C00049C4H7NO40.590氨基酸类化合物上升L-组氨酸C00135C6H9N3O20.580氨基酸类化合物下降邻苯二甲酸二正戊酯C14300C18H26O43.698苯环型化合物上升丙脯氨酸—C10H18N2O33.620氨基酸类化合物上升苹果酸C00149C4H6O50.713 4有机酸类化合物上升异丙酰胺—C20H37N5O102.870氨基酸类化合物上升腺嘌呤C00147C5H5N51.026嘌呤类化合物下降次黄嘌呤C00262C5H4N4O1.902 3嘌呤类化合物下降L-天冬酰胺C00152C4H8N2O30.589氨基酸类化合物上升琥珀酸C00042C4H6O41.649 4有机酸类化合物上升柠檬酸C00158C6H8O71.267 8有机酸类化合物上升
注:—代表无数据。
研究发现干酪乳酪杆菌与柠檬酸、琥珀酸、苹果酸、脯氨酸含量成正相关,干酪乳酪杆菌在发酵过程中能利用糖类物质生成有机酸,故ZY组中大部分有机酸含量相较于JM组有所上调[24]。酵母能参与蛋白质的代谢并加速其分解,产生大量氨基酸[25],推测氨基酸含量与酵母菌呈正相关,ZY组中酿酒酵母及安琪酵母含量均高于JM组,故能促进氨基酸的生成。
2.3.2.3 层级聚类分析
由于本实验所检测到差异代谢物数量较多,故选取丰度前50的代谢物进行层级聚类分析,探究代谢物在样品中的表达情况。两组样本间的差异代谢物热图如图5所示,由图5可看出,液态白酒糖化醪在微生物的作用下产生氨基酸、有机酸、葡萄糖等代谢物。腺苷、脱氧鸟苷酸、烟酸、5-(生物酰胺)戊胺等物质在JM组中含量较高,而在ZY组中含量较低,原因是ZY组相较于JM组多添加了干酪乳杆菌,干酪乳杆菌可将此类代谢物转化为其他代谢物。雄烯二酮、缬氨酸和谷氨酸、肉桂酸、正亮氨酸、5-甲基-2-糠醛、1,4-b-D-甘露聚糖、腺嘌呤、维生素B6等代谢物在在KB组及JM组中含量较低,而在ZY组中含量较高,说明添加毕赤酵母及干酪乳杆菌进行液态白酒的混菌发酵相较于纯种发酵能提高此类代谢物的含量,而这类代谢物与酒体风味有较大关联性,说明利用混菌发酵提高液态白酒质量是可行的。

图5 层级聚类分析图
Fig.5 Hierarchical cluster analysis diagram
2.3.3 差异代谢物代谢通路分析
2.3.3.1 代谢通路总分析
通过KEGG PATHWAY数据库查找相关代谢产物,根据代谢物比对到KEGG compound ID 的信息,可以获知代谢物参与的代谢通路信息,从而评价其对生物新陈代谢过程的影响。ZY组与JM组所富集到的代谢通路如图6所示,可将KEGG代谢通路分为7个一级分类:代谢,遗传信息处理,环境信息处理,细胞过程,生物体系统,人类疾病,药物开发[26]。一级分类下涉及46个二级分类,其中代谢通路最多的是脂质代谢以及氨基酸代谢两大类,分别有64条及48条。
2.3.3.2 差异代谢通路富集分析
通过KEGG富集分析对差异代谢途径进行比较,对ZY组与JM组进行通路富集分析可获得262种差异代谢通路,其中有94条存在显著差异的代谢通路,选择富集程度前20条的代谢通路绘制成柱状图,结果如图7所示,富集程度最好的前5条通论分别是:a)轴突再生;b)GnRH信号通路;c)胆固醇代谢;d)癌症中的胆碱代谢;e)脂肪细胞脂解的调节。
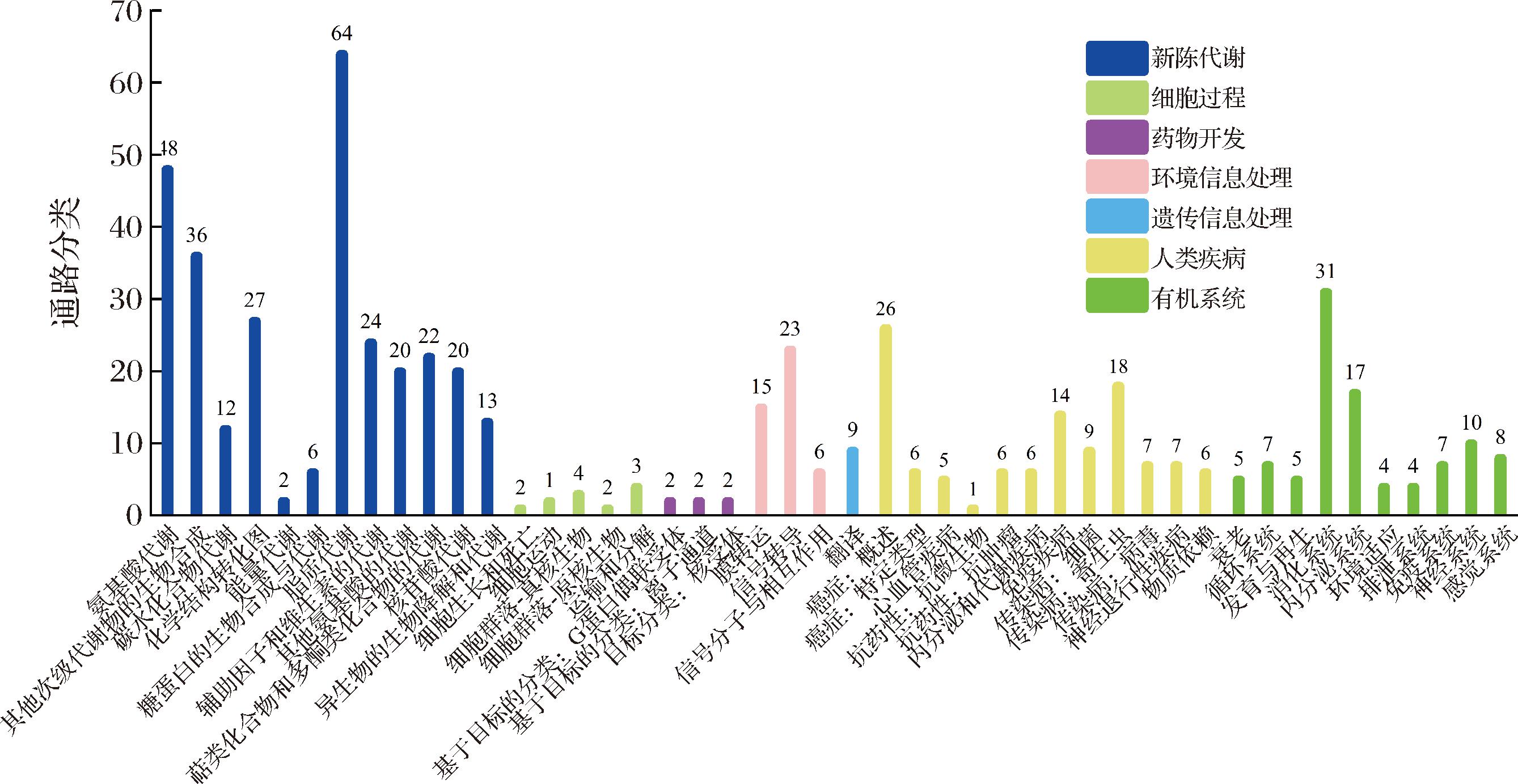
图6 差异代谢通路统计图
Fig.6 Statistical chart of differential metabolic pathways in all samples
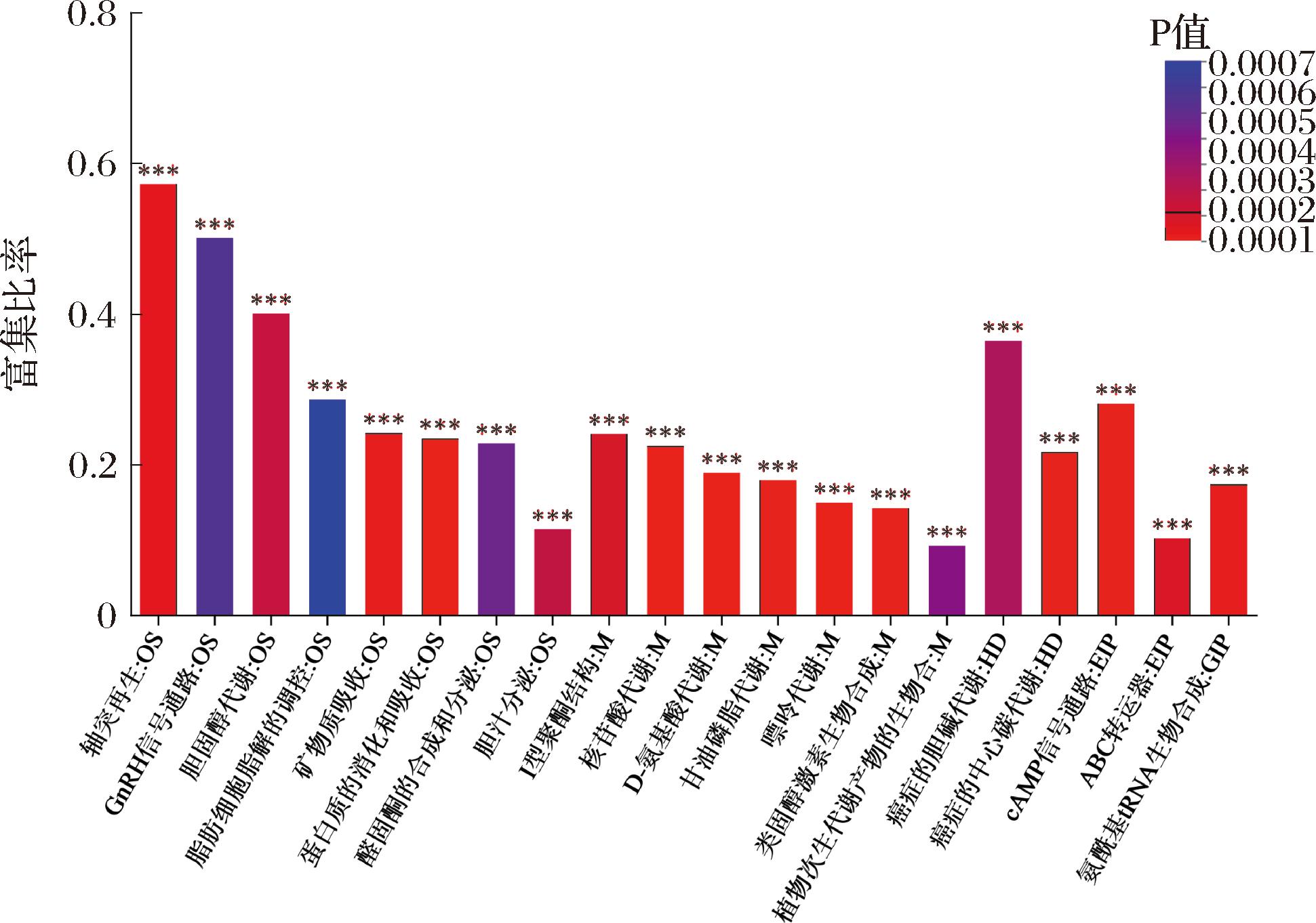
图7 显著差异代谢物KEGG富集图
Fig.7 KEGG enrichment map of metabolites with significant differences
注:***代表差异极显著(P<0.001)。
根据KEGG拓扑学分析气泡图(图8)所示,前5条关键代谢途径分别为:a)类固醇降解;b)丙氨酸、天冬氨酸和谷氨酸代谢;c)核苷酸代谢;d)甘油磷脂代谢;e)类固醇激素生物合成。L-色氨酸、天冬氨酸、L-天门冬酰胺、5-磷酸核糖胺、腺嘌呤、脱氧腺苷、鸟嘌呤、次黄嘌呤、脱氧鸟苷酸、鸟嘌呤、L-丝氨酸、2-羟基雌酮、牛磺胆酸等关键代谢产物与这5条关键代谢途径相关。
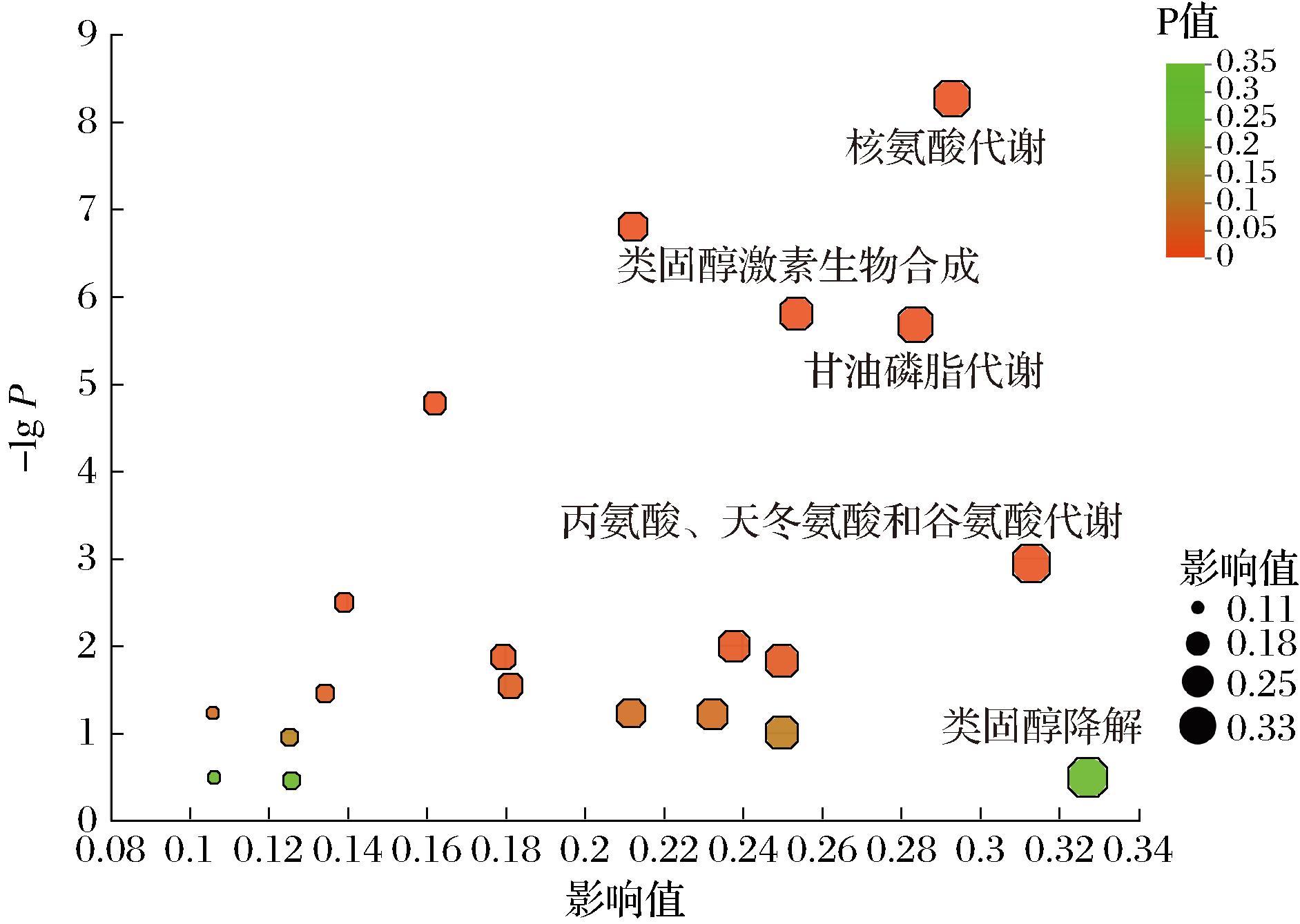
图8 KEGG拓扑学分析气泡图
Fig.8 KEGG topology analysis bubble diagram
2.3.4 代谢网络图构建
通过对差异代谢物及关键代谢途径进行分析,将部分差异代谢产物反映到代谢途径中,如图9所示。在发酵过程中,淀粉首先在微生物的作用下分解成葡萄糖,然后进一步合成丙酮酸[27]。丙酮酸可以通过丙酮酸代谢途径生成乳酸,也可通过糖酵解途径生成乙醇,在丙酮酸代谢后可在丙酮酸脱氢酶的作用下合成乙酰辅酶A,然后进入TCA循环(又称柠檬酸循环),TCA循环是碳水化合物、脂类、氨基酸等多条代谢的关键枢纽[28]。琥珀酸、2-酮戊二酸通过TCA循环产生,并进一步转化为必需氨基酸,如谷氨酸和天冬氨酸[29]。
ZY组、JM组均对丙氨酸、天冬氨酸和谷氨酸代谢途径有影响,但相较于JM组,ZY组中的L-天冬氨酸、天冬氨酸、L-丝氨酸等多种关键代谢物含量均有所上升,其中L-天冬氨酸是液态白酒发酵过程中的重要代谢底物,L-天冬氨酸可被转化成赖氨酸、L-酪氨酸等代谢物,进一步进行生物素代谢、倍他林生物合成等。ZY组中,丙酮酸可转化成L-同型半胱氨酸,进行核苷酸代谢,从而对腺嘌呤、鸟嘌呤、黄嘌呤、次黄嘌呤等关键代谢物含量及种类造成影响,进一步对酒体风味及品质带来影响。这些预测的途径与观察到的液态白酒在酿造过程中不同代谢物的相对丰度变化是一致的。

图9 液态白酒发酵过程关键差异代谢物的相关途径
Fig.9 Related pathways of key differential metabolites in liquid Baijiu fermentation process
注:红色为上调代谢物,蓝色为下调代谢物。
3 结果与讨论
本实验通过均匀设计实验得到多菌种混合发酵液态白酒的最优工艺条件为酿酒酵母添加量∶毕赤酵母添加量=5.3∶1、酿酒酵母接种量为0.006 5 g/g、干酪乳杆菌接种量1.9%、酵母接种时间23.5 h、干酪乳杆菌在发酵开始时加入,预计总酯产量为1.999 g/L,测得样品实际总酯产量为2.040 g/L,比预测总酯产量高出0.041 g/L,相对偏差为0.029%。基于非靶向代谢组学对多菌种混合发酵液态白酒发酵液中代谢产物进行评价,在ZY组与JM组中共检测到的差异代谢物1 261个,主要差异代谢物主要可分为氨基酸9种、脂质类29种、核酸类12种、碳水化合物4种等,其中具有天冬氨酸、L-天门冬酰胺、腺嘌呤、鸟嘌呤、次黄嘌呤、脱氧鸟苷酸、鸟嘌呤、牛磺胆酸等关键差异代谢产物。其中腺嘌呤、鸟嘌呤、脯氨酸、脱氧胞苷、天冬氨酸、L-天门冬酰胺、牛磺胆酸盐、异丙酰胺等含量上升,鸟苷、次黄嘌呤等含量下降,说明利用多菌种进行混合发酵能够有效提高液态白酒风味及品质。通过KEGG富集分析对差异代谢途径进行比较,共有46中代谢通路,其中代谢通路最多的是脂质代谢以及氨基酸代谢两大类,分别有64条及48条。对ZY组与JM组进行通路富集分析可获得262种差异代谢通路,其中有94条存在显著差异的代谢通路,前5条关键代谢途径分别为:a)类固醇降解;b)丙氨酸、天冬氨酸和谷氨酸代谢;c)核苷酸代谢;d)甘油磷脂代谢;e)类固醇激素生物合成。
[1] 彭海文, 周文美. 液态发酵法酿造荞麦酒发酵工艺研究[J]. 酿酒科技, 2012(8):97-100; 105.
PENG H W, ZHOU W M. Research on fermentation conditions of buckwheat wine by liquid fermentation[J]. Liquor-Making Science &Technology, 2012(8):97-100; 105.
[2] 唐取来.米香型白酒新工艺的研究[D].天津:天津科技大学,2016.
TANG Q L. Study on the new technology of rice-flavor liquor[D]. Tianjin: Tianjin University of Science and Technology, 2016.
[3] 张国强. 中国白酒味之韵[J]. 酿酒, 2014, 41(4):16-17.
ZHANG G Q. The charm of Chinese liquor taste[J]. Liquor Making, 2014, 41(4):16-17.
[4] 王星凯.米酒液态发酵原料预处理及发酵条件优化[D].广州:华南理工大学,2018.
WANG X K. Pretreatment of raw materials for liquid fermentation of rice wine and optimization of fermentation conditions [D].Guangzhou: South China University of Technology,2018.
[5] 罗玲. 大曲发酵液态白酒工艺优化研究[J]. 食品安全导刊, 2023(5):130-134; 144.
LUO L. Research on process optimization of liquid fermentation Baijiu by daqu fermentation[J]. China Food Safety Magazine, 2023(5):130-134; 144.
[6] 岳春, 周尚, 陈明忠, 等. 全液态化生产红薯叶保健黄酒的研究[J]. 中国调味品, 2008, 33(3):37-40.
YUE C, ZHOU S, CHEN M Z, et al. Entire liquid state production sweet potato leaf health yellow wine research[J]. China Condiment, 2008, 33(3):37-40.
[7] 王春霞, 王敏, 王建玲, 等. 液态发酵柿子白酒的研究[J]. 食品与发酵工业, 2002, 28(5):43-46.
WANG C X, WANG M, WANG J L, et al. Study on the persimmon liquor manufacture with liquid state fermentation[J]. Food and Fermentation Industries, 2002, 28(5):43-46.
[8] 彭全生, 刘春连. 固液结合法白酒的特点、发展趋势和目前面临的问题[J]. 食品工程, 2007(3):30-32.
PENG Q S, LIU C L. The feature tendency and obstacles of the liquor produced with technology of solid-liquid combination[J]. Food Engineering, 2007(3):30-32.
[9] YU H Y, GUO W, XIE T, et al. Aroma characteristics of traditional Huangjiu produced around Winter Solstice revealed by sensory evaluation, gas chromatography-mass spectrometry and gas chromatography-ion mobility spectrometry[J]. Food Research International, 2021, 145:110421.
[10] 曾宪玮, 陈永达. 米香型白酒降度后调香技术研究[J]. 现代食品, 2021, 27(15):15-16; 20.
ZENG X W, CHEN Y D. Study on flavoring technology of rice flavor liquor after reducing alcohol content[J]. Modern Food, 2021, 27(15):15-16; 20.
[11] YOU L, ZHAO D, ZHOU R Q, et al. Distribution and function of dominant yeast species in the fermentation of strong-flavor Baijiu[J]. World Journal of Microbiology &Biotechnology, 2021, 37(2):26.
[12] 简轻松. 对提高贵州液态法白酒质量的看法[J]. 当代化工研究, 2018(7):30-31.
JIAN Q S. Opinions on improving the quality of Guizhou liquor by liquid method[J]. Modern Chemical Research, 2018(7):30-31.
[13] 张河云, 王学娇, 张曼, 等. 酸类物质对浓香型白酒风味的影响研究[J]. 中国酿造, 2023, 42(11):82-89.
ZHANG H Y, WANG X J, ZHANG M, et al. Influence of acids on the flavor of strong-flavor Baijiu[J]. China Brewing, 2023, 42(11):82-89.
[14] 黄慧敏.基于代谢组学技术分析枯草芽孢杆菌对致龋菌的生长抑制作用[D].兰州:兰州大学,2018.
HUANG H M. Analysis of growth inhibition of Bacillus subtilis on cariogenic bacteria based on metabonomics technology[D].Lanzhou:Lanzhou University, 2018.
[15] 张子洁, 唐鳗秋, 夏玙, 等. 基于代谢组学分析四川黄酒麦曲制曲发酵过程中黄酮类物质的代谢[J]. 食品科技, 2022, 47(7):250-255.
ZHANG Z J, TANG M Q, XIA Y, et al. Metabolic analysis of flavonoids during koji making and fermentation of Sichuan yellow wine wheat koji based on metabonomics[J]. Food Science and Technology, 2022, 47(7):250-255.
[16] 胡明珍, 刘慧燕, 潘琳, 等. 基于非靶向代谢组学分析副干酪乳杆菌发酵枸杞汁各阶段代谢差异[J]. 食品科学, 2022, 43(8):142-149.
HU M Z, LIU H Y, PAN L, et al. Non-targeted metabolomics analysis of differential metabolite profiles of goji juice fermented by Lactobacillus paracasei[J]. Food Science, 2022, 43(8):142-149.
[17] WANG J, WANG D Q, HUANG M Q, et al. Identification of nonvolatile chemical constituents in Chinese Huangjiu using widely targeted metabolomics[J]. Food Research International, 2023, 172:113226.
[18] 尹永芹, 严优芍, 陶曙红, 等. 均匀设计法优化五爪金龙提取工艺及不同采收期总黄酮含量测定[J]. 中医药导报, 2012, 18(11):14-17.
YIN Y Q, YAN Y S, TAO S H, et al. Uniform design method for optimizing the extraction technology of Ipomoea cairica and content determination of flavonoid in different harvest times[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2012, 18(11):14-17.
[19] CHEN S, XU Y, QIAN M C. Comparison of the aromatic profile of traditional and modern types of Huang Jiu (Chinese rice wine) by aroma extract dilution analysis and chemical analysis[J]. Flavour and Fragrance Journal, 2018, 33(3):263-271.
[20] BETTENHAUSEN H M, BENSON A, FISK S, et al. Variation in sensory attributes and volatile compounds in beers brewed from genetically distinct malts: An integrated sensory and non-targeted metabolomics approach[J]. Journal of the American Society of Brewing Chemists, 2020, 78(2):136-152.
[21] 李东娜. 基于代谢组学的非酿酒酵母与酿酒酵母协同发酵白果米酒的研究[D].上海:上海应用技术大学,2021.
LI D N.Study on co-fermentation of Ginkgo rice wine by non-Saccharomyces cerevisiae and Saccharomyces cerevisiae based on metabonomics[D].Shanghai: Shanghai University of Applied Sciences, 2021.
[22] WEN L F, LEI J P, YANG L X, et al. Metagenomics and untargeted metabolomics analyses to unravel the formation mechanism of characteristic metabolites in Cantonese soy sauce during different fermentation stages[J]. Food Research International, 2024, 181:114116.
[23] 雷宏杰.高浓麦汁氮源组成对酵母氨基酸同化及发酵调控影响的研究[D].广州:华南理工大学, 2014.
LEI H J. Effect of nitrogen source composition of high consistency wort on amino acid assimilation and fermentation regulation of yeast[D].Guangzhou : South China University of Technology, 2014.
[24] 聂元皓, 徐岩, 吴群, 等. 芳香族化合物前体物质酪氨酸和苯丙氨酸在白酒中的来源解析[J]. 食品与发酵工业, 2018, 44(10):1-6.
NIE Y H, XU Y, WU Q, et al. Analysis on source of tyrosine and phenylalanine as precursors of aromatic compounds in Baijiu(Chinese liquor)[J]. Food and Fermentation Industries, 2018, 44(10):1-6.
[25] 贾勇磊, 张宿义, 许德富, 等. 泸型酒糟醅中微生物组学和挥发性代谢物关联性分析[J]. 食品与发酵工业, 2024, 50(13):72-81.
JIA Y L, ZHANG S Y, XU D F, et al. Correlation analysis of microbiomics and volatile metabolites in fermented grains from Luzhou-flavor liquor[J]. Food and Fermentation Industries, 2024, 50(13):72-81.
[26] 张飞, 李钰景, 彭春秀, 等. 玫瑰花红茶发酵工艺以及水提物的非靶向代谢组学分析及体外抗氧化活性评价[J]. 食品与发酵工业, 2024, 50(20):216-225.
ZHANG F, LI Y J, PENG C X, et al. Fermentation process of rose black tea and non-targeted metabolomics analysis of water extract and evaluation of antioxidant activity in vitro[J]. Food and Fermentation Industries, 2024, 50(20):216-225.
[27] AO X L, LIAO Y M, KANG H Y, et al. Untargeted metabolomics and physicochemical analysis revealed the quality formation mechanism in fermented milk inoculated with Lactobacillus brevis and Kluyveromyces marxianus isolated from traditional fermented milk[J]. Foods, 2023, 12(19):3704.
[28] ZHAO G Z, KUANG G L, LI J J, et al. Characterization of aldehydes and hydroxy acids as the main contribution to the traditional Chinese rose vinegar by flavor and taste analyses[J]. Food Research International, 2020, 129:108879.
[29] WU L H, LU Z M, ZHANG X J, et al. Metagenomics reveals flavour metabolic network of cereal vinegar microbiota[J]. Food Microbiology, 2017, 62:23-31.