食醋是饮食中占据主导地位的调味品,拥有超过两千年的悠久历史。它为食物带来独特的酸味、香味和鲜味。食醋的酿造包括固态、半固态和液态工艺,因微生物在开放环境下通过各种作用机制相互影响而酿制而成[1-2]。早在春秋战国时期,就已经有了食醋的记载,当时,醋还被视为奢侈品,主要用于富贵人家的宴席,直到汉代,醋的规模化生产才正式启动[3]。北魏时期,在《齐民要术》书籍中就提到了食醋的生产方法,等到唐代时,食醋已渐渐走进普通百姓家中,人们也逐渐发现了它的药用价值和保健功能[4]。
小米醋作为食醋种类的一种,主要通过糖化、酒化和醋化等工艺酿制而成。以小米为主原料制作的醋含有多种酸性成分,可刺激胃酸分泌,增强消化功能,减轻积食腹胀,促进肠道通畅。此外,小米醋还具有软化血管、降低血脂和胆固醇的作用,进而降低血压,预防心脏病[5-6]。
国内外有关小米醋的研究还在持续探索中,张宇[7]研究了小米醋在传统发酵工艺中的指标变化及风味生成过程。在传统工艺基础上,采用工艺改良及人工接种的方法,探究工艺改良对小米醋品质变化的影响,并确定了最佳的生产工艺;潘洁琼[8]通过不同固态发酵方法生产小米醋,并对整个发酵过程进行理化指标以及风味的测定,确定最优的发酵方法以及最佳的生产工艺;于迪等[9]借鉴山西老陈醋酿造工艺,并将其应用于小米醋生产中。在发酵过程中,对各项理化指标进行检测,同时对小米醋风味物质进行了深入剖析和研究;徐清萍等[10]研究了小米醋酒精发酵阶段α-淀粉酶和糖化酶对小米醋发酵的影响。
在食醋生产过程中,醋酸菌发挥着关键作用。其产酸能力高低对食醋企业生产有着重要影响[11],因此,具备高产酸、耐受性强的醋酸菌一直是食醋行业的研究重点。杨杰等[12]从广西民间醋醅中分离出一株高效产酸且耐高温、乙醇的醋酸杆菌。王超敏等[13]则在山西老陈醋醋醅中筛选出18株巴氏醋杆菌(Acetobacter pasteurians)和2株醋化醋杆菌,其中巴氏醋杆菌SAV-CP1884发酵性能最佳。
目前,在食醋研究领域,针对菌种筛选、发酵性能研究内容主要体现在四大名醋,但在小米醋中涉及较少。因此本实验以小米醋为研究重点,对小米醋酿造过程中的醋液及醋醅进行醋酸菌的分离筛选,并对其进行产酸及耐受性能力分析,为提高小米醋出醋率及醋体品质提供理论基础,同时为调制直投式发酵剂研究奠定理论及实际指导。
1 材料与方法
1.1 材料与试剂
醋液、醋醅,内蒙古自治区和山西省境内小米醋酿造主产区;对照菌:醋酸菌AS1.41;葡萄糖、碳酸钙、无水乙醇、磷酸二氢钾、七水硫酸镁、三氯化铁,天津市鑫铂特化工有限公司;酵母膏、酵母浸粉,北京奥博星生物技物技术有限责任公司。
分离培养基(g/100 mL):酵母浸粉1.0,葡萄糖1.0,碳酸钙2.0,琼脂2.0,121 ℃灭菌20 min,待温度降约70 ℃时每100 mL培养基加入3 mL无水乙醇。
液体培养基(g/100 mL):葡萄糖1.0,酵母浸粉1.0,七水硫酸镁0.5,pH 4.5,121 ℃灭菌20 min,待温度降约70 ℃时每100 mL培养基加入3 mL无水乙醇。
发酵培养基(g/100 mL):葡萄糖1.0,酵母膏1.0,磷酸二氢钾1.0,七水硫酸镁1.0,pH 5.5,121 ℃灭菌20 min,待温度降约70 ℃时每100 mL培养基加入6 mL无水乙醇。
1.2 仪器与设备
DL-CJ-2 ND1超净工作台,北京东联哈尔仪器制造有限公司;KG-SX-700立式压力蒸汽灭菌锅,上海莱睿科学仪器有限公司;CX23光学显微镜,奥林巴斯(中国)有限公司;HWS-250B电热恒温培养箱,天津市泰斯特仪器有限公司;XJ220A-SCS电子分析天平,上海天美天平仪器有限公司;LPH-A pH计,北京兰杰柯科技有限公司;TU1901双光束紫外可见分光光度计,北京普析仪器厂。
1.3 实验方法
1.3.1 分离筛选
称取10 g醋醅或10 mL醋样,置于含有90 mL无菌生理盐水的三角瓶中,于30 ℃、150 r/min充分振荡30 min。取1 mL菌悬液装入含有9 mL无菌生理盐水的试管中进行梯度稀释。将各梯度(10-3、10-4、10-5、10-6、10-7)溶液吸取0.2 mL涂布于分离培养基平板中,于30 ℃恒温培养箱中倒置培养2~3 d。培养结束后,挑选出变色圈清晰且生长良好的单菌落进行2~3次分离纯化。对符合条件的单菌落进行编号,挑选菌落形态一致的单菌落转移到斜面培养基上,于4 ℃冰箱中保存备用。同时将纯化后的醋酸菌与30%甘油1∶1(体积比)混合,存放在2 mL 的EP管中,保存于-80 ℃冰箱。
1.3.2 形态特征
1.3.2.1 菌落形态
将筛选菌株划线于分离培养基平板,30 ℃培养48 h后,观察并记录单菌落特征,包括透明度、颜色、表面情况、边缘状态以及外观形状。
1.3.2.2 细胞形态
在分离纯化后,将待观察的菌株进行革兰氏染色,放置在显微镜下,观察菌体细胞形态和大小[14]。
1.3.3 生理生化实验
生理生化实验参照冯荆舒[15]的方法。
1.3.4 醋酸菌特性研究
1.3.4.1 定性实验
该方法参照石叠庆等[16]、何星[17]的方法。将斜面保存的菌种进行2次活化后,接种到装有100 mL发酵培养基的三角瓶中,于30 ℃、150 r/min的振荡培养箱中振荡培养72 h后吸取10 mL发酵培养液至离心管中,于5 000 r/min的转速离心10 min后取出5 mL培养液置于小烧杯中。用0.1 mol/L NaOH溶液中和至pH 7.0,然后滴加4~5滴50 g/L的FeCl3溶液。若水浴加热5 min后出现红褐色沉淀,则为醋酸菌。
1.3.4.2 定量实验
将斜面保藏菌株接种于50 mL液体培养基中,30 ℃,150 r/min振荡培养36 h后取菌液5 mL接种于50 mL发酵培养基中,30 ℃,150 r/min振荡培养5 d,产酸量测定参照GB 12456—2021《食品安全国家标准 食品中总酸的测定》方法。
1.3.5 醋酸菌耐受性研究
将3%、5%、7%、9%、11%(体积分数)的无水乙醇;2、4、6、8、10 g/L的氯化钠;1.0%、2.0%、3.0%、4.0%、5.0%(体积分数)的乙酸接入到100 mL发酵培养基中,按10%(体积分数)的接种量接入菌悬液,于30 ℃、150 r/min摇床培养,每隔12 h测定OD600值和产酸量,直至稳定,每个菌种3次重复。
1.3.6 生长曲线测定
将前期筛选出来的优良菌株活化接种于液体培养基中,于30 ℃、150 r/min振荡培养箱中培养。每隔12 h取一次样,利用分光光度计测定其OD600值,同时将10-4、10-5、10-6、10-7的活化菌液吸取0.5 mL均匀涂布至醋酸菌分离培养基平板,于28 ℃恒温培养箱培养,测定其活菌数,每个菌种3次重复。
1.3.7 分子生物学鉴定
将筛选出来的优良菌株进行测序,测序引物选用细菌16S rDNA的通用引物27F和1492R。测序结果在NCBI数据库中检索与目标菌株具有较大同源性的菌种做分析比较,采用MEGA11.0软件进行多序列比对,并采用邻位相连法构建系统发育树。
1.4 数据分析
本实验采集3个平行样,利用Excel、Orgrain软件进行数据处理和作图,数据表示为“平均值±标准差”。
2 结果与分析
2.1 菌落及细胞形态
从小米醋醋液、醋醅中分离得到24株具有典型醋酸菌特征的菌株。分别命名为SY01、SY02、SY03、RH04、RH05、SH06、YH07、YH08、GL09、GL10、GL11、XM12、XM13、GL14、SY15、GL16、GL17、GL18、GL19、XM20、SZ21、RH22、XM23、XM24。细胞形态主要为椭圆状、短杆状。典型醋酸菌落及细胞形态见图1。
2.2 生理生化实验结果
将前期分离筛选出的24株菌根据实验方法1.3.3节进行生理生化实验,结果如表1所示。24株菌在接触酶、甘油生酮、乙醇氧化、发酵葡萄糖及产葡萄糖实验中为阳性反应,在氧化酶、产水溶性色素中为阴性反应;在运动性实验中,除菌株SY01、SY02、SY03、SH06、GL14、GL19为阴性反应外,其余菌株均为阳性反应;乳酸氧化实验中,除菌株GL09、GL17、GL18、SZ21、RH22、XM23、XM24菌为阴性反应外,其余菌株为阳性;在乙酸氧化实验中,除菌株RH05、SH06、GL09、GL11、SY15、GL16、SZ21、RH22外,其余菌株呈现阳性反应。
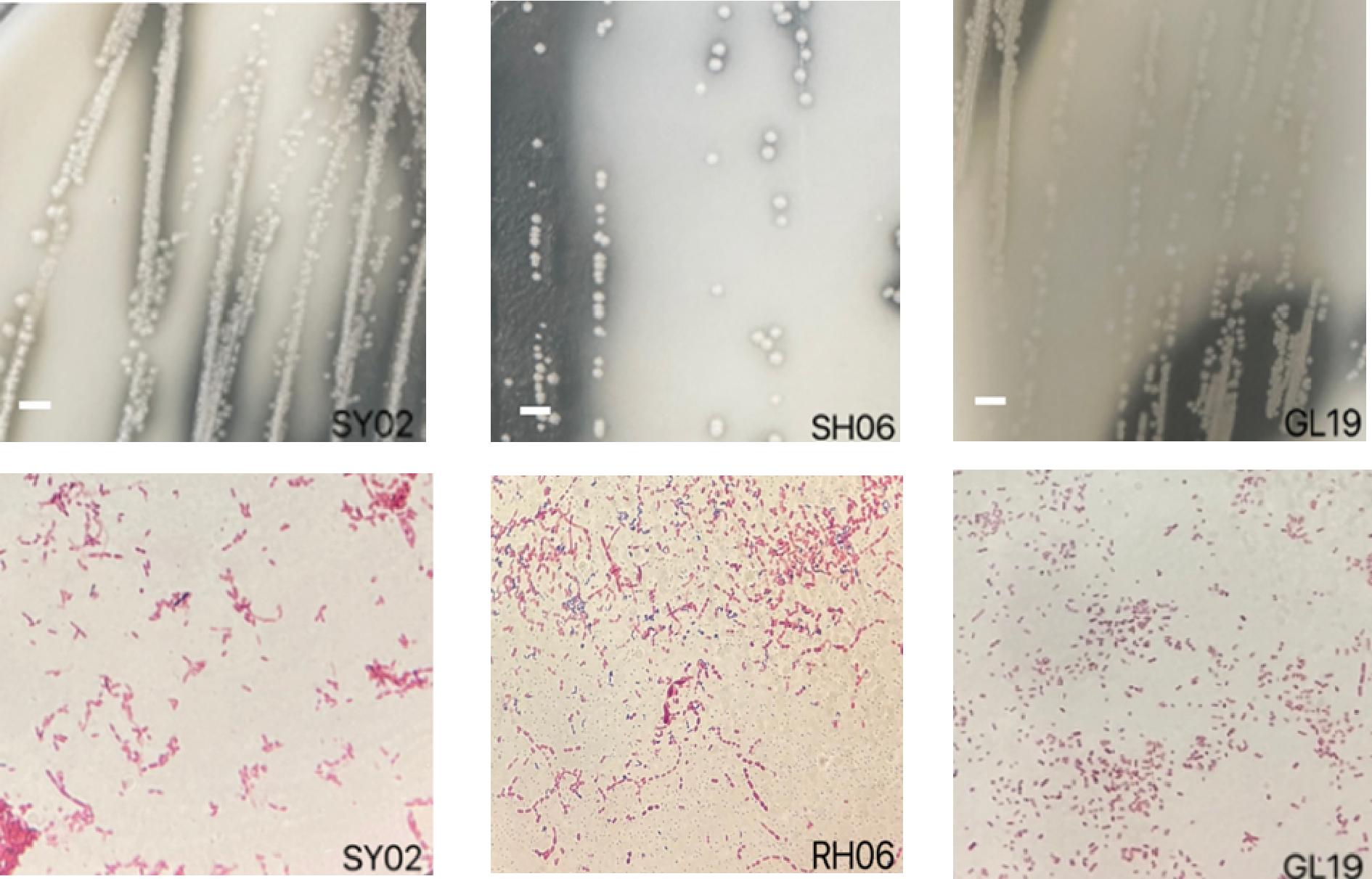
图1 醋酸菌菌落及细胞形态
Fig.1 Colony and cell morphology of acetic acid bacteria
注:标尺为3 mm;放大倍数100×。
表1 生理生化实验
Table 1 Physiological and biochemical test
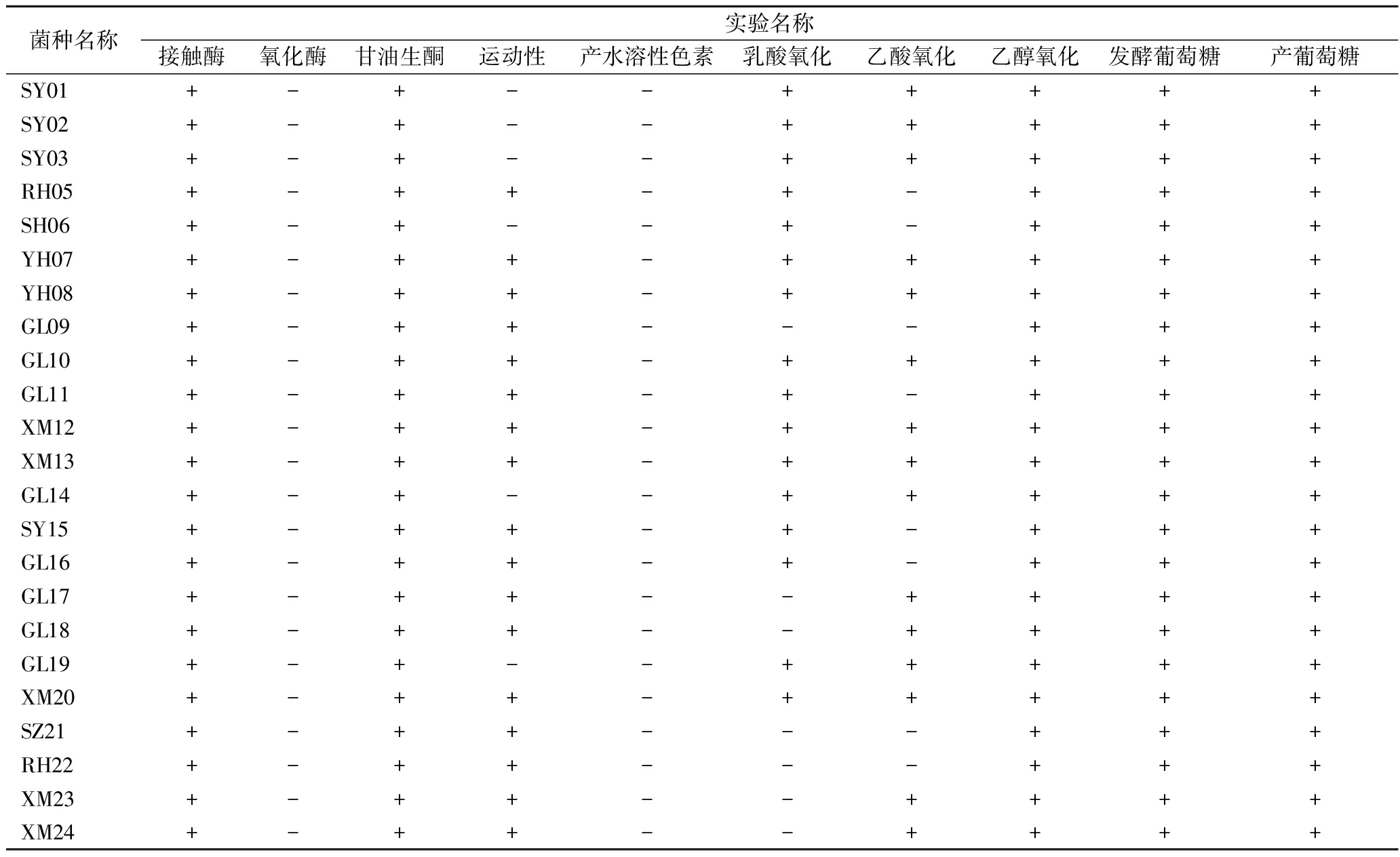
菌种名称实验名称接触酶氧化酶甘油生酮运动性产水溶性色素乳酸氧化乙酸氧化乙醇氧化发酵葡萄糖产葡萄糖SY01+-+--+++++SY02+-+--+++++SY03+-+--+++++RH05+-++-+-+++SH06+-+--+-+++YH07+-++-+++++YH08+-++-+++++GL09+-++---+++GL10+-++-+++++GL11+-++-+-+++XM12+-++-+++++XM13+-++-+++++GL14+-+--+++++SY15+-++-+-+++GL16+-++-+-+++GL17+-++--++++GL18+-++--++++GL19+-+--+++++XM20+-++-+++++SZ21+-++---+++RH22+-++---+++XM23+-++--++++XM24+-++--++++
注:阴性:“-”、阳性:“+”。
综合以上生理生化实验结果,对照《伯杰细菌鉴定手册》[18]和《常见细菌系统鉴定手册》[19],初步确定24株菌为醋酸杆菌属(Acetobacter)。
2.3 定性实验结果
将前期分离筛选出的24株菌根据实验方法1.3.4.1节进行产酸定性实验,结果如表2所示,除菌株GL09外,其他菌株均能产生明显的红褐色沉淀,说明菌株GL19不具备产醋酸能力,因此鉴定该菌株不属于醋酸杆菌属。
表2 定性实验
Table 2 Qualitative tests
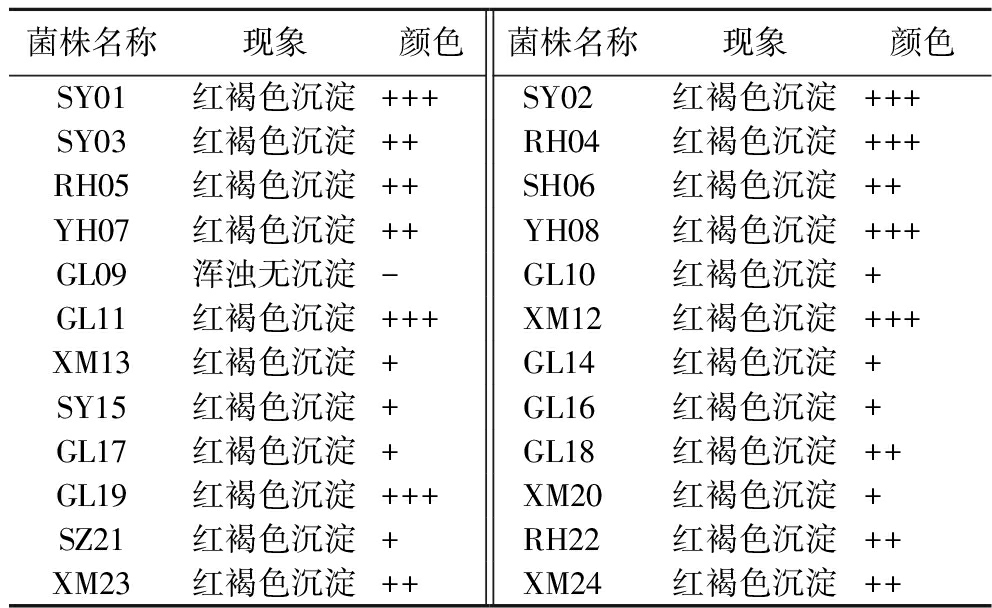
菌株名称现象颜色菌株名称现象颜色SY01红褐色沉淀+++SY02红褐色沉淀+++SY03红褐色沉淀++RH04红褐色沉淀+++RH05红褐色沉淀++SH06红褐色沉淀++YH07红褐色沉淀++YH08红褐色沉淀+++GL09浑浊无沉淀-GL10红褐色沉淀+GL11红褐色沉淀+++XM12红褐色沉淀+++XM13红褐色沉淀+GL14红褐色沉淀+SY15红褐色沉淀+GL16红褐色沉淀+GL17红褐色沉淀+GL18红褐色沉淀++GL19红褐色沉淀+++XM20红褐色沉淀+SZ21红褐色沉淀+RH22红褐色沉淀++XM23红褐色沉淀++XM24红褐色沉淀++
注:“-”表示无红褐色,“+”表示红褐色不明显,“++”表示红褐色较明显,“+++”表示红褐色明显。
2.4 醋酸菌定量实验结果
产酸量是反映醋酸菌的重要指标,筛选产酸能力较强的醋酸菌对提高醋醅酸度,改善传统食醋工艺具有重要作用。
本研究对比24株菌的产酸量,以AS1.41为对照菌。由图2可知,从小米醋发酵过程醋液、醋醅样品中共筛选出24株菌,菌株SY01、SY02、SH06、YH07、GL11以及GL19产酸能力强,其产酸量分别为43.05、45.30、43.35、49.50、45.45、49.95 g/L;菌株SY03、RH04、RH05、YH08、GL10、XM12、SY15、GL16、GL17、GL18产酸能力适中,产酸量分别为38.10、38.05、31.80、35.70、38.65、32.25、38.20、38.25、39.15、38.45 g/L;菌株XM13、GL14、SZ21与对照菌株AS1.41(27 g/L)相差不大,产酸量分别为27.50、29.85、27.60 g/L;菌株XM20、RH22、XM23、XM24产酸量低于对照菌株AS1.41(27 g/L),产酸量分别为19.2、19.05、18.9、19.5 g/L。谢锦明[20]在陕西民间醋醅中成功筛选出一株热带醋酸菌(Acetobacter tropicalis),其产酸量高达42 g/L。本实验结果共有6菌株产酸达到42 g/L以上,与谢锦明研究结果相比,菌株产酸能力较强。
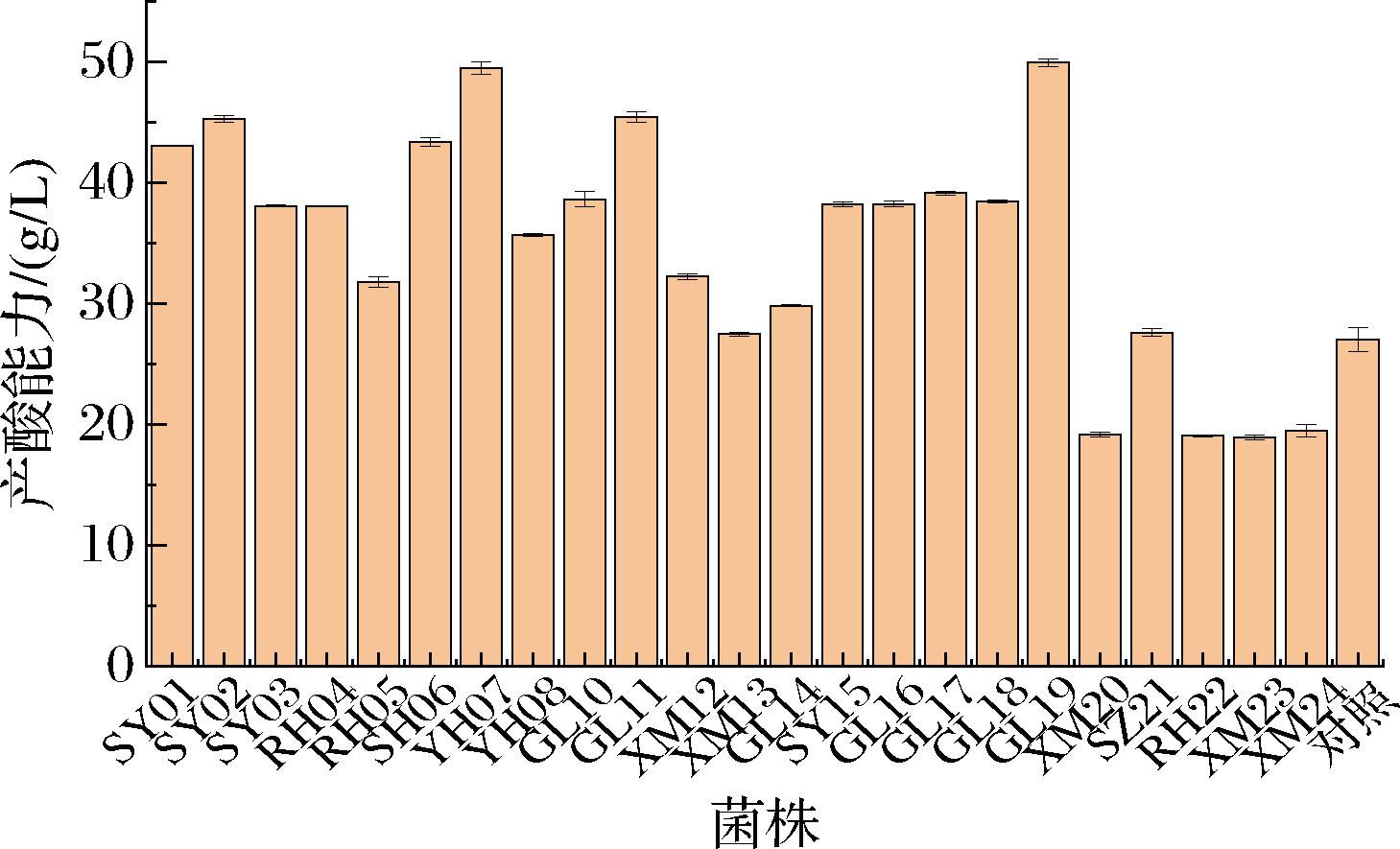
图2 菌株产酸能力
Fig.2 Acid production capabilities of the strains
2.5 醋酸菌耐受性实验结果
2.5.1 耐乙醇能力分析
通过前期产酸定量实验,共筛选出6株优良菌株,分析其乙醇耐受性。结果如图3所示,乙醇从3%增加至11.0%过程中,各菌株生长量呈现下降趋势,而产酸量呈现先增加后降低的趋势。菌株AS1.41、SY01、YH07、GL19在3%乙醇时测得最大产酸量,其中AS1.41产酸为23.9 g/L;菌株SY02、SH06、GL19在5%乙醇时生长量及产酸量较好,其中SY02产酸量最高,可达38 g/L。当乙醇增至7%时,菌株SY01、SY02、SH06、YH07、GL11、GL19及对照菌生长量及产酸量呈下降趋势,此时SY02产酸量最高为18.3 g/L,而AS1.41产酸为9.6 g/L。当乙醇增至7%~9%时,菌株SY02、SH06、GL19生长量仍分别为0.690、0.485、0.689,而其余4株菌生长量和产酸量均受到明显影响,对照菌AS1.41停止产酸。因为乙醇有抑制细菌生长的作用[21],所以当初始乙醇添加量达到醋酸菌耐受临界点时,菌种的生长变化慢,导致其产酸下降甚至停止。通过对比可知,菌株SY01、SY02、SH06在高浓度乙醇下生长量及产酸量优于其他4菌株,拥有较好的乙醇耐受性。
2.5.2 耐氯化钠能力分析
通过前期产酸定量实验,共筛选出6株优良菌株,分析其氯化钠耐受性。结果如图4所示,氯化钠质量浓度从2 g/L增至6g/L时,菌株生长及产酸量基本不受影响;从4 g/L增至8 g/L时,对照菌生长量及产酸量呈现明显下降趋势;在质量浓度为10 g/L时几乎停止产酸;从2 g/L增至6 g/L时,菌株SY01、SY02、SH06、YH07、GL11及GL19生长量及产酸量受到较小影响;从6 g/L增至10 g/L时,菌株SY02、SH06、GL19生长量仍分别0.571、0.724、0.706,产酸量分别为12.60、13.80、17.84 g/L,而菌株SY01、YH07、GL11生长量和产酸量呈现明显下降趋势,谢锦明等[22]研究发现,醋酸菌在氯化钠浓度较低时仍可以生长,但随着浓度增加生长会受到严重抑制,影响其产酸能力。总的来看,氯化钠对菌株SY01、YH07、GL11生长影响较大,因此在培养时,氯化钠尽量控制在6 g/L以内,保证菌株能较好产酸及生长。通过比较可知,在一系列氯化钠浓度下,菌株SY02、SH06、GL19生长量和产酸量能力优于其他菌,拥有较好的氯化钠耐受性。
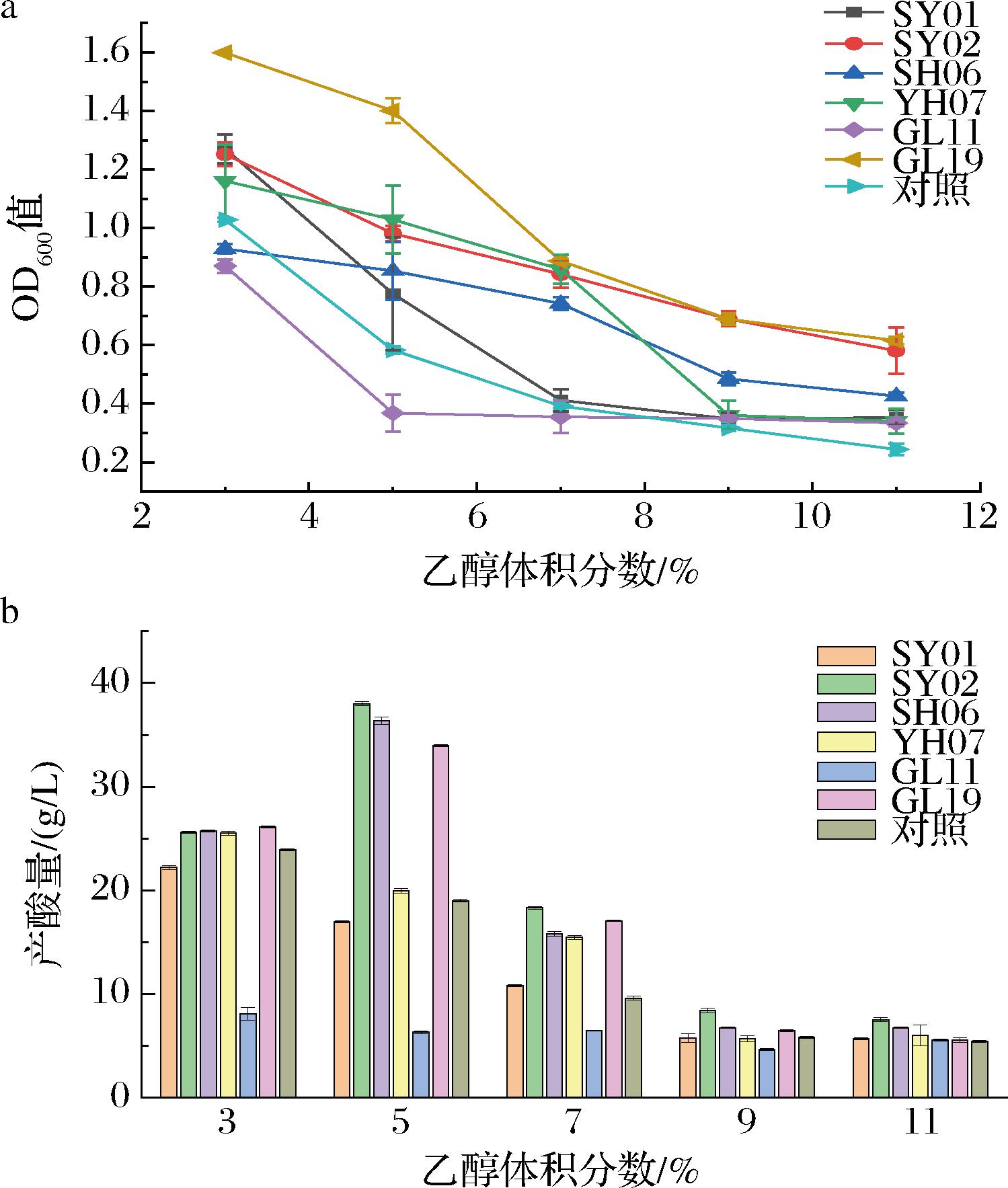
a-生长量;b-产酸量
图3 不同乙醇浓度对菌株生长及产酸量影响
Fig.3 Effects of different ethanol concentrations on strain growth and acid production
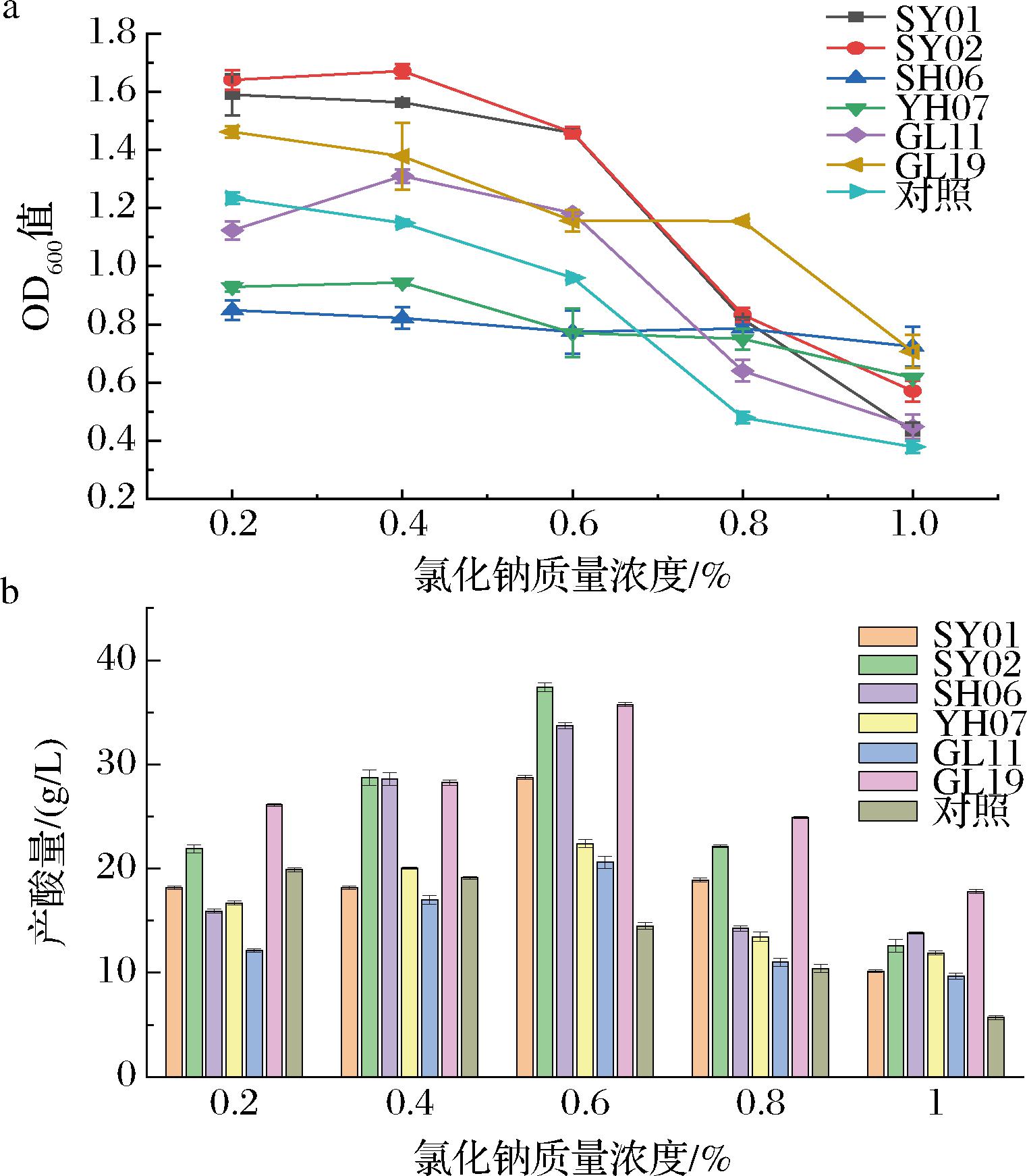
a-生长量;b-产酸量
图4 不同氯化钠浓度对菌株生长及产酸量影响
Fig.4 Effects of different sodium chloride concentrations on strain growth and acid production
2.5.3 耐乙酸能力分析
通过前期产酸定量实验,共筛选出6株优良菌株,分析其乙酸耐受性。结果如图5所示,随着乙酸浓度不断增加,7株菌产酸量均呈现先上升后下降的趋势。当乙酸为2.0%时,GL11、GL19及对照菌产酸量达到最大,其中GL19及对照菌产酸量分别为42.90、28.95 g/L;当乙酸为3.0%时,菌株SY01、SY02、SH06、YH07产酸量达到最大,其中SY02产酸量最高为40.80 g/L,而对照菌产酸量为24.60 g/L;当乙酸从2.0%增至3.0%时,所有菌生长量及产酸量受到较小影响,当乙酸为4.0%时,菌株YH07、GL11及对照菌生长量受到明显抑制,而SY01、SY02、SH06、GL19生长量分别为0.531、0.471、0.435、0.450,产酸量仍达到23 g/L以上,当乙酸为5.0%时,菌株SY01、SY02、SH06、YH07、GL19产酸量低于13 g/L。因为过酸环境会影响醋酸菌生长,而醋酸菌产酸能力也与其机体内的酶有关,过酸和碱性的环境都会导致相关酶活力降低,从而影响醋酸菌产酸能力[23]。通过对比可知,菌种SY01、SY02、SH06、GL19在乙酸存在下生长量及产酸量优于其他菌株,拥有较好的耐乙酸能力。
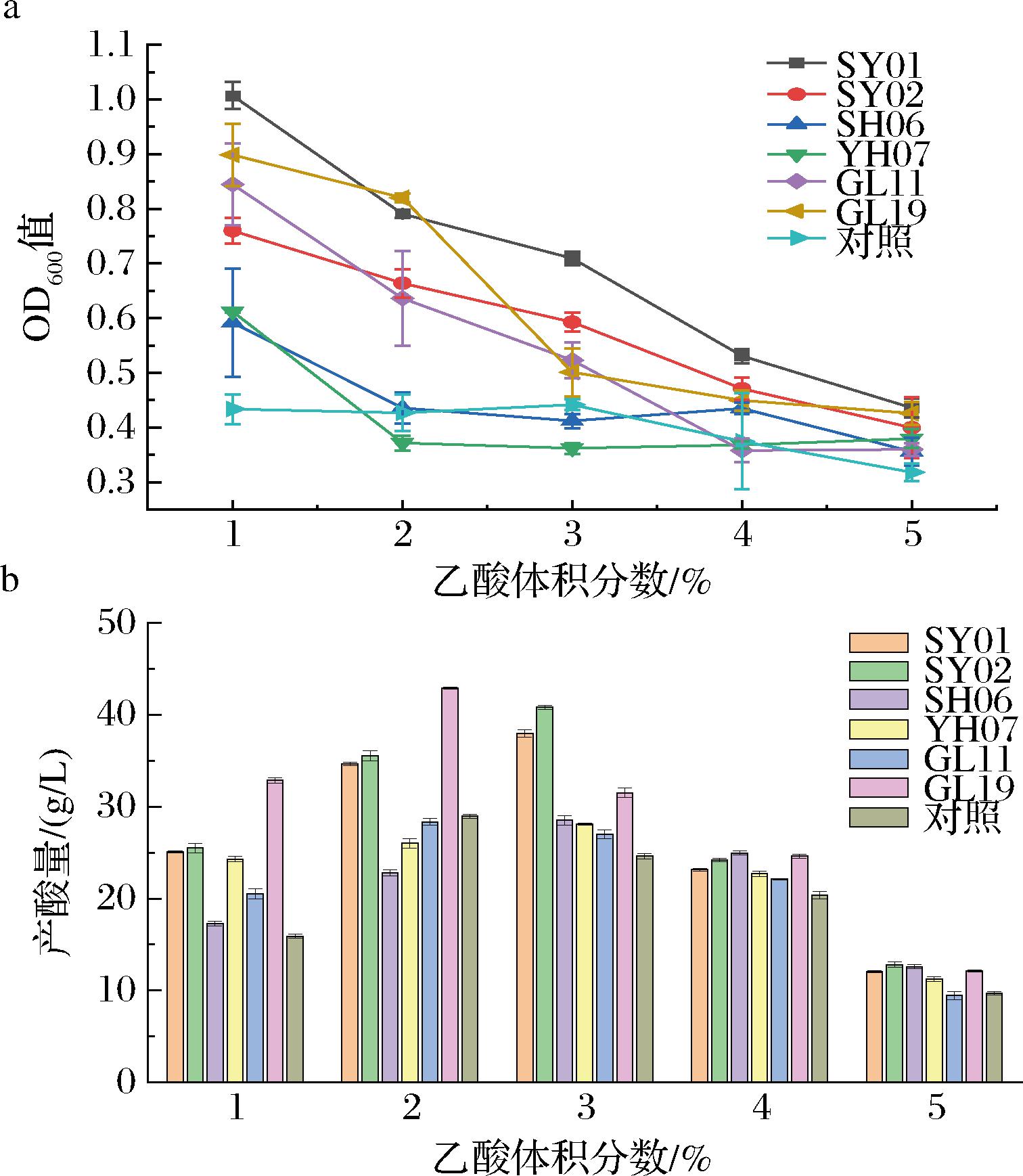
a-生长量;b-产酸量
图5 不同乙酸浓度对菌株生长及产酸量影响
Fig.5 Effects of different acetic acid concentrations on strain growth and acid production
综合以上耐受性结果发现,菌株SY02、SH06、GL19的耐醇、耐氯化钠、耐酸能力较强,具体表现为:乙醇耐受可达9.0%,氯化钠耐受可达10 g/L,乙酸耐受可达4.0%。因此确定菌株SY02、SH06、GL19 为目标菌株,用于后续研究。
2.6 生长曲线测定结果
实验筛选3株耐受性较强的菌株SY02、SH06和GL19,测定其生物量和生长曲线,结果如图6所示,菌株SY02和SH06的活菌数及OD600值均在12~36 h生长繁殖速度快,处于对数期,菌体生物量最大浓度分别为7.56 lg CFU/mL和7.52 lg CFU/mL,OD600值最大分别为1.755、0.967,36~48 h处于稳定期,48 h后活菌数开始呈现下降趋势,逐渐进入衰亡期。菌株GL19的活菌数和OD600值均在24~48 h生长繁殖速度快,处于对数期,菌体最大浓度分别为6.87 lg CFU/mL,48~60 h处于稳定期,60 h后活菌数逐渐进入衰亡期。醋酸菌SY02、SH06、GL19都能在较短时间内进入对数期,在这个阶段,菌体以几何级数增长,对外界环境具有强大的抵抗力。

a-OD600值;b-活菌数
图6 菌株SY02、SH06、GL19生长曲线OD值及活菌数
Fig.6 OD values and viable cell counts of strains SY02, SH06, and GL19
2.7 分子生物学鉴定结果
2.7.1 核苷酸序列分析
将菌株SY02、SH06及GL19的16 rDNA序列上传到NCBI数据库进行对比,结果见表3,对比发现3株菌株与序列号为NR_178820.1的A.pasteurianus同源性最高,相似度分别为99.50%、99.8%及99.78%。因而可确定筛选出来的3株菌均属于巴氏醋杆菌(Acetobacter pasteurianus)。
表3 菌株序列对比结果
Table 3 Comparison results of strain sequences
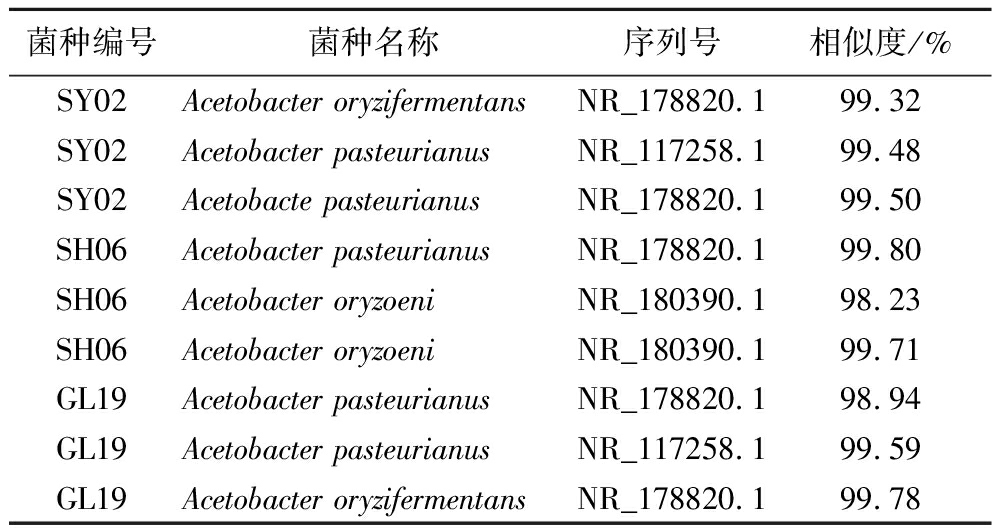
菌种编号菌种名称序列号相似度/%SY02Acetobacter oryzifermentansNR_178820.199.32SY02Acetobacter pasteurianus NR_117258.199.48SY02Acetobacte pasteurianusNR_178820.199.50SH06Acetobacter pasteurianus NR_178820.199.80SH06Acetobacter oryzoeniNR_180390.198.23SH06Acetobacter oryzoeniNR_180390.199.71GL19Acetobacter pasteurianusNR_178820.198.94GL19Acetobacter pasteurianusNR_117258.199.59GL19Acetobacter oryzifermentansNR_178820.199.78
3 结论
本实验从传统固态小米醋的醋液及醋醅中筛选得到24株菌,经定性实验、耐受性实验等筛选出3株产酸能力达到43 g/L以上,能耐受9%乙醇、1.0%氯化钠和4.0%乙酸的优良醋酸菌;经分子生物学鉴定这3株菌均为巴氏醋杆菌(Acetobacter pasteurians)。
由于实验采用的是固态发酵过程中的醋醅及醋液,筛选出来的菌种在原醋醅中占比不高,未开展接种强化发酵应用,后期可将筛选出来的优良醋酸菌强化应用到实际生产中,研究醋酸菌在醋酸发酵阶段的微生物群落变化以及对风味形成机制的影响。
[1] JIANG Y J, LV X C, ZHANG C, et al. Microbial dynamics and flavor formation during the traditional brewing of Monascus vinegar[J]. Food Research International, 2019, 125:108531.
[2] FAN S W, PAN T H, LI G Q. Evaluation of the physicochemical content and solid-state fermentation stage of Zhenjiang aromatic vinegar using near-infrared spectroscopy[J]. International Journal of Food Engineering, 2020, 16(12):20200127.
[3] 夏维华. 特色调味品山西陈醋对区域经济的影响及其加工工艺研究现状[J]. 中国调味品, 2021, 46(11): 191-194.
XIA W H. Effect of Shanxi aged vinegar on regional economy and research status of its processing technology[J]. China Condiment, 2021, 46(11): 191-194.
[4] 钱沁. 麦芽醋发酵工艺及其品质的研究[D]. 无锡: 江南大学, 2023.
QIAN Q. Fermentation technology and quality of malt vinegar[D]. Wuxi: Jiangnan University, 2023.
[5] MENG H M, SONG J, FAN B Q, et al. Monascus vinegar alleviates high-fat-diet-induced inflammation in rats by regulating the NF-κB and PI3K/AKT/mTOR pathways[J]. Food Science and Human Wellness, 2022, 11(4):943-953.
[6] ZHANG L X, QIN Z H, ZHANG L, et al. Dynamic changes of quality and flavor characterization of Zhejiang rosy vinegar during fermentation and aging based on untargeted metabolomics[J]. Food Chemistry, 2023, 404:134702.
[7] 张宇. 传统固态发酵小米醋风味物质的变化及工艺改良[D]. 呼和浩特: 内蒙古农业大学, 2021.
ZHANG Y. Changes of flavor substances in traditional solid-state fermentation of millet vinegar and its technological improvement[D]. Hohhot: Inner Mongolia Agricultural University, 2021.
[8] 潘洁琼. 固态法小米醋酿造工艺的研究[D]. 呼和浩特: 内蒙古农业大学, 2020.
PAN J Q. Study on brewing technology of millet vinegar by solid state method[D]. Hohhot: Inner Mongolia Agricultural University, 2020.
[9] 于迪, 乔羽, 李江涌, 等. 小米醋的制作工艺及理化指标分析[J]. 中国调味品, 2018, 43(2):48-51;57.
YU D, QIAO Y, LI J Y, et al. Production process and analysis of physical and chemical indicators of millet vinegar[J]. China Condiment, 2018, 43(2):48-51;57.
[10] 徐清萍, 尧俊英. 液化方式对小米醋酒精发酵阶段的影响[J]. 中国调味品, 2014, 39(2):47-50.
XU Q P, YAO J Y. Effect of liquefaction on alcohol fermentation stage of millet vinegar[J]. China Condiment, 2014, 39(2):47-50.
[11] LYNCH K M, ZANNINI E, WILKINSON S, et al. Physiology of acetic acid bacteria and their role in vinegar and fermented beverages[J]. Comprehensive Reviews in Food Science and Food Safety, 2019, 18(3):587-625.
[12] 杨杰, 黄翠姬, 林培娇, 等. 广西醋醅中醋酸菌的分离鉴定及发酵特性[J]. 中国调味品, 2021, 46(9):1-7.
YANG J, HUANG C J, LIN P J, et al. Separation, identification and fermentation characteristics of acetic acid bacteria from vinegar fermented grains in Guangxi[J]. China Condiment, 2021, 46(9):1-7.
[13] 王超敏, 李雅茹, 魏莎莎, 等. 山西老陈醋醋醅中醋酸菌的分离、ERIC分型及发酵特性研究[J]. 中国酿造, 2021, 40(11):37-42.
WANG C M, LI Y R, WEI S S, et al. Isolation, ERIC genotyping and fermentation characteristic of acetic acid bacteria from Cupei of Shanxi aged vinegar[J]. China Brewing, 2021, 40(11):37-42.
[14] 冯荆舒, 张荣, 高献礼, 等. 醋醅中优良醋酸菌的分离筛选及性能研究[J]. 食品与发酵工业, 2023, 49(1):95-100.
FENG J S, ZHANG R, GAO X L, et al. Screening, identification and characteristic of excellent acetic acid bacteria from vinegar fermented grains[J]. Food and Fermentation Industries, 2023, 49(1):95-100.
[15] 冯荆舒. He-Ne激光和脉冲强光诱变选育高产酸醋酸菌及其机制研究[D]. 镇江: 江苏大学, 2023.
FENG J S. Breeding of high acid-producing acetic acid bacteria by He-Ne laser and pulsed light and its mechanism[D]. Zhenjiang: Jiangsu University, 2023.
[16] 石庆叠, 何星, 卢红梅, 等. 赤水晒醋醋醅中醋酸菌的筛选和发酵特性研究[J]. 食品与发酵工业, 2021, 47(14):223-228.
SHI Q D, HE X, LU H M, et al. Screening of acetic acid bacteria in Chishui Sun-dried vinegar Pei and its fermentation characteristics[J]. Food and Fermentation Industries, 2021, 47(14):223-228.
[17] 何星. 赤水晒醋发酵工艺优化的研究[D]. 贵阳: 贵州大学, 2020.
HE X. Study on optimization of fermentation process of Sun-dried vinegar in Chishui[D]. Guiyang: Guizhou University, 2020.
[18] BUCHANA R E, GIBBONS N E. Bergeys Manual of Determinative Bacteriology[M]. Beijing: Science Press, 1984: 382-533.
[19] DONG X Z, CAI M Y. Common Bacteria Manual System Identification[M]. Beijing: Science Press, 2001: 349-370.
[20] 谢锦明. 苦荞醋醋酸发酵工艺及生物活性初探[D]. 武汉: 湖北工业大学, 2020.
XIE J M. Preliminary study on fermentation technology and biological activity of Tartary buckwheat vinegar and acetic acid[D]. Wuhan: Hubei University of Technology, 2020.
[21] PITIWITTAYAKUL N, YUKPHAN P, SINTUPRAPA W, et al. Identification of acetic acid bacteria isolated in Thailand and assigned to the genus Acetobacter by groEL gene sequence analysis[J]. Annals of Microbiology, 2015, 65(3):1557-1564.
[22] 谢锦明, 赵秀芳, 袁江兰, 等. 陕西民间醋醅中高产酸醋酸菌的筛选和发酵特性[J]. 食品与发酵工业, 2020, 46(10):173-178.
XIE J M, ZHAO X F, YUAN J L, et al. Screening of high yield acetic acid bacteria in Shaanxi Folk Vinegar Pei and its fermentation characteristics[J]. Food and Fermentation Industries, 2020, 46(10):173-178.
[23] 赵馨仪, 范冰倩, 郑宇, 等. 山西老陈醋醋醅中产酸菌的分离、鉴定及醇酸耐受分析[J]. 中国酿造, 2021, 40(1):128-132.
ZHAO X Y, FAN B Q, ZHENG Y, et al. Isolation, identification of acid-producing bacteria from Shanxi aged vinegar cupei and their alcohol and acid tolerance ability analysis[J]. China Brewing, 2021, 40(1):128-132.