贮存老熟是蒸馏酒生产过程中必不可少的步骤,几乎所有类型的蒸馏酒在蒸馏后都会经过数月至数年,甚至数十年的贮存老熟过程[1]。许多重要的风味化合物是在老熟过程中通过缓慢的化学反应形成[2],或者从橡木中通过缓慢萃取进入酒体[3]。贮存老熟过程不仅可以改善蒸馏酒的风味,还能提升蒸馏酒的口感[4]。此外,越来越多的证据显示,老熟还可以提升蒸馏酒的体外抗氧化能力[5-6]。
白酒是我国的优势传统酒精饮料,与威士忌、白兰地、伏特加、朗姆酒、金酒并称为世界六大蒸馏酒[7]。老熟对白酒的生产至关重要,与西方蒸馏酒类似,未经贮存老熟的白酒通常辛辣刺鼻。因此,新蒸馏的白酒在装瓶销售之前通常会经过数月至数年的老熟过程,一些高端白酒甚至可能贮存超过20年[8]。在前期的研究中,本课题组通过系统比较新酒与老酒之间的差异发现,新酒和老酒在化学物质的种类[9]、风味物质的强度[10]以及口味刺激感强度[11]等方面均存在明显差异。然而,这些成分与感官方面的差异能否体现在生理层面并不清楚。
本论文建立了不同贮存时间白酒干预的小鼠模型,通过表型、生化、病理以及行为学分析系统评价了不同贮存时间白酒的生物学功能,同时通过检测海马组织炎症因子的表达水平,探究了不同贮存时间白酒对神经系统的免疫激活情况。本论文不仅为白酒活性成分的挖掘提供了理论基础,也为传统发酵食品健康价值研究提供了技术平台。
1 材料与方法
1.1 实验动物、材料与试剂
1.1.1 实验动物
40只SPF级雄性C57BL/6 J小鼠(8周,20~22 g),购自斯莱克实验动物(上海)有限公司。
1.1.2 材料与试剂
食用级乙醇来自本实验室贮存,不同年份白酒样本由四川舍得酒业股份有限公司提供的浓香型原酒,酒样信息如表1所示。
表1 用于动物造模的酒样信息
Table 1 The main information of Baijiu samples
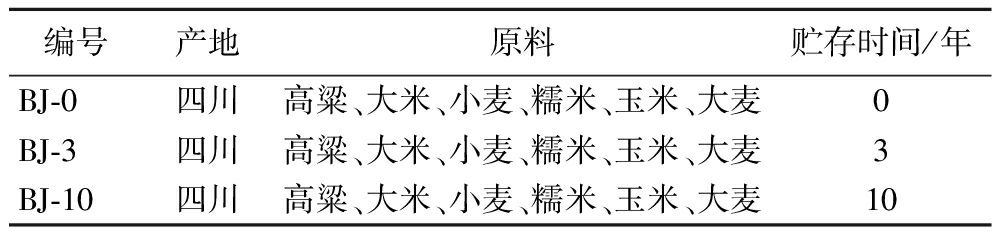
编号产地原料贮存时间/年BJ-0四川高粱、大米、小麦、糯米、玉米、大麦0BJ-3四川高粱、大米、小麦、糯米、玉米、大麦3BJ-10四川高粱、大米、小麦、糯米、玉米、大麦10
多聚甲醛,武汉塞维尔生物科技有限公司;OCT包埋剂,日本樱花;酒精、二甲苯、甲醛、氯化钙、丙二醇、苏木精、碘酸钠、硫酸铝铵、柠檬酸、甘油、明胶、苯酚等用于病理切片染色与制作的化学试剂如无特殊说明,国药集团(上海);ALT检测试剂盒和AST检测试剂盒;美国Thermo Fisher公司;皮质酮ELISA检测试剂盒,美国ENZO公司。
1.2 仪器与设备
-80 ℃超低温冰箱,美国Thermo Fisher公司;Milli-Q超纯水仪器,美国Millipore公司;自动生化分析仪,日本Hitachi公司;便携式酒精计,奥地利Anton Paar公司;激光扫描共聚焦显微镜,日本Nikon公司;Avanti J-E冷冻离心机,德国Beckman Coulter公司;组织研磨机,美国BioSpec Products公司;强迫游泳装置与旷场实验系统,华东师范大学动物实验中心;ASP 200S型组织脱水机、1150H石蜡包埋机、RM2245手动轮转切片机,德国徕卡。
1.3 实验方法
1.3.1 动物模型
小鼠饲养条件以及动物日常护理工作依照《中华人民共和国卫生部实验动物环境及设施标准》实施,环境温度为(22±2) ℃,环境相对湿度为40%~60%,12 h 昼夜更替。水和饲料供应充足,小鼠自由进食。
适应1周后,40只小鼠随机分为5组:空白对照组(Ctrl,8只)、新酒干预组(BJ-0,8只)、3年贮存白酒干预组(BJ-3,8只)、10年贮存白酒干预组(BJ-10,8只)和酒精干预组(EtOH,8只),并记录小鼠体重,作为小鼠的初始体重。为了与实验组保持一致,Ctrl组灌相同体积的无菌水。另外,为保证干预组之间小鼠摄入的酒精剂量一致,利用便携式酒精计将所有白酒样品与EtOH稀释至相同酒精浓度。酒精灌胃剂量参照本课题组前期研究,采用梯度增加的方式进行,初始酒精剂量为3.2 g/kg每天,此后每5 d增加0.6 g/kg,直至第20天达到5.7 g/kg,并保持到造模结束[12]。在正式造模前(第0周)、造模第3周、造模第6周和造模终点(第9周)进行行为学训练与测试。造模终点,小鼠使用异氟烷麻醉后,颈椎脱臼处死,并收集小鼠全血。为避免溶血现象,血浆置于4 ℃冰箱至少0.5 h,再10 000 r/min离心收集上清液,并立即置于-80 ℃冰箱备用;打开小鼠腹腔,取肝脏样本,部分新鲜组织固定于4%多聚甲醛溶液,部分直接包埋于OCT包埋剂中备用;取海马组织,部分新鲜组织固定于4%多聚甲醛溶液,剩余部分立即置于-80 ℃冰箱备用。
1.3.2 翻正实验
将灌胃后小鼠轻轻翻动,使每只小鼠腹部和四肢朝上(仰卧位)。如果30 s内无法翻身,则认为失去正常的翻正反射,定义该时间点为醉酒点。保持小鼠仰卧位,待小鼠能够自发的破坏仰卧位,说明小鼠恢复翻正反射,以每分钟内能否进行3次翻正反射判定为小鼠醒酒。记录小鼠从醉酒点到恢复翻正反射的时间,即为小鼠的醒酒时间[13]。
1.3.3 糖水偏好实验
在正式糖水偏好实验测试前48 h对小鼠进行糖水适应训练:一瓶为1%蔗糖水,一瓶为双蒸水,适应期间每24 h更换两瓶水的位置。适应结束后,小鼠禁食禁饮12 h。所有小鼠完成糖水适应训练后,开始正式测试。为了消除位置偏倚,将一半糖水放置在鼠笼的左边,另一半放右边。24 h后称量水瓶质量,计算糖水和清水的消耗量,计算如公式(1)所示[14]:
糖水偏好![]()
(1)
1.3.4 强迫游泳实验
将小鼠置于恒温游泳仪[高20 cm,直径14 cm,水深15 cm,水温(23±1) ℃]中适应2 min,再用摄像头记录在接下来5 min内小鼠的活动情况。测试完成后取出小鼠,擦干身体。最后,弃去游泳仪中的水并清理粪便,在加入新鲜的水,为下一只小鼠的测试做准备。所有小鼠完成游泳测试后,用SMART v2.5软件分析小鼠的游泳情况,记录小鼠不动时间(停止挣扎或四肢有轻微动作以保持头部处在水面)评估绝望程度[15]。
1.3.5 旷场实验
将小鼠放入旷场箱(45 cm×45 cm×45 cm)正中,适应1 min,自由运动5 min。每只小鼠完成旷场实验后,清理旷场箱中的粪便及尿液,并用75%酒精消毒旷场箱内壁及底面并擦干,以去除前一只小鼠的气味。所有小鼠测试完以后用SMART v2.5软件分析其在旷场箱中的活动情况。将旷场箱底面正中1/4的区域定义为中心区域,小鼠在中心区域的活动距离被定义为中心距离,中心距离与总距离之比用来评估小鼠的焦虑程度。使用摄像头全程记录小鼠行动轨迹,最终评价指标为中心运动时间、中心移动距离及总移动距离等[16]。
1.3.6 生化指标测定
小鼠血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)和皮质酮等生化指标的测定根据相应试剂盒说明书进行,批内变异系数小于10%的样品用于后续数据分析。
1.3.7 病理检测
肝脏组织的包埋、染色与切片以及海马组织免疫荧光分析,具体方法参考题组前期发表论文[17]。
1.3.8 蛋白质印记分析
-80 ℃冰箱中保存的海马组织解冻后,对样本依次进行匀浆、裂解、蛋白提取等操作,测定并调整其浓度后,制备上样。上样制备完成后,进行电泳、转膜、封闭、一抗孵育、Tris缓冲盐溶液-Tween 20(Tris Buffered Saline with Tween 20, TBST)清洗、二抗孵育、TBST清洗、显影、拍照,具体方法参照文献[18]。
1.4 数据分析
采用SPSS 22.0对结果进行One-way ANOVA分析,*表示差异显著(P<0.05),**表示差异极显著(P<0.01),所有实验结果均以“平均值±标准差”表示。图形制作均采用Oringin 2023进行绘制。
2 结果与分析
2.1 不同年份白酒摄入对小鼠表型的影响
通过分析不同干预组小鼠在整个造模期间的体重增加量的变化趋势,结果发现,虽然所有组别小鼠体重均随造模时间稳步增加,但是3组白酒组(BJ-0、BJ-3和BJ-10)和酒精组小鼠的体重增加量均低于对照组,且随干预周期的延长,差异越来越明显(图1-a)。进一步分析造模终点时不同干预组之间体重增加量的差异发现,虽然酒精组和3组白酒组小鼠的体重增加量均显著低于对照组,但是3组白酒组小鼠的体重增加量均高于EtOH组,尤其是BJ-10组(图1-b)。
由于慢性酒精摄入会破坏肝脏脂肪代谢与转运,造成酒精性脂肪肝,导致肝脏质量增加,肝重体重比(肝脏指数)可以初步反应酒精性脂肪肝的程度。因此,对造模动物的肝脏指数进行了分析。结果发现,虽然3组白酒组和EtOH组小鼠的肝脏指数均高于对照组,但是3组白酒组的肝脏指数均低于EtOH组,尤其是BJ-10(图1-c)。该结果说明相同酒精剂量条件下,过量白酒饮用造成的肝损伤程度可能比酒精低,尤其是老酒。
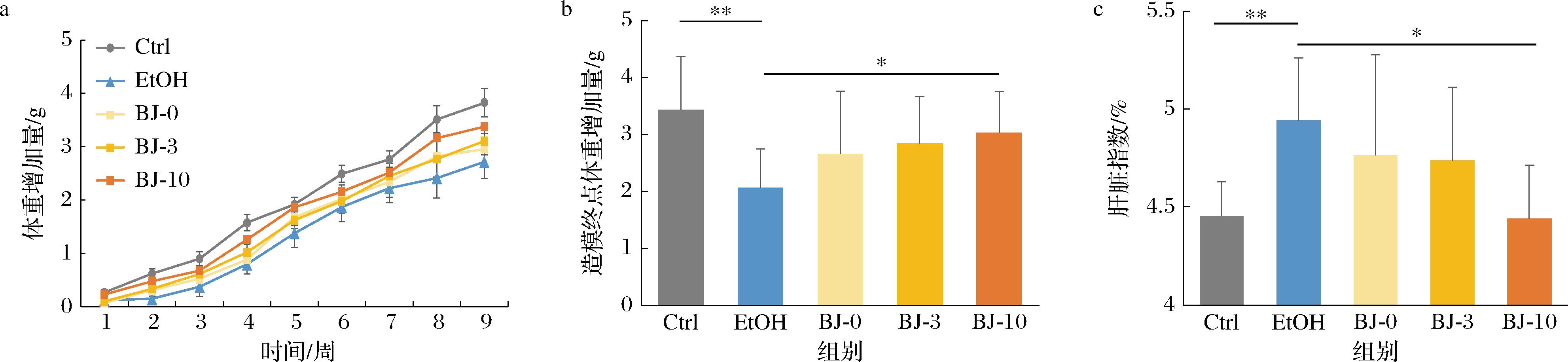
a-小鼠体重随干预时间的变化;b-造模终点小鼠体重增加量;c-肝脏指数
图1 表型分析
Fig.1 Phenotypic analysis
注:*表示P<0.05;**表示P<0.01(下同)。
2.2 不同年份白酒摄入对肝损伤的影响
为了探究不同干预组之间表型的差异是否会导致不同程度的肝损伤,本文又通过生化分析检测了血清ALT和AST的含量。结果发现,酒精和3组不同年份白酒的慢性摄入均导致了小鼠血清ALT和AST显著升高(图2-a、图2-b)。其中,酒精组ALT和AST水平分别约是对照组的2.59、2.45倍。同时还观察到3组白酒组小鼠血清ALT和AST水平显著低于乙醇组,酒精组中ALT含量分别为BJ-0、BJ-3、BJ-10组的1.13、1.16、1.32倍,AST含量分别为BJ-0、BJ-3、BJ-10组的1.07、1.15、1.39倍。
为了确定白酒和酒精干预引起的表型与生化指标的差异是否导致肝脏病理差异,本研究进一步通过油红O和苏木精-伊红(hematoxylin-eosin,H&E)染色切片分别观察了肝脏组织的脂滴累积情况与脂肪变形程度。结果发现,与生化分析结果一致,在造模终点时,酒精组小鼠肝脏组织出现明显脂滴累积(图2-c)和脂肪变性(图2-d)现象。3组不同年份白酒组虽然也观察到一定程度的脂滴累积与脂肪变性,但是均低于酒精组,并且BJ-0组小鼠的肝组织脂滴累积和脂肪变性程度比BJ-10组更为明显。综合以上小鼠表型、血清生化与肝脏病理分析,结果表明慢性酒精摄入导致了小鼠肝损伤,而同等酒精剂量的白酒造成的肝损伤程度比酒精低,并且老酒组小鼠的肝损伤程度最低。
2.3 不同年份白酒干预对小鼠醒酒及压力的影响
通过翻正实验观察不同干预组小鼠的醒酒情况,结果发现,所有白酒干预组小鼠在整个造模期间的醒酒时间均短于酒精干预组,并且在干预9周时,还观察到BJ-10组小鼠的醉酒时间显著低于BJ-3和BJ-0组(图3-a~图3-c),表明老酒中的物质可以改善酒精诱导的小鼠急性醉酒。
通过分析血清皮质酮含量发现,虽然白酒和酒精干预均增加了血清皮质酮含量,但是所有白酒干预组小鼠的血清皮质酮含量均低于酒精干预组,尤其是BJ-10(图3-d),表明老酒可以抑制酒精诱导的血清皮质酮含量升高。综上,老酒干预组小鼠的醉酒时间更短,并且压力水平比新酒和酒精更低。

a-血清ALT含量;b-血清AST含量;c-肝脏组织代表性油红O染色切片;d-肝脏组织代表性H&E染色切片
图2 不同年份白酒对小鼠肝损伤的影响
Fig.2 Effect of different interventions on liver injury
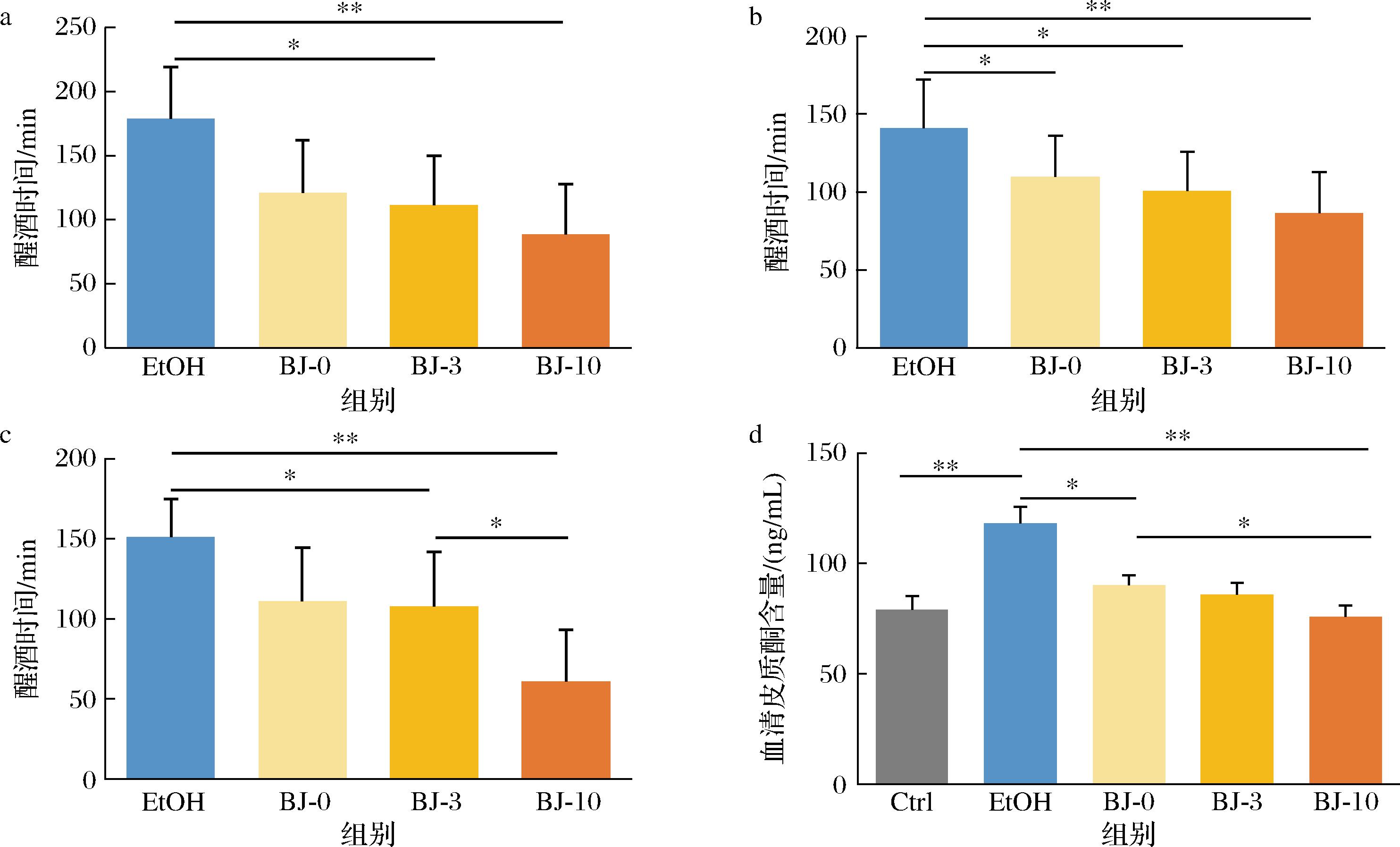
a-干预3周醒酒时间;b-干预6周醒酒时间;c-干预9周醒酒时间;d-血清皮质酮含量
图3 不同年份白酒干预对小鼠醒酒及压力的影响
Fig.3 Effect of different interventions on sober-up time and stress of mice
2.4 不同年份白酒干预对对小鼠行为学的影响
通过记录分析不同组别小鼠对糖水的偏好,结果发现,在正式造模前(第0周)和造模3周时,各组小鼠的糖水偏好基本无差异(图4-a)。随着造模时间的进一步延长,从第6周开始观察到,酒精组小鼠的糖水偏好度显著低于酒精组和老酒组,并且在干预第9周时还观察到BJ-10组(86.12%)小鼠的糖水偏好度显著高于BJ-0组(79.62%),BJ-10组小鼠的糖水偏好度在整个造模期间与对照组之间均无显著差异。
进一步通过强迫游泳实验发现(图4-b),在正式造模前(第0周),各组小鼠的静止时间与总时间的比值基本无差异。在造模3周时,虽然各组小鼠之间的静止时间与总时间的比值仍然没有显著差异,但是酒精组小鼠明显升高(20.3%)。到了干预6周时,酒精组小鼠的静止时间与总时间的比值较对照组升高了27.4%,并且显著高于BJ-10干预组。在造模终点(干预9周),所有干预组小鼠的静止时间与总时间的比值均有不同程度的上升,并且酒精组与BJ-0之间也观察到显著差异,同时BJ-10干预组小鼠的静止时间与总时间的比值显著低于BJ-0(15.9%)和BJ-3组(14.7%)。
最后通过旷场实验发现,在3周时,各组小鼠在自主活动箱中的总运动距离(图4-c)和活动箱中心区域运动距离/总距离(图4-d)均无显著差异。但是随着造模时间的延长,从第6周开始,观察到酒精和白酒干预组小鼠的移动总距离(图4-c)和中心区域距离/总距离(图4-d)均下降,说明慢性过量酒精的摄入对小鼠的中枢神经系统存在抑制现象。此外还观察到白酒组小鼠移动总距离(图4-c)和中心区域距离/总距离均高于酒精组,尤其是BJ-10组(9.18%),移动总距离和中心区域距离/总距离在造模终点(第9周)显著高于BJ-3(6.01%)和BJ-0组(5.24%)。
综合以上小鼠行为学分析表明,虽然慢性酒精灌胃会导致小鼠的抑郁样行为,但是白酒中的物质可以改善小鼠在在糖水偏好和强迫游泳环境中抑郁行为。并且,长期老酒干预并未对小鼠的自主活动产生显著影响,说明老酒中的物质可以减轻酒精诱导的焦虑与抑郁等负面情绪状态。
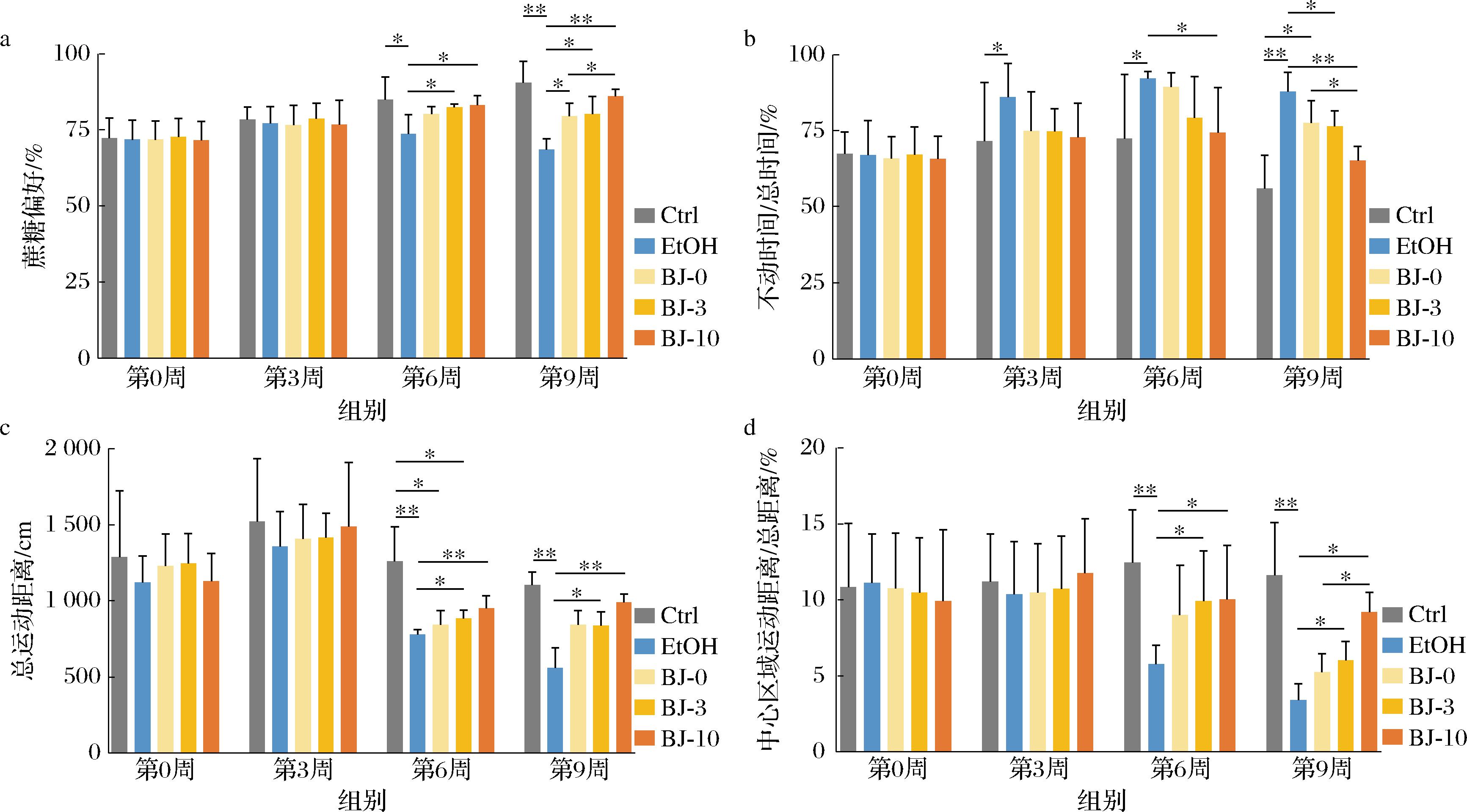
a-蔗糖偏好;b-不动时间/总时间;c-总运动距离;d-活动箱中心区域运动距离/总距离
图4 不同年份白酒干预对小鼠抑郁和焦虑的影响
Fig.4 Effect of different interventions on sober-up time and stress of mice
2.5 不同年份白酒干预对小鼠神经炎症的影响
通过反转录酶-聚合酶链锁反应(reverse transcription-polymerase chain reaction,RT-PCR)分析海马组织炎性相关细胞因子的mRNA表达发现,酒精和不同年份白酒的干预均导致细胞因子mRNA表达上调(图5-a~图5-c),尤其是酒精组,白细胞介素-6(interleukin-6,IL-6)(图5-a)、白细胞介素-10(interleukin-10,IL-10)(图5-b)和γ干扰素(interferon-γ,IFN-γ)(图5-c)的mRNA表达分别比对照组高出365%、461%和533%。另外,虽然在3组白酒组中也都观察到细胞因子mRNA的表达出现不同程度的上调,但是均显著低于酒精组,尤其是BJ-10组,其IL-6和IL-10的mRNA表达显著低于BJ-0组。
为了进一步验证不同干预组之间细胞因子mRNA表达量的差异是否会导致海马组织小胶质细胞活性标志物蛋白表达的不同,本研究又利用蛋白质印迹(Western blot)技术结合免疫荧光技术对衡量小胶质细胞吞噬活性的标记物溶酶体抗原CD68蛋白的表达进行了分析。结果与预期一致,虽然酒精组和不同年份白酒组小鼠的海马组织CD68蛋白的表达均上调,但是所有白酒组海马组织CD68蛋白的表达均低于酒精组,尤其是BJ-10组(图5-d、图5-e)。
综上表明,慢性过量酒精的摄入导致了神经系统的免疫激活,而老酒干预导致的系统炎症及神经炎症水平最低,表明老酒中物质减轻酒精诱导的焦虑与抑郁行为,可能与较低的炎症水平有关。
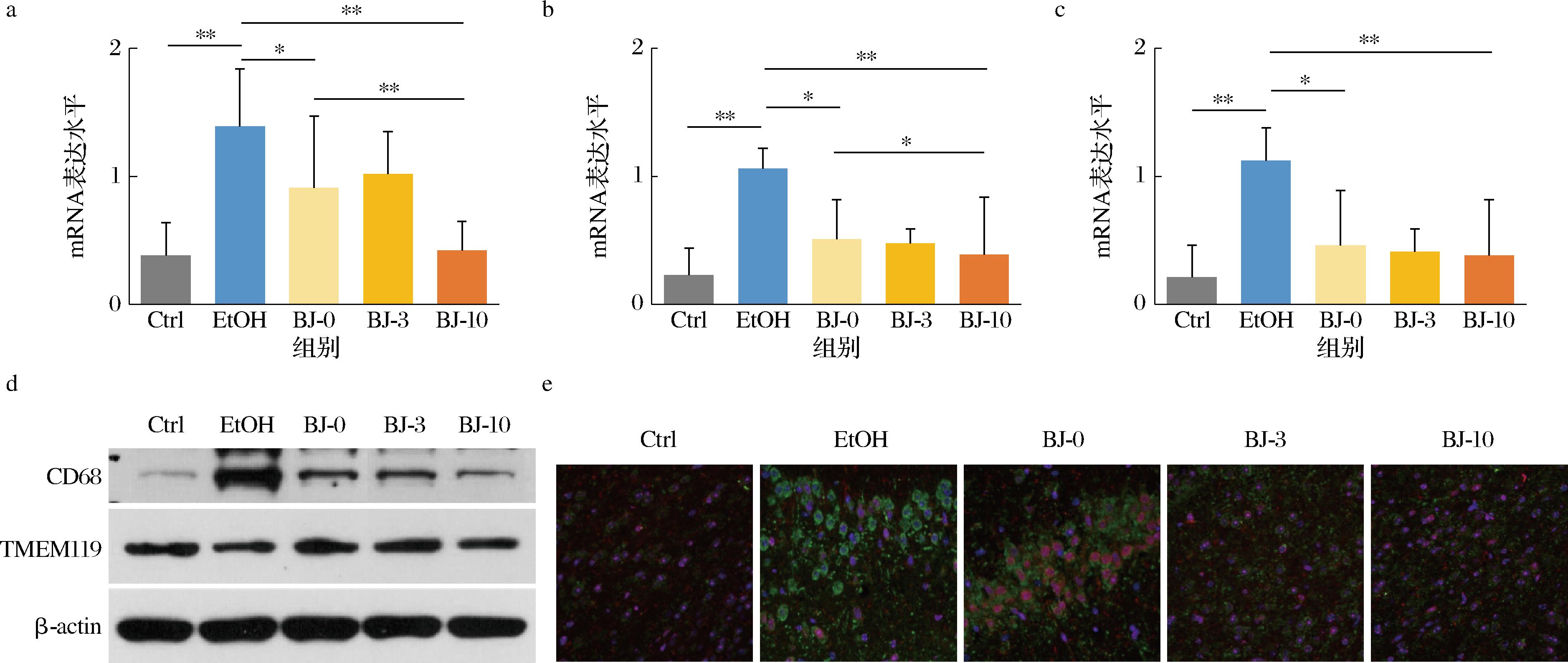
a-海马组织IL-6 mRNA表达水平;b-海马组织IL-10 mRNA表达水平;c-海马组织IFN-γ mRNA表达水平;d-海马组织CD68蛋白Western blot分析;e-海马组织CD68蛋白免疫荧光分析
图5 不同年份白酒干预对小鼠神经炎症的影响
Fig.5 Effect of SHEDE with different aging time on neuroinflammation in mice
3 结论与讨论
本研究通过动物模型,比较了不同贮存时间(0、3、10年)白酒在过量酒精剂量条件下对小鼠生物学功能的影响。首先通过表型、生化与病理分析发现,所有白酒摄入均导致小鼠肝损伤,且肝损伤程度均低于酒精组小鼠,尤其是老酒。这一发现与最近的研究结果相一致,表明老酒中的物质减轻了酒精诱导的肝损伤[8]。
另外,本研究还通过翻正反射、糖水偏好、强迫游泳和旷场实验评价了不同贮存时间白酒摄入对小鼠的行为学的影响。翻正反射消失常被用来评估麻醉药物诱导动物无意识的效价强度,小鼠翻正反射消失常被用来作为意识研究和麻醉效价强度研究的一个重要指标。因此,在急性醉酒研究中,翻正反射可以被用来评价醉酒强度以及是否醒酒[19]。糖水偏好实验常用于评估动物是否存在快感缺失,快感缺失可作为抑郁样行为的一个评估指标[20]。强迫游泳实验的原理类似悬尾实验,也是衡量“抑郁样”行为的经典测试。通过模拟小鼠在强迫应激条件下,经过反复挣扎后处于“绝望状态”的表现[21]。旷场实验是检测小鼠在陌生环境内的行为表现及探索行为,反映其自发行为、运动情况及情绪状态,其活动强度用于评价小鼠中枢神经系统的兴奋或抑制状态,可用于评估动物的焦虑水平[22]。通过对以上行为学指标的评估,本研究发现老酒干预组小鼠的醉酒时间比新酒和酒精更短,糖水偏好程度更高,并能有效缩短在强迫游泳应激条件下的不动时间,同时增加在旷场实验中的运动路程。这些结果充分说明长期老酒干预并未对小鼠的自主活动产生显著影响,老酒中的物质可以减轻酒精诱导的焦虑与抑郁等负面情绪状态。
最后,为了阐明老酒减轻酒精诱导的小鼠抑郁样行为的机理,本研究还分析了血清炎性细胞因子的含量,以及海马组织中炎性细胞因子mRNA与蛋白的表达情况。研究表明,中枢神经系统的炎症反应会导致细胞因子大量分泌,加重抑郁和焦虑症状,对相关神经回路和神经递质功能造成直接或间接的影响。因此,神经系统的细胞因子水平与抑郁程度呈正相关[23]。海马体是学习和记忆最重要的大脑区域,其结构和功能的变化直接影响情绪和认知功能。由于炎症因子的模式识别受体在海马中高表达,且易受到炎症的有害影响。小胶质细胞是神经胶质细胞的一种,是中枢神经系统中的第一道也是最主要的一道免疫防线[24]。因此,本研究还分析了海马组织小胶质细胞活性标志物mRNA及蛋白的表达。结果发现慢性过量酒精的摄入导致了神经系统的免疫激活,而老酒干预导致的系统炎症及神经炎症水平最低,表明老酒中物质减轻酒精诱导的焦虑与抑郁行为,可能与较低的炎症水平有关。
[1] JIN G Y, ZHU Y, XU Y.Mystery behind Chinese liquor fermentation[J].Trends in Food Science &Technology, 2017, 63:18-28.
[2] FANG C, DU H, JIA W, et al.Compositional differences and similarities between typical Chinese Baijiu and western liquor as revealed by mass spectrometry-based metabolomics[J].Metabolites, 2019, 9(1):2.
[3] GUTHRIE B, BEAUCHAMP J D, BUETTNER A, et al.Sex, Smoke, and Spirits:The Role of Chemistry[M].Washington:American Chemical Society, 2019.
[4] 何英霞. 白酒刺激感特征的多维表征及风味化学基础解析[D].无锡:江南大学, 2022.
HE Y X.Multidimensional characterization of Baijiu pungency and analysis of flavor chemical basis[D].Wuxi:Jiangna University, 2022.
[5] BARTOSZEK M, POLAK J.An electron paramagnetic resonance study of antioxidant properties of alcoholic beverages[J].Food Chemistry, 2012, 132(4):2089-2093.
[6] 罗强, 刘杰, 刘志刚.酱香型白酒中活性成分的抗氧化活性[J].食品与发酵工业, 2019, 45(23):84-89.
LUO Q, LIU J, LIU Z G.Antioxidant activity of active components in Maotai-flavor liquor[J].Food and Fermentation Industries, 2019, 45(23):84-89.
[7] XU Y Q, ZHAO J R, LIU X, et al.Flavor mystery of Chinese traditional fermented Baijiu:The great contribution of ester compounds[J].Food Chemistry, 2022, 369:130920.
[8] FANG C, LU W, LIU Q Y, et al.Comparative study between the effects of aged and fresh Chinese Baijiu on gut microbiota and host metabolism[J].Food Bioscience, 2022, 49:101859.
[9] 凌与听, 陈双, 徐岩, 等.采用顶空固相微萃取结合全二维气相色谱-飞行时间质谱技术解析不同陈酿时间古井贡酒挥发性组分特征[J].食品与发酵工业, 2022, 48(17):241-248.
LING Y T, CHEN S, XU Y, et al.Analysis of characteristics in volatile component of Gujnggong Baijiu with different aging times based on HS-SPME-GC×GC-TOFMS[J].Food and Fermentation Industries, 2022, 48(17):241-248.
[10] CHEN S, LU J L, QIAN M, et al.Untargeted headspace-gas chromatography-ion mobility spectrometry in combination with chemometrics for detecting the age of Chinese liquor (Baijiu)[J].Foods, 2021, 10(11):2888.
[11] HE Y X, CHEN S, TANG K, et al.Sensory characterization of Baijiu pungency by combined time-intensity (TI) and temporal dominance of sensations (TDS)[J].Food Research International, 2021, 147:110493.
[12] 成津燕, 方程, 徐岩.白酒摄入对小鼠肠道Akkermansia muciniphila数量的影响[J].食品与发酵工业, 2024, 50(6):1-6.
CHENG J Y, FANG C, XU Y.Effect of Chinese Baijiu intake on quantity of Akkermansia muciniphila in intestinal of mice[J].Food and Fermentation Industries, 2024, 50(6):1-6.
[13] JIANG X X, YAN C L, ZHANG H L, et al.Oral probiotic expressing human ethanol dehydrogenase attenuates damage caused by acute alcohol consumption in mice[J].Microbiology Spectrum, 2023,11(3):e0429422.
[14] LIU M Y, YIN C Y, ZHU L J, et al.Sucrose preference test for measurement of stress-induced anhedonia in mice[J].Nature Protocols, 2018, 13(7):1686-1698.
[15] UENO H, TAKAHASHI Y, MURAKAMI S, et al.Effect of simultaneous testing of two mice in the tail suspension test and forced swim test[J].Scientific Reports, 2022, 12:9224.
[16] QIN X Q, WANG W, WU H R, et al.PPARγ-mediated microglial activation phenotype is involved in depressive-like behaviors and neuroinflammation in stressed C57BL/6 J and ob/ob mice[J].Psychoneuroendocrinology, 2020, 117:104674.
[17] FANG C, DU H, ZHENG X J, et al.Solid-state fermented Chinese alcoholic beverage (Baijiu) and ethanol resulted in distinct metabolic and microbiome responses[J].The FASEB Journal, 2019, 33(6):7274-7288.
[18] WANG L J, TANG L, FENG Y M, et al.A purified membrane protein from Akkermansia muciniphila or the pasteurised bacterium blunts colitis associated tumourigenesis by modulation of CD8+ T cells in mice[J].Gut, 2020, 69(11):1988-1997.
[19] 韩梁. 拉米夫定通过激活乙醛脱氢酶治疗小鼠急性酒精中毒[D].兰州:兰州大学, 2023.
HAN L.Lamivudine remedies alcoholism by activating acetaldehyde dehydrogenase in mice[D].Lanzhou:Lanzhou University, 2023.
[20] PRIMO M J, FONSECA-RODRIGUES D, ALMEIDA A, et al.Sucrose preference test:A systematic review of protocols for the assessment of anhedonia in rodents[J].European Neuropsychopharmacology, 2023, 77:80-92.
[21] 张楠. 岩藻多糖对酒精依赖小鼠的神经保护作用及其机制研究[D].青岛:青岛大学, 2023.
ZHANG N.Neuroprotective effect of fucoidan on alcohol-exposed mice and its mechanism[D].Qingdao:Qingdao University, 2023.
[22] PRUT L, BELZUNG C.The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors:A review[J].European Journal of Pharmacology, 2003, 463(1-3):3-33.
[23] DANTZER R, O’CONNOR J C, FREUND G G, et al.From inflammation to sickness and depression:When the immune system subjugates the brain[J].Nature Reviews Neuroscience, 2008, 9(1):46-56.
[24] YANG Q Q, ZHOU J W.Neuroinflammation in the central nervous system:Symphony of glial cells[J].Glia, 2019, 67(6):1017-1035.