便秘是一种常见的肠道疾病,与肠道微生物菌群失调有关。主要表现为排便周期长、粪便干硬、排出困难或伴有腹胀等[1]。肠道微生态的稳定、菌群结构的平衡以及肠道屏障的完善,是机体维持正常运转,应对外界食源性刺激,保护人体健康的关键所在。大量研究表明,肠道功能紊乱会引发多种疾病,而多种疾病的发生也会导致肠道功能失调,两者互为因果关系。最为常见的就是肠道功能紊乱引起的便秘,目前便秘的治疗方法包括中药治疗、西医治疗、手术治疗及肠道微生态调整[2],但60%的便秘患者用刺激性泻剂和大便软化剂缓解症状,这些药物存在副作用大、易产生药物依赖性等问题[3],导致约1/3患者无法获得理想的治疗效果[4]。
益生菌是一类有益于宿主健康的微生物,具有调节肠道菌群、维持肠道内环境均衡、抗炎、润肠通便等功能,这些健康功效主要与益生菌活菌本身、代谢活动所产生的酶系和多种功能活性成分相关。调控和改善肠道微生物群可能是未来治疗便秘的途径之一,而益生菌缓解功能性便秘的潜在能力已被实验证明[5]。YOON等[6]采用嗜热链球菌MG510和植物乳杆菌LRCC5193进行随机对照实验,结果表明,益生菌能显著改善便秘患者的大便黏稠度。因此,补充益生菌可能是一种治疗由菌群失调导致的便秘的新思路。
植物乳植杆菌BC299是本研究室分离自中国传统发酵白菜的益生菌,前期已对其开展了系统的益生功能研究,发现其具有良好的调节肠道菌群组成和结构、调节免疫等功能。另外,黑茶中含有多种生物活性物质,如茶色素(以茶褐素为主,其次是茶黄素、茶红素)、茶多酚、多糖等,这些物质的存在使得黑茶具有抗氧化、降血糖、降血脂、调理肠胃等多种功效[7]。因此,本研究基于前期研究基础,分析黑茶本身、益生菌发酵黑茶、益生菌复配黑茶对洛哌丁胺诱导的小鼠便秘的缓解作用,并通过分析肠屏障、炎症反应、肠道菌群等探究各样品潜在的作用机制。本研究将为黑茶及益生菌联合黑茶缓解便秘提供理论基础和技术支撑。
1 材料与方法
1.1 材料与试剂
黑茶粉,湖南省湘茶高科技有限公司;盐酸洛哌丁胺,西安杨森制药有限公司;妈咪爱枯草杆菌二联活菌颗粒,北京韩美药品有限公司;植物乳植杆菌BC299由本实验室保藏;商业化益生菌,科汉森。
小鼠胃泌素酶联免疫分析ELISA试剂盒、小鼠胃动素酶联免疫分析ELISA试剂盒、小鼠P物质酶联免疫分析ELISA试剂盒,南京草本源生物科技有限公司;逆转录扩增试剂盒,武汉爱博泰克有限公司;逆转录试剂盒、SYBR qPCR Master Mix试剂盒、ABScript Neo RT Master Mix试剂盒,武汉爱博泰克有限公司;TNF-α、IL-1β和IL-10基因的RT-qPCR引物由金唯智生物科技有限公司合成。
1.2 仪器与设备
3-18K型台式高速冷冻离心机,德国SIGMA公司;Thermo全波长酶标仪,美国Thermo Fisher公司;YS-100光学显微镜,日本尼康公司;C100 TouchTM实时荧光定量基因扩增仪,美国BIO-RAD公司;22331-Hamburg PCR仪,德国Eppendorf公司。
1.3 实验方法
1.3.1 益生菌复配黑茶与发酵黑茶的制备
将-80 ℃甘油保藏的植物乳植杆菌BC299以及商业化益生菌接种到MRS液体培养基中,在37 ℃恒温培养箱中培养24 h,活化3次,得到活化菌种。将活化后植物乳植杆菌BC299和商业化益生菌按2%的接种量接种于1 L的液体培养基中扩大培养,37 ℃恒温培养下培养24 h后,离心后获得菌泥,无菌生理盐水冲洗,用10%(质量分数)的脱脂乳作为保护剂重悬,冷冻干燥后,与黑茶1∶1(质量比)进行复配。
将活化好的种子菌液按2%的接种量接种至添加含1%(质量分数)黑茶的MRS液体培养基中,于37 ℃恒温培养箱中扩大培养24 h。将培养好的菌液进行真空冷冻干燥处理。约18 h之后,冷冻干燥过程结束,获得益生菌发酵黑茶样品。
1.3.2 实验动物分组
将64只6周龄SPF级雄性BALB/c小鼠分为8组,每组8只。分别为空白组(Ctrl)、便秘模型组(Model)、阳性药物处理组(妈咪爱枯草杆菌二联活菌颗粒,PC)、黑茶本身组(HC)、商业化益生菌与黑茶复配组(KC)、植物乳植杆菌BC299与黑茶复配组(BC)、商业化益生菌发酵黑茶组(KFC)、植物乳植杆菌BC299发酵黑茶组(BFC)。
1.3.3 小鼠模型建立
小鼠在动物房适应性喂养1周,正常进食、饮水。在第1~7天,空白组小鼠每日灌胃无菌生理盐水(0.2 mL),其他组别灌胃洛哌丁胺(10 mg/kg BW,0.2 mL)构建便秘小鼠模型。在8~21 d,空白组灌胃无菌生理盐水(0.2 mL),其余各组灌胃洛哌丁胺(10 mg/kg BW,0.2 mL),1 h后阳性药物组灌胃枯草杆菌二联活菌颗粒(0.01 g/d)、模型组灌胃无菌生理盐水(0.2 mL)、各治疗组分别灌胃黑茶(0.01 g/d)、益生菌复配黑茶(0.01 g/d,含109 CFU益生菌)、益生菌发酵黑茶(0.01 g/d,含109 CFU益生菌)。第21天,脱颈处死小鼠,眼球取血[8],取小肠、小鼠粪便等生物样本用作后续实验。
1.3.4 小鼠一般状况的记录与观察
观察记录治疗前后小鼠体重,精神状态、毛发色泽情况。
1.3.5 小鼠粪便含水率测定
在动物实验结束前1 d进行此指标的测定,将每只小鼠放入独立的笼子内收集粪便,记录烘干前后粪便的质量,按照公式(1)计算粪便含水率:
粪便含水率![]()
(1)
式中:A为小鼠粪便湿重;B为小鼠粪便干重。
1.3.6 小鼠首粒黑便排出时间测定
测定前小鼠禁食不禁水12 h。每只小鼠灌胃0.2 mL墨汁,小鼠从灌胃到开始排出首粒黑便的时间间隔即为首粒黑便排出时间。
1.3.7 小鼠小肠转运率计算
小鼠处死采集组织前30 min每只灌胃0.2 mL墨汁,然后取其小肠段,测量墨汁推进长度与小肠总长度的比值即为小肠转运率。按照公式(2)计算:
小肠推进率![]()
(2)
式中:A为墨汁推进长度;B为小肠总长度。
1.3.8 小鼠血清中胃肠调节肽的测定
将收集到的小鼠血液在4 ℃,3 000 r/min条件下离心15 min,获得小鼠血清,利用ELISA试剂盒分别检测血清中3种胃肠调节肽(胃动素、胃泌素、P物质)的含量。
1.3.9 苏木精-伊红(hematoxylin-eosin, HE)染色
小鼠小肠置于4%甲醛液中固定后,进行了乙醇梯度脱水处理。随后,将其透明化并浸泡于二甲苯中后,采用石蜡包埋技术制作6 μm厚度的石蜡切片。接着,将切片放入温度为65 ℃的烘箱中烘烤约20 min,并进行常规的HE染色。最后,使用中性树脂进行封片,待完全凝固后,在光学显微镜下观察小肠组织的肠屏障病理变化。
1.3.10 小鼠小肠炎症因子的相对转录水平分析
采用RT-qPCR方法测定小鼠小肠组织中相关基因的表达水平。用Trizol法提取RNA,参照反转录试剂盒说明书将RNA逆转成cDNA。确定引物序列,由金唯智生物科技有限公司合成引物。通过BioRad -CFX实时荧光定量基因扩增仪测定小鼠小肠组织中TNF-α、IL-1β和IL-10的相对表达量。小鼠TNF-α、IL-1β、IL-10基因和内参基因GAPDH基因引物如表1所示。
表1 引物序列
Table 1 Primer sequences
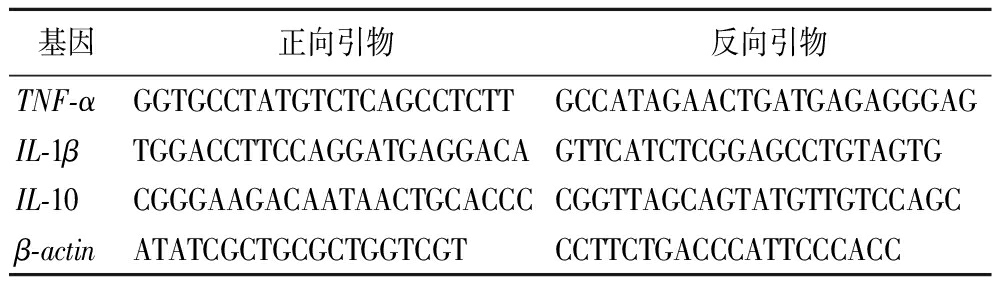
基因正向引物反向引物TNF-αGGTGCCTATGTCTCAGCCTCTTGCCATAGAACTGATGAGAGGGAGIL-1βTGGACCTTCCAGGATGAGGACAGTTCATCTCGGAGCCTGTAGTGIL-10CGGGAAGACAATAACTGCACCCCGGTTAGCAGTATGTTGTCCAGCβ-actinATATCGCTGCGCTGGTCGTCCTTCTGACCCATTCCCACC
1.3.11 16S rRNA测序分析小鼠肠道菌群变化
采用16S rRNA 基因测序来分析小鼠肠道微生物群和细菌群落结构的多样性。提取小鼠粪便中微生物的DNA,并对提取的DNA的质量和浓度进行鉴定,使用上游引物F(5′-ACTCCTACGGGAGGCAGCA-3′)和下游引物R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因V3~V4可变区进行PCR扩增。16S rRNA测序工作由北京百迈客生物有限公司进行。最后使用在线平台BMKCloud (http://www.Biocloud.net)进行数据分析。
1.4 统计分析
实验数据用GraphPad Prism 7.0软件进行数据统计和作图,组数据间比较采用单因素方差分析,2组数据间比较采用t检验, 图表中#表示空白组与模型组的区别,*表示模型组与干预组的区别。P<0.05为差异有统计学意义,*P<0.05;**P<0.01;***P<0.001。
2 结果与分析
2.1 黑茶和益生菌黑茶对便秘小鼠体重及一般形态的影响
采用盐酸洛哌丁胺构建便秘小鼠模型,Ctrl组小鼠精神状态良好,反应灵敏,动作敏捷,皮毛光泽,粪便干湿均匀。与Ctrl组小鼠相比,Model组小鼠排便量减少,且粪便由连续湿软黄色长条形变为干硬褐色颗粒状;小鼠精神状态较空白组明显变差,并且毛发光泽度下降。当灌胃黑茶、益生菌发酵黑茶和益生菌复配黑茶后,各组小鼠精神状态明显好转,粪便干结情况显著改善。
体重变化是研究便秘动物模型重要指标之一,如图1-a所示,与Ctrl组相比,Model组小鼠体重随时间有一定的增长,说明便秘会导致小鼠排便困难,进一步引起体重的增长。与Model组相比,除BFC组外,其他黑茶联合益生菌治疗组均对小鼠体重有一定的影响。图1-b表示最后一天小鼠的体重变化,显示与Ctrl组相比,Model组小鼠的体重显著上升(P<0.000 1),经阳性药物和各黑茶样品灌胃后小鼠体重都显著降低(P<0.01),其中HC和KC组的显著性差异最为明显(P<0.000 1)。由此可见,黑茶及黑茶联合益生菌均能有效改善小鼠因便秘引起的精神不振、体重增加的问题。
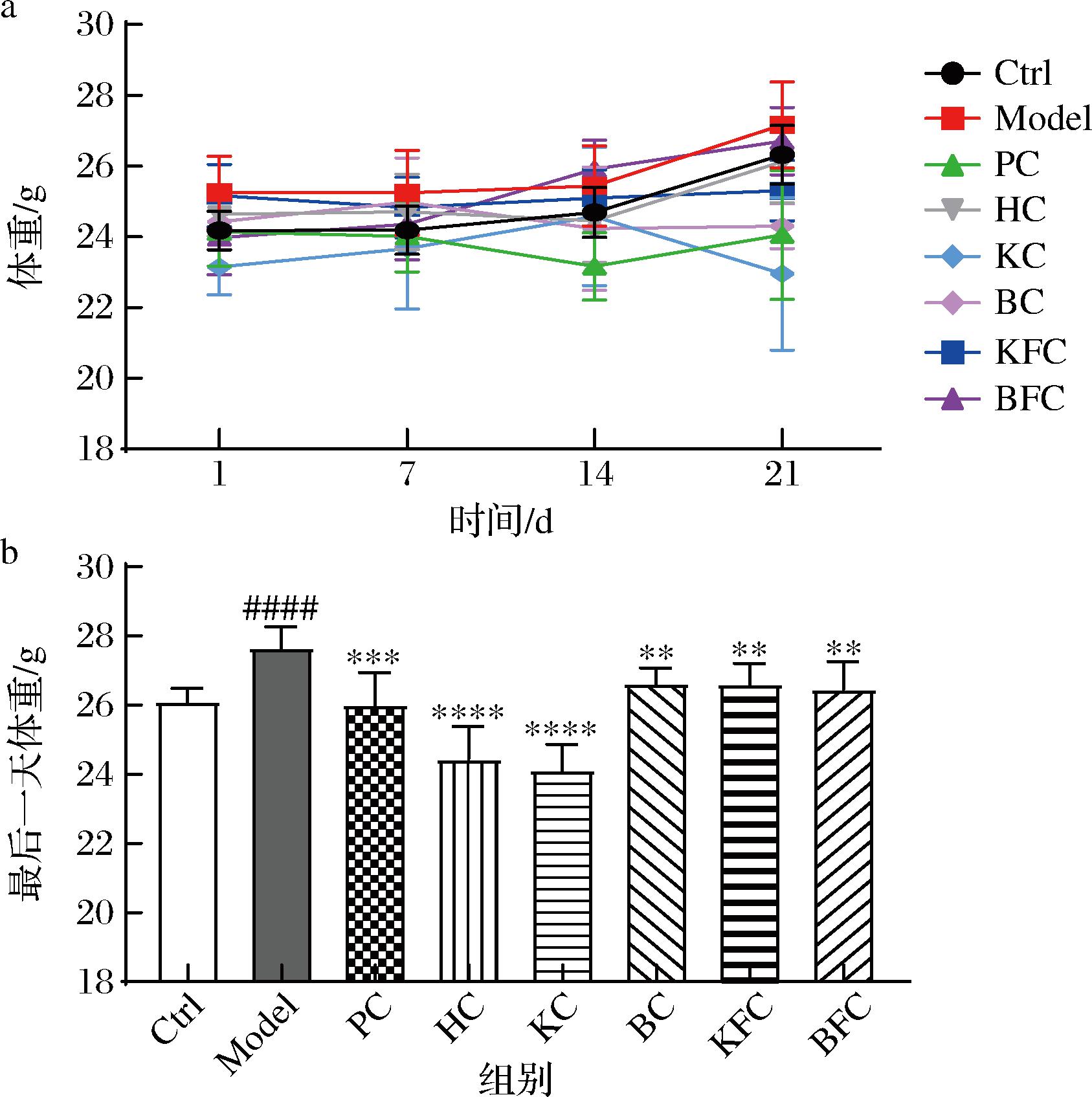
a-各组小鼠体重的变化;b-最后一天小鼠体重的变化
图1 小鼠体重变化
Fig.1 Changes in mice body weight
2.2 黑茶和益生菌黑茶对便秘小鼠粪便含水率、首粒黑便排出时间及肠道转运率的影响
针对便秘主要的临床症状,本研究通过系统分析小鼠粪便含水率、首粒排出黑便时间和小肠转运率3项指标来评价黑茶及益生菌联合黑茶对便秘的缓解作用。如图2-a所示,与Ctrl组相比,Model组小鼠粪便含水率显著减少(P<0.01)。当灌胃黑茶、益生菌发酵黑茶和益生菌复配黑茶后,小鼠粪便含水率显著增高(P<0.01)。此外,对小鼠的首粒黑便排出时间也进行了统计,结果显示与Ctrl组相比,Model组小鼠首粒黑便排出时间显著延长(P<0.05),而当灌胃黑茶和益生菌黑茶样品后,首粒黑便排出时间显著缩短(P<0.05),尤其是灌胃HC和BC,其首粒黑便排出的时间较PC组更短(图2-b,P<0.000 1)。胃肠内容物的运动主要由肠道蠕动推动,可以通过测量肠道转运率来检测,小肠转运率表明消化过程中食物经过胃消化通过小肠时间,肠道转运率越快,就越有利于粪便的排出。如图2-c所示,与Ctrl组相比,Model组小鼠小肠转运率显著降低(P<0.01),表明肠道蠕动能力减弱。与Model组相比,黑茶及益生菌黑茶样品都能显著提高小鼠的小肠转运率(P<0.05),其中,灌胃HC和BC的效果最为显著(P<0.000 1)。以上结果表明黑茶、益生菌复配黑茶和益生菌发酵黑茶都能明显改善盐酸洛哌丁胺引起的小鼠便秘,其中黑茶和植物乳植杆菌BC299复配黑茶的效果最好。

a-小鼠粪便含水率的变化;b-小鼠首粒黑便排出时间的变化;c-小鼠小肠转运率的变化
图2 小鼠便秘相关指标
Fig.2 Constipation-related indicators in mice
2.3 黑茶和益生菌黑茶对便秘小鼠血清中胃肠调节肽的影响
胃肠调节肽主要包括兴奋型与抑制型两大类[9-10],兴奋型胃肠调节肽在调节胃肠道的运动方面起着至关重要的作用。本研究利用ELISA试剂盒分析了黑茶及益生菌联合黑茶对便秘小鼠血清中3种兴奋型胃肠调节肽,胃泌素、胃动素、P物质[11]含量的影响作用。胃泌素和胃动素可通过调节肌肉运动以及消化液的分泌和运输改善胃肠蠕动,其中胃泌素可促进胃酸分泌、胃窦收缩及胃肠道黏膜生长,刺激消化道进行机械运动和电活动[12],而胃动素影响水和电解质的运输,促进胃肠蠕动,刺激顶壁细胞分泌盐酸,刺激胰液和胆汁的分泌[13]。P物质是由11个氨基酸组成的兴奋性神经递质,广泛存在于整个胃肠道,能直接与肠道平滑肌细胞上相应的离子通道结合后收缩肠管[14-15],可以刺激胃肠道平滑肌收缩,增加胃肠道的收缩和运动[16]。如图3所示,与Ctrl组相比,Model组小鼠胃动素、胃泌素、P物质含量都显著下降(P<0.05),而经过黑茶和益生菌联合黑茶处理后,除KFC对P物质含量的提高作用不显著以外,其他含有黑茶的组别都能不同程度显著提高便秘小鼠血清中胃肠调节肽的含量(P<0.05)。因此,灌胃黑茶、益生菌协同黑茶能有效提高盐酸洛哌丁胺诱导便秘小鼠血清中胃动素、胃泌素、P物质胃肠调节肽的含量,从而促进胃肠道的蠕动和消化黏液的分泌。

a-小鼠胃肠调节肽胃泌素相对含量的变化;b-小鼠胃肠调节肽胃动素相对含量的变化;c-小鼠胃肠调节肽P物质相对含量的变化
图3 小鼠胃肠调节肽的变化
Fig.3 Changes in gastrointestinal regulatory peptides in mice
2.4 黑茶和益生菌黑茶缓解便秘小鼠小肠组织细胞损伤和炎症反应
便秘会引起小肠组织细胞损伤以及免疫炎症的发生。本研究采用HE染色来分析灌胃黑茶、益生菌协同黑茶对便秘小鼠小肠损伤的作用。结果如图4所示,Ctrl组小鼠小肠黏膜上皮细胞微绒毛多,排列整齐,细胞间隙紧密,上皮细胞无明显脱落,细胞形态正常且结构清晰。而Model组小鼠的小肠黏膜上皮细胞皱缩,体积变小,排列稀疏,肠绒毛被截短且大部分消失。经黑茶、益生菌协同黑茶干预后,小鼠小肠黏膜上皮细胞的损伤呈现不同程度的修复,尤其是HC组和BC组,小肠上皮细胞完整,排列整齐,细胞间隙明显缩小。
通过测定小鼠小肠中促炎细胞因子(TNF-α、IL-1β)和抗炎细胞因子(IL-10)的相对表达水平,来分析黑茶、益生菌协同黑茶对便秘小鼠的免疫调节作用。如图4-b和图4-c所示,与Ctrl组相比,Model组小鼠小肠中TNF-α和IL-1β的相对表达水平均显著升高(P<0.01),而抗炎因子IL-10的相对表达水平显著降低(P<0.01),说明便秘可导致小鼠机体产生炎症反应[17]。在黑茶、益生菌协同黑茶的干预下,炎症因子TNF-α和IL-1β的相对表达水平均显著降低(P<0.01),抗炎因子IL-10的相对表达水平显著升高(P<0.05)。由此可见,灌胃黑茶、益生菌协同黑茶能有效缓解盐酸洛哌丁胺引起小鼠便秘导致的肠屏障损伤和免疫炎症反应。
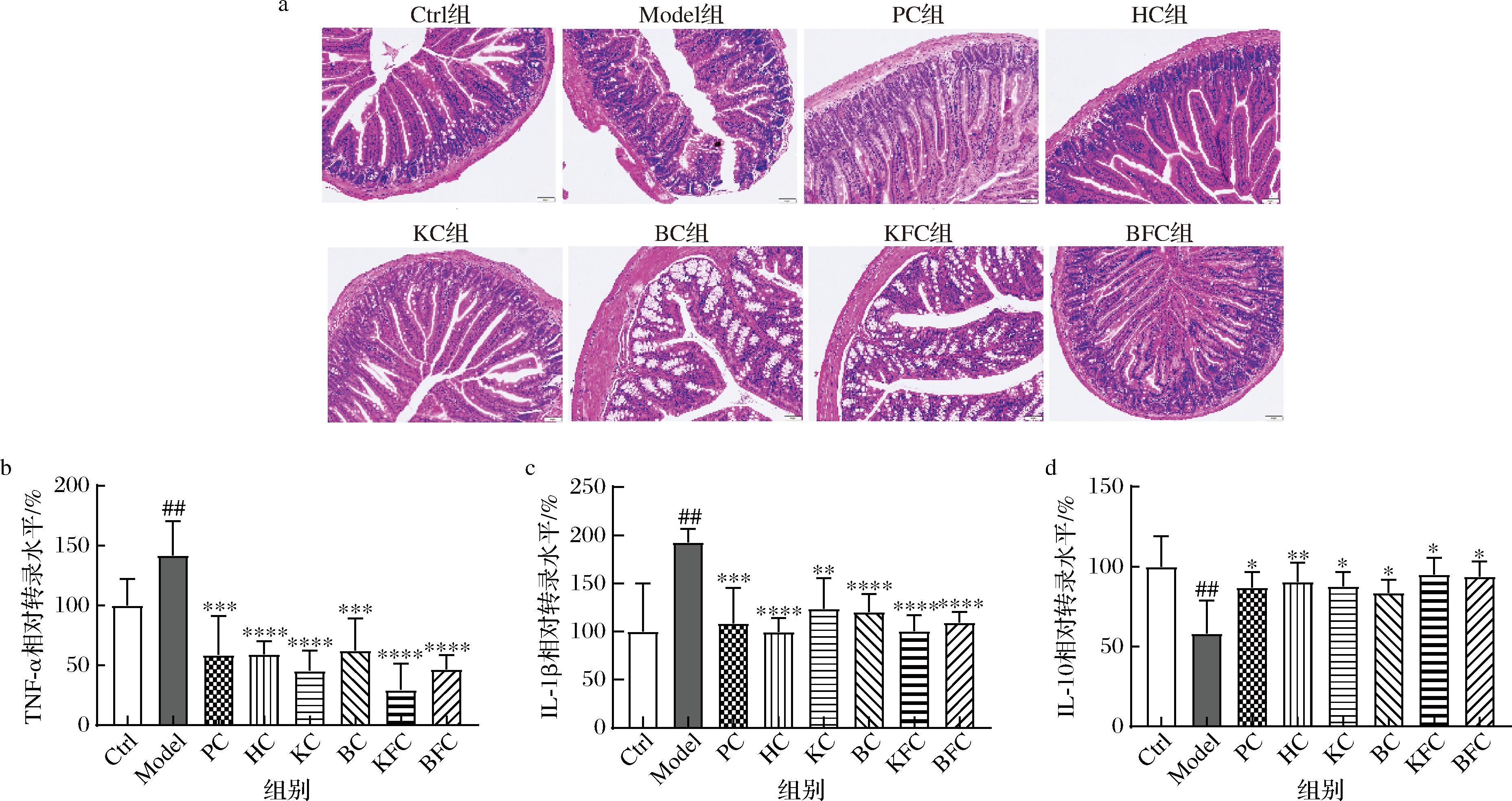
a-小鼠小肠组织的变化;b-TNF-α相对转录水平;c-小鼠IL-1β相对转录水平;d-小鼠IL-10相对转录水平
图4 小鼠小肠H&E染色以及炎症指标
Fig.4 H&E staining and inflammation indicators in mice small intestine
2.5 黑茶和益生菌黑茶调节便秘小鼠肠道菌群
便秘的发生与肠道微生物菌群的失衡密切相关,主要表现为肠道内有益菌株相对丰度的减少和潜在性致病菌株相对丰度的增加[18-19]。为探究黑茶、益生菌协同黑茶对便秘小鼠肠道菌群的影响,收集最后一天小鼠粪便进行16S rRNA高通量测序,并进行相应的菌群分析。
2.5.1 α多样性指数分析
α多样性可反映微生物群落的丰度和多样性。α多样性指数分析包括四方面内容:Shannon指数、Simpson指数、Chao1指数、ACE指数。其中Shannon指数、Simpson指数是用来代表微生物群落多样性的指数,Shannon指数数值越大,Simpson指数越大说明微生物菌落的多样性越丰富。Chao1指数、ACE指数是用来代表微生物群落丰度的指数之一,其所呈现的值越大,表明所含物种种类更丰富。
本研究分析了灌胃黑茶、益生菌协同黑茶后小鼠肠道菌群的α多样性。如表2所示,与Ctrl组相比,除Simpson指数外,Model组的ACE、Chao1和Shannon指数均明显降低。灌胃黑茶和益生菌协同黑茶后,并未明显提高模型小鼠肠道菌群的Simpson和Shannon指数,但HC和KC 2组的ACE、Chao1指数明显提高,说明补充黑茶和商业化益生菌复配黑茶能有效提高便秘小鼠肠道菌群的丰富度,补充其他益生菌黑茶对便秘小鼠肠道菌群的物种丰富度影响不大。
表2 各组小鼠肠道菌群群落α多样性指数比较(n=4)
Table 2 Comparative analysis of the α-diversity index among the intestinal microbiota communities across distinct mouse groups, offering insights into the richness and evenness of microbial populations within each cohort (n=4)
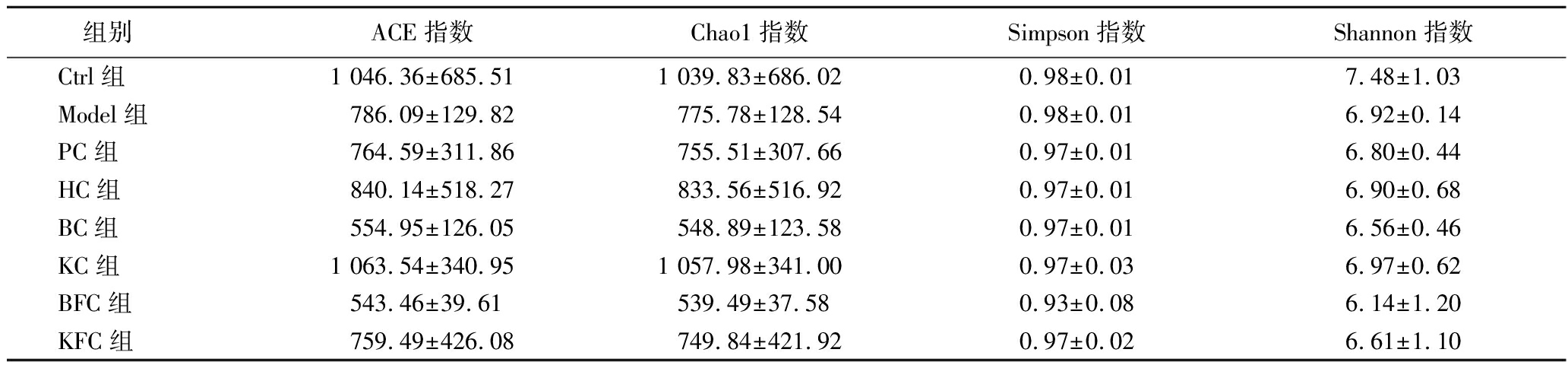
组别 ACE指数Chao1指数Simpson指数Shannon指数Ctrl组1 046.36±685.511 039.83±686.020.98±0.017.48±1.03Model组786.09±129.82775.78±128.540.98±0.016.92±0.14PC组764.59±311.86755.51±307.660.97±0.016.80±0.44HC组840.14±518.27833.56±516.920.97±0.016.90±0.68BC组554.95±126.05548.89±123.580.97±0.016.56±0.46KC组1 063.54±340.951 057.98±341.000.97±0.036.97±0.62BFC组543.46±39.61539.49±37.580.93±0.086.14±1.20KFC组759.49±426.08749.84±421.920.97±0.026.61±1.10
2.5.2 β多样性指数分析
β多样性分析展示样品微生物菌群间物种多样性的差异。如图5-a所示,主坐标分析(principal co-ordinates analysis,PCoA)表明,不同组别样本均表现出一定的的聚类关系。Model组与Ctrl组相比菌群存在一定偏离,说明灌胃盐酸洛哌丁胺引起了小鼠肠道菌群的变化。与Model组小鼠相比,灌胃黑茶、益生菌协同黑茶后小鼠肠道菌群组成均存在一定程度的偏离,也存在部分重叠,但菌群结构的离散程度较Model组更大,同样说明黑茶、益生菌协同黑茶的干预影响了便秘小鼠的肠道菌群结构和组成。
2.5.3 黑茶和益生菌黑茶对便秘小鼠肠道菌群的影响
接下来,分析了各组小鼠不同水平肠道菌群组成的具体差异,由图5-b可知,空白组,模型组,黑茶组,益生菌协同黑茶组的肠道微生物群落主要包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、脱硫杆菌门(Desulfobacterota)、放线菌门(Actinobacteriota)和变形菌门(Proteobacteria)。与空白组相比Model组中拟杆菌门的相对水平升高,而益生菌黑茶组的干预能明显调节拟杆菌门的数量。其中厚壁菌门与拟杆菌门的比率(F/B)可用于评估肠道微生物群的动态平衡[20],如图5-c所示,与Ctrl组相比,Model组的F/B显著降低(P<0.05),而灌胃黑茶、益生菌协同黑茶后F/B均显著提高(P<0.05)。F/B降低与炎症性肠病,抑郁,阿尔茨海默病等相关,这可能与短链脂肪酸尤其丁酸的生成减少,蛋白代谢物组胺,脂多糖累积等相关诱导的免疫炎症反应相关。
在属水平上,各组小鼠优势菌群分布如图5-d所示,主要是拟普雷沃氏菌属(Alloprevotella)、另枝菌属(Alistipes)、毛螺菌属(Lachnospiraceae)、普雷沃氏菌属(Prevotella)、联合乳杆菌属(Ligilactobacillus)。与Model组相比,BFC组在联合乳杆菌属水平上有一定的上升趋势。联合乳杆菌属是有益于肠道的微生物,可以促进肠道内水分的分泌,增强肠道内的渗透压,降低粪便硬度,易于排出。同时可以降低肠道内的pH值,从而促进肠道的蠕动,改善便秘症状的发生[21]。
最后,利用LEfSe(LDA Effect Size)基于线性判别分析(linear discriminant analysis,LDA)对组间富集的微生物物种进行比对,筛选出组间显著差异的生物标记物,采用LDA线性判别分析差异物种丰度对组间差异影响的大小(LDA>3.0)。如图6-a所示,在Ctrl组中显著富集的物种为丹毒丝菌属(Erysipelotrichaceae),Model组中显著富集的物种为拟杆菌属(Bacteroides),HC组中显著富集的物种为毛螺菌属(Lachnospiraceae)、乳杆菌属(Lactobacillus),其中乳杆菌属对人体健康有着重要的作用,能够维护肠道菌群平衡,抑制有害菌的生长,防止肠道感染和炎症。乳杆菌通过调节肠道菌群来缓解便秘[22-23],人体肠道菌群中乳杆菌属是有益菌的代表,通过降低肠道内环境的pH值、抑制有害菌增殖而发挥作用[24]。BC组中显著富集的物种为副拟杆菌属(Parabacteroides),副拟杆菌属与宿主健康(如代谢综合征、炎症性肠病)有密切关系。副拟杆菌具有糖代谢和分泌短链脂肪酸的生理特征。综上所述,黑茶和益生菌协同黑茶干预能有效恢复盐酸洛哌丁胺引起的便秘小鼠肠道菌群结构和组成变化,主要表现为提高有益菌乳杆菌、副拟杆菌的相对丰度。

a-β多样性;b-门水平的物种组成;c-厚壁菌门与拟杆菌门比值;d-属水平的物种组成
图5 小鼠粪便菌群多样性及门/属水平分析
Fig.5 Diversity and phylum/genus level analysis of fecal microbiota in mice

a-LEfSe 分析物种进化分枝图;b-LDA值分布柱状图
图6 小鼠肠道微生物的LEfSe分析
Fig.6 LEfSe analysis of mice gut microbes
3 结论
本研究评价了益生菌协同黑茶对便秘小鼠的作用效果及影响机制。结果表明,益生菌复配黑茶和益生菌发酵黑茶均具有较好的通便润肠作用。并且益生菌协同黑茶可以增加便秘小鼠粪便含水率,提高小肠转运率,缩短首粒黑便排出的时间,维持肠道结构特征。同时益生菌协同黑茶还可以提高便秘小鼠血清中兴奋性神经递质水平。其中综合评估,益生菌复配黑茶BC改善便秘的效果最好。此外,益生菌协同黑茶对便秘小鼠的肠道菌群结构和组成具有调节作用,能够显著提高有益菌乳杆菌、副拟杆菌的相对丰度。总体而言,益生菌复配黑茶和益生菌发酵黑茶对上述指标均有不同程度的改善效果。本研究将为益生菌协同黑茶缓解便秘提供新思路。
[1] HAYAT U, DUGUM M, GARG S.Chronic constipation:Update on management[J].Cleveland Clinic Journal of Medicine, 2017, 84(5):397-408.
[2] 刘宝华. 《便秘外科诊治指南》(2017年版)解读[J].中华胃肠外科杂志, 2017(12):1331-1333.
LIU B H.Interpretation of Chinese guidelines for the diagnosis and treatment of constipation surgery (2017)[J].Chinese Journal of Gastrointestinal Surgery, 2017(12):1331-1333.
[3] 李俊洁, 陈庆森.双歧杆菌调理和改善肠道相关疾病作用的研究进展[J].食品科学, 2011, 32(23):326-332.
LI J J, CHEN Q S.Recent advances in research on the role of bifidobacteria in regulating and improving gut-associated diseases[J].Food Science, 2011, 32(23):326-332.
[4] BOKIC T, STORR M, SCHICHO R.Potential causes and present pharmacotherapy of irritable bowel syndrome:An overview[J].Pharmacology, 2015, 96(1-2):76-85.
[5] RAO T P, QUARTARONE G.Role of guar fiber in improving digestive health and function[J].Nutrition, 2019, 59:158-169.
[6] YOON J Y, CHA J M, OH J K, et al.Probiotics ameliorate stool consistency in patients with chronic constipation:A randomized, double-blind, placebo-controlled study[J].Digestive Diseases and Sciences, 2018, 63(10):2754-2764.
[7] YANG W Q, REN D Y, ZHAO Y, et al.Fuzhuan brick tea polysaccharide improved ulcerative colitis in association with gut microbiota-derived tryptophan metabolism[J].Journal of Agricultural and Food Chemistry, 2021, 69(30):8448-8459.
[8] LUO J Y, YAN D, SONG J Y, et al.A strategy for trade monitoring and substitution of the organs of threatened animals[J].Scientific Reports, 2013, 3:3108.
[9] CHEN J Q, LI D W, CHEN Y Y, et al.Elucidating dosage-effect relationship of different efficacy of rhubarb in constipation model rats by factor analysis[J].Journal of Ethnopharmacology, 2019, 238:111868.
[10] QIAN Y, SONG J L, YI R K, et al.Preventive effects of Lactobacillus plantarum YS4 on constipation induced by activated carbon in mice[J].Applied Sciences, 2018, 8(3):363.
[11] 彭昊, 龙博文, 肖晨, 等.重症监护室患儿血清胃泌素和胃动素指标的变化及意义研究[J].中国全科医学, 2021, 24(32):4094-4098;4109.
PENG H, LONG B W, XIAO C, et al.Changes and significance of serum gastrin and motilin in the blood of children in pediatric intensive care unit[J].Chinese General Practice, 2021, 24(32):4094-4098;4109.
[12] FUJIMURA K E, SLUSHER N A, CABANA M D, et al.Role of the gut microbiota in defining human health[J].Expert Review of Anti-Infective Therapy, 2010, 8(4):435-454.
[13] 孙祥珍, 马臻棋, 马雪芹.初探VIP、P物质与便秘的关系[J].世界最新医学信息文摘,2019,19(26):113-114.
SUN X Z, MA Z Q, MA X Q.Preliminary study on the relationship between VIP,substance P and constipation[J].World Latest Medicine Information,2019,19(26):113-114.
[14] 李冬华, 朱飞鹏, 李珊珊, 等.疏肝健脾法调控肠易激综合征动物模型胃肠激素水平的研究[J].中国实验方剂学杂志, 2008, 14(7):20-23.
LI D H, ZHU F P, LI S S, et al.Study on the method of soothing the liver and strengthening the spleen on regulating gastrointestinal hormones in animals model of irritable bowel syndrome[J].Chinese Journal of Experimental Traditional Medical Formulae, 2008, 14(7):20-23.
[15] ZOU J F, SHEN Y M, CHEN M J, et al.Lizhong decoction ameliorates ulcerative colitis in mice via modulating gut microbiota and its metabolites[J].Applied Microbiology and Biotechnology, 2020, 104(13):5999-6012.
[16] PLAZA-D AZ J, RUIZ-OJEDA F J, VILCHEZ-PADIAL L M, et al.Evidence of the anti-inflammatory effects of probiotics and synbiotics in intestinal chronic diseases[J].Nutrients, 2017, 9(6):555.
AZ J, RUIZ-OJEDA F J, VILCHEZ-PADIAL L M, et al.Evidence of the anti-inflammatory effects of probiotics and synbiotics in intestinal chronic diseases[J].Nutrients, 2017, 9(6):555.
[17] DIBAISE J K, FRANK D N, MATHUR R.Impact of the gut microbiota on the development of obesity:Current concepts[J].The American Journal of Gastroenterology Supplements, 2012, 1(1):22-27.
[18] KHALIF I L, QUIGLEY E M M, KONOVITCH E A, et al.Alterations in the colonic flora and intestinal permeability and evidence of immune activation in chronic constipation[J].Digestive and Liver Disease, 2005, 37(11):838-849.
[19] 罗真东, 梁鉴坤, 王哲, 等.小麦纤维素联合乳果糖治疗儿童功能性便秘的临床观察[J].中国现代医学杂志, 2018, 28(36):96-99.
LUO Z D, LIANG J K, WANG Z, et al.Application of Fiberform and Lactulose in treatment of functional constipation in children[J].China Journal of Modern Medicine, 2018, 28(36):96-99.
[20] MARIAT D, FIRMESSE O, LEVENEZ F, et al.The Firmicutes/Bacteroidetes ratio of the human microbiota changes with age[J].BMC Microbiology, 2009, 9:123.
[21] SHIDA K, MAKINO K, MORISHITA A, et al.Lactobacillus casei inhibits antigen-induced IgE secretion through regulation of cytokine production in murine splenocyte cultures[J].International Archives of Allergy and Immunology, 1998, 115(4):278-287.
[22] 彭芝榕, 刘晓梅, 倪学勤, 等.植物乳杆菌F1208对便秘大鼠胃肠道功能的影响[J].食品科学, 2013, 34(13):243-246.
PENG Z R, LIU X M, NI X Q, et al.Effect of Lactobacillus plantarum F1208 on gastrointestinal functions in constipated rats[J].Food Science, 2013, 34(13):243-246.
[23] 刘晓梅, 彭芝榕, 倪学勤, 等.低聚果糖、乳酸杆菌对便秘模型大鼠的通便功能影响[J].食品科学, 2013, 34(11):296-299.
LIU X M, PENG Z R, NI X Q, et al.Aperient effect of fructooligosaccharides and Lactobacillus on constipation model of rats[J].Food Science, 2013, 34(11):296-299.
[24] 詹宏杰, 梁寒.肠道菌群与结直肠癌关系研究进展[J].中国肿瘤临床, 2015, 42(13):675-679.
ZHAN H J, LIANG H.Research progress on the relationship between intestinal microflora and colorectal cancer[J].Chinese Journal of Clinical Oncology, 2015, 42(13):675-679.