中国作为一个畜牧业大国,每年在动物饲料方面需投入大量资源。豆粕是大豆榨油后剩下的副产品,其中粗蛋白含量高达30%~50%,是制作动物饲料的主要原料[1]。然而,我国大豆产量较低,大部分依靠进口,大豆进口额占粮食进口额的60%以上。为了缓解这种压力,人们将目光转向了餐厨垃圾。餐厨垃圾,也称为餐桌剩余物,主要源自餐饮服务、学校及企业食堂的食物剩余。这类剩余物的一个主要特征是含有较高水分和丰富的有机物,使得它们易于在自然环境中腐败滋生各种微生物。如果处理不当,这些易腐物会迅速引发恶臭、吸引害虫,并可能对环境造成污染,有时还可能对人类健康构成威胁。针对餐厨垃圾的处理,目前已有多种技术,主要包括焚烧、填埋和喂养牲畜[2]。然而,这些处理方法容易产生其他问题,例如加剧全球变暖、土壤污染和盐碱化以及传播疾病等[3-4]。近年来,越来越多的研究表明餐厨垃圾可通过微生物发酵转化为甲烷、乙醇、生物氢以及生物油/生物炭等生物资源[5-6],这种方法不仅减少了垃圾量,还促进了资源循环利用和环境无害化处理,为可持续发展做出了贡献。
餐厨垃圾的组成受地域饮食习惯和季节变化的影响,一般蛋白质的含量占干物质的20%以上,然而尚未达到饲料中蛋白含量标准。因此,为了将餐厨垃圾用作饲用蛋白原料,需要提高其粗蛋白含量,如通过微生物发酵生产单细胞蛋白(single cell protein,SCP)。单细胞蛋白是由藻类、酵母、细菌和真菌产生的大量干燥细胞,也可以被称为生物蛋白、微生物蛋白或生物质[7]。其中,真菌和细菌是主要生产者[8],因为它们具有生长速度快、蛋白质含量高等特点[9]。单细胞蛋白含有丰富的蛋白质,占干物质含量的30%~80%[10],富含各种必需氨基酸[11]以及碳水化合物、核酸、脂肪、矿物质和维生素等营养物质。单细胞蛋白的生产过程不需要农业用地,也不受季节或气候的影响[12]。由于其具有营养丰富、来源广泛、廉价易得、绿色健康等优点,在食品畜牧业具有广泛的应用前景。GERVASI等[13]在25 L发酵罐中使用酿酒酵母进行直接发酵。YANG等[14]利用解脂耶氏酵母对餐厨垃圾厌氧发酵后的液体部分进行发酵生产SCP。然而,目前该领域的研究仍不充分,存在诸如产物单一、发酵步骤繁琐、成本高等缺陷。这些都限制了利用餐厨垃圾生产单细胞蛋白的工业化应用。
基于上述分析,本研究旨在利用乳酸片球菌以统合生物工艺从餐厨垃圾中同步生产单细胞蛋白和乳酸。即从一株来源于餐厨垃圾的乳酸片球菌C33出发,利用合成生物学手段,构建了表达淀粉酶的工程菌株。利用重组菌株以统合生物工艺发酵餐厨垃圾中的淀粉,生产单细胞蛋白和乳酸。发酵上清液可进一步分离纯化得到乳酸,而餐厨垃圾发酵醪中含有大量菌体蛋白,可以作为饲用蛋白原料。这项研究为餐厨垃圾转化成饲用蛋白原料提供了可能。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒来源
乳酸片球菌C33,实验室前期筛选得到且保藏于本实验室;产淀粉酶枯草芽孢杆菌,广东利世康低碳科技有限公司;大肠杆菌DH5α感受态,上海生工生物工程有限公司;质粒pNW33N和pMG36e,本实验室保存。
1.1.2 培养基
mMRS培养基(g/L):酵母提取物5.0;蛋白胨10.0;葡萄糖20.0;磷酸氢二钾2.0;柠檬酸氢二铵2.0;乙酸钠5.0;硫酸镁0.2;硫酸锰0.05;吐温80 1.0;琼脂15.0(固体培养基),根据需要添加终质量浓度为14 μg/mL的氯霉素。
LB培养基(g/L):酵母提取物5.0;胰蛋白胨10.0;氯化钠10.0;琼脂15.0(固体培养基),添加终质量浓度为28 μg/mL的氯霉素。
YPS培养基(g/L):酵母提取物10.0;胰蛋白胨20.0;可溶性淀粉10.0;琼脂15.0(固体培养基),添加终质量浓度为14 μg/mL的氯霉素。
上述培养基均121 ℃灭菌20 min。其中,葡萄糖需配成200 g/L的母液,单独灭菌。
1.2 实验方法
1.2.1 餐厨垃圾的制备及主要成分测定
餐厨垃圾配方:根据成都市餐厨垃圾的主要成分(质量分数):总糖1.97%~3.13%,油脂6.7%~9.7%,粗蛋白16%~22%,含水率78%~85%(数据来源于成都市四川利兴龙环保科技有限公司),本研究采用人工复配的餐厨垃圾进行实验。本研究的餐厨垃圾配方如下(g/kg):肉100,玉米80,面条120,卷心菜200,橘皮30,食用油70,水400,将除水以外的组分切碎混合,并用粉碎机打碎,置于密封袋中,于-20 ℃冰箱中保存。使用前准确称取相应质量的餐厨垃圾后,按比例加水混匀。
参照GB/T 6432—2018《饲料中粗蛋白的测定 凯氏定氮法》、GB 5009.6—2016 《食品安全国家标准 食品中脂肪的测定》等,对餐厨垃圾的营养成分(含水率、蛋白质、脂质、淀粉)进行定量分析[15]。所有测试样品进行3次平行试验,计算平均值及标准差。
1.2.2 发酵条件对野生型乳酸片球菌C33产SCP的影响
种子培养:挑取一颗单菌落于5 mL mMRS培养基中,37 ℃,200 r/min培养24 h,接种到50 mL mMRS培养基中,按照发酵温度的需求以不同温度扩大培养12~14 h;然后接种至灭菌的餐厨垃圾中进行发酵。接种前用紫外分光光度计测定OD600值,用无菌水稀释至所需浓度。发酵时控制单一变量,每组3个重复。
摇瓶发酵:准确称取30 g餐厨垃圾于50 mL血清瓶中,121 ℃高压蒸汽灭菌20 min,待冷却至室温后,加入适量商业化淀粉酶和糖化酶,加入0.5 g灭菌的无水碳酸钙(以不同初始pH发酵的样品不加),发酵条件如下所述。
1.2.2.1 接种量对产SCP的影响
设置接种量为1 mL OD600值为0.5、1、1.5、2的乳酸片球菌C33,37 ℃发酵96 h,每隔24 h取样1次,测定粗蛋白含量,确定较优接种量和发酵时间。
1.2.2.2 发酵温度对产SCP的影响
采用优化后的接种量,设置30、37、42、45 ℃这4个温度进行发酵,发酵72 h,每隔24 h取样1次,测定粗蛋白含量,确定较优发酵温度。
1.2.2.3 初始pH对产SCP的影响
采用优化后的接种量和发酵温度,用乳酸将餐厨垃圾的初始pH调节至2.2、3.2、4.2和5.2,发酵72 h,每隔24 h取样1次,测定粗蛋白含量,确定较优发酵初始pH。
1.2.3 异源表达α-淀粉酶的重组乳酸片球菌的构建
1.2.3.1 α-淀粉酶基因表达盒的构建
参照NCBI数据库中乳酸片球菌PB22的基因组序列(登录号:CP025471.1)设计引物PldhL-F和PldhL-R(引物序列见表1),以乳酸片球菌C33基因组DNA为模板扩增出ldhL基因编码区上游472 bp的启动子序列PldhL。参照NCBI数据库中枯草芽孢杆菌168菌株的基因组序列(登录号:AL009126.3),设计引物amyE-F和amyE-R,以产淀粉酶枯草芽孢杆菌基因组DNA为模板扩增出1 980 bp的α-淀粉酶基因编码区片段amyE。以TT-F和TT-R为引物,pMG36e质粒为模板扩增出128 bp的终止子TT。利用重叠PCR将启动子-淀粉酶基因-终止子顺序连接,构建成α-淀粉酶基因表达盒PamyT。
表1 引物序列
Table 1 Primer sequence

引物名称引物序列(5′- 3′)PldhL-FTCCCGTTCTCTCTGATTGTGTCCATTAACGGACGCACCGCTCPldhL-RCAAACATAATATCCATTCCCTTCATTTATTAGATTATATATTTGGamyE-FATGAAGGGAATGGATATTATGTTTGCAAAACGATTCAAAACCTCamyE-RTCAATGGGGAAGAGAACCGCCTTT-FGCGGTTCTCTTCCCCATTGAGGTACTGATGACCGGTAAAATTTTT-RGCAGCGGCCGCTACTAGTAGCGTTTGATTTTCAAACTTCGCVector1-FAAAGATACCAGGCGTTTCCCVector1-RCACAATCAGAGAGAACGGGAAAGTVector2-FTACTAGTAGCGGCCGCTGCAGGCVector2-RGGGAAACGCCTGGTATCTTT
注:下划线标注的为重叠PCR的同源序列。
1.2.3.2 重组表达质粒pNW33N-amyE的构建与转化
以pNW33N质粒为模板,分别用引物对Vector1-F、Vector1-R和Vector2-F、Vector2-R扩增出1 366 bp和2 842 bp的载体片段1和载体片段2。使用无缝连接试剂盒将α-淀粉酶基因表达盒PamyT与载体片段1和2连接,得到质粒pNW33N-amyE。重组质粒利用电击转化法[16]转入乳酸片球菌C33,利用氯霉素抗性平板筛选得到阳性转化子。提取转化子的基因组,进行PCR验证。进一步通过淀粉水解圈法[17]筛选得到成功表达α-淀粉酶的重组乳酸片球菌C33-pamy。
1.2.4 淀粉酶活力的测定
采用3,5-二硝基水杨酸比色法测定α-淀粉酶活力[18]。1个α-淀粉酶活力单位定义为:在60 ℃,pH 4.5的条件下,每1 min水解可溶性淀粉产生1 μmol麦芽糖当量的还原糖所需要的酶量,以U表示。计算如公式(1)所示:
(1)
式中:A,α-淀粉酶活力,U/mL;c,根据标准曲线计算出的生成的麦芽糖的质量浓度,mg/mL;V′,酶解反应体积,为1 mL;V,加入酶液的体积,mL;t,反应时间,min;n,稀释倍数。
1.2.5 重组菌株发酵餐厨垃圾产单细胞蛋白和乳酸
种子培养:以1%的接种量将乳酸片球菌C33接种到5 mL mMRS培养基中,将重组菌C33-pamy以相同的接种量接种到5 mL含氯霉素的mMRS培养基中,37 ℃,200 r/min活化24 h。将活化好的菌株以1%的接种量分别转接至50 mL含或不含氯霉素的0.5%可溶性淀粉的YPS培养基中,37 ℃,200 r/min培养12~16 h,即为种子液。
精确称取45 g(精确到0.000 1 g)餐厨垃圾于50 mL 血清瓶中,121 ℃灭菌20 min,实验分为3组,每组3个平行,具体如下:
第1组:对照组,以10%的接种量接种乳酸片球菌C33。
第2组:以10%的接种量接种乳酸片球菌C33,另加3 mg/kg的商业淀粉酶和9 mg/kg的商业糖化酶。
第3组:以10%的接种量接种重组乳酸片球菌C33-pamy。
按上述添加好后,每个样品加入1 g无菌碳酸钙,将所有血清瓶放入37 ℃摇床,200 r/min厌氧发酵。每24 h取样1次,12 000 r/min离心5 min后,取950 μL上清液,加入50 μL 10%(体积分数)硫酸并过滤后,利用高效液相色谱仪测定样品中葡萄糖、乳酸和副产物乙酸、乙醇的含量。沉淀烘干后进行粗蛋白含量测定。
1.3 分析方法和结果统计
使用Origin 2022软件(https://www.originlab.com/)进行实验数据分析和绘图,统计分析采用单因素方差分析和Fisher LSD检验,P<0.05为差异显著。
2 结果与分析
2.1 餐厨垃圾主要成分测定结果
餐厨垃圾主要成分测定结果如表2所示,pH、含水率、总糖、粗蛋白和油脂含量与之前报道一致[19],皆在正常范围,可用于后续实验。
表2 餐厨垃圾中主要成分含量
Table 2 Contents of main components in food waste
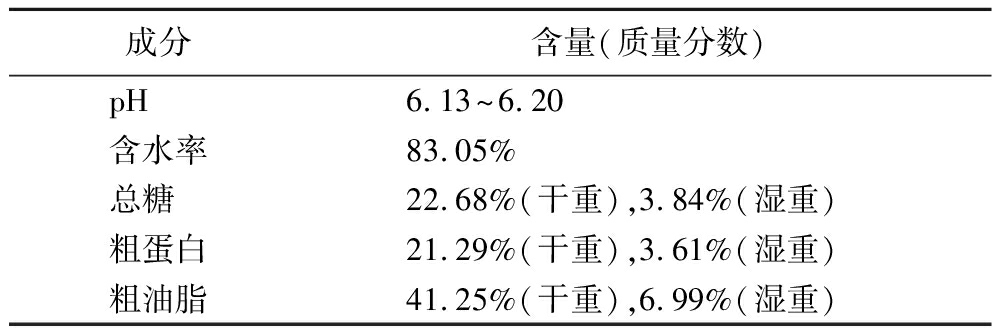
成分含量(质量分数)pH6.13~6.20含水率83.05%总糖22.68%(干重),3.84%(湿重)粗蛋白21.29%(干重),3.61%(湿重)粗油脂41.25%(干重),6.99%(湿重)
2.2 发酵条件对乳酸片球菌C33产SCP的影响
2.2.1 接种量对生产SCP的影响
在发酵过程中,接种量的多少会影响菌体的生长速度和产物合成。接种量低时,会导致细菌生长的停滞期延长;接种量高时,发酵前期细菌大量生长,会导致培养基中的营养物质被迅速消耗,影响产物的合成。在本研究中,为研究接种量对SCP产量的影响,以1 mL OD600值为0.5、1、1.5、2的种子液接种,发酵结果如图1-a所示,发酵72 h后,OD600值为0.5、1和1.5的样品粗蛋白含量均超过了37%,且各接种量之间单细胞蛋白的产量没有显著差异,为了节约菌种,确定了最适接种量为OD600值为0.5,发酵时间为72 h。
2.2.2 发酵温度对生产SCP的影响
温度对微生物的生长状态和代谢过程影响很大,从而影响产物的品质。分别于30、37、42、45 ℃的温度下发酵餐厨垃圾,发酵结果如图1-b所示,温度过高和过低都不利于SCP发酵,发酵温度为37 ℃时,SCP的产量最高。尽管高温有利于淀粉酶发挥作用,但发酵时加入的淀粉酶是过量的,这种情况下影响单细胞蛋白产量的主要是菌体本身的温度偏好。
2.2.3 初始pH对生产SCP的影响
pH值是发酵过程中的关键参数之一。餐厨垃圾在贮存和运输过程中,环境中的乳酸菌会在其中定植、生长、发酵,产生乳酸、乙酸等酸性物质,使得pH值自然降低。
用乳酸将餐厨垃圾的初始pH值分别调到2.2、3.2、4.2、5.2,不加碳酸钙进行发酵,结果如图1-c所示,初始pH 5.2且不加碳酸钙的条件下发酵时,不会影响单细胞蛋白的产量。初始pH 2.2(图中未显示)的发酵情况较为特殊,发酵结束后,餐厨垃圾的状态发生变化,由渣状固体变为细腻的脂状固体,且烘干后仅剩少量固体。推测可能是pH过低,菌体无法生长,且淀粉酶的结构被不可逆地破坏,导致发酵过程被抑制。
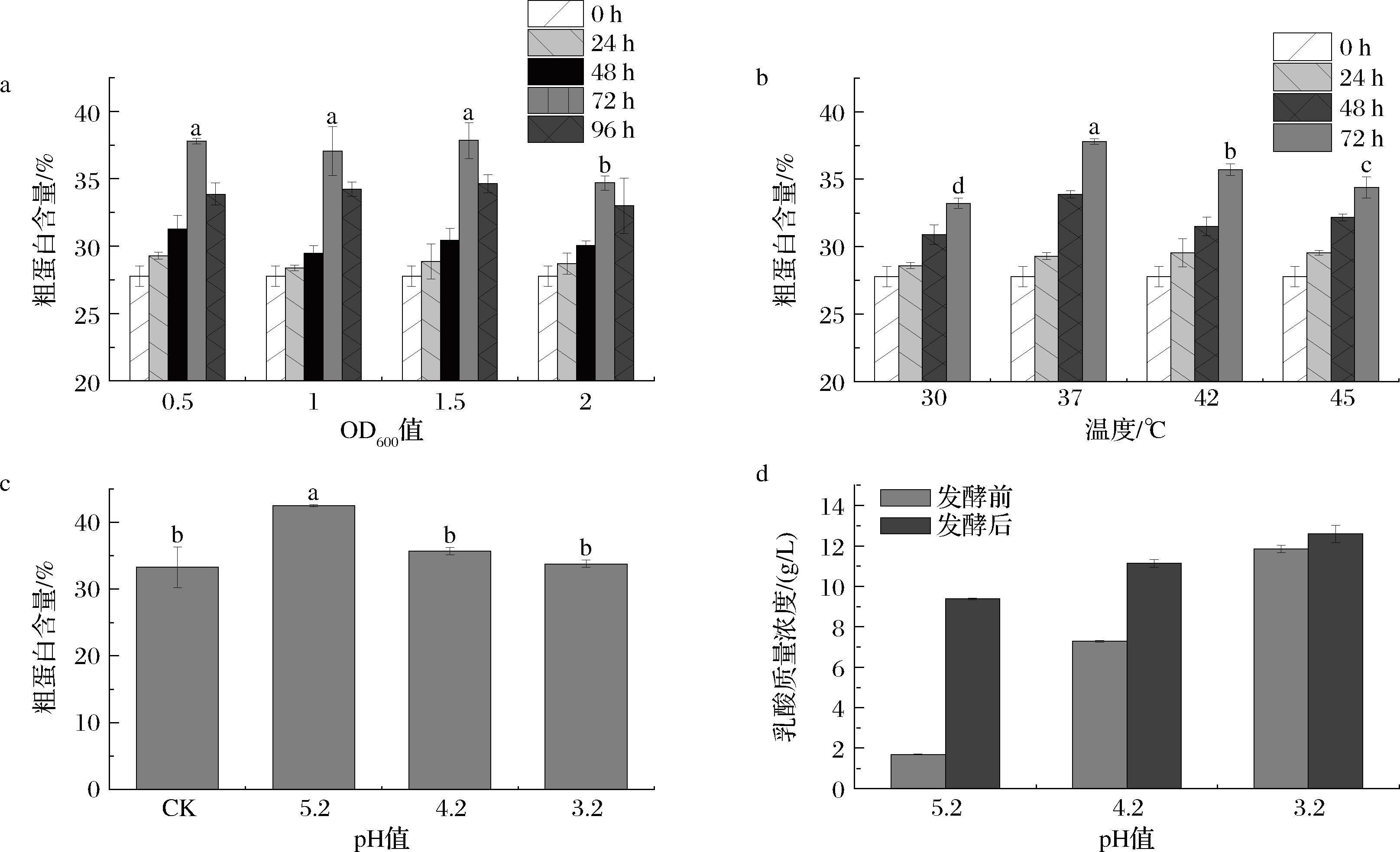
a-接种量;b-发酵温度;c-初始pH(粗蛋白含量);d-初始pH(乳酸质量浓度)
图1 发酵条件对乳酸片球菌C33产SCP的影响
Fig.1 Effect of fermentation conditions on SCP production by Pediococcus acidilactici C33
综合上述单因素实验的结果,以1 mL OD600值为0.5的种子液接种发酵,发酵温度37 ℃,发酵时间72 h,初始pH 5.2~6.2时,发酵效果最好。在最优条件下发酵,粗蛋白含量达到37.79%,比发酵前增加了10.01个百分点,表明乳酸片球菌能有效生产单细胞蛋白。研究人员尝试通过两阶段发酵提高解脂耶氏酵母从餐厨垃圾生产SCP的产量,结果表明,两阶段发酵后SCP的产量从24.2%(质量分数)生物质干重(BDW)增加到38.8%(质量分数) BDW[14]。尽管该研究得到的粗蛋白含量高于本研究的结果,可能是因为酵母细胞本身蛋白含量比乳酸片球菌高,但本研究发酵时间较短,且可同步生产SCP和乳酸,在节约了发酵成本的同时增加经济价值,提高了经济可行性。
2.3 α-淀粉酶在重组乳酸片球菌C33中表达
将重组质粒pNW33N-amyE转入乳酸片球菌C33中后,以重组乳酸片球菌C33的基因组为模板进行PCR验证,琼脂糖凝胶电泳结果(图2)表明,α-淀粉酶已成功转入乳酸片球菌C33。淀粉水解圈结果(图3)表明,有2株转化子成功表达分泌了α-淀粉酶。
2.4 α-淀粉酶的酶活曲线
用YPS培养基(1%可溶性淀粉为唯一碳源)接种重组乳酸片球菌,测定酶活力曲线的结果如图4所示,24 h内α-淀粉酶活力增长得较快,48 h时达到最大值4.35 U/mL,之后,酶活力趋于稳定但略有下降,84~96 h时酶活力保持在4.17~4.22 U/mL。
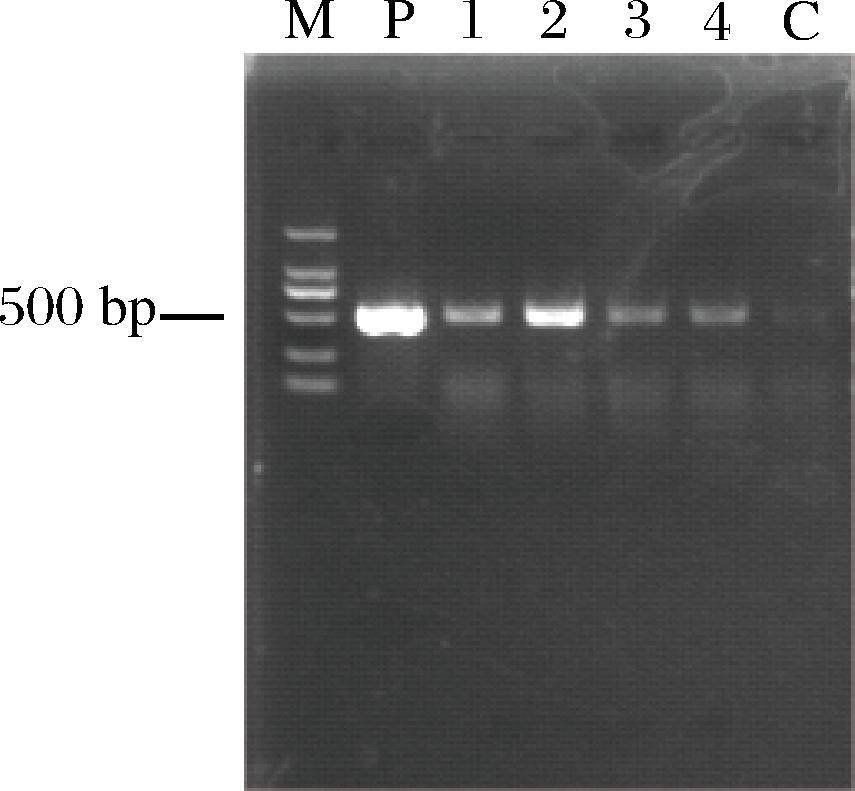
M-DNA Marker DL2000;P-阳性对照;泳道1~4-单菌落;C-阴性对照。
图2 重组乳酸片球菌PCR产物电泳图
Fig.2 Electrophoresis of PCR products of α-amylase from recombinant P.acidilactici
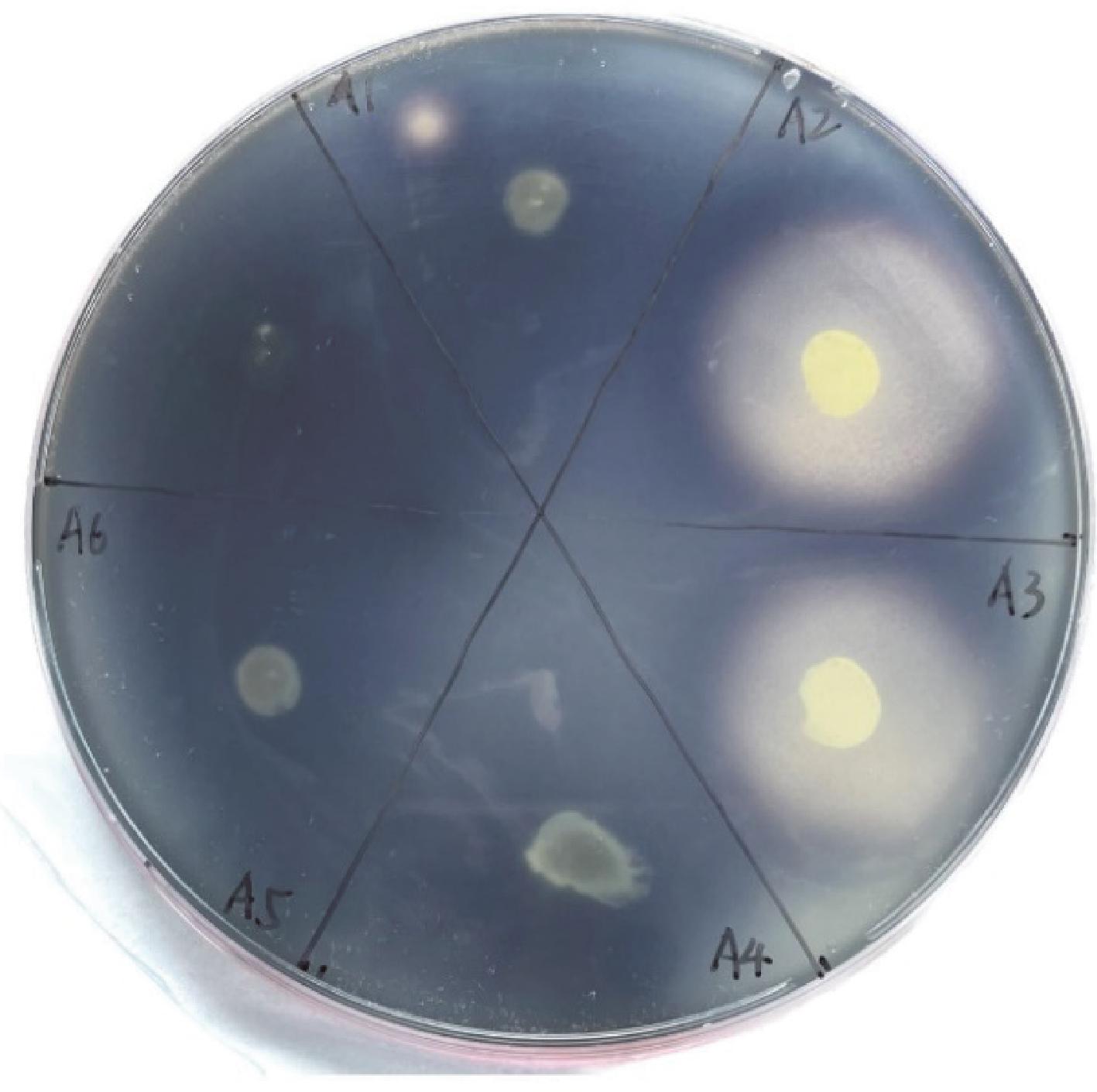
图3 重组乳酸片球菌C33-pamy淀粉水解圈
Fig.3 Transparent zone assay of recombinant P.acidilactici C33-pamy
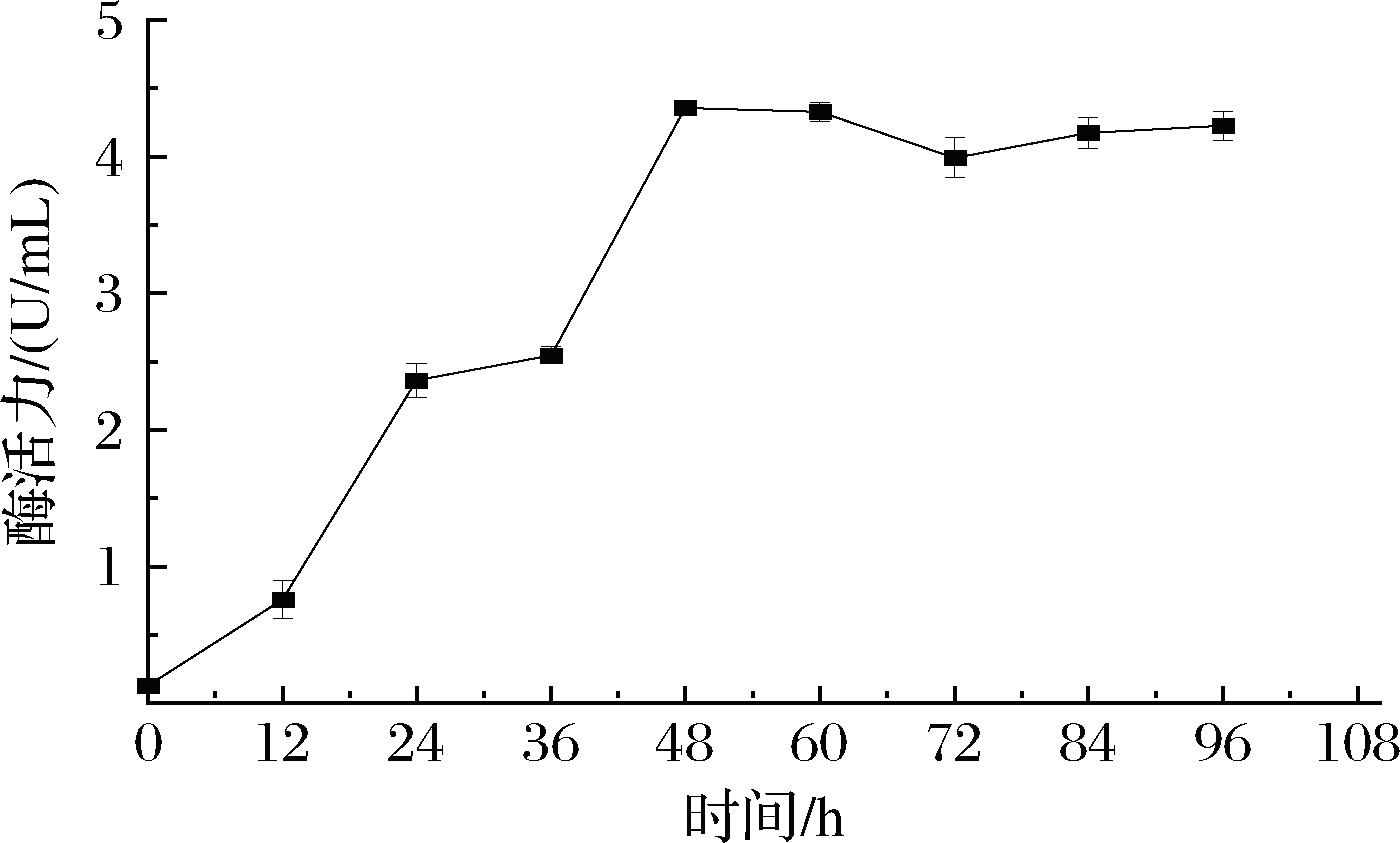
图4 C33-pamy菌株的酶活力曲线
Fig.4 Enzyme activity curve of C33-pamy strain
2.5 重组菌株发酵餐厨垃圾产SCP和乳酸
野生型乳酸片球菌C33(图5-a)只能利用餐厨垃圾中的游离糖,不能直接利用淀粉,乳酸的最高质量浓度为21.17 g/L,随后开始下降,可能转化成了少量乙酸。整个发酵过程中几乎没有检测到乙醇。该结果说明乳酸片球菌C33能适应餐厨垃圾中的高油环境,这种环境下可能更有利于其进行厌氧发酵,乳酸的转化率很高,是理论值的97.56%,且基本没有副产物产生。添加了商业化淀粉水解酶后(图5-b),糖没有被迅速消耗完,而是边消耗边积累,84 h时糖基本被消耗完,此时乳酸产量达到最大值42.94 g/L,产率达到了94.66%。重组菌株C33-pamy(图5-c)在发酵过程中存在糖的积累,乳酸含量在72 h达到最大值32.59 g/L,产率为71.85%,随后乳酸浓度略有下降。发酵结束后,没有乙酸但产生了少量乙醇。从图5-b和5-c的比较可以看出,二者的发酵情况较为相似,发酵过程中都存在一定的糖积累,说明重组菌株C33-pamy分泌的α-淀粉酶活力较高,足够在发酵过程中水解淀粉,但相较于添加商业化水解酶而言,由于没有糖化酶,由α-淀粉酶水解淀粉产生的部分糊精无法被彻底水解成葡萄糖而被乳酸片球菌利用,导致乳酸的产量和转化率降低。
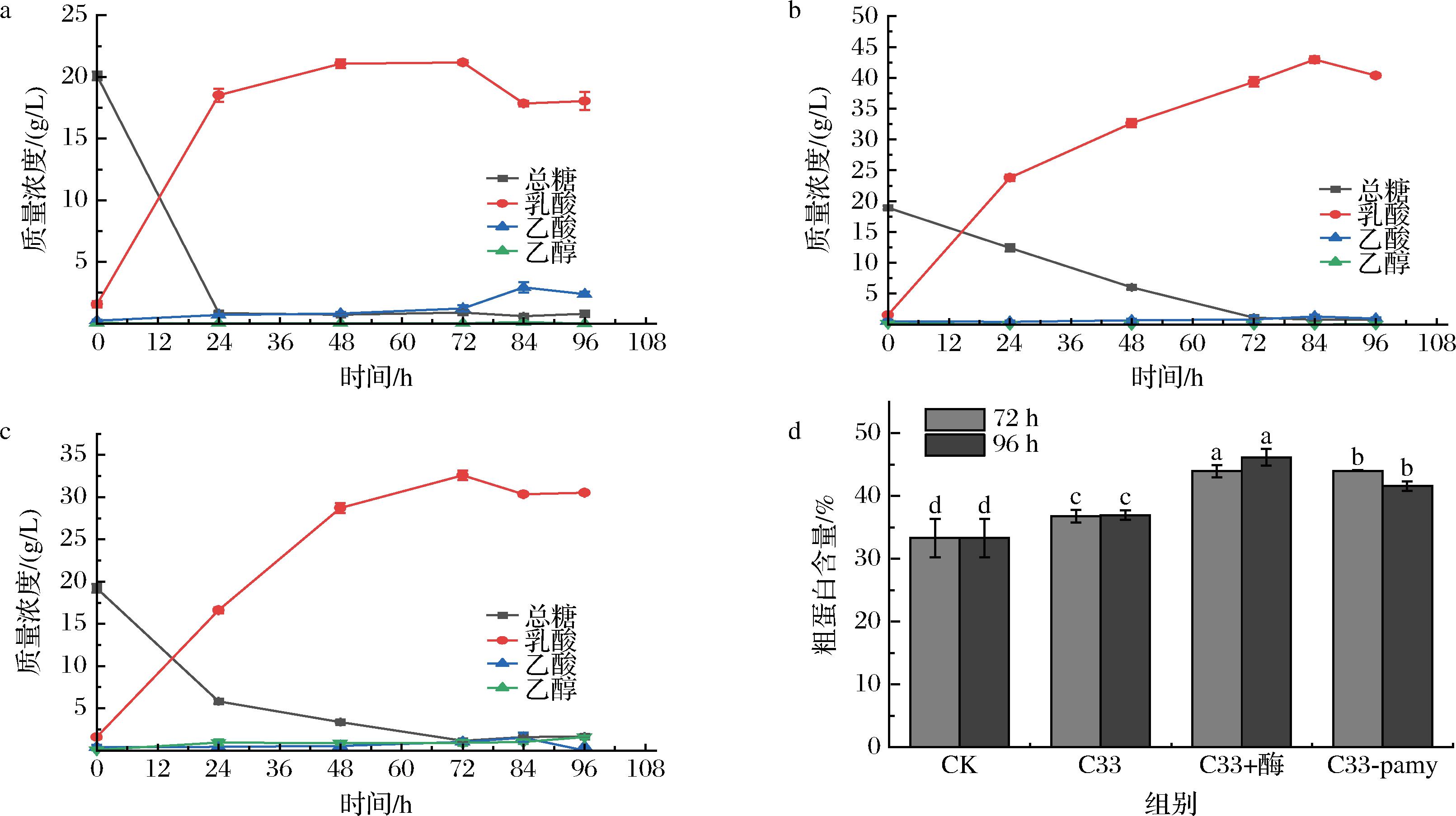
a-乳酸片球菌C33;b-C33+商业化淀粉酶;c-C33-pamy菌株;d-粗蛋白含量(CK为未发酵餐厨垃圾)
图5 乳酸片球菌C33餐厨垃圾发酵结果
Fig.5 Fermentation results of food waste by P.acidilactici
由于这3个组的乳酸含量在不同时间达到最大值,因此分别测定发酵72和96 h后固体中的粗蛋白含量,结果如图5-d所示。从图5-e可以看出,粗蛋白含量高的时间点也是乳酸产量最大的时间点,乳酸片球菌C33加商业化淀粉酶的组在96 h粗蛋白含量最高,为46.17%,比未发酵时的33.29%提高了12.88%;重组菌株C33-pamy在72 h时粗蛋白含量达到最大值44.00%,比未发酵时提高了10.71%,96 h后下降到41.59%,原因可能是发酵后期菌种逐渐退化、裂解,胞内蛋白释放到上清中,导致粗蛋白含量下降。野生型菌株不添加商业化淀粉酶的组在96 h粗蛋白含量最高,为36.96%,仅比未发酵时高3.68个百分点,单细胞蛋白的产量最低。
3 结论与讨论
微生物来源的α-淀粉酶的主要优点是工业规模生产成本较低、具有良好的稳定性和特异性,在食品加工、饲料、造纸和医药等行业有广泛的应用[20-22]。目前,芽孢杆菌属是工业用淀粉酶的重要来源,其中枯草芽孢杆菌、地衣芽孢杆菌和解淀粉芽孢杆菌是常见的用于生产α-淀粉酶的微生物菌株[23]。然而,国内外大多数研究将淀粉酶在大肠杆菌或酵母中实现异源表达[24-25],较少在乳酸菌进行异源表达。乳酸片球菌具有耐酸、耐高温、耐高浓度盐和乙醇环境、乳酸发酵性能优异等优点[26-28],且能作为微生物添加剂添加到动物饲料中,是一种理想的工业发酵底盘微生物。然而,乳酸片球菌C33不能直接利用淀粉,限制了其在餐厨垃圾资源化处理中的应用。
本文将枯草芽孢杆菌来源的α-淀粉酶在乳酸片球菌中实现分泌表达,酶活力最高可以达到4.35 U/mL。利用重组菌株以统合生物工艺方法发酵餐厨垃圾生产单细胞蛋白和乳酸,最高可产生32.59 g/L乳酸,产率为71.85%,粗蛋白含量为44.0%,比未发酵时提高了10.71%,表明这种生产工艺具有可行性。与添加商业化酶相比,重组菌株的乳酸产量降低了22.81%,可能与淀粉酶种类有关,淀粉糖化不够充分;粗蛋白含量仅下降了2.17%,表明一种淀粉酶水解的淀粉已经足够乳酸片球菌菌体生长。先前的研究显示,解脂耶氏酵母通过两阶段发酵能提高单细胞蛋白产量。第一阶段利用餐厨垃圾自带的微生物群进行厌氧发酵,产生挥发性脂肪酸,为微生物提供足够的能量,难降解有机物含量大大降低;第二阶段为解脂耶氏酵母利用厌氧发酵后的上清液生产单细胞蛋白,与一步发酵相比,单细胞蛋白的产量增加14.6%[14]。与本研究相比,粗蛋白含量稍高,但发酵周期长,产物单一,且餐厨垃圾剩余的固体部分需要进一步焚烧或填埋处理,容易造成环境污染。
综上所述,本实验构建的淀粉降解工程菌株具有较好的同步发酵生产SCP和乳酸的能力,可以利用不需要预处理的餐厨垃圾通过一步简单的厌氧发酵实现产酶、淀粉水解、单细胞蛋白生产以及乳酸发酵。该菌株在一定程度上解决了乳酸片球菌淀粉利用的问题,简化了操作,节约了成本,实现餐厨垃圾的资源化处理和利用。进一步的研究将涉及重组菌株在实际餐厨垃圾处理过程中的应用效果和稳定性,探究重组菌株大规模发酵效果。
[1] DENG Z X, DUARTE M E, KIM S Y, et al.Comparative effects of soy protein concentrate, enzyme-treated soybean meal, and fermented soybean meal replacing animal protein supplements in feeds on growth performance and intestinal health of nursery pigs[J].Journal of Animal Science and Biotechnology, 2023, 14(1):89.
[2] BADGETT A, MILBRANDT A.Food waste disposal and utilization in the United States:A spatial cost benefit analysis[J].Journal of Cleaner Production, 2021, 314:128057.
[3] PHAM T P T, KAUSHIK R, PARSHETTI G K, et al.Food waste-to-energy conversion technologies:Current status and future directions[J].Waste Management, 2015, 38:399-408.
[4] ZHU L F, CHENG K K.Enhanced biogas production efficiency of kitchen waste by anaerobic co-digestion and pretreatment[J].Biomass Conversion and Biorefinery, 2024, 14(20):24949-24962.
[5] HU Y Y, LIU S S, WANG X F, et al.Enhanced anaerobic digestion of kitchen waste at different solids content by alkali pretreatment and bentonite addition:Methane production enhancement and microbial mechanism[J].Bioresource Technology, 2023, 369:128369.
[6] SUHARTINI S, ROHMA N A, ELVILIANA, et al.Food waste to bioenergy:Current status and role in future circular economies in Indonesia[J].Energy, Ecology and Environment, 2022, 7(4):297-339.
[7] SAEED M, YASMIN I, MURTAZA M A, et al.Single cell proteins a novel value added food product[J].Pakistan Journal of Food Sciences, 2016, 26(4):211-217.
[8] ANUPAMA, RAVINDRA P.Value-added food:Single cell protein[J].Biotechnology Advances, 2000, 18(6):459-479.
[9] GAO L M, CHI Z M, SHENG J, et al.Single-cell protein production from Jerusalem artichoke extract by a recently isolated marine yeast Cryptococcus aureus G7a and its nutritive analysis[J].Applied Microbiology and Biotechnology, 2007, 77(4):825-832.
[10] NYYSSÖL A, SUHONEN A, RITALA A, et al.The role of single cell protein in cellular agriculture[J].Current Opinion in Biotechnology, 2022, 75:102686.
A, SUHONEN A, RITALA A, et al.The role of single cell protein in cellular agriculture[J].Current Opinion in Biotechnology, 2022, 75:102686.
[11] GAO Y R, LI D P, LIU Y.Production of single cell protein from soy molasses using Candida tropicalis[J].Annals of Microbiology, 2012, 62(3):1165-1172.
[12] YUNUS F U N, NADEEM M, RASHID F.Single-cell protein production through microbial conversion of lignocellulosic residue (wheat bran) for animal feed[J].Journal of the Institute of Brewing, 2015, 121(4):553-557.
[13] GERVASI T, PELLIZZERI V, CALABRESE G, et al.Production of single cell protein (SCP) from food and agricultural waste by using Saccharomyces cerevisiae[J].Natural Product Research, 2018, 32(6):648-653.
[14] YANG R, CHEN Z, HU P, et al.Two-stage fermentation enhanced single-cell protein production by Yarrowia lipolytica from food waste[J].Bioresource Technology, 2022, 361:127677.
[15] 雷森林.毕赤酵母发酵餐厨垃圾生产乳酸的统合生物工艺研究[D].广州:暨南大学, 2018.
LEI S L.Consolidated bioprocessing study of lactic acid production from kitchen waste by recombinant Pichia pastoris[D].Guangzhou:Jinan University, 2018.
[16] QIU Z Y, GAO Q Q, BAO J.Constructing xylose-assimilating pathways in Pediococcus acidilactici for high titer D-lactic acid fermentation from corn stover feedstock[J].Bioresource Technology, 2017, 245:1369-1376.
[17] 文狄, 褚丹维, 罗绍娇, 等.土壤中产高活性淀粉酶细菌的分离与纯化[J].安徽农业科学, 2018, 46(27):6-9, 41.
WEN D, CHU D W, LUO S J, et al.Isolation and purification of bacteria producing highly active amylase in soil[J].Journal of Anhui Agricultural Sciences, 2018, 46(27):6-9, 41.
[18] 张永帅, 孙俊良, 梁新红, 等.测定枯草芽孢杆菌生产中温α-淀粉酶方法的研究[J].农产品加工(学刊), 2014(15):1-4;7.
ZHANG Y S, SUN J L, LIANG X H, et al.Determination methods of medium temperature α-amylase of Bacillus subtilis[J].Academic Periodical of Farm Products Processing, 2014(15):1-4;7.
[19] 潘丽爱, 张贵林, 石晶, 等.餐厨垃圾特性的试验研究[J].粮油加工, 2009(9):154-156.
PAN L A, ZHANG G L, SHI J, et al.Experimental study on characteristics of kitchen waste[J].Cereals and Oils Processing, 2009(9):154-156.
[20] ABD-ELAZIZ A M, KARAM E A, GHANEM S M, et al.Production of a novel α-amylase by Bacillus atrophaeus NRC1 isolated from honey:Purification and characterization[J].International Journal of Biological Macromolecules, 2020, 148:292-301.
[21] EL-KADY E M, ASKER M S, HASSANEIN M, et al.Optimization, production, and partial purification of thermostable α-amylase produced by marine bacterium Bacillus sp.NRC12017 [J].International Journal of Pharmaceutical and Clinical Research, 2017, 9(8):558-570.
[22] GUPTA R, GIGRAS P, MOHAPATRA H, et al.Microbial α-amylases:A biotechnological perspective[J].Process Biochemistry, 2003, 38(11):1599-1616.
[23] 张慧. 高温菌株生理生化及有机物降解性质研究[D].上海:华东师范大学, 2010.
ZHANG H.Physiological, biochemical characteristics and degradation properties of thermophilic bacteria[D].Shanghai:East China Normal University, 2010.
[24] YANG S H, JIA N B, LI M G, et al.Heterologous expression and efficient ethanol production of a Rhizopus glucoamylase gene in Saccharomyces cerevisiae[J].Molecular Biology Reports, 2011, 38(1):59-64.
[25] SANCHEZ A C, RAVANAL M C, ANDREWS B A, et al.Heterologous expression and biochemical characterization of a novel cold-active α-amylase from the Antarctic bacteria Pseudoalteromonas sp.2-3[J].Protein Expression and Purification, 2019, 155:78-85.
[26] PARK G S, HONG S J, JUNG B K, et al.Whole genome sequence of lactic acid bacterium Pediococcus acidilactici strain S1[J].Brazilian Journal of Microbiology, 2017, 48(3):395-396.
[27] QURESHI A S, ZHANG J, DA COSTA SOUSA L, et al.Antibacterial peptide secreted by Pediococcus acidilactici enables efficient cellulosic open L-lactic acid fermentation[J].ACS Sustainable Chemistry &Engineering, 2017, 5(10):9254-9262.
[28] BOSMA E F, FORSTER J, NIELSEN A T.Lactobacilli and pediococci as versatile cell factories-Evaluation of strain properties and genetic tools[J].Biotechnology Advances, 2017, 35(4):419-442.