百菌清(chlorothalonil)别名2,4,5,6-四氯-1,3-苯二甲腈,于1966年由美国公司研发出的一种有机氯杀菌剂[1-2]。目前普遍被用来防治水果、蔬菜、水稻、小麦、茶叶、豆类等作物的病害[3],同时也是世界范围内使用最广泛的杀菌剂之一[4]。研究表明,百菌清不仅可以改变土壤微生物活性[5],对鱼类及其他水生生物也有很强的毒性[6]。4-羟基-2,5,6-三氯异二苯腈 (4-hydroxy-2,5,6-trichloroisophthalonitrile,简称4-羟基百菌清) 是百菌清最主要的代谢产物,其吸附性强、水溶性较高、急性毒性更强,对水体和土壤更易造成污染,通过生物富集和一定的食物链作用于水生生物及相关植物,并最终转移至家禽家畜等动物和人体,严重威胁生态环境与人类健康[6-9]。KRAIS等[2]对1 808名来自瑞典和393名来自哥斯达黎加从事农业生产的孕妇血清样本进行检测,结果所有样本中均检出4-羟基百菌清。我国是农业生产大国,关于百菌清及其代谢物4-羟基百菌清暴露问题更是不容忽视。近年来欧盟、加拿大、新西兰、巴西等国家已将百菌清列入禁用或限制使用名单[10]。新版国家标准GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》明确规定植物源性食品中百菌清残留物为百菌清,动物源性食品中的残留物为4-羟基百菌清,且新增了禽肉类、禽类内脏、哺乳动物肉类、哺乳动物内脏、哺乳动物脂肪、生乳、禽类脂肪七类动物源性食品中4羟基百菌清的临时限量,但该标准中暂无关于动物源性食品中4-羟基百菌清的测定方法。猪肉、牛肉等动物源性食品是许多家庭日常餐桌不可或缺的食材,因此关注动物源性食品中4-羟基百菌清残留意义重大。
目前,国内外关于食品中4-羟基百菌清的检测方法主要有液相色谱法[11-13]、液相色谱-串联质谱法[2,14-18]。这些检测方法主要集中在果蔬类基质[13-15,18]、蔬菜及土壤基质[12,17]、中药材三七基质[16]以及人的血清基质[2],对于动物源性食品基质研究鲜见报道。仅有陈美君等[11]采用高效液相色谱检测鸡胗中百菌清及4-羟基百菌清残留量,该方法的研究对象仅为鸡胗,基质单一,适用范围较窄;其次,该方法4-羟基百菌清定量限为0.02 mg/kg,对于GB 2763—2021中规定禽肉类及禽类脂肪类4-羟基百菌清的临时限量为0.01 mg/kg,该方法难以满足新版国家标准的要求。因此,建立快速、高效、适用于多种动物源性食品基质中4-羟基百菌清残留量的检测方法势在必行。
近年来,超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)以其高灵敏度、高准确度、抗干扰性强、分析时间短、适用范围广等优势,被广泛应用于动物源性食品中各种组分分析测定[19-22]。该研究以猪肉、牛肉、羊肉、鸡肉、鸡皮、猪腰、猪油、鸡肝、牛奶为研究对象,全覆盖新版国家标准动物源性食品7个类别,通过对仪器条件和前处理方法进行优化,建立UPLC-MS/MS测定动物源性食品中4-羟基百菌清残留量的分析方法。该方法快速、高效、准确,可以为动物源性食品中4-羟基百菌清的残留量检测提供技术支持,也可为后续开展4-羟基百菌清在动物源性食品中代谢规律研究奠定基础。
1 材料与方法
1.1 材料与试剂
4-羟基百菌清(纯度97.60%,上海安谱璀世标准技术服务有限公司);正己烷、乙腈(色谱纯,上海安谱实验科技股份有限公司);无水硫酸钠、乙酸(分析纯,国药集团化学试剂有限公司);中性氧化铝萃取柱(500 mg/6 mL),天津博纳艾杰尔科技有限公司;猪肉、猪腰、猪油、牛肉、鸡肝、鸡肉、鸡皮、羊肉、纯牛奶,市售。
1.2 仪器与设备
LCMS-8050型三重四极杆液相色谱质谱联用仪,日本岛津公司;BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),美国Waters公司;S225D-1CN型十万分之一电子天平,德国赛多利斯集团;3H16RI型智能高速冷冻离心机,湖南赫西仪器装备有限公司;KB-5010型离心管振荡器,江苏海门市其林贝尔仪器有限公司;TurboVapLV型氮吹浓缩装置,瑞典Biotage公司。
1.3 实验方法
1.3.1 标准溶液的配制
标准贮备液:称取适量标准品,用色谱纯乙腈溶解、定容于10 mL棕色容量瓶中,配制成约100.0 mg/L的4-羟基百菌清标准贮备液,-18 ℃密封保存。
标准中间液:移取适量上述贮备液于棕色容量瓶中,用色谱纯乙腈定容,配制成1.0 mg/L的标准中间液,现用现配。
标准工作溶液:取一定量的标准中间液,用80%(体积分数)乙腈水溶液稀释成标准系列工作曲线溶液,待测。
1.3.2 样品前处理
准确称取2 g(精确至0.01 g)制备均匀的样品,于50 mL离心管中,加入15 mL 1%乙酸的乙腈溶液、5 g无水硫酸钠,涡旋混匀,振荡提取15 min,4 200 r/min离心5 min,收集提取液;残渣继续加入15 mL 1%乙酸的乙腈溶液,振荡提取15 min,离心,合并提取液,于40 ℃氮吹浓缩至约2 mL,待净化。
用6 mL乙腈活化中性氧化铝柱,待活化完成,上样(控制流速为1 mL/min),再用6 mL乙腈分2次洗脱中性氧化铝柱,收集流出液,于40 ℃氮吹至干,加入1 mL 80%乙腈水溶解残渣,用1 mL正己烷(乙腈饱和的)脱脂1次,4 200 r/min离心5 min,过0.22 μm有机滤膜后,供UPLC-MS/MS测定。
1.3.3 色谱和质谱条件
液相色谱条件:Waters BEH C18色谱柱(内径2.1 mm,柱长100 mm,粒径1.7 μm);流速设置为0.3 mL/min;流动相分别是1.0 mmol/L乙酸铵水溶液(A)和色谱纯甲醇(B)。梯度洗脱条件:0~1.00 min,20% B;1.00~1.50 min,20%B~95% B;1.50~7.00 min,95% B;7.00~7.50,95% B~20% B;7.50~12.00 min,20% B。柱温:40 ℃;进样体积:1 μL。
质谱条件:电喷雾电离(ESI)源;负离子扫描;多反应监测(multiple reaction monitoring, MRM)模式;电晕针电压3 000 V;雾化气、干燥气流速分别为3 L/min、10 L/min;加热块、接口、脱溶剂管温度分别设置为400、300、526 ℃;碰撞气压力设置为 2.7×105 Pa;保留时间、定性定量离子对、预杆偏置电压及碰撞能量见表1。
表1 4-羟基百菌清的质谱参数
Table 1 Mass spectrum parameters of 4-hydroxychlorothalonil

化合物保留时间/min母离子(m/z)子离子(m/z)预杆Q1偏置电压/V碰撞能量/V预杆Q3偏置电压/V4-羟基百菌清3.733245.0182.0∗30.026.018.0147.111.037.014.0
注:*定量离子。
1.3.4 基质效应的考察
分别用经前处理过的猪肉、牛肉、羊肉等9种阴性基质溶液和溶剂配制系列标准曲线,并按公式(1)对基质效应(matrix effect,简称ME)进行评价。ME为正或负值时分别表示基质增强或基质抑制效应。
(1)
式中:ME为基质效应;k2为基质匹配标准曲线的斜率;k1为溶剂标准曲线的斜率。
1.4 数据处理
岛津LCMS-8050配有LabSolutions数据处理软件,可以建立标准曲线及计算结果,采用WPS Excel进行数据处理及图表绘制。色谱图为OriginPro 8.5软件绘制。
2 结果与分析
2.1 色谱条件的优化
本研究分别比较了甲醇-水、乙腈-水作为流动相时的分离效果。结果见图1,2种体系下,目标物的响应均较好;甲醇流动相体系下,4-羟基百菌清的峰宽更小,峰形更好,因此本研究选择甲醇作有机相。另外,在水中加入1 mmol/L乙酸铵后,4-羟基百菌清的峰宽更小,峰形更尖锐,此时目标物的响应强度约为乙腈-水体系时的31%,正好可以避免后续高水平添加时响应过载;进一步增加乙酸铵的浓度(5.0、10.0 mmol/L)对4-羟基百菌清的峰形影响不大,目标物的响应反而略有降低。这主要是因为![]() 的加入可以与其他化合物竞争结合色谱柱填料中的硅羟基,从而改善峰形;继续增加
的加入可以与其他化合物竞争结合色谱柱填料中的硅羟基,从而改善峰形;继续增加![]() 的浓度,可能产生离子抑制效应。综合考虑,本研究选取甲醇-1 mmol/L乙酸铵水溶液作为最终的流动相。
的浓度,可能产生离子抑制效应。综合考虑,本研究选取甲醇-1 mmol/L乙酸铵水溶液作为最终的流动相。
2.2 质谱条件的优化
采用直接进样方式扫描4-羟基百菌清,检测到一个母离子m/z 245。对4-羟基百菌清进行二级质谱扫描,得到4个碎片离子峰m/z 210.0、182.0、175.1、147.1。根据4-羟基百菌清的相对分子质量以及各碎片离子的质荷比可以推测上述4个离子峰可能为m/z 245分别失去1个Cl原子、1个Cl原子+1个羰基、2个Cl原子、2个Cl原子+1个羰基后的碎片离子。本研究以m/z 245为母离子,选取二级谱图中相对丰度较高的2对子离子m/z 147.1、182.0为定性离子,对四级杆预杆偏置电压(Q1、Q3)、碰撞能量等进行优化,优化后的质谱参数见表1,图2为优化条件下4-羟基百菌清的多反应监测色谱图。
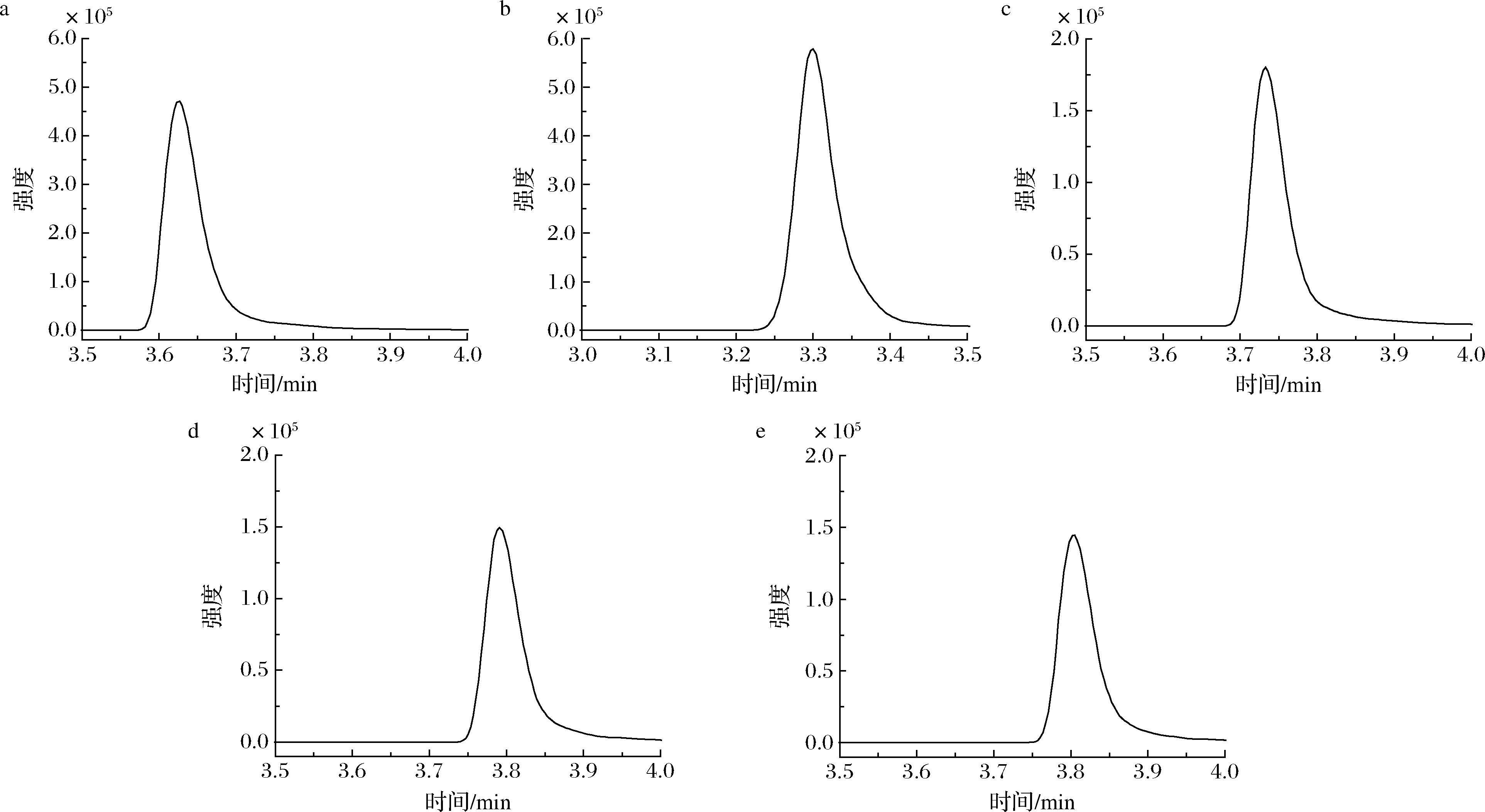
a-甲醇-水;b-乙腈-水;c-甲醇-1 mmol/L乙酸铵水溶液;d-甲醇-5 mmol/L乙酸铵水溶液;e-甲醇-10 mmol/L乙酸铵水溶液
图1 不同流动相体系下4-羟基百菌清标准溶液(0.1 mg/L)总离子流图
Fig.1 Total ion flow diagram of 4-hydroxychlorothalonil standard solution (0.1 mg/L) in different mobile phase systems
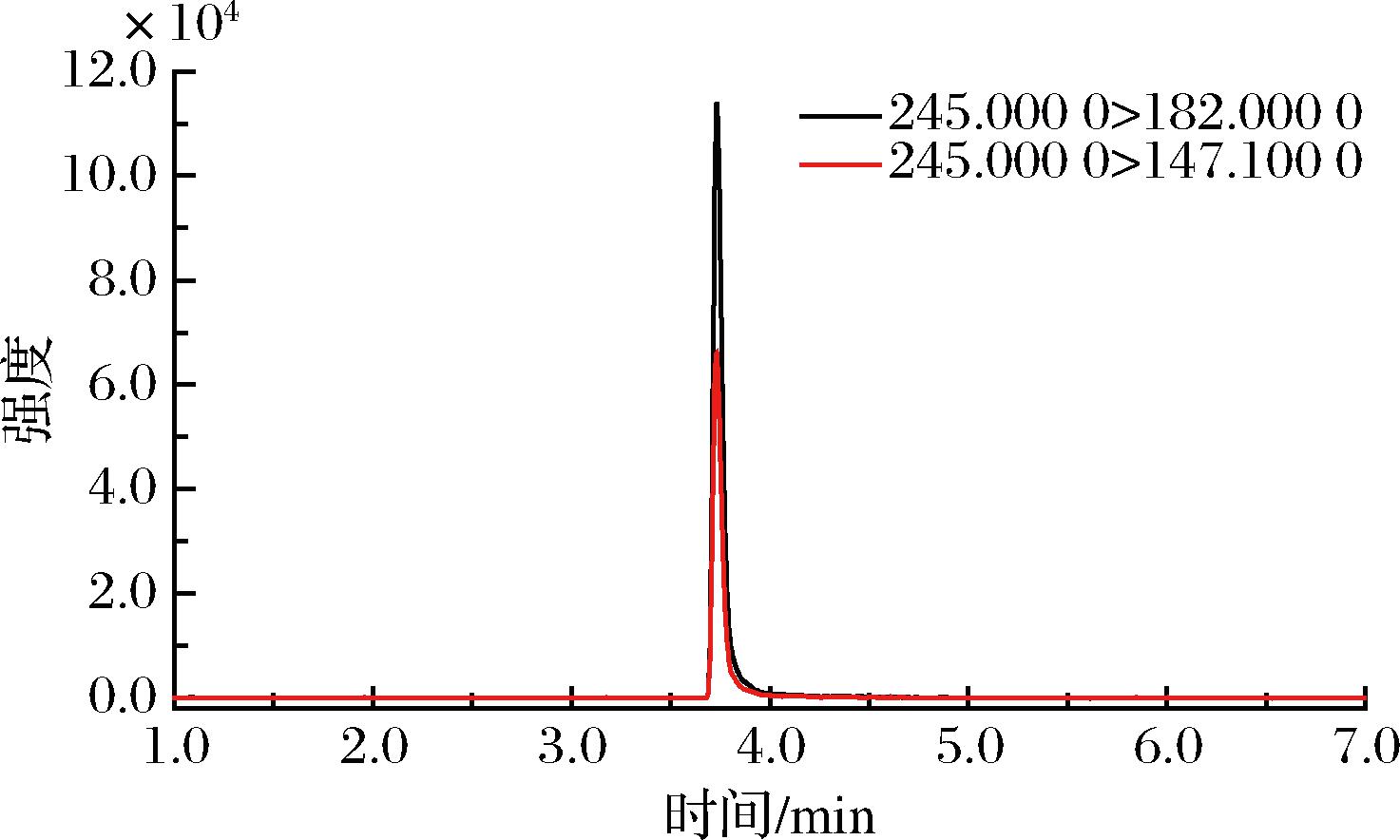
图2 4-羟基百菌清标准溶液(0.1 mg/L)的MRM色谱图
Fig.2 MRM chromatogram of 4-hydroxychlorothalonil standard solution (0.1 mg/L)
2.3 前处理条件的优化
2.3.1 提取溶剂的选择
以猪肉基质为研究对象,本研究对比了甲醇、乙腈、1%乙酸乙腈、乙酸乙酯四种提取溶剂对4-羟基百菌清提取效率的影响。结果如图3所示,乙腈与1%乙酸乙腈对4-羟基百菌清的提取效率较好,均超过了95%,甲醇、乙酸乙酯的提取效率次之。这主要是因为4-羟基百菌清为极性,对比甲醇和乙酸乙酯,乙腈极性最大而且穿透性强,因此提取效果好。因加入1%乙酸,有助于沉淀样品中的蛋白质,净化样品,所以选择1%乙酸乙腈溶液为最终提取溶剂。
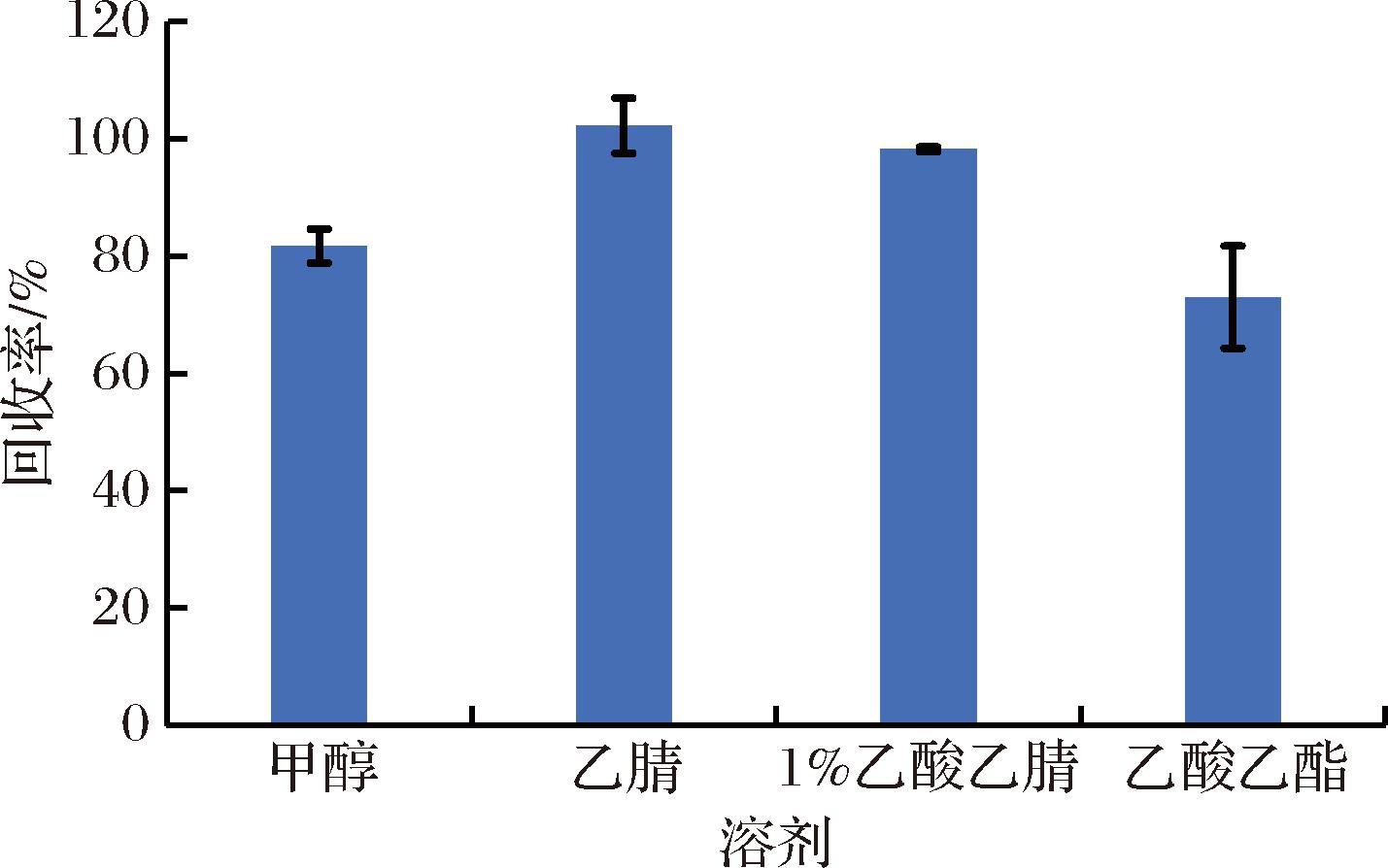
图3 不同提取溶剂对4-羟基百菌清提取效率的影响
Fig.3 Influence of different extraction solvents on the extraction efficiency of 4-hydroxychlorothalonil
2.3.2 净化方式的优化
由于动物源性食品基质复杂、种类多、干扰物(蛋白质、脂肪、有机酸、糖原、胆固醇等杂质)多,SPE法能有效去除样品中的杂质,减少仪器污染,便于目标化合物准确定量,因此,本研究选择固相萃取法作为前处理方法。动物源性食品净化常用的固相萃取柱有中性氧化铝萃取柱、C18柱、HLB 固相萃取柱等。以猪肉样品为研究对象,本研究比较了Cleanert Alumina N中性氧化铝萃取柱(填料500 mg,柱容量6 mL)、弗罗里硅土固相萃取柱(填料500 mg,柱容量6 mL)、HLB 固相萃取柱(200 mg/6 mL)、MCX(混合强阳离子)固相萃取柱(500 mg/6 mL)、C18柱(500 mg/6 mL)5款固相萃取柱在4-羟基百菌清加标质量浓度是0.02 mg/kg时的净化效果和回收率。结果显示,中性氧化铝萃取柱回收最好,达到84.2%,弗罗里硅土柱回收次之83.1%,其他3款固相萃取柱回收极低甚至无回收。这可能是因为4-羟基百菌清本身不易被洗脱,牢牢吸附在萃取柱上,所以回收极低。因此,研究最终选择Cleanert Alumina N中性氧化铝萃取柱(500 mg/6 mL)进行净化。
2.3.3 复溶溶剂的选择
为了比较不同浓度的复溶溶剂对4-羟基百菌清回收率的影响,本研究分别用40%、60%、80%乙腈水及纯乙腈溶解氮吹后样品。研究发现,40%、60%乙腈水复溶时会发生分层,可能是前处理过程中分离不完全的无水硫酸钠在复溶液水相比例较高时溶于水发生盐析,造成实际溶解目标物的体积偏小,因此回收率偏高;80%乙腈水、纯乙腈溶解后溶液均透明,无分层现象,但纯乙腈溶解时,其回收率及锋形均不如80%乙腈水,这可能是纯乙腈溶解性太好,前处理过程中净化不彻底的蛋白质、糖原等内源性杂质同样被溶解,对目标物的分析产生一定干扰。因此研究最终选择80%乙腈水作为复溶溶剂,此时4-羟基百菌清的回收率与峰形均最好。
2.4 基质效应
在质谱分析中,不得不考察基质效应。结果如图4 所示,除猪肉、牛肉外,羊肉、牛奶等其他基质对4-羟基百菌清均有不同程度的抑制效应,其中鸡肝的抑制作用最强,达到-10.9%。这可能是因为鸡肝中比其他基质含有更丰富的蛋白质、有机酸、胆固醇、糖原等内源性物质,这些物质会与4-羟基百菌清在离子源端竞争离子化。9种基质中4-羟基百菌清基质效应均小于11%,为弱基质效应。因此,本研究定量时配制溶剂标准工作溶液即可。
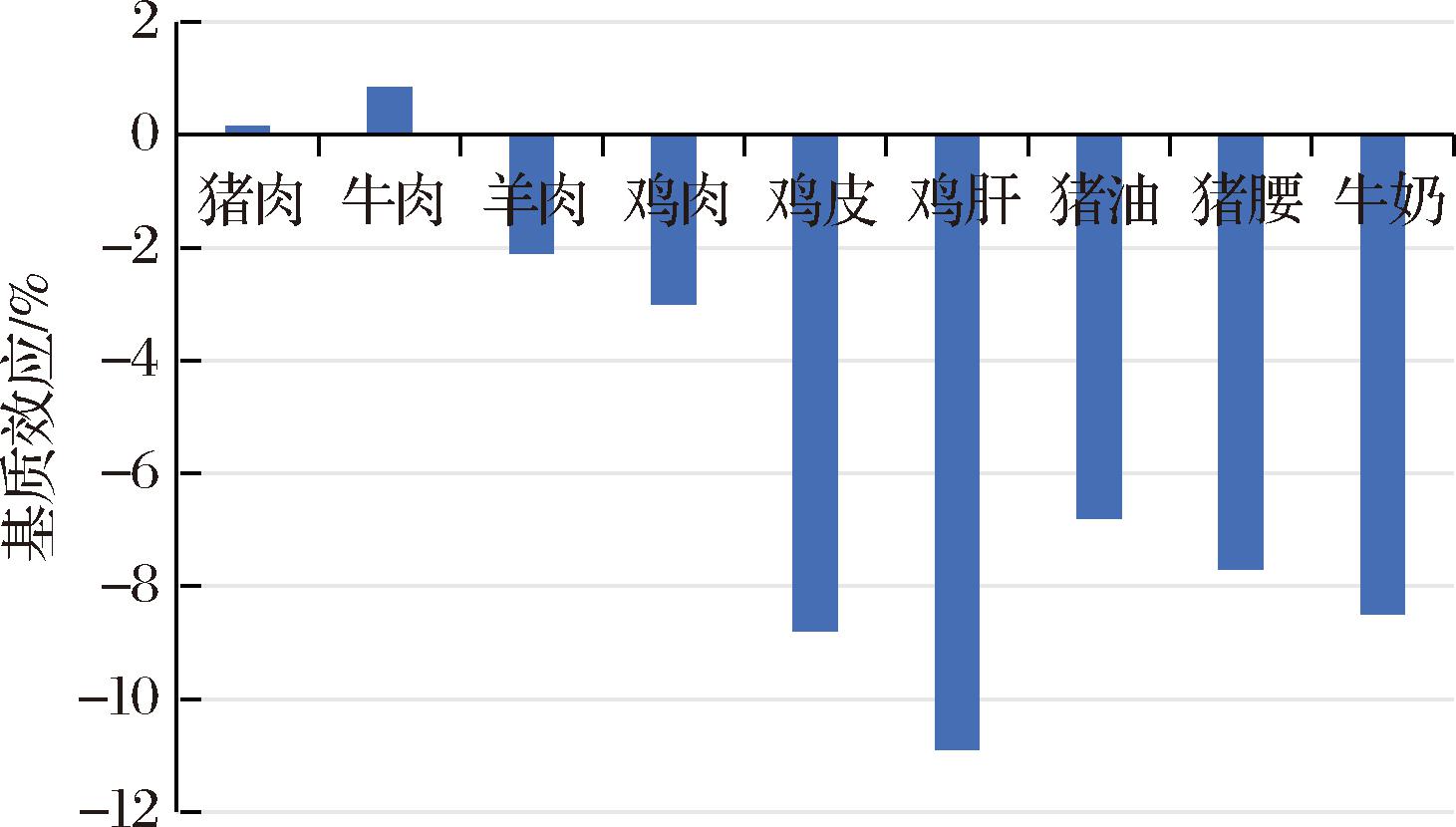
图4 4-羟基百菌清在9种动物源性食品中的基质效应
Fig.4 Matrix effects of 4-hydroxychlorothalonil in 9 animal-derived foods
2.5 方法学验证
2.5.1 线性范围与定量限
用80%乙腈水配制浓度分别为5.0、10.0、20.0、40.0、50.0、100.0、200.0、500.0 μg/L的系列标准溶液,以色谱峰的峰面积对4-羟基百菌清的质量浓度绘制标准曲线,其线性方程为y=3 740.23x+19 364.9,相关系数(r2)为0.999 4。结果显示,4-羟基百菌清在5~500 μg/L线性范围内相关性很好。
在阴性样品中添加4-羟基百菌清标准溶液,以10倍信噪比结合回收率和精密度确定方法的定量限,得到4-羟基百菌清的定量限为0.005 mg/kg。与陈美君等[11]、毕瑞锋等[14]、李文希等[16]方法相比,本研究方法灵敏度更高,且满足新版国家标准GB 2763—2021中规定禽肉类及禽类脂肪类4-羟基百菌清临时限量为0.01 mg/kg的检测要求。
2.5.2 准确度与精密度
选取猪肉、猪腰、牛奶等9种阴性样品,依据标准GB/T 27404—2008《实验室质量控制规范 食品理化检测》附录F中关于回收率三水平选取要求以及GB 2763—2021中每种样品4-羟基百菌清临时限量的不同,依次加入适量的4-羟基百菌清标准溶液,分别进行低、中、高3水平6平行加标回收试验。具体结果如表2所示,在猪肉、牛肉等9种基质中,4-羟基百菌清平均回收率为76.9%~104.7%,相对标准偏差为0.6%~4.6%,该研究回收率和精密度均符合标准GB/T 27404—2008要求。与陈美君等[11]方法对比,本研究基质全覆盖新版国家标准GB 2763—2021关于4-羟基百菌清动物源性食品所有类别,适用范围广;与李文希等[16]方法相比,本研究中4-羟基百菌清平均回收率更高,稳定性更好。本研究表明该研究方法适用于动物源性食品中4-羟基百菌清残留量的定量分析。
表2 9种基质中4-羟基百菌清平均回收率及精密度(n=6)
Table 2 Average recovery and precision of 4-hydroxychlorothalonil in 9 substrates (n=6)

基质加标水平/(mg/kg)回收率/%精密度/%低中高低中高低中高猪肉0.0050.010.0297.499.598.54.61.53.0牛肉0.0050.010.0295.392.292.54.12.23.9羊肉0.0050.010.02104.793.490.32.82.42.3鸡肉0.0050.010.0289.887.289.41.92.62.7鸡皮0.0050.010.0287.086.481.72.61.31.4鸡肝0.0050.030.0788.592.091.54.62.51.7猪油0.0050.030.0778.088.791.53.33.40.6猪腰0.0050.040.2079.591.785.73.01.72.7牛奶0.0050.030.0776.999.089.62.30.71.4
2.6 实际样品的检测
采用本研究方法,对市售的牛肉、猪肉、猪肝、猪腰、猪油、羊肉、鸡肉、鸡翅、鸡肝、鸡皮、牛奶共计36份样品进行4-羟基百菌清的残留检测。结果所有样品都没有检测出4-羟基百菌清。由于绝大部分样品购自湖南省内,表明该地区的动物源性食品中关于4-羟基百菌清的暴露问题暂时安全。杀菌剂百菌清首先作用于农作物,其代谢物4-羟基百菌清的残留可能需要后续跟踪研究。
3 结论
本研究建立了UPLC-MS/MS测定动物源性食品中4-羟基百菌清残留的方法。本方法操作简单,分析时间短,经过方法学验证,9种动物源性食品基质中4-羟基百菌清的平均回收率为76.9%~104.7%,相对标准偏差为0.6%~4.6%,该方法准确度高,稳定性好,通用性广。本研究可为动物源性食品中 4-羟基百菌清的残留检测提供技术手段,有助于对动物源性食品中4-羟基百菌清残留的市场监管。
[1] 刘庆菊,韩平,巩文雯,等.农产品中百菌清残留快速检测研究进展[J].食品科技,2018,43(6):306-311.
LIU Q J, HAN P, GONG W W, et al.Advances in rapid detection of chlorothalonil in agricultural products[J].Food Science and Technology, 2018,43(6):306-311.
[2] KRAIS A M, DE JOODE B V W, LILJEDAHL E R, et al.Correction to:Detection of the fungicide transformation product 4-hydroxychlorothalonil in serum of pregnant women from Sweden and Costa Rica[J].Journal of Exposure Science &Environmental Epidemiology, 2024, 34(2):386.
[3] VAN SCOY A R, TJEERDEMA R S.Environmental fate and toxicology of chlorothalonil[J].Reviews of Environmental Contamination and Toxicology, 2014, 232:89-105.
[4] QIAO W J, LIU G P, LI M Y, et al.Complete reductive dechlorination of 4-hydroxy-chlorothalonil by Dehalogenimonas populations[J].Environmental Science &Technology, 2022, 56(17):12237-12246.
[5] WU X W, YIN Y M, WANG S Y, et al.Accumulation of chlorothalonil and its metabolite, 4-hydroxychlorothalonil, in soil after repeated applications and its effects on soil microbial activities under greenhouse conditions[J].Environmental Science and Pollution Research, 2014, 21(5):3452-3459.
[6] 环境保护部. 国家污染物环境健康风险名录.化学第二分册[M].北京:中国环境科学出版社, 2011:28-33.
Ministry of Environmental Protection.The national catalogue of environmental health risks of pollutants:Chemistry part two[M].Beijing:China Environmental Science Press, 2011:28-33.
[7] 苏晓静. 4-羟基百菌清厌氧微生物还原脱氯功能菌群结构及宏基因组分析[D].南京:南京农业大学,2021.
SU X J.The anaerobic reductive dechlorination of 4-hydroxychlorothalonil and analysis of the associated functional microbial communities and metagenomics [D].Nanjing:Nanjing Agricultural University,2021.
[8] GAMBLE D S, LINDSAY E, BRUCCOLERI A G, et al.Chlorothalonil and its 4-hydroxy derivative in simple quartz sand soils:A comparison of sorption processes[J].Environmental Science &Technology, 2001, 35(11):2375-2380.
[9] B EZ M E, SARKAR B, PE
EZ M E, SARKAR B, PE A A, et al.Effect of surfactants on the sorption-desorption, degradation, and transport of chlorothalonil and hydroxy-chlorothalonil in agricultural soils[J].Environmental Pollution, 2023, 327:121545.
A A, et al.Effect of surfactants on the sorption-desorption, degradation, and transport of chlorothalonil and hydroxy-chlorothalonil in agricultural soils[J].Environmental Pollution, 2023, 327:121545.
[10] 申继忠,叶子雨.百菌清的禁限用与替代产品的选择[J].世界农药,2021,43(7):9-17;37.
SHEN J Z, YE Z Y.Chlorothalonil prohibition, restriction and alternative products[J].World Pesticide,2021,43(7):9-17;37.
[11] 陈美君, 左海根, 刘小玉, 等.鸡胗中百菌清及其代谢物残留量检测[J].安徽农业科学, 2022, 50(3):201-203;258.
CHEN M J, ZUO H G, LIU X Y, et al.Detection of chlorothalonil and its metabolite residues in gizzards[J].Journal of Anhui Agricultural Sciences, 2022, 50(3):201-203;258.
[12] 张钊溪. 百菌清及其代谢物在笋瓜及土壤中的残留动态研究[D].合肥:安徽农业大学,2018.
ZHANG Z X.Study on residue dynamics of chlorothalonil and its metabolites in cucurbita maxima duch.ex lam.andsoil[D].Hefei:Anhui Agricultural University,2018.
[13] 纪淑娟,郭乃菲,齐小辉,等.高效液相色谱法检测蔬菜中百菌清及其代谢产物的方法研究[J].食品工业科技,2011,32(7):397-399;402.
JI S J, GUO N F, QI X H, et al.Determination of chlorothalonil and its metabolite residues in vegetables by HPLC[J].Science and Technology of Food Industry,2011,32(7):397-399;402.
[14] 毕瑞锋,邓锁成,付萌,等.改进的QuEChERS-高效液相色谱-串联质谱法同时测定蔬菜水果中百菌清及其代谢物残留[J].农药学学报,2022,24(2):429-434.
BI R F, DENG S C, FU M, et al.Simultaneous determination of chlorothalonil and its metabolite in fruits and vegetables using modified QuEChERS-high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Pesticide Science, 2022,24(2):429-434.
[15] 李凌云,许晓敏,林桓,等.液相色谱-大气压化学电离串联质谱法测定蔬菜中百菌清残留[J].农产品质量与安全,2021,(1):56-59;66.
LI L Y, XU X M, LIN H, et al.Determination of chlorothalonil residues in vegetables by liquid chromatography-atmospheric pressure chemical ionization tandem mass spectrometry[J].Agricultural Product Quality and Safety,2021,(1):56-59;66.
[16] 李文希,浦恩堂,代雪芳,等.百菌清及其代谢物4-羟基百菌清在三七上的残留行为及膳食风险评估[J].农药学学报,2020,22(3):510-520.
LI W X, PU E T, DAI X F, et al.Residual behavior and dietary risk assessment of chlorothalonil and its metabolite 4-hydroxy chlorothalonil in Panax notoginseng[J].Chinese Journal of Pesticide Science,2020,22(3):510-520.
[17] 姚芳, 陈小微, 梁赤周, 等.百菌清及其代谢产物(4-羟基百菌清)在油麦菜及土壤中的残留降解研究[J].食品安全质量检测学报, 2018, 9(1):155-160.
YAO F, CHEN X W, LIANG C Z, et al.Research on the residue and degradation dynamic of chlorothalonil and its metabolite(4-hydroxy chlorothalonil) in Lactuca sativa and soil[J].Journal of Food Safety &Quality, 2018, 9(1):155-160.
[18] 吴成,任海雷,赵志强,等.液相色谱-串联质谱法测定甘蓝中4-羟基百菌清的残留量[J].化学分析计量,2016,25(6):71-74.
WU C, REN H L, ZHAO Z Q, et al.Determination of 4-hydroxychlorothalonil residues in cabbage by liquid chromatography-tandem mass spectrometry [J].Chemical Analysis and Meterage,2016,25(6):71-74.
[19] 冯丽凤,黄芊,叶梦薇,等.QuEChERS-超高效液相色谱-串联质谱法测定动物源性食品中30种抗寄生虫类药物残留[J].食品工业科技,2024,45(6):280-288.
FENG L F, HUANG Q, YE M W, et al.Determination of 30 kinds of antiparasitic drugs in animal-derived foods by QuEChERS-UPLC-MS/MS[J].Science and Technology of Food Industry,2024,45(6):280-288.
[20] 刘川,李佳佳,吴雪莹,等.通过式固相萃取-超高效液相色谱-串联质谱法测定动物源性食品中30种食源性兴奋剂[J].食品科学,2024,45(4):289-299.
LIU C, LI J J, WU X Y, et al.Simultaneous determination of 30 foodborne stimulant drug residues in animal-derived foods by ultra-high performance liquid chromatography-tandem mass spectrometry with pass-through solid phase extraction[J].Food Science,2024,45(4):289-299.
[21] 唐韵熙, 白亚敏, 刘露露, 等.超高效液相色谱—串联质谱法同时测定动物源性食品中21种全氟类化合物残留[J].食品与机械, 2023, 39(7):29-39.
TANG Y X, BAI Y M, LIU L L, et al.Simultaneous determination of 21 perfluorinated compounds in animal-derived food by UPLC-MS/MS[J].Food &Machinery, 2023, 39(7):29-39.
[22] 梁明, 胡均鹏, 吴玉銮, 等.QuEChERS/超高效液相色谱-串联质谱法测定动物源食品中氟啶虫胺腈和氟吡呋喃酮残留量[J].分析测试学报, 2023, 42(6):722-728.
LIANG M, HU J P, WU Y L, et al.Determination of sulfoxaflor and flupyradifurone residues in animal-derived foods by QuEChERS/UPLC-MS/MS[J].Journal of Instrumental Analysis, 2023, 42(6):722-728.